HAL Id: tel-00264868
https://tel.archives-ouvertes.fr/tel-00264868
Submitted on 18 Mar 2008HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Ecologie de la transmission de parasites (virus,
nématodes) au sein d’une communauté de rongeurs
cycliques. Conséquences pour la santé humaine.
Julie Deter
To cite this version:
Julie Deter. Ecologie de la transmission de parasites (virus, nématodes) au sein d’une communauté de rongeurs cycliques. Conséquences pour la santé humaine.. Ecologie, Environnement. Université Montpellier II - Sciences et Techniques du Languedoc, 2007. Français. �tel-00264868�
UNIVERSITE MONTPELLIER II
SCIENCES ET TECHNIQUES DU LANGUEDOC
T H E S E pour obtenir le grade de
DOCTEUR DE L'UNIVERSITE MONTPELLIER II
Discipline : Parasitologie Ecole Doctorale : SIBAGHE présentée et soutenue publiquement
par Julie DETER
Le vendredi 26 Octobre 2007
Titre :
Écologie de la transmission de parasites (virus,
nématodes) au sein d’une communauté de
rongeurs à populations cycliques. Conséquences
sur la santé humaine.
JURY
M. Gilles Aumont Mme. Nathalie Charbonnel M. Philippe Christe, Rapporteur
M. Jean-François Cosson, Co-directeur de Thèse M. Serge Morand, Directeur de Thèse
M. François Monicat Mme. Dominique Pontier M. Robert Poulin, Rapporteur
Remerciements
Je remercie tout d’abord vivement Robert Poulin et Philippe Christe d’avoir accepté d’être les rapporteurs de cette thèse ainsi que Gilles Aumont, François Monicat et Dominique Pontier de me faire l’honneur d’être membres du jury.
Cette thèse est l’accomplissement de mes trois dernières années passées au Centre de biologie et de Gestion des Populations à Montpellier. Pour toutes ces années, je remercie vivement l’équipe de choc formée de mes trois « chefs » : Nathalie Charbonnel, Jean-François Cosson et Serge Morand. Plus particulièrement, je remercie Serge pour m’avoir toujours encouragée et suivie dans mes idées (même les plus dispersées) en me fixant les délais dont j’ai tant besoin, Jeff pour m’avoir laissée faire évoluer ma thèse selon mes aspirations, mais aussi pour sa franchise (avec un brin de diplomatie) et enfin Nath pour avoir toujours répondu présente quand il le fallait, pour sa rigueur et ses critiques toujours justes et avisées (mais aussi les moments de détente). Vous avez toujours su vous rendre disponibles et vous êtes montrés d’une parfaite complémentarité. Encore merci à tous les trois !
Tous les résultats obtenus durant cette thèse n’auraient jamais pu voir le jour sans mes fidèles co-équipiers : Yannick Chaval et Maxime Galan. Yannick, je te remercie pour ta bonne humeur (pas toujours) et ta hargne sur le terrain, ton aide en carto et les horribles bases Accès au bureau. Merci aussi pour tous les bons moments passés en dehors du bureau sur les sentiers des Cévennes ou autour de bons repas. Max, je te remercie pour ton aide précieuse en biologie moléculaire. Sans toi je n’aurais jamais eu le courage de faire toutes ces banques microsatellites au son de musique punk…même si sans toi, cela aurait été quelque fois plus rapide !
Au CBGP, je remercie aussi Philippe et Laurent pour leur bonjour et leur bonne humeur du matin, Anne, Armelle et Manue (et ses lauriers) pour la désormais réglementaire pause de 16h, et les dernières heures du vendredi. Une pensée aussi pour mes collègues de bureau Julien et Bertrand qui m’ont tenue au courant des infos sur le foot malgré moi et bien sûr à Karine toujours disponible (avant d’être en Suisse) malgré ses sautes d’humeur légendaires. Pour le travail accompli, je suis reconnaissante à l’équipe finlandaise : Heikki Henttonen et Juha Laakkonen pour leur rigueur dans la gestion des échantillons, les analyses et leurs corrections des papiers, ainsi que pour leur compagnie bien agréable lors des congrès. Je remercie vivement Catherine Moulia et Marco Perriat-Sanguinet pour leurs conseils et leur aide pour les infestations contrôlées par Trichuris. Merci également à Alexis Ribas Salvador pour l’identification des parasites, à Stanislas Kaluz pour les acariens, à Jan Bradley et Kathryn Else pour des essais (même infructueux) de mesures d’anticorps, Alain Franc pour ses conseils en modélisation et Patrice Cadet pour son aide avec les analyses multivariées. Je suis également reconnaissante envers les membres de mon comité de thèse qui m’ont suivie durant ces trois années et ont su m’écouter et me réorienter quand il le fallait : Thierry Boulinier, Jean-François Guégan et Patrice David.
Merci enfin à toutes celles et ceux qui ont donné un coup de main sur le terrain ou à l’animalerie : Sylvain Piry, Florian Holon, Audrey Scala, Virginie Rougeron (pour s’être occupée de mes campagnols pendant mon absence), Josef Bryja, Sabrina Marquès et Kiya (ma chienne désormais passionnée par les campagnols).
Une petite pensée tout de même pour le gîte du Souillot que l’on ne reverra heureusement plus et pour M. Marion et ses sujets discussions plutôt atypiques. Une dernière pensée pour les personnes qui m’ont fait découvrir et apprécier la parasitologie : F. Arnoult, E. Faliex et C. Combes.
D’un point de vue moins professionnel, je souhaite remercier toutes les personnes qui m’ont aidée à suivre cette longue mais appréciable voie du doctorat et les personnes avec qui j’ai aimé passer mon temps libre de ces trois dernières années. Merci à ma famille : ma grand-mère et mes parents pour leur soutien et leur foi en moi, mes petits frères et sœurs : Laurianne, Zoé et Eliott pour leur bonne humeur et les moments de joie lors de leurs visites. Plus particulièrement : merci à ma grand-mère (Minouche) pour les valeurs qu’elle m’a inculquées, ma maman pour avoir laissé un peu trop traîner le dictionnaire médical à la maison lorsque j’étais petite, et mon papa pour m’avoir donné le goût de l’efficacité.
Un grand MERCI à Florian Holon, mon compagnon de tous les jours qui trouve toujours les mots pour m’encourager et m’aider à avoir plus confiance en moi. Merci aussi pour me pousser à découvrir toujours plus de choses. Une pensée pour sa famille qui m’a entourée comme si j’étais l’un de ses membres depuis toujours.
Pour tous les autres moment, merci à Julia et Nico mes voisins et amis (plus particulièrement Julia pour les discussions et ballades de chiens du midi), Aurélie pour son énergie, Steph et José pour les bons moments à Assas ou en rando.
Une grande pensée pour les actifs de l’association Contact que je côtoie depuis un an et demi et avec qui je me suis un peu plus découverte moi-même en travaillant avec eux sur de nombreux projets. Je pense plus particulièrement à Cathy Morales, Ingrid Chanefo, Laetitia Mahé, Mélanie Beaujouin, Fabrice Hoff, David Barat et Eric Perrera. Une pensée pour l’équipe SERL (Adèle, les trois Alex, Thierry, Camille, Berti, Philippe et Florent) avec qui j’ai apprécié organiser les « 3emes rencontres écologie et comportement ». J’enchaîne avec la CJC, avec une pensée pour Cécile qui a su me remotiver et me rassurer quand il le fallait. Enfin pour leurs conseils avisés quant à la suite (l’après thèse), merci encore une fois à mes trois chefs et à Olivier Thaler, Maurice Brunel et Marielle Portier.
Même si le « mauvais œil » s’est quelques fois un peu trop acharné sur moi (et ça en a fait rire plus d’un(e)), finalement j’ai réussi à faire tout ce que je souhaitais sans y perdre la santé et en y gagnant des ami(e)s. Même en rédigeant ces dernières lignes après ces mois de rédaction, je continue à penser que le doctorat est une très belle aventure.
Sommaire
REMERCIEMENTS 2
LISTE DES PUBLICATIONS MAJEURES 6
1. INTRODUCTION 8
1.1. LES CYCLES DEMOGRAPHIQUES 8
1.2. L’EMERGENCE DE ZOONOSES 9
1.2.1. INFLUENCE DES CYCLES DEMOGRAPHIQUES DES ESPECES RESERVOIRS 9
1.2.2. AUTRES FACTEURS D’EMERGENCE 11
1.2.3. L’ECOLOGIE DE LA SANTE : UNE APPROCHE PLURIDISCIPLINAIRE POUR L’ETUDE DE
L’EMERGENCE DES ZOONOSES 11
1.3. ETUDE DE LA COMMUNAUTE DE RONGEURS A POPULATIONS CYCLIQUES ET DE LEURS PARASITES EN FRANCHE-COMTE 12
1.3.1. LES RONGEURS 12
1.3.2. LES PRINCIPAUX AGENTS DE ROBOVIROSES 13
1.3.2.1. Les hantavirus 13
1.3.2.2. Le virus Cowpox (CPXV) 15
1.3.2.3. Le virus de la chorioméningite lymphocytaire (LCMV) 16 1.3.3. PRINCIPAUX PARASITES POUVANT INFLUENCER LA DYNAMIQUE DES POPULATIONS DE
RONGEURS 16
1.3.3.1. Trichuris sp 16
1.3.3.2. Taenia taeniaeformis 17
1.4. OBJECTIFS 17
2. MATERIELS ET METHODES 17
2.1. LES SITES D’ETUDE ET LA CAPTURE DES RONGEURS 18 2.2. LES DONNEES INDIVIDUELLES, MACRO- ET MICRO- PARASITOLOGIQUES 19
2.3. LES ANALYSES 20
3. RESULTATS ET DISCUSSION 23
3.1. LA COMMUNAUTE DE PARASITES DANS LA COMMUNAUTE DE RONGEURS 23
3.1.1. IDENTIFICATION ET PREVALENCES DES PARASITES 23
3.1.1.1. Les virus 23
3.1.1.2. Les coccidies 24
3.1.1.3. Les helminthes 24
3.1.1.4. Les ectoparasites 25
3.1.2. STRUCTURE DE LA COMMUNAUTE DE PARASITES AU SEIN DE LA COMMUNAUTE DE RONGEURS
ARVICOLINES 27
3.2. SPECIFICITE ET TRANSMISSION DES PARASITES 30
3.2.1. SPECIFICITE DES HANTAVIRUS 30
3.2.2. INDICES DE TRANSMISSION DU VIRUS COWPOX AU SEIN DE LA COMMUNAUTE DE RONGEURS 30 3.2.3. TRANSMISSION DE TRICHURIS SP AU SEIN DE LA COMMUNAUTE DE RONGEURS 31 3.2.4. ROLE DE LA DISPERSION DE L’HOTE DANS LA TRANSMISSION DES PARASITES ET PATRONS
3.2.5. ROLE DU COMPORTEMENT SOCIAL DES HOTES DANS LA TRANSMISSION 38 3.3. IMPACT DES PARASITES SUR LEURS HOTES, CONSEQUENCES POUR LA REGULATION DES
POPULATIONS DE RONGEURS 39
3.3.1. IMPACT DES PARASITES SUR LA REPRODUCTION DES HOTES 39
3.3.2. CONSEQUENCES DES PARASITES SUR LA DYNAMIQUE DES POPULATIONS D’HOTES 41 3.4. FACTEURS DE RISQUE D’INFECTION POUR LES RONGEURS, CONSEQUENCES POUR L’HOMME
42
3.4.1. L’ENVIRONNEMENTEXTERIEUR A L’HOTE 42
3.4.1.1. Lien entre densité et phase du cycle de l’hôte et les données parasitaires 42
3.4.1.2. Lien entre paysage et parasitisme 43
3.4.2. IMPORTANCE DE L’IMMUNOGENETIQUE ET DE LA PRESENCE DES AUTRES PARASITES 45 3.4.3. IMPORTANCE DE L’ECHELLE SPATIALE DANS L’ETUDE DES RISQUES 49
4. CONCLUSION 50
BIBLIOGRAPHIE 53
Liste des publications majeures
Ce manuscrit de thèse est basé sur 15 articles scientifiques auxquels je me référerai dans le texte avec les chiffres romains I à XV. Ces manuscrits sont disponibles dans le même ordre en annexe. Les manuscrits XIV et XV traitent de données obtenues très récemment et sont donc à considérer comme des ébauches qui devront être améliorées et soumises pour publication fin 2007.
I. Deter, J., K. Berthier, Y. Chaval, J.-F. Cosson, S. Morand and N. Charbonnel
“Influence of geographical scale on the detection of density dependence in the host-parasite system, Arvicola terrestris and Taenia taeniaeformis.” Parasitology 2006, 132 (4); 595-605
II. Morand, S. and J. Deter. Parasitisme et régulation des populations hôtes. In Ecologie et évolution des systèmes parasites. Thomas F, JF Guégan & F. Renaud (Eds). De Boeck Université. 2007
III. Deter, J., Y. Chaval, M. Galan, K. Berthier, A. Ribas Salvador, C. Feliu, S. Morand, J.-F. Cosson, and N. Charbonnel
“Linking demography and host dispersal to Trichuris arvicolae distribution in a cyclic vole species.” International Journal for Parasitology 2007, 37 (7); 813-824
IV. Plyusnina, A., J. Deter, N. Charbonnel, J.-F. Cossonand A. Plyusnin “Puumala and Tula Hantaviruses in France.” Accepté dans Virus Research V. Deter, J., N. Charbonnel, J.-F. Cosson and S. Morand
“Regulation of vole populations by the nematode Trichuris arvicolae: insights from modelling.” European Journal for Wildlife Research.Sous presse DOI 10.1007/s10344-007-0110-6
VI. Deter, J., J.-F. Cosson, N. Charbonnel and S. Morand
“The intestinal nematode Trichuris arvicolae affects the fecundity of its host, the common vole Microtus arvalis.” Parasitology Research. Sous presse DOI 10.1007/s00436-007-0584-x
VII. Deter, J., J. Bryja, Y. Chaval, M. Galan, H. Henttonen, J. Laakkonen, L. Voutilainen, O. Vapalahti, A. Vaheri, A. Ribas Salvador, JS. Morand, J.-F. Cosson and N. Charbonnel
“Association between the DQA MHC class II gene and Puumala virus infection in the specific reservoir Myodes glareolus.” Accepté dans Infection, Genetics and Evolution VIII. Charbonnel, N., J. Deter, Y. Chaval, J. Laakkonen, H. Henttonen, L. Voutilainen, O.
Vapalahti, A. Vaheri, S. Morand and J.-F. Cosson
“Emerging rodent-borne viruses in French populations of the fossorial water vole Arvicola terrestris scherman (Rodentia, Cricetidae, Arvicolinae).” Accepté dans Vector-Borne and Zoonotic Diseases.
IX. Deter, J., Y. Chaval, H. Henttonen, J. Laakkonen, L. Voutilainen, B. Gauffre, S. Morand, N. CharbonnelandJ.-F.Cosson
“Kinship and dispersal: role in hantavirus transmission in bank and common voles.” Soumis à Archives of Virology.
X. Deter J., Y. Chaval, H. Henttonen, J. Laakkonen, L. Voutilainen, P. Giraudoux, S. Morand, J.-F. Cosson and N. Charbonnel
“Spatial diffusion of Cowpox virus within a rodent community.” En préparation. XI. Deter, J., M. Galan, N. Charbonnel and J.-F. Cosson
“Characterization and PCR multiplexing of polymorphic microsatellite loci in the whipworm Trichuris arvicolae, parasite of arvicoline rodents and their cross-species utilization in T. muris, parasite of murines.” En préparation.
XII. Tollenaere, C., J. Bryja, M. Galan, P. Cadet, J. Deter, Y. Chaval, K. Berthier, A. ribas Salavador, L. Voutilainen, J. Laakkonen, H. Henttonen, J.-F. Cosson and N. Charbonnel
“Multiple parasites mediate balancing selection at MHC class II genes: insights from multivariate analyses and population genetics in the fossorial water vole.” En préparation.
XIII. Deter, J., M. Galan, Y. Chaval, S. Morand, N. Charbonnel and J.-F. Cosson
“Transmission and gene flow of whipworms Trichuris sp within a rodent community.” En préparation.
XIV. Deter, J., M. Galan, Y. Chaval, S. Morand, N. Charbonnel and J.-F. Cosson
“Population genetic study shows an absence of spatial structure for the whipworm Trichuris arvicolae.” En préparation.
1.
Introduction
1.1.
Les cycles démographiques
De nombreuses espèces (vertébrés et invertébrés) montrent des densités de populations fluctuant régulièrement dans le temps, sans que cette régularité puisse être expliquée par les variations saisonnières. Ces populations, dites cycliques, oscillent entre faibles et fortes densités sur des périodes de trois à plus de dix ans. Au début du siècle dernier, Elton [59] fut le premier à décrire les populations cycliques de manière scientifique et à proposer des explications biologiques principalement pour les cycles d’arvicolinés (lemmings et campagnols). Depuis ce travail pionnier, la littérature n’a cessé de s’enrichir notamment sur l’étude des petits rongeurs (plus de 100 publications [6]).
D’après Krebs et Myers [115], un cycle se compose de quatre phases : faible densité, croissance, abondance (pullulation) et déclin (voir Figure 1). C’est une fluctuation qui se produit régulièrement dans le temps.
Turchin et Hanski [183] décrivent formellement comme cycliques quatre groupes de rongeurs arvicolinés à l’aide de modèles mathématiques. Ces rongeurs montrent des oscillations d’ordre 2 c'est-à-dire présentant une densité dépendance avec délai (voir Boite 1). Ces groupes sont le campagnol agreste, Microtus agrestis, dans le Nord de la Fenno Scandinavie, le lemming, Lemnus lemnus en Fenno Scandinavie, le campagnol terrestre, Arvicola terrestris scherman dans le jura suisse et le campagnol de Sundevall, Myodes rufocanus à Hokkaido. Plus récemment, il a été décrit pour le campagnol des champs dans le sud ouest de la France l’existence de cycles d’ordre 2 également [118].
Figure 1 : Cycles de populations de lemmings (Lemnus lemnus) à Finse, Norvège. (modifié à partir de la Fig.1a [19]). Le piégeage a été réalisé au printemps (S) et en automne (A). F représente la phase de faible densité, C de croissance, A d’abondance et D de déclin. “Am” représente l’amplitude de l’oscillation (environ 10 lemmings pour100 nuit pièges) et “P” la période (environ 3,5 ans).
Boite 1 : Ordre de densité dépendance
En plus de la période et de l’amplitude (voir Fig. 1), les oscillations de populations peuvent aussi être caractérisées par l’ordre de densité dépendance. En général, une dynamique de population est gouvernée à la fois par des facteurs dépendants et indépendants de la densité. Le concept d’ordre de densité dépendance est défini par le délai. Le taux de reproduction d’une population dépend en général de sa propre densité observée quelques pas de temps auparavant (délai). Plus on a besoin de délais pour décrire le processus, plus l’ordre est élevé. Si l’on appelle :
t t
t X X
R= +1− by Rt=f( ZX, )
Avec Rt le log du taux de reproduction, Xt le log de la densité de la population au temps t et X représente les données de densité, et Z les données des facteurs indépendants de la densité (Z étant fixé pour les processus densité dépendants purs).
Supposons que la densité observée quelques temps auparavant, permette de déterminer Rt, on peut alors écrire : ) 1 ,..., , (X X 1 X Z f Rt= t t− t−h+
Et appeler ceci nième ordre de densité dépendance du processus. Par exemple, pour un processus de premier ordre (n = 1), Rt est seulement déterminé par Xt, pour un Z donné, et pour un second ordre (n=2) par Xt, mais aussi par Xt-1, etc. La notion d’ordre formalise en fait la distinction entre de la densité dépendance avec et sans délai dans le temps (ou retard). Selon Royama [159], les cycles d’ordre 2 ou plus peuvent provenir de trois (différentes mais non exclusives) situations : (1) quand les animaux concernés on une durée de vie longue et qu’un ancien effet de densité se répercute sur le statut reproducteur présent; (2) lorsque l’effet de la densité est retardé dans le temps; (3) lorsqu’une population d’une espèce donnée interagit avec une population d’une autre espèce même sans effet retard (prédateur-proie, hôte-parasite, système d’espèces en compétition).
La recherche du déterminisme de ces cycles chez les arvicolinés a suscité de nombreuses hypothèses. Ainsi, les fluctuations ont été attribuées d’une part à des facteurs intrinsèques comme le stress physiologique [37], la dispersion [121], la reproduction [148], des effets maternels [92] ou la sénescence (vieillissement des populations [18]) et d’autre part, à des facteurs extrinsèques comme les ressources [182] et les défenses des plantes [99], la compétition [84], la prédation [79], le paysage ou le parasitisme [49, 80]. Un consensus s’établit sur l’origine plurifactorielle des cycles qui seraient le résultat combiné des deux types de facteurs [122]. Le déterminisme des cycles n’est en fait pas encore bien compris, notamment pour les causes du déclin et la durée de la phase de faible densité [19].
1.2.
L’émergence de zoonoses
1.2.1. Influence des cycles démographiques des espèces réservoirs
Les variations d’abondance engendrées par ces cycles expliquent les fluctuations des dégâts causés par les rongeurs. Les pullulations sont bien souvent l’occasion de dégâts en agri- ou sylvi- culture et de risques accrus pour la santé [47, 48] car les campagnols sont souvent des ravageurs de culture et/ou des réservoirs de zoonoses. On appelle zoonoses, les maladies qui se transmettent naturellement des animaux vertébrés aux humains et vice versa (définition de l’Organisation Mondiale de la Santé, OMS en 1959). D’un point de vue médical, les zoonoses sont plus ou moins graves selon l’agent en cause : la rage est mortelle, brucellose et tuberculose sont des maladies sévères, la vaccine ou la fièvre aphteuse généralement bénignes [4]. Certaines zoonoses, comme la brucellose et la tuberculose sont des fléaux économiques majeurs pour l’élevage. D’autres, par contre, n’entraînent que des pertes économiques modérées chez l’animal. Cependant, le fait que les humains soient menacés conduit à l’application de mesures de lutte extrêmement onéreuses. C’est le cas par exemple de la rage qui n’a qu’une incidence modérée par le nombre d’animaux domestiques
qu’elle fait disparaître ; la lutte contre ce virus n’est justifiée que par le danger pour les humains.
De nombreuses études ont montré un lien entre les cycles démographiques et la variation du nombre de cas de zoonoses parce que les fortes abondances de rongeurs sont à l’origine de contacts plus nombreux entre humains et animaux [86, 138, 146]. Toutefois, de récents travaux de modélisation ont démontré qu’à une échelle saisonnière, il existait une corrélation négative voire une absence de corrélation entre abondance de rongeurs et prévalence [46] (voir Boîte 2). Cette relation inverse peut s’expliquer lorsque la croissance de la population est obtenue suite à un afflux massif de jeunes ou lors d’une relation avec délai dans le temps entre abondance et prévalence comme dans le cas des cycles réguliers [46]. A une échelle plus grande (> 5 ans), les auteurs ont montré une relation positive avec délai entre abondance et prévalence chez les rongeurs [46]. Dans tous les cas, l’abondance est en général difficile à utiliser en tant que facteur de risques et le suivi des populations réservoirs est nécessaire [46]. Sauvage et ses collaborateurs [164] ont confirmé que l’abondance et la prévalence chez les rongeurs étaient de mauvais indicateurs du risque de fièvres hémorragiques à syndrome rénal (FHSR) chez les humains. Ce serait en fait la vitesse de croissance et donc l’arrivée de jeunes rongeurs nouvellement infectés par les hantavirus qui expliqueraient les épidémies de fièvres hémorragiques chez les humains. Dans ce contexte, les populations de rongeurs non cycliques présenteraient un risque moindre pour les populations humaines [164]. Il est donc important d’étudier et de connaître la dynamique des réservoirs de maladies si l’on veut en comprendre les risques. Toutefois, si les épidémies humaines sont favorisées par les pullulations de réservoirs, ces dernières sont en général facilitées par d’autres facteurs météorologiques et écologiques comme dans le cas des hantavirus transmis par des souris en Amérique du Sud [173]. Il convient donc également d’étudier ces autres facteurs de risque.
Boite 2 : Termes parasitologiques
Un parasite est un être vivant qui profite des ressources d’un autre. Cet autre être vivant qui permet au parasite de vivre sur ou à l’intérieur de lui, est appelé hôte. Contrairement aux relations proies-prédateurs, l’interaction entre le parasite et son hôte est durable souvent jusqu’à la mort de l’un des deux.
Plusieurs espèces d’hôtes, peuvent être successivement exploitées au cours du développement d’un parasite, cette série d’étapes obligatoires dans la vie du parasite pour lui permettre de se reproduire est appelée cycle biologique. Un parasite qui n’a besoin que d’une seule espèce d’hôte pour se reproduire est dit monoxène. Par exemple les vers Trichuris trichiura, agents de la trichuriose vivent dans le duodénum de l’homme où ils pondent leurs œufs, lesquels sont évacués à l’extérieur avant d’être ingérés par un Homme. Le cycle ne comporte qu’une seule espèce (l’Homme) et un événement de transmission d’Homme à Homme. Au contraire, le ver plat (cestode) Taenia taeniaeformis est dit hétéroxène. Les adultes vivent dans le duodénum des chats, les œufs sont évacués à l’extérieur avec les fèces. Ces œufs peuvent être ingérés par des rongeurs, ils éclosent et donnent naissance à une larve qui se développe dans un kyste dans le foie (cysticerque). Lorsque le chat mange un rongeur infesté, les cysticerques évoluent en adultes.
On peut ensuite suivre les parasites dans une population d’hôtes en calculant la proportion d’hôtes infestés ; c’est ce que l’on appelle la prévalence. Similairement, la séroprévalence est la proportion d’hôtes positifs au niveau sérologique (présence d’anticorps) pour un parasite donné. On appelle abondance moyenne d’une espèce de parasite, le nombre moyen de parasites de cette espèce trouvés dans une population hôte (individus sains + infestés) et intensité moyenne, le nombre de parasites présents uniquement dans la population infestée échantillonnée. En réalité, tous ces paramètres sont des estimations basées sur un échantillon car il est impossible de tester une population en entier. La charge parasitaire pour un parasite donnée, d’un individu fait référence au nombre de parasites de cette espèce comptés dans cet individu hôte. (basé d’après [41])
1.2.2. Autres facteurs d’émergence
Boite 3 : Zoonoses émergentes
L’OMS en 2004 définit une zoonose émergente comme une zoonose nouvellement connue ou apparue ou encore qui existait déjà, mais dont le nombre de cas s’étend au niveau géographique, des hôtes ou des vecteurs.
Bien que l’émergence des zoonoses (Boîte 3) soit souvent mise en relation avec l’amélioration des moyens diagnostics, de nombreux autres facteurs ont été mis en cause comme une grande diversité génétique des agents pathogènes [75, 169], une faible biodiversité [107], un potentiel de dispersion important des réservoirs [149], le climat [134], mais aussi les comportements humains et l’urbanisation engendrant des contacts accrus avec les réservoirs, la modification des habitats naturels et des pratiques culturales [23, 36].
1.2.3. L’écologie de la santé : une approche pluridisciplinaire pour l’étude de l’émergence des zoonoses
Etant donné les nombreux facteurs pouvant être mis en jeu dans l’émergence des zoonoses, il convient non seulement de réaliser des suivis épidémiologiques classiques, mais aussi d’utiliser d’autres disciplines telles que l’écologie des communautés, l’épidémiologie moléculaire ou l’immunogénétique. Ces approches permettent de définir les réservoirs potentiels présents dans la faune sauvage, de comprendre la transmission inter ou intra espèce des parasites par des analyses de génétique des populations, de mettre en évidence des possibles adaptations locales entre parasites et hôtes (voir Boîte 4) et l’influence de la génétique sur les interactions hôtes-parasites (susceptibilité-résistance). Cette approche intégrant les connaissances issues de disciplines différentes est appelée « écologie de la santé » (« conservation medicine » en anglais) [77] (Figure 2). Ce courant de pensée a pour objectifs principaux une meilleure compréhension des liens et des interactions entre santé humaine, santé animale et dynamique des écosystèmes.
Boite 4 : Adaptation locale
On parle d’adaptation locale d’un parasite à son hôte lorsque la valeur sélective du parasite exploitant son hôte sympatrique est supérieure à la valeur sélective d’un parasite exploitant un hôte allopatrique. Ce mécanisme peut se mettre en place lorsque la dispersion du parasite est supérieure à celle de l’hôte [69].
Une fois regroupées, toutes les données apportées par les différentes approches peuvent servir à mieux comprendre et prédire la répartition géographique des zoonoses. A une échelle régionale ou d’un pays, ces facteurs ajoutés à des données climatologiques et/ou écologiques et satellitaires peuvent servir à caractériser l’habitat favorable pour un parasite en utilisant un Système d’Information Géographique (SIG). On appelle cartes de risques, ces cartes permettant de visualiser les zones favorables pour un parasite (données concernant le réservoir) ou directement les zones de risques pour les humains (données sur les cas humains). Des cartes ont ainsi été établies pour les Etats-Unis et l’Europe pour de nombreuses maladies et pathogènes tels que la maladie de Lyme causée par la bactérie Borrelia burgdorferi transmise par des tiques à des rongeurs et à l’Homme [78, 191], le virus West Nile transmis par des moustiques [24] ou les fièvres hémorragiques causées par les hantavirus transmis par les rongeurs [74]. Ces cartes sont très utiles pour les gestionnaires de la santé qui peuvent ainsi prévoir les zones où mener des campagnes de prévention.
Les petits rongeurs étant d’importants réservoirs de zoonoses, j’ai choisi d’étudier le rôle d’une communauté de rongeurs cycliques dans l’émergence de différentes zoonoses.
1.3.
Etude de la communauté de rongeurs à populations
cycliques et de leurs parasites en Franche-Comté
1.3.1. Les rongeurs
En France, il existe 31 espèces de rongeurs, et la plupart sont vecteurs de zoonoses [119]. J’ai choisi de travailler en Franche-Comté sur une communauté de rongeurs sauvages vivant en milieu rural. Cette communauté se compose de campagnols des champs (Microtus arvalis) et de campagnols terrestres (Arvicola terrestris scherman). Ils vivent plutôt en prairie sous formes de colonies respectivement semi-souterraines et totalement souterraines [119]. Ces prairies sont insinuées de haies (milieu bocager) et entourées fréquemment de forêts dans lesquelles vivent les campagnols roussâtres (Myodes [anciennement Clethrionomys] glareolus), le mulot sylvestre (Apodemus sylvaticus) et le mulot à collier (Apodemus Figure 2 :
Schéma montrant les liens entre santé humaine, santé animale et modifications d’écosystèmes a) en épidémiologie traditionnelle : seules les conséquences sur la santé humaine sont prises en compte et b) en écologie de la santé : toutes les composantes interagissent les unes avec les autres. Le système étudié est encadré en bleu. Illustration modifiée issue de Guégan et al. [77].
Toutes ces espèces de rongeurs montrent des fluctuations cycliques de leur abondance de durées plus ou moins longues et plus ou moins synchrones selon les années : cycles d’environ 3 ans pour le campagnol roussâtre et les mulots, 4-5 ans pour le campagnol des champs et 8 ans pour le campagnol terrestre [71, 136, 157].
1.3.2. Les principaux agents de roboviroses
En France les rongeurs sont des porteurs d’agents de nombreuses zoonoses répertoriées par l’Institut National de Veille Sanitaire (INVS) : la leptospirose, l’échinococcose alvéolaire, la tularémie [29]. Parmi les zoonoses dont les responsables sont des virus (roboviroses = « rodent borne » viroses), on peut citer les Fièvres Hémorragiques à Syndrome Rénal (FHSR), la chorioméningite lymphocytaire ou les infections à virus Cowpox. Les FHSR sont d’ailleurs considérées comme des maladies émergentes par l’INVS, notamment dans le Jura (en Franche–Comté) où le nombre de cas augmentent depuis 2005. Je me suis plus particulièrement intéressée à ces roboviroses puisque ma thèse s’inscrit dans le programme européen EDEN qui s’intéresse à ces maladies émergentes (Boîte 5).
Boite 5 : EDEN (Emerging Diseases in a changing European eNvironment) EDEN est un programme cadre européen qui a pour but d’identifier et quantifier les impacts des changements environnementaux, sociaux et économiques en Europe sur la distribution spatiale et temporelle et la
dynamique d’agents pathogènes pour l’Homme. Cinq groupes de travail abordent des maladies indicatrices pour leur sensibilité aux changements environnementaux : West Nile virus, Maladies transmises par les tiques, malaria, leishmaniose et roboviroses. Eden est à l’origine d’un réseau d’une quarantaine de laboratoires européens et d’Afrique du Nord qui travaillent ensemble en connectant leurs diverses compétences. http://www.eden-fp6project.net/ programme cadre Européen
Toujours dans le but de mener une approche globale, durant mon doctorat, je me suis intéressée à l’étude de parasites (helminthes, coccidies, acariens) autres que les virus. Ces parasites potentiellement régulateurs sont importants à étudier, car en agissant sur la dynamique des hôtes (par mortalité induite ou par impact sur la reproduction), ils peuvent influencer la dynamique des roboviroses. De plus, les parasites partageant un même hôte étant plus ou moins en interaction, une synergie ou un antagonisme (via l’immunité de l’hôte) pourrait se développer entre certains d’entre eux entraînant une protection croisée (terme utilisé pour l’immunité contre un virus protégeant contre un virus de la même famille, exemple du virus de la vaccine protégeant contre la variole et à l’origine du vaccin de Jenner en 1796), un antagonisme (infection par un parasite qui protège contre l’infection par un autre, exemple entre deux nématodes gastro-intestinaux [106]) ou au contraire une plus grande susceptibilité d’un hôte déjà infecté (exemple des candidoses ou autres parasites opportunistes se développant chez les patients atteints par le SIDA [168]).
1.3.2.1. Les hantavirus
Les FHSR ont pour agents étiologiques des hantavirus (genre Hantavirus, famille Bunyaviridae) [184]. Chaque espèce d’hantavirus est portée par une espèce hôte particulière de rongeurs, et la transmission à d’autres espèces (dont l’Homme) est une impasse pour le virus [111, 154]. Parmi les hantavirus présents en Europe, Puumala virus (PUUV) est associé au campagnol roussâtre et Tula virus (TULV) au campagnol des champs. Dobrava virus (DOBV) est porté par le mulot à collier et a seulement été décrit dans les Balkans [184]. Seoul virus a été détecté récemment chez le rat Rattus norvegicus en milieu urbain [85]. PUUV est
mortalité) et DOBV d’une forme sévère (7-12 % de mortalité) [184]. Au contraire, TULV ne semble pas être pathogène malgré le recensement d’un cas suspect en Suisse [166]. Malgré le diagnostic de plusieurs centaines de cas de FHSR et de rongeurs infectés [151, 184], aucun hantavirus n’a jamais été isolé ou caractérisé chez le campagnol roussâtre et des champs en France jusqu’à ce jour. Deux zones épidémiques sont recensées en France : des Ardennes à la région parisienne, et la Franche-Comté (Figure 3). La transmission est horizontale chez les rongeurs, et les humains se contaminent directement par morsure, l’urine ou le plus souvent indirectement par les aérosols. Chez le rongeur l’infection est chronique.
De nombreuses études ont été conduites ces dernières années en Europe sur la dynamique des hantavirus au sein des populations de leurs hôtes [12, 60, 61, 146, 190] mais de récents résultats ouvrent de nouvelles perspectives de travail. La plupart de ces études ont examiné les facteurs de risques des rongeurs comme le sexe, l’âge, la densité de populations ou l’habitat. La séroprévalence semble être soit densité [avec un délai, voir Davis 46], soit habitat dépendante [60, 146, 147, 190]. L’existence d’un lien entre abondance de rongeurs et cas humains a été affirmée pendant longtemps [86, 138, 146]. Pourtant, récemment, Sauvage et al. [164] ont montré que l’abondance et la prévalence chez les rongeurs étaient de mauvais indicateurs du risque de FHSR chez les humains (voir paragraphe 2.2.1)
Les males adultes sont en général plus nombreux à être infectés que les femelles et les jeunes pour des raisons comportementales et/ou physiologiques [12, 145]. Des travaux de laboratoire ont montré que si l’on infecte des rats avec le virus Seoul, autant de femelles que de mâles sont infectés [108]. Par contre Klein [108] a montré que les mâles infectés montraient une plus grande réponse immunitaire, dispersaient plus tôt et de plus grandes quantités de virus dans l’environnement par le biais de plus de moyens (salive, fèces, urine) que les femelles.
Figure 3 :
Répartition géographique en fonction du code postal de résidence des cas de FHSR entre 2005 et 2007 en France (INVS).
immunitaire à médiation cellulaire T des mâles qui est différente de celle des femelles (Th1 chez les mâles) à cause d’une différence d’expression de deux gènes sous l’influence des hormones sexuelles [108]. Klein [108] suggère également un mode de transmission différent selon le sexe. Ces nouveaux résultats montrent le lien existant entre l’infection par les hantavirus et la génétique, soulignant ainsi l’intérêt d’une approche immunogénétique pour étudier l’épidémiologie de ces virus. L’immunogénétique serait d’autant plus intéressante qu’elle pourrait mettre en évidence une résistance ou une susceptibilité génétique des rongeurs aux hantavirus. Cette nouvelle perspective est envisageable depuis que Kallio et al. [103]ont trouvé une influence de l’infection par PUUV sur la reproduction : les jeunes campagnols roussâtres porteurs d’anticorps maternels anti-hantavirus deviennent matures plus tôt que les jeunes de mères négatives aux hantavirus. Dans cette étude, certains campagnols n’ont pas pu être infectés par le virus confirmant une possible résistance à l’infection [103]. L’épidémiologie des hantavirus est étudiée depuis de nombreuses années mais presque toujours de manière classique. Les dernières études en modélisation, en génétique ou en physiologie prouvent que de nombreuses informations doivent encore être apportées pour la compréhension de ce système hôte-parasite.
1.3.2.2. Le virus Cowpox (CPXV)
Cowpox virus est un orthopox virus de la famille des Poxviridae. Il est endémique de la plupart des populations de rongeurs en Europe et en Asie occidentale [9]. Bien que des infections naturelles soient détectées chez le bétail, l’Homme ou les chats domestiques, ces cas sont plutôt rares et les réservoirs principaux acceptés sont les rongeurs sauvages [10]. Cependant, le nombre de cas humains est en augmentation certainement à cause de l’arrêt de la vaccination contre la variole (virus de la même famille, déclaré éradiqué dans les années 80) qui devait conférer une protection croisée [101]. Au Royaume Uni, où les cas d’infections sont les mieux étudiés, les séroprévalences les plus élevées sont observées chez le campagnol des champs, roussâtre et le mulot sylvestre, considérés comme étant les réservoirs [34]. En France, aucune donnée n’est pour l’instant disponible concernant la faune sauvage ou les animaux de compagnie, mais plusieurs cas humains ont d’ores et déjà été décrits [38, 76, 82, 152]. Le virus semble être transmis directement bien que les mécanismes n’aient pas encore été élucidés expérimentalement [7, 30]. Des études expérimentales montrent qu’un animal est infecté (porteur du virus) et infectieux (peut transmettre le virus) durant les 4 semaines suivant l’infection et développe une réponse anticorps deux semaines après l’infection et pour toute la durée de sa vie [11, 34]. Les travaux conduits sur le virus Cowpox dans des populations de campagnols roussâtres ou de mulots sylvestres indiquent que l’infection induit un retard dans la reproduction durant l’été et réduit la survie durant l’hiver [63, 174, 175]. Cavanagh et al. [32] ont suggéré un patron de densité dépendance avec un délai de 3 à 6 mois entre les densités de campagnols agrestes de la forêt de Kielder (Ecosse) et la séroprévalence de Cowpox. Plus récemment, Burthe et al. [28] ont confirmé cette densité dépendance avec un délai de 3 mois et ont montré que les individus matures et les mâles avaient significativement plus de risques d’être séropositifs que les immatures et les femelles.
L’épidémiologie du virus Cowpox a donc été principalement étudiée au Royaume Uni et aucune donnée n’est disponible en France à ce jour. Contrairement aux hantavirus qui sont spécifiques, le virus Cowpox semble capable de se transmettre facilement entre espèces différentes chacune potentiellement porteuse d’un hantavirus. La comparaison entre les deux systèmes pourrait alors nous aider à mieux comprendre l’épidémiologie de chacun de ces virus et peut être même à déceler des interactions entre ces pathogènes.
1.3.2.3. Le virus de la chorioméningite lymphocytaire (LCMV) La chorioméningite Lymphocytaire est une zoonose causée par un arénavirus du même nom dont le principal vecteur est la souris domestique ou sauvage (Mus musculus) mais qui peut aussi être transmis par les animaux domestiques tels que le hamster doré ou le cobaye. En Italie, d’autres espèces de rongeurs ont été trouvées séropositives : le mulot à collier (6,1%, N = 1181), le campagnol roussâtre (3,3 %, N = 276), et le campagnol des champs (14,3 %, N = 7) [100]. Les souris infectées éliminent le virus par les urines, les fèces, le lait et les secrétions nasales. La contamination se fait par aérosols et/ou par morsure et de manière verticale. Les prévalences observées aux Etats-Unis ou en Europe varient de 3 à 20 % [8, 97, 100, 117]. Les cas humains publiés sont nombreux et ont déjà été reportés aux Etats Unis et en Europe notamment en France [97, 160]. Les conséquences peuvent être graves chez la femme enceinte puisque des avortements, malformations ou mort du nouveau né ont été décrits. Chez l’adulte et l’enfant infectés, la forme est sévère sans entraîner la mort [97]. Tout comme le virus Cowpox, de récents résultats suggèrent une transmission possible au sein de la communauté de rongeurs sauvages. Il semble intéressant de dresser un état des lieux de la présence de ce virus puisque aucune donnée concernant la faune sauvage en France n’est disponible à notre connaissance.
1.3.3. Principaux parasites pouvant influencer la dynamique des populations de rongeurs
Il est nécessaire d’étudier les parasites régulateurs car en agissant sur la dynamique des hôtes, ils peuvent influencer la dynamique des roboviroses. De plus, nous avons vu qu’il pouvait se développer des antagonismes ou des synergies (via l’immunité de l’hôte) entre ces parasites et les virus à l’origine des zoonoses.
La régulation d’une population correspond à la tendance à diminuer la taille d’une population lorsque celle ci dépasse un certain seuil, et à l’augmenter lorsque la taille est inférieure à ce seuil [9]. Dans ce cas, un processus qui influence les taux de natalité et de mortalité de façon densité dépendante peut être considéré comme régulateur. En théorie, les macroparasites (parasites que l’on peut dénombrer comme les helminthes en opposition aux microparasites que sont les virus et les bactéries) peuvent réguler l’abondance de leurs hôtes [2, 132, 167]. Je me suis plus particulièrement intéressée à deux helminthes montrant des indices de potentiel de régulation de leurs populations d’hôtes : un nématode et un cestode.
1.3.3.1.
Trichuris
spParmi les macroparasites, un nématode gastro-intestinal monoxène (voir Boite 2), Trichuris arvicolae est fréquemment trouvé chez les trois espèces de campagnols citées précédemment. Ce nématode pourrait réguler ses populations d’hôtes car une forte charge parasitaire (voir Boite 2) peut induire des pathologies (anémie, troubles digestifs…). Un impact négatif clair d’une espèce proche sur la valeur sélective des hôtes a récemment été démontré chez Mus musculus [155]. Les souris, infestées par T. muris (une espèce proche de T. arvicolae [62]) ont moins de portées, des tailles réduites de portée et des poids de naissance de petits inférieurs en comparaison aux témoins. Ces caractéristiques sont particulièrement intéressantes dans le cas des rongeurs étudiés ici car la théorie a montré qu’un impact sur la fécondité était plus à même de produire des cycles qu’un impact sur la survie [132]. De plus, le système T. arvicolae –arvicoliné ajouterait au modèle T. muris - Mus musculus une
nouvelle opportunité de comparaison pour les études concernant le macroparasite humain T. trichuira fléau dans les pays en développement [15, 39].
1.3.3.2.
Taenia taeniaeformis
Taenia taeniaeformis est un cestode hétéroxène (boite2). Les rongeurs murinés et arvicolinés, hôtes intermédiaires hébergent le parasite sous forme de kyste dans leur foie alors que les chats sauvages Felis sylvestris ou domestiques Felis catus, hôtes définitifs abritent le cestode adulte dans leurs intestins [165]. T. taeniaeformis est le cestode le plus fréquemment trouvé chez les campagnols terrestres et des champs en Franche-Comté (prévalence jusqu’à 38 et 35 % respectivement d’après Cerqueira [33]). Sa présence, dépendant de la densité de campagnols [33, 64] est un indice d’un potentiel régulateur sur les populations de campagnols [181]. De plus T. taeniaeformis pourrait affecter la fertilité [123] et la survie de ses hôtes [55], et il a été montré que des parasites à effets sub-létaux (fécondité) avaient de plus grands effets régulateurs que des parasites induisant une mortalité [52]. A ce jour, aucune information n’a été publiée sur l’impact de T. taeniaeformis sur les campagnols terrestres ou des champs, mais les indices précédents laissent présager un possible effet régulateur.
1.4.
Objectifs
Les objectifs de cette thèse sont de comprendre l’écologie de la transmission de parasites agents de zoonoses en se plaçant à l’échelle de la communauté d’hôtes et de parasites, dans le but de mieux évaluer et gérer les risques pour l’Homme. Pour cela, je vais décrire la communauté de parasites d’une communauté de rongeurs afin de déterminer les réservoirs d’agents de zoonoses et les parasites potentiellement régulateurs de cette communauté de rongeurs.
Pour plus de clarté, on peut mettre en évidence quatre axes de travail : (i) la communauté de parasites avec les interactions qui y existent,
Existe-il des similarités entre les communautés de parasites des rongeurs sympatriques ? Existe-t-il des antagonismes ou des synergies entre parasites et agents de zoonoses (la présence d’un parasite empêche ou facilite-t-elle la présence d’un autre) ?
(ii) la spécificité et la transmission des parasites avec prise en compte du rôle de la dispersion et du comportement des hôtes,
Existe-t-il un partage, une transmission des parasites au sein de la communauté de rongeurs ? Quel est le rôle de la dispersion et du comportement des hôtes sur la présence des parasites ? Une adaptation locale des parasites à leurs hôtes peut-elle exister ?
(iii) l’impact des parasites sur les populations de rongeurs et leurs conséquences sur les zoonoses,
Certains parasites ont-ils un impact sur la reproduction de leurs hôtes ? Quelles en sont les conséquences en terme de régulation de leurs populations d’hôtes ?
(iv) les facteurs de risques d’infection pour les rongeurs qui peuvent être environnementaux (densité, phase du cycle démographique, paysage) ou individuels (immunité, autres infections).
Les aspects i), ii) et iii) me permettront de mieux évaluer l’échelle spatiale à laquelle nous devons travailler afin de comprendre les risques zoonotiques pour l’Homme.
Toutes les informations relatives aux matériels et méthodes utilisées durant cette thèse sont résumées dans le Tableau 1 et détaillés dans les différentes publications.
2.1.
Les sites d’étude et la capture des rongeurs
Les données récoltées et utilisées durant ma thèse proviennent de plusieurs sites situés dans l’Est de la France, en Franche-Comté. Le site principal de capture se trouve autour de Mignovillard (46°8 N’, 6°13 E’, 850 m d’altitude) dans le Jura (Figure 4a). Les autres sites sont suivis principalement par Nathalie Charbonnel et Karine Berthier. Le site de Mignovillard représente une surface de 4 km2 piégée trois fois par an (printemps, été, automne) entre octobre 2004 et octobre 2006. D’un point de vue paysager, cette zone se compose de prairies bocagères et de forêts (feuillus et / ou résineux) (Figure 4b et c). J’ai échantillonné la communauté de rongeurs sauvages vivant dans ce milieu : le campagnol roussâtre, le campagnol des champs, le campagnol terrestre, le mulot sylvestre et le mulot à collier. Ces rongeurs arvicolinés (campagnols) et murinés (mulots) présentent des durées de vie assez courtes (6 mois en moyenne) et des potentiels de reproduction importants (3 à 4 portées par an d’environ 5 petits) [119]. Etant donné qu’il est difficile de déterminer à quelle espèce appartiennent les jeunes mulots, tous les individus Apodemus ont été identifiés à l’aide du test moléculaire de Michaux et al. [135].
a) b) c) Figure 4 : Carte représentant l’emplacement des lignes de piégeage (triangle) avec leurs codes (lettres majuscules) à Mignovillard (Jura, Franche-Comté). Le paysage se compose du village (noir), de routes (lignes noires), de prairies avec haies (blanc, photo 4b) et de forêt (gris, photo 4c).
J’ai piégé les rongeurs de petites tailles (< 25g) comme les campagnols roussâtres, des champs et mulots à l’aide de pièges INRA dotés de dortoirs. Les dortoirs contenaient du foin et un morceau de pomme afin de maintenir les rongeurs en vie jusqu’au prochain relevé. Le protocole de piégeage a consisté à placer 20 lignes de 100 m composées chacune de 34 pièges disposés à 3 m d’intervalles. Ces lignes étaient disposées pour moitié en milieu ouvert (prairies) et pour moitié en milieu fermé (haies, forêt). La Figure 4a) présente le site de Mignovillard et la disposition des pièges. Pour chaque session de piégeage, ces lignes de pièges ont été laissées en place durant trois nuits consécutives et vérifiées matins et soirs. Ce protocole strict m’a permis d’estimer les abondances de chaque espèce à partir du nombre de captures obtenues pour un même effort de piégeage. Lorsqu’une espèce était peu abondante, j’ai posé des pièges supplémentaires directement près des indices de présence (colonies, trous, fèces) afin d’obtenir environ 35 individus de chaque espèce à chaque session de piégeage. Ces individus n’ont pas été comptabilisés pour les estimations d’abondance.
Au contraire, de par leur taille plus importante (environ 90g) et leur mode de vie presque totalement souterrain, les campagnols terrestres ont été capturés autour des lignes à l’aide de pièges BTS posés directement dans les colonies visibles et relevés toutes les deux heures. L’abondance des campagnols terrestres a été déterminée à l’aide d’une méthode basée sur les indices de surface et développée par Giraudoux et al. [73]. Deux transects perpendiculaires et de 250 m chacun ont été analysés en considérant des intervalles de 10 m pour la présence ou l’absence d’activités en surface (tumuli de terre dus à l’activité fouisseuse des campagnols). L’indice d’abondance correspond au pourcentage d’intervalles positifs sur le site.
Une étude temporelle des indices d’abondance m’a permis de suivre les cycles des différentes espèces.
2.2.
Les données individuelles, macro- et micro-
parasitologiques
Une fois piégés, les rongeurs ont été euthanasiés par dislocation cervicale comme recommandé par Mills et al. [137]. Différents paramètres individuels ont été notés (sexe, longueur, poids, état reproducteur), les yeux prélevés pour l’estimation de l’âge (méthode de Martinet [131]) et la présence de plusieurs parasites a été recherchée de manière directe ou indirecte (par les anticorps pour les virus). Pour chaque individu, j’ai prélevé du sang du coeur ou de la cavité thoracique sur un buvard Whatman® de 1cm². Au laboratoire, chaque morceau de buvard imprégné de sang séché a été placé dans 1 ml de tampon phosphate (PBS). Ces échantillons ont ensuite été analysés pour rechercher la présence d’anticorps anti-virus Puumala (PUUV) par immunofluoresence (ImmunoFluorescence Assays, IFA) comme décrit précédemment [101, 112, 126 ]. Cette partie a été réalisée en collaboration avec l’institut Haartman (Helsinki, Finlande). PUUV est à l’origine d’une infection chronique chez son hôte le campagnol roussâtre, la détection des anticorps est donc fortement liée à la présence du virus sauf pour les très jeunes individus pour lesquels la présence d’anticorps maternels peut être détectée alors qu’ils protègent temporairement des infections. Chaque échantillon de sang a aussi été utilisé pour rechercher la présence d’anticorps virus Cowpox (CPXV) et anti-virus de la chorioméningite lymphocytaire (LCMV) par IFA comme décrit dans [100, 101, 116].
Au moment du piégeage, la présence d’ectoparasites (tiques, acariens) a aussi été recherchée à l’œil nu et notée. Le cerveau frais a été écrasé entre deux lames et observé à la loupe binoculaire pour rechercher la présence de cystes de Frenkelia (Coccidies, Apicomplexa: Sarcocystidae). Pour finir, j’ai recherché la présence de cestodes larvaires dans le foie et les cavités des rongeurs. Les tractus digestifs (estomac, intestins) ont ensuite été stockés dans de
l’alcool à 95° jusqu’à la dissection au laboratoire. Tous les helminthes détectés ont été comptés puis identifiés en collaboration avec l’Université de pharmacie de Barcelone (Espagne).
2.3.
Les analyses
Pour répondre aux objectifs de cette thèse, de nombreuses analyses ont été menées en faisant appel à plusieurs disciplines comme l’écologie, la parasitologie, la génétique, l’immunogénétique ou les biomathématiques. En fait, j’ai utilisé deux approches principales : (i) la parasitologie et (ii) la génétique.
(i) Mon approche de parasitologue a elle-même fait appel à l’écologie en identifiant les parasites et les interactions existant entre eux et leurs hôtes dans leur environnement sauvage. Dans ce cadre, j’ai analysé les liens entre parasites et environnement ou facteurs relatifs aux hôtes, mais aussi la structure de la communauté de parasites d’arvicolinés. L’étude de la structure de cette communauté en intra et en inter espèces hôtes n’a donné lieu à aucune publication, c’est pourquoi je décris brièvement la méthode ici. La similarité des communautés d’espèces de parasites a été évaluée entre espèces d’arvicolinés, en intra-espèce et en inter-hôte et entre dates pour une même intra-espèce hôte. Ces analyses ont été réalisées sur les données obtenues à Mignovillard entre printemps 2004 et automne 2006. J’ai exclu les données du printemps 2006, période à laquelle très peu de campagnols roussâtres et terrestres ont été capturés (voir tableau 2). Pour ces analyses, j’ai utilisé les données de présence/absence de parasites dans un groupe d’hôtes en utilisant l’indice d’incidence de Sørensen et les données quantitatives (nombres d’hôtes présentant le parasite) par l’indice de Bray-Curtis [128]. Ces indices varient entre zéro (pas de similarité entre les communautés de groupes d’hôtes) à un (les groupes présentent les mêmes communautés exactement). Ces indices ont été calculés à l’aide du logiciel ESTIMATES 7.5 [40]. J’ai procédé à des tests de Kruskal-Wallis pour tester la différence de similarité de communautés entre différents groupes et au sein des différents groupes.
Afin de comprendre d’où proviennent les différences de communautés observées, j’ai procédé à des Analyses Factorielles des Correspondances (AFC) sur les données individuelles de présence/absence des mêmes parasites (équivalent des résultats obtenus par analyse univariée avec l’indice de Bray-Curtis). Ces analyses multivariées ont été utilisées pour montrer comment se structure la variance des données parasitologiques en fonction des espèces hôtes, de la date ou du paysage. La structure est visualisée à l’aide d’un graphique qui la distribue en fonction de deux facteurs F1 et F2 expliquant la plus grande partie de la variance. Les variables considérées comme expliquant les données sont celles situées le plus loin de l’origine de l’axe 1 ou de l’axe 2. Des variables localisées dans une même direction par rapport à l’origine sont considérées comme associées positivement alors que des variables localisées dans des directions différentes sont considérées comme antagonistes. Les variables situées près de l’origine ne peuvent pas être interprétées. Les AFC on été réalisées à l’aide du logiciel ADE 4 [178].
Par des expérimentations d’infestations contrôlées en laboratoire, j’ai étudié l’impact d’un nématode sur la reproduction de son hôte, et enfin la modélisation (équations différentielles) m’a permis de tester l’effet théorique de ce même parasite in natura.
(ii) J’ai utilisé la génétique neutre pour comprendre comment étaient structurées les populations de rongeurs et de parasites dans le temps et dans l’espace (génétique des
dans la dispersion des parasites. J’ai fait appel à la phylogénie pour caractériser génétiquement les parasites et tester l’hypothèse d’une transmission entre espèces hôtes. Enfin, par le biais de l’immunogénétique, j’ai recherché des liens entre résistance ou susceptibilité aux parasites et les caractéristiques génétiques de gènes de l’immunité.
Ces méthodes utilisées sont résumées dans le tableau 1 et sont détaillées dans les publications correspondantes.
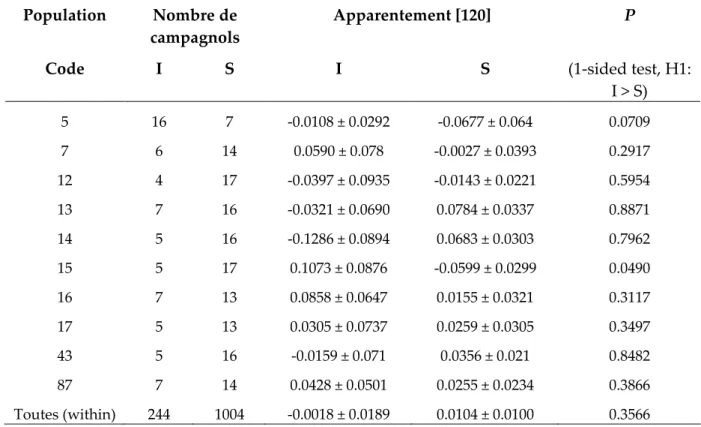
Tableau 1 : Tableau récapitulatif des différentes hypothèses testées, des méthodes utilisées et des publications auxquelles se référer pour le descriptif détaillé. IFA = Immunofluorescence Assay (détection des anticorps).
Hypothèses testées Méthodes Publicati
ons Espèce hôte Espèce parasite Site IFA
IV, VII, VIII, IX,
XII
Les arvicolinés Hantavirus Mignovillard, Canton de Nozeroy IFA VIII, X,
XII La communauté Virus Cowpox
Mignovillard, Canton de Nozeroy Loupe
binoculaire VII M. glareolus Frenkelia sp Mignovillard Microscope III, V, XII La communauté Nématodes Mignovillard,
Canton de Nozeroy Microscope I, VII, XII
A. terrestris scherman et M. glareolus Cestodes Mignovillard, Canton de Nozeroy Id en ti fi ca ti o n d es p a ra si te s
Œil nu VII M. glareolus Acariens Mignovillard Phylogénie XIII La communauté T. arvicolae Mignovillard Phylogénie IV M. arvalis et M.
glareolus Hantavirus Mignovillard Spécificité
Analyses
statistiques XI La communauté Cowpox virus Mignovillard I A. terrestris
scherman T. taeniaeformis Canton de Nozeroy III
(adaptation locale), XIII, XIV
La communauté T. arvicolae Mignovillard, Canton de Nozeroy Dispersion
IX M. arvalis et M. glareolus
Tula virus et
Puumala virus Mignovillard
T ra n sm is si o n d es P a ra si te s Apparentement, comportement Génétique des populations XI M. arvalis et M. glareolus Tula virus et
Puumala virus Mignovillard I A. terrestris
scherman T. taeniaeformis Canton de Nozeroy III A. terrestris
scherman T. arvicolae Canton de Nozeroy IX M. arvalis et M.
glareolus Hantavirus Mignovillard
In fl u en ce d es fa ct eu rs ex te rn es s u r le s p ré v a le n ce s Paysage, démographie, densité Analyses statistiques
X La communauté Cowpox virus Mignovillard I A. terrestris
scherman T. taeniaeformis Canton de Nozeroy III A. terrestris
scherman T. arvicolae Canton de Nozeroy IV M. arvalis et M.
glareolus Hantavirus Mignovillard Sexe, âge Analyses
statistiques
XI La communauté Cowpox virus Mignovillard VII M. glareolus Puumala virus Mignovillard
In fl u en ce d es f a ct eu rs in d iv id u el s d e l’ h ô te s u r le s p ré v a le n ce s Immunité
Immuno-génétique XII A. terrestris
scherman Communauté Canton de Nozeroy Suivi
spatio-temporel I
A. terrestris
scherman T. taeniaeformis Canton de Nozeroy Impact sur la
reproduction Expérimenta
tion VI M. arvalis T. arvicolae Mignovillard
Im p a ct d es p a ra si te s Impact sur la reproduction, immunité Modéli-sation V A. terrestris scherman, M.
3.
Résultats et discussion
3.1.
La communauté de parasites dans la communauté de
rongeurs
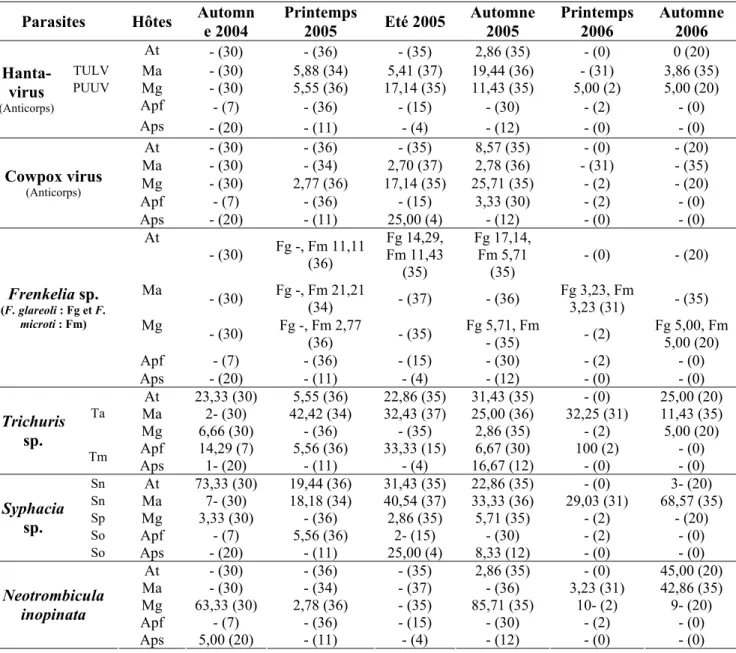
Grâce à cette étude, je peux faire un état des lieux du cortège parasitaire au sein de la communauté de rongeurs étudiée. Je dispose de données relatives à 643 rongeurs piégés à Mignovillard (deux années). Ces données ont été en partie utilisées dans différents travaux publiés ou sont en cours de publication. Elles sont détaillées ci après et résumées dans le Tableau 2 situé à la fin du paragraphe 3.1.
3.1.1. Identification et prévalences des parasites 3.1.1.1. Les virus
Sur tous les individus capturés à Mignovillard, 13 (sur 158 captures) campagnols roussâtres et 11 (sur 203 captures) campagnols des champs ont été détectés comme étant séropositifs aux hantavirus (Tableau 2 et IX). Les campagnols roussâtres montrent des séroprévalences similaires à celles observées dans les Ardennes, foyer épidémique (0 à 18 % pour PUUV [151]). De plus, en 2005, des animaux infectés ont été capturés à près de 500 m du village de Mignovillard suggérant un réel risque pour la population. Ceci a été confirmé par les 36 cas de FHSR recensés dans le Jura durant l’épidémie de 2005 [94]. Cette étude dresse un premier état des lieux concernant les hantavirus portés par les campagnols des champs car aucune donnée n’était disponible auparavant.
Des campagnols terrestres ont également été trouvés séropositifs aux hantavirus dans le canton de Nozeroy sur sept sites différents à raison de un à deux positifs par site (VIII).
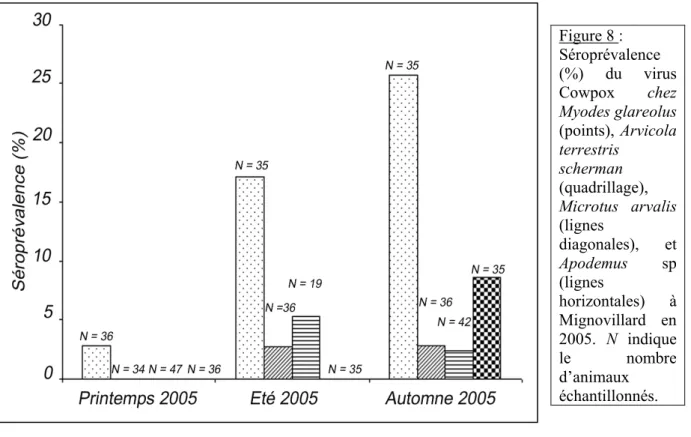
De même, pour la première fois, nous avons montré la présence du virus Cowpox en France avec des séroprévalences variant entre 0 et 82 % environ. Ces résultats sont traités en détail dans les manuscrits VIII et X. Dans le canton de Nozeroy, une analyse spatiale montre une répartition en tâches des campagnols terrestres positifs (VIII). Toutes les espèces de rongeurs capturées ont été trouvées séropositives, ajoutant le campagnol terrestre et des champs, ainsi que le mulot à collier à la liste des réservoirs potentiels de ce virus [34]. Il faudrait désormais confirmer leur rôle de réservoirs par détection directe de l’ADN de virus (PCR). Malgré plusieurs tentatives, je n’ai pas réussi à obtenir des amplifications fiables en suivant la méthode de biologie moléculaire développée par Sandvik et al. [161].
Tous les rongeurs capturés à Mignovillard ont également été criblés pour rechercher des anticorps anti-LCMV, mais aucun ne s’est révélé être séropositif (voir VII). Par contre, 13 campagnols terrestres ont été trouvés séropositifs dans deux localités du canton de Nozeroy avec des prévalences de 22,7 et 27,6 % (VIII). Ces prévalences sont du même ordre de grandeur que celles observées chez les souris sauvages considérées comme réservoirs [8, 97]. Ces résultats allongent la liste des réservoirs “secondaires” de LCMV [100, 117]. Toutefois la spécificité générale des arenavirus laisse plutôt penser à une multitude de souches de LCMV circulant en Europe plutôt qu’à une seule souche présente chez les souris. Une caractérisation génétique des souches serait nécessaire pour confirmer cette hypothèse.
3.1.1.2. Les coccidies
Les cystes de Frenkelia, un parasite hétéroxène vivant dans le tube digestif de rapaces à l’état adulte, ont été identifiés chez tous les rongeurs étudiés, à l’exception des murinés. Pourtant des Apodemus spp. ont déjà été trouvés positifs dans la même région mais à des prévalences faibles (1 %) [65]. Cette même étude montrait déjà la présence de F. glareoli chez le campagnol roussâtre (47 %) et terrestre (10 %) et de F. microti uniquement chez le campagnol des champs (9 %). Mes résultats montrent la présence des deux espèces chez tous les arvicolinés étudiés, mais avec des prévalences variables. F. glareoli et F. microti sont trouvés principalement chez les campagnols terrestres (environ 9 % et 7 % respectivement). Les autres espèces sont très peu atteintes : moins de 1 % et 4 % des campagnols des champs respectivement pour F. glareoli et F. microti et moins de 2 % des campagnols roussâtres quelle que soit l’espèce de Frenkelia (Tableau 2 et VII). A ma connaissance, aucune étude n’a pour l’instant précisé si les faibles prévalences sont dues à une résistance innée de la majorité des individus, à une plus faible exposition ou à une forte mortalité des animaux infestés. La très faible proportion de campagnols roussâtres observée lors de ma thèse comparée à la prévalence observée par Fichet-Calvet et al. [65] de près de 50 % est certainement due à une différence d’exposition à mettre en corrélation avec l’infestation des rapaces. Cependant, aucune donnée n’est disponible sur ce point. Des changements de comportement facilitant la prédation des hôtes infestés ont été montrés [187] mais on ne sait pas si ces changements sont plus ou moins marqués selon les espèces de rongeurs.
3.1.1.3. Les helminthes
Concernant Trichuris sp, toutes les espèces ont été trouvées infestées. Les prévalences varient autour de 20 à 30 % chez les campagnols des champs et terrestres alors qu’elles sont beaucoup plus faibles chez le campagnol roussâtre puisque inférieures à 7 % (III, V, VII, XIII et XIV). En ce qui concerne les mulots, les prévalences se situent autour de 10 % (voir Tableau 2 et XIII).
Les nématodes oxyures du genre Syphacia ont été observés chez toutes les espèces de rongeurs. Leurs prévalences varient selon l’espèce entre 0 et 73 % chez le campagnol terrestre, 18 et 70 % chez le campagnol des champs, entre 0 et 6 % chez le campagnol roussâtre, entre 0 et 20 % chez le mulot à collier et entre 0 et 25 % chez le mulot sylvestre (Tableau 2, III pour les données du campagnol terrestre dans le canton de Nozeroy et VII).
Un inventaire exhaustif des parasites gastro-intestinaux (cestodes et nématodes) a été réalisé sur tous les rongeurs piégés. Une partie des tubes digestifs (intestin grêle et estomac) est encore en cours d’inspection par le Dr. Alexis Ribas Salvador à l’Université de Pharmacie de Barcelone (Espagne). Seules les données concernant le campagnol roussâtre sont pour l’instant disponibles (voir VII).
Enfin, la présence de cestodes larvaires a été notée. Ils sont peu fréquents puisque l’on dénombre en tout 15 rongeurs porteurs d’Echinococcus multilocularis, parasite hétéroxène causant l’échinococcose alvéolaire chez l’Homme. Trois sont des campagnols terrestres et 12 des campagnols des champs. Le ver adulte vit chez le renard ou le chien. Six rongeurs forestiers (5 campagnols roussâtres et 1 mulot à collier) étaient atteints de Taenia mustelae, parasite hétéroxène dont l’adulte vit chez la belette et l’hermine (mustélidés). Trois campagnols des champs étaient porteurs de T. crassiceps, parasite hétéroxène dont l’adulte vit
![Figure 1 : Cycles de populations de lemmings (Lemnus lemnus) à Finse, Norvège. (modifié à partir de la Fig.1a [19])](https://thumb-eu.123doks.com/thumbv2/123doknet/13609779.424663/9.892.114.746.477.900/figure-cycles-populations-lemmings-lemnus-lemnus-norvège-modifié.webp)