HAL Id: tel-01443622
https://tel.archives-ouvertes.fr/tel-01443622
Submitted on 23 Jan 2017
HAL is a multi-disciplinary open access
archive for the deposit and dissemination of
sci-L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents
Mécanismes d’action de l’homéoprotéine Engrailed dans
les neurones dopaminergiques adultes du mésencéphale
Hocine Rekaik
To cite this version:
Hocine Rekaik. Mécanismes d’action de l’homéoprotéine Engrailed dans les neurones dopaminergiques adultes du mésencéphale. Neurosciences [q-bio.NC]. Université Pierre et Marie Curie - Paris VI, 2016. Français. �NNT : 2016PA066257�. �tel-01443622�
THÈSE DE DOCTORAT DE L’UNIVERSITÉ PARIS VI
ÉCOLE DOCTORALE CERVEAU-COGNITION-COMPORTEMENT
CIRB – Collège de France / Équipe Alain Prochiantz
Mécanismes d’action de l’homéoprotéine Engrailed dans
les neurones dopaminergiques adultes du mésencéphale
Par Hocine REKAIK
Soutenance le 27 septembre 2016
Composition du jury
Dr Patricia GASPAR
Présidente
Dr Laure BALLY-CUIF
Rapportrice
Pr François KARCH
Rapporteur
Dr Frédéric SAUDOU
Examinateur
Dr Alessandra PIERANI
Examinatrice
Pr Alain PROCHIANTZ
Examinateur
A mes parents,
pour toutes les belles choses qu’ils m’ont apportées
Remerciements
Je voudrais tout d’abord remercier les membres du jury de cette thèse qui ont aimablement accepté mon invitation, spécialement mes deux rapporteurs, Laure Bally-Cuif et François Karch, d’avoir pris de leur temps pour examiner mon travail.
Bien entendu, je ne saurai trouver les mots pour exprimer ma gratitude envers Alain Prochiantz, pour m’avoir accueilli dans son laboratoire et donné la possibilité de découvrir la recherche, pour sa confiance, sa bienveillance et son optimisme sans égal. Merci d’être à nos cotés, tous les jours, merci pour tout !
Merci Raju. D’abord pour être mon directeur de thèse, pour m’avoir tant appris et conseillé pour la réussite du projet, et pour avoir supporté mon insouciance au quotidien. Merci aussi pour les discussions infinies, scientifiques ou non, que nous avons eu des centaines de fois autour du « petit café ». Quelle joie de travailler avec une personne passionnée et positive telle que toi. Merci à toi Julia, pour ta bonne humeur et ta gentillesse qui irradient l’équipe Parkinson. Pour tes précieux conseils et ta rigueur scientifique qui m’a appris qu’un bon chercheur, c’est d’abord un chercheur précis. Je te souhaite le meilleur pour ta carrière. Ne change rien !
A toi François-Xavier, compagnon de route, je te dis merci pour ton amitié et ta collaboration durant ces années de thèse, et pour les moments partagés lors de nos déplacements en congrès. Quelle chance ce fût d’avoir un binôme aussi brillant à mes cotés. Je te souhaite la carrière exceptionnelle que tu mérites.
Merci à toi Olivia, pour ta franchise, ton aide inestimable et ta disponibilité. Rien ne serait pareil dans le laboratoire sans tes qualités scientifiques et ton dévouement au quotidien.
Je remercie aussi Ariel pour m’avoir accepté en tant que stagiaire en M1 et grâce à qui j’en suis là aujourd’hui. Raoul pour son aide et ses conseils précieux. Ken et Michel pour leur expertise scientifique. Eliane pour sa gentillesse au jour le jour. Francine, pour son soutien moral considérable et son aide avec les tâches administratives.
Je tiens à remercier les membres de l’équipe Vriz-Joliot, ainsi que tous les membres passés et présents du laboratoire Prochiantz, en particulier Anabelle, Eva, Anthony, Clémence, Joshua, Clémentine, Karen, Colette, Patricia, Vincent, Chantal, Stéphanie et Marion qui rendent ce lieu vivant et joyeux. Un grand merci à Jessica, Damien et Eugénie pour leur bonne humeur et leur foi inébranlable dans la science ;)
Une pensée pour mes amis, des deux côtés de la méditerranée, merci pour votre soutien.
Je tiens finalement à remercier ceux qui occupent une place précieuse dans ma vie, ma famille. Malgré la distance qui nous sépare, vous avez toujours été là pour moi, pour me supporter et m’encourager. Je vous aime profondément. Merci pour tout.
Table des matières
Tables des figures ... iii
Liste des tableaux ... v
Liste des abréviations ... vi
INTRODUCTION ... 1
I. Le système dopaminergique et son développement ... 3
A. Physiologie du système dopaminergique ... 3
B. Développement des neurones dopaminergiques mésencéphaliques ... 5
II. Homéoprotéines ... 6
A. Les homéoprotéines comme facteurs de transcription classiques ... 6
B. Engrailed et son rôle durant le développement des neurones dopaminergiques ... 9
C. Capacité de signalisation des homéoprotéines ... 10
D. Activité non autonome-cellulaire des homéoprotéines ... 12
III. Altération du système dopaminergique et maladie de Parkinson ... 13
A. Description de la maladie de Parkinson et facteurs de risque ... 13
B. Pathologie de la maladie de Parkinson ... 14
C. Mécanismes de la maladie de Parkinson ... 16
1. Mécanismes liés aux gènes de la maladie de Parkinson ... 16
2. Stress oxydatif ... 17
IV. Instabilité génomique et éléments transposables ... 18
A. Instabilité génomique liée au stress oxydatif ... 18
B. LINE-1 comme famille active d’éléments transposables ... 20
C. Mécanisme de rétrotransposition et instabilité du génome ... 22
D. Expression des LINE-1 dans le cerveau ... 22
E. Mécanismes de défense ... 23
V. Engrailed dans la physiopathologie des neurones dopaminergiques adultes ... 24
A. Phénotype de la souris hétérozygotes En1+/- ... 24
B. Effet neuroprotecteur d’Engrailed ... 26
ARTICLE 1 - Engrailed Homeoprotein Protects Mesencephalic
Dopaminergic Neurons from Oxidative Stress ... 29
Introduction ... 32
Résultats ... 32
Procédures expérimentales ... 38
Contribution des auteurs ... 38
Remerciements ... 38
Procédures et figures supplémentaires ... 41
ARTICLE 2 - L1 repression attenuates degeneration in adult dopaminergic
neurons ... 53
Introduction ... 57 Résultats ... 58 Discussion ... 63 Procédures expérimentales ... 66 Remerciements ... 71Contribution des auteurs ... 72
DISCUSSION ... 89
I. Phénotype de dégénérescence des neurones dopaminergique de la souris En1+/- ... 91
A. Notion de seuil dans la mort neuronale ... 91
B. Modèle de mort neuronale dans la maladie de Parkinson ... 93
C. Sélectivité de la mort des neurones dopaminergique chez la souris En1+/- ... 94
D. Progressivité de la mort des neurones dopaminergiques chez la souris En1+/- ... 96
II. Mécanismes d’action d’En1 dans les neurones dopaminergiques mésencéphaliques ... 97
A. Régulation transcriptionnelle par En1 chez la souris En1+/- ... 97
B. Rôle d’En1 dans la réparation de l’ADN des neurones dopaminergiques ... 97
C. Un modèle : la structure de la chromatine au cœur de la régulation par En1 ... 99
D. Le stress nucléolaire comme cible d’En1 ... 101
E. En1 réprime l’expression des LINE-1 dans les neurones dopaminergiques ... 102
F. Mécanisme de répression des LINE-1 par En1 ... 105
G. Mécanismes d’action d’En1, à court et à long terme ... 107
1. Effets à long terme ... 107
2. Effets à court terme ... 108
H. Mécanisme épigénétique de signalisation ... 109
III. Engrailed, comme protéine thérapeutique ... 110
A. Potentiel thérapeutique du mécanisme d’internalisation des homéoprotéines ... 110
B. Capacités de neuroprotection des homéoprotéines ... 111
C. Engrailed comme protéine multifonctionnelle ... 112
D. Possible potentiel neurogénique d’En1 dans le mésencéphale ... 114
Conclusion ... 115
Tables des figures
Introduction
1. Distribution des noyaux dopaminergiques dans le cerveau adulte des rongeurs ... 4
2. Mutation d’Antennapedia chez la drosophile ... 7
3. Les homéoprotéines participent à la formation des barrières entre les compartiments du cerveau en développement ... 8
4. L’expression d’Engrailed chez l’embryon et l’adulte ... 9
5. Le signal de sécrétion et d’internalisation des homéoprotéines ... 17
6. Structure des éléments transposables LINE-1 chez l’homme et la souris ... 21
7. Dégénérescence progressive des neurones dopaminergiques chez la souris En1+/- ... 25
8. La souris En1+/- présente des symptômes moteurs et non-moteurs comparables à ceux de la maladie de Parkinson ... 25
Papier 1
1. Altered Expression of DNA Damage and Heterochromatin Marks in En1+/- Mice ... 332. DNA Damage and Chromatin Alteration in SNpc TH+ Neurons upon 6-OHDA Injection ... 34
3. Engrailed Rescues TH+ Cells from 6-OHDA-Induced Cell Death ... 36
4. RNA-Seq Analysis Reveals Engrailed Anti-apoptotic Activity ... 37
S1. Altered genes expression in mDA neurons of En1+/- mice ... 41
S2. TH cell death and chromatin changes in 6-OHDA injected mice ... 43
S3. Engrailed transcription activity involved in TH neuron protection ... 45
S4. Detection of cell cycle markers in TH+ neurons upon acute oxidative stress in vivo ... 47
Papier 2
1. Full-length L1 Elements are expressed in the adult mouse ventral midbrain ... 762. L1 expression is increased upon oxidative stress, inducing DNA damage repressed by
Engrailed ... 78
3. L1 expression is enhanced in En1-het mice ... 80
4. Engrailed is a direct repressor of L1 transcription and represses rétrotransposition ... 82
5. Under oxidative stress, the piRNA binding protein Piwil1 decreases the number of nuclear γ-H2AX and L1-RNA foci ... 84
6. ORF2 siRNAs and stavudine protect against DNA damage and neurodegeneration ... 86
Discussion
1. Modèle de « l’hypothèse d’accélération stochastique » ... 942. Modèle de mort neuronal initié par l’instabilité génomique ... 100
3. L’activité endonucléase de ORF2p induit une instabilité génomique dans le cerveau ... 103
4. Mécanisme d’action de la stavudine sur la répression de l’activité des LINE-1 ... 105
5. Mécanismes de régulation des LINE-1 par En1/2 ... 106
Liste des tableaux
1. Processus cellulaires impliqués dans la pathologie de la maladie de Parkinson ... 16
Liste des abréviations
6-OHDA 6-hydroxydopamine
A30P Alpha-synuclein point mutant ADN Acide désoxyribonucléique ADNc ADN complémentaire ARN Acide ribonucléique
ARNm Acide ribonucléique messager ATM Ataxia Telangiectasia Mutated ATP Adénosine-5-triphosphate ATV Aire tegmentale ventrale BER Réparation par excision de base CS Chondroitines sulfatés
DA Dopamine
E8 Jour embryonnaire 8
En Engrailed
En1 Engrailed1
En1+/- Souris hétérozygotes pour Engrailed1 En2 Engrailed2
FGF8 Fibroblast growth factor 8 Foxa1/2 Forkhead Box A1 et A2 GABA Acide γ-aminobutyrique
Gadd45b Growth Arrest And DNA Damage Inducible Beta GBA Glucocérébrosidase
Gbx2 Gastrulation brain homeobox 2 H2O2 Peroxyde d'hydrogène
γ-H2AX Histone2AX phosphorylé H3k27me3 Histone 3 lysine 27 méthyl 3 H3k9me3 Histone 3 lysine 9 méthyl 3
HD Homéodomaine
HP1 Heterochromatin protein 1 JNK c-Jun N-terminal kinase KAP1 KRAB-associated protein-1 L-DOPA 3,4-dihydroxyphénylalanine
LINE-1 longs éléments nucléaires intercalés-1 Lmx1b LIM homeobox transcription factor 1-beta LRRK-2 Leucine-rich repeat kinase 2
MILI Miwi-like MIWI2 Piwi murin 2
MPTP 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine mTOR Mammalian target of rapamycin
NER Réparation par excision de nucléotides NGF Nerve growth factor
NHEJ Réparation par jonction d'extrémités non homologues NMDA Acide N-méthyl-D-aspartique
Ogg1 8-Oxoguanine glycosylase ORF Open reading frame Otx2 Orthodenticle homolog 2 Pax6 Paired box 6
piRNA ARN interagissant avec Piwi Pitx3 Pituitary homeobox 3
PIWI P-element induced wimpy testes Pol-II RNA-Polymérase II
PV Parvalbumine
RH Recombinaison homologue SHH Sonic hedgehog
SNpc Substantia nigra pars compacta SVZ Zones sous-ventriculaires TH Tyrosine hydroxylase
TrkA Tropomyosin receptor kinase A wt Sauvage
Les homéoprotéines, facteurs de transcription impliqués dans toutes les étapes du développement des métazoaires, restent exprimées chez l’adulte, en particulier dans le système nerveux. Les homéoprotéines exercent quelques unes de leurs fonctions à travers leur capacité de transfert entre les cellules. Le laboratoire étudie dans ce contexte le rôle des homéoprotéines dans le développement, la physiologie, la plasticité cérébrale ainsi que dans certains troubles du système nerveux.
Parmi ces homéoprotéines, Engrailed1/2 (collectivement Engrailed) est importante pour le développement de la tête aux stades embryonnaires, mais reste néanmoins exprimée au stade adulte dans les neurones dopaminergiques mésencéphaliques, ceux-là même qui dégénèrent dans la maladie de Parkinson. Chez les souris délétées d’une copie du gène (En1+/-), une dégénérescence progressive des neurones dopaminergiques s’accompagne de symptômes moteurs et non moteurs rappelant la maladie de Parkinson, ce qui pourrait faire de ces souris un modèle nouveau et intéressant de cette maladie neurodégénérative. Des expériences de transduction de la protéine En1 dans les cellules du mésencéphale de souris démontrent son effet neuroprotecteur dans des modèles toxicologiques de la maladie de Parkinson et chez les souris En1+/-, menant à l’hypothèse qu’Engrailed est important dans la physiopathologie de cette maladie.
L’essentiel de ce travail de thèse s’inscrit dans la compréhension des mécanismes d’action de l’homéoprotéine Engrailed dans les neurones dopaminergiques mésencéphaliques. L’activité physiologique importante de ces neurones et le stress métabolique oxydant qui est généré touche plusieurs compartiments cellulaires, dont le noyau. La stabilité du génome semble être un aspect majeur de l’action d’Engrailed dans ces neurones. D’abord contre les effets délétères du stress oxydatif sur l’intégrité de l’ADN et la structure de la chromatine, ensuite, contre l’activité génotoxique des éléments transposables LINE-1. Dans cette introduction je vais en premier aborder les caractéristiques du système dopaminergique et l’implication d’Engrailed dans son développement. Je vais par la suite décrire les altérations du système dans la maladie de Parkinson, et l’importance de la stabilité génomique et des éléments transposables dans ce contexte. Enfin, la dernière partie rapportera nos actuelles connaissances sur le rôle d’Engrailed dans la physiopathologie des neurones dopaminergiques.
I. Le système dopaminergique et son développement A. Physiologie du système dopaminergique
Depuis la découverte des fonctions physiologiques de la dopamine (DA) à la fin des années 50 (Carlsson et al., 1957), ce neurotransmetteur de la famille des catécholamines a bénéficié d’une attention considérable.
La dopamine est métabolisée à partir de l’acide aminé tyrosine, et active des récepteurs couplés aux protéines G. Il existe cinq récepteurs dopaminergiques classés dans 2 familles principales : les familles D1 et D2 qui peuvent être pré- ou post-synaptiques (Beaulieu and Gainetdinov, 2011).
Comme d’autres neurotransmetteurs monoaminergiques, la dopamine exerce son action sur les circuits neuronaux via une modulation de la neurotransmission rapide médiée par le glutamate et l’acide γ-aminobutyrique (GABA). En effet, la transmission synaptique rapide classique utilise des récepteurs ionotropes1, contrairement à la neuromodulation qui elle utilise des récepteurs
métabotropes plus lents (comme les récepteurs couplés aux protéines G). Il en ressort que la principale fonction de la dopamine n’est clairement pas celle d’un neurotransmetteur excitateur ou inhibiteur, mais bien d’un neuromodulateur qui altère la réponse des neurones cibles aux autres neurotransmetteurs, et peut donc contrôler la plasticité synaptique.
Dans le système nerveux central des mammifères, les régions du cerveau qui synthétisent la dopamine ont des projections qui donnent naissance à 4 voies axonales : les voies nigrostriée, mésolimbique, mésocorticale et tubéro-infundibulaire. Ces noyaux dopaminergiques sont nommés A9 (nigrostriée), A10 (mésolimbique et mésocorticale) et A8 (tubéro-infundibulaire) (Andén et al., 1964; Dahlstroem and Fuxe, 1964) (Figure 1). Les neurones dopaminergiques du groupe A9 forment la substantia nigra pars compacta (SNpc), l’une des composantes de la substantia nigra (ou substance noire). L’autre partie étant la substantia nigra pars reticulata,
essentiellement composée de neurones GABAergiques, avec des connections et des fonctions différentes.
La substantia nigra est un noyau du mésencéphale et fait partie des ganglions de la base avec le thalamus, le globus pallidus et le noyau sous-thalamique. Ces ganglions sont interconnectés avec plusieurs régions du cerveau, incluant le cortex cérébral, le thalamus et le tronc cérébral. Ils sont associés à une variété de fonctions, principalement le contrôle moteur et dans une moindre mesure, l’apprentissage moteur, les fonctions exécutives et les émotions (Lanciego et al., 2012). Les neurones dopaminergiques de la SNpc projettent vers la partie dorsale du striatum (le putamen et le noyau caudé) où ils modulent l’activité des neurones épineux moyens, permettant au circuit de générer des mouvements volontaires harmonieux.
Figure 1. Distribution des noyaux dopaminergiques dans le cerveau adulte des rongeurs
Les neurones dopaminergiques sont localisés dans 8 noyaux distribués à travers le cerveau, du mésencéphale au bulbe olfactif. Section sagittale montrant les projections des noyaux dopaminergiques illustrées par des flèches (adaptée depuis Björklund and Dunnett, 2007).
Les neurones du groupe A10 sont localisés dans l’aire tegmentale ventrale (ATV) dans le mésencéphale, à proximité des neurones dopaminergiques de la SNpc. Ces neurones projettent vers le cortex préfrontal et le système limbique où ils régulent respectivement les fonctions cognitives et les systèmes de récompense. Le groupe A8 forme quant à lui le champ rétrorubral qui projette vers le striatum dorsal, le système limbique et le cortex préfrontal. Ses fonction sont, en revanche, moins bien définies (Björklund and Dunnett, 2007).
Les groupes de neurones dopaminergiques A11 à A17 sont distribués à travers l’hypothalamus, le bulbe olfactif et la rétine. Néanmoins, avec 75% du nombre total des neurones dopaminergiques, les neurones dopaminergiques mésencéphaliques demeurent les plus étudiés dans le cerveau, notamment à cause de leur implication dans des fonctions critiques. Il n’est donc pas surprenant que de multiples pathologies humaines soient reliées à des disfonctionnements de ce système.
B. Développement des neurones dopaminergiques mésencéphaliques
Chez les mammifères, l’origine des neurones dopaminergiques mésencéphaliques remonte à la formation du tube neural et de deux de ses centres organisateurs : l’organisateur isthmique et la plaque du plancher (floor plate). Le premier est responsable de la formation sur l’axe antéro-postérieur de la barrière délimitant le mésencéphale du rhombencéphale2. Cette structure est mise
en place par l’expression coordonnée et mutuellement répressive de deux facteurs de transcription : Orthodenticle homolog 2 (Otx2) dans le mésencéphale et Gastrulation brain homeobox 2 (Gbx2) dans le rhombencéphale (Broccoli et al., 1999; Wassarman et al., 1997). La floor plate quant à elle est présente au niveau ventral du tube neural. Elle est induite par Sonic hedgehog (SHH) secrété d’abord depuis la notochorde3 et qui active l’expression des facteurs de
transcription Forkhead Box A1 et A2 (Foxa1/2), eux même responsables de l’induction de SHH dans la floor plate autour du jour embryonnaire 8,5 (E8,5) chez la souris (Ang and Rossant, 1994; Roelink et al., 1995). Le SHH de la floor plate et le « Fibroblast growth factor 8 » (FGF8), facteur diffusible secrété depuis l’organisateur isthmique, vont créer ensemble avec l’aide d’autres facteurs de transcription la région du mésencéphale ventrale où les neurones dopaminergiques sont induits. Ce champ morphogénétique est mis en place à travers la diffusion en gradients de SHH et FGF8 selon un système bidimensionnel de coordonnées cartésiennes à la jonction de la floor plate et de l’organisateur isthmique (Ye et al., 1998).
A ce stade, un seul paradigme a été mentionné dans le processus de spécification embryonnaire des neurones dopaminergiques du mésencéphale. Il s’agit de centres de signalisation qui secrètent des facteurs diffusibles le long des axes antéro-postérieur et dorso-ventral et délimitent ainsi
2 Rhombencéphale ou cerveau postérieur, est une catégorisation développementale du cerveau. Il inclut le cervelet, le pont et le bulbe rachidien.
spatialement une région permissive à l’induction de progéniteurs dopaminergiques. La suite du développement de ces progéniteurs implique des signaux intrinsèques via les facteurs exprimés à l’intérieur même de ces cellules et qui se coordonnent pour donner les neurones dopaminergiques matures.
En effet, à E9, toujours sous l’influence des deux centres régulateurs mentionnés plus haut, les progéniteurs dopaminergiques entament leur différenciation via l’expression d’une cascade de facteurs de transcription. Ces facteurs poussent progressivement ces cellules vers un phénotype dopaminergique mature, tout en restreignant leur choix de différenciation vers d’autres phénotypes (Blaess and Ang, 2015). Vers E11,5, des marqueurs de neurones dopaminergiques matures commencent à s’exprimer comme la Tyrosine hydroxylase (TH, responsable de la conversion de la tyrosine en L-DOPA), ainsi que d’autres enzymes de la voie de synthèse de la dopamine (Lauder and Bloom, 1974). Entre E12,5 et E13,5, ces neurones commencent leur migration vers les trois clusters dopaminergiques dans le mésencéphale : l’ATV, la SNpc et le champ rétrorubral. Là-bas, ils vont parfaire leur maturation avec la croissance axonale vers leurs cibles spécifiques et la synaptogenèse.
II. Homéoprotéines
A. Les homéoprotéines comme facteurs de transcription classiques
Les gènes homéotiques ou homéogènes constituent une famille de gènes développementaux découverts grâce à l’étude de transformations étranges chez la drosophile. Ces mutations appelées transformations homéotiques impliquent le remplacement d’un segment ou d’une partie du segment de la mouche par un autre segment ou partie du segment (Figure 2). Dans un des exemples frappants de ces transformations chez la drosophile, l’antenne sur la tête est remplacée par les pattes du deuxième segment thoracique, suggérant que chez l’embryon, les cellules de la tête ont interprété leur position comme étant celle du deuxième segment thoracique, et ont développé des pattes (Garber et al., 1983; Lawrence et al., 1983).
Figure 2. Mutation d’Antennapedia chez la drosophile
Une mutation homéotique du gène Antennapedia, sur le panneau à gauche, l’antenne de la drosophile est remplacée par des pattes, en comparaison avec une drosophile normale sur le panneau de droite (Photo par FR Turner, Indiana Univ).
Ce travail a montré que les cellules de la tête contiennent l’information nécessaire pour se développer en pattes, ce qui est expliqué par le principe qu’une cellule, via l’information présente dans son ADN, peut construire un organisme entier. L’autre principe non moins important est celui de l’information de position que chaque segment du corps acquière lors du développement et qui l’oblige à suivre un destin (fate) bien précis. Cela est possible grâce, principalement, aux gènes homéotiques qui, selon un paradigme d’expression différentielle spatio-temporelle, donnent une identité positionnelle à chaque segment de l’embryon (la famille des gènes Hox) (Holland and Hogan, 1988).
Fonctionnellement, les homéogènes codent pour des protéines appelées homéoprotéines, qui se trouvent être des facteurs de transcription. En tant que facteurs de transcription, les homéoprotéines se lient à leurs cibles dans le génome via une séquence très conservée appelée homéodomaine (HD), qui fait 60 acides aminés de long. La diversité de séquences dans les régions effectrices des homéoprotéines et au sein même de l’HD leur permet de réguler l’expression de différents ensembles de gènes. La combinaison d’homéoprotéines se trouvant dans les mêmes cellules permet de mieux affiner le destin cellulaire à travers l’expression régulée davantage de gènes.
En plus de leur rôle dans la formation de patrons de développement du neuroepithelium (patterning), les homéoprotéines jouent un rôle essentiel dans la compartimentation de ses différentes régions (Figure 3). Elles participent à la formation et au positionnement des barrières qui séparent deux compartiments adjacents (Kiecker and Lumsden, 2005). Dans plusieurs cas décrits, l’expression de deux homéoprotéines des deux côtés de la barrière est caractérisée par un mécanisme d’auto-activation et d’inhibition réciproque. Ce processus a été bien étudié dans la formation de la barrière délimitant le mésencéphale du rhombencéphale avec deux homéoprotéine Otx2 et Gbx2, décrites plus haut dans ce texte.
La plupart des homéoprotéines demeurent exprimées après le développement, quand elles acquièrent, comme beaucoup d’autres protéines, de nouvelles fonctions. Dans le système nerveux, en plus de leur rôle dans la segmentation et la compartimentation, elles participent à la migration cellulaire et axonale. Plus tard chez l’adulte, ces homéoprotéines exprimées dans des compartiments plus restreints, acquièrent des fonctions physiologiques (Prochiantz and Di Nardo, 2015). Ce dernier aspect va être abordé en profondeur dans ce travail.
Figure 3. Les homéoprotéines participent à la formation des barrières entre les compartiments du cerveau en développement
L’expression de deux homéoprotéines avec des propriétés d’auto-activation et d’inhibition réciproque définit ces différentes barrières. Abréviations : DMB, diencephalon–midbrain boundary ; ZLI, zona limitans intrathalamica ; PSB, pallial–subpallial boundary ; MHB, midbrain–hindbrain boundary (adaptée depuis Prochiantz and Di Nardo, 2015).
B. Engrailed et son rôle durant le développement des neurones dopaminergiques
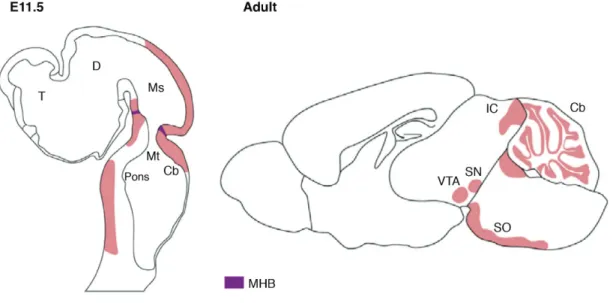
Les protéines Engrailed (En) sont des homéoprotéines largement conservées à travers le règne animal (Gibert, 2002). Chez les murins, il existe deux paralogues d’Engrailed, En1 et En2, tous deux importants durant le développement embryonnaire. L’expression de En1 et En2 (En1/2) chez l’embryon commence autour de E8,5 dans un domaine qui couvre la plaque neurale de la partie postérieure du mésencéphale et antérieure du rhombencéphale (Figure 4). Ce domaine coïncide avec la partie du tube neural qui va générer les structures dorsales incluant le colliculus inférieur et le cervelet, ainsi que les noyaux ventraux du mésencéphale. En1 est exprimée dans les neurones dopaminergiques dès E11, au moment où ils entament leur différenciation. Chez l’adulte, En1 reste exprimée dans ces neurones de l’ATV et la SNpc alors que le niveau d’expression d’En2 est plus faible dans ces structures et se concentre plus fortement dans le cervelet. En revanche, dans le colliculus inférieur, En1 et En2 montrent des patterns d’expression semblables (Millen et al., 1994; Simon et al., 2001; Wurst et al., 1994).
Figure 4. L’expression d’Engrailed chez l’embryon et l’adulte
A partir de E8,5, l’expression d’En1/2 commence dans une région qui entoure la barrière mésencéphale-rhombencéphale (MHB). Cette expression continue chez l’adulte dans des zones spécifiques du mésencéphale ventral, le colliculus inférieur et le cervelet. Abréviations : T, telencephalon ; D, diencephalon ; Ms, mesencephalon ; Mt, metencephalon ; Cb, cerebellum ; IC, inferior colliculus ; SN, substantia nigra ; SO, superior olive ; VTA, ventral tegmentum area (adaptée depuis Prochiantz and Di Nardo, 2015; Simon et al., 2001).
Comme mentionné plus haut, l’expression spatiale et temporelle d’En1 est limitée à la jonction entre le mésencéphale et le rhombencéphale et coïncide avec le développement et le maintien des neurones dopaminergiques mésencéphaliques. Plusieurs études se sont donc intéressées au rôle d’En1/2 dans ce contexte et ont montré que, chez la souris, les mutants homozygotes pour En1 (En1-/-) meurent à la naissance et présentent des défauts développementaux avec l’absence du cervelet et du colliculus inférieur (Wurst et al., 1994). En revanche, le développement des neurones dopaminergiques ne semble pas être altéré chez ces souris. Des études récentes ont démontré que ces défauts sont dus au fond génétique des souris, et que sur un fond C57BL/6J, l’absence d’En1 n’altère pas le développement du cervelet (Bilovocky et al., 2003). En revanche, chez ces mutants, il semble y avoir une expansion ectopique du domaine dopaminergique sur la partie rostrale du rhombencéphale (domaine sérotoninergique), ce qui indique que En1 est probablement important pour le positionnement correct de l’organisateur isthmique et la barrière délimitant le mésencéphale du rhombencéphale (Kouwenhoven et al., 2016).
Ce n’est qu’en mutant les deux gènes Engrailed sur les quatre allèles (En1-/- ; En2-/-) qu’on observe la perte complète des neurones dopaminergiques. Chez ces embryons, les neurones deviennent post-mitotiques et expriment la TH mais toute la population est perdue au alentour de E14. Encore plus intéressante est la capacité d’un seul allèle d’En1 (En1+/- ; En2-/-) de sauver ces neurones dopaminergiques et de rétablir le phénotype sauvage, alors qu’un allèle d’En2 (En1-/- ; En2+/-) n’y suffit pas (Simon et al., 2001). Il ressort de ces études qu’Engrailed est un facteur de survie pour les neurones dopaminergiques durant le développement, avec un effet dose-dépendant. Il est aussi intéressant de noter que En1 semble être plus important que En2 dans ce rôle, et que ces deux homéoprotéines peuvent être interverties et jouer un rôle équivalant. Cela a d’ailleurs été confirmé dans un travail démontrant qu’En2 inséré dans le locus d’En1 peut fonctionnellement remplacer En1, permettant le développement du mésencéphale et la survie des souris homozygotes En1-/- (Hanks et al., 1995).
C. Capacité de signalisation des homéoprotéines
A la fin des années 80, Alain Prochiantz et ses collaborateurs s’intéressaient aux interactions neurones-astrocytes et à leur impact sur la forme des neurones (Denis-Donini et al., 1984). L’idée
était que les homéoprotéines qui contrôlent le processus de morphogénèse (par exemple la transformation d’un tissu en organe) peuvent aussi contrôler, sur un plan organisationnel inférieur, la morphologie des cellules. Pour tester cette hypothèse, l’HD d’Antennapedia, une homéoprotéine de drosophile, a été internalisé dans les neurones via une technique qui permet la perturbation de la membrane plasmique. Cette expérience a bien fonctionné, et a démontré que l’HD peut modifier la forme des neurones en se liant sur des sites d’HP dans le génome et en perturbant ainsi l’activité des HP endogènes (Joliot et al., 1991). Dans le contrôle de cette expérience, où l’HD est mis dans le milieu extérieur sans perturbation de la membrane, les auteurs ont observé aussi un changement de morphologie des neurones, ce qui suggérait que l’HD était peut-être entré par lui même dans la cellule. La confirmation de cette hypothèse a initié une série de découvertes qui ont conduit à démontrer que les homéoprotéines ont la capacité de rentrer dans la cellule sans passer par des récepteurs (internalisation), et de sortir de la cellule (sécrétion) sans peptide signal classique, à l’aide de séquences situées dans l’HD et spécifiques de chaque étape de ce mécanisme de transfert (Figure 5) (Joliot et al., 1998; Le Roux et al., 1993).
Figure 5. Le signal de sécrétion et d’internalisation des homéoprotéines
Le panneau à gauche présente la structure conservée de l’homéodomaine en forme de 3 hélices contenant les séquences de sécrétion et d’internalisation, flanquées par deux domaines variable N- et C-terminal. Le panneau de droite est un diagramme du transfert intercellulaire des homéoprotéines, via un mécanisme non conventionnel de sécrétion et d’internalisation (adaptées depuis Brunet et al., 2007; Prochiantz and Di Nardo, 2015).
Les voies classiques de signalisation impliquent la sécrétion de divers types de molécules qui se lient à des récepteurs spécifiques à la surface des membranes cellulaires et activent la transduction de cascades de signaux intracellulaires. Les homéoprotéines ont cette capacité d’internalisation qui leur permet d’accéder au cytoplasme et au noyau des cellules où elles peuvent réguler directement, en tant que facteur de transcription, leurs différentes cibles (Figure 5). Les effets de cette signalisation atypique au niveau développemental et physiologique ont été étudiés depuis dans plusieurs modèles. A contrario, les mécanismes exacts d’internalisation et de sécrétion des homéoprotéines demeurent encore mal compris, et font l’objet d’intenses investigations. Néanmoins, avec l’omniprésence de ces molécules dans l’organisme, ce phénomène de transduction pourrait représenter un mode majeur de communication cellulaire.
D. Activité non autonome-cellulaire des homéoprotéines
Au nombre de près de 300 chez les mammifères, les homéoprotéines jouent un rôle essentiel dans plusieurs aspects de la vie de l’organisme, dès premiers stades développementaux jusqu’à la mort. Ce mécanisme de transduction leur apportent, en plus de leur fonction autonome cellulaire, une capacité de signalisation non autonome-cellulaire nécessitant une sécrétion et un passage dans des cellules receveuses.
Toutes les homéoprotéines testées in vitro à ces jours, autour de 10, montrent cette capacité de transfert. In vivo, 4 homéoprotéines (En1, En2, Otx2 et Pax6) ont permis de montrer que ce transfert intercellulaire porte des fonctions précises sur le plan physiologique (Spatazza et al., 2013a). Néanmoins, chez l’animal, l’étude de cet effet non autonome-cellulaire reste difficile du fait que les séquences responsables du transfert se trouvent à l’intérieur même de l’homéodomaine. Les muter rendrait cette protéine inapte à réguler proprement ses cibles sur le plan autonome cellulaire, et compliquerait l’interprétation du phénotype qui en résulterait et les supposés effets non autonome-cellulaires. C’est dans cette optique que le laboratoire a développé un outil génétique qui permet à des cellules de secréter dans le milieu extracellulaire des anticorps contre une homéoprotéine donnée. Cet outil permet d’étudier spécifiquement l’effet non autonome-cellulaire sans toucher à la capacité de fonctionnement de la protéine sur le plan autonome-cellulaire. Dans Bernard et al., le blocage du transfert intercellulaire d’Otx2 dans le
cortex de la souris via la sécrétion d’anticorps contre Otx2 induit des changement dans la plasticité du cortex visuel (Bernard et al., 2016; Spatazza et al., 2013b).
III. Altération du système dopaminergique et maladie de Parkinson A. Description de la maladie de Parkinson et facteurs de risque
La maladie de Parkinson est une maladie neurologique chronique, de nature neurodégénérative, qui se caractérise par des symptômes moteurs associés à la présence des corps de Lewy et la perte progressive des neurones dopaminergiques de la SNpc. Elle est considérée comme la maladie neurodégénérative la plus fréquente après l’Alzheimer. Touchant les personnes âgées, elle devient une importante préoccupation pour la santé publique avec le vieillissement continu de la population mondiale.
Les symptômes moteurs, caractéristiques de la maladie, ont été décrits pour la première fois par le médecin britannique James Parkinson, il y a deux siècles. Ces symptômes parkinsoniens incluent une lenteur des mouvements (bradykinésie), une rigidité musculaire, des tremblements, une instabilité posturale et des troubles de la locomotion (Parkinson, 1817). Ils se manifestent de façon hétérogène chez les patients, rendant difficile une classification exacte des sous-types de la maladie.
La progression de la maladie est caractérisée par la détérioration des symptômes moteurs, qui dans un premier temps, peuvent être gérés avec des traitements symptomatiques4. Plus tard, dans
les derniers stades de la maladie, la détérioration de la qualité de vie implique une prise en charge spécialisée de ces patients. Avec l’avancement de la maladie, les traitements prolongés causent des effets secondaires, parmi lesquels une fluctuation des symptômes moteurs et non-moteurs, une dyskinésie et des psychoses. Dans les derniers stades de la maladie, les symptômes résistant au traitement deviennent proéminent et incluent une instabilité posturale, des troubles de la
4 La L-DOPA est un précurseur de la dopamine, qui peut passer la barrière hémato-encéphalique. Cette molécule est utilisée pour traiter les symptômes liés à la diminution de la dopamine dans le cerveau.
marche, des chutes, une dysphagie et des troubles de la parole. Des symptômes non-moteurs apparaissent aussi, avec des disfonctionnements de certaines fonctions du système nerveux autonome et une forme de démence qui, 20 ans après le déclanchement de la maladie, touche 83% des patients (Kalia and Lang, 2015).
Les causes exactes de l’apparition de la maladie sont mal connues. Néanmoins, l’âge reste le premier facteur de risque de la maladie de Parkinson. La fréquence d’apparition de cette maladie augmente exponentiellement avec l’âge pour atteindre un pic à 80 ans (Driver et al., 2009). Il existe aussi des facteurs de risques environnementaux auxquels le patient aurait été exposé durant son existence. Une méta-analyse a identifié 11 facteurs environnementaux qui altèrent le risque d’apparition de la maladie de Parkinson. Parmi eux, les pesticides et les traumatismes crâniens augmentent ce risque, alors que le tabac et le café semblent être des facteurs protecteurs (Noyce et al., 2012).
Il y a aussi une susceptibilité génétique à la maladie de Parkinson, suggérée par l’augmentation du risque de son apparition chez des personnes avec un historique familial de la maladie. A ce jour, 24 variantes génétiques associées à la maladie ont été identifiées grâce à une méta-analyse d’études d'association pangénomique (Nalls et al., 2014). Parmi ces gènes on trouve le gène de l’α-synucléine, le gène LRRK-2 (leucine-rich repeat kinase 2) ou encore le gène de la glucocérébrosidase (GBA), tous les trois responsables de formes familiales monogéniques de la maladie de Parkinson.
Toutefois, l’incidence de ces formes familiales n’est que de 10% et la plupart des cas restent sporadiques. Le risque de développer la maladie de Parkinson est donc clairement multifactoriel, mais l’interaction entre les différents facteurs, environnementaux et génétiques, reste méconnue, et fait l’objet aujourd’hui d’une attention particulière.
B. Pathologie de la maladie de Parkinson
Parmi les traits pathologiques communs aux patients atteints de la maladie de Parkinson, on trouve la perte des neurones dopaminergiques de la SNpc. Cette dégénérescence contribue à la
baisse de la dopamine dans le striatum et provoque un déséquilibre dans le circuit des ganglions de la base qui mène à l’émergence des symptômes moteurs caractéristiques. La région la plus affectée de la SNpc est la zone ventro-latérale, qui contient les neurones qui projettent vers la partie dorsal du putamen (Dickson et al., 2009).
Les corps de Lewy constituent un autre marqueur de la maladie de Parkinson. Il s’agit d’agrégats anormaux de protéines qui se forment dans les neurones dopaminergiques. Des agrégats semblables sont présents dans plusieurs maladies neurodégénératives et sont classifiés selon la protéine majoritaire qui les compose. Dans le cas de la maladie de Parkinson, ces agrégats ont été identifiés comme composés majoritairement par l’α-synucléine (Spillantini et al., 1997). Durant les deux dernières décennies, la détection de corps de Lewy dans d’autres régions que la substance noire a permis la formulation d’hypothèses pour expliquer les symptômes non-moteurs qui accompagnent les symptômes moteurs caractéristiques chez les patients. En effet, l’autopsie,démontre une progression chronologique des lésions synucléinopathiques qui touchent en premier lieu des régions non dopaminergiques, comme par exemple le noyau olfactif antérieur, les noyaux sérotoninergiques du raphé ou le complexe noradrénergique du locus cœruleus, et qui se propagent par la suite vers les noyaux dopaminergiques du mésencéphale (Braak et al., 2003). Ces premières lésions qui touchent des régions extranigral pourraient être à l’origine des symptômes pré-parkinsoniens, à l’image des troubles de sommeil et la perte d’odorat, qui peuvent survenir plusieurs années avant l’apparition des symptômes moteurs (Wolters, 2009).
L’inflammation est un autre marqueur de la maladie de Parkinson. Il a été démontré que chez les patients des phénomènes de neuro-inflammation prennent place dans les régions qui dégénèrent (Tansey and Goldberg, 2010). Il s’agit d’une réponse inflammatoire locale induite par des astrocytes et des microglies qui participent au nettoyage des débris extracellulaires. Dans ce processus, les microglies secrètent une multitude de facteurs trophiques bénéfiques, mais aussi des facteurs cytotoxiques et des molécules pro-inflammatoires. Les recherches actuelles sur cet aspect tentent de déterminer si l’équilibre de ces actions est bénéfique ou toxique pour les neurones dopaminergiques.
C. Mécanismes de la maladie de Parkinson 1. Mécanismes liés aux gènes de la maladie de Parkinson
Dans les formes familiales ou sporadiques de la maladie de Parkinson, les mêmes phénotypes de dégénérescence sont observés, suggérant que les mécanismes impliqués ont une origine commune. Depuis la découverte des formes familiales monogéniques de la maladie, beaucoup d’efforts ont été entrepris pour comprendre les fonctions de ces gènes au sein des processus intracellulaires normaux. Le Tableau 1 dénombre les processus cellulaires impliqués dans la pathogénèse de la maladie de Parkinson, grâce à l’étude des gènes et des polymorphismes identifiés chez les patients.
Tableau 1. Processus cellulaires impliqués dans la pathologie de la maladie de Parkinson
(adapté depuis Kalia and Lang, 2015).
Parmi ces processus, l’agrégation des protéines, le transport protéique et membranaire, et la dégradation des protéines par les systèmes ubiquitine-protéasome et lysosome/autophagie semblent indiquer un disfonctionnement dans l’homéostasie protéique de la cellule. Ces études ont aussi permis de confirmer l’importance du disfonctionnement mitochondrial, précédemment étudié dans les modèles cytotoxiques de la maladie de Parkinson.
Processus cellulaires Gènes associés Références
Agrégation des protéines SNCA, MAPT (Ross and Poirier, 2004) Trafic membranaire et protéique VPS35!, DNAJC13 (REM-8) LRRK2!, GAK!, RAB7L1!, RAB39B (Trinh and Farrer, 2013) Structure des nurites LRRK2, MAPT (tau) (MacLeod et al., 2006) Propagation prion-like SNCA (α-synucléine) (Brundin et al., 2010) Système ubiquitine-protéasome Parkin!, FBXO7, !SCA3 (ataxin-3) (McNaught et al., 2001) Fonction mitochondriale et mitophagie Parkin, CHCHD2, PINK1 POLG1, DJ-1, SREBF1 (Ryan et al., 2015) Voie du lysosome-autophagie LRRK2!, VPS35!, DNAJC13 (REM-8), ATP13A2, !GBA!, SCARB2 (LIMP-2) (Pan et al., 2008) Fonction synaptique et neurotransmission de
la dopamine SNCA (α-synucléine), LRRK2!, SYNJ1 (synaptojanin 1), GCH1, STX1B (syntaxin-1B)
(Lotharius and Brundin, 2002)
2. Stress oxydatif
Les processus cellulaires mentionnés plus haut ont été étudiés après l’identification de gènes mutés dans les formes familiales de la maladie de Parkinson. En dehors de ces processus, il y a peu de fonctions cellulaires étudiées dans la maladie qui n’ont pas de précédent génétique. En effet, l’approche classique pour le développement de thérapies basées sur des mécanismes revient à identifier préalablement un locus, trouver un gène, comprendre la pathologie et ensuite développer un traitement qui ciblerait la voie identifiée (Singleton and Hardy, 2016).
Avant « l’ère génétique », le stress oxydatif faisait partie de ces phénomènes observés en premier lieu dans des études post mortem. La notion de stress oxydatif implique un déséquilibre entre la présence des radicaux libres cytotoxiques et la capacité de la cellule à réduire ces éléments ou à réparer les dommages qui en découlent. Dans les neurones dopaminergiques, l’origine du stress oxydatif est liée principalement aux altérations du métabolisme de la dopamine, dont l’oxydation de ce neuromédiateur (Zucca et al., 2013), à une accumulation de fer dans les cellules (Sian-Hülsmann et al., 2011) et à un disfonctionnement de la chaîne de transport d'électrons de la mitochondrie (Schapira, 2008).
L’idée que l’augmentation du stress oxydatif peut être à l’origine de la dégénérescence des neurones dopaminergiques est controversée. Même si la découverte de toxines générant un stress oxydatif et tuant spécifiquement les neurones dopaminergique conforte cette idée. L’utilisation de la 6-hydroxydopamine5 (6-OHDA) induit la mort sélective des neurones dopaminergiques via un
mécanisme qui augmente les radicaux libres (Cohen et al., 1974). Le 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine (MPTP)/MPP+, similairement à la 6-OHDA, induit une mort apoptotique des cellules, par blocage du complexe I de la chaîne de transport d'électrons de la mitochondrie (Burns et al., 1983).
Cependant, la présence du stress oxydatif de façon globale dans le cerveau, pose la question de la sélectivité de la mort des neurones dopaminergique dans la maladie de Parkinson. Il en ressort que s’il existe bien une sensibilité accrue de ces neurones au stress, le mécanisme par lequel le
5 La 6-OHDA est un composé organique neurotoxique qui entre sélectivement dans les neurones dopaminergiques via le transporteur de monoamine et provoque la mort de ces neurones.
stress oxydatif provoque cette dégénérescence demeure incompris. L’arborisation axonale des neurones dopaminergiques étant parmi les plus développées dans le cerveau, il se peut que cette caractéristique morphologique soit associée à une activité mitochondriale élevée productrice, certes d’ATP, mais aussi de radicaux libres (Pacelli et al., 2015).
IV. Instabilité génomique et éléments transposables A. Instabilité génomique liée au stress oxydatif
L’instabilité génomique est une piste de plus en plus étudiée dans le domaine des maladies neurodégénératives.
Pendant longtemps, les études sur le comportement de l’ADN ont été négligées dans le cerveau, à cause de la nature post-mitotique des neurones et donc, pour ces cellules, d’un niveau faible de synthèse, voire de réplication, de l’ADN. Durant les deux dernières décennies, l’amélioration des connaissances sur les maladies neurodégénératives et la susceptibilité importante du cerveau au stress oxydatif ont considérablement attiré l’attention sur la compréhension des voies de réparation de l’ADN et de l’instabilité génomique.
L’instabilité génomique se réfère à une fréquence importante de mutations dans le génome de la cellule. Ces mutations peuvent inclure par exemple des modifications de séquences ou des réarrangements chromosomiques. Dans le cerveau, un neurone peut subir environ 50 000 évènements de ce type chaque jour (Rao, 2007). Maintenir une intégrité génomique est donc fondamental pour la survie de l’organisme. C’est dans ce sens que la cellule est équipée d’un système de réparation active de l’ADN. Selon le type de dommage de l’ADN qu’une cellule subit, différentes voies de réparation peuvent être engagées. Les modifications survenues sur les bases nucléiques sont généralement réparées avec un mécanisme d’excision qui enlève quelques nucléotides sur un petit fragment via la voie de réparation par excision de base (BER), ou sur un fragment plus long via la réparation par excision de nucléotide (NER). Les cassures simple brin sont réparées par dégradation partielle et copie du brin intact. Dans le cas de cassure double brin,
il existe deux voies majeures de réparation : la réparation par jonction d'extrémités non homologues (NHEJ) et la réparation par recombinaison homologue (RH), plus rare dans le cerveau adulte car elle nécessite une division cellulaire (McKinnon, 2009).
La réparation par RH recrute une machinerie protéique capable de remplacer les bases nucléotidiques touchées à l’identique de la séquence originale. En revanche la réparation par NHEJ n’étant pas parfaite, des « erreurs » de réparation peuvent survenir, provoquant des mutations irréversibles (Chow and Herrup, 2015). Dans le système nerveux central adulte, un défaut de réparation causé par une mutation dans le gène d’une protéine impliquée dans un processus de réparation peut être à l’origine de maladies neurodégénératives. Un exemple de cela est le gène Ataxia Telangiectasia Mutated (ATM) qui, muté, provoque la maladie Ataxie télangiectasie (Savitsky et al., 1995).
Dans la maladie de Parkinson, le stress oxydatif détecté provoque des dommages importants dans les lipides, les protéines et l’ADN (Alam et al., 1997a, 1997b; Dexter et al., 1994). Dans cette dernière étude, les auteurs ont trouvé une augmentation des dommages dans l’ADN en mesurant le niveau du 8-Hydroxyguanosine, chez les patients atteints de Parkinson. Cette modification est une oxydation de la guanosine, considérée comme biomarqueur du stress oxydatif, et sa réparation est prise en charge par la voie BER de réparation de l’ADN.
Deux possibilités ont été invoquées pour expliquer ce phénotype. La première est qu’il y a une altération dans la machinerie de réparation de l’ADN qui empêche une réparation efficace. Parmi les quelques exemples qui vont dans ce sens, il y a celui de la protéine Ogg1 qui participe à la réparation de l’ADN au sein de la voie BER. Sa mutation chez la souris (Ogg1-/-) provoque une dégénérescence des neurones dopaminergiques de la SNpc et une sensibilité accrue au MPTP/MPP+ (Cardozo-Pelaez et al., 2012). Un phénotype similaire de dégénérescence des neurones dopaminergiques est aussi observé chez des souris mutées pour le gène Atm (Atm-/-). La protéine Atm est impliquée dans plusieurs processus cellulaires avec un rôle prédominant dans la réparation des cassures double brin de l’ADN.
L’autre explication serait que les dommages dans l’ADN sont si importants que les systèmes de réparation de la cellule ne peuvent pas y faire face, même sans altération dans leur efficacité (via des mutations, etc). Ce déséquilibre entre dommage et réparation conduit à une accumulation progressive de ces dommages dans les neurones dopaminergiques. Cette idée est d’autant plus intéressante, qu’elle s’inscrit dans un phénomène qui se produit dans la durée. L’âge étant le premier facteur de risque pour la maladie de Parkinson, il n’est pas impossible d’imaginer une accumulation progressive de ces dommages due à une détérioration de l’efficacité des processus qui veillent à l’intégrité génomique. Cet aspect fait déjà l’objet de plusieurs publications, pas seulement dans la maladie de Parkinson, mais dans la plupart des maladies neurodégénératives (Chow and Herrup, 2015). Il sera traité plus en profondeur dans la discussion de cette thèse.
B. LINE-1 comme famille active d’éléments transposables
Les éléments transposables ou « gènes sauteurs » sont des séquences génomiques répétées à plusieurs endroits sur les différents chromosomes, et qui couvrent environ 45% du génome humain (Lander et al., 2001). Historiquement considérés comme de « l’ADN poubelle », ce n’est qu’avec le séquençage du génome et les études de génétique moléculaire et de génomique fonctionnelle que ces éléments se sont révélés d’une grande importance biologique au sein du génome des mammifères. Les éléments transposables sont classés selon le mécanisme qui leur permet de bouger, soit par un intermédiaire ADN (transposon) ou un intermédiaire ARN (rétrotransposon). Les rétrotransposons représentent la classe la plus importante dans le génomes des mammifères (Boeke et al., 1985).
Avec la pression négative de sélection au cours de l’évolution, la pluparts de ces éléments transposables ont perdu, à la suite de mutations, cette capacité de bouger. Parmi ces éléments, on trouve les longs éléments nucléaires intercalés-1 (LINE-1). Ce sont des rétrotransposons qui amplifient le génome des mammifères depuis 160 million d’années et couvrent de nos jours 17% du génome humain (Feschotte, 2008). Nombre d’entre eux sont « fossilisés », mais certains demeurent toujours actifs, et participent à la diversité des génomes. Il est estimé que chez l’homme approximativement 80 à 100 LINE-1 sont actifs et compétents pour la rétrotransposition.
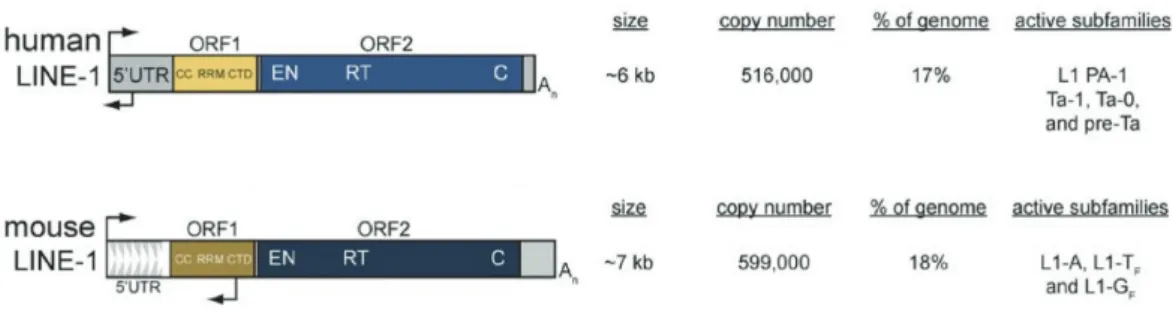
Structurellement, les LINE-1 actifs font environ 6000 paires de bases (6 kb) de long (Figure 6). Ils contiennent une région 5’UTR qui inclue deux promoteurs (sens et antisens) de la RNA-Polymérase II (Pol-II), suivie par deux phases ouvertes de lecture (open reading frame ou ORF), ORF1 et ORF2, et une région 3’UTR qui se termine avec une queue polyA (Dombroski et al., 1991). L’ORF1 humain code pour la protéine de 40 kDa ORF1p, qui peut se lier à l’ARN (RNA binding protein) et présente une activité de protéine chaperon (Martin and Bushman, 2001). ORF2 code pour la protéine ORF2p qui fait 150 kDa, et qui présente une double activité d’endonucléase et de transcriptase inverse (Feng et al., 1996; Mathias et al., 1991).
Chez la souris, les LINE-1 couvrent environ 18% du génome et sont en majorité tronqués. Environ 3000 éléments semblent actifs (Goodier et al., 2001). Et à la différence de l’homme, leur séquence 5’UTR contient une série de répétition (Furano, 2000). Ils peuvent être classés structurellement dans 5 sous-familles (A, Tf, Gf, F et V), qui diffèrent entre elles par le nombre et la nature de ces répétitions au sein du 5’UTR (Sookdeo et al., 2013). Les LINE-1 des sous-familles A, Tf et Gf sont considérés comme étant les seuls capables de rétrotransposition.
Figure 6. Structure des éléments transposables LINE-1 chez l’homme et la souris
La structure des LINE-1 se compose d’une région 5’UTR non traduite, deux promoteurs internes sens et anti-sens ainsi que deux phases ouverte (ORF), codant pour deux protéines ORF1p et ORF2p. Chaque séquence est listée avec sa taille, le nombre de copies dans le génomes, pourcentage du génome couvert et les sous-familles (adaptée depuis Garcia-Perez et al., 2015).
C. Mécanisme de rétrotransposition et instabilité du génome
Les LINE-1 rétrotransposent via un mécanisme de « copier-coller ». Après la transcription de l’ARN messager polycistronique, celui-ci quitte le noyau vers le cytoplasme pour sa traduction. Les protéines ORF1p et ORF2p vont se lier entre elles et avec leur ARN messager (ARNm), formant un complexe protéines-ARN ou une ribonucléoprotéine (RNP). Cette RNP entre dans le noyau via un mécanisme non encore élucidé. ORF2p avec sa fonction endonucléase, induit une cassure simple brin dans l’ADN d’une séquence consensus (Cost et al., 2002), et permet via sa fonction de transcription inverse de synthétiser à partir de l’ARNm, une copie ADNc du LINE-1 qui sera insérée au site de la cassure.
Du fait que la transcription inverse ne va pas jusqu’au bout, la plupart des phénomènes d’insertion se terminent par des séquences LINE-1 mutés ou tronquées (Gilbert et al., 2005). Ces séquences nouvellement insérées dans le génomes, qu’elles soient complètes (actives) ou non, induisent une instabilité génomique. Les insertions des LINE-1 peuvent se produire dans des exons, menant à des mutations des gènes en question (Kazazian et al., 1988). De la même façon, l’insertion dans des introns peut induire des erreurs d’épissage, ou des sauts d’exons (Belancio et al., 2008). La présence de promoteurs reconnus par la Pol-II dans la région 5’UTR peut aussi altérer l’expression des gènes aux alentours (Kim et al., 2015). Enfin, l’activité endonucléase de ORF2p peut causer des cassures double brin dans l’ADN, ce qui a été démontré dans plusieurs travaux, suggérant un rôle délétère des LINE-1, indépendant de leur insertion (Gasior et al., 2006; Lin et al., 2009).
D. Expression des LINE-1 dans le cerveau
Longtemps considéré comme spécifique des cellules germinales, l’expression et la rétrotransposition des LINE-1 a depuis été observée dans le cerveau (Muotri et al., 2005). Chez l’homme, dans une étude sur des tissues post mortem, le niveau de rétrotransposition est plus important dans l’hippocampe que dans le foie ou le cœur (Coufal et al., 2009). La question de savoir si cette rétrotransposition a une signification biologique, physiologique ou pathologique, demeure ouverte. Quelques travaux suggèrent qu’elle peut contribuer au mosaïcisme somatique dans le cerveau (Baillie et al., 2011). En pathologie, les LINE-1 semblent être impliqués dans des
maladies neurologiques comme le syndrome de Rett (Muotri et al., 2010), l’Ataxia telangiectasia (Coufal et al., 2011) ou la Schizophrénie (Bundo et al., 2014).
E. Mécanismes de défense
Pour lutter contre les effets délétères des LINE-1, la cellule a développé plusieurs mécanismes pour restreindre leur activité. Nous allons en mentionner deux parmi ceux qui ont été décrits à ce jour.
La méthylation des îlots CpG est un mécanisme qui régule l’expression des gènes. Dans le cas des LINE-1, la forte méthylation de la région 5’UTR riche en CpG est associée à l’inhibition de leur expression dans une variété de cellules (Yoder et al., 1997). A cette méthylation, s’ajoute un autre niveau de répression qui implique des changements de l’état de la chromatine vers un état plus condensé appelé hétérochromatine (Garcia-Perez et al., 2010). L’activité transcriptionnelle de l’hétérochromatine est faible à cause de son accessibilité réduite aux complexes de transcription (Saksouk et al., 2015). Son association avec les LINE-1 semble correspondre à un mécanisme de répression de ces derniers. Il y a deux types d’hétérochromatine qui contiennent des méthylations spécifiques au niveau des histones H3. La méthylation concerne soit la lysine 9 (H3k9me3) pour les chromocentres, soit la lysine 27 (H3k27me3) pour l’hétérochromatine peri-nucléaire et péri-nucléolaire (Bártová et al., 2008). Les éléments répétitifs sont souvent trouvés dans l’hétérochromatine marquée par H3k9me3 (Pauler et al., 2009).
Un autre mécanisme implique les protéines P-element induced wimpy testes (PIWI) qui appartiennent à la famille des protéines argonautes, capables de s’associer avec des petits ARN interférents. Ces ARN, qui se lient à PIWI, sont longs de 24-31 nucléotides et sont appelés ARN interagissant avec Piwi (ARNpi ou piRNA) (Siomi et al., 2011). Chez la drosophile, les piRNA, initialement générés à partir de transposons, se lient à PIWI et servent de guide pour cliver le transcrit des transposons actifs dans les cellules germinales (Malone et al., 2009). Ce mécanisme confère à la cellule un système robuste pour lutter contre les transposons, et semble être conservé chez les mammifères. Chez la souris deux protéines Piwi murin (MIWI2) et Miwi-like (MILI) participent à la défense contre les transposons dans les cellules germinales. MIWI2, guidé par les piRNA, semble participer à la méthylation des séquence de rétrotransposons (Aravin et al., 2008;
Carmell et al., 2007). L’activité transcriptionnelle du promoteur antisens dans le 5’UTR des LINE-1 pourrait aussi former un complexe avec le messager sens pour générer des petits ARN qui vont servir à dégrader les transcrits LINE-1 (Yang and Kazazian, 2006).
V. Engrailed dans la physiopathologie des neurones dopaminergiques adultes A. Phénotype de la souris hétérozygotes En1
+/-Le rôle dose-dépendant d’Engrailed dans la survie et le maintien des neurones dopaminergiques mésencéphaliques durant le développement continue après la naissance. En1 reste en effet exprimé dans les neurones de la SNpc et de l’ATV chez la souris adulte (Sonnier et al., 2007). A ce jour, EN1 n’est pas considéré comme un gène de la maladie de Parkinson. Toutefois, une étude des variations polymorphiques chez des patients atteints de la maladie, a montré une association entre le gène EN1 et certaines formes sporadiques de la maladie de Parkinson (Haubenberger et al., 2011).
Chez la souris, la délétion d’un seul allèle d’En1 (souris En1-/+ ; En2+/+) provoque une dégénérescence progressive et spécifique des neurones dopaminergiques de la SNpc et de l’ATV (Sonnier et al., 2007). Dans la SNpc, cette perte commence à partir de la 6ème semaines après la
naissance, et continue jusqu’à 24 semaines où elle se stabilise autour de 38% de différence en nombre de neurones TH+ par rapport aux souris sauvages (wt) (Figure 7). Dans l’ATV, la mort n’atteint que 23% chez des souris âgées de 48 semaines. Cette diminution est accompagnée d’une réduction des quantités de dopamine dans le striatum, ainsi que de symptômes moteurs et non-moteurs, caractéristiques d’une altération des voies nigrostriée et mésolimbique, respectivement (Sonnier et al., 2007) (Figure 8).
La mort progressive et la vulnérabilité accrue des neurones de la SNpc par rapport à ceux de l’ATV ainsi que les symptômes moteurs et non-moteurs observés chez les souris En1-/+ constituent autant de traits de la maladie de Parkinson chez les humains. Durant les dernières années, plusieurs modèles animaux utilisant des gènes liés à cette maladie ont été générés. Toutefois, les souris En1-/+ sont parmi les seules à avoir autant de caractéristiques communes
avec la maladie, ce qui fait de ces souris un bon modèle pour étudier plusieurs aspects de la pathologie de la maladie de Parkinson.
Figure 7. Dégénérescence progressive des neurones dopaminergiques chez la souris En1
+/-La quantification du nombre de neurones TH+ dans la SNpc et la VTA chez la souris En1+/- montre une perte
progressive des neurones dopaminergiques qui commence autour de la 6ème semaine. La perte est plus importante
dans la SNpc de ces souris en comparaison avec la VTA (adaptée depuis Sonnier et al., 2007).
Figure 8. La souris En1+/- présente des symptômes moteurs et non-moteurs comparables à ceux de la maladie
de Parkinson
Une caractérisation plus approfondie des souris En1-/+ a révélé une dégénérescence des axones des neurones dopaminergiques dans le striatum (Nordström et al., 2015). Cette dégénérescence est accompagnée par une diminution de l’autophagie et une augmentation de l’activité de la voie mammalian target of rapamycin (mTOR), menant à une dégénérescence rétrograde des corps cellulaires dans la SNpc, aussi observée dans la maladie de Parkinson (Cheng et al., 2010). L’importance d’Engrailed dans le guidage axonale a déjà été démontrée (Brunet et al., 2005), suggérant un rôle d’Engrailed dans le maintien des connexions axonales des neurones dopaminergiques dans le striatum (Yoon et al., 2012).
B. Effet neuroprotecteur d’Engrailed
La capacité de transduction de l’homéoprotéine Engrailed a été utilisée dans le contexte de dégénérescence des neurones dopaminergiques. Chez la souris En1-/+ , l’infusion de la protéine recombinante En2 dans la SNpc à 6 semaines stoppe la perte des neurones dopaminergiques observée chez ce mutant (Sonnier et al., 2007). Dans une autre étude, le laboratoire a montré que la transduction d’En1 ou En2 protège les neurones dopaminergiques dans des modèles toxiques de la maladie de Parkinson (MPTP, Roténone, 6-OHDA et l’α-synucléine mutée) in vivo et in vitro (Alvarez-Fischer et al., 2011). Dans le modèle MPTP/MPP+, un inhibiteur du complexe I mitochondrial, En1 semble augmenter la traduction des transcrits des sous-unités Ndufs1 et Ndufs3 de ce complexe, et donc augmenter son activité (Alvarez-Fischer et al., 2011).
Les activités de survie et de neuroprotection d’Engrailed impliquent plusieurs mécanismes. En plus d’être un facteur de transcription, Engrailed régule aussi la traduction via son interaction avec le facteur d’initiation de la traduction eIF4E. Cette capacité est d’ailleurs partagée avec d’autres homéoprotéines (Topisirovic and Borden, 2005). Ce double potentiel régulateur d’Engrailed lui confère une importance particulière dans la physiologie des neurones dopaminergiques. Son implication déjà démontrée dans l’activité mitochondriale et la maintenance axonale chez l’adulte n’exclue pas la possibilité qu’Engrailed régule d’autres fonctions cellulaires.
Le but de ce travail de thèse est de comprendre les mécanismes d’action d’Engrailed dans les neurones dopaminergiques mésencéphaliques. En partant du phénotype des souris En1+/-, nous avons établi un lien entre Engrailed et le stress oxydatif, et identifié une régulation transcriptionnelle par Engrailed de gènes liés à la modification de la structure de la chromatine et de la réparation de l’ADN. Nous avons ensuite affiné ce lien en formulant et validant l’hypothèse que Engrailed régule l’expression des LINE-1 et atténue les effets délétères de ces derniers sur la stabilité du génome. En tout, ce travail saura, je l’espère, convaincre de l’importance de l’homéoprotéine Engrailed dans la physiologie des neurones dopaminergiques, et de l’utilité de l’envisager, en prenant avantage de sa capacité de transduction, comme agent thérapeutique dans la maladie de Parkinson.
Article 1 - Engrailed Homeoprotein Protects
Mesencephalic Dopaminergic Neurons from Oxidative
Stress
Dans ce premier travail, nous avons étudié le lien entre Engrailed et le stress oxydatif dans les neurones dopaminergiques adultes du mésencéphale. La souris hétérozygote pour En1 (En1+/-) présente une dégénérescence progressive des neurones dopaminergiques de la SNpc et de la VTA qui commence vers 6 semaines. A cet âge là, nous avons effectué une analyse du transcriptome de la souris En1+/-, et observé une altération de l’expression de gènes impliqués dans le remodelage de la chromatine et la réparation de l’ADN. Après avoir validé la présence d’une instabilité génomique dans ces neurones, nous avons montré que ces mêmes altérations sont présentes dans un modèle de stress oxydatif important (6-OHDA) et que, dans ces conditions, les neurones dopaminergiques de la souris En1+/- sont davantage sensibles à la mort neuronale. Dans le modèle 6-OHDA, l’injection de la protéine recombinante Engrailed2 dans la SNpc sauve d’abord les neurones dopaminergiques, via l’induction de l’expression de gènes anti-apoptotiques. Dans un second temps, Engrailed2 permet de restaurer les marques de l’hétérochromatine et de réparer les dommages dans l’ADN, validant ainsi le rôle important d’Engrailed dans la stabilité génomique des neurones dopaminergiques.