Développement et pré-test d’un plan de soins de suivi pour des femmes
atteintes du cancer de l’endomètre avec traitements adjuvants lors de la
transition de la fin du traitement actif vers la survie au cancer
Thèse
Johanne Hébert
Doctorat en sciences infirmières
Philosophiæ doctor (Ph.D.)
Québec, Canada
Développement et pré-test d’un plan de soins de suivi pour des femmes
atteintes du cancer de l’endomètre avec traitements adjuvants lors de la
transition de la fin du traitement actif vers la survie au cancer
Thèse
Johanne Hébert
Sous la direction de :
iii
Résumé
La fin du traitement actif et le début de la phase de survie correspondent à une période de transition qui présente de nombreux défis pour la personne survivante au cancer, les soignants et le système de santé. La phase de survie au cancer est une phase distincte mais négligée du continuum de soins. Pour faciliter la transition de la fin du traitement actif vers la survie et optimiser la coordination des soins de suivi, la mise en place d’un plan de soins de suivi (PSS) est proposée. Le but de cette recherche est de développer, de mettre en place et d’évaluer si un plan de soins de suivi (PSS) permet de répondre aux besoins globaux, de diminuer la détresse émotionnelle et de favoriser les comportements d’autogestion de santé de femmes atteintes du cancer de l’endomètre (FACE) lors de la transition de la fin du traitement actif vers la survie au cancer. Elle comprend deux phases distinctes.
La première phase visait d’abord le développement d’un plan de soins de suivi (PSS) pour des femmes atteintes du cancer de l’endomètre avec traitements adjuvants. La sélection du contenu du PSS a été faite à partir de la recension des écrits et des données recueillies lors d’entrevues individuelles avec 19 FACE, 24 professionnels de la santé travaillant avec cette clientèle et quatre gestionnaires de proximité en oncologie. Cette première phase avait également pour but la validation du contenu du PSS auprès de dix professionnels de la santé impliqués dans l’étude.
La seconde phase consistait à évaluer la faisabilité, l’acceptabilité du PSS et à en pré-tester l’utilité à répondre aux besoins globaux, à diminuer la détresse émotionnelle (peur de la récidive) et à favoriser l’autogestion de santé auprès d’un groupe de 18 femmes atteintes du cancer de l’endomètre avec traitements adjuvants à la fin du traitement actif vers la survie. Sur le plan de la faisabilité, les résultats suggèrent que la mise en place du PSS comporte des défis en termes de temps, de ressources et de coordination pour l’infirmière pivot en oncologie (IPO). Concernant l’acceptabilité du PSS, les FACE le perçoivent comme un outil d’information utile qui favorise la communication avec le médecin de famille ou d’autres professionnels de la santé. Les IPO soutiennent sa valeur ajoutée à la fin du traitement et soulignent que la discussion du contenu du PSS fait ressortir des éléments de surveillance et
iv
de suivi essentiels à prendre en compte pour la phase de survie et permet de mettre l’emphase sur l’autogestion de sa santé.
Pour les médecins de famille, le PSS est un outil d’information pour les survivantes qui favorise la réassurance, la communication et la continuité des soins entre professionnels de la santé. Enfin, pour ce qui est de l’utilité du PSS à répondre aux besoins globaux, les résultats suggèrent que l’ensemble des besoins sont plus satisfaits trois mois après la fin des traitements pour le groupe ayant reçu un PSS. Bien que la peur de récidive du cancer (PRC) s’améliore au suivi de trois mois pour le groupe exposé au PSS, 55% des FACE conservent un score cliniquement significatif de 13 à la sous-échelle de sévérité de peur de récidive à la fin du traitement et 42% au suivi de trois mois. Les comportements d’autogestion de santé s’améliorent entre la fin du traitement et le suivi de trois mois pour le groupe exposé un PSS. Considérant ces résultats, la démarche soutient la pertinence de mettre en place un PSS à la fin du traitement actif pour les FACE pour répondre à des besoins d’information, favoriser la communication et la continuité des soins avec les professionnels de la santé et les comportements d’autogestion de santé dans la phase de survie. Cependant, des contraintes de temps, de ressources et de coordination doivent être prises en compte pour sa mise en place dans le milieu clinique.
Mots-clés : Transition, fin du traitement actif, besoins, survie au cancer, plan de soins de
suivi.v
Abstract
The end of active treatment and the beginning of survivorship correspond to a period of transition which presents many challenges for cancer survivors, caregivers and the health care system. The cancer survivorship phase (that follows primary treatment) is a distinct phase but overlooked in the continuum of care. To facilitate the transition from the end of active treatment to survivorship and optimize the coordination of follow-up care, the implementation of a survivorship care plan is proposed. The purpose of this research is to develop, implement and evaluate whether a survivorship care plan (SCP) meets global needs, reduce emotional distress (fear of cancer recurrence) and promote the empowerment of women with endometrial cancer during the transition from the end of active treatment to survivorship. The research consists of two distinct phases.
The first phase was to develop a survivorship care plan (SCP) for women with endometrial cancer and adjuvant treatments. The content of the SCP was selected from the literature review and data collected during interviews with 19 women with endometrial cancer, 24 health professionals working with this population and four managers dedicated to oncology. This first phase included the validation of the SCP by ten health professionals involved in the study.
The second phase was to evaluate the feasibility, the acceptability of the SCP and pre-test its use to meet global needs, reduce emotional distress (fear of recurrence) and promote empowerment for 18 women with endometrial cancer and adjuvant treatments at the end of the active treatment towards survivorship. In terms of feasibility, the results suggest that the implementation of the SCP has challenges in terms of time, resources and coordination for the oncology nurse navigators. Regarding the acceptability of the SCP, the women perceived it as a tool with useful information that facilitates communication with the family doctor or other health professionals. The nurse navigators support its value added at the end of treatment and acknowledge that the discussion involved with the SCP highlights essential elements of monitoring and follow-up to take into account in survivorship and allows the emphasis on health self-management.
vi
For family doctors, the SCP is a tool with information for survivors that promotes reassurance, communication and continuity of care between health professionals. Finally, with regard to the usefulness of the SCP to meet global needs, the results suggest that all the needs are more satisfied at three-month follow-up for the group receiving the SCP. Although the fear of cancer recurrence decreases at the three-month follow-up for the group with SCP, 55% of women maintained a clinically significant score of 13 on severity subscale of fear of cancer recurrence at the end of treatment and 42% at three-month follow-up. Health self-management behaviors (empowerment) improved between the end of treatment and the three-month follow-up for the group receiving a SCP.
Considering these results, the approach supports the relevance of implementing a survivorship care plan at the end of active treatment for women with endometrial cancer to fulfill information needs, promote communication and continuity of care with health care professionals and promote health self-management behaviors in survivorship. However, constraints of time, resources and coordination must be taken into account for its implementation in the clinical community.
Keywords: Transition, end of active treatment, needs, cancer survivorship, survivorship care plan.
vii
Table des matières
Résumé ... iii
Abstract ... v
Table des matières ... vii
LISTE DES TABLEAUX ... xii
LISTE DES FIGURES ... xiii
REMERCIEMENTS ... xv
Introduction ... 1
Chapitre 1 - Problématique ... 4
1.1 Le contexte de la survie au cancer ... 4
1.2 Les facteurs de risques associés à la survie au cancer et aux traitements ... 8
1.2.1 Les modalités de traitements. ... 8
1.2.2 Les comorbidités. ... 10
1.2.3 Les comportements de santé. ... 11
1.3 Les besoins des survivantes atteintes de cancers gynécologiques ... 13
1.3.1 Les besoins physiques. ... 13
1.3.2 Les besoins d’information. ... 15
1.3.3 Les besoins psychosociaux. ... 16
1.4 La fin du traitement actif vers la survie ... 18
1.4.1 Une période de transition. ... 18
1.4.2 Les modèles organisationnels de soins en survie au cancer. ... 19
1.4.3 L’infirmière et les soins de suivi en période de survie au cancer. ... 21
1.4.4 Le plan de soins de suivi (PSS) et l’équipe interdisciplinaire en oncologie. ... 22
1.5 La pertinence de l’étude ... 25
1.6 But et objectifs généraux de l’étude ... 26
Chapitre 2 - Recension des écrits ... 27
2.1 Développement du contenu et mise en place de plan de soins de suivi (PSS) ... 27
2.2 Évaluation de plans de soin de suivi (PSS) ... 38
2.3 Les études randomisées et l’utilité du PSS ... 44
Chapitre 3 – Cadre conceptuel ... 52
3.1 Les modèles conceptuels en sciences infirmières... 52
viii
3.2.1 Les concepts de la théorie. ... 54
3.2.1.1 La nature des transitions. ... 54
3.2.1.2 Les conditions de transition facilitantes et entravantes. ... 56
3.2.1.3 Les indicateurs de processus d’une transition saine. ... 57
3.2.1.4 Les indicateurs de résultat (empowerment ou autogestion de santé). ... 58
3.2.1.5 Les interventions infirmières. ... 59
3. 3 La théorie de la transition et la fin du traitement du cancer ... 60
3.3.1 Les interventions infirmières dans la phase de transition vers la survie. ... 60
3.4 Le cadre des soins de soutien Fitch (1994) ... 64
3.4.1 Les besoins de la personne atteinte de cancer à la fin du traitement. ... 64
3.4.2 L’évaluation cognitive. ... 66
3.4.3 Coping et adaptation. ... 67
3.4.4 Les soins de soutien. ... 68
3.5 Intégration des concepts de Meleis et de Fitch ... 71
3.6 Le modèle opérationnel de Patton (1997)... 73
3.7 Objectifs spécifiques et questions de recherche ... 75
3.6.1 Première phase : Développement d’un plan de soins de suivi (PSS). ... 75
3.6.2 Deuxième phase : Pré-test et évaluation du PSS auprès des acteurs clés. ... 76
Chapitre 4 – Cadre méthodologique ... 78
4.1 Devis de recherche de l’étude ... 78
4.2 Phase 1 de l’étude ... 79
4.2.1 Approches et devis. ... 79
4.2.2 Participants et critères d’inclusion. ... 80
4.2.3 Collecte des données. ... 81
4.2.3.1. Méthode de collecte des données qualitatives. ... 81
4.2.4 Procédure. ... 82
4.2.4.1 Étape 1. ... 82
4.2.4.2 Étape 2. ... 83
4.2.4.3 Étape 3. ... 84
4.2.5 Plan d’analyse des données. ... 85
ix
4.2.6 Résultats la phase 1 qui guident la phase 2. ... 88
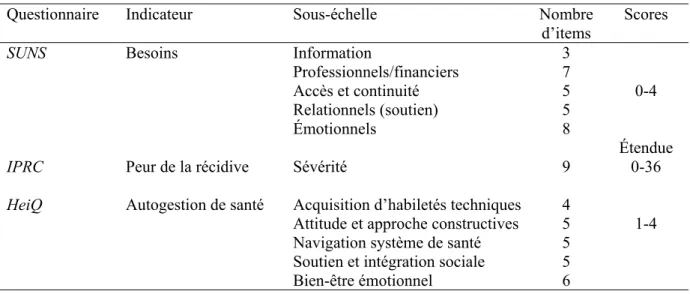
4.2.6.1 SUNS (Survivors Unmet Needs Survey, Campbell et al. 2011). ... 89
4.2.6.2 IPRC (Inventaire de la peur de la récidive du cancer, Simard & Savard, 2009). ... 90
4.2.6.3 HeiQ (Health Education Impact Questionnaire, Osborne et al., 2007). ... 90
4.3 Phase 2 de l’étude ... 92
4.3.1 Approches et devis. ... 92
4.3.2 Participants et critères d’inclusion. ... 93
4.3.3 Collecte des données. ... 93
4.3.3.1 Méthode de collecte de données qualitatives. ... 93
4.3.3.2 Méthode de collecte des données quantitatives. ... 95
4.3.4 Procédure. ... 95
4.3.4.1 Étape 1. ... 95
4.3.4.2 Étape 2. ... 96
4.3.5 Plan d’analyse des données. ... 96
4.3.5.1 Données qualitatives descriptives. ... 96
4.3.5.2 Données quantitatives descriptives. ... 98
4.3.6 Considérations éthiques (Phases 1 et 2). ... 101
Chapitre 5 – Résultats de la phase 1 ... 102
Avant-propos du chapitre 5 ... 102
Article 1 : Développement et validation d’un plan de soins de suivi (PSS) pour des femmes atteintes du cancer de l’endomètre lors de la transition de la fin du traitement actif vers la survie au cancer. ... 103
Introduction ... 105
Méthodologie ... 108
Analyses des données ... 111
Résultats ... 113
Les besoins exprimés par la clientèle ciblée ... 114
Perceptions des professionnels de la santé et gestionnaires de proximité... 116
Validation et présentation du PSS final ... 120
x
La prise en compte des besoins des FACE ... 121
La contribution des professionnels de santé ... 122
La précision du contenu et du format d’un PSS et le moment de remise ... 123
Les barrières anticipées à sa mise en œuvre ... 124
Références ... 126
Conclusion chapitre 5 ... 131
Chapitre 6 – Résultats de la phase 2 ... 134
Avant-propos du chapitre 6 ... 134
Article 2- Évaluation de la faisabilité, de l’acceptabilité et pré-test de l’utilité d’un plan de soins de suivi (PSS) auprès de femmes atteintes du cancer de l’endomètre lors de la transition de la fin du traitement actif vers la survie au cancer. ... 135
Introduction ... 137 Méthodologie ... 139 Devis et objectifs ... 139 Participants et procédure ... 140 Conditions d’exposition ... 141 Collecte de données ... 142
Plan d’analyse des données ... 143
Résultats ... 145
Échantillon des FACE et professionnels de la santé ... 145
Faisabilité de mettre en place un PSS à la fin du traitement ... 147
Acceptabilité du PSS ... 148 Discussion ... 153 Limites ... 156 Conclusion ... 156 Références ... 158 Conclusion du chapitre 6 ... 163 Conclusion générale ... 166 Références générales ... 170 Annexes ... 187
Annexe 1 – Documents de confirmation des articles soumis ... 188
Annexe 2 - Plan de soins de suivi (ASCO) ... 191
xi
Annexe 4 – Contenu d’un PSS selon l’IOM (2006) ... 204
Annexe 5 – PSS présentés lors des entrevues avec professionnels ... 205
Annexe 6 - Cahiers de codification et exercices de validation Phase 1 ... 210
Annexe 7 – Plan de soins de suivi (PSS) développé à la Phase 1 ... 233
Annexe 8 – Instruments de mesure Phases 1 et 2 ... 237
Annexe 9 – Lettre de présentation et questionnaire médecins de famille ... 252
xii
LISTE DES TABLEAUX
Tableau 1 - Conditions de transition facilitantes ou entravantes à la fin du traitement actif
... 56
Tableau 2 - Domaines de besoins (Fitch, 1994) ... 66
Tableau 3 - Besoins et normes de soins en phase de survie ... 70
Tableau 4 - Cadre opérationnel pour évaluer le processus de mise en œuvre du PSS .... 74
Tableau 5 - Collecte de données et groupes d’acteurs phase 1 ... 82
Tableau 6 - Cadre méthodologique des données qualitatives phase 1 ... 87
Tableau 7 - Questionnaires remis aux FACE phases 1 et 2... 89
Tableau 8 - Collecte de données et groupes d’acteurs phase 2 ... 94
Tableau 9 - Cadre méthodologique des données qualitatives phase 2 ... 97
ARTICLE 1 Tableau 1 - Concepts et indicateurs retenus pour élaborer le contenu du PSS ... 110
Tableau 2 - Caractéristiques socio démographiques et médicales des FACE ... 113
Tableau 3 - Cinq thèmes permettant de regrouper les besoins exprimés par les FACE ... 115
Tableau 4 - Thèmes et composantes émergeants des entrevues avec les professionnels de la santé et les gestionnaires de proximité... 118
ARTICLE 2 Tableau 1 - Cadres et concepts retenus pour guider la collecte, l’analyse et l’interprétation des données qualitatives ... 144
Tableau 2 - Comparaison des caractéristiques sociodémographiques et médicales des FACE en pourcentage de l’échantillon ... 146
Tableau 3 - Variation des indicateurs selon le groupe (témoin vs exposé) à chaque temps de mesure (T0 et T1) ... 152
xiii
LISTE DES FIGURES
Figure 1 - Théorie de la transition adaptée à la fin du traitement actif du cancer ... 60
Figure 2 - Intégration des concepts de Meleis et al., (2000) et Fitch, (1994) ... 72
Figure 3 - Illustration du devis séquentiel adapté de Creswell & Plano Clark (2011) ... 79
xiv
xv
REMERCIEMENTS
Tout comme le parcours d’une personne survivante au cancer, un projet de thèse est rempli de défis, de questionnements et de remises en question. Il faut de la persévérance et du soutien pour arriver au bout de la route. Je tiens à exprimer toute ma gratitude aux femmes atteintes du cancer de l’endomètre qui ont si gentiment accepté de participer à ce projet de recherche de même qu’aux membres de l’équipe interdisciplinaire qui ont cru au projet et m’ont accordé leur précieux temps. Une pensée spéciale pour mes deux IPO, Sophie et Nicole qui ont porté ce projet du début à la fin.
Je tiens tout d’abord à remercier très sincèrement ma directrice, Lise Fillion, sans qui cette thèse n’aurait pu se réaliser. Son soutien inconditionnel aux moments clés de ce long processus, sa capacité à transmettre ses connaissances de chercheure passionnée et chevronnée de même que la pertinence et la rigueur de ses innombrables commentaires m’ont permis de développer ce projet et de me donner le goût de faire de la recherche. Je retire de nombreux apprentissages et trois mots qui caractérisent chacun d’eux : rigueur, précision et cohérence.
Merci aux membres de mon comité de thèse, Michèle Aubin et Jean-François Desbiens pour leur présence et leurs judicieux commentaires tout au long de mon cheminement. Votre présence lors des comités de thèse a été un réel soutien et vos expertises respectives ont permis le cheminement de mon projet. Merci également à Christine Maheu, évaluatrice externe, d’avoir accepté d’évaluer cette thèse.
Je tiens à remercier les personnes qui m’ont aidé à développer le volet méthodologique de cette thèse, Anne-Marie Veillette, Claude-Julie Bourque, Andrée Sévigny et son équipe pour votre expertise lors de moments clés. Un merci du fond du cœur à ma précieuse statisticienne, Hélène Crépeau, pour sa patience et les nombreuses heures à m’expliquer et à travailler les données.
Je veux remercier mon collègue et ami précieux de doctorat, Daniel Milhomme, avec qui j’ai partagé les joies et les peines d’un parcours de doctorat lors de nos « lunchs d’étudiants ». Merci pour ton écoute et ta présence qui m’ont été d’un soutien inestimable tout au long de ce processus.
xvi
Merci à mes collègues de l’UQAR, Danielle, Isabelle, Emmanuelle, Dominique, Caroline et Nathalie qui m’ont si bien accueilli et soutenu durant les deux dernières années. Vos mots d’encouragements ont été appréciés et m’ont permis de persévérer. Vous êtes importantes pour moi. Un merci bien spécial à Lily Lessard, amie et collègue qui m’a accueillie plus souvent qu’à son tour dans son bureau pour répondre à mes innombrables questions pratiques et existentielles.
Je souhaite remercier les membres de ma famille, mes parents Diane et Bertrand qui m’appuient depuis toujours dans mes projets de même que mon frère Patrick et ma sœur Karine si importants dans ma vie. La famille procure un soutien tellement précieux pour garder l’équilibre ! À mes amis qui m’ont écouté raconter mon projet durant toutes ces années, je vous exprime toute ma reconnaissance, particulièrement à mon amie Renée pour son écoute indéfectible lors de nos « pauses-amitié ».
Le plus émotif des mercis est destiné aux deux amours de ma vie, Catherine et Alexandre pour votre patience et votre compréhension d’une mère encore aux études ! Vous êtes le plus beau cadeau que la vie m’ait offert et la raison qui me pousse à être une meilleure personne chaque jour. À mon amour Camille, sans qui ce projet n’aurait pu se réaliser. Ta présence, ta patience, ton soutien et ton amour inconditionnels m’ont donné la persévérance de continuer dans les moments difficiles.
Finalement, j’aimerais souligner l’appui financier de la Fondation de Recherche en Sciences Infirmières du Québec (FRESIQ), maintenant reconnue sous le nom de la Fondation de l’ordre des infirmières et infirmiers du Québec (OIIQ), de la Chaire de soins palliatifs du Québec, du Centre de recherche du CHU de Québec, de la Faculté des sciences infirmières de l’Université Laval et du Réseau de recherche en intervention en sciences infirmières du Québec (RRISIQ). Merci aux professeures qui ont marqué mon parcours universitaire post-gradué : Danielle Blondeau, Hélène Patenaude, Kathleen Lechasseur, Johanne Gagnon, Clémence Dallaire, Hélène Provencher et Philippe Voyer.
1
Introduction
Cette étude s’intéresse à la survie de femmes atteintes du cancer de l’endomètre avec traitements adjuvants après la fin du traitement actif du cancer. La période de transition entre la fin du traitement du cancer et la survie au cancer est ciblée. La phase de survie débute au moment où les personnes terminent leur traitement actif du cancer sans égard au pronostic espéré ou attendu pour la survie (Hewitt, Greenfield & Stovall, 2006). Cette phase de survie est une phase distincte mais négligée de la trajectoire de soins du cancer tant sur les plans de l’éducation et de la pratique clinique que de la recherche (Hewitt et al., 2006). De façon plus spécifique, l’étude vise le développement, l’implantation et le pré-test d’un plan de soins de suivi interdisciplinaire pour des femmes atteintes du cancer de l’endomètre avec traitements adjuvants et comporte deux étapes de recherche distinctes. La première étape, qualitative, consiste à développer et à valider auprès de tous les acteurs clés impliqués dans la trajectoire de soins de la population cible, un plan de soins de suivi (PSS). La deuxième phase, principalement quantitative, consiste à pré-tester le plan de soins de suivi développé à la première phase auprès de cette clientèle et à évaluer sa faisabilité et son acceptabilité de même que son utilité à répondre à des besoins globaux, à diminuer la détresse (peur de la récidive) et à favoriser les comportements d’autogestion de santé.
La thèse est rédigée selon le mode de présentation par articles et reconnu par l’Université Laval. Elle comporte six chapitres. Deux articles sous forme de manuscrits sont inclus.
Le premier chapitre aborde la problématique associée à la survie au cancer. Le contexte de la survie et les facteurs de risque associés sont d’abord présentés. Par la suite, les besoins des femmes atteintes du cancer de l’endomètre à cette phase distincte de la trajectoire de soins sont discutés. Puis, la fin du traitement actif, décrit comme une période de transition, les modèles de soins de suivi en survie au cancer, la place de l’infirmière dans la transition de la fin du traitement de même que le développement de PSS dans un contexte d’équipe interdisciplinaire sont abordés. Le chapitre se termine par la présentation de la pertinence de l’étude et la formulation du but et des objectifs de l’étude.
2
Le deuxième chapitre présente la recension des écrits et vise à répertorier les études concernant le développement et la mise en place de plans de soins de suivi (PSS) en survie au cancer. Plus précisément, il se divise en trois parties qui présentent des études portant sur : 1) le développement du contenu et la mise en place de PSS, 2) l’évaluation de PSS (pertinence et l’utilité) et, 3) les études randomisées (efficacité de PSS).
Le troisième chapitre aborde le cadre conceptuel de l’étude. D’abord, le concept de transition, utile à décrire la phase de fin de traitement vers la survie au cancer, est exposé à l’aide de la théorie intermédiaire de la transition (Meleis, 1994). Ensuite, le cadre des soins de soutien en oncologie (Fitch, 1994) permet de conceptualiser et d’opérationnaliser le type de soutien nécessaire pour aider les personnes atteintes de cancer à répondre à leurs besoins lors de leur transition de la phase de traitement vers la phase de survie au cancer. Par la suite, l’intégration des deux modèles principaux de l’étude est présentée. Finalement, le modèle de Patton (1997) utilisé pour documenter le processus de changements organisationnels pour la mise en place d’un PSS est brièvement exposé. Le chapitre se termine par la formulation des objectifs spécifiques et des questions de recherche des deux phases distinctes de l’étude.
Le quatrième chapitre expose le cadre méthodologique de l’étude. Le devis de recherche est d’abord présenté. Par la suite, chacune des deux phases de l’étude sont présentées successivement et comprennent les sections suivantes : Approches et devis, participants et critères d’inclusion, collecte des données, procédure et plan d’analyse des données. Finalement, les considérations éthiques pour les phases 1 et 2 de l’étude terminent le chapitre.
Le cinquième chapitre présente le premier article de la thèse et expose les résultats de la première phase de recherche. Il débute par un avant-propos et un résumé de l’article. Plus précisément, il décrit le développement et la validation du contenu d’un PSS pour des femmes atteintes du cancer de l’endomètre lors de la transition de la fin du traitement actif vers la survie au cancer. Il décrit les besoins globaux rapportés par la clientèle cible à la fin du traitement actif et les perceptions des professionnels de la santé impliqués dans la trajectoire de soins et de gestionnaires de proximité en oncologie concernant le PSS (utilité, contenu et format souhaité). Le chapitre se termine par une conclusion de la réalisation de la phase 1.
3
Le sixième chapitre présente le deuxième article de la thèse et expose les résultats de la deuxième phase de recherche, soit l’évaluation du PSS développé à la phase 1. Il débute par un avant-propos et un résumé de l’article. Plus précisément, il décrit les résultats de l’évaluation de la faisabilité, de l’acceptabilité et le pré-test de l’utilité du PSS à répondre à des besoins globaux, à diminuer la détresse (peur de la récidive du cancer) et à favoriser les comportements d’autogestion de santé auprès de femmes atteintes du cancer de l’endomètre (FACE). Le chapitre se termine par une conclusion de la réalisation de la phase 2.
Une conclusion générale termine la thèse. Cette section permet d’abord le rappel des objectifs poursuivis aux deux étapes distinctes de l’étude, précise l’atteinte de ces objectifs et dégage les éléments essentiels de la démarche. Elle se termine par une discussion plus large sur l’apport de cette thèse en sciences infirmières.
4
Chapitre 1 - Problématique
Le premier chapitre présente la problématique associée à la survie au cancer. Le contexte de la survie et les facteurs de risque associés sont d’abord présentés. Par la suite, les besoins des femmes atteintes du cancer de l’endomètre à cette phase distincte de la trajectoire de soins sont exposés. Puis, la fin du traitement actif comme une période de transition vers la survie est proposée. Le chapitre se termine par la formulation du but et des objectifs généraux de l’étude.
1.1 Le contexte de la survie au cancer
On estime à 196 900 le nombre de nouveaux cas de cancer au Canada et à 50 100 au Québec en 2015 (Société canadienne du cancer, [SCC], 2015). Le cancer est responsable de 30% de tous les décès et est la principale cause de décès au Canada. Près de la moitié des Canadiens développeront un cancer au cours de leur vie et le nombre de nouveaux cas de cancer et de décès liés au cancer continue d’augmenter. La hausse du nombre de nouveaux cas de cancer est principalement attribuable à la croissance démographique et au vieillissement de la population (SCC, 2015). De fait, on estime qu’entre 2028-2032, la population annuelle moyenne augmentera de 29% et celle des 65 ans et plus passera de 13% à 22%. En 2015, 89% des nouveaux cas de cancer touchent des Canadiens de 50 ans et plus et près de la moitié (43%) surviennent chez les 70 ans et plus (SCC, 2015). En 2026, 23% de la population québécoise sera âgée de 65 ans et plus (Institut de la statistique du Québec [INSQ] (2010).
Après le cancer du sein, 26.1%, les cancers gynécologiques sont responsables de 12% des nouveaux cancers chez les femmes au Canada et comprennent les cancers de l’endomètre (6,5%), de l’ovaire (2,9%), du col de l’utérus (1,5%) de même que ceux du vagin et de la vulve qui sont plus rares (SCC, 2015).Parmi les types de cancers gynécologiques, le cancer de l’endomètre est le plus fréquent (Jemal et al., 2006 ; SCC, 2015) et représente le quatrième cancer le plus courant chez la femme (SCC, 2015). Alors que l’incidence et les taux de mortalité de plusieurs cancers ont diminué ou se sont stabilisés, le taux de cancers de l’endomètre ne cesse d’augmenter (Fader, Arriba, Frasure & von Gruenigen, 2009 ; SCC,
5
2015). L’incidence du cancer de l’endomètre augmente de 2,6% par année depuis 2004 (SCC, 2015).
Heureusement, grâce à l’amélioration du dépistage, de la prévention et des traitements, la survie au cancer, incluant celle pour le cancer de l’endomètre, augmente (Meneses & Benz, 2010 ; SCC, 2014 ; Van der Aa, Schutter, Looijen-Salamon, Martens, & Siesling, 2008). Au Canada, le taux de survie relative à cinq ans pour tous les types de cancers confondus est de 63% (SCC, 2015). Le cancer de l’endomètre est diagnostiqué généralement à un stade précoce de la maladie (Truong et al., 2005) et la survie relative à cinq ans dépasse 80% (SCC, 2015).
Il n’y a pas de consensus sur la définition de la phase de survie au cancer (Hewitt et al., 2006). Dans cette étude, la survie correspond à une phase précise de la trajectoire de soins qui débute au moment où les personnes terminent leur traitement actif du cancer sans égard au pronostic espéré ou attendu pour la survie.
La fin des traitements actifs et le début de la phase de survie correspondent à une période de transition qui présente de nombreux défis pour la personne survivante, les soignants et le système de santé (Hewitt et al., 2006 ; Jones & Grunfeld, 2011 ; Landier, 2009). Pour la personne survivante, les conséquences du cancer et de ses traitements amènent des défis substantiels qui affectent la qualité de vie (Dahl, Wittrup, Vaeggemose, Petersen, & Blaakaer, 2013). Ces défis relèvent des domaines physique, informationnel, émotionnel, psychologique, pratique, social et spirituel (Fitch, Porter & Page, 2008 ; Harrison, Young, Price, Butow, & Solomon, 2009 ; Hewitt et al., 2006 ; Steele & Fitch, 2008). Pour les soignants et le système de santé, la diversité des personnes, des diagnostics, des traitements et des séquelles potentielles augmente la complexité des soins à la phase de survie et se complique notamment par le manque de lignes directrices pour les soins de survie au cancer (Adler, 2008 ; Landier, 2009 ; Rutledge et al., 2010).
Dans le but de mieux répondre aux besoins des personnes à la phase de survie au cancer, le rapport charnière de l’Institute of Medicine [IOM], (Hewitt et al., 2006) propose des recommandations. Le rapport souligne notamment qu’en raison du nombre croissant de survivants du cancer, le système de prestation de soins actuel est inadéquat. Selon ce
6
document, la transition des soins à la fin du traitement actif du cancer serait mal coordonnée et de nombreux survivants et soignants ne recevraient pas suffisamment d’information sur les soins de suivi, les effets tardifs et à long terme du cancer de même que sur les risques élevés du cancer et de ses traitements sur la santé à long terme (Hewitt et al., 2006). Malgré que le rapport date maintenant de plusieurs années, peu d’améliorations ont été constatées, et la nécessité de fournir des soins spécialisés pour répondre aux besoins spécifiques des personnes dans cette phase du continuum de soins demeure (Feurstein & Ganz, 2011 ; LIVESTRONG, 2012 ; Mayer et al., 2014). Le cancer devrait être considéré au même titre que d’autres maladies chroniques, telles que les maladies cardiovasculaires, le diabète ou les maladies pulmonaires obstructives chroniques (MPOC). À ce titre, le rapport de l’IOM recommande que les soins de suivi en survie au cancer devraient comprendre : 1) la prévention (récidive, nouveaux cancers et effets tardifs), 2) la surveillance (récidive, métastases, second cancer; évaluations médicale et psychosociale), 3) les interventions (conséquences du cancer et des traitements) et la coordination des soins (entre spécialistes et professionnels de la santé de première ligne) pour assurer la réponse aux besoins des personnes à cette phase de survie au cancer (Hewitt et al., 2006).
Le rapport suggère également que pour faciliter la transition de la fin du traitement actif vers la survie et optimiser la coordination des soins de suivi, les personnes qui terminent leur traitement devraient recevoir un résumé de traitement et un plan de soins de suivi écrit contenant une série d’éléments multidimensionnels de base, adaptés au type de cancer et au traitement (Hewitt et al., 2006).
Encore récemment, on déplore le peu d’études qui décrivent le développement, le contenu, la mise en place, l’acceptabilité, la faisabilité et l’efficacité du plan de soins de suivi (Brothers, Easley, Salani & Andersen, 2013 ; Salz, Oeffinger, McCabe, Layne & Bach, 2012). De plus, les études rapportent que peu de survivantes de cancers gynécologiques (10%) ont accès à un plan de soins de suivi (Brothers et al., 2013 ; Grover et al., 2012 ; Sabatino et al., 2013 ; Salani, 2013). Pour faire pression sur l’organisation des services, la littérature suggère qu’un travail d’éducation à la population doit être fait concernant l’existence et les avantages potentiels d’un PSS (Mayer et al., 2014). La lenteur de l’adoption du PSS (développement, mise en place, évaluation) serait due en partie à des contraintes
7
organisationnelles en grande partie liées à des contraintes économiques (temps, coûts, ressources). Paradoxalement, il est suggéré que la mise en place de PSS aurait un impact économique favorable sur l’utilisation des services de santé (Smith, Singh-Carlson, Downie, Payeur & Wai, 2011).
Par ailleurs, lors de la décision d’implanter de telles mesures, on recommande que le développement, la mise en place et l’évaluation du PSS soient d’abord guidés par une démarche de partenariat entre l’équipe interdisciplinaire en oncologie et les survivants pour prendre en compte à la fois les contraintes de l’organisation et les besoins des patients (Mayer et al., 2014). On recommande aussi de documenter l’acceptabilité et l’efficacité à répondre aux besoins à la fin du traitement actif vers la phase de survie au cancer d’une telle démarche afin de produire des orientations et d’éventuels guides de pratique (Stricker & O’Brien, 2014)). Actuellement, la façon d’intégrer le PSS et son utilité pour améliorer la qualité de vie des survivants demeurent floues et peu documentées (Klemanski, Browning & Kue, 2015). Afin de fournir un exemple d’application de ces dernières recommandations, cette thèse vise à documenter le développement et la mise en place d’un PSS personnalisé en collaboration avec une équipe interdisciplinaire et des femmes atteintes du cancer de l’endomètre. Elle vise à explorer des pistes de solution pour sa mise en œuvre en documentant le développement d’un PSS selon une démarche qui implique à la fois les perceptions des acteurs de l’organisation et celles des patientes, la faisabilité de son implantation, son acceptabilité auprès de la clientèle visée et des acteurs clés de la trajectoire de soins et son utilité à répondre à des besoins physiques, informationnels et psychosociaux.
Afin d’explorer les éléments de contenu du PSS propre à la clientèle retenue, favorisant ainsi l’acceptabilité éventuelle de l’outil et une meilleure réponse aux besoins, les facteurs de risques liés à la survie au cancer et à ses traitements ainsi que les besoins des femmes atteintes de cancers gynécologiques sont d’abord présentés. Des pistes d’accessibilité à un tel outil permettant ainsi la faisabilité de son implantation en décrivant certains éléments de l’organisation des soins liés au déroulement de fin du traitement actif du cancer et aux rôles possibles de l’infirmière et des membres de l’équipe interdisciplinaire à cette phase du continuum du cancer sont explorées. Puis, après avoir exploré la contribution de l’étude sur la précision d’éléments de contenu et d’accessibilité à un plan de soins de suivi
8
comme pistes de solution au problème énoncé, la contribution additionnelle de la réalisation de cette étude au savoir infirmier en discutant de la contribution infirmière est abordée. Enfin, à la lueur de cette analyse des pistes de solution, une première formulation du but et des objectifs de l’étude est réalisée.
1.2 Les facteurs de risques associés à la survie au cancer et aux traitements Cette section présente trois facteurs de risques associés à la survie au cancer de l’endomètre soient, les modalités de traitement, la présence de comorbidités et les comportements de santé.
1.2.1 Les modalités de traitements.
Le stade du cancer et les modalités de traitements sont associés à une variété de risques pour la santé des survivants (Joly et al., 2014 ; Grover et al., 2012). Les modalités de traitements peuvent provoquer des effets secondaires persistants (problèmes cognitifs, fatigue, lymphœdème et neuropathies périphériques) ainsi que des effets secondaires tardifs qui se manifestent des mois ou des années plus tard (séquelles cardiaques et pulmonaires, second cancer) (Aziz, 2007a ; Grover et al., 2012 ; Weaver et al., 2013). La chirurgie, la chimiothérapie et la radiothérapie sont des modalités de traitement couramment utilisées pour le traitement des cancers gynécologiques. Ces trois modalités de traitements sont fréquemment combinées pour favoriser la survie à long terme (Green et al., 2001 ; Ryu et al., 2005) et comportent des effets secondaires persistants ou tardifs (Vaz et al., 2011).
La chirurgie est la première modalité de traitement pour tous les cancers de l’endomètre. Les effets secondaires persistants ou tardifs liés à la chirurgie dépendent du type de chirurgie pratiquée et de l’état de santé générale de la femme atteinte du cancer (Basen-Engquist & Bodurka, 2007). On retrouve notamment, la stérilité, le lymphœdème (lors de l’ablation des ganglions lymphatiques du bassin lors d’une hystérectomie radicale), la ménopause (si ablation des deux ovaires), un rétrécissement vaginal, une occlusion intestinale, la présence de fistules (entre la vessie et le vagin, les uretères et le vagin, le rectum et le vagin pouvant causer des fuites (urine ou selles) par le vagin) et la perte d’intérêt sexuel (Basen-Engquist & Bodurka, 2007).
9
La chimiothérapie de son côté serait associée à un risque accru de toxicité et de nouveaux cancers (Basen-Enquist & Bodurka, 2007 ; Earle, 2007 ; Stricker & Hollis, 2011 ; Zablotska, Matasar & Neugut, 2007). Elle serait également associée au développement de divers problèmes de santé, tels que les neurotoxicités (neuropathies périphériques et neurocognitives), des problèmes gastro-intestinaux et génito-urinaires, de la douleur, l’infertilité, des problèmes sexuels, des symptômes de ménopause précoce, de la fatigue, de l’ostéoporose et de la détresse psychologique (Basen-Engquist & Bodurka, 2007 ; Feuerstein, 2007 ; Ganz, 2007 ; Rutledge, Heckman, Qualls, Muller, & Rogers, 2010 ; Langhorne, Fulton & Otto, 2007). Plus spécifiquement pour les femmes atteintes du cancer de l’endomètre, les effets secondaires tardifs et à long terme les plus fréquemment rencontrés sont des changements gastro-intestinaux, sexuels, des neuropathies périphériques, des changements cognitifs, des changements au niveau de la peau et des problèmes de perte d’audition (Grover et al., 2012 ; Rutledge et al., 2010).
Enfin, les effets secondaires persistants et tardifs de la radiothérapie sont la plupart du temps circonscrits à la tumeur et peuvent être associés à des changements gastro-intestinaux, urinaire, gynécologique et ovarien qui peuvent provoquer des effets indésirables comme de la diarrhée, des saignements vaginaux et rectaux, de la dysurie, de l’incontinence urinaire, de l’hématurie, des bouffées de chaleur, de la sténose et de la sécheresse vaginale, une dyspareunie et une diminution de l’intérêt sexuel qui ont un impact sur la qualité de vie (Grover et al., 2012 ; Vaz et al., 2011). De plus, cette modalité de traitement peut affaiblir, endommager ou inflammer les organes et les tissus avoisinants (Aziz, 2007a ; Feuerstein, 2007). Les effets de la radiothérapie peuvent favoriser le développement de nouveaux cancers lorsque des tissus voisins sont endommagés par la radiation par exemple, le développement d’un cancer de l’intestin suite à la radiation abdominale ; ces effets peuvent aussi entraîner de la toxicité (Aziz, 2007a ; Feuerstein, 2007 ; Herrera, Santa Cruz, Achtari, Bourhis, & Ozsahin, 2014).
Par ailleurs, la combinaison des traitements est associée à des risques accrus de problèmes cardio-pulmonaires, urinaires, gastro-intestinaux et hépatiques, de lymphœdème et de fatigue (Aziz, 2007a). De fait, les risques de problèmes cardiovasculaires seraient plus élevés chez les survivants du cancer que dans la population générale et plus à risque de
10
compromettre la santé et le bien-être à long terme (Weaver et al., 2013). Le cancer et ses traitements ont également des impacts majeurs sur la perte osseuse (ostéoporose) et le risque de fractures (Drake, 2013).
En somme, la littérature rapporte plusieurs conséquences négatives possibles (effets persistants et à long terme) des traitements du cancer (Aziz, 2007b ; Ganz, 2007 ; Lester & Schmitt, 2011). Ainsi, le contenu d’un plan de soins de suivi (PSS) pourrait informer sur les principaux effets secondaires persistants ou tardifs possibles et à surveiller, selon les modalités de traitements reçus de même que sur les symptômes de récidive ou de nouveau cancer. Le PSS pourrait également préciser les modalités de suivi médical prévues pour faciliter cette surveillance.
1.2.2 Les comorbidités.
La présence de comorbidités peut affecter les modalités de traitements, la survie et les risques d’effets secondaires tardifs. L’âge avancé est associé à une vulnérabilité accrue aux affections concomitantes telles que le diabète, les maladies pulmonaires obstructives chroniques, les maladies cardiaques, l’arthrite et l’hypertension (Hewitt et al., 2006 ; Yancik, Ganz, Varricchio & Conley, 2001). Plusieurs comorbidités sont communes chez les survivants du cancer : obésité, HTA et diabète (Joly et al., 2014 ; Hawkes, Lynch, Owen & Aitken, 2011 ; Weaver et al., 2013). La présence de comorbidités chez certaines personnes atteintes de cancer incluant les cancers gynécologiques, pourraient rendre ces personnes plus à risque de développer un second cancer, des effets secondaires tardifs liés aux traitements et des comorbidités chroniques (Aziz, 2007a ; Ganz, 2007).
L’obésité est considérée comme une comorbidité et constitue une menace pour la santé des survivantes du cancer de l’endomètre (Arem & Irwin, 2013 ; Beesley et al., 2008 ; Fader, Arriba, Frasure & von Gruenigen, 2009, Fader, Frasure, Gil, Berger, & von Gruenigen 2011 ; Kaaks, Lukanova, & Kurzer, 2002 ; von Gruenigen, Gil, Frasure, Jenison, & Hopkins, 2005 ; von Gruenigen et al., 2011). De fait, les femmes atteintes du cancer de l’endomètre sont souvent obèses (Arem & Irwin, 2013 ; Fader et al., 2009) et ont un risque significatif de développer d’autres problèmes de santé liés à l’obésité tels que le diabète de type II et les maladies cardiovasculaires (Chia, Newcomb, Trentham-Dietz, & Hampton, 2007 : von
11
Gruenigen et al., 2006 ; Kushi et al., 2012). Des études soulignent le haut niveau d’obésité pour ce groupe (Beesley et al., 2008 ; Courneya et al., 2005 ; Fader et al., 2009 ; Mishra et al., 2012 ; Weaver et al., 2013) et un impact négatif significatif sur la santé et la qualité de vie (Beesley et al., 2008 ; Courneya et al., 2005 ; Fader et al., 2011). Approximativement 70% des survivantes du cancer de l’endomètre sont obèses et sont inactives (Blanchard, Courneya & Stein, 2008 ; Courneya et al., 2005 ; von Gruenigen et al., 2011). Vivre avec un cancer signifie pour de nombreux survivants, de vivre avec une condition de santé chronique (Jackson, Scheid & Rolnick, 2013). Le plan de soins de suivi pourrait préciser en quoi les comorbidités représentent un risque pour la santé et la qualité de vie et l’importance de bien contrôler ces maladies et d’en faire le suivi avec le médecin de famille.
1.2.3 Les comportements de santé.
Parmi les comportements de santé, l’activité physique, une saine alimentation, l’arrêt du tabagisme et la diminution de la consommation d’alcool sont discutés dans cette section.
Les comportements de santé déficients comme la sédentarité, le tabagisme, une mauvaise alimentation, et la consommation d’alcool constitueraient des facteurs de risque (Beesley et al., 2008 ; Fader et al., 2009 ; SCC, 2015) et sont fréquents chez les femmes atteintes du cancer de l’endomètre (von Gruenigen et al., 2011). Inversement, l’amélioration des comportements de santé favoriserait la survie au cancer ainsi que la qualité de vie (Beesley et al., 2008 ; Blanchard et al., 2008 ; Demark-Wahnefried, Pinto, & Gritz, 2006 ; Eakin et al., 2007 ; Fader et al., 2009 ; Holmes, Chen, Feskanich, Kroenke, & Colditz, et al., 2005 ; Mishra et al., 2012 ; Stevinson et al., 2007). Des études démontrent la relation positive entre l’activité physique et la qualité de vie (Mishra et al., 2012) et ses bénéfices pour diminuer la fatigue (Cramp & Byron-Daniel, 2012), l’anémie, le bien-être physique et fonctionnel (Beesley et al., 2008 ; Courneya et al., 2005), les troubles de sommeil (Tomlinson, Diorio, Beyene & Sung, 2014) et les symptômes anxieux et dépressifs (Craft, Vaniterson, Helenowski, Rademaker, & Courneya, 2012 ; Tomlinson et al., 2014). L’activité physique peut améliorer la qualité de vie en atténuant certains effets secondaires des traitements, en réduisant les risques de comorbidités, en diminuant l’anxiété, en améliorant l’image de soi et en augmentant les interactions sociales (Courneya et al., 2005). Les femmes atteintes du cancer de l’endomètre qui adoptent des comportements de santé sains tels que
12
l’activité physique, l’arrêt du tabagisme et une diète équilibrée rapportent une meilleure qualité de vie (Blanchard et al., 2008). Cependant, une proportion substantielle de survivants rapporte ne pas discuter de comportements de santé avec leurs professionnels de la santé (Weaver et al., 2013) et être inactifs (Courneya et al., 2005 ; Fader et al., 2009).
Contrairement à l’activité physique, les études concernant la relation entre la nutrition et le cancer de l’endomètre ne sont pas concluantes (Kushi et al., 2012) bien qu’un régime comprenant une charge glycémique élevée augmenterait le risque de cancer de l’endomètre (Mulholland, Murray, Caldwell, & Cantwell, 2008). Actuellement, maintenir un poids santé, avoir une diète équilibrée faible en gras et pratiquer une activité physique régulièrement sont les comportements de santé qui diminuent le risque de cancer de l’endomètre et favorisent la qualité de vie générale (Fader et al., 2009 ; Kushi et al., 2012).
Dans le même sens, le tabagisme et la consommation d’alcool sont des facteurs de risque modifiables pour le développement du cancer (Tabuchi, Ozaki, Ioka & Miyashiro, 2015). Le tabagisme est un facteur de risque majeur bien connu dans l’incidence et le taux de mortalité du cancer chez l’adulte et il serait également associé au risque de développer un second cancer (Tabuchi et al., 2015). Les survivants qui ont cessé de fumer immédiatement après un diagnostic de cancer peuvent diminuer leur risque de développer un second cancer (Parson, Daley, Begh & Aveyard, 2010 ; Tabuchi et al., 2015). La modération de la consommation d’alcool diminue les risques de second cancer et l’interaction entre le tabac et l’alcool augmente les risques de développer un second cancer (Tabuchi et al., 2015). De fait, les personnes ayant toujours eu l’habitude de boire et de fumer comparées avec celles n’ayant jamais eu ces habitudes ont 108% plus de risque de développer un second cancer (Tabuchi et al., 2015). La fin du traitement initial du cancer représente un « teachable moment » (Ganz, 2007) et offre l’opportunité d’avoir un impact sur l’amélioration des comportements de santé des survivants. La promotion des habitudes de vie saines (arrêt tabagique, activité physique quotidienne, alimentation équilibrée, consommation d’alcool modérée) ainsi que la gestion du stress (réponse adaptée aux préoccupations psychosociales et à la détresse) semblent améliorer le bien-être fonctionnel et la qualité de vie des survivants (Howell et al., 2011). Le plan de soins de suivi pourrait inclure des éléments d’information spécifiques portant sur les
13
comportements de santé tels que l’activité physique, la nutrition, le tabagisme, l’alcool et la gestion du stress qui pourraient faciliter les comportements d’autogestion de santé.
En résumé, l’exploration des facteurs de risques permet de préciser la pertinence d’inclure les éléments de contenu du plan de soins de suivi suivants : les effets secondaires possibles associés aux traitements, la précision des rencontres de suivi médical avec l’équipe spécialisée, la nécessité du suivi médical avec le médecin de famille pour les problèmes de santé déjà existants et les recommandations de comportements de santé sains. Outre les comportements de santé, l’exploration de ces facteurs a surtout permis de préciser des éléments de contenu d’un PSS qui portent essentiellement sur le volet physique du suivi.
Comme il est recommandé qu’un PSS inclut à la fois des éléments physiques et psychosociaux (Mayer et al., 2014 ; Rechis, Beckjord, Arvey, Reynolds, & Mcgoldrick, 2011), la littérature nous permet d’explorer également l’ensemble des besoins des survivantes durant la période de transition de la fin du traitement initial vers la survie. L’exploration des besoins peut à la fois compléter les éléments de contenu pour le volet physique du plan de suivi, de même que préciser davantage les éléments de contenu à retenir pour le volet psychosocial.
1.3 Les besoins des survivantes atteintes de cancers gynécologiques
Cette section présente les besoins physiques, informationnels et psychosociaux et met l’emphase sur l’utilité de faciliter une meilleure réponse à ces besoins pour améliorer la qualité de vie des survivantes. La phase de survie au cancer comporte de nombreux défis pour les survivantes de cancers gynécologiques qui peuvent engendrer différents besoins dans le domaine physique, et également dans les domaines informationnel et psychosocial (Salani, 2013). La présence de besoins non satisfaits risque de compromettre la qualité de vie (Grover et al., 2012 ; Jones et al., 2012).
1.3.1 Les besoins physiques.
Tout comme pour les autres cancers, les femmes atteintes de cancer gynécologiques font face à de nombreux défis dans la restauration et le maintien de leur santé et de leur bien-être lors de la transition de la fin de la phase de traitement initial vers la phase de survie au
14
cancer (Jones et al., 2012 ; Steele & Fitch, 2008). À la phase de survie, on retrouve de nombreux besoins d’ordre physique associés à la maladie et aux traitements (Abbott-Anderson & Kwekkeboom, 2012 ; Beesley et al., 2008 ; Carlson et al., 2004 ; Ferrell, Smith, Cullinane & Melancon, 2002 ; Steele & Fitch, 2008)
La persistance de nombreux symptômes physiques et effets secondaires à la phase de survie peut ainsi être rapportée par les femmes ayant été traitées pour un cancer gynécologique. La difficulté à gérer la douleur, plusieurs symptômes de ménopause, la fatigue, des problèmes gastro-intestinaux et sexuels sont souvent rapportés comme des besoins physiques (Abbott-Anderson & Kwekkeboom, 2012 ; Ganz, 2007 ; Jones et al., 2012 ; Pearman, 2003 ; Vaz et al., 2011 ; Vollrath, Zenger, Singer, Einenkel, & Hinz, 2013 ; Wenzel, Vergote & Cella, 2003) qui peuvent affecter la qualité de vie (Fox & Lyon, 2007 ; Reis, Beji & Coskun, 2010 ; Vaz et al., 2011). Par exemple, la fatigue liée à la maladie et aux traitements est le symptôme le plus souvent rapporté et est présente chez le tiers (31%) des survivants jusqu’à six ans après la fin des traitements. Cette fatigue persistante est associée à un haut niveaux d’invalidité (Jones et al., 2015 ; Wu & Harden, 2015). La fatigue persistante a été associée au stress et à l’humeur dépressive, aux troubles du sommeil et au niveau de fatigue préexistant (Wu & Harden, 2015). Par ailleurs, les survivantes des cancers gynécologiques éprouvent d’autres besoins physiques associés à une difficulté à gérer différents groupes de symptômes après la fin des traitements qui incluent une combinaison de fatigue, dépression, anxiété, douleur, troubles du sommeil et problèmes cognitifs (Wu & Harden, 2015). De plus, les survivantes de cancers gynécologiques rapportent des besoins physiques en lien avec certains changements physiques et la ménopause, tels que la perte de la fonction ovarienne, les bouffées de chaleur, la sécheresse vaginale, la perte de cheveux et des problèmes cutanés de même que des changements de l’humeur (Pearman, 2003). Par ailleurs, des études soulignent l’association entre la présence de besoins physiques et la diminution de la qualité de vie (Abbott-Anderson & Kwekkeboom, 2012 ; Brearley et al., 2011 ; Vaz et al., 2011).
L’impact négatif sur le fonctionnement sexuel des femmes atteintes de cancers gynécologiques est, entre autres, bien documenté (Abbott-Anderson & Kwekkeboom, 2012 ; Audette & Waterman, 2010 ; Liavaag et al., 2008 ; Reis et al., 2010 ; Stead, Fallowfield,
15
Selby & Brown, 2006). Les traitements peuvent entraîner des limitations physiques (Audette & Waterman, 2010 ; Stead et al., 2006) tels que des changements du niveau hormonal, la perte d’organes sexuels causée par la chirurgie (utérus, trompes de Fallope, ovaires et col de l’utérus) qui peuvent provoquer des dommages aux nerfs pelviens et diminuer la qualité de vie (Rutledge et al., 2010 ; Stead, 2004 ; Vaz et al., 2011). Parmi les facteurs affectant la fonction sexuelle, la dyspareunie et la perte de désir sont les plus communs (Abbott-Anderson & Kwekkeboom, 2012 ; Pearman, 2003 ; Sekse, Gjengedal & Raheim, 2013 ; Stilos, Doyle & Daines, 2008 ; Vaz et al., 2011). Les changements physiques liés à la maladie et aux traitements peuvent affecter l’estime de soi et être associés à de la détresse (Abbott-Anderson & Kwekkeboom, 2012 ; Sekse et al., 2013 ; Stilos et al., 2008). Les besoins physiques, peuvent ainsi être associés à des besoins de soutien émotionnel et social (Pinar, Okdem, Buyukgonenc, & Ayhan, 2012).
Le PSS permettrait de mieux connaître les effets indésirables possibles associés à la maladie et aux traitements et de surveiller les symptômes à signaler au médecin ou à la personne à contacter précisée dans le PSS.
1.3.2 Les besoins d’information.
La littérature rapporte que toutes les personnes qui terminent leur traitement actif du cancer ont des besoins d’information (Nissen, Tsai, Blaes, Swenson, & Koering, 2013 ; Rechis, Beckjord & Nutt, 2014) et que ces besoins ne sont pas satisfaits (Jones et al., 2012 ; Nicolaije et al., 2012). De nombreuses études ont documenté les besoins d’information chez les femmes atteintes de cancers gynécologiques à la fin du traitement actif du cancer (Greimel, Lahousen, Dorfer, Lambauer & Lang, 2011 ; Lydon, Beaver, Newbery & Wray, 2009 ; Nicolaije et al., 2012 ; Papadakos et al., 2012). Elles expriment des besoins d’information concernant la prévention et les risques de récidive, les possibilités d’un second cancer, les effets secondaires persistants et tardifs des traitements sur les plans physique et psychosocial, le soutien psychosocial, et d’autres problèmes de santé liés aux traitements et à la maladie (Brennan, Butow, Spillane & Boyle, 2010 ; Burg, Lopez, Dailey, Keller & Prendergast, 2009 ; Marbach & Griffie, 2011; Miller, 2008 ; Nicolaije et al., 2012 ; Papadakos et al., 2012). De plus, recevoir de l’information concernant les ressources disponibles et sur les comportements de santé à adopter est nécessaire (Nicolaije et al., 2012).
16
Les survivantes de cancers gynécologiques rapportent un manque de préparation à la phase de survie au cancer, ont des difficultés d’accessibilité à l’information et aux ressources et de la difficulté à communiquer avec leurs professionnels de la santé (Jones et al., 2012). Des besoins concernant l’adaptation à la vie quotidienne après la fin des traitements de même que la disponibilité de ressources et de soutien psychosocial à l’extérieur de l’hôpital sont rapportés par les survivantes du cancer de l’endomètre (Nicolaije et al., 2012). Le sentiment d’être informé et une meilleure préparation à ce qui s’en vient après les traitements aideraient à diminuer la détresse (Stanton et al., 2005) et la perception de contrôle sur la situation déterminerait les réponses de stress psychologiques (Jones et al., 2010). Actuellement, les femmes atteintes du cancer de l’endomètre ne recevraient pas suffisamment d’information pour l’après traitement (Jones et al., 2012 ; Nicolaije et al., 2012).
Le PSS pourrait être d’une part, un outil d’information tant au niveau de la maladie et des traitements reçus que pour les symptômes physiques à reconnaître et à surveiller et pour détecter une récidive ou un nouveau cancer. D’autre part, il serait une ressource utile pour la continuité des soins de suivi (examen de suivi, personnes à contacter au besoin) et la coordination des soins pour l’après-traitement (qui fait quoi). Finalement, il permettrait le partage de l’information avec le médecin de famille ou d’autres professionnels de la santé à l’extérieur de l’équipe d’oncologie selon les ententes entre les organisations concernées.
1.3.3 Les besoins psychosociaux.
Les cancers gynécologiques et leurs traitements ont des conséquences sur les besoins psychosociaux tout au long du continuum de soins (Hodgkinson et al., 2007). Sur le plan psychologique, l’impact de la maladie et du traitement peut se manifester par de la dépression et de l’anxiété. Près de la moitié des femmes atteintes de cancers gynécologiques rapportent des niveaux élevés d’anxiété, de dépression, de symptômes post-traumatiques et une diminution de la qualité de vie après la fin du traitement (Urbaniec, Collins, Denson, & Whitford, 2011). De fait, entre 11% et 19% de femmes atteintes d’un cancer gynécologique ont des symptômes de dépression 3 mois après la fin du traitement et 5.7% d’entre elles, 18 mois en post traitement (Harrington, Hansen, Moskowitz, Todd & Feuerstein, 2010). Les préoccupations liées à la récidive de la maladie, aux effets secondaires persistants et tardifs et à la possibilité d’une diminution de la durée de vie sont communes (Dahl et al., 2013 ;
17
Deimling, Bowman, Stern, Wagner & Kahana, 2006 ; Fox & Lyon, 2007 ; Linden, Vodermaier, MacKenzie & Duncan, 2012 ; Simard et al., 2013). Des études soutiennent l’association entre la peur de la récidive du cancer, la détresse, la dépression, l’anxiété et l’évitement/l’intrusion (Simard et al., 2013). Le sentiment d’anxiété est fréquemment observé dans l’année qui suit la fin du traitement initial (Harrington et al., 2010).
L’anxiété est souvent associée à la peur de la récidive de la maladie et persiste durant la phase de survie au cancer (Brother, Easley, Salani & Andersen, 2013 ; Howell, Fitch & Dean, 2003 ; Jones et al., 2010 ; Oshima et al., 2011 ; Salani, 2013 ; Wenzel et al., 2003). La peur que le cancer revienne ou progresse dans une autre partie du corps est fréquemment rapportée chez les survivants du cancer (Armes et al., 2009; Curcio, Lambe, Schneider & Khan, 2012 ; Faul et al., 2012 ; Greimel et al., 2011 ; Jefford et al., 2008; Kew, Galaal & Manderville, 2009; Simard et al., 2013) et chez la majorité des femmes atteintes de cancers gynécologiques (Beesley et al., 2008; Dahl et al., 2013; Fitch & Steele, 2010; Hodgkinson et al., 2007; Sekse et al., 2013; Steele & Fitch, 2008) et affecte la qualité de vie (Dahl et al., 2013; Fox & Lyon, 2007; Lockwood-Rayermann, 2006 ;Wenzel et al., 2003). Les survivants du cancer qui présentent une plus grande fréquence ou un plus grand nombre de symptômes physiques (effets secondaires globaux, fatigue, douleur, image/apparence corporelle altérée) ont davantage de peur de récidive (Simard et al., 2013). L’amélioration du bien-être émotionnel serait une stratégie pour diminuer la peur de la récidive (Urbaniec et al., 2011) et la façon d’y faire face serait un prédicateur de la qualité de vie à long terme (Dahl et al., 2013 ; Simard, Savard & Ivers, 2010). L’anxiété, la peur et le sentiment de culpabilité peuvent rendre la communication difficile et affecter le bien-être et la qualité de vie générale (Ratner, Foran, Schwartz & Minkin, 2010).
En résumé, la période de transition de la fin de la phase du traitement initial vers la phase de survie au cancer comporte des défis substantiels auxquels s’associent des besoins. La persistance des symptômes physiques, le manque d’information et la détresse liée à la peur de la récidive ont des impacts sur la qualité de vie après les traitements. Le besoin d’information et de préparation concernant l’après-traitement et les risques associés à la maladie et aux traitements sont majeurs et le manque d’information est substantiel. Les besoins non satisfaits sur le plan psychologique, telle que la peur de la récidive, seraient
18
associés à une plus grande détresse émotionnelle (anxiété et dépression) et à une diminution de la qualité de vie. Les survivants nécessitent à la fois des soins médicaux et des soins psychosociaux continus à la fin du traitement actif du cancer dans la transition vers la survie. Le plan de soins de suivi pourrait être un outil d’information qui faciliterait la période de transition.
En somme, le contenu d’un plan de soins de suivi devrait prendre en compte les facteurs de risque individuels associés à la maladie et aux modalités de traitement et répondre aux besoins d’information sur l’histoire de la maladie (diagnostic, résumé de traitement, particularités), les signes et symptômes à surveiller pour une récidive ou un second cancer, les examens de suivi, les ressources disponibles et les comportements de santé à adopter en survie au cancer. Il devrait également préciser les rencontres de suivi et les personnes à contacter au besoin. De plus, pour faciliter le développement, la mise en place et l’accessibilité au plan de soins de suivi, certains éléments de l’organisation des soins, comme le mode de partage des responsabilités entre les professionnels de l’équipe de soins et les diverses organisations devraient être pris en compte.
1.4 La fin du traitement actif vers la survie
La section qui suit présente la fin de la phase de traitement comme le début d’une période de transition pour laquelle un plan de soins de suivi interdisciplinaire permettrait de répondre aux besoins de la phase de survie au cancer. Elle discute également des modèles de soins en survie au cancer et de la place de choix qu’occupe l’infirmière dans l’équipe interdisciplinaire pour le développement de tels modèles et de plans de soins de suivi.
1.4.1 Une période de transition.
La fin de la phase du traitement actif du cancer correspond à une période de transition sur le continuum de soins du cancer, entre deux phases de la trajectoire de soins : traitement et survie. Cette transition se réalise également sur le plan personnel. Elle correspond à un rétablissement de la santé et des facteurs psychosociaux sont impliqués dans ce processus. Le PSS pourrait faciliter la continuité des soins entre la fin du suivi de l’équipe spécialisée et celui de la première ligne et faciliter la transition pour la personne qui termine ses traitements.
19
Bien que la fin du traitement soit généralement vécue comme un événement positif, un nombre croissant d’études documentent les difficultés liées à cette période de transition sur le continuum de soins (Beesley et al., 2008 ; Jones et al., 2012). La période de transition implique nécessairement la notion de changement et de stress. Il s’agit souvent d’une période de déséquilibres et de bouleversements dans plusieurs domaines de vie. L’adaptation requiert l’intégration de nouvelles connaissances et la modification de comportements (Meleis, Sawyer, Im, Hilfinger Messias & Schumacher, 2000). La transition de la fin du traitement vers la survie au cancer est une période souvent difficile qui peut avoir des impacts à long terme sur la santé des survivants (Hewitt et al., 2006 ; Jones et al., 2010 ; Jones et al., 2012).
1.4.2 Les modèles organisationnels de soins en survie au cancer.
La transition de la phase de la fin du traitement se situe entre une phase thérapeutique et une phase de réadaptation qui peut impliquer toutes les sphères d’activités de la personne survivante et générer des besoins. Pour faciliter la transition, des modèles de soins de suivi facilitant l’accès à un suivi planifié et à un PSS ont été proposés (Howell et al., 2012 ; McCabe & Jacobs, 2012 ; Oeffinger & McCabe, 2006). Ces modèles incluent des cliniques de suivi en survie au cancer, des modèles de soins partagés entre oncologues et médecins de famille, des modèles de soins multidisciplinaires et des modèles infirmiers de suivis systématiques de clientèles reposant sur une approche centrée sur les besoins de la personne soignée où l’infirmière en oncologie joue un rôle de premier plan (Corcoran, Dunne & McCabe, 2015 ; Sun et al., 2015). Une approche de soins centrée sur la personne permet d’offrir des soins globaux et coordonnés. Une telle approche permet de développer une relation de confiance et de partager l’information, de répondre aux émotions et d’aider à la gestion de l’incertitude, de favoriser la prise de décision et les comportements d’autogestion de santé de la personne (Epstein & Street, 2007). Même si plusieurs modèles de suivi sont proposés dans les écrits, les modèles de suivi mis en place sont souvent limités à la surveillance de symptômes physiques et médicaux et n’incluent pas de PSS (Oeffinger & McCabe, 2006).
Le modèle de soins partagés des soins de suivi (responsabilités des soins de suivi partagées entre les professionnels de la santé) implique la clarification des rôles, la communication et le transfert de connaissances entre médecins spécialistes et médecins de
20
famille avec la participation active du patient (Corcoran et al., 2015 ; Nissen et al., 2007). Dans ce modèle, le rôle du médecin de famille est de s’assurer que l’ensemble des besoins physiques et psychosociaux du patient soient satisfaits, d’assumer la responsabilité des soins pour les conditions de santé chroniques, de référer le patient au médecin spécialiste périodiquement pour une réévaluation et de consulter d’autres spécialistes au besoin pour résoudre des problèmes spécifiques. Le rôle du spécialiste est de fournir l’information nécessaire au patient concernant les traitements reçus et les effets secondaires à surveiller, de garder le médecin de famille informé du plan de traitement et de lui retourner le patient pour les autres besoins de soins de santé (Corcoran et al., 2015). L’infirmière peut faciliter le processus de transition entre le médecin spécialiste et le médecin de famille en fournissant l’information de suivi nécessaire à l’aide d’un PSS (Corcoran et al., 2015 ; Sun et al., 2015). Un modèle infirmier de suivi systématique de la clientèle pourrait également s’appliquer. On retrouve notamment en oncologie pédiatrique, l’usage de suivi systématique en cliniques ambulatoires durant les traitements ainsi qu’un suivi systématique à long terme qui inclut à la fois des suivis en milieu hospitalier à certains moments du continuum de soins et un suivi en première ligne à d’autres moments (Friedman, Freyer & Levitt, 2006). Le rôle de l’infirmière lors de ce suivi systématique en oncologie se rapproche du rôle de l’infirmière pivot en oncologie (IPO). Au Québec, le rôle de l’IPO constitue une variante de suivi systématique. En effet, le modèle de gestion de cas privilégié lors de la création de ce rôle visait une meilleure réponse aux besoins globaux de la personne atteinte de cancer tout en facilitant la continuité des soins. Le modèle retenu est apparenté à la fois à l’approche centrée sur la personne et au suivi systématique (modèle de gestionnaire de cas centré sur la personne). Lors de sa mise en œuvre, l’IPO devrait jouer un rôle crucial lors des périodes de transition, incluant celle de la phase survie. Le programme québécois contre le cancer qui a intégré ce nouveau rôle (de Serres & Rochette, 2004) ne précisait ni l’organisation des soins de survie et ni le rôle de l’IPO à cette phase de la trajectoire. La contribution de l’IPO à cette phase de la trajectoire demeure à définir mais les fonctions et les activités sont déjà bien documentées (Cook et al., 2013 ; Fillion et al., 2012 ; Fournier, 2011 ; Hébert & Fillion, 2011).