HAL Id: tel-02066673
https://tel.archives-ouvertes.fr/tel-02066673
Submitted on 13 Mar 2019
HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Les canaux anioniques sensibles au gonflement
cellulaire : inhibiteurs, perméabilité, rôle dans la
transition épithéliomésenchymateuse et l’inflammasome
Jonas Friard
To cite this version:
Jonas Friard. Les canaux anioniques sensibles au gonflement cellulaire : inhibiteurs, perméabilité, rôle dans la transition épithéliomésenchymateuse et l’inflammasome. Biologie cellulaire. Université Côte d’Azur, 2018. Français. �NNT : 2018AZUR4093�. �tel-02066673�
Les canaux anioniques sensibles au
gonflement cellulaire
Inhibiteurs, perméabilité, rôle dans la transition
épithélio-mésenchymateuse et l’inflammasome
Jonas FRIARD
Laboratoire de Physiomédecine Moléculaire
LP2M CNRS UMR 7370
Présentée en vue de l’obtention du grade de docteur en Sciences de la Vie et de la Santé de l’Université Côte d’Azur
Dirigée par :
Christophe Duranton Isabelle Rubera
Soutenue le :
23 novembre 2018
Devant le jury, composé de :
Président du jury :
Florian Lesage, DR Inserm, Université Côte d’Azur Rapporteurs :
Frédéric Becq, Pr, Université de Poitiers
François Rassendren, DR CNRS, Université de Montpellier Examinateur :
Valérie Urbach, DR Inserm, Université de Paris Descartes Directeurs de Thèse :
Isabelle Rubera, CR CNRS, Université Côte d’Azur Christophe Duranton, DR CNRS, Université Côte d’Azur
Titre de la thèse :
Les canaux anioniques sensibles au gonflement cellulaire Sous-titre de la thèse :
Inhibiteurs, perméabilité, rôle dans la transition épithélio-mésenchymateuse et l’inflammasome
Mots-clés :
Canaux chlorures, LRRC8/VRAC, glutathion, transition épithélio-mésenchymateuse, inflammasome, inhibiteurs
Résumé :
Les canaux anioniques ont toujours été sous-estimés par rapport aux canaux cationiques principalement en raison des difficultés à caractériser leurs identités moléculaires et par l'absence d'inhibiteurs sélectifs puissants. C’est une classe comportant une grande hétérogénéité et une importante complexité comprenant entre autres le CFTR activé par l’AMP cyclique, les anoctamines activées par le calcium intracellulaire et les canaux VRAC activés lors d’un gonflement cellulaire. L’identité moléculaire d’une protéine essentielle aux courants ioniques déclenchés par le gonflement cellulaire a été découverte en 2014, permettant de pouvoir enfin investiguer le fonctionnement et le rôle de ces canaux.
Dans une première partie, nous avons démontré l’absence de spécificité des inhibiteurs des principaux canaux chlorures. Cette étude met en exergue le besoin de développer de nouveaux inhibiteurs permettant de discriminer les différents canaux chlorures, mais aussi la nécessité de coupler l’approche pharmacologique à une approche génétique.
Dans une deuxième partie, nous avons mis en évidence la perméabilité des canaux anioniques sensibles au gonflement cellulaire au glutathion, principal antioxydant cellulaire. Nos résultats suggèrent donc que les canaux VRAC pourraient être impliqués dans la régulation du stress oxydatif.
Dans la troisième partie de ma thèse, nous avons montré que le facteur de croissance TGFβ1 stimule l’ouverture des canaux anioniques sensibles au gonflement cellulaire. Cette activation s’accompagne d’une perte de glutathion et d’une accumulation intracellulaire d’espèces réactives de l’oxygène. Cette dernière est à l’origine d’une transition épithélio-mésenchymateuse des cellules rénales. L’inhibition pharmacologique ainsi que la répression génétique des canaux VRAC réduit significativement les effets du TGFβ1.
Enfin dans la dernière partie, nous avons caractérisé le rôle des canaux anioniques sensibles au gonflement cellulaire dans la sécrétion de facteurs pro-inflammatoires par les macrophages stimulés par un choc hypotonique. En collaboration, nous avons montré que le blocage de la régulation du volume
cellulaire, sous le contrôle de ces canaux, entraine une inhibition de l’activation de l’inflammasome et donc de la sécrétion des facteurs pro-inflammatoires.
Bien que les mécanismes de signalisation cellulaire restent à déterminer, ces travaux mettent en lumière l’importance des canaux anioniques sensibles au gonflement cellulaire dans la transition épithélio-mésenchymateuse et l’inflammasome. Il apparaît que ces canaux pourraient être des cibles thérapeutiques prometteuses dans un certain nombre de pathologies et qu’il est primordial de poursuivre les investigations dans ce domaine.
Thesis title :
Volume Regulated Anion Channels Thesis sub-title :
Inhibitors, Glutathione permeability, role in epithelial-mesenchymal-transition and inflammasome
Keywords :
Chloride channels, LRRC8/VRAC, glutathione, epithelial-mesenchymal transition, inflammasome, inhibitors
Abstract :
Les canaux anioniques ont toujours été sous-estimés par rapport aux canaux cationiques principalement en raison des difficultés à caractériser leurs identités moléculaires et par l'absence d'inhibiteurs sélectifs puissants. C’est une classe comportant une grande hétérogénéité et une importante complexité comprenant entre autres le CFTR activé par l’AMP cyclique, les anoctamines activées par le calcium intracellulaire et les canaux VRAC activés lors d’un gonflement cellulaire. L’identité moléculaire d’une protéine essentielle aux courants ioniques déclenchés par le gonflement cellulaire a été découverte en 2014, permettant de pouvoir enfin investiguer le fonctionnement et le rôle de ces canaux.
Dans une première partie, nous avons démontré l’absence de spécificité des inhibiteurs des principaux canaux chlorures. Cette étude met en exergue le besoin de développer de nouveaux inhibiteurs permettant de discriminer les différents canaux chlorures, mais aussi la nécessité de coupler l’approche pharmacologique à une approche génétique.
Dans une deuxième partie, nous avons mis en évidence la perméabilité des canaux anioniques sensibles au gonflement cellulaire au glutathion, principal antioxydant cellulaire. Nos résultats suggèrent donc que les canaux VRAC pourraient être impliqués dans la régulation du stress oxydatif.
Dans la troisième partie de ma thèse, nous avons montré que le facteur de croissance TGFβ1 stimule l’ouverture des canaux anioniques sensibles au gonflement cellulaire. Cette activation s’accompagne d’une perte de glutathion et d’une accumulation intracellulaire d’espèces réactives de l’oxygène. Cette dernière est à l’origine d’une transition épithélio-mésenchymateuse des cellules rénales. L’inhibition pharmacologique ainsi que la répression génétique des canaux VRAC réduit significativement les effets du TGFβ1.
Enfin dans la dernière partie, nous avons caractérisé le rôle des canaux anioniques sensibles au gonflement cellulaire dans la sécrétion de facteurs pro-inflammatoires par les macrophages stimulés par un choc hypotonique. En collaboration, nous avons montré que le blocage de la régulation du volume cellulaire, sous le contrôle de ces canaux, entraine une inhibition de l’activation de l’inflammasome et donc de la sécrétion des facteurs pro-inflammatoires.
Bien que les mécanismes de signalisation cellulaire restent à déterminer, ces travaux mettent en lumière l’importance des canaux anioniques sensibles au gonflement cellulaire dans la transition épithélio-mésenchymateuse et l’inflammasome. Il apparaît que ces canaux pourraient être des cibles thérapeutiques prometteuses dans un certain nombre de pathologies et qu’il est primordial de poursuivre les investigations dans ce domaine.
« C’est ce que nous pensons déjà connaître qui nous
empêche souvent d’apprendre »
Avant-propos
Lorsque je me suis présenté au laboratoire de physiomédecine moléculaire (LP2M), au mois de juillet 2015 pour préparer mon entretien de sélection, Christophe m’a dit que la thèse était comme un marathon et qu’il était important de veiller à ne pas s’essouffler. J’étais motivé et j’avais bien travaillé le sujet. J’aimais l’électrophysiologie et je savais dans quoi je m’engageais. Du moins c’est ce que je pensais à cette époque. Ce n’est que plus tard que j’ai réalisé ce que Christophe voulait dire en comparant la thèse à un marathon.
A l’origine, mes recherches devaient s’orienter autour de deux axes majeurs avec comme point commun un canal qui venait d’être identifié après plus de vingt ans d’investigation. Le premier axe était la caractérisation du rôle de ce nouveau canal dans la transition épithélio-mésenchymateuse. Isabelle, ma co-encadrante de thèse, avait déjà obtenu quelques données encourageantes sur cette partie. Le second axe de recherche était plus éloigné des compétences de mon équipe et reposait sur un travail collaboratif avec une autre équipe du laboratoire. Il s’agissait de déterminer le rôle du canal dans l’activation des lymphocytes T.
La lecture de certaines thèses donne l’impression que l’auteur a suivi un chemin direct, consistant en une succession d’obstacles plus ou moins complexes à franchir. Je tiens à prévenir mes lecteurs que mon travail n’a pas suivi un tel chemin. Lors de mon marathon, j’ai dû marquer de nombreux arrêts, parfois en raison d’obstacles difficiles à franchir, parfois pour explorer d’autres chemins et parfois pour aider d’autres coureurs à franchir leurs obstacles.
Ainsi, la première partie de ma thèse se porte sur le manque de spécificité des inhibiteurs des canaux chlorures. Bien que moins original et sans doute moins intéressant que le reste de mes recherches, ce travail fut l’occasion d’encadrer une stagiaire et de lui transmettre mon savoir-faire. De plus, ce fut aussi une grande opportunité pour moi étant donné que cela m’a permis d’écrire mon premier article scientifique et d’être publié.
La deuxième et la troisième partie de ma thèse pourraient former un ensemble, comme sur l’article actuellement en soumission. Cependant, j’ai fait le choix de les séparer dans un souci de clarté mais aussi pour introduire d’autres données que j’ai obtenues. Dans la deuxième partie, sur la perméabilité du canal, j’aborde principalement le transport du glutathion qui pourrait être responsable des effets observés dans la troisième partie sur la transition épithélio-mésenchymateuse. Toutefois, il me semblait important de m’attarder sur le fait que ce transport est unidirectionnel et d’en proposer une explication. J’ai aussi ajouté les résultats sur la perméabilité du canal à l’ATP que j’ai obtenus dans le cadre d’une collaboration. Je dois confesser avoir hâte de voir la publication de mes recherches sur la
perméabilité au glutathion. Ce travail m’a passionné dès le début de ma thèse et la plupart des figures de cette partie datent de 2016.
La troisième partie a connu de nombreux rebondissements. Nous avions rapidement identifié le fait que la stimulation au TGFβ1 entraînait une surexpression de LRRC8A et une augmentation du courant chlorure correspondant en 24 heures. Cependant, nous avions raté l’activation aiguë du canal car nous n’avions pas observé de changement de volume dans ces conditions. En dehors de quelques données, il nous manquait des résultats concluants sur la fonctionnalité de notre modèle de transition épithélio-mésenchymateuse. De nombreuses tentatives d’invasion en chambre de Boyden donnant lieu à un échec technique faillit mettre un terme au projet. Il faut dire qu’Isabelle était débordée entre ses autres projets et ses aller-retours incessants pour les commissions d’évaluation CNRS et que ce projet qui s’éternisait avait tout pour nous démotiver. La thèse est un marathon et il est important de ne pas s’essouffler… Nous avons pu surmonter toutes ces épreuves, ainsi que celles qui se sont présentées par la suite. Dans la vie, il faut parfois se faire violence pour avancer, et c’est ce que nous avons fait. J’ai même réalisé une série de western blot. Anodin ? Après un stage de 6 mois en master à rater des western blot, cela fut tout de même une épreuve pour moi. Et une grande victoire.
La quatrième et dernière partie porte sur mes travaux collaboratifs quant au rôle du canal dans les mécanismes inflammatoires. Au début de ma thèse, j’ai commencé à m’intéresser au canal VRAC et à son rôle dans l’activation des lymphocytes T. Après la caractérisation des courants ioniques présents dans ces cellules, activées et non activées, je devais dans un premier temps confirmer les résultats préliminaires obtenus par un stagiaire en collaboration avec l’équipe d’immunologie de notre laboratoire. Au vu des données de la littérature, il apparaît que le canal VRAC joue un rôle primordial dans le développement et l’activation lymphocytaire. J’espère que ces travaux pourront être repris après mon départ. Si l’histoire s’arrêtait là, je ne l’aurais sans doute même pas mentionnée. Mais j’ai eu l’occasion dans le cadre d’un congrès du LabEx ICST (Ion Channel Science and Therapeutics) de présenter ces ébauches de travaux. Il se trouve que mes résultats ont trouvé résonnance dans l’esprit d’un chercheur présent à ce congrès. Vincent avait trouvé que l’inhibition d’un canal chlorure impliqué dans la régulation du volume réduisait l’activation de l’inflammasome. C’est par ce biais que j’ai pu travailler de nouveau sur le système immunitaire, non plus sur les lymphocytes T mais sur les macrophages. La plupart des résultats présentés dans cette dernière partie ont été réalisés par l’équipe de Vincent à Montpellier car les expériences que j’ai menées n'ont malheureusement donné que peu de résultats.
Enfin, à la fin de mon manuscrit figurent quatre annexes. La première présente mes travaux dans le cadre d’un projet pour l’association « Vaincre La Mucoviscidose ». Il s’agit d’un travail similaire à ce que j’avais déjà réalisé pour d’autres projets, à savoir le calcul de la perméabilité du canal CFTR pour le glutathion en présence de potentiateurs en condition physiologique et pathologique. Je n’ai
malheureusement eu le temps de faire les mesures qu’en condition physiologique. J’ai pu encadrer deux stagiaires sur ce projet, ce qui m’a permis de réaliser que j’aimais transmettre. La deuxième annexe est l’introduction à un article scientifique que j’ai co-écris avec Christophe et Isabelle pour « Journal of Physiology ». L’article que nous avons mis en perspective pouvait expliquer certains résultats que nous avions obtenus à l’époque. La troisième annexe présente une figure que j’ai réalisée lors d’une collaboration avec des immunologistes parisiens. Cette collaboration a été une véritable aubaine pour moi bien que je n’aie eu qu’un rôle de technicien pour ce travail. En effet, la publication dans JACC, un journal au facteur d’impact de 16.8 a récompensé ce travail de quelques jours. Pour finir, la dernière annexe présente une partie de mes résultats, fruits d’une collaboration avec une équipe du laboratoire voisin (IRCAN). Le but initial de cette collaboration était d’enregistrer des courants calciques dans des cellules cancéreuses. Après de nombreuses tentatives infructueuses, nous avons décidé d’enregistrer le potentiel membranaire des cellules, ce qui est directement corrélé au calcium intracellulaire. J’ai pu obtenir des résultats très intéressants et les nombreux échanges que j’ai eus lors de cette collaboration m’ont beaucoup apporté sur le plan personnel. En raison de la complexité de l’histoire et du nombre impressionnant de données, ces résultats n’ont pas été publiés avec l’article dans « Cancer Research ». Cette collaboration m’a aussi permis de valider ma formation d’expérimentation animale et d’aider Héloïse sur ses modèles de xénogreffes.
Avant de vous laisser poursuivre la lecture de mon manuscrit, je tenais à faire le bilan de ces trois années de thèse d’un point de vue personnel, à la manière d’un marathonien qui se remémore son parcours quelques centaines de mètre avant la fin de la course pour se donner le courage de la finir. Tout d’abord, il y a l’évidence, la recherche et son processus, les expérimentations et les heures passées devant mon poste de patch-clamp… le plaisir de la paillasse ! Mais ce n’est pas tout, ce que j’ai préféré, ce sont les échanges scientifiques, lors de congrès scientifiques, lors de collaborations mais aussi avec les autres doctorants et chercheurs. Je me suis aussi découvert une fibre pour la transmission et l’encadrement. Ce n’est pas étonnant si j’ai pu apprécier les formations de management proposées par l’école doctorale. J’ai pu essayer d’appliquer ce que j’y ai appris avec mes stagiaires, mais cela m’a aussi permis de changer ma méthode de travail pour davantage d’efficacité, notamment à travers les objectifs SMART (Spécifique, Mesurable, Accessible, Réaliste, Temporel). La thèse est une dualité entre formation et emploi professionnel qu’il est parfois difficile d’appréhender, mais j’ai pu en tirer de nombreux enseignements et je vous laisse le soin de juger ma contribution scientifique.
Sun Tzu a écrit que « celui qui n’a pas d’objectifs ne risque pas de les atteindre ». Je pense que la plus grande difficulté que j’ai rencontrée a été de ne pas perdre mes objectifs de vue en dépit du nombre de projets différents sur lequels je travaillais. J’espère que la lecture de mon manuscrit sera tout de même agréable car en dépit d’un parcours tumultueux, j’ai pris plaisir à suivre le chemin de la curiosité et de la découverte.
« La reconnaissance est la mémoire du cœur »
Hans Christian Andersen
Tout d’abord, j’aimerais remercier l’ensemble des membres du jury pour l’attention que vous allez porter sur ma thèse et pour votre présence le jour de ma soutenance. Je tiens à remercier particulièrement Florien Lesage qui était là pour mon audition et qui m’a donné l’opportunité de m’épanouir dans le cadre du LabEx ICST. Je tiens aussi à faire part à Frédéric Becq de ma gratitude pour son enseignement sur les canaux chlorures. J’espère être à la hauteur.
Je tiens ensuite à remercier Jacques Barhanin pour son accueil au laboratoire, mais aussi pour ses nombreux conseils sur le plan scientifique comme professionnel. J’ai pu apprendre beaucoup pendant ma thèse et nos discussions scientifiques et tes retours sur mes expériences en sont pour beaucoup. Dommage que notre histoire sur TASK n’ait rien donné d’intéressant, mais ça a été un plaisir de travailler avec toi.
Christophe, Isabelle… Merci ! Tout d’abord merci de m’avoir pris sous votre aile, malgré les risques que cela comportait. Merci pour votre confiance. Merci pour votre encadrement, votre bonne humeur, l’esprit de famille que vous insufflez à l’équipe. Les relations entre un doctorant et ses encadrants peuvent parfois être compliquées. Pourtant vous avez su être justes dans votre encadrement, tout en me considérant comme un collaborateur. Vous avez su trouver un équilibre entre autonomie et guidage, me laissant du temps pour trouver et réaliser des collaborations tout en avançant sur mon projet. Vous m’avez fait confiance et laissé beaucoup de liberté tout en me divulguant de nombreux conseils. La liste de ce que je vous dois est longue, et plutôt qu’un long discours, j’ai choisi la citation d’Andersen pour vous.
Je tiens aussi à remercier le reste de l’équipe, Michel, Marc, Georges et Alain. Michel, merci pour ta bienveillance, ton écoute, tes nombreux conseils et tes enseignements. J’ai réellement beaucoup appris à tes côtés ! Tes solides connaissances ont pu faire avancer mes projets et nous avons résolu quelques problèmes ensemble. Mais je te remercie aussi pour ton humanité, pour ces longues discussions à refaire le monde et surtout pour tous ces échanges autour du voyage. Marc, c’était très agréable de travailler à tes côtés. J’espère qu’avant mon départ nous aurons le temps de faire un pot avec ces biscuits apéro horribles qui viennent de Chine et que tu aimes tant ! Merci aussi à Georges pour 1) tes prescriptions médicales et consultations 2) ton positivisme scientifique 3) le surplus d’énergie que tu donnes à tout le monde 4) le congrès de la FEPS à Vienne.
Mes remerciements s’étendent naturellement à tout le personnel du laboratoire. En particulier, je tiens à remercier Noëlle pour son accueil chaleureux, Annie pour ses longues discussions et Matthieu
pour sa disponibilité et sa bonne humeur. Mes pensées vont aussi à Marie-Pierre qui malheureusement ne lira jamais ces remerciements. Etonnamment, elle était l’équilibre du laboratoire.
Je tiens aussi à remercier les jeunes du laboratoire avec qui j’ai passé de très bons moments. Vous êtes bien plus que des collègues ! Auréa, ne m’oublie pas quand tu seras présidente de l’univers ! J’espère que l’on se recroisera un jour, peut-être à l’autre bout de la planète. Maria, on a bien rigolé. On aurait dû enregistrer notre clip. Enfin tout n’est pas perdu, ce sera pour plus tard ! Suyash, merci pour ta cuisine épicée et ton grain de folie. C’était un plaisir de t’apprendre le patch-clamp ! Julia, je sais que je vais te manquer. Thomas, ne baisse pas les bras, tu es trop bon pour ça ! Il ne reste plus trop de temps mais je suis toujours disponible pour un cours de boxe… Antoine, on ira nager ensemble un de ces jours ! C’était un plaisir de te rencontrer. Romain, heureusement que tu es là pour sauver des vies. Ne perds pas trop de temps à lire les remerciements, chaque seconde compte ! Audrey, c’était un véritable plaisir de travailler avec toi. Tu es une personne super. Profite bien de chaque instant et fais-moi rêver avec les photos de tes voyages ! Alain, on a bien rigolé, on a bien fait la révolution, on a bien travaillé, dans le bruit et la bonne humeur !
J’ai passé aussi de très bons moments avec de nombreux intervenants de la tour Pasteur. C’était un plaisir d’échanger autour de quelques pauses café avec Didier et Cecilia. Les réunions de doctorants ont été l’occasion de grandir tous ensemble. Je ne peux pas remercier tout le monde mais je ne vous oublie pas. Lucile, Margot, Julian et Lucas, bon courage pour la suite ! Héloïse, c’était un plaisir de travailler avec toi. C’était une bonne collaboration, on remet ça quand tu veux ! Je remercie Roxane et Jean-Baptiste pour m’avoir fait souffrir à ma pause de midi. Combien de squats, combien de pompes ? La tour Pasteur est un super environnement de travail.
Julien, Alain, Pape, Héloïse et toute l’équipe du Kali, merci à vous ! Le travail est important mais sans le kali pour se défouler, ça n’aurait pas pu aussi bien avancer. Je sais que vous savez ce que je sais donc je ne vais pas en écrire beaucoup davantage. Merci…
Maintenant, je voudrais aussi remercier le corps enseignant de l’université de Poitiers pour leur formation. C’est auprès d’eux qu’est né ma passion pour la recherche et l’électrophysiologie. Je tiens à remercier tout particulièrement Patrick Bois, Aurélien Chatelier, Jean-François Faivre, Jocelyn Bescond, Frédéric Becq, Laurent Cronier, Paule Seité et bien sûr Marc Mesnil. Ma thèse n’a duré que trois ans mais le parcours pour en arriver là est bien plus long.
Pour tenir ce marathon qu’est la thèse, il est nécessaire d’avoir de bons ravitaillements. Je remercie sincèrement mes amis et ma famille pour avoir accompagné mon parcours pendant toutes ces années. Il y a les amis que j’ai rencontrés sur le chemin, et que j’ai déjà remerciés, comme Julien, Pape, Héloise, Auréa, Maria, Simon, Alain, etc. Mais il y aussi ceux qui était présents avant. Merci Emy et Jérôme pour votre soutien. C’était un vrai plaisir de vous retrouver après ces quelques années. Merci aussi à toi Alizée pour ton soutien et l’organisation de cette superbe journée au début de l’été 2018.
Un grand merci à toute la famille de Victoria, pour leur soutien, leurs encouragements et toutes ces journées passées ensemble. Anthony et Cie, merci de nous avoir accueillis en Chine. Le retour de vacances a été difficile mais c’était un minutage parfait. Nicholas et Cie, promis plus de trampoline juste avant de devoir écrire ma thèse. Bon cependant je ne suis pas contre une sangria… Chris et Cie, rendez-vous prochainement pour notre jeu d’évasion annuel. Et quelques margaritas aussi, avec beaucoup de citrons ! Bob et Marie-Hélène, un grand merci à vous ! J’espère être toujours à la hauteur du tee-shirt que vous m’avez offert cet été.
Je tiens à remercier mes grands-parents Marie-Thérèse, Annie et Pierre pour leur soutien indéfectible et leur écoute. Pour cela, je peux aussi compter sur mes parents, Papa, Maman et Françoise. Je vous remercie du fond du cœur pour votre implication dans ma vie, votre aide et votre amour. Un grand merci pour tout. Et un grand merci aussi pour le reste !
Elles ont aussi toujours été un soutien pour moi, écoutant mes coups de gueule, supportant mes plaintes, mais aussi riant avec moi. Je parle bien sûr de mes deux sœurs Bibi et Anne-Laure. Merci d’avoir toujours été là pour moi.
Enfin, je voudrais te remercier toi, Victoria. Tous les jours, tu te tiens à mes côtés. Tu m’écoutes patiemment, tu me soutiens dans les épreuves, tu me portes dans les difficultés, tu es ma joie et la raison de mon sourire. Tu vas chercher le soleil quand dans nos vies il fait gris, et tu es ma canne quand j’ai du mal à marcher. Tu m’as accompagné jusqu’ici en m’accordant ta confiance et ton amour. Merci pour ton aide tout au long de ma thèse, merci pour tes conseils, merci pour ta patience, merci pour tes relectures et corrections. Mes mots ne sont pas à la hauteur de mes sentiments.
L’amour est un phare guidant le voyageur perdu vers de meilleurs horizons, En cette nuit sombre, les vagues ondulant sous mon navire reflète ton visage, Seul je me tiens debout sur le pont, mais mille et une étoiles veillent au diapason.
Oh déesse, les caresses du vent me porteront toujours vers ton blanc rivage.
T
ABLE DES MATIERES
Table des illustrations ... 1
Introduction ... 3
VRAC: Volume Regulated Anion Channels ... 6
Introduction ... 6
Caractéristiques biophysiques ... 6
Processus de réduction du volume cellulaire ... 7
Mécanismes d’activation ... 9
Rôle du calcium et de l’adénosine triphosphate ... 9
Inhibiteurs ... 10
Tentatives d’identification ... 11
Identification moléculaire ... 12
LRRC8 : une famille de canaux hétéromériques ... 13
Structure du canal ... 14
Physiopathologies associées aux LRRC8 ... 17
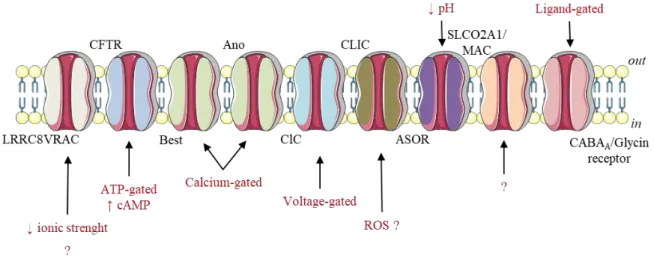
Les autres canaux chlorures ... 18
CFTR ... 18 CaCC ... 20 ClC ... 21 CLIC ... 21 GABAA/Glycine ... 22 ASOR ... 22 MAC ... 22
Le stress oxydatif et le rôle du glutathion ... 23
Les espèces dérivées de l’oxygène ... 24
Production des espèces dérivées de l’oxygène ... 25
Modifications induites par les ROS ... 27
Voies de signalisation activées par les ROS ... 28
Antioxydants et maintien de l’équilibre du potentiel oxydo-réducteur ... 28
Le Glutathion ... 29
Le transport du glutathion ... 30
La transition épithélio-mésenchymateuse ... 32
Rôle de la transition épithélio-mésenchymateuse ... 32
EMT et fibrose rénale ... 34
Induction par le TGFβ1 ... 34
Résultats ... 38
Partie I ... 42
Pharmacologie des canaux chlorures ... 42
Partie II ... 60
Perméabilité au glutathion ... 60
Résultats ... 63
Choc hypotonique, régulation du volume et perte du glutathion intracellulaire ... 63
Perméabilité au glutathion du LRRC8/VRAC ... 65
Inhibition du VRAC par le glutathion ... 68
Perméabilité à l’ATP ... 70
Discussion ... 70
Partie III ... 74
VRAC et la Transition Epithelio-Mésenchymateuse ... 74
Résultats ... 76
Activation de VRAC par le TGFβ1 ... 76
Diminution du GSHi et accumulation des ROS ... 77
Inhibition de VRAC ... 78
Inhibition de l’EMT induite par le TGFβ1 en ciblant VRAC ... 79
Boucle d’amplification potentielle du mécanisme ... 83
Origine des espèces réactives dérivées de l’oxygène ... 83
Discussion ... 84
Partie IV ... 88
VRAC et le système immunitaire ... 88
Introduction ... 90
Inflammation et macrophages ... 90
Inflammasome NRLP3 ... 90
Résultats préliminaires obtenus par le Dr Vincent Compan ... 91
Résultats ... 92
LRRC8/VRAC dans les macrophages ... 92
Effets de l’inhibition du VRAC ... 94
Discussion ... 95 Conclusion ... 98 Perspectives ... 106 Matériels et méthodes ... 110 Culture cellulaire ... 112 HEK293 ... 112 HK2 ... 112
Extinction par siRNA ... 112 BMDM ... 112 RT-qPCR ... 112 Amorces... 113 Western blot ... 113 Immunofluorescence ... 113 Volume cellulaire ... 114 Electrophysiologie ... 114 Patch-clamp ... 114
Correction du potentiel de jonction liquide ... 115
Calcul de la perméabilité relative ... 115
Glutathion intracellulaire ... 115
Cinétique avec le CMFDA ... 115
Quantitatif avec l’OPA ... 116
Espèces réactives de l’oxygène ... 116
Calcium cytosolique ... 116
Concentration ionique intracellulaire ... 116
ATP extracellulaire ... 117 Morphologie cellulaire ... 117 Test de toxicité ... 117 Test de la blessure ... 117 Sphéroïdes ... 118 Statistiques ... 118 Annexes ... 120 Annexe I ... 122 Annexe II ... 126 Annexe III ... 130 Annexe IV ... 134 Annexe V ... 142 Curriculum Vitae ... 143 Formation : ... 143 Stages : ... 143
Formations complémentaires au doctorat : ... 143
Congrès :... 144
1
T
ABLE DES ILLUSTRATIONS
Figure 1. Propriétés biophysique du canal anionique sensible au gonflement cellulaire. ... 7
Figure 2 Régulation du volume cellulaire consécutive à un choc hypotonique. ... 8
Figure 3 Structures des inhibiteurs du canal anionique sensible au gonflement cellulaire. ... 11
Figure 4 LRRC8A est nécessaire pour le canal anionique sensible au gonflement cellulaire. ... 13
Figure 5 Structure des LRRC8 avec 4 domaines transmembranaires et un domaine LRR C-terminale. ... 14
Figure 6 Structure de l'homohéxamère formé par LRRC8A. ... 16
Figure 7 Structure et mécanisme d'activation du CFTR. ... 18
Figure 8 Courants CFTR déclenchés par de la forskoline et la génistéine ... 19
Figure 9 TMEM16A : courants chlorures, structures du canal et activation par le calcium. ... 21
Figure 10 Les canaux chlorures de la membrane plasmique et leurs mécanismes d'activation ... 23
Figure 11 Le stress oxydatif. ... 24
Figure 12 Espèces réactives dérivées de l'oxygène. ... 25
Figure 13 La phosphorylation oxydative et la production d'ATP. ... 26
Figure 14 Modification post-traductionnelle par les ROS... 27
Figure 15 Cycle du glutathion. ... 30
Figure 16 Diminution du glutathion intracellulaire en condition hypotonique.. ... 64
Figure 17 Courants et perméabilité du VRAC au glutathion.. ... 66
Figure 18 Courants et perméabilité du VRAC au glutathion des cellules HK2.. ... 67
Figure 19 comparaison des LRRC8/VRAC des cellules HEK293 sauvages et des HK2 ... 68
Figure 20 Inhibition du VRAC par le glutathion extracellulaire. ... 69
Figure 21 Perméabilité du VRAC au glutamate des HEK293. ... 70
Figure 22 Variation de la concentration d'ATP extracellulaire consécutive à un choc hypotonique. ... 70
Figure 23 Activation du VRAC par le TGFβ1.. ... 76
Figure 24 Volume cellulaire et concentration du chlorure et du potassium intracellulaire. ... 77
Figure 25 Variation du glutathion intracellulaire et des ROS après traitement au TGFβ1. ... 77
Figure 26 Extinction du LRRC8A et toxicité du DCPIB sur les HK2. ... 78
Figure 27 Induction des marqueurs de l'EMT par le TGFβ1 sur les cellules HK2. ... 80
Figure 28 Analyse morphologique des HK2 ... 81
Figure 29 Propriétés migratoires et invasives des cellules HK2. ... 82
Figure 30 Amplification du VRAC induite par le TGFβ1... 83
Figure 31 Modulation de l’expression des marqueurs de l'EMT par l'inhibition des ROS.. ... 84
Figure 32 Schéma représentant le rôle du LRRC8/VRAC dans l'EMT. ... 85
Figure 33 Inflammasome NLRP3. ... 90
Figure 34 LRRC8/VRAC et l’inflammasome NLRP3. ... 92
Figure 35 Expression et fonctionnalité du LRRC8/VRAC dans les BMDM. ... 93
Figure 36 Régulation du volume et variation des concentrations ioniques intracellulaires. ... 94
Figure 37 Variation du glutathion intracellulaire entrainée par l'ivacaftor dans les cellules 16HBE. . 123
Figure 38 Perméabilité du CFTR au chlorure et au glutathion en présence d'ivacaftor. ... 124
Figure 39 Variation du calcium cytosolique dans les lymphocytes T CD4+ ... 127
Figure 40 Calcium cytosolique dans le SCC. ... 131
Figure 41 Potentiel de membrane des SCC traitées à l'EGF selon la dureté de la matrice extracellulaire. ... 132
Figure 42 Modèle de progression tumorale avec durcissement de la matrice extracellulaire. ... 132
3
I
NTRODUCTION
5 Pendant des années l’étude des canaux anioniques a été négligée au profit de celle des canaux cationiques, principalement en raison du rôle de ces derniers dans la régulation des potentiels d’action. L’ion chlorure est l’anion majoritaire avec le bicarbonate. La concentration de chlorure extracellulaire est d’environ 120mM tandis que la concentration intracellulaire est assez variable selon les types cellulaires et généralement le potentiel d’équilibre du chlorure est proche du potentiel de repos des cellules (Jentsch and Pusch, 2018). Il a longtemps été considéré que le chlorure diffusait librement à travers la membrane cellulaire en fonction du potentiel membranaire. Aujourd’hui, de nombreux canaux chlorures ont été identifiés et clonés, et leur rôle physiopathologique ne peut plus être ignoré.
La direction du transport des ions chlorures à travers un canal anionique est souvent difficile à appréhender. Tandis que les ions potassiques sont généralement transportés vers le milieu extracellulaire, les ions chlorures peuvent entrer ou sortir de la cellule selon leur potentiel d’équilibre électrochimique et le potentiel membranaire de la cellule (souvent ces potentiels sont proches). Néanmoins, on peut considérer que l’ouverture d’un canal chlorure dans une cellule dont le potentiel de repos est régulé par des canaux potassiques a un effet dépolarisant correspondant à un efflux de chlorure. A l’inverse, l’apparition d’une conductance chlorure tend à repolariser une cellule dépolarisée, ce qui correspond à un influx de chlorure. Les canaux chlorures interviennent donc dans le maintien du potentiel de repos et le contrôle de l’excitabilité cellulaire. En plus de leur participation au potentiel membranaire, les canaux chlorures jouent un rôle majeur dans la modulation du pH, dans la sécrétion des fluides des glandes sécrétrices mais aussi dans les transports transépithéliaux (Jentsch et al., 2002).
Les canaux chlorures sont constitués d’un ensemble hétérogène de protéines et sont régulés par divers mécanismes. Certains, par exemple, sont sensibles aux potentiels membranaires, d’autres sont activés par une augmentation de l’ATP intracellulaire tandis que d’autres encore sont activés en cas de gonflement cellulaire. Les stimuli sont nombreux et les canaux chlorures sont en réalité finement régulés. Les canaux chlorures sont décrits comme étant perméables à de petits anions tels que l’iodure ou le bicarbonate sans grande discrimination, et peuvent aussi être perméables à de petits acides organiques tels que le lactate ou l’aspartate.
Ces différentes familles, leurs régulations et leurs fonctions seront décrites plus en détails dans la suite de cette introduction, qui commence, dans un premier temps, par la description historique de la conductance des canaux anioniques sensibles au gonflement cellulaire (VRAC pour Volume Regulated Anion Channel) et l’indentification moléculaire de la famille des canaux LRRC8 (Leucin Rich Repeat Containing 8). L’introduction se poursuit ensuite par une description du stress oxydatif et de la transition épithélio-mésenchymateuse, deux sujets nécessaires pour la compréhension du rôle du LRRC8/VRAC développé lors de ma thèse.
6
VRAC: Volume Regulated Anion Channels
Introduction
Dès les années 1980, différentes équipes de recherche mettent en évidence l’existence d’une augmentation d’une conductance anionique consécutive à un gonflement cellulaire. Ces observations, originellement décrites pour des cellules cancéreuses d’ascites et pour des lymphocytes (Grinstein et al., 1982; Hoffmann et al., 1979), ont pu être reproduites dans tous les types cellulaires de mammifère et ont permis de mettre en évidence les caractéristiques biophysiques d’un canal ionique communément appelé VRAC, dont l’identité moléculaire demeura un mystère pendant plus de trente ans (Pedersen et al., 2015).
Caractéristiques biophysiques
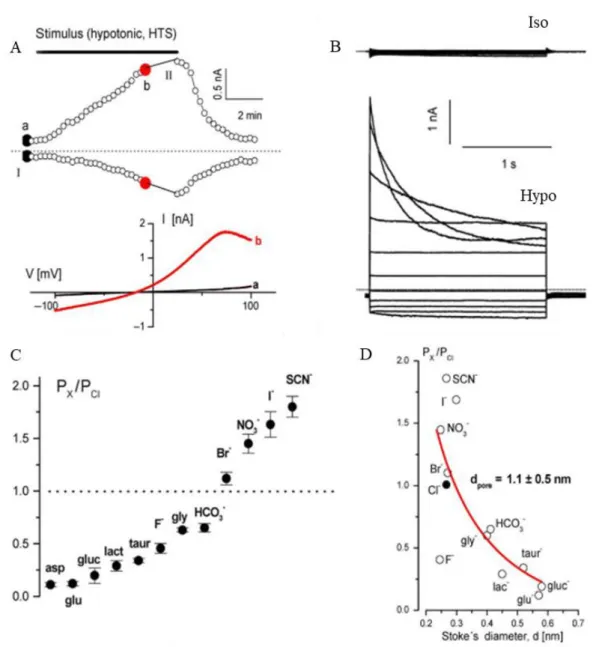
Bien que de nombreuses propriétés semblent légèrement différer d’un type cellulaire à l’autre, il est admis que le canal VRAC est caractérisé par un courant anionique activé par le gonflement de la cellule, déclenché expérimentalement par une exposition à un milieu hypotonique. Cette conductance est généralement nulle en milieu isotonique, augmente lentement en condition hypotonique ou dans le cas d’une diminution de la force ionique intracellulaire, et est inhibée par des milieux hypertoniques (Pedersen et al., 2016). Le courant présente une faible rectification sortante, une inactivation pour les potentiels positifs et une sélectivité suivant la séquence I d’Eisenman, étant plus perméable aux iodures qu’aux chlorures (I-> NO3-> Br-> Cl-> F-).
7
Figure 1. Propriétés biophysique du canal anionique sensible au gonflement cellulaire. A) Activation du canal par un choc
hypotonique. B) Profil du courant. C) Séquence de perméabilité du VRAC. D) Relation entre la perméabilité du canal et le diamètre des anions perméants.(Pedersen et al., 2016)
Processus de réduction du volume cellulaire
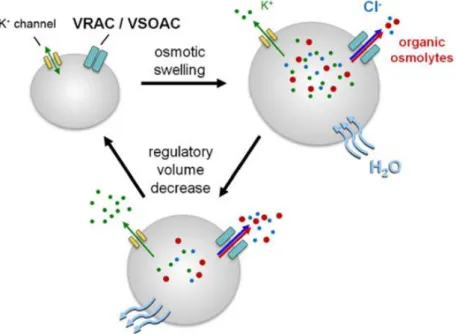
La participation des canaux chlorures dans la régulation du volume cellulaire est particulièrement mise en évidence à travers deux mécanismes appelés « réduction régulée du volume » (RVD : Regulatory Volume Decrease) consécutive à un choc hypotonique et « réduction apoptotique du volume » (AVD : Apoptotic Volume Decrease) lors du phénomène de mort cellulaire par apoptose (Okada and Maeno, 2001). L’exposition d’une cellule à un milieu hypotonique entraine une rapide entrée d’eau dans la cellule à l’origine d’un gonflement cellulaire. L’augmentation du volume est perçue comme un stress diminuant le fonctionnement cellulaire physiologique. Une perte d’osmolytes va permettre à la cellule d’ajuster son osmolarité pour réduire son volume afin de maintenir une certaine homéostasie cellulaire. Cette réduction fait intervenir des canaux potassiques, mais aussi des canaux chlorures, principalement les canaux VRAC. L’efflux d’électrolytes entraine une sortie d’eau et donc
8 une diminution du volume cellulaire, permettant à la cellule de s’adapter au milieu extracellulaire. Une augmentation du métabolisme cellulaire résulte en un accroissement de l’osmolarité intracellulaire, entrainant aussi un gonflement cellulaire. La réduction régulée du volume permet à la cellule de retrouver son volume physiologique.
Figure 2 Régulation du volume cellulaire consécutive à un choc hypotonique. (Jentsch, 2016)
L’apoptose est un programme de mort cellulaire caractérisé par une condensation nucléaire, une fragmentation de l’ADN et la formation de corps apoptotiques. La formation de ces petits corps permet probablement leur phagocytose par les cellules voisines ou les macrophages. Ainsi, l’apoptose est une mort cellulaire limitant la toxicité induite par la libération des composants intracellulaires dans le milieu extracellulaire. L’AVD n’est pas précédée par un gonflement cellulaire mais son mécanisme est proche de celui impliqué dans la RVD. L’activation de canaux VRAC entraine l’efflux d’ions chlorures et de petits osmolytes, conduisant à un efflux d’eau et donc à une diminution du volume. La réduction du volume cellulaire est nécessaire à la formation des corps apoptotiques. Sans cette réduction du volume, les cellules ne peuvent mourir par apoptose et se nécrosent, libérant de nombreux facteurs pro-inflammatoires dans le milieu extracellulaire (Bortner and Cidlowski, 2002; Maeno et al., 2000).
La régulation du volume s’accompagne d’un efflux d’osmolytes intracellulaires tels que la taurine, le lactate et le glutamate, conduisant à un efflux secondaire d’eau (Hoffmann et al., 2009; Jentsch, 2016). De nombreuses études ont proposé que cet efflux d’osmolytes soit aussi médié par le VRAC, bien que la communauté scientifique diverge sur ce point en raison d’une différence de régulation et de pharmacologie de ces deux transports. Cette controverse est à l’origine de la seconde appellation du VRAC : VSOAC pour Volume-Sensitive organic Osmolytes/Anion Channel (Pedersen et al., 2016).
9
Mécanismes d’activation
Les mécanismes d’activation et d’inactivation du VRAC sont peu compris. L’ouverture du canal est traditionnellement stimulée par un choc hypotonique qui entraine dans un premier temps le gonflement cellulaire. L’activation du pool complet des VRAC membranaires n’est pas immédiate et nécessite quelques minutes, tandis que le gonflement cellulaire est généralement maximum en moins de deux minutes. Cette différence dans les cinétiques suggère que le canal n’est pas sensible à l’étirement de la membrane, ce qui a été démontré dans de nombreuses études. Divers mécanismes d’activation ont été proposés mais le plus réaliste semble être que le VRAC agit comme un senseur de la force ionique intracellulaire (Nilius et al., 1998; Sabirov et al., 2000; Voets et al., 1999). Cette hypothèse est appuyée par les récents travaux de l’équipe de Patapoutian montrant l’ouverture de certains canaux VRAC (voir paragraphe LRRC8) en courant unitaire par des variations de la force ionique sans variation de volume (Syeda et al., 2016). Ces résultats restent à confirmer mais pourraient expliquer certaines données contradictoires de la littérature. Une telle hypothèse pourrait expliquer l’activation du VRAC dans la réduction du volume en cas d’apoptose, non précédée par un gonflement cellulaire. Lors d’un choc hypotonique, la pression osmotique peut changer, a priori sans variation des concentrations ioniques. Cependant, l’entrée d’eau dans la cellule provoquant le gonflement cellulaire est à l’origine d’une dilution des ions intracellulaires, et donc d’une diminution de la force ionique (Emma et al., 1997; Strange, 1994). De nombreuses études ont montré que l’activation d’autres canaux chlorures étaient nécessaires à l’activation du VRAC (Barrière et al., 2003; Benedetto et al., 2016; Juul et al., 2014; Milenkovic et al., 2015).
Rôle du calcium et de l’adénosine triphosphate
Il est généralement admis que le VRAC est non dépendant du calcium car l’enregistrement des courants unitaires du VRAC peut se faire en l’absence de calcium (Kubo and Okada, 1992; Nilius et al., 1994). De plus, les courants macroscopiques sont enregistrés en présence d’EGTA, chélateur du calcium cytosolique. Cependant, de nombreuses études ont montré que le BAPTA, chélateur du calcium cytosolique et sous-membranaire, empêche l’activation du VRAC et la régulation du volume cellulaire consécutives à un choc hypotonique (Akita et al., 2011; Akita and Okada, 2011; Ponomarchuk et al., 2016; Rubera et al., 1997). Il semblerait que l’activation du VRAC puisse dépendre de la présence très localisée de calcium sous-membranaire.
L’activation du VRAC requiert de l’ATP intracellulaire, sans nécessiter son hydrolyse (Nilius et al., 1997). En effet, le VRAC peut être activé en présence d’analogues non hydrolysables tels que l’ATPγS (Bryan-Sisneros et al., 2000). Le rôle de l’ATP sur le fonctionnement du canal reste peu compris.
10
Inhibiteurs
Historiquement, les premiers bloqueurs des canaux chlorures, tels que le DIDS (4,4'-Diisothiocyano-2,2'-stilbenedisulfonic acid), le SITS (4-acetamido-4'-isothiocyanatostilbene-2,2'-disulfonic acid), le 9-AC (9-anthracenecarboxylic acid) et le DPC (Diphenylamine-2-carboxylic acid) présentent une faible affinité pour le VRAC (Nilius et al., 1997). Leur efficacité à bloquer le courant chlorure activé par le gonflement cellulaire reste limité et diffère sensiblement d’un type cellulaire à l’autre. Cette variabilité a permis de spéculer sur l’existence non pas d’une unique entité moléculaire mais de différents types de canaux anioniques sensibles aux gonflements cellulaires.
D’autres substances telles que le NPPB (5-nitro-2-(3-phenylpropyl-amino) benzoic acid), le FFA (flufenamic acid) et le NFA (niflumic acid) inhibent le VRAC avec des concentrations de demi inhibition (IC50) comprises entre la micro- et la milli-molaire, en fonction du type cellulaire. Ils ont été
pendant de longues années considérés comme les seuls inhibiteurs efficaces pour bloquer les courants anioniques médiés par le VRAC, malgré un manque évident de spécificité. En effet, ils sont aussi connus pour inhiber dans les mêmes ordres de grandeurs les courants chlorures activés par le calcium (CaCC). De nombreuses autres molécules inhiberaient le courant du VRAC. Parmi celles-ci, le tamoxifène, un modulateur des récepteurs aux œstrogènes prescrit pour son action anti-tumorale, est également un bloqueur de haute affinité pour le VRAC (Zhang et al., 1994). D’autres molécules aux potentiel anti-oestrogéniques, telles que le nafoxidine et le clomiphene, ont un effet inhibiteur sur le VRAC (Maertens et al., 2001). Cependant, l’usage de telles molécules est limité en raison de leur manque de spécificité et de leurs nombreux effets secondaires.
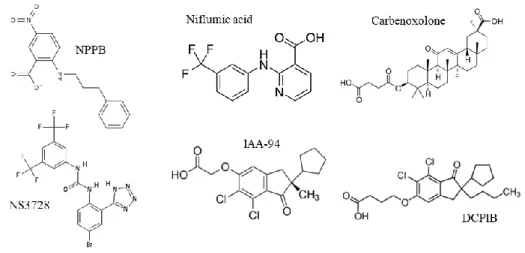
Il a fallu attendre les années 2000 pour voir enfin synthétiser des inhibiteurs plus spécifiques possédant une meilleure affinité pour le canal. En 2001, Decher et al. publient la découverte d’un inhibiteur sélectif ciblant le courant VRAC et ayant un effet cardioprotecteur (Decher et al., 2001). Avec un IC50 de 4.1µM et une inhibition quasi-totale à 10µM, le DCPIB s’impose en tant qu’inhibiteur
standard. Cette molécule dérivée du carbenoxolone, inhibiteur des connexines, présente l’avantage de ne pas inhiber les courants portés par les autres canaux chlorures : CaCC, ClC et CFTR. En 2003, l’équipe de Christophersen montre que le NS3728, un dérivé de l’acide di-aryl-urée, possède un IC50 de
0.4µM pour le VRAC (Hélix et al., 2003). Synthétisé à l’origine pour bloquer les conductances chlorures érythrocytaires, ces dérivés permettent notamment de stabiliser le volume des érythrocytes in vivo. Malgré la forte affinité du NS3728 pour le VRAC, celui-ci n’a que peu été utilisé, en partie parce qu’il inhibe aussi les conductances chlorures médiées par les CaCC.
11
Figure 3 Structures des inhibiteurs du canal anionique sensible au gonflement cellulaire.
Tentatives d’identification
En dépit de nombreux efforts et d’une caractérisation précoce de ses propriétés biophysiques, l’identité moléculaire du VRAC est longtemps demeurée énigmatique pour des raisons techniques et méthodologiques. En effet, les stratégies classiques de clonage de canal étaient vouées à l’échec (Pedersen et al., 2015).
Tout d’abord, il est généralement nécessaire de travailler dans des cellules dénuées du canal à cloner. Or, le VRAC est ubiquitaire et son courant est présent de manière native dans tous les types cellulaires. L’utilisation de systèmes d’expression hétérologue s’est donc heurtée à la difficulté de différencier le courant endogène des potentiels courants induits par l’expression hétérologue. La méthode de purification au moyen de ligands de haute affinité présentait le problème du manque de tels ligands et les inhibiteurs étaient déjà connus pour se lier avec de nombreuses autres protéines dont des canaux ioniques et transporteurs. Enfin, l’apparente variabilité dans les propriétés biophysiques du canal en fonction des types cellulaires a ajouté un certain niveau de complexité. De nombreux candidats potentiels ont été proposés mais ils ne répondaient que partiellement aux critères requis.
En 1992, Valverde et al. proposent un premier candidat moléculaire au VRAC. Il s’agit de la p-glycoproteine, encodé par le gène MDR1 (Valverde et al., 1992). Cette protéine possède une homologie proche du canal chlorure CFTR et son expression dans des fibroblastes génère un courant sensible au gonflement cellulaire qui semble absent dans les cellules non transfectées. Cependant il a été montré par la suite que ces fibroblastes ont bien un courant endogène, et de nombreuses études ont écarté ce premier candidat. D’autres candidats ont été présentés au cours des années suivantes : pClCln en 1992 (Paulmichl
et al., 1992), p64 CLIC1 et l’échangeur anionique AE1 Cl-/HCO3- en 1993 (Haynes and Goldstein,
1993; Redhead et al., 1992). pClCln s’est avérée être une petite protéine non membranaire impliquée dans
la régulation de l’épissage. p64 CLIC1 semble être un canal chlorure intracellulaire dont les fonctions restent incertaines en particulier en raison de son repliement typique des Glutathione-S-transferases, lui conférant un rôle dans l’état d’oxydo-réduction des cellules. En 1995, Moorman et al. proposent le
12 phospholemman et Dermitzel et al. le VDAC (Voltage-Dependent Anion Channel) (Dermietzel et al., 1994; Moorman et al., 1995). Cependant, le premier est en fait une protéine à un seul segment transmembranaire, impliquée dans la régulation de la pompe Na+/K+ ATPase, et le second est un canal
anionique de la membrane externe des mitochondries. ClC3, membre de la famille des ClC a été proposé en 1997 (Duan et al., 1997), mais cet échangeur Cl-/H+ est relativement spécifique des compartiments
intracellulaires. Ces dernières années, différents groupes ont proposé les membres des bestrophines et des TMEM16 (aussi connus sous le nom d’anoctamines) comme candidats (Almaça et al., 2009; Chien and Hartzell, 2007; Juul et al., 2014; Stotz and Clapham, 2012). Cependant la sensibilité de ceux-ci pour le calcium est complètement différente de celle du VRAC. Ces protéines ont rapidement été classées en tant que membres des canaux chlorures activés par le calcium intracellulaire (CaCC).
Ces longues années de recherches infructueuses mettent en exergue d’importants éléments concernant les VRAC et les canaux chlorures. Le premier point est la mise en évidence d’un nombre de protéines et de canaux gravitant autour du transport des ions chlorures, et dont la communauté scientifique ignore encore aujourd’hui le rôle et la fonction. Le second point est la complexité de différenciation des canaux et des processus intervenant dans ce qui est caractérisé comme le courant VRAC. Quoi qu’il en soit, ces longues années de recherche n’ont pas été vaines, et bien qu’elles aient augmenté considérablement la complexité du domaine, il en ressort de très nombreuses observations à propos des transports anioniques et leurs implications physiopathologiques.
Identification moléculaire
Il a fallu attendre l’année 2014 pour découvrir l’identité moléculaire du VRAC. Deux équipes indépendantes, celle d’Ardem Patapoutian et celle de Thomas Jentsch ont trouvé et démontré dans des publications parues à un mois d’intervalle que la protéine LRRC8A était indispensable aux courants du VRAC (Qiu et al., 2014; Voss et al., 2014). Les deux groupes ont développé une stratégie similaire de criblage de larges bibliothèques de petits ARN interférents (siRNA). Ils se sont basés sur la perméabilité du VRAC aux ions iodures pour leurs tests et sur la méthode développée par Galietta et al. pour le clonage du TMEM16A (Caputo et al., 2008). La protéine YFP (Yellow Fluorescent Protein) sensible aux halides est une protéine dont la fluorescence est inhibée par les halides, et donc par les ions iodures. La technique repose sur la présence d’un milieu extracellulaire contenant des ions iodures qui vont entrer dans la cellule et inhiber la fluorescence de la YFP lors de l’ouverture du VRAC. En présence du siRNA ciblant le VRAC, la désactivation (quenching) de la fluorescence de la YFP intracellulaire est censée être moindre en condition hypotonique. L’équipe de Patapoutian a utilisé le DCPIB comme contrôle positif et celle de Jentsch le carbenoxolone. Les deux équipes sont arrivées à la même conclusion montrant que la protéine LRRC8A (Leucine Rich Repeat Containing 8) est indispensable aux courants VRAC. Le groupe du Dr Patapoutian a renommé cette protéine SWELL1 dans un effort de clarification mais cette appellation n’a pas été reprise par la communauté scientifique pour le moment.
13 Bien que de nombreuses données valident l’identification des LRRC8 comme formant des canaux anioniques sensibles au gonflement cellulaire, certains résultats semblent remettre partiellement en question la participation des LRRC8 (Milenkovic et al., 2015; Okada et al., 2017; Sirianant et al., 2016). Il est possible que les canaux anioniques sensibles au gonflement cellulaire puissent regrouper plusieurs familles protéiques distinctes dont les LRRC8/VRAC.
LRRC8 : une famille de canaux hétéromériques
Alors que l’équipe de Patapoutian avait montré que le LRRC8A était essentiel au VRAC, celle de Jentsch a montré que le LRRC8A interagissait avec au moins un autre membre des LRRC8 pour former un canal fonctionnel (Qiu et al., 2014; Voss et al., 2014). En effet, les cellules n’exprimant plus LRRC8A (LRRC8A KO) n’ont plus de courant VRAC. Il semblerait qu’en l’absence de LRRC8A, les autres LRRC8 ne peuvent plus être exportées à la membrane plasmique. De la même manière, les cellules n’exprimant plus que LRRC8A (LRRC8B/C/D/E KO) n’ont pas non plus de courants VRAC. Ainsi, il apparaît nécessaire que le LRRC8A interagisse avec les autres LRRC8 pour former un canal fonctionnel à la membrane plasmique.
Figure 4 LRRC8A est nécessaire pour le canal anionique sensible au gonflement cellulaire. A) Le VRAC nécessite la
présence de LRRC8A et d’au moins un autre LRRC8. B) L’extinction génétique de LRRC8A inhibe la régulation du volume cellulaire consécutive à un choc hypotonique. (Voss et al., 2014)
A partir de ces cellules KO, la réexpression de couple de LRRC8 permet de retrouver la plupart des caractéristiques biophysiques du VRAC. LRRC8A-D possède une grande perméabilité aux anions volumineux tels que l’aspartate et le glutamate. Il est impliqué dans l’efflux de taurine mais aussi dans le transport du cisplatine et de la blasticidine (Lee et al., 2014; Lutter et al., 2017a; Planells-Cases et al., 2015a). Le couple LRRC8A-C a une plus grande conductance et présente une faible inactivation tandis que le couple LRRC8A-E a une conductance moyenne mais présente une inactivation plus marquée (Syeda et al., 2016; Voss et al., 2014). Ces assemblages ne semblent pas non plus être régulés de la même manière : LRRC8A-C et LRRC8A-D sont plutôt potentialisés par les agents réducteurs et inhibés par les agents oxydants tandis que LRRC8A-E est potentialisé par les agents oxydants (Gradogna et al., 2017c). L’association de LRRC8A et de LRRC8B ne donne a priori pas de courant ionique. Il a été reporté que LRRC8B était principalement exprimé dans le réticulum endoplasmique où il jouerait un rôle dans la régulation du calcium (Ghosh et al., 2017).
14
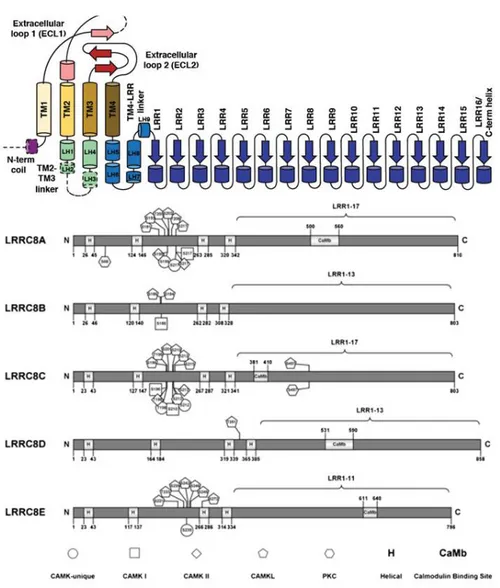
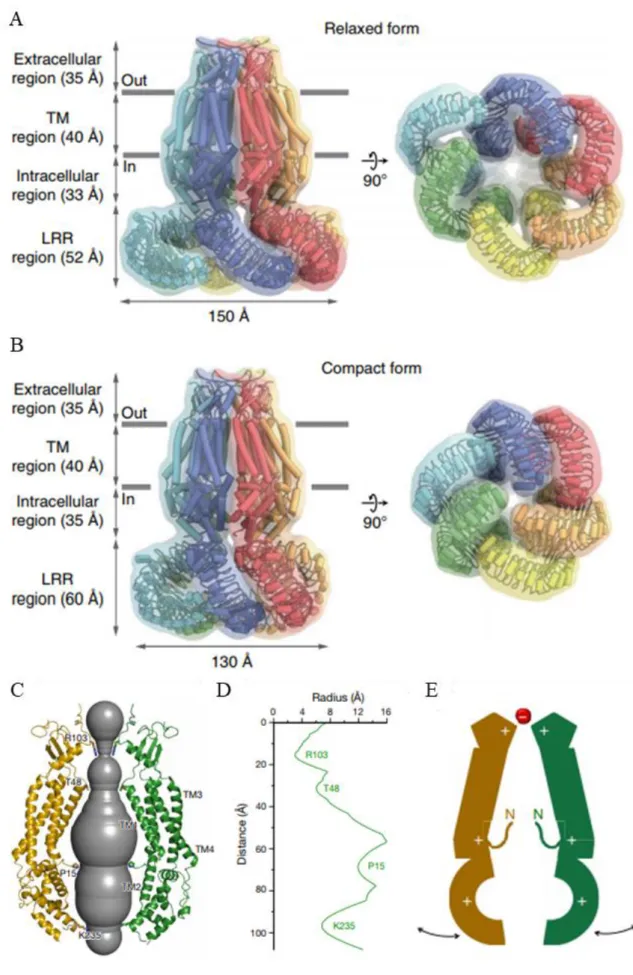
Structure du canal
Quelques années avant la découverte que les LRRC8 formaient une famille de canaux chlorure, une analyse bio-informatique des séquences des LRRC8 a montré que ces derniers possèdent une homologie avec les pannexines (Abascal and Zardoya, 2012). Les pannexines formant des canaux hexamériques, il avait été proposé que les LRRC8 pouvaient former des canaux héxamériques. Tout comme les pannexines, les LRRC8 possèdent quatre segments transmembranaires et les boucles extracellulaires possèdent chacune deux cystéines. La particularité des LRRC8 est cette longue queue C-terminale possédant une répétition de domaine riche en leucine (LRR), dont la fonction semble être primordiale pour l’ouverture du canal (Kasuya et al., 2018; Kefauver et al., 2018). A l’exception du LRRC8B, toutes les autres protéines possèdent un site de liaison à la calmoduline au niveau de la partie C-terminale (Ponomarchuk et al., 2016). Il existe de nombreux sites de phosphorylation sur les domaines intracellulaires qui pourraient moduler le VRAC. De plus, il existe un motif KYD impliqué dans les processus d’inactivation au niveau de la première boucle extracellulaire (Kefauver et al., 2018; Ullrich et al., 2016; Yamada and Strange, 2018; Zhou et al., 2018).
Figure 5 Structure des LRRC8 avec 4 domaines transmembranaires et un domaine LRR C-terminale.(Kefauver et al., 2018;
15 Voss et al. ont montré que le LRRC8A co-immunoprécipitait avec tous les autres LRRC8 (Voss et al., 2014). Des équipes ont rapidement confirmé ces résultats tout en ajoutant que l’assemblage de ces sous-unités formait au minimum des hexamères (Gaitán-Peñas et al., 2016a; Syeda et al., 2016). L’assemblage des différentes sous-unités semble aléatoire, dépendant principalement du niveau d’expression des différents LRRC8. Trois récentes études ont cristallisé la structure d’homohexamère de LRRC8A montrant des résultats similaires. Deneka et al. a montré que le canal forme un entonnoir avec une constriction formant un filtre de sélectivité au niveau extracellulaire (Deneka et al., 2018a). Ce filtre est dû à la présence sur le LRRC8A d’une arginine à la position 103. A ce niveau, le LRRC8C et le LRRC8E possèdent une leucine tandis que le LRRC8D possède une phénylalanine, donnant un pore plus large et permettant ainsi le passage de molécules plus volumineuses. La présence d’une arginine à ce niveau sur le LRRC8B pourrait expliquer pourquoi l’expression de LRRC8A-B (tout comme les homohexamères de LRRC8A) donne des constructions avec une très faible conductance. L’équipe de Patapoutian a quant à elle mis en évidence que le domaine LRR était riche en acides aminés chargés et que l’interaction de ces domaines pourrait dépendre de la force ionique (Kefauver et al., 2018). L’ouverture du canal serait causée par un écartement des domaines LRR qui entrainerait un déplacement des segments transmembranaires. Kasuya et al. ont eux aussi observé que les domaines LRR étaient flexibles et mobiles, possédant deux conformations possibles : une forme relaxée et une forme compacte (Kasuya et al., 2018). Une telle régulation expliquerait pourquoi les constructions de LRRC8 taguées par des fluorophores au niveau des domaines LRR donnent des canaux constitutivement actifs (Gaitán-Peñas et al., 2016a).
16
Figure 6 Structure de l'homohéxamère formé par LRRC8A. A) Forme relaxée et forme compacte. C) Pore du LRRC8A/VRAC.
D) Radius du pore en fonction de la profondeur du canal. E) Filtre de sélectivité et mouvement du pore. (Deneka et al., 2018a;
17
Physiopathologies associées aux LRRC8
A part le cas d’une mutation de LRRC8A entrainant une agammaglobulinémie sévère (Sawada et al., 2003), il n’est pas reporté de maladie génétique en relation avec les LRRC8 bien que de nombreuses évidences démontrent leur rôle dans de nombreux mécanismes physiologiques. L’expression de LRRC8A est ubiquitaire tandis que l’expression des autres LRRC8 est tissu spécifique. Le LRRC8A est fortement exprimé dans les poumons, dans les ganglions dorsaux et dans les lymphocytes B et T (Qiu et al., 2014).
Les souris KO pour LRRC8A ne sont pas viables et les rares souris survivant à leur naissance présentent de nombreuses dysfonctions développementales (Kumar et al., 2014). La perte de LRRC8A est notamment associée à un défaut développemental des lymphocytes B et T. De plus, un problème de spermatogénèse à l’origine d’une perte de fertilité des mâles a pu être mis en évidence dans des études utilisant différents KO conditionnels (Bao et al., 2018; Lück et al., 2018). LRRC8C favorise quant à lui la différenciation adipocytaire et les souris LRRC8C KO sont plus résistantes à un régime hypercalorique (Hayashi et al., 2011; Tominaga et al., 2004). Le LRRC8/VRAC joue aussi un rôle important au niveau de la sécrétion de l’insuline par les cellules β pancréatiques, exprimant principalement LRRC8A-D (Best et al., 2004; Kang et al., 2018; Stuhlmann et al., 2018; Zhang et al., 2017). En effet, l’activation du VRAC par un choc hypotonique ou par une augmentation du glucose entraine une dépolarisation favorisant la sécrétion de l’insuline. Les souris n’exprimant plus LRRC8A au niveau des cellules β pancréatiques ont une diminution de la tolérance au glucose.
Le VRAC joue aussi un rôle important au niveau du transport de molécules volumineuses. De nombreuses études ont montré que le LRRC8/VRAC était perméable au cisplatine et que l’absence de LRRC8A était nécessaire à l’entrée de cette molécule dans les cellules cancéreuses. Ainsi, le LRRC8/VRAC pourrait jouer un rôle dans la résistance au cisplatine en cas de traitement anticancéreux (Planells-Cases et al., 2015a; Sørensen et al., 2014, 2016a, 2016c). L’expression de LRRC8A est un facteur de mauvais pronostic dans les cancers du côlon où elle est associée à une augmentation de la prolifération et de l’occurrence des métastases (Zhang et al., 2018). Dans ces cellules de glioblastome, la répression de LRRC8A entraine une diminution de la prolifération et une augmentation de la sensibilité au Temozolomide et au Carmustine (Rubino et al., 2018).
Sa perméabilité au glutamate et potentiellement à l’ATP en font une cible privilégiée dans le système nerveux où ces deux molécules sont connues pour avoir une forte toxicité (Formaggio et al., 2018; Hyzinski-García et al., 2014). Le DCPIB avait montré un effet protecteur dans des modèles d’ischémie/hypoxie cérébrale (Alibrahim et al., 2013; Han et al., 2014; Wang et al., 2017a; Zhang et al., 2008). Il semble par ailleurs que le VRAC soit une cible intéressante dans le cadre de la cardioprotection (Decher et al., 2001; Shen et al., 2014; Wang et al., 2017a).
18
Les autres canaux chlorures
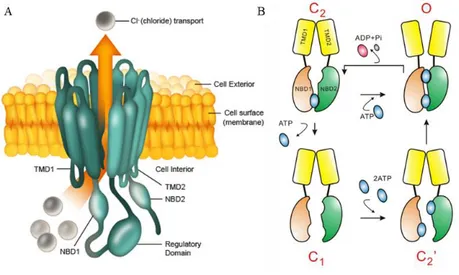
CFTR
Le CFTR (cystic fibrosis transmembrane conductance regulator) ou ABCC7, est un membre de la famille des transporteurs à cassette d’ATP (ABC transporter), mais il est le seul, a priori, à former un canal ionique (Dean and Allikmets, 2001). Il est l’un des premiers canaux chlorures clonés en 1989 et sa structure tridimensionnelle a été imagée récemment (Liu et al., 2017; Riordan et al., 1989). Il est constitué de douze segments transmembranaires formant deux domaines transmembranaires distincts séparés par une boucle intracellulaire entre le segment 6 et le segment 7. Cette boucle contient un domaine de liaison à l’ATP et un domaine régulateur R phosphorylé par la protéine kinase A. Le domaine R est unique au sein de la famille des transporteurs ABC. L’activation du CFTR nécessite la phosphorylation de ce domaine par la PKA, activée par une augmentation de l’AMPc intracellulaire. Il existe un second domaine de liaison à l’ATP sur la queue C-terminale. L’interaction de l’ATP au niveau de leur domaine de liaison est requise pour que ses deux domaines se superposent et forme une « cassette ». Ce changement de conformation est à l’origine de l’ouverture du CFTR. L’hydrolyse de l’ATP entraine la fermeture du canal via un nouveau changement de conformation (Tsai et al., 2010). Le CFTR est caractérisé par un courant macroscopique linéaire sans cinétique d’activation ou d’inactivation. Son activité est généralement déclenchée par un traitement à la forskoline, un activateur de l’adénylate cyclase.
Figure 7 Structure et mécanisme d'activation du CFTR. A) vue schématique du CFTR. B) Mécanisme d'ouverture du pore
par l'ATP.(Tsai et al., 2010)
Le CFTR est un canal présent sur la membrane apicale des épithélia. Il joue un rôle important dans les échanges transépithéliaux et dans la sécrétion du mucus. Il est aussi impliqué dans les processus apoptotiques. La perte de sa fonctionnalité est à l’origine de la mucoviscidose, la plus fréquente des maladies rares (Riordan et al., 1989). La cause principale de morbidité de cette maladie est une atteinte des voies respiratoires. La réduction de l’efflux d’ions chlorures entraine un épaississement du mucus
19 qui s’accumule au niveau des bronches. Le CFTR est aussi impliqué dans la sécrétion d’agents anti-infectieux. Or, il a été observé chez les patients mucoviscidosiques une augmentation des agents infectieux associée à une perte des défenses immunitaires (Starosta et al., 2006). Les patients souffrent aussi d’atteintes hépatiques, pancréatiques et intestinales. Les mutations du CFTR sont définies en plusieurs classes selon leurs effets : inhibition de la synthèse protéique (classe I), problème de maturation empêchant l’export membranaire (classe II), altération de la régulation du canal (classe III) et perte de la conductance du canal (classe IV). La mutation la plus fréquente est la délétion ΔF508, au niveau du domaine de liaison à l’ATP. Elle résulte à la fois en un problème de maturation mais aussi de régulation par l’ATP.
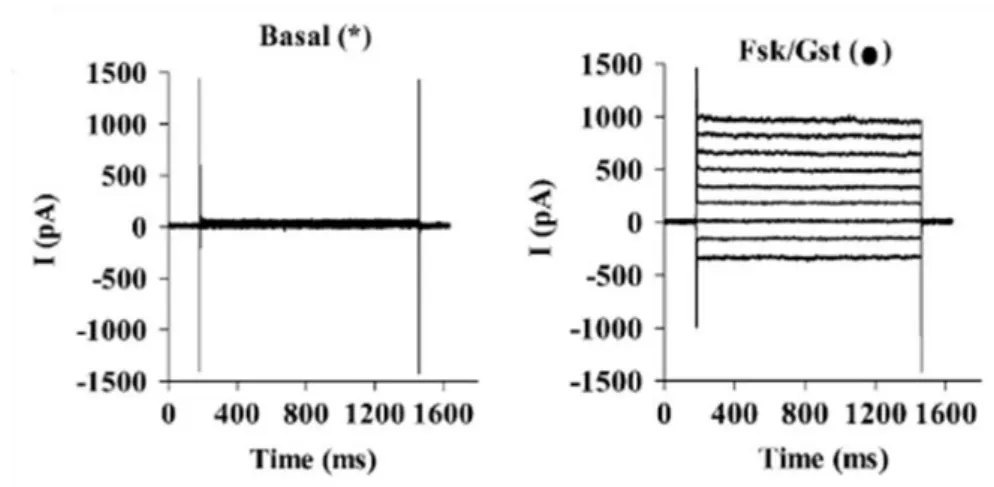
Figure 8 Courants CFTR déclenchés par de la forskoline et la génistéine enregistrés en configuration cellule entière
(respectivement 10 et 30µM). (Norez et al., 2009)
Le CFTR est inhibé par la plupart des inhibiteurs peu sélectifs des canaux chlorures, tels que le NPPB, le SITS et le DPC. Il est insensible au DIDS, ce qui permettait de le différencier des autres canaux chlorures. Depuis les années 2000, de nombreux inhibiteurs ont été développés pour cibler plus spécifiquement le CFTR. Parmi eux, le CFTRinh-172, le GlyH-101 et le PPQ-102 semblent être les plus
efficaces (Ma et al., 2002; Muanprasat et al., 2004; Tradtrantip et al., 2009). A l’instar des inhibiteurs, des potentiateurs et des ouvreurs, comme l’ivacaftor et le lumacaftor, ont également été développés pour pallier la perte de fonctionnalité due à certaines mutations (Van Goor et al., 2009, 2011). Les correcteurs du CFTR ont un intérêt thérapeutique pour le traitement des patients atteints de la mucoviscidose. En dehors des mutations de classe I qui entrainent la perte de l’expression de CFTR, les autres mutations résultent en une perte de fonction du canal, soit en raison d’un mauvais adressage de la protéine à la membrane (classe II), soit en raison d’un mauvais fonctionnement du canal membranaire (classe III et IV). Le lumacaftor est un potentiateur du CFTR ΔF508 qui favorise son adressage membranaire, ce qui permet de restaurer une partie des conductances chlorures des cellules épithéliales présentant cette mutation. L’ivacaftor quant à lui est un ouvreur du canal qui augmente sa probabilité d’ouverture, ce qui résulte en une augmentation des conductances chlorures des cellules exprimant correctement le CFTR