© Frédérique Parent-Prévost, 2020
Mécanismes de localisation de la protéine de polarité
Yurt.
Mémoire
Frédérique Parent-Prévost
Maîtrise en biologie cellulaire et moléculaire - avec mémoire
Maître ès sciences (M. Sc.)
Mécanismes de localisation de la protéine de polarité Yurt
Mémoire
Frédérique Parent-Prévost
Sous la direction de :
ii
Résumé
Introduction. La distribution asymétrique des composantes cellulaires au sein des cellules épithéliales résulte en une polarité apico-basale, laquelle divise la cellule en un domaine apical, un domaine latéral et un domaine basal. Cette polarité est essentielle à la physiologie des tissus épithéliaux et à l’homéostasie des organes. D’ailleurs, la perte de polarité épithéliale favorise la progression tumorale. Crumbs est une protéine de la polarité limitant la progression tumorale. Chez la drosophile, la protéine Yurt, associée au cortex cellulaire, inhibe Crumbs. De plus, les orthologues humains de Yurt – EPB41L5 et EPB41L4B – sont surexprimés dans plusieurs cancers. Leur surexpression amplifie la formation de métastases et est donc associée à un mauvais pronostic. Ces protéines seraient de bonnes cibles thérapeutiques, mais leurs modes de régulation sont peu connus. Nous émettons l’hypothèse que la localisation subcellulaire est importante pour la régulation de Yurt et ses orthologues. Ce projet vise à 1) définir les domaines de Yurt lui permettant de lier le cortex cellulaire et 2) déterminer les mécanismes régissant cette localisation. Méthodologie et résultats. Nous avons procédé à une analyse structure-fonction couplée à des immunofluorescences pour identifier les domaines protéiques responsables de la localisation corticale de Yurt. Diverses troncations et délétions au sein de la protéine nous ont permis d’identifier un motif basique et hydrophobe et un domaine Pleckstrin Homology-like au sein du domaine FERM permettant de cibler Yurt au cortex. Cette association se fait par des interactions électrostatiques avec des lipides membranaires. Conclusion. Nous avons mis en lumière de nouveaux mécanismes régulant la protéine Yurt. Ces connaissances pourraient contribuer au développement de nouvelles stratégies thérapeutiques en oncologie ciblant les orthologues humains de Yurt.
iii
Abstract
Introduction. Epithelial polarity is characterized by the asymmetrical distribution of cellular components in epithelial cells, which divides the cell into an apical domain, a lateral domain, and a basal domain. This polarity is essential for proper tissue function and the homeostasis of organs. Indeed, loss of epithelial polarity contributes to cancer progression. Crumbs is a polarity protein that limits tumour progression. In Drosophila, the protein Yurt, which associates to the cell cortex, limits the activity of Crumbs. Moreover, the human orthologs of Yurt – EPB41L5 and EPB41L4B – are overexpressed in many cancers. This overexpression increases metastasis formation and is thus associated with a poor prognosis. These proteins represent potential targets in the treatment of cancer, but little is known about their modes of regulation. We hypothesize that subcellular localization is important for the regulation of Yurt and its human orthologs. The aims of this project are to 1) define which domains of Yurt target it to the cell cortex and 2) determine the mechanisms responsible for this localization. Methodology and results. We performed a structure-function analysis coupled to immunofluorescence to identify the protein domains responsible for the cortical localization of Yurt. Many truncations and deletions were tested and allowed the identification of one basic and hydrophobic motif along with a Pleckstrin Homology-like domain within the FERM domain that are essential for Yurt’s cortical localization. This localization is mediated by electrostatic interactions with membrane lipids. Conclusion. We have successfully identified novel mechanisms regulating Yurt localization. These findings could contribute to the development of new therapeutics in oncology that target the human orthologs of Yurt.
iv
Table des matières
Résumé ... ii
Abstract ... iii
Table des matières ... iv
Liste des figures ... vi
Liste des tableaux ... vii
Liste des abréviations et acronymes ... viii
Remerciements ... x
Introduction ... 1
1. Les tissus épithéliaux ... 1
2. Drosophila melanogaster ... 4
3. Les jonctions cellulaires ... 7
3.1. Les desmosomes ... 7
3.2. Les jonctions adhérentes ... 7
3.3. Les jonctions serrées ... 8
4. La polarité épithéliale ... 10 4.1. Les phosphoinositides... 10 4.2. Le domaine apical ... 13 4.2.1. Le complexe Par ... 13 4.2.2. Le complexe Crumbs ... 16 4.3. Le domaine basolatéral ... 18 4.3.1. Le module Scribble... 18 4.3.2. Le groupe Yurt/Coracle ... 21
4.4. Interactions entre les complexes de polarité ... 21
5. La protéine Yurt et ses orthologues humains ... 23
5.1. La structure de Yurt et de ses orthologues ... 23
5.2. Les rôles de Yurt et ses orthologues dans le développement embryonnaire ... 25
5.3. Les rôles de Yurt dans la polarité épithéliale ... 25
5.4. Les rôles de Yurt et ses orthologues dans l’adhésion cellulaire ... 27
5.5. Les rôles de Yurt et ses orthologues dans la morphologie cellulaire ... 28
5.6. Les modes de régulation de Yurt ... 29
5.7. Les implications de EPB41L5 et EPB41L4B dans la progression tumorale ... 31
6. Hypothèses et objectifs ... 33
Chapitre 1 – Matériel et méthodes ... 36
1.1. Clonage moléculaire ... 36
v
1.3. Transfection des cellules S2... 36
1.4. Immunofluorescence ... 37
1.5. Traitement des cellules S2 avec des drogues ... 37
1.6. Imagerie cellulaire et traitement des images ... 38
Chapitre 2 – Résultats ... 39
2.1. Yurt est corticale dans les cellules S2 ... 39
2.2. Des domaines en N-terminal ciblent Yurt au cortex ... 40
2.3. Les trois lobes du domaine FERM contribuent à la localisation de Yurt ... 43
2.4. La contribution des motifs basiques et hydrophobes du domaine FERM ... 44
2.5. Le domaine PH-like cible Yurt au cortex ... 49
2.6. Les mécanismes de localisation corticale de Yurt ... 50
2.6.1. La localisation corticale de Yurt est indépendante de son oligomérisation ... 50
2.6.2. Des interactions électrostatiques avec les PIP ciblent Yurt au cortex cellulaire ... 51
Chapitre 3 – Discussion et perspectives ... 54
3.1. La localisation de Yurt dans les cellules S2 ... 54
3.2. Le rôle des domaines et sous-domaines de Yurt dans sa localisation corticale ... 55
3.2.1. L’implication des différents domaines de Yurt ... 55
3.2.2. Le rôle du domaine FERM dans la localisation de Yurt ... 56
3.2.3. La contribution des motifs BH et du domaine PH-like ... 57
3.3. Les mécanismes de localisation corticale de Yurt ... 58
3.3.1. L’oligomérisation de Yurt ... 58
3.3.2. Les interactions électrostatiques avec les PIP... 59
3.4. Perspectives ... 60
Conclusion ... 65
Annexe 1 ... 67
vi
Liste des figures
Figure 1 L’organisation des tissus épithéliaux. Figure 2 Structure des cellules épithéliales polarisées. Figure 3 Transition épithélio-mésenchymateuse et cancer. Figure 4 Le système UAS-GAL4.
Figure 5 Structure générale des jonctions cellulaires. Figure 6 Régulation des phosphoinositides.
Figure 7 Structure de la protéine Crb/CRB.
Figure 8 Régulation de la localisation corticale de Lgl.
Figure 9 Interactions entre les déterminants de la polarité épithéliale. Figure 10 Structure de Yrt/EPB41L5/EPB41L4B.
Figure 11 Modulation de la polarité épithéliale par l’interaction entre Yrt et Crb.
Figure 12 Influence de EPB41L4B dans la contraction de la CAC via la voie RhoA/ROCK/Myosine-II. Figure 13 Modes de régulation de Yrt.
Figure 14 Hypothèse du mécanisme de localisation de Yrt.
Figure 15 Rôle potentiel de la localisation des orthologues humains de Yrt en oncologie. Figure 16 Localisation de FLAG-Yrt-β dans les cellules S2.
Figure 17 Localisation de diverses troncations de FLAG-Yrt.
Figure 18 Comparaison de la localisation de FLAG-Yrt CT et FLAG-Yrt CTPBM.
Figure 19 Localisation de constructions FLAG-Yrt avec des délétions en N-terminal. Figure 20 Les motifs BH de la protéine Yrt.
Figure 21 Mutations ponctuelles des motifs BH de Yrt.
Figure 22 Rôle des charges positives au sein du domaine PH-like. Figure 23 Localisation du monomère de Yrt.
Figure 24 Rôle des interactions électrostatiques avec les PIP dans la localisation de FLAG-Yrt-β. Figure 25 Stratégie proposée pour l’obtention d’une lignée cellulaire S2 dépourvue de Yrt. Figure 26 Motifs BH et résidus phosphorylables de Yrt.
Figure 27 Conservation des résidus positifs ciblant Yrt au cortex dans EPB41L5 et EPB41L4B. Figure 28 Modèle proposé pour la localisation corticale de Yrt.
vii
Liste des tableaux
viii
Liste des abréviations et acronymes
α-cat Alpha-caténine β-cat Beta-caténine
A Alanine
ADN Acide désoxyribonucléique
Anx2 Annexine 2
aPKC Atypical Protein Kinase C (Protéine kinase C atypique)
Arm Armadillo
AurA Aurora A
Baz Bazooka
BH Basique et hydrophobe
BioID Biotinylation de proximité CAC Ceinture d’actine circonférentielle CaCl2 Chlorure de calcium
CCC Complexe cadhérine-caténine ConA Concanavaline A
Cora Coracle
cPKC Conventional Protein Kinase C (Protéine kinase C conventionnelle) Crb/CRB Crumbs
CRISPR Clustered Regularly Interspaced Short Palindromic Repeats
CT C-terminal
D Acide aspartique
DAG Diacylglycérol
DAPI 4’,6-diamidino-2-phénylindole DE-Cad Cadhérine épithéliale de drosophile
Dlg Discs large
DMSO Diméthylsulfoxyde E-Cad Cadhérine épithéliale
EHM2 Expressed in High Metastatic 2 EMT Epithelial-mesenchymal transition
EPB41L4B Erythrocyte Membrane Protein Band 4.1-Like 4B EPB41L5 Erythrocyte Membrane Protein Band 4.1-Like 5 ERM Ezrin, Radixin, Moesin
F Phénylalanine
FA FERM Adjacent
FAK Focal Adhesion Kinase
FDB FERM Domain Binding
FERM Four point one, Ezrin, Radixin, Moesin
GDP Guanosine diphosphate
GEF Guanosine Exchange Factor
GFP Green Fluorescent Protein
GTP Guanosine Triphosphate
GUK Guanylate kinase
INPP5E Inositol Pholyphosphate-5-Phosphatase E
Iono Ionomycine
IP3 Inositol triphosphate
JA Jonction adhérente
JAM Junctional Adhesion Molecules
ix JSep Jonction septée
K Lysine
Lgl Lethal (2) Giant Larvae MDCK Madin-Darby Canine Kidney MET Mesenchymal-Epithelial Transition
MIB1 Mind Bomb 1
MLRC Myosin Regulatory Light Chain
Moe Moesin
Neur Neuralized
NGS Normal Goat Serum
NGT NGS dilué dans du PBS-Triton 0.01% NLP Nucleoplasmin-Like Protein
NMII-A Non-Muscle Myosin IIA
NMuMG Normal Murine Mammary Gland Epithelial
nPKC Novel Protein Kinase C (Protéine kinase C nouvelle) Nrx IV Neurexine IV
NT N-terminal
p120ctn p120-caténine
PAO Oxyde de phénylarsine
PBD PDZ-binding domain
PBM PDZ-binding motif
PBS Phosphate-buffered saline (Tampon phosphate salin)
PFA Paraformaldéhyde
PH Pleckstrin Homology
PI Phosphoinositide
PI3K Phosphoinositide 3-kinase PI4K Phosphoinositide 4-kinase PI5K Phosphoinositide 5-kinase PIP Phosphoinositides phosphorylés PJ-Sac Pseudojanin Sac
PLA Proximity Ligation Assay
PLC Phospholipase C
PtdIns Phosphoinositide
PtdIns(3,4,5)P3 Phosphoinositide phosphorylé en position 3, 4 et 5
PtdIns(4,5)P2 Phosphoinositide phosphorylé en position 4 et 5
PTEN Phosphatase and tensin homolog
R Arginine
S Sérine
S2 Schneider 2
Scrib Scribble
Sdt Stardust
SPOP Speckle-type POZ protein
T Thréonine
TGF-β Transforming Growth Factor Beta
Ub Ubiquitine
W Tryptophane
YMO1 Yrt/Mosaic Eyes-Like 1
Yrt Yurt
ZA Zonula adherens
x
Remerciements
Je tiens tout d’abord à remercier mon directeur de recherche, le Dr Patrick Laprise. Merci de m’avoir accueillie dans ton laboratoire à plusieurs reprises lors de mon baccalauréat en sciences biomédicales, puis pour ma maîtrise. Un gros merci pour toute ton adaptation, que mon double cheminement imposait. Ça a été une opportunité incroyable pour moi de pouvoir continuer mon cheminement en recherche fondamentale tout en développant mes compétences cliniques. Merci de m’avoir encouragée à participer à plusieurs évènements scientifiques, qui m’ont permis de développer mes compétences de communication scientifique. Tu as été très disponible pour moi et tu as su m’aider à prioriser les différents projets dans lesquels j’étais impliquée.
Je souhaite également remercier mes collègues de laboratoire. Un énorme merci à Clémence pour sa patience, ses explications détaillées et ses réponses à mes nombreuses questions. Je la remercie aussi pour sa bonne humeur et toutes ses anecdotes. Merci à Alexandra pour ses conseils techniques en laboratoire et pour m’avoir aidé à relativiser l’ampleur des défis dans mon parcours. Je remercie Cornélia pour ses grandes réflexions scientifiques, son énergie inépuisable et son sens de l’humour unique. Merci à ma voisine de « bench » et de bureau, Justine, pour toutes ses petites attentions et les belles soirées avec de la bonne bouffe. Merci à Myriam pour ses jeux de mots, et à Helori pour ses nombreuses blagues. Merci à Kevin pour ses conseils et sa collaboration. Un gros merci à Carl à l’imagerie cellulaire, pour sa patience à me réapprendre les différentes fonctions des microscopes après mes absences prolongées.
Un gros merci à ma famille, qui m’a appris que « quand on veut, on peut ». Merci à mes amies de baccalauréat Samira, Alexandra, Katherine et Marie-Kim pour leur soutien et pour les soirées jeux de société qui me permettaient de décrocher. Merci à Catherine, qui n’hésite jamais à offrir son aide. Merci à Alain, Noémi et Alexandre pour les soirées sushis et pour les fous rires. Un merci particulier à Alexandre, de m’avoir endurée pendant toutes ces années! Merci pour ton soutien et ta compréhension, merci de croire en moi et de me pousser à me dépasser. Je remercie Rachou pour ses encouragements, pour les appels Skype qui duraient des heures et pour ses visites surprises. Un merci tout particulier à Jean-Christophe, qui me pousse à être la meilleure version de moi-même. Je le remercie pour son aide, ses petites attentions, ses conseils Excel. Merci d’écouter mes présentations (même si les sujets sont hors de ton champ d’expertise), merci de ta patience et merci d’être là, même dans les moments plus difficiles.
Finalement, je remercie les Instituts de recherche en santé du Canada (IRSC) pour leur soutien financier au cours de ma maîtrise.
1
Introduction
1. Les tissus épithéliaux
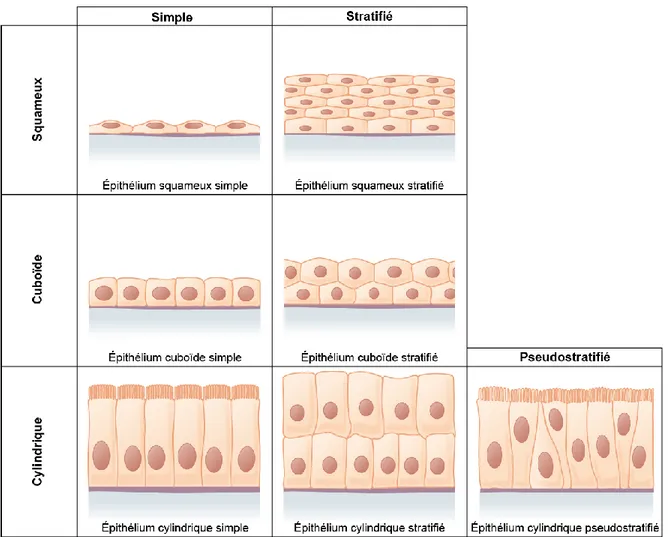
Les tissus épithéliaux sont parmi les quatre principaux types de tissus retrouvés dans le corps humain, les trois autres étant les tissus conjonctifs, les tissus nerveux et les tissus musculaires. Les tissus épithéliaux tapissent la surface du corps et de ses cavités; ils sont donc présents dans la majorité des organes du corps humain. On compte plus de 150 types de cellules épithéliales chez les mammifères (Rodriguez-Boulan & Macara, 2014). Ces cellules sont hautement spécialisées afin de permettre leurs fonctions de protection, de barrière à perméabilité sélective et de transport vectoriel qui maintiennent les différences biochimiques entre les différents compartiments du corps, ce qui est indispensable à l’homéostasie des organes. Les cellules épithéliales peuvent être squameuses, cuboïdes ou cylindriques et elles peuvent s’organiser en une monocouche (épithélium simple), en multicouche, qu’on appellera alors épithélium stratifié ou en tissu pseudostratifié (Figure 1). Ces tissus reposent sur une lame basale qui les sépare des tissus conjonctifs sous-jacents.
2
Figure 1. L’organisation des tissus épithéliaux. Vue latérale de différentes organisations de tissus épithéliaux. Les tissus
épithéliaux sont classés selon la forme des cellules et l’organisation des couches cellulaires. Les cellules peuvent être de forme squameuse, cuboïde ou cylindrique. Le tissu peut s’organiser en une seule couche, qu’on appelle épithélium simple. Les tissus qui s’organisent en multicouches sont dit stratifiés. Les tissus pseudostratifiés ont des cellules de tailles et de formes irrégulières qui donnent l’apparence de multicouches, mais chacune des cellules est en contact avec la lame basale.
Image adaptée de OpenStax, Anatomy and Physiology 2013.
Les cellules épithéliales sont maintenues ensemble par des jonctions cellulaires nommées jonctions adhérentes (JA). Il existe aussi des jonctions occlusives qui modulent la diffusion paracellulaire. On les appelle jonctions serrées (JS) chez les vertébrés et jonctions septées (JSep) chez les invertébrés. Elles permettent de former une barrière séparant deux compartiments distincts en empêchant la diffusion passive paracellulaire. La composition biochimique entre deux compartiments est aussi modulée par les cellules épithéliales elles-mêmes. En effet, les cellules épithéliales peuvent absorber et sécréter de manière unidirectionnelle, ce qui permet, par exemple, l’absorption efficace des nutriments au niveau de l’intestin et la sécrétion localisée d’acide chlorhydrique dans l’estomac.
3
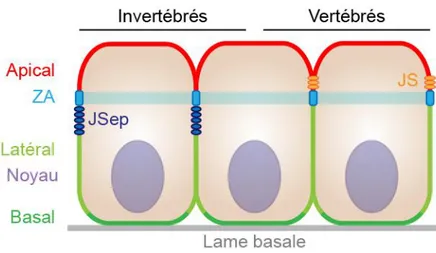
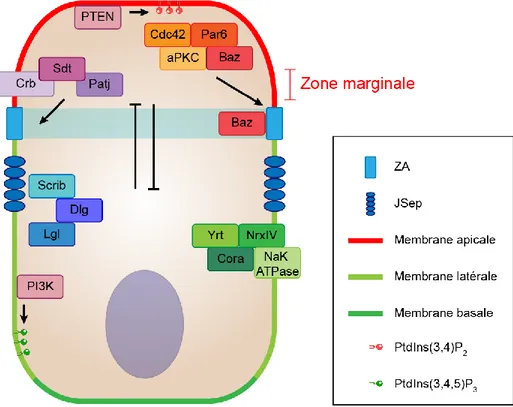
La distribution asymétrique des composantes cellulaires lipidiques et protéiques permet de diviser la cellule épithéliale en plusieurs domaines différents (Chatterjee & McCaffrey, 2014). C’est ce qu’on appelle la polarité épithéliale (aussi appelée polarité apico-basale). Elle permet de diviser la cellule en un domaine apical faisant face au lumen ou au milieu extérieur, un domaine latéral accolé aux cellules voisines et un domaine basal qui est en contact avec la lame basale. La zonula adherens (ZA), un type de JA, sépare le domaine apical du domaine latéral (Figure 2). La polarité épithéliale joue des rôles essentiels dans la morphogenèse et le développement des organes. Il existe une ceinture d’actomyosine localisée dans la portion apicale des cellules épithéliales (Lecuit & Lenne, 2007). La contraction de cette ceinture permet de faire la constriction du domaine apical afin de modifier la forme des cellules, notamment lors de la gastrulation (Dawes-Hoang et al., 2005). Les cellules épithéliales peuvent également ajuster la taille de leur domaine latéral pour former des cellules squameuses, cuboïdes ou cylindriques (Rodriguez-Boulan & Macara, 2014). De plus, les acteurs de la polarité épithéliale contrôlent la localisation de médiateurs clés pour la prolifération cellulaire, l’apoptose, la différenciation et l’organisation tissulaire (Chatterjee & McCaffrey, 2014).
Figure 2. Structure des cellules épithéliales polarisées. Les composantes cellulaires des cellules épithéliales se
distribuent de façon asymétrique au sein de la cellule. Ceci permet de former un domaine apical (en rouge) faisant face au milieu extérieur ou au lumen, un domaine latéral (en vert pâle) qui est en contact avec les cellules voisines et un domaine basal (en vert foncé) qui est en contact avec la lame basale. Le domaine apical est séparé du domaine latéral par la ZA, une JA permettant de maintenir la cohésion entre les cellules. Chez les invertébrés, les JSep sont basales à la ZA. Elles forment une barrière qui limite la diffusion paracellulaire. Chez les vertébrés, ce sont les JS qui accomplissent cette fonction. Elles sont apicales à la ZA.
Dans certains contextes, les cellules ont besoin de perdre leur polarité apico-basale pour accomplir leurs fonctions. Ce processus contribue à la transition épithélio-mésenchymateuse (« epithelial-mesenchymal transition »; EMT). La perte de polarité à elle seule est insuffisante pour induire l’EMT, mais elle est indispensable à ce processus (Chatterjee & McCaffrey, 2014). Lors de l’EMT, les cellules perdent leurs
4
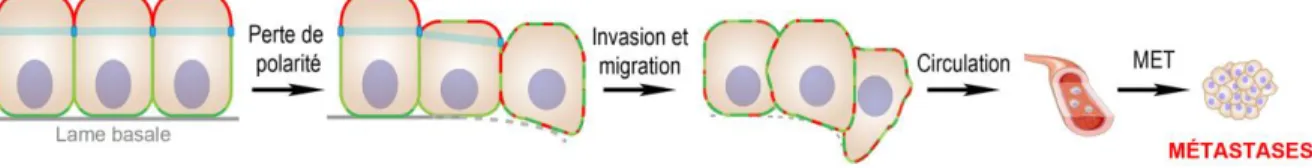
caractéristiques épithéliales pour acquérir un phénotype mésenchymateux. Ceci se traduit par une perte de polarité épithéliale, une perte de cohésion cellulaire, la dégradation de la lame basale et une augmentation des capacités migratoire et invasive des cellules (Figure 3; Coradini, Casarsa, & Oriana, 2011; Dongre & Weinberg, 2019; Thiery, Acloque, Huang, & Nieto, 2009). L’EMT est essentielle pour l’embryogenèse et la réparation tissulaire (Dongre & Weinberg, 2019). Puisque l’EMT augmente la migration et l’invasion, il n’est pas surprenant de constater qu’elle est aussi impliquée dans le cancer, dont plus de 80% sont d’origine épithéliale (Coradini et al., 2011; Dongre & Weinberg, 2019; McCaffrey & Macara, 2011; Nieto, Huang, Jackson, & Thiery, 2016). Plusieurs des facteurs impliqués dans l’EMT peuvent inhiber des protéines de la polarité épithéliale, ce qui contribue à la désorganisation des tissus épithéliaux (Gandalovičová, Vomastek, Rosel, & Brábek, 2016). En plus d’augmenter la migration et l’invasion, l’EMT augmente aussi la résistance à plusieurs traitements anticancéreux (Dongre & Weinberg, 2019, Haslehurst et al., 2012; Shibue & Weinberg, 2017; Zheng et al., 2015), notamment en diminuant l’apoptose et en favorisant l’acquisition de caractéristiques de cellules souches par les cellules cancéreuses (Fischer et al., 2015; Kurrey et al., 2009; Lim et al., 2013). L’EMT étant réversible, les cellules qui ont subi l’EMT peuvent réacquérir des caractéristiques épithéliales par la transition mésenchymale-épithéliale (« mesenchymal-epithelial transition »; MET). Ceci permet entre autres aux cellules cancéreuses de former des tumeurs secondaires (métastases) dans le corps (Figure 3; Gandalovičová et al., 2016).
Figure 3. Transition épithélio-mésenchymateuse et cancer. L’EMT est caractérisée par une perte de caractéristiques
épithéliales, dont la polarité apico-basale et la cohésion intercellulaire. Parallèlement, les cellules acquièrent un phénotype mésenchymateux qui leur confère des propriétés invasives et migratoires. Bien que l’EMT soit nécessaire lors de l’embryogenèse et la réparation tissulaire, elle a aussi des implications en oncologie. L’EMT permet aux cellules cancéreuses de se détacher de la tumeur primaire, d’envahir les tissus avoisinants et d’accéder à la circulation sanguine ou lymphatique. Un processus inverse à l’EMT, nommé MET, permet ensuite aux cellules cancéreuses en circulation de coloniser des sites secondaires afin de former des métastases.
2. Drosophila melanogaster
Drosophila melanogaster est un modèle in vivo qui contribue grandement à la compréhension des processus
biologiques communs avec l’humain. En effet, les processus biologiques fondamentaux sont très bien conservés au cours de l’évolution (St Johnston, 2002). Il existe donc de nombreuses similitudes au niveau du développement entre la drosophile et l’humain. D’ailleurs, il est estimé qu’environ 75% des gènes associés aux
5
maladies humaines ont des orthologues chez la drosophile (Reiter, Potocki, Chien, Gribskov, & Bier, 2001). Puisque c’est un modèle in vivo, il possède l’avantage d’intégrer les processus biologiques complexes dans un contexte beaucoup plus près de la réalité que les cellules en culture. Ce modèle permet d’évaluer la morphologie et l’intégrité tissulaire ainsi que les impacts sur le développement et la viabilité de l’organisme. La drosophile est donc un modèle de choix pour étudier la polarité épithéliale. De plus, la drosophile est un outil génétique puissant. Il y a souvent plusieurs homologues ou paralogues chez l’humain et un seul orthologue équivalent chez la drosophile. Il existe donc moins de redondance chez la drosophile, ce qui facilite grandement l’étude fonctionnelle de diverses protéines. La drosophile possède également une génétique très malléable (Rubin & Lewis, 2000). Il n’existe que quatre chromosomes chez la drosophile et il n’y a aucune recombinaison méiotique chez le mâle. La séquence entière du génome de la drosophile a été publiée en 2000 (Adams et al., 2000). De plus, le cycle de vie de la drosophile est beaucoup plus court que celui des modèles murins. Alors que les souris prennent de trois à quatre mois à produire une descendance, la drosophile a un cycle de vie qui ne dure que 10 à 12 jours à 25C (ou 28 jours à 18C). Puisque c’est un modèle peu coûteux et largement utilisé, il existe de nombreuses lignées de drosophiles mutantes et transgéniques disponibles dans des banques comme « Bloomington Drosophila Stock Center » et « Drosophila Genomics and Genetic Resources ».
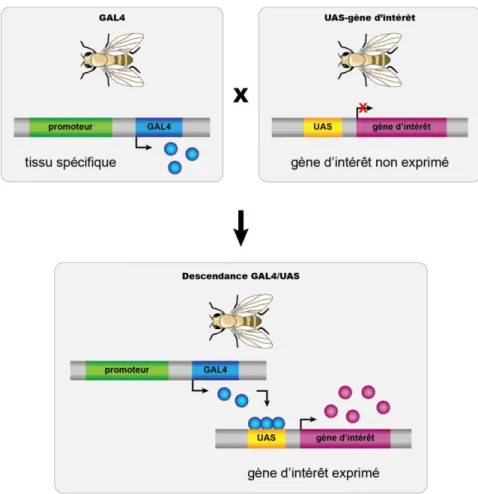
Il existe un système, nommé UAS-GAL4, qui permet d’induire l’expression de protéines dans des tissus spécifiques chez la drosophile (Brand & Perrimon, 1993). Dans ce système, le gène d’intérêt est inséré dans le plasmide pUASTattB, qui contient la séquence UAS (dont l’activation dépend de la GAL4), un site permettant l’intégration dans le génome de la drosophile et un gène de sélection permettant d’identifier les mouches ayant intégré le transgène (Venken & Bellen, 2005). Ce plasmide est injecté dans des embryons, qui n’exprimeront pas le transgène en absence de GAL4. Le gène de levure codant pour GAL4, qui est un activateur transcriptionnel, est inséré dans le génome d’une autre lignée de drosophile. Les mouches portant le gène GAL4 dans leur génome peuvent ensuite être croisées avec les mouches portant le UAS et le gène d’intérêt afin d’induire l’expression de ce dernier dans les mouches (Figure 4; Brand & Perrimon, 1993). Le plasmide pUASTattB peut aussi être transfecté dans des cellules de drosophiles en culture avec un plasmide exprimant la GAL4 sous le contrôle du promoteur de l’actine. Cette méthode permet des études préliminaires dans les cellules en culture qui pourront rapidement mener à des études in vivo.
6
Figure 4. Le système UAS-GAL4. Des mouches exprimant le gène GAL4 sous le contrôle d’un promoteur tissu spécifique sont croisées avec des mouches qui contiennent le gène d’intérêt sous le contrôle de la séquence UAS. La descendance ainsi obtenue exprime la protéine GAL4, qui lie la séquence UAS et active ainsi l’expression du gène d’intérêt.
La lignée cellulaire de drosophile la plus utilisée est la lignée des cellules Schneider 2 (S2; Rogers & Rogers, 2008). Les cellules S2 sont dérivées d’embryons de drosophile trypsinées à un stade tardif (Schneider, 1972). Leurs caractéristiques suggèrent qu’elles seraient dérivées d’hémocytes, des macrophages phagocytant les bactéries et les cellules apoptotiques chez la mouche (Rämet, Manfruelli, Pearson, Mathey-Prevot, & Ezekowitz, 2002). Les cellules S2 sont rondes et légèrement adhérentes. Elles forment une monocouche et à confluence, plusieurs cellules croissent en suspension (Buster, Nye, Klebba, & Rogers, 2010; Rogers & Rogers, 2008). Les cellules S2 ont l’avantage de croitre à température ambiante et dans des conditions atmosphériques normales, ce qui en facilite grandement la maintenance et la microscopie en temps réel (Buster et al., 2010). Dans ces conditions, leur cycle de division dure environ 20h (Rogers & Rogers, 2008). Bien que les cellules S2 ne soient pas polarisées, elles possèdent l’avantage d’avoir beaucoup moins de redondance fonctionnelle que les cellules de mammifères, ce qui facilite l’étude par perte de fonction d’une protéine cible (Buster et al., 2010; Rogers & Rogers, 2008). Un défi lors de l’étude par microscopie des cellules S2 est leur faible adhésion à la surface sur laquelle elles croissent. Pour surmonter ce défi, il est possible de transférer les cellules sur une surface
7
préalablement traitée avec la lectine Concanavaline A (ConA; Rogers, Wiedemann, Stuurman, & Vale, 2003). La ConA provoque l’attachement et l’aplatissement des cellules S2 sur la surface, ce qui permet de fixer et traiter les cellules pour des expériences subséquentes, comme dans le cas d’une immunofluorescence.
3. Les jonctions cellulaires
Les principales jonctions cellulaires retrouvées dans les tissus épithéliaux sont les desmosomes, les jonctions adhérentes, les jonctions serrées et les jonctions communicantes (non discutées dans le présent ouvrage). Les JA permettent la cohésion entre les cellules composant les tissus épithéliaux. Elles sont robustes pour permettre la résistance au stress mécanique et dynamiques pour permettre d’établir de nouveaux contacts lors du développement, du renouvellement tissulaire et de la réparation tissulaire (T. J. Harris & Tepass, 2010). Les jonctions occlusives permettent de maintenir des différences biochimiques d’une part et d’autres du tissu épithélial, ce qui est indispensable à l’homéostasie des organes (Rodriguez-Boulan & Macara, 2014).
3.1.
Les desmosomes
Les desmosomes sont les jonctions les plus abondantes dans les tissus épithéliaux stratifiés chez les vertébrés (Franke, 2009). Leur fonction principale est l’adhésion afin de maintenir l’intégrité tissulaire chez les vertébrés. Ils forment des points d’adhésion qui sont dépendants du calcium et qui sont dispersés dans la membrane cellulaire latérale (Najor, 2018). Ils sont composés de protéines transmembranaires de la famille des cadhérines nommées desmogléine et desmocolline, de protéines adaptatrices nommées plakoglobine et plakophiline et de desmoplakine (Figure 5a). Il existe aussi plusieurs protéines accessoires qui lient les desmosomes, dont certaines contribuent à l’adhésion. Les desmosomes ont une structure très organisée avec une région centrale dans l’espace intercellulaire où les extrémités N-terminales des cadhérines interagissent en trans. Pour leur part, les plaques cytoplasmiques des desmosomes lient les filaments intermédiaires de kératine à l’aide de la desmoplakine (Figure 5a), générant une plus grande résistance au stress mécanique (Garrod & Chidgey, 2008). En plus d’être présents dans les tissus épithéliaux, les desmosomes se retrouvent dans d’autres tissus soumis à de forts stress mécaniques, comme le cœur. Des mutations au sein des composantes des desmosomes peut mener à diverses maladies dermatologiques et pourrait avoir des rôles dans le cancer (Najor, 2018; Wong et al., 2008).
3.2.
Les jonctions adhérentes
Les JA sont cruciales pour la cohésion intercellulaire. Une des JA les plus importantes est la ZA. On la retrouve dans la majorité des cellules épithéliales, où elle forme une ceinture qui sépare le domaine apical du domaine latéral et elle permet de maintenir l’intégrité des feuillets épithéliaux (Campanale, Sun, & Montell, 2017; T. J. Harris & Tepass, 2010; Laprise & Tepass, 2011). La composante principale de la ZA est un récepteur de la
8
famille des cadhérines, soit la E-Cad dans les tissus épithéliaux (ou DE-Cad chez la drosophile). Celle-ci contient plusieurs répétitions de domaines cadhérine conservés dans sa région extracellulaire. Ces domaines sont stabilisés par le calcium et participent à des interactions homotypiques avec les E-Cad des cellules voisines (interaction en trans) pour médier l’adhésion et la reconnaissance cellulaire (Brüser & Bogdan, 2017; Coopman & Djiane, 2016; T. J. Harris & Tepass, 2010). Puisque cette interaction en trans est relativement faible, plusieurs molécules d’E-Cad s’assemblent en cis pour former un multimère qui intensifie l’adhésion (Figure 5b; Harrison et al., 2011). En plus des interactions extracellulaires avec les E-Cad voisines, l’E-Cad interagit avec les caténines, notamment la p120-caténine (p120ctn) et la β-caténine (β-cat; appelées respectivement p120ctn et Armadillo [Arm] chez la drosophile) grâce à son domaine cytoplasmique (Figure 5b). La p120ctn stabilise l’E-Cad en inhibant son endocytose et en favorisant son interaction avec les microtubules (Coradini et al., 2011; Shahbazi et al., 2013). La liaison de l’E-Cad avec l’α-caténine (α-cat) et la β-cat forme le complexe cadhérine-caténine (CCC; T. J. Harris & Tepass, 2010). Celui-ci permet de lier le réseau d’actomyosine, créant ainsi une ceinture d’actomyosine au pourtour de la cellule (Bertocchi et al., 2017; T. J. Harris, 2012; Perez-Moreno & Fuchs, 2006). Cette liaison au réseau d’actomyosine permet d’effectuer la constriction du domaine apical, phénomène crucial à la fois lors de l’embryogenèse et pour l’homéostasie tissulaire (T. J. Harris & Tepass, 2010; Yonemura, 2011). Cette interaction permet également de lier la ZA de façon indirecte au cytosquelette des cellules voisines, ce qui contribue à la cohésion entre les cellules épithéliales (Bertocchi et al., 2017).
3.3.
Les jonctions serrées
Les JS forment une ceinture de points de contact focaux entre les membranes plasmiques de cellules voisines, souvent appelées « kissing points » (Tsukita, Furuse, & Itoh, 2001). Elles forment une barrière extracellulaire qui bloque la diffusion passive et régule la diffusion paracellulaire selon la taille et la charge des solutés (Franke, 2009; Zihni, Mills, Matter, & Balda, 2016). Cette régulation de la diffusion est cruciale pour maintenir les différences de composition entre les différents compartiments du corps et donc pour leur homéostasie. Les JS se retrouvent au-dessus de la ZA chez les vertébrés. Chez les invertébrés, ce type de jonction se nomme JSep et elle est localisée sous la ZA (Campanale et al., 2017; Tsukita et al., 2001). Les principales protéines qui composent les JS sont les claudines, les occludines et les « Junctional Adhesion Molecules » (JAM; Figure 5c; Coradini et al., 2011). En extracellulaire, ces protéines interagissent en trans pour médier l’adhésion aux cellules voisines et ainsi fermer l’espace intercellulaire (Van Itallie & Anderson, 2013). Les claudines sont considérées comme l’élément central des JS et elles confèrent la spécificité de la perméabilité aux différents ions en paracellulaire (Bhat et al., 2018). Au niveau de la plaque cytoplasmique, on retrouve un réseau de protéines adaptatrices qui interagissent avec les composantes intracellulaires des protéines transmembranaires. Ces protéines peuvent également lier l’actine et les microtubules, assurant un lien entre les JS et le cytosquelette (Zihni et al., 2016). Un exemple important est la protéine zonula occludens 1 (ZO-1), qui lie à la fois les claudines,
9
les JAM et les occludines avec ses domaines PDZ et GUK et la protéine de signalisation ZONAB avec son domaine SH3 (Zihni et al., 2016). Ainsi, on retrouve un important réseau signalétique à la face intracellulaire des JS. Ceci permet une communication bidirectionnelle, c’est-à-dire des JS vers l’intérieur de la cellule, mais également de l’intérieur de la cellule vers les JS pour permettre aux cellules de moduler leurs contacts et de réagir aux changements comme lors d’une perte des cellules voisines. Étant donné les nombreuses voies de signalisation qu’elles influencent, il n’est pas surprenant de constater que des dérèglements au niveau des JS sont impliqués dans la prolifération et la formation de tumeurs (Runkle & Mu, 2013).
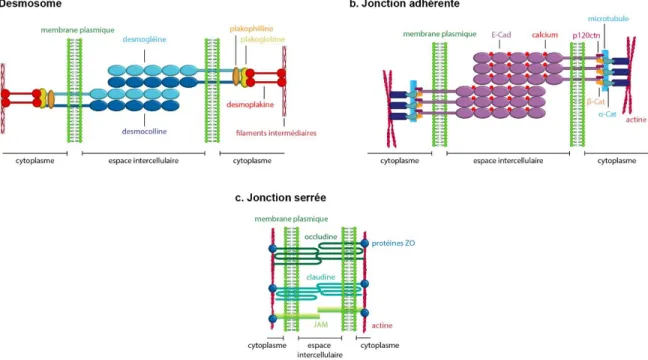
Figure 5. Structure générale des jonctions cellulaires. a. Les desmosomes sont composés de protéines
transmembranaires de la famille des cadhérines, soit la desmogléine et la desmocolline, ainsi que la plakoglobine, la plakophiline et la desmoplakine du côté cytoplasmique. Dans l’espace intercellulaire, les cadhérines interagissent en trans alors que du côté cytoplasmique, les desmosomes interagissent avec les filaments intermédiaires de kératine. b. La composante principale de la ZA est l’E-Cad, stabilisée par le calcium. L’E-Cad participe à des interactions en trans avec les E-Cad des cellules voisines. Il y a aussi des interactions en cis afin d’intensifier l’adhésion entre les E-Cad. En intracellulaire, la E-Cad interagit avec la β-cat et l’α-cat pour former le CCC et lier l’actomyosine. La p120ctn permet de lier les microtubules et empêche l’endocytose de l’E-Cad. c. Les JS sont composées principalement des claudines, des occludines et des JAM. Ce sont les claudines qui confèrent la spécificité de la barrière paracellulaire formée par les JS. Les protéines transmembranaires composant les JS interagissent en trans dans l’espace intercellulaire. En intracellulaire, ces protéines lient plusieurs protéines adaptatrices, dont les protéines ZO.
10
4. La polarité épithéliale
La distribution asymétrique des composantes cellulaires permet la formation d’un domaine apical et un domaine basolatéral (appellation groupée du domaine latéral et du domaine basal), séparés l’un de l’autre par la ZA. La majorité des protéines qui établissent et qui maintiennent cette polarité sont conservées dans toutes les espèces animales (Tepass, 2012). Ces protéines contrôlent la localisation de médiateurs clés pour la prolifération, l’apoptose, la différenciation et l’organisation tissulaire (Chatterjee & McCaffrey, 2014). Le maintien de la polarité épithéliale est donc crucial pour la bonne fonction des cellules épithéliales. Il existe des lipides et plusieurs complexes protéiques qui orchestrent la polarité épithéliale, dont le complexe Par et le complexe Crumbs (Crb) au domaine apical et le module Scribble (Scrib) et le groupe Yurt (Yrt)/Coracle (Cora) au domaine basolatéral.
4.1.
Les phosphoinositides
Les phosphoinositides (PI ou PtdIns) sont des lipides membranaires amphiphiles concentrés sur la surface cytosolique des membranes. Bien qu’ils ne constituent que moins de 1% des lipides cellulaires, ils jouent des rôles cruciaux dans plusieurs fonctions cellulaires en recrutant de façon réversible diverses protéines ou complexes protéiques à la membrane (Schink, Tan, & Stenmark, 2016; Shewan, Eastburn, & Mostov, 2011). Les PI jouent des rôles importants dans des processus tel que le trafic vésiculaire, la régulation du réseau d’actomyosine, le chimiotactisme, la cytokinèse et la polarité épithéliale (Balla, 2013; Comer & Parent, 2007; Khwaja, Lehmann, Marte, & Downward, 1998; H. Liu, Radisky, Wang, & Bissell, 2004; Molitoris & Simon, 1986; Shewan et al., 2011). Ils sont donc indispensables à la morphogenèse. Différentes combinaisons de phosphorylations des groupes inositols en position 3, 4, et 5 permettent de générer sept différentes isoformes de PI phosphorylés (PIP), qui servent de signature pour les différentes membranes au sein de la cellule et assurent le transport approprié des vésicules. Plusieurs kinases et phosphatases régulent finement ces phosphorylations (Figure 6; Claret, Jouette, Benoit, Legent, & Guichet, 2014; Shewan et al., 2011) afin d’enrichir les PtdIns(4,5)P2 à la membrane apicale et les PtdIns(3,4,5)P3 à la membrane basolatérale (Claret et al., 2014; Schink et al., 2016). Cette séparation des PIP entre le domaine apical et basolatéral permet de cibler les protéines, notamment celles impliquées dans la polarité, au domaine approprié (Gassama-Diagne et al., 2006; Martin-Belmonte et al., 2007; Román-Fernández et al., 2018).
11
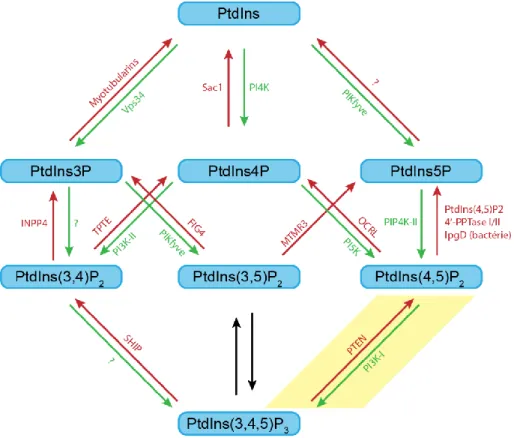
Figure 6. Régulation des phosphoinositides. Plusieurs kinases (en vert) et phosphatases (en rouge) régulent la
phosphorylation du groupe inositol des PI en position 3, 4 et 5. Elles génèrent différents PIP qui permettent de conserver l’identité des différentes membranes cellulaires. L’antagonisme entre PI3K et PTEN (en jaune) est particulièrement important pour la polarité épithéliale puisqu’il permet d’enrichir les PtdIns(4,5)P2 à la membrane apicale et les
PtdIns(3,4,5)P3 à la membrane basale.Adapté de Schink et al., 2016.
L’activation de la PI(3)-kinase (PI3K), une kinase hautement conservée qui converti les PtdIns(4,5)P2 en PtdIns(3,4,5)P3, est importante pour l’identité de la membrane basale. Cette kinase peut être activée notamment par la voie des intégrines et par l’E-Cad (Shewan et al., 2011). Dans des cellules de mammifères en culture, l’inhibition de la PI3K provoque une diminution de la taille du domaine basolatéral et conséquemment une réduction de la hauteur des cellules (Gassama-Diagne et al., 2006; Jeanes, Smutny, Leerberg, & Yap, 2009). L’insertion ectopique de PtdIns(3,4,5)P3 au domaine apical cause le recrutement de plusieurs protéines basolatérales au domaine apical en plus d’exclure des protéines apicales, soulignant le rôle des PtdIns(3,4,5)P3 comme déterminant du domaine basolatéral (Gassama-Diagne et al., 2006). La protéine apicale « Atypical Protein Kinase C » (aPKC) contribue aussi à restreindre les PtdIns(3,4,5)P3 à la membrane basolatérale afin de maintenir les différences entre ces deux membranes (Takahama, Hirose, & Ohno, 2008).
Le domaine apical est plutôt enrichi de PtdIns(4,5)P2, notamment grâce à l’action de la PI(5)-kinase (PI5K) qui phosphoryle les PtsIns4P en PtdIns(3,4)P2 et de la « Phosphatase and tensin homolog» (PTEN) qui
12
déphosphoryle les PtdIns(3,4,5)P3 en PtdIns(4,5)P2 (Downes et al., 2007; Stiles, Groszer, Wang, Jiao, & Wu, 2004). PTEN module des processus tels que la polarité, la formation des jonctions cellulaires, la perméabilité paracellulaire, la migration et la progression tumorale (Langlois et al., 2010). Il existe des interactions entre PTEN et des protéines de la polarité épithéliale, comme la protéine PAR3, qui favorise le recrutement de PTEN aux jonctions cellulaires pour moduler les niveaux de PtdIns(3,4,5)P3 (Balla, 2013; W. Feng, Wu, Chan, & Zhang, 2008; Pinal et al., 2006; von Stein, Ramrath, Grimm, Müller-Borg, & Wodarz, 2005). PTEN peut également interagir avec la protéine apicale Crb, qui module son activité dans les glandes salivaires de drosophile (Lattner, Leng, Knust, Brankatschk, & Flores-Benitez, 2019). La présence de PTEN au domaine apical a aussi une grande influence sur la polarité épithéliale (Langlois et al., 2010; Martin-Belmonte et al., 2007). En effet, dans les cellules MDCK formant des kystes, les PtdIns(4,5)P2 et PTEN sont enrichis au domaine apical (Martin-Belmonte et al., 2007). Les PtdIns(4,5)P2 peuvent lier la protéine Annexine 2 (Anx2; Rescher, Ruhe, Ludwig, Zobiack, & Gerke, 2004), qui peut à son tour interagir avec la petite GTPase Cdc42. Cette dernière peut recruter les protéines de polarité PAR6 et aPKC pour assembler le complexe PAR (discuté dans la section 4.2.1 de l’introduction; Comer & Parent, 2007; Martin-Belmonte et al., 2007; Schink et al., 2016). En effet, la perte de PTEN, Anx2 ou Cdc42 résulte en l’accumulation cytoplasmique des protéines PAR6/aPKC (Martin-Belmonte et al., 2007). Une diminution de PtdIns(4,5)2 mène au démantèlement des JA, une réorganisation du cytosquelette d’actine et la constriction du domaine apical (Claret et al., 2014). À l’inverse, l’ajout de PtdIns(4,5)2 au domaine basolatéral mène à une redistribution de protéines apicales (dont Anx2, Cdc42 et aPKC) et de protéines des jonctions cellulaires au domaine basolatéral (Martin-Belmonte et al., 2007). Afin de maintenir des niveaux appropriés de PtdIns(4,5)P2 au domaine apical, il est également important de limiter l’action de la PI3K. La protéine apicale Crb participe à un antagonisme mutuel avec cette kinase pour moduler la taille du domaine apical et maintenir l’intégrité tissulaire. Une boucle de rétroaction positive entre la PI3K et la protéine Rac1 contribue à leur activation respective. Cette boucle de rétroaction ainsi que la signalisation par la voie PI3K sont inhibées par la protéine apicale Crb (Chartier, Hardy É, & Laprise, 2011).
Des mutations au niveau des kinases et des phosphatases régulant les PIP sont fréquemment rencontrées dans le cancer. En effet, la PI3K est souvent mutée et suractive dans le cancer (Samuels et al., 2004). Ceci permet une croissance cellulaire indépendante des signaux extracellulaires (Goncalves, Hopkins, & Cantley, 2018). La mutation de PI3K est suffisante pour promouvoir la prolifération cellulaire et la dissémination de cellules cancéreuses injectées dans des souris (Gustin et al., 2009; Pang et al., 2009; Samuels et al., 2005). Les inhibiteurs de PI3K ont fait l’objet de plusieurs études cliniques, mais leur efficacité est variable et ces drogues seraient plus efficaces en combinaison avec d’autres drogues anticancéreuses (Burke, 2018; Goncalves et al., 2018). Pour sa part, PTEN est un suppresseur de tumeur. Sa perte de fonction a été observée dans plusieurs
13
cancers, et une diminution – même légère – de son activité favoriserait la progression tumorale (Lee, Chen, & Pandolfi, 2018).
4.2.
Le domaine apical
4.2.1. Le complexe Par
Le complexe Par est composé de la sérine/thréonine kinase aPKC, les protéines PAR-6 et PAR-3 et la petite GTPase Cdc42 (Goldstein & Macara, 2007; Laprise & Tepass, 2011). Les protéines PAR sont des protéines hautement conservées qui ont tendance à lier le cortex cellulaire de façon asymétrique, ce qui leur permet de jouer des rôles dans la polarisation cellulaire (Goldstein & Macara, 2007; Kemphues, 2000). Le complexe est impliqué dans la polarité apico-basale, la polarité antéro-postérieure lors du développement et la polarité lors de la migration cellulaire (Aranda, Nolan, & Muthuswamy, 2008). En effet, le complexe Par contribue à la migration cellulaire en contrôlant l’activité de l’actomyosine et des GTPases dans l’espace (Aranda et al., 2008). Il joue également des rôles dans le remodelage des JA en modulant l’endocytose (Georgiou, Marinari, Burden, & Baum, 2008; K. P. Harris & Tepass, 2008). De plus, le complexe peut limiter l’activité de la GTPase Rho aux JA pour moduler la tension apicale et, conséquemment, la forme des épithéliums (Warner & Longmore, 2009). L’activité des différents membres du complexe Par peut être influencée par les PIP. Effectivement, les PtdIns(4,5)P2 générés par PTEN peuvent recruter Cdc42 à la membrane apicale. PTEN peut également lier PAR3 pour promouvoir la formation des JS (Pinal et al., 2006; von Stein et al., 2005).
La protéine PAR3 n’a qu’un seul orthologue chez la drosophile, que l’on nomme Bazooka (Baz), alors que deux orthologues existent chez les mammifères : PAR3α et PAR3β (Assemat, Bazellieres, Pallesi-Pocachard, Le Bivic, & Massey-Harroche, 2008). C’est PAR3α qui interagit avec les membres du complexe Par (Izumi et al., 1998). En plus d’avoir des rôles dans le complexe Par, Baz/PAR3 a également des fonctions indépendantes de celui-ci qui sont cruciales pour la polarisation des cellules et l’organisation des JA et des JS (T. J. Harris & Peifer, 2004; Simoes Sde et al., 2010; Suzuki et al., 2001; Tabuse et al., 1998; Tepass, 2012).
Chez la drosophile, le complexe Par se forme initialement lorsque Par6 et aPKC lient Baz, ce qui permet leur recrutement au domaine apical (T. J. Harris & Peifer, 2005; Suzuki & Ohno, 2006). La phosphorylation de Baz par aPKC diminue l’interaction entre ces deux protéines et l’interaction entre Baz et la protéine Stardust (Sdt) pour permettre la formation du complexe Crb-Sdt (décrit dans la section 4.2.2 de l’introduction; Krahn, Bückers, Kastrup, & Wodarz, 2010; Morais-de-Sa, Mirouse, & St Johnston, 2010). La perte d’interaction entre Baz et Par6/aPKC permet à Baz de se rendre aux JA, où elle peut recruter les protéines de jonction Echinoid/Nectine et Arm/β-cat (Wei et al., 2005). Baz peut ainsi recruter les CCC qui contribuent à la formation des JA (McGill, McKinley, & Harris, 2009) et assurer la bonne localisation de celles-ci dans la cellule (Morais-de-Sa et al., 2010).
14
De plus, par son interaction avec les JAM (Ebnet et al., 2001), PAR3 est importante pour la formation des JS dans les cellules de mammifères (X. Chen & Macara, 2006). Parallèlement, la perte d’interaction entre Baz et Par6/aPKC permet à Par6/aPKC de se rendre à la membrane apicale (T. J. Harris & Peifer, 2005; Horikoshi et al., 2009; McCaffrey & Macara, 2009; Morais-de-Sa et al., 2010; Walther & Pichaud, 2010). Le recrutement de Par6/aPKC au domaine apical est également favorisé par l’interaction entre Par6 et Crb. Cette interaction est plus forte que l’interaction entre Par6 et Baz (Morais-de-Sa et al., 2010; Walther & Pichaud, 2010).
Un mode de régulation important pour Baz/PAR3 est l’oligomérisation. L’oligomérisation de Baz, médiée par sa région N-terminale, est indispensable pour sa bonne localisation au cortex cellulaire via sa liaison aux PIP (Benton & St Johnston, 2003a; J. Chen & Zhang, 2013; Dickinson, Schwager, Pintard, Gotta, & Goldstein, 2017; T. J. C. Harris, 2017; Kullmann & Krahn, 2018). Au domaine basolatéral, après sa phosphorylation par la kinase Par1, Baz lie la protéine 14-3-3 qui bloque son oligomérisation et son interaction avec aPKC (Dickinson et al., 2017; Kullmann & Krahn, 2018; Laprise & Tepass, 2011). Ainsi, Baz interagit avec de multiples protéines et lipides, dont aPKC (Nagai-Tamai, Mizuno, Hirose, Suzuki, & Ohno, 2002), Sdt (Krahn, Bückers, et al., 2010), Par1 (Benton & St Johnston, 2003b),les PIP (Krahn, Klopfenstein, Fischer, & Wodarz, 2010) et la protéine 14-3-3 (Benton & St Johnston, 2003b).
La famille des PKC dont fait partie aPKC est fortement conservée chez les eucaryotes (Mellor & Parker, 1998). Cette famille comprend les PKC conventionnelle (cPKC) PKCα, PKCβ et PKCγ, qui sont activées par leur liaison aux phospholipides, le diacylglycérol (DAG) et/ou le calcium. Pour leur part, les nouvelles PKC (nPKC) sont activées de façon semblable, mais contrairement aux cPKC, elles ne répondent pas directement au calcium. Finalement, les aPKC ne dépendent ni du calcium, ni du DAG. Elles sont plutôt activées par leur interaction avec Par6 (Akimoto et al., 1994; W. S. Liu & Heckman, 1998; Rosse et al., 2010). La signalisation par les PKC est très localisée, ce qui permet d’augmenter leur spécificité dans le temps et l’espace (Rosse et al., 2010). aPKC est particulièrement importante dans la polarité épithéliale puisqu’elle est un déterminant apical majeur chez la drosophile (Kim et al., 2009; Rolls, Albertson, Shih, Lee, & Doe, 2003; Wodarz, Ramrath, Grimm, & Knust, 2000) et elle assure (avec les autres composantes du complexe Par) le bon positionnement des JA en régulant le cytosquelette et le trafic vésiculaire (Georgiou et al., 2008; K. P. Harris & Tepass, 2008; T. J. Harris & Peifer, 2007; Leibfried, Fricke, Morgan, Bogdan, & Bellaiche, 2008).
L’activité d’aPKC est inhibée par une interaction entre son motif pseudo-substrat et son domaine kinase (Graybill, Wee, Atwood, & Prehoda, 2012). Lorsque Par-6 lie aPKC, elle bloque cette auto-inhibition, activant ainsi aPKC (Graybill et al., 2012; C. Wang, Shang, Yu, & Zhang, 2012). Une fois activée, aPKC peut phosphoryler de nombreuses cibles qui contribuent à la polarité. La majorité de ces cibles sont conservées de
15
la mouche à l’humain. Ainsi, aPKC peut phosphoryler les protéines Baz/PAR3 (Nagai-Tamai et al., 2002) et Crb (Sotillos, Diaz-Meco, Caminero, Moscat, & Campuzano, 2004) ainsi que les protéines basolatérales Lethal (2) Giant Larvae (Lgl; Betschinger, Mechtler, & Knoblich, 2003; Musch et al., 2002; Plant et al., 2003; Yamanaka et al., 2003), Yrt (Gamblin, Hardy, Chartier, Bisson, & Laprise, 2014) et Par1 (Hurov, Watkins, & Piwnica-Worms, 2004). La phosphorylation de Crb par aPKC est requise pour la bonne localisation et la fonction du complexe Crb (Fletcher, Lucas, Brain, Tournier, & Thompson, 2012; Hurd, Gao, Roh, Macara, & Margolis, 2003; Lemmers et al., 2004; Q. Wang, Hurd, & Margolis, 2004). Par sa phosphorylation de Baz, Lgl, Yrt et Par1, aPKC permet d’exclure ces protéines du domaine apical afin de préserver l’identité de ce dernier (Campanale et al., 2017; Gamblin et al., 2014; Tepass, 2012). Le maintien de l’identité du domaine apical est également assuré par la kinase Pak1, qui agit de façon redondante avec aPKC (Aguilar-Aragon et al., 2018). La phosphorylation de PAR-1b, un des orthologues mammifères de Par-1, permet de réguler négativement son activité en la dissociant de la membrane latérale et en l’excluant du domaine apical (Hurov et al., 2004; Suzuki et al., 2004). Quant à la phosphorylation de Lgl par aPKC, elle permet de moduler sa localisation et ses fonctions (discuté à la section 4.3.1 de l’introduction; Bailey & Prehoda, 2015; Hutterer, Betschinger, Petronczki, & Knoblich, 2004; Musch et al., 2002; Raman et al., 2016; Yamanaka et al., 2003).
Finalement, Par6 joue des rôles importants dans le développement embryonnaire et l’établissement de la polarité épithéliale. Par-6 est une co-activatrice d’aPKC. Sans elle, aPKC est incapable de délocaliser Lgl du cortex cellulaire (Graybill et al., 2012). Elle permet d’assurer la bonne localisation apicale d’aPKC en liant Cdc42 (Noda et al., 2001; Tepass, 2012). Cette liaison au domaine apical est aussi importante pour l’activité de Par6 et aPKC (Tepass, 2012; Yamanaka et al., 2001). En plus de pouvoir lier aPKC et Cdc42, Par6 interagit aussi avec Par3 (Joberty, Petersen, Gao, & Macara, 2000), Sdt et Patj, ce qui lui permet de lier indirectement la protéine Crb (Bulgakova, Kempkens, & Knust, 2008; Nam & Choi, 2003; Q. Wang et al., 2004).
Chez les mammifères, la dissociation ou la suppression du complexe PAR contribue à la progression tumorale, notamment en favorisant l’EMT et le démantèlement des JS (Ozdamar et al., 2005; X. Wang et al., 2019). La dissociation du complexe peut être médiée par l’hypoxie (Zhou et al., 2017) ou la phosphorylation de PAR6 par aPKC (Gunaratne, Thai, & Di Guglielmo, 2013; Ozdamar et al., 2005). L’expression de PAR3 est souvent altérée dans le cancer. La diminution de PAR3 mène à une perte de cohésion intercellulaire (Guo et al., 2016; Xue, Krishnamurthy, Allred, & Muthuswamy, 2013). Elle a été observée dans des cancers tel que le cancer du sein (Jung et al., 2019), de la thyroïde (Tuccilli et al., 2017), de l’œsophage (Kitaichi et al., 2017) et du pancréas (Guo et al., 2016). D’autre part, la surexpression de PAR3 peut contribuer à la progression tumorale dans d’autres cancers. La surexpression de PAR3 peut mener à sa délocalisation dans les cancers du rein (Dugay et al., 2014) et du foie (Jan et al., 2013). Une surexpression de PAR3 a également été démontrée dans le cancer
16
de la prostate (Zhou et al., 2017) et de l’ovaire (Nakamura et al., 2016). Finalement, PAR6 est elle aussi surexprimée dans certains cancers, comme le cancer du sein (Nolan et al., 2008).
4.2.2. Le complexe Crumbs
Le complexe Crb est composé de Crb/Sdt/Patj chez la drosophile et de CRB/PALS1/PATJ chez les mammifères. Il joue des rôles cruciaux dans la polarité épithéliale et la formation des jonctions cellulaires (Roh, Fan, Liu, & Margolis, 2003). Tel que mentionné précédemment, Sdt lie Baz au niveau des JA. La phosphorylation de Baz par aPKC affaiblit cette interaction, permettant ainsi à Sdt de lier Crb (Krahn, Klopfenstein, et al., 2010). Cette liaison entre Sdt et Crb assure une bonne localisation et fonction de ces protéines dans la polarité en plus d’augmenter leur stabilité (Hong, Stronach, Perrimon, Jan, & Jan, 2001). En effet, Sdt empêche l’endocytose de Crb (Lin et al., 2015). Cette action est antagonisée par la E3 ubiquitine-ligase Neuralized (Neur), qui cible Sdt et permet ainsi l’endocytose de Crb (Perez-Mockus, Roca, Mazouni, & Schweisguth, 2017). Sdt permet aussi de relier le complexe Crb au complexe Par grâce à ses interactions avec Patj et Par6 (Sotillos et al., 2004; Tepass, 2012). Patj/PATJ est elle aussi responsable de stabiliser Crb/CRB à la membrane apicale, tant chez la drosophile que chez les mammifères (Michel et al., 2005; Richard, Grawe, & Knust, 2006). Patj/PATJ joue des rôles dans la formation des JS (Adachi et al., 2009; Michel et al., 2005; Shin, Straight, & Margolis, 2005) et supporte la formation des JA, influençant ainsi la morphogenèse tissulaire (Roh et al., 2003; Tepass, 2012).
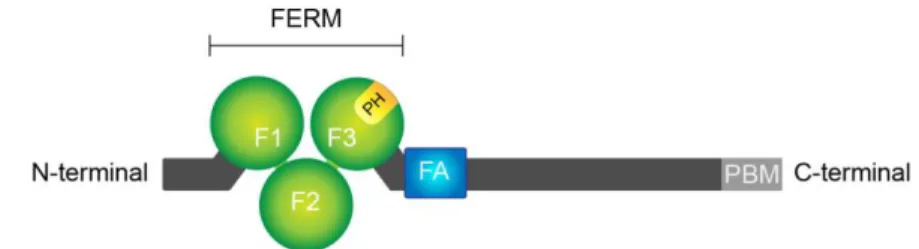
Crb est une protéine apicale transmembranaire exprimée dans les tissus épithéliaux dérivés de l’ectoderme. Elle est donc exprimée dans la majorité des épithéliums chez la drosophile (Tepass, Theres, & Knust, 1990). Outre son domaine transmembranaire, Crb possède un domaine extracellulaire et une courte portion intracellulaire contenant un « PDZ-Binding Domain » (PBD) et une région « FERM Domain Binding » (FDB) pouvant lier les domaines « Four point one, Ezrin, Radixin, Moesin » (FERM; Figure 7; Laprise et al., 2006). Cette protéine est conservée de la drosophile à l’humain (Assemat et al., 2008), chez qui on compte 3 orthologues, soit CRB1, CRB2 et CRB3. La protéine CRB1, tout comme Crb chez la drosophile, est présente dans les photorécepteurs de la rétine où elle maintient l’intégrité de la ZA et stabilise le cytosquelette de spectrine (Pellikka et al., 2002). Des mutations de CRB1 sont impliquées dans la pathogenèse de dystrophies autosomales de la rétine (den Hollander et al., 2004). Pour sa part, CRB2 est surtout exprimée dans la rétine, le cerveau et les reins et à des niveaux plus faibles dans les poumons, le placenta et le cœur (van den Hurk et al., 2005). Des mutations de CRB2 sont associées à des défauts au niveau de la rétine (Alves et al., 2019; X. Chen et al., 2019; Quinn, Alves, Klooster, & Wijnholds, 2018) et à certains syndromes néphrotiques (Udagawa et al., 2017). Elle est également cruciale pour le développement cardiaque (Jiménez-Amilburu & Stainier, 2019) et la gastrulation (Ramkumar et al., 2016). Quant à CRB3, elle est présente dans la plupart des épithéliums (Klebes & Knust, 2000). Elle se localise au domaine apical et aux JS afin de supporter la polarité épithéliale et
17
maintenir l’intégrité des JS (Fogg, Liu, & Margolis, 2005; Lemmers et al., 2002; Makarova, Roh, Liu, Laurinec, & Margolis, 2003; Margolis, 2018; Tilston-Lunel et al., 2016).
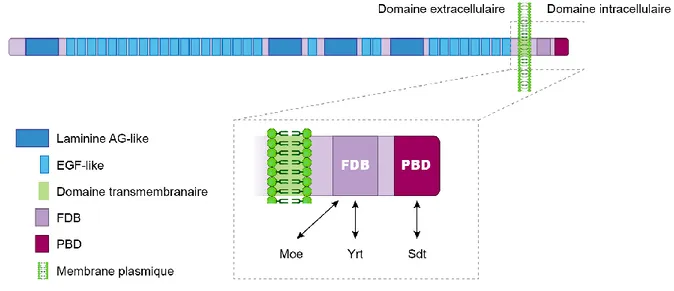
Figure 7. Structure de la protéine Crb/CRB. La protéine Crb/CRB a un long domaine extracellulaire contenant des répétitions EGF-like et Laminine AG-like, un domaine transmembranaire et un court domaine intracellulaire. Ce dernier contient un motif FDB lui permettant d’interagir avec le domaine FERM de Moesin (Moe) et Yrt et un motif PBD lui permettant d’interagir avec Sdt. Cette dernière lie également Patj, ce qui permet la formation du complexe Crb.
Chez la drosophile, Crb se localise dans la zone marginale, c’est-à-dire la portion de la membrane apicale juste au-dessus de la ZA (Tepass, 1996). Elle joue des rôles dans la polarité épithéliale, la régulation de la taille du domaine apical et dans la formation des jonctions cellulaires (Pellikka et al., 2002; Salis et al., 2017; Tepass, 1996; Wodarz et al., 2000). Crb est également impliquée dans la constriction apicale, laquelle joue des rôles majeurs dans la morphogenèse tissulaire (Bazellieres, Aksenova, Barthelemy-Requin, Massey-Harroche, & Le Bivic, 2018; Flores-Benitez & Knust, 2015; Letizia, Sotillos, Campuzano, & Llimargas, 2011). Sans Crb, il y a une perte de l’identité de la membrane apicale et donc de la polarité épithéliale, une désorganisation des épithéliums notamment par l’absence de ZA et une augmentation de la mort cellulaire (Bachmann, Schneider, Theilenberg, Grawe, & Knust, 2001; Laprise et al., 2006; Tepass, 1996; Tepass et al., 1990; Wodarz, Grawe, & Knust, 1993). D’autre part, la surexpression de Crb mène à une augmentation de la taille de la membrane apicale et une diminution de la taille du domaine basolatéral (Wodarz, Hinz, Engelbert, & Knust, 1995). Dans le neuroectoderme, la portion extracellulaire de Crb est requise d’une part pour sa localisation apicale et d’autre part pour inhiber le récepteur Notch afin de réguler le nombre de cellules (Das & Knust, 2018). C’est le domaine intracellulaire qui module la majorité des autres fonctions de Crb grâce à sa liaison aux protéines à domaine FERM par son FDB et aux protéines à domaine PDZ par son PBD (Margolis, 2018). Le FDB de Crb est impliqué dans l’intégrité de la ZA (Izaddoost, Nam, Bhat, Bellen, & Choi, 2002; Klebes & Knust, 2000), l’abondance de
18
Crb à la membrane (Laprise et al., 2006) et la régulation de la croissance des tissus (Chen et al., 2010; Grzeschik, Parsons, Allott, Harvey, & Richardson, 2010; Ling et al., 2010; Robinson, Huang, Hong, & Moberg, 2010). En effet, Crb aide à établir et stabiliser la ZA en assurant la bonne localisation de Baz (McGill et al., 2009; Walther & Pichaud, 2010) et par ses interactions avec Patj (Klebes & Knust, 2000). Elle peut également lier le domaine PDZ de Par6 pour moduler son affinité avec Cdc42 (Whitney et al., 2016). Crb influence le cytosquelette d’actine en liant le domaine FERM de la protéine Moe, qui lie et module l’actine (Medina et al., 2002; Tepass, 2009). D’autres partenaires importants de Crb sont les protéines Lin7 et Yrt (Laprise & Tepass, 2011). De plus, Crb est une cible de aPKC et cette phosphorylation est importante pour ses fonctions (Sotillos et al., 2004).
Les protéines Crb/CRB3 ont aussi des implications en oncologie. L’expression de CRB3 est diminuée dans plusieurs cancers, dont le cancer du sein (P. Li et al., 2018; P. Li et al., 2017) et le cancer du rein (P. Li, Liu, Li, & Liu, 2019; Mao et al., 2015). Cette diminution augmente le potentiel tumorigène des cellules cancéreuses (Karp et al., 2008; P. Li et al., 2017), induit l’EMT et favorise la migration et l’invasion cellulaire (P. Li et al., 2017) en plus de donner des caractéristiques de cellules souches aux cellules cancéreuses (P. Li et al., 2018). De plus, l’expression de CRB3 est diminuée par des facteurs associés à l’EMT, comme ZEB1 et SNAIL, qui peuvent aussi réprimer l’expression de PATJ et PALS1 (Aigner et al., 2007; Whiteman, Liu, Fearon, & Margolis, 2008). Plusieurs de ces changements augmentent la résistance aux traitements contre le cancer. Il n’est donc pas surprenant que la diminution d’expression de CRB3 soit associée à un mauvais pronostic (P. Li et al., 2018; Mao et al., 2015). La réexpression de CRB3 permet de restaurer les jonctions cellulaires et la polarité tout en limitant la migration cellulaire et la formation de métastases (Karp et al., 2008; P. Li et al., 2017; Loie, Charrier, Sollier, Masson, & Laprise, 2015; Mao et al., 2015). Ceci peut s’expliquer en partie par le fait que l’expression de CRB3 bloque partiellement l’EMT induite par SNAIL (Whiteman et al., 2008). La surexpression de CRB3 dans des cellules dans lesquelles son expression était diminuée permet aussi de restaurer la sensibilité aux traitements anticancéreux, comme le tamoxifène dans le cancer du sein (P. Li et al., 2018).
4.3.
Le domaine basolatéral
4.3.1. Le module Scribble
Le module Scrib est composé des suppresseurs de tumeurs Scrib, Lgl et Discs large (Dlg). Chez l’humain, on retrouve un homologue de Scrib (SCRIB), cinq pour Dlg (DLG1-5) et deux pour Lgl (LGL1 et LGL2; Elsum, Yates, Humbert, & Richardson, 2012). Scrib, Dlg et Lgl sont localisées aux JSep et au cortex cellulaire du domaine basolatéral (Bilder, Li, & Perrimon, 2000; Bilder & Perrimon, 2000). Ces protéines agissent dans des voies communes pour moduler la polarité et la croissance cellulaire (Bilder et al., 2000). En plus de jouer des rôles dans la polarité apico-basale, le complexe régule d’autres formes de polarité, comme la division
19
asymétrique des cellules souches neuronales chez la drosophile (Carmena, 2020). Il régule également le cytosquelette d’actine et le trafic vésiculaire (Elsum et al., 2012). Le module Scrib joue un rôle central dans l’exclusion des déterminants apicaux hors du domaine basolatéral et il est impliqué dans l’assemblage et le positionnement de la ZA (Bilder et al., 2000; Bilder & Perrimon, 2000; Bonello, Choi, & Peifer, 2019). Une perte de Scrib mène à une distribution inappropriée des déterminants apicaux au domaine basolatéral et un mauvais positionnement des JA (Bilder & Perrimon, 2000). Chez la drosophile, une perte de n’importe quel membre du module Scrib mène à une surcroissance du domaine apical et une diminution du domaine basolatéral (Bilder et al., 2000).
Un des rôles importants de Lgl dans la polarité épithéliale est d’exclure aPKC, Crb et Par6 du domaine basolatéral (Bilder & Perrimon, 2000; Campanale et al., 2017; Chalmers et al., 2005; Tanentzapf & Tepass, 2003). Elle a également des fonctions dans la division cellulaire asymétrique (Dong et al., 2015). Bien qu’il existe un antagonisme entre Crb et Lgl pour définir les domaines apical et basolatéral respectivement, ces deux protéines participent à la formation de la ZA tôt dans le développement (Tanentzapf & Tepass, 2003). Lgl se localise au cortex cellulaire grâce à des interactions électrostatiques entre son motif basique et hydrophobe (BH) et les PIP membranaires (Figure 8; Bailey & Prehoda, 2015; Dong et al., 2015). Dans les neuroblastes de drosophile, Lgl peut également se lier au cytosquelette d’actine (Betschinger et al., 2003). Il existe un antagonisme important entre Lgl et aPKC qui leur permet de réguler leur localisation respective et, conséquemment, la polarité épithéliale (Chalmers et al., 2005). D’ailleurs, la phosphorylation de Lgl par aPKC mène à sa dissociation du cortex cellulaire (Bailey & Prehoda, 2015; Betschinger, Eisenhaber, & Knoblich, 2005) et à son exclusion du domaine apical pour qu’elle puisse soutenir la stabilité du domaine basolatéral (Betschinger et al., 2003; Hutterer et al., 2004). La phosphorylation par aPKC module également l’interaction de Lgl avec Par6/aPKC. En effet, Lgl est initialement liée à Par6/aPKC, puis, une fois phosphorylée par aPKC, elle se sépare du complexe pour permettre à Par3 de s’associer à Par6/aPKC (Yamanaka et al., 2003). La kinase aPKC régule aussi les interactions de Lgl avec « Non-Muscle Myosin II Isoform A » (NMII-A) afin de moduler la migration cellulaire (Dahan, Yearim, Touboul, & Ravid, 2012). Lors de la mitose, aPKC agit de concert avec la kinase Aurora A (AurA) pour phosphoryler et ainsi exclure Lgl du domaine apical et du cortex cellulaire (C. A. Carvalho, Moreira, Ventura, Sunkel, & Morais-de-Sa, 2015). Cette phosphorylation est contrée par la phosphatase PP1 afin de permettre à Lgl de revenir au cortex en fin de mitose (Figure 8; Moreira et al., 2019). D’ailleurs, l’absence de PP1 mène à une perte de polarité et l’acquisition de caractères invasifs qui mime la perte de Lgl (Moreira et al., 2019).
20
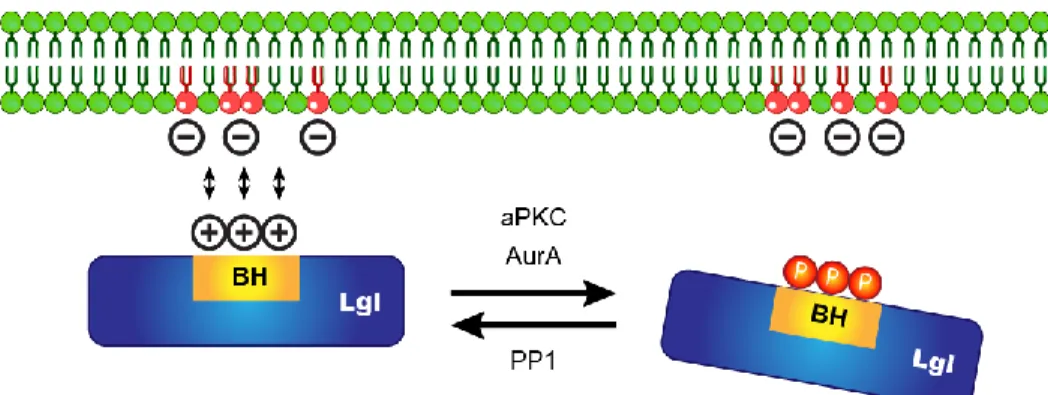
Figure 8. Régulation de la localisation corticale de Lgl.La protéine basolatérale Lgl se localise au cortex cellulaire grâce à des interactions entre les ses motifs BH chargés positivement et les PIP membranaires (en rouge), chargés négativement. Cette interaction est interrompue par la phosphorylation de Lgl par aPKC (ou AurA lors de la mitose). La phosphorylation par aPKC et AurA est contrée par la phosphatase PP1, qui permet à Lgl de retourner au cortex cellulaire.
Quant à Scrib, elle antagonise le complexe Crb pour contribuer à l’équilibre entre le domaine apical et le domaine basolatéral (Bilder & Perrimon, 2000). La déplétion de SCRIB dans l’épithélium mammaire mène à une perte de polarité, bloque la morphogenèse, inhibe l’apoptose et induit la formation de tumeurs (Bilder, 2004; Bilder et al., 2000; Zhan et al., 2008). SCRIB est souvent délocalisée ou sous-exprimée dans divers cancers, comme le cancer cervical (Nakagawa et al., 2004), le cancer du côlon (Gardiol, Zacchi, Petrera, Stanta, & Banks, 2006), le cancer de l’endomètre (Ouyang, Zhan, & Dan, 2010), le cancer de la prostate (H. B. Pearson et al., 2011) et le cancer du sein (Feigin et al., 2014; Zhan et al., 2008). De plus, on note une diminution de SCRIB dans les cellules résistantes à la chimiothérapie (J. Liu et al., 2020; N. Wang et al., 2019). En effet, dans le cancer du sein, une diminution de SCRIB est associée à une plus forte résistance au tamoxifène et au paclitaxel. Une augmentation de l’expression et de la localisation membranaire de SCRIB diminue la prolifération et l’invasion de ces mêmes cellules (J. Liu et al., 2020). Des observations semblables ont été faites dans le cancer du poumon, où la diminution de SCRIB augmente la résistance à la cisplatine (Wang et al., 2019). Lgl est elle aussi souvent délocalisée ou sous-exprimée dans le cancer (Dahan et al., 2012; Dong et al., 2015; Kuphal et al., 2006; Schimanski et al., 2005). Des facteurs associés à l’EMT comme ZEB1 et SNAIL peuvent supprimer l’expression de Lgl (Aigner et al., 2007; Spaderna et al., 2008). De plus, une diminution de Lgl augmente la survie des cellules en hypoxie, ce qui pourrait contribuer à la croissance tumorale (Dong et al., 2015). Finalement, DLG serait délocalisée dans certains cancers, comme le cancer cervical, où elle devient cytoplasmique (Watson et al., 2002). D’autres études ont démontré que DLG3 est surexprimée dans le cancer du sein, ce qui est associé à un mauvais pronostic (J. Liu et al., 2019).