UNIVERSITÉ de CAEN NORMANDIE ---
FACULTÉ de MÉDECINE
Année 2018/2019
THÈSE POUR L’OBTENTION
DU GRADE DE DOCTEUR EN MÉDECINE
Présentée et soutenue publiquement le : 25 avril 2019
par
Mme Clémence MARTIN
Née le 30 janvier 1990 à Reims (Marne)
:
NEURODATA : devenir à 1 an et facteurs pronostiques des hémorragies sous-arachnoïdiennes prises en charge au CHU de Caen
Président : Monsieur le Professeur Jean-Luc HANOUZ Membres : Madame le Professeur Evelyne EMERY
Monsieur le Professeur Olivier MARTINAUD Madame le Docteur Anne PESKINE
Monsieur le Docteur Clément GAKUBA
U N I VE RS I T É DE C AE N · N O R M A N DI E U F R SA N T É - F A C U L T E D E ME D E C IN E
Année Universitaire 2018/2019
Doyen
Professeur Emmanuel TOUZÉ
Assesseurs
Professeur Paul MILLIEZ (pédagogie) Professeur Guy LAUNOY (recherche)
Professeur Sonia DOLLFUS & Professeur Evelyne EMERY (3ème cycle) Directrice administrative
Madame Sarah CHEMTOB
PROFESSEURS DES UNIVERSITÉS - PRATICIENS HOSPITALIERS
M. AGOSTINI Denis Biophysique et médecine nucléaire
M. AIDE Nicolas Biophysique et médecine nucléaire
M. ALLOUCHE Stéphane Biochimie et biologie moléculaire
M. ALVES Arnaud Chirurgie digestive
M. AOUBA Achille Médecine interne
M. BABIN Emmanuel Oto-Rhino-Laryngologie
M. BÉNATEAU Hervé Chirurgie maxillo-faciale et stomatologie
M. BENOIST Guillaume Gynécologie - Obstétrique
M. BERGER Ludovic Chirurgie vasculaire
M. BERGOT Emmanuel Pneumologie
M. BIBEAU Frédéric Anatomie et cytologie pathologique
Mme BRAZO Perrine Psychiatrie d’adultes
M. BROUARD Jacques Pédiatrie
M. BUSTANY Pierre Pharmacologie
Mme CHAPON Françoise Histologie, Embryologie
Mme CLIN-GODARD Bénédicte Médecine et santé au travail
M. COQUEREL Antoine Pharmacologie
M. DAO Manh Thông Hépatologie-Gastro-Entérologie
M. DAMAJ Ghandi Laurent Hématologie
M. DEFER Gilles Neurologie
M. DELAMILLIEURE Pascal Psychiatrie d’adultes
M. DENISE Pierre Physiologie
M. DERLON Jean-Michel Éméritat jusqu’au 31/08/2020 Neurochirurgie
Mme DOLLFUS Sonia Psychiatrie d'adultes
M. DREYFUS Michel Gynécologie - Obstétrique
Mme ÉMERY Evelyne Neurochirurgie
M. ESMAIL-BEYGUI Farzin Cardiologie
Mme FAUVET Raffaèle Gynécologie – Obstétrique
M. FISCHER Marc-Olivier Anesthésiologie Réanimation et médecine Péri-opératoire
M. GÉRARD Jean-Louis Anesthésiologie Réanimation et médecine Péri-opératoire
M. GUILLOIS Bernard Pédiatrie
Mme GUITTET-BAUD Lydia Epidémiologie, économie de la santé et prévention
M. HABRAND Jean-Louis Cancérologie option Radiothérapie
M. HAMON Martial Cardiologie
Mme HAMON Michèle Radiologie et imagerie médicale
M. HANOUZ Jean-Luc Anesthésiologie Réanimation et médecine Péri-opératoire
M. HULET Christophe Chirurgie orthopédique et traumatologique
M. HURAULT de LIGNY Bruno Éméritat jusqu’au 31/01/2020 Néphrologie
M. ICARD Philippe Chirurgie thoracique et cardio-vasculaire
M. JOIN-LAMBERT Olivier Bactériologie - Virologie
Mme JOLY-LOBBEDEZ Florence Cancérologie
M. JOUBERT Michael Endocrinologie
Mme KOTTLER Marie-Laure Biochimie et biologie moléculaire
M. LAUNOY Guy Epidémiologie, économie de la santé et prévention
M. LE COUTOUR Xavier Epidémiologie, économie de la santé et prévention
M. LE HELLO Simon Bactériologie-Virologie
Mme LE MAUFF Brigitte Immunologie
M. LEPORRIER Michel Éméritat jusqu’au 31/08/2020 Hématologie
M. LEROY François Rééducation fonctionnelle
M. LOBBEDEZ Thierry Néphrologie
M. MANRIQUE Alain Biophysique et médecine nucléaire
M. MARCÉLLI Christian Rhumatologie
M. MARTINAUD Olivier Neurologie
M. MAUREL Jean Chirurgie générale
M. MILLIEZ Paul Cardiologie
M. MOREAU Sylvain Anatomie/Oto-Rhino-Laryngologie
M. MOUTEL Grégoire Médecine légale et droit de la santé
M. NORMAND Hervé Physiologie
M. PARIENTI Jean-Jacques Biostatistiques, info. médicale et tech. de communication
M. PELAGE Jean-Pierre Radiologie et imagerie médicale
Mme PIQUET Marie-Astrid Nutrition
M. QUINTYN Jean-Claude Ophtalmologie
M. RAVASSE Philippe Chirurgie infantile
M. REZNIK Yves Endocrinologie
M. ROD Julien Chirurgie infantile
M. ROUPIE Eric Médecine d’urgence
M. TILLOU Xavier Urologie
M. TOUZÉ Emmanuel Neurologie
M. TROUSSARD Xavier Hématologie
Mme VABRET Astrid Bactériologie - Virologie
M. VERDON Renaud Maladies infectieuses
Mme VERNEUIL Laurence Dermatologie
M. VIADER Fausto Neurologie
M. VIVIEN Denis Biologie cellulaire
PROFESSEUR DES UNIVERSITÉS
PROFESSEUR ASSOCIÉ DES UNIVERSITÉS A TEMPS PLEIN
M. VABRET François Addictologie
PROFESSEURS ASSOCIÉS DES UNIVERSITÉS A MI-TEMPS
M. de la SAYETTE Vincent Neurologie
Mme DOMPMARTIN-BLANCHÈRE Anne Dermatologie
Mme LESCURE Pascale Gériatrie et biologie du vieillissement
M. SABATIER Rémi Cardiologie
PRCE
U N I VE RS I T É DE C AE N · N O R M A N DI E U F R SA N T É - F A C U L T E D E ME D E C IN E
Année Universitaire 2018 / 2019
Doyen
Professeur Emmanuel TOUZÉ
Assesseurs
Professeur Paul MILLIEZ (pédagogie) Professeur Guy LAUNOY (recherche)
Professeur Sonia DOLLFUS & Professeur Evelyne EMERY (3ème cycle) Directrice administrative
Madame Sarah CHEMTOB
MAITRES DE CONFERENCES DES UNIVERSITÉS - PRATICIENS HOSPITALIERS
M. ALEXANDRE Joachim Pharmacologie clinique
Mme BENHAÏM Annie Biologie cellulaire
M. BESNARD Stéphane Physiologie
Mme BONHOMME Julie Parasitologie et mycologie
M. BOUVIER Nicolas Néphrologie
M. COULBAULT Laurent Biochimie et Biologie moléculaire
M. CREVEUIL Christian Biostatistiques, info. médicale et tech. de communication
M. DE BOYSSON Hubert Médecine interne
Mme DEBRUYNE Danièle Éméritat jusqu’au 31/08/2019 Pharmacologie fondamentale
Mme DERLON-BOREL Annie Éméritat jusqu’au 31/08/2020 Hématologie
Mme DINA Julia Bactériologie - Virologie
Mme DUPONT Claire Pédiatrie
M. ÉTARD Olivier Physiologie
M. GABEREL Thomas Neurochirurgie
M. GRUCHY Nicolas Génétique
M. GUÉNOLÉ Fabian Pédopsychiatrie
M. HITIER Martin Anatomie - ORL Chirurgie Cervico-faciale
M. ISNARD Christophe Bactériologie Virologie
M. LEGALLOIS Damien Cardiologie
Mme LELONG-BOULOUARD Véronique Pharmacologie fondamentale
Mme LEPORRIER Nathalie Éméritat jusqu’au 31/10/2020 Génétique
Mme LEVALLET Guénaëlle Cytologie et Histologie
M. LUBRANO Jean Chirurgie générale
M. MITTRE Hervé Biologie cellulaire
M. SESBOÜÉ Bruno Physiologie
M. TOUTIRAIS Olivier Immunologie
M. VEYSSIERE Alexis Chirurgie maxillo-faciale et stomatologie
MAITRES DE CONFERENCES ASSOCIÉS DES UNIVERSITÉS A MI-TEMPS
Mme ABBATE-LERAY Pascale Médecine générale
M. COUETTE Pierre-André (fin 31/08/19) Médecine générale
M. LE BAS François (fin 31/08/19) Médecine générale
M. SAINMONT Nicolas (fin 31/08/19) Médecine générale
Remerciements
A Monsieur le Professeur Jean-Luc Hanouz, de me faire l’honneur de présider ce jury. Merci pour votre enseignement, votre implication dans notre formation et nos projets de recherches.
A Madame le Professeur Evelyne Emery, d’avoir répondu favorablement pour participer à ce jury et de nous transmettre son expérience dans le domaine de la neurochirurgie.
A Monsieur le Professeur Olivier Martinaud, d’apporter son expertise à ce travail.
Au Docteur Anne Peskine, de participer à ce jury et d’apporter un regard pluridisciplinaire.
Au Docteur Clément Gakuba, je suis ravie d’avoir fait ce travail avec toi et de t’avoir comme directeur de thèse. Merci pour ton aide et ton dynamisme sans faille.
A toutes les équipes d’anesthésie-réanimation du CHU de Caen. C’est sans regret que j’ai quitté le grand Est pour le grand Ouest. J’y ai fait de très belles rencontres professionnelles et humaines. J’ai tout appris à vos côtés.
A toutes les équipes d’anesthésie-réanimation de Cherbourg et d’Avranches qui m’ont vu faire mes tous premiers pas d’interne.
A mes amis rémois, mes amis de toujours, qui ont suivi de près toutes les étapes de ses longues années d’études.
A Farah et Albin pour leur soutien et tous ces moments mémorables. A mes amis externes, les pitous expatriés au 4 coins de la France. A Julie, pour sa chasse aux fautes d’orthographe.
A mes amis caennais et la Cherby team qui ont rendu cet internat exceptionnel ; Alice, Marie, Maud, Lin, Bastien, Candice, Martin, Kévin, Rémi.
A Coucou, ma colocataire, plus de 2 ans de vie commune, et d’innombrables fous rires. Merci pour ton soutien, tes cours excel et mes premières charentaises !
A mes co-internes, sans doute la meilleure promo de tous les temps !
A Claire, pour toutes ces aventures partagées ensemble et à toutes celles qui nous restent encore.
A ma famille, toujours présente à mes côtés, d’un soutien inestimable. A ma sœur jumelle, et à ce lien unique qui nous unit.
A Gauthier, pour ta folie contagieuse.
A mon grand frère, le meilleur qu’on puisse avoir. A Laurence et mes neveux Clara et Loïc.
Abréviations :
AVC : Accident vasculaire cérébral CHU : Centre Hospitalier Universitaire DTC : Doppler transcrânien
DVE : Dérivation ventriculaire externe GOS : Glasgow Outcome Scale
GOSe : Glasgow Outcome Scale extended HSA : Hémorragie sous-arachnoïdienne HTA : Hypertension artérielle
HTIC : Hypertension intracrânienne
LATA : Limitation et arrêt des thérapeutiques actives LCR : Liquide cérébrospinal
MAV : Malformation artérioveineuse mRS : Modified Rankin Outcome Scale OR : Odd Ratio
PIC : Pression intracrânienne
PPC : Pression de perfusion cérébrale RR : Risque Relatif
TDM: Tomodensitométrie
Tableaux, figures et annexes:
TABLEAU 1-LES CARACTERISTIQUES DE LA POPULATION ETUDIEE ... 12
TABLEAU 2 :ETIOLOGIES, TRAITEMENTS ET COMPLICATIONS ... 14
TABLEAU 3 :EVOLUTION A 3 MOIS,6 MOIS ET 12 MOIS ... 16
TABLEAU 4 :LES FACTEURS PRONOSTIQUES A 1 AN ... 21
FIGURE 1:DIAGRAMME DE FLUX ... 10
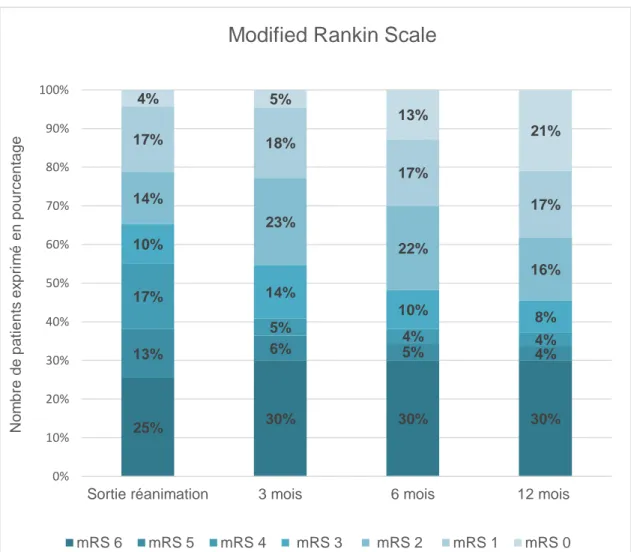
FIGURE 2 :EVOLUTION DU MODIFIED RANKIN SCALE A LA SORTIE DE REANIMATION, A 3 MOIS, A 6 MOIS ET A 12 MOIS ... 17
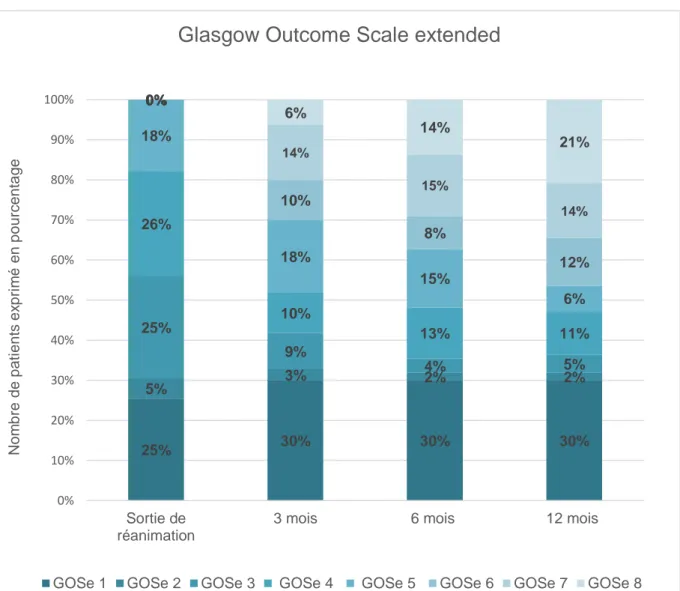
FIGURE 3:EVOLUTION DU GLASGOW OUTCOME SCALE EXTENDED A LA SORTIE DE REANIMATION, A 3 MOIS, A 6 MOIS ET A 12 MOIS ... 18
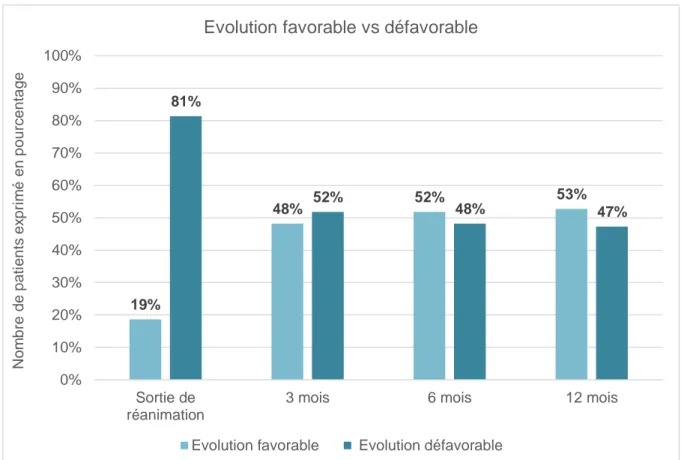
FIGURE 4:EVOLUTION FAVORABLE ET DEFAVORABLE A LA SORTIE DE REANIMATION, A 3 MOIS, A 6 MOIS ET A 12 MOIS ... 19
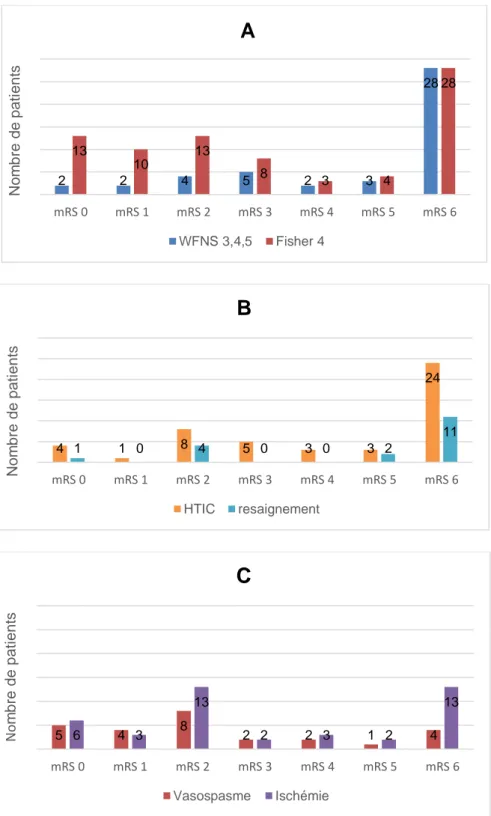
FIGURE 5 :MODIFIED RANKIN SCALE A 1 AN EN FONCTION DES FACTEURS PRONOSTIQUES ... 22
ANNEXE 1 :FACTEURS DE RISQUE D’UNE HEMORRAGIE SOUS-ARACHNOÏDIENNE ... 32
ANNEXE 2 :CLASSIFICATION DE LA WORLD FEDERATION OF NEUROLOGICAL SURGEON (WFNS) ... 33
ANNEXE 3 :CLASSIFICATION DE HUNT ET HESS ... 33
ANNEXE 4 :CLASSIFICATION SCANOGRAPHIQUE DE FISHER ... 33
ANNEXE 5 :MODIFIED RANKIN SCALE (MRS) ... 34
ANNEXE 6 :GLASGLOW OUTCOME SCALE (GOS) ... 34
ANNEXE 7 :ECHELLE DE GLASGOW ... 35
ANNEXE 8 :MODIFIED RANKIN SCALE QUESTIONNAIRE ... 36
ANNEXE 9 :GLASGOW OUTCOME SCALE EXTENDED QUESTIONNAIRE ... 37
Sommaire
I. INTRODUCTION ... 1
1.1 Définition ... 1
1.2 Epidémiologie ... 1
1.3 Les facteurs de risque ... 1
1.4 Diagnostic et classification des HSA ... 2
1.5 La prise en charge... 2
1.6 Pronostic ... 3
1.6.1 Mortalité et évolution neurologique ... 3
1.6.2 Les facteurs pronostiques liés au terrain ... 4
1.6.3 Les facteurs pronostiques cliniques ... 5
1.6.4 Les facteurs pronostiques scanographiques ... 5
1.6.5 Les facteurs pronostiques liés à la prise en charge ... 5
II. MATERIEL ET METHODE ... 6
2.1 Ethique ... 6
2.2 La population étudiée ... 6
2.3 La prise en charge des patients avec une HSA au CHU de Caen ... 7
2.4 Les critères d’inclusion et de non inclusion ... 7
2.5 L’objectif principal de l’étude ... 8
2.6 Les critères d’évaluation ... 8
2.7 Analyses statistiques ... 9
III. RESULTATS ... 10
3.1 Diagramme de flux ... 10
3.2 Les caractéristiques de la population étudiée ... 11
3.3 Les caractéristiques des HSA graves et des HSA non graves ... 13
3.4 Evolution à 3 mois, 6 mois et 12 mois ... 15
3.5 Les facteurs pronostiques à 1 an... 20
V DISCUSSION ... 23
V CONCLUSION ... 27
VI BIBLIOGRAPHIE ... 28
1 I. INTRODUCTION
1.1 Définition
L’hémorragie sous-arachnoïdienne (HSA) est un accident vasculaire cérébral hémorragique secondaire dans 85 % des cas à la rupture d’un anévrisme cérébral (1). Elle est responsable d’une issue de sang dans les espaces méningés entourant le cerveau.
1.2 Epidémiologie
En France, l’incidence de l’HSA varie de 5 à 7/100 000 habitants par an soit 1 à 7 % des accidents vasculaires cérébraux (AVC). Dans le monde l’incidence est estimée à 9,1 /100 000 habitants par an (2). L’HSA touche des personnes d’âge moyen entre 50 et 60 ans, avec une prédominance féminine de 60 à 70 % (3). C’est une maladie sporadique dans 90% des cas. Cependant de rares formes familiales existent. Les apparentés au premier degré des patients présentant un anévrisme cérébral ont un risque augmenté d’en présenter un eux même (4). Certaines maladies génétiques autosomiques dominantes exposent au risque de rupture anévrismale, telles que la polykystose rénale, la maladie de Marfan ou la maladie d’Elher – Danlos (5).
1.3 Les facteurs de risque
Le tabac est un facteur de risque important d’HSA. Il est mis en évidence dans différentes études avec un risque relatif (RR) de 2,2 à 3,1 (6) (7). Le rôle de l’alcool comme facteur de risque d’HSA n’est pas aussi bien établi que celui du tabagisme actif. Plusieurs cohortes montrent que la consommation excessive d’alcool augmente le risque d’HSA. Dans l’étude de Ruigrok et al ; la consommation d’alcool supérieure à 300 g par semaine est retrouvée dans 20 % des HSA (8). Il est également démontré que l’hypertension artérielle (HTA) augmente significativement le risque d’HSA (RR:2,5 ; OR:2,6) (6) (Annexe1).
2 1.4 Diagnostic et classification des HSA
Le diagnostic d’HSA peut être évoqué devant une céphalée brutale, intense et inhabituelle. Elle peut être accompagnée de vomissements, d’une perte de conscience ou de convulsions. Le syndrome méningé quant à lui apparait plusieurs heures après l’HSA. Devant ces signes cliniques aspécifiques environ 12% des HSA ne sont pas diagnostiquées ou diagnostiquées tardivement (9). Les deux échelles d’évaluation clinique les plus utilisées sont celles de la World Federation of Neurological Surgeons (WFNS) (Annexe 2) et celle de Hunt et Hess (Annexe 3). L’échelle WFNS reste celle à privilégier, elle permet de qualifier la gravité de l’HSA. Une HSA grave étant définie par une échelle WFNS 3, 4 ou 5 (10).
La tomodensitométrie (TDM) cérébrale non injectée est la pierre angulaire du diagnostic. Elle est réalisée chez tous les patients suspects d’une HSA. Elle permet en outre de faire le diagnostic positif en mettant en évidence la présence de sang dans les espaces méningés, et aussi d’évaluer l’importance de l’HSA et les éventuelles conséquences et complications précoces. La classification scanographique la plus utilisée est l’échelle de Fisher (Annexe 4). Dans une faible proportion de cas, lorsque le scanner cérébral est normal mais que les signes cliniques sont évocateurs d’une HSA, le diagnostic positif peut être établi par la réalisation d’une ponction lombaire et la mise en évidence d’un liquide xanthochromique dans les 6 à 12 heures suivant la rupture anévrismale (9) (10).
1.5 La prise en charge
Le resaignement d’un anévrisme est associé à une mortalité élevée de 50 à 80 % et à un mauvais pronostic de récupération fonctionnelle chez les survivants (12). Le risque de resaignement est important dans les 12 premières heures et maximum à 2 heures. C’est pourquoi, le diagnostic d’HSA impose le transfert dans un centre de référence incluant des équipes de neurochirurgie, de neuroradiologie et de neuroanesthésie-réanimation dans le but de mettre à l’abri du resaignement et de traiter le plus précocement le sac anévrismal. Le choix de la technique thérapeutique, endovasculaire ou chirurgicale doit résulter d’une discussion pluridisciplinaire en
3
tenant compte de la localisation de l’anévrisme, de son aspect morphologique, de l’état clinique du patient et de ses antécédents.
La prise en charge initiale de l’HSA consiste également à prévenir et traiter la survenue des complications précoces. L’HSA de grade clinique élevé peut s’accompagner d’une hypertension intracrânienne résultant de plusieurs mécanismes : la présence d’un hématome intracérébral, qui accompagne 20 % des HSA et peut être responsable d’un engagement cérébral nécessitant une évacuation chirurgicale ; la présence d’œdème cérébral qui impose le monitorage de la pression intracrânienne (PIC) et l’hydrocéphalie aiguë qui résulte d’un trouble de la résorption du liquide cérébrospinal (LCR) par le sang présent dans les espaces sous-arachnoïdiens imposant une dérivation ventriculaire externe (DVE) sur certains critères scanographiques (dilatation des cornes temporales ou augmentation de l’index bicaudé). Les HSA anévrismales peuvent également entraîner des troubles du rythme cardiaque, des altérations de la fonction myocardique et un œdème pulmonaire. Ces troubles cardiovasculaires résultent d’une hyperactivation du système sympathique et d’une décharge noradrénergique (10) (12). Dans les complications tardives, le vasospasme est de loin la plus fréquente. Il survient classiquement entre le 4ème et le 14ème jour. Le vasospasme s’exprime cliniquement par une altération de la conscience, des céphalées ou un déficit neurologique focal et peut être la cause d’une ischémie cérébrale retardée. Son diagnostic peut être évoqué sur un doppler transcrânien (DTC). Seul le vasospasme de l’artère cérébrale moyenne (ACM) peut être prédit avec une sensibilité et une spécificité suffisantes au DTC. Cependant le diagnostic est confirmé par la réalisation d’une artériographie cérébrale. Un traitement préventif du vasospasme par nimodipine à la dose de 360 mg/j pendant 21 jours est recommandé pour tous les patients présentant une HSA (13).
1.6 Pronostic
1.6.1 Mortalité et évolution neurologique
L’évolution d’une HSA est souvent défavorable, la mortalité est de l’ordre de 40 %. Néanmoins, la survie a augmenté de près de 17 % ces dernières années probablement grâce à un diagnostic et une prise en charge de l’anévrisme plus précoce, au
4
développement de la neuroradiologie interventionnelle et à la surveillance dans des unités de neuro-réanimation spécialisées. Cependant les survivants peuvent présenter des troubles cognitifs qui affectent leur vie quotidienne avec une réduction de la capacité au travail et de la qualité de vie. Leur quotidien est marqué par des troubles de la concentration, de l’humeur et du sommeil (14). L’Association des neuro-anesthésistes-réanimateurs de langue française (ANARLF) a mis en place une cohorte prospective observationnelle incluant tous les patients victimes d’une HSA par rupture d’un anévrisme. L’étude consiste à évaluer les patients à 6 mois par un questionnaire téléphonique déterminant l’échelle de Rankin modifiée (mRS : modified Rankin Scale). Une évolution favorable est déterminée par une échelle mRS entre 0 et 2 et une évolution défavorable par une échelle mRS entre 3 et 6. L’échelle mRS permet de mesurer le degré de dépendance pour les activités de la vie quotidienne des patients souffrant d’un accident vasculaire cérébral (Annexe 5). L’étude rapporte 60 % d’évolution favorable et 40 % d’évolution défavorable à 6 mois. La mortalité est de 25%.
En 2018, une étude s’intéresse à la création d’un modèle de prédiction clinique pour faciliter la prise en charge des patients présentant une HSA. Il s’agit de l’étude SAHIT (Subarachnoid Haemorrhage International Trialists) (15). C’est une analyse de régression logistique sur les variables de 10 936 patients comprenant l’âge, la gravité clinique initiale basée sur l’échelle WFNS, un antécédent d’HTA, la quantité de sang estimée par l’échelle de Fisher, la taille et la localisation de l’anévrisme ainsi que la méthode de traitement : endovasculaire ou chirurgicale. Un calculateur de ce score, disponible sur internet, évalue la probabilité de mortalité et le pronostic fonctionnel à 3 mois selon l’échelle Glasgow Outcome Scale (GOS) des patients victimes d’HSA. L’échelle GOS est un outil fiable d’évaluation globale des patients. Il est initialement décrit pour analyser le devenir des traumatisés crâniens (Annexe 6).
1.6.2 Les facteurs pronostiques liés au terrain
L’âge apparait comme un facteur pronostique d’évolution défavorable. Plus les patients sont âgés, plus la mortalité est élevée et le pronostic fonctionnel défavorable. Certaines comorbidités sont aussi associées à un mauvais pronostic tels que les antécédents d’hypertension artérielle et de diabète. Le tabagisme actif est lui aussi retrouvé comme un facteur de risque d’évolution défavorable (16).
5
1.6.3 Les facteurs pronostiques cliniques
L’état clinique initial du patient est déterminant concernant son évolution. En effet, les patients présentant une HSA associée à un grade WFNS 4 ou 5 ont davantage une évolution défavorable. Tout comme les patients présentant une absence de réactivité pupillaire à la prise en charge initiale. Dans l’évolution clinique du patient victime d’HSA, l’hyperglycémie, l’anémie et l’hypovolémie apparaissent comme des facteurs de risque d’évolution défavorable. L’apparition de certaines complications comme le resaignement, l’HTIC, l’hydrocéphalie aiguë et l’ischémie cérébrale retardée sont associées à une mortalité élevée et à un mauvais pronostic fonctionnel (17).
1.6.4 Les facteurs pronostiques scanographiques
La plupart des études s’intéressant aux facteurs pronostiques d’HSA s’accordent pour dire que l’importance du saignement intracrânien est un facteur pronostique. Les patients présentant une HSA anévrismale associée à un hématome intra-parenchymateux ou à une hémorragie intra-ventriculaire (échelle de Fisher 4) ont une évolution à long terme plus défavorable. Tandis que les patients présentant une HSA non anévrismale périmésencéphalique qui représente 10 % des HSA ont une évolution favorable (16).
1.6.5 Les facteurs pronostiques liés à la prise en charge
Depuis de nombreuses années, la neuroradiologie interventionnelle et le traitement par voie endovasculaire des anévrismes cérébraux se développent.
L’étude ISAT (International Subarachnoid Aneurysm Trial) (18) compare la proportion de patients dépendant ou décédé à 1 an ; à l’aide de l’échelle mRS selon une prise en charge endovasculaire ou chirurgicale d’une HSA anévrismale. Les patients sans incapacité à un an sont significativement plus nombreux dans le groupe traitement endovasculaire que dans le groupe traitement chirurgical. Cependant, aucune différence de mortalité n’est retrouvée dans les 2 groupes.
6
De nombreuses données dans la littérature sont disponibles concernant le devenir des patients victimes d’HSA. Le devenir est souvent étudié à 3 mois et 6 mois. La connaissance de nos pratiques et du devenir des patients sont indispensables pour améliorer leur prise en charge.
Nous réalisons une étude de cohorte prospective afin de recueillir l’évolution au cours de la première année de tous les patients pris en charge pour une HSA au Centre Hospitalier Universitaire (CHU) de Caen entre novembre 2015 et décembre 2017.
II. MATERIEL ET METHODE
2.1 Ethique
Le recueil prospectif des informations liées à la prise en charge et à l’évolution des patients neurolésés admis au sein du pôle réanimations-anesthésie-SAMU-SMUR du CHU de Caen a fait l’objet d’une lettre d’information au Comité de Protection des Personnes (CPP) nord-ouest III avec avis favorable de ce comité (référence CPP : A12-D35-VOL13 ; référence CHU : NEURODATA). Une information était délivrée au patient ou à défaut à ses proches quant à la participation au recueil de données.
2.2 La population étudiée
Nous réalisons une étude observationnelle, monocentrique, prospective incluant tous les patients admis en premier recours ou secondairement au CHU de Caen pour la prise en charge d’une HSA entre novembre 2015 et décembre 2017.
Chaque patient neurolésé du pôle anesthésie réanimation du CHU de Caen possède un livret « NEURODATA ». Il a été mis en place en novembre 2015 afin de recueillir toutes les informations des patients neurolésés depuis leur admission jusqu’à leur sortie de l’hôpital et leur évolution à 3 mois, 6 mois, 12 mois et 24 mois.
7
2.3 La prise en charge des patients avec une HSA au CHU de Caen
La prise en charge des patients victimes d’un HSA au CHU de Caen suit un protocole rédigé conjointement par le service de neurochirurgie, de neuroradiologie interventionnelle et d’anesthésie-réanimation se conformant aux recommandations nationales et internationales.
Devant tout signe clinique évocateur d’une HSA, une TDM cérébrale sans injection confirme le diagnostic. Elle est souvent couplée à un angioscanner cérébral qui fait le diagnostic étiologique d’HSA anévrismale. La prise en charge initiale des patients se fait au déchocage. L’ensemble des mesures thérapeutiques initiales visent à prévenir un resaignement précoce. Le patient est sédaté, intubé, ventilé s’il présente des troubles de la conscience. Nous prévenons les phénomènes d’ischémie secondaire par la prescription de nimodipine. La pression artérielle est strictement contrôlée par un monitorage invasif et un traitement par nicardipine intra-veineux si besoin pour maintenir une pression artérielle systolique inférieure à 160 mmHg. Un traitement anti-fibrinolytique par acide tranexamique est initié après avoir objectivé une HSA d’origine anévrismale et avec l’accord du neurochirurgien en absence de contre-indication. L’anévrisme est exclu le plus rapidement possible, dans les 72 premières heures. Le choix de la procédure d’exclusion doit impérativement faire l’objet d’une discussion multidisciplinaire entre neuroradiologue et neurochirurgien. Une DVE est posée pour tous les patients dans le coma ou sédaté pour le monitorage de la PIC. Dans les autres situations, la décision de la mise en place d’une DVE est du ressort du neurochirurgien sur des critères scanographiques d’hydrocéphalie et/ou sur des troubles de la vigilance. La prise en charge de tout patient présentant une HSA se fait en réanimation chirurgicale ou en réanimation médicale.
2.4 Les critères d’inclusion et de non inclusion
Les critères d’inclusion sont :
- Tous les patients présentant une HSA admis au CHU de Caen, au déchocage ou en réanimation entre novembre 2015 et décembre 2017
8 Les critères de non inclusion sont :
- Les patients de moins de 18 ans - Le refus du patient
- Les patients admis au CHU de Caen pour une HSA mais transférés dans un autre centre pour la prise en charge étiologique
2.5 L’objectif principal de l’étude
L’objectif principal de l’étude est d’évaluer le devenir à 1 an des patients ayant présentés une HSA.
2.6 Les critères d’évaluation
A partir de la base de données « NEURODATA », nous recueillons toutes les informations concernant les données démographiques des patients (l’âge, le sexe, les antécédents, les traitements, la situation familiale et professionnelle) ; les données cliniques initiales (l’échelle de Glasgow (Annexe 7), le déficit neurologique, le grade WFNS) ; les données radiologiques (l’échelle de Fisher ; la localisation de l’anévrisme) ; les données relatives à la prise en charge initiale du patient au déchocage puis en réanimation et les complications majeures relatives à l’HSA et au séjour en réanimation. Concernant l’objectif principal de notre étude, nous recueillons les informations liées au devenir des patients à l’aide de deux questionnaires standardisés : le Modified Rankin Scale questionnaire (Annexe 8) et le Glasgow Outcome Scale extended questionnaire (Annexe 9) au cours d’entretiens téléphoniques avec le patient ou l’un de ses proches. Nous nous aidons également des courriers des différentes consultations de suivi avec les neurochirurgiens, les neuroradiologues interventionnels et les neuropsychologues.
L’évaluation prospective du devenir des patients consiste en une évaluation à 3 mois, 6 mois et 12 mois après la date de survenue de l’HSA. Le recueil des données à l’aide du Modified Rankin Scale questionnaire nous permet d’appréhender le degré d’incapacité ou de dépendance dans les activités de la vie quotidienne de ces patients et d’établir l’échelle mRS. Tandis que le Glasgow Outcome Scale extended
9
questionnaire met en évidence les troubles neurologiques subjectifs non quantifiés par les échelles standards de dépendance tels que les troubles thymiques, les troubles mnésiques, les modifications du comportement, les troubles du sommeil, et les difficultés relationnelles nous permettant d’établir l’échelle Glasgow Outcome Scale extended (GOSe) (Annexe 10).
Afin de déterminer les facteurs pronostiques d’évolution défavorable, nous classons les patients inclus en deux catégories. La première, évolution favorable correspondant aux patients présentant une échelle mRS entre 0 et 2, et une échelle GOSe entre 5 et 8 ; et la deuxième, évolution défavorable correspondant aux patients présentant une échelle mRS entre 3 et 6, et une échelle GOSe entre 1 et 4.
2.7 Analyses statistiques
Les variables nominales sont exprimées en n (%). Les variables continues sont exprimées en médiane [interquartile]. Pour l’analyse de la recherche des facteurs pronostiques un test de Khi deux est utilisé pour les variables qualitatives et un test de Student pour les variables continues lorsque les conditions de validité sont remplies. Le seuil de significativité est atteint pour un p < 0,05.
10 III. RESULTATS
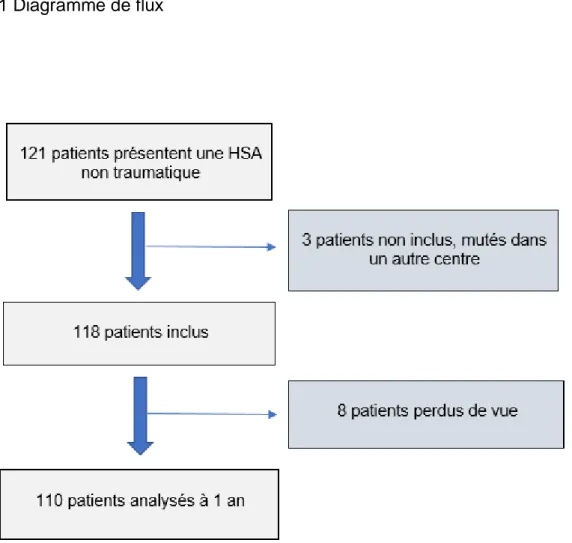
Entre novembre 2015 et décembre 2017, nous avons identifié 121 patients présentant une HSA non traumatique. Trois patients n’ont pas pu être inclus car ils ont été transférés secondairement dans un autre centre pour le traitement endovasculaire de l’anévrisme intracrânien faute de neuroradiologue interventionnel au CHU de Caen lors de leur admission. Huit patients ont été perdus de vue au cours du suivi. Ainsi, au total, 110 patients ont été évalués à 1 an.
3.1 Diagramme de flux
11
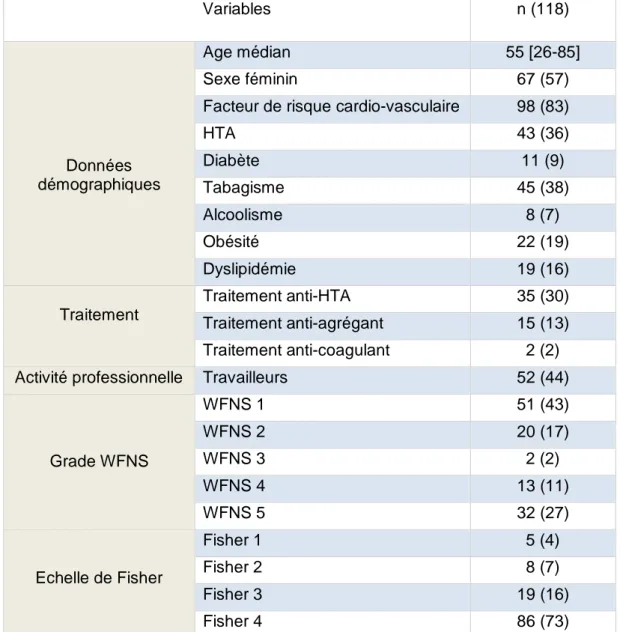
3.2 Les caractéristiques de la population étudiée
Soixante-sept patients (57 %) sont des femmes. L’âge médian est de 55 ans [26-85]. On retrouve la présence de facteurs de risque cardio-vasculaires chez 98 patients (83 %). Les facteurs de risque cardio-vasculaires comprennent : l’âge supérieur ou égal à 50 ans pour les hommes ; supérieur ou égal à 60 ans pour les femmes, le tabagisme actif ou sevré depuis moins de 3 ans, l’hypertension artérielle traitée ou non traitée, le diabète de type 2, la dyslipidémie, les antécédents familiaux de maladies coronaires ou d’infarctus du myocarde chez un parent au premier degré avant 55 ans pour les hommes et avant 65 ans pour les femmes (17). Les patients traités par un anti-agrégant plaquettaire sont au nombre de 15 (13 %) et 2 (2 %) sont sous traitement anti-coagulant.
Au sein de cette population d’âge moyen, 52 (44 %) des patients ont une activité professionnelle.
Soixante et onze (60 %) présentent une HSA de grade 1 et 2 ; et 47 (40 %) une HSA de grade 3, 4 ou 5. Sur le plan radiologique, 5 (4 %) patients présentent une échelle de Fisher à 1 ; 8 (7 %) une échelle de Fisher à 2 ; 19 (16 %) une échelle de Fisher à 3 et 86 (73 %) une échelle de Fisher à 4.
12
Tableau 1 - Les caractéristiques de la population étudiée
HTA : hypertension artérielle, WFNS : World Federation of Neurological Surgeon, données en effectifs (pourcentage), âge médian [interquartile]
Variables n (118)
Données démographiques
Age médian 55 [26-85]
Sexe féminin 67 (57)
Facteur de risque cardio-vasculaire 98 (83)
HTA 43 (36) Diabète 11 (9) Tabagisme 45 (38) Alcoolisme 8 (7) Obésité 22 (19) Dyslipidémie 19 (16) Traitement Traitement anti-HTA 35 (30) Traitement anti-agrégant 15 (13) Traitement anti-coagulant 2 (2) Activité professionnelle Travailleurs 52 (44)
Grade WFNS WFNS 1 51 (43) WFNS 2 20 (17) WFNS 3 2 (2) WFNS 4 13 (11) WFNS 5 32 (27) Echelle de Fisher Fisher 1 5 (4) Fisher 2 8 (7) Fisher 3 19 (16) Fisher 4 86 (73)
13
3.3 Les caractéristiques des HSA graves et des HSA non graves
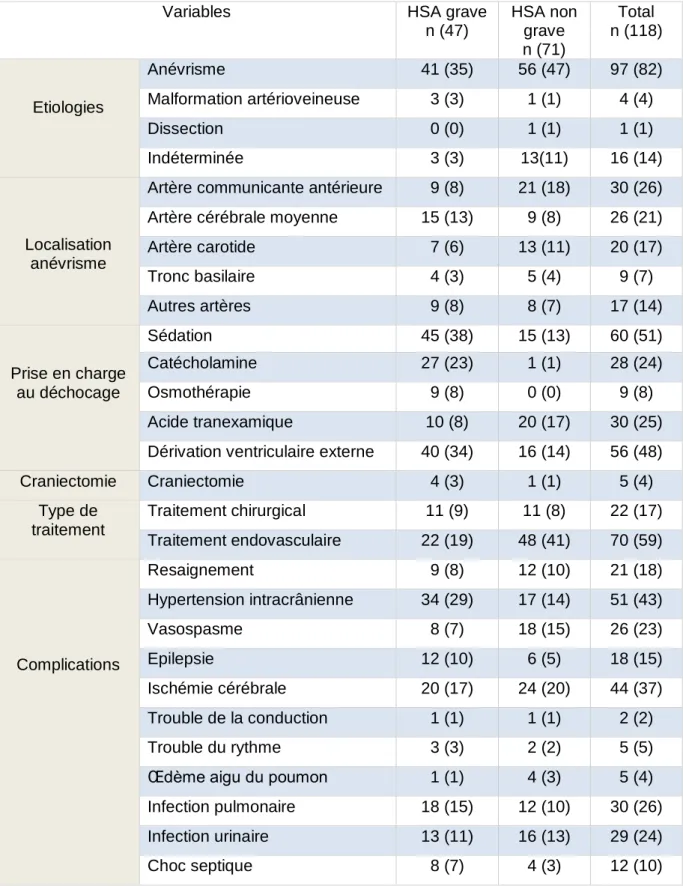
Parmi les 118 patients inclus dans l’étude, 47 (40 %) présentent une HSA grave. L’anévrisme est la principale étiologie retrouvée. Quatre-vingt-dix-sept (82 %) des HSA sont secondaires à la rupture d’un anévrisme intracérébral, 4 à une malformation artérioveineuse et 1 à une dissection artérielle. Aucune malformation vasculaire n’est retrouvée pour 14 % des HSA. Les anévrismes sont de localisations variées avec une prédominance pour l’artère communicante antérieure ; responsable de 30 HSA et de l’artère carotide interne, dont la rupture est la cause de 20 HSA. Concernant la prise en charge thérapeutique, 60 (51 %) des HSA sont sédatées sur des troubles de la conscience à la phase initiale au déchocage soit 45 (38 %) des HSA graves et 15 (13 %) des HSA non graves sur une dégradation secondaire de l’état de conscience. Vingt-huit patients (24 %) nécessitent un support aminergique. Neuf (8 %) des patients bénéficient d’une osmothérapie au déchocage soit par mannitol 20 % ou sérum salé hypertonique. Une DVE est réalisée devant une hydrocéphalie aiguë chez 56 (48 %) des patients dont 40 (34 %) présentent une HSA grave et 16 (14 %) une HSA non grave. Cinq patients (4 %) bénéficient d’une craniectomie décompressive due à une HTIC majeure dont une HSA initialement non grave compliquée d’un resaignement sur une malformation artérioveineuse (MAV). Soixante-dix (59 %) des HSA sont traitées par voie endovasculaire et 22 (17 %) des patients bénéficient d’un traitement chirurgical.
L’HSA se complique chez 21 (18 %) des patients d’un resaignement, dont 11 avant le traitement étiologique, 3 per-opératoire et 7 per-embolisation. L’HTIC survient chez 51 (43 %) des patients avec une prédominance pour les patients présentant une HSA grave. Vingt-six (23 %) des patients présentent un vasospasme et 18 (15 %) une épilepsie. L’évolution est marquée par une ischémie cérébrale chez 44 (37 %) patients. L’ischémie cérébrale est objectivée par une hypodensité à la TDM cérébrale et peut être secondaire à un vasospasme, à une complication chirurgicale ou à une complication d’embolisation avec la migration de coïls. Sept (7 %) des patients présentent des complications cardiaques à type de trouble du rythme ou de la conduction et 5 (4 %) des patients un œdème aigu du poumon. Le séjour en réanimation est marqué par une infection pulmonaire chez 30 (26 %) des patients, une infection urinaire chez 29 (24 %) des patients et un choc septique chez 12 (10 %) des patients.
14
Tableau 2 : Etiologies, traitements et complications
Légende : HSA : hémorragie sous-arachnoïdienne, Autres artères : artère cérébrale postérieure, artère cérébrale antérieure, artère péricalleuse, artère cérébelleuse inféro-postérieure, données en effectifs (pourcentage)
Variables HSA grave
n (47) HSA non grave n (71) Total n (118) Etiologies Anévrisme 41 (35) 56 (47) 97 (82) Malformation artérioveineuse 3 (3) 1 (1) 4 (4) Dissection 0 (0) 1 (1) 1 (1) Indéterminée 3 (3) 13(11) 16 (14) Localisation anévrisme
Artère communicante antérieure 9 (8) 21 (18) 30 (26) Artère cérébrale moyenne 15 (13) 9 (8) 26 (21)
Artère carotide 7 (6) 13 (11) 20 (17) Tronc basilaire 4 (3) 5 (4) 9 (7) Autres artères 9 (8) 8 (7) 17 (14) Prise en charge au déchocage Sédation 45 (38) 15 (13) 60 (51) Catécholamine 27 (23) 1 (1) 28 (24) Osmothérapie 9 (8) 0 (0) 9 (8) Acide tranexamique 10 (8) 20 (17) 30 (25) Dérivation ventriculaire externe 40 (34) 16 (14) 56 (48)
Craniectomie Craniectomie 4 (3) 1 (1) 5 (4) Type de traitement Traitement chirurgical 11 (9) 11 (8) 22 (17) Traitement endovasculaire 22 (19) 48 (41) 70 (59) Complications Resaignement 9 (8) 12 (10) 21 (18) Hypertension intracrânienne 34 (29) 17 (14) 51 (43) Vasospasme 8 (7) 18 (15) 26 (23) Epilepsie 12 (10) 6 (5) 18 (15) Ischémie cérébrale 20 (17) 24 (20) 44 (37) Trouble de la conduction 1 (1) 1 (1) 2 (2) Trouble du rythme 3 (3) 2 (2) 5 (5)
Œdème aigu du poumon 1 (1) 4 (3) 5 (4) Infection pulmonaire 18 (15) 12 (10) 30 (26) Infection urinaire 13 (11) 16 (13) 29 (24)
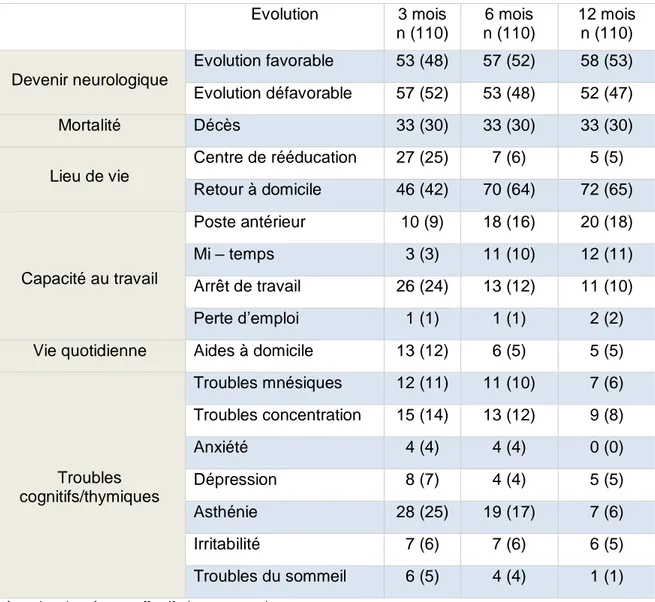
15 3.4 Evolution à 3 mois, 6 mois et 12 mois
Parmi les 110 patients avec un suivi complet à 12 mois, 57 (52 %) ont une évolution défavorable à 3 mois, 53 (48 %) à 6 mois et 52 (47 %) à 12 mois. Trente patients (25 %) sont décédés avant la sortie de réanimation et 3 patients dans le premier mois après la sortie de réanimation (dont un patient dans les suites d’une méningite bactérienne, un patient sur un état de mal épileptique et un patient sur une détresse respiratoire aiguë compliquée d’une inhalation) ; soit un total de 33 (30 %) de décès à 12 mois.
A 3 mois, 46 (42 %) des patients sont rentrés à domicile, 70 (64 %) à 6 mois et 72 (65 %) à 12 mois. Certains patients gardent des déficits neurologiques ne leur permettant pas un retour à domicile. A 3 mois, 27 (25 %) des patients sont en centre de rééducation, 7 (6 %) à 6 mois et 5 (5 %) à 12 mois.
Concernant la capacité au travail, parmi les 52 travailleurs, 10 patients ont repris leur poste antérieur à 3 mois soit 19 % des travailleurs, 18 (34 % des travailleurs) à 6 mois et 20 (38 % des travailleurs) à 12 mois. Vingt-six (50 % des travailleurs) sont en arrêt de travail à 3 mois, 13 (25 % des travailleurs) à 6 mois et 11 (21 % des travailleurs) à 12 mois.
Treize (12 %) des patients nécessitent des aides à domicile (aides ménagères, aides au repas, aides à la toilette, à l’habillage, infirmier) à 3 mois, 6 (6 %) à 6 mois et 5 (5 %) à 12 mois. Certains patients présentent des troubles cognitifs et thymiques persistants. Quinze (14 %) des patients présentent des troubles de la concentration à 3 mois, 13 (12 %) à 6 mois et 9 (8 %) à 12 mois. Douze (11 %) des patients présentent des troubles mnésiques à 3 mois avec une atteinte prédominante sur la mémoire à court terme, 11 (10 %) à 6 mois et 7 (6 %) à 12 mois. Quelques patients témoignent de trouble du sommeil, 6 (5 %) à 3 mois, 4 (4 %) à 6 mois et 1 (1 %) à 12 mois. Dix-neuf (17 %) des patients à 3 mois décrivent des troubles thymiques telles que la dépression, l’anxiété et l’irritabilité ; 15 soit 14 % à 6 mois et 11 (10 %) à 12 mois.
16
Tableau 3 : Evolution à 3 mois, 6 mois et 12 mois
Légende : données en effectifs (pourcentage)
Evolution 3 mois n (110) 6 mois n (110) 12 mois n (110) Devenir neurologique Evolution favorable 53 (48) 57 (52) 58 (53) Evolution défavorable 57 (52) 53 (48) 52 (47) Mortalité Décès 33 (30) 33 (30) 33 (30) Lieu de vie Centre de rééducation 27 (25) 7 (6) 5 (5) Retour à domicile 46 (42) 70 (64) 72 (65) Capacité au travail Poste antérieur 10 (9) 18 (16) 20 (18) Mi – temps 3 (3) 11 (10) 12 (11) Arrêt de travail 26 (24) 13 (12) 11 (10) Perte d’emploi 1 (1) 1 (1) 2 (2) Vie quotidienne Aides à domicile 13 (12) 6 (5) 5 (5)
Troubles cognitifs/thymiques Troubles mnésiques 12 (11) 11 (10) 7 (6) Troubles concentration 15 (14) 13 (12) 9 (8) Anxiété 4 (4) 4 (4) 0 (0) Dépression 8 (7) 4 (4) 5 (5) Asthénie 28 (25) 19 (17) 7 (6) Irritabilité 7 (6) 7 (6) 6 (5) Troubles du sommeil 6 (5) 4 (4) 1 (1)
17
Légende : mRS 6 : décès ; mRS 5 : incapacité sévère ; mRS 4 : incapacité modérément sévère ; mRS 3 : incapacité modérée ; mRS 2 : faible incapacité ; mRS 1 : pas d’incapacité en dehors des symptômes ; mRS 0 : aucun symptôme
Figure 2 : Evolution du Modified Rankin scale à la sortie de réanimation, à 3 mois, à 6 mois et à 12 mois
25% 30% 30% 30% 13% 6% 5% 4% 17% 5% 4% 4% 10% 14% 10% 8% 14% 23% 22% 16% 17% 18% 17% 17% 4% 5% 13% 21% 0% 10% 20% 30% 40% 50% 60% 70% 80% 90% 100%
Sortie réanimation 3 mois 6 mois 12 mois
Nom b re d e p a ti e n ts e x p ri m é e n p o u rce n ta g e
Modified Rankin Scale
18
Légende : GOSe 1 : décès ; GOSe 2 : état végétatif ; GOSe 3 : incapacité sévère, niveau supérieur ; GOSe 4 : incapacité sévère, niveau inférieur ; GOSe 5 : incapacité modérée, niveau supérieur ; GOSe 6 : incapacité modérée, niveau inférieur ; GOSe 7 : symptômes mineurs, quotidien affecté ; GOSe 8 : symptômes mineurs, quotidien non affecté
Figure 3: Evolution du Glasgow Outcome Scale extended à la sortie de réanimation, à 3 mois, à 6 mois et à 12 mois
25% 30% 30% 30% 5% 3% 2% 2% 25% 9% 4% 5% 26% 10% 13% 11% 18% 18% 15% 6% 0% 10% 8% 12% 0% 14% 15% 14% 0% 6% 14% 21% 0% 10% 20% 30% 40% 50% 60% 70% 80% 90% 100% Sortie de réanimation
3 mois 6 mois 12 mois
No m b re d e p a ti e n ts e x p ri m é e n p o u rce n ta g e
Glasgow Outcome Scale extended
19
Légende : évolution favorable : mRS de 0 à 2 et GOSe de 5 à 8 ; évolution défavorable : mRS de 3 à 6 et GOSe de 1 à 4
Figure 4: Evolution favorable et défavorable à la sortie de réanimation, à 3 mois, à 6 mois et à 12 mois 19% 48% 52% 53% 81% 52% 48% 47% 0% 10% 20% 30% 40% 50% 60% 70% 80% 90% 100% Sortie de réanimation
3 mois 6 mois 12 mois
Nom b re d e p a ti e n ts e x p ri m é e n p o u rce n ta g e
Evolution favorable vs défavorable
20 3.5 Les facteurs pronostiques à 1 an
Dans notre cohorte, certaines comorbidités cardiovasculaires apparaissent comme des facteurs de risque de pronostic défavorable à 1 an telles que l’HTA (p < 0,001), le diabète (p=0,009) et la dyslipidémie (p=0,001). Le tabagisme actif et l’éthylisme chronique quant à eux ne sont pas associés à un pronostic défavorable. La prise d’un traitement anti-agrégant plaquettaire semble être un facteur de pronostic défavorable (p=0,001).
L’état clinique neurologique initial, évalué par le grade WFNS ainsi que l’importance scanographique de l’hémorragie méningée, évaluée par l’échelle de Fisher sont des facteurs de pronostic défavorable
En ce qui concerne les différentes étiologies des HSA et la localisation des anévrismes ; elles n’apparaissent pas comme des facteurs pronostiques.
La prise en charge au déchocage avec la nécessité d’une sédation, d’un support aminergique, d’osmothérapie, d’acide tranexamique, et la mise en place d’une DVE sont des facteurs de mauvais pronostic.
La survenue de certaines complications comme une HTIC (p <0,001), un resaignement (p=0,005), une infection pulmonaire (p=0,001) ou un choc septique (p=0,011) sont des facteurs pronostiques d’évolution défavorable à 1 an.
21 Tableau 4 : Les facteurs pronostiques à 1 an
Légende : HTA : hypertension artérielle ; Autres artères : artère cérébrale postérieure, artère cérébrale antérieure, artère péricalleuse, artère cérébelleuse inféro-postérieure ; sédation, catécholamine, osmothérapie, acide tranexamique et pose d’une dérivation ventriculaire externe au déchocage, données en effectifs (pourcentage) et médiane [interquartile] Variables Evolution favorable à 1 an n (58) Evolution défavorable à 1 an n (52) p value Age 54[34-69] 55 [26-85] 0,056 Sexe féminin 37 (34) 27 (25) 0,208
Facteur de risque cardio vasculaire 46 (42) 44 (40) 0,471
HTA 9 (8) 33 (30) < 0,001 Diabète 1 (1) 8 (7) 0,009 Tabac 24 (22) 17 (15) 0,347 Alcool 4 (4) 3 (3) Obésité 8 (7) 12 (11) 0,208 Dyslipidémie 3 (3) 15 (14) 0,001
Traitement anti HTA 8 (7) 25 (23) < 0 ,001
Traitement anti agrégant 1 (1) 11 (10) 0,001
Traitement anti-coagulant 0 (0) 2 (2) 0,132 Activité professionnelle 31 (28) 18 (16) 0,047 WFNS 1,2 51 (46) 14 (13) < 0,001 WFNS 3,4,5 7 (6) 38 (35) Fisher 1,2,3 23 (21) 8 (7) 0,005 Fisher 4 35 (32) 44 (40) Etiologie anévrismale 45 (41) 45 (41) 0,093 Etiologie indéterminée 11 (10) 4 (4)
Anévrisme a. communicante antérieure 15 (14) 13 (12)
0,975 Anévrisme a. cérébrale moyenne 9 (8) 12 (11)
Anévrisme artère carotide 9 (8) 7 (6)
Anévrisme tronc basilaire 4 (4) 4 (4)
Anévrisme autres artères 8 (7) 9 (8)
Traitement chirurgical 10 (9) 9 (8) 0,740 Traitement endovasculaire 37 (34) 28 (25) Sédation 21 (19) 38 (35) < 0,001 Catécholamine 12 (11) 25 (23) 0,002 Osmothérapie 5 (5) 12 (11) 0,036 Acide tranexamique 10 (9) 18 (16) 0,037
Dérivation ventriculaire externe 26 (24) 37 (34) 0,005
Hypertension intracrânienne 11 (10) 37 (34) < 0,001 Vasospasme 16 (15) 10 (9) 0,303 Resaignement 4 (4) 14 (13) 0,005 Epilepsie 5 (5) 11 (10) 0,063 Ischémie cérébrale 20 (18) 22 (20) 0,399 Infection pulmonaire 7 (6) 20 (18) 0,001 Infection urinaire 14 (13) 12 (11) 0,896 Choc septique 1 (1) 8 (7) 0,011
22
Légende : mRS 0 : aucun symptôme ; mRS 1 : pas d’incapacité en dehors des symptômes ; mRS 2 : faible incapacité ; mRS 3 : incapacité modérée ; mRS 4 : incapacité modérément sévère ; mRS 5 : incapacité sévère ; mRS 6 : décès Figure A : mRS selon le grade WFNS et l’échelle de Fisher ; figure B : mRS selon l’HTIC et le resaignement ; figure C : mRS selon le vasospasme et l’ischémie cérébrale
Figure 5 : Modified Rankin Scale à 1 an en fonction des facteurs pronostiques 2 2 4 5 2 3 28 13 10 13 8 3 4 28 mRS 0 mRS 1 mRS 2 mRS 3 mRS 4 mRS 5 mRS 6 Nom b re d e p a ti e n ts
A
WFNS 3,4,5 Fisher 4 4 1 8 5 3 3 24 1 0 4 0 0 2 11 mRS 0 mRS 1 mRS 2 mRS 3 mRS 4 mRS 5 mRS 6 Nom b re d e p a ti e n tsB
HTIC resaignement 5 6 4 3 8 2 2 1 4 13 2 3 2 13 mRS 0 mRS 1 mRS 2 mRS 3 mRS 4 mRS 5 mRS 6 No m b re d e p a ti e n tsC
Vasospasme Ischémie23 V DISCUSSION
Dans notre étude de cohorte, 47 % des patients ont une évolution défavorable à 1 an. Parmi ces patients, 30 % sont décédés dont 15 % d’une limitation et arrêt des thérapeutiques actives (LATA) en réanimation. Les facteurs prédictifs d’évolution défavorable à 1 an sont : les antécédents d’HTA, de diabète et de dyslipidémie, la prise d’un traitement anti-agrégant, le grade WFNS, l’échelle de Fisher, la sédation, le support aminergique, la mise en place d’une DVE, les complications à type d’HTIC, de resaignement, d’infection pulmonaire et de choc septique.
Pour appréhender l’évolution neurologique des patients nous avons utilisé les échelles mRS et GOSe. L’échelle mRS est très utilisé dans les différentes études, il permet de mesurer le degré de dépendance dans les activités de la vie quotidienne des patients souffrant d’un accident vasculaire cérébral (20). Le bon rétablissement peut être considéré comme une indépendance physique et l’absence de déficit neurologique. Cependant, il parait important de tenir compte du handicap social, de la réduction des activités, des loisirs, de la perturbation de la vie familiale et des liens d’amitiés. Le Glasgow Outcome Scale a été créé en 1975 par Jennett and Bond, il permet d’appréhender les troubles neurologiques subjectifs non mesurés par les échelles standards de dépendance. Il s’agit initialement d’une échelle de devenir global des traumatisés crâniens. La version originale en anglais propose une classification en 5 catégories. Elle est facile d’emploi, cependant quelques critiques sont émises concernant sa reproductibilité, sa spécificité et sa sensibilité. C’est dans ce sens, qu’une nouvelle version est proposée en 1981, comptant 8 catégories : le Glasgow Outcome Scale Extended (21). Le GOSe apparait reproductible qu’il soit réalisé en face à face ou au téléphone ; par un examinateur expérimenté ou non (22).
La définition d’une évolution favorable diffère selon les études. La cohorte de l’ANARLF et l’étude ISAT s’accordent pour définir une évolution favorable par une échelle mRS entre 0 et 2. Tandis que l’étude MASH-2 (23) définit une évolution favorable par une échelle mRS entre 0 et 3. Nous considérons dans notre cohorte, l’absence de symptôme ou une incapacité légère comme une évolution favorable. Cela correspond à une échelle mRS compris entre 0 et 2 et une échelle GOSe entre 5 et 8.
24
Cependant l’évaluation de cette incapacité reste subjective malgré des échelles avec une bonne spécificité et une bonne sensibilité ; et peut constituer un biais de mesure.
Dans l’étude ISAT (18) (International Subarachnoid Aneurysm Trial), 27 % des patients dans le groupe traitement endovasculaire et 31 % des patients dans le groupe chirurgie ont une évolution défavorable à 1 an. Dans notre cohorte, le taux de mauvaise évolution à 1 an est de 47 %. Cette différence peut s’expliquer par le taux d’HSA grave (grade WFNS 3-4-5) plus important dans notre cohorte que dans l’étude ISAT ; respectivement 40 % et 12 %. L’étude STASH (24) (Simvastatin in aneurysmal subarachnoid haemorrhage) met en évidence une évolution favorable (échelle mRS entre 0 et 2) chez 53 % des patients. C’est une étude multicentrique, en double aveugle, randomisée qui compare un traitement par simvastatine versus placebo ; dont le critère de jugement principal est la distribution de l’échelle mRS à 6 mois. Ces résultats sont similaires à ceux de notre cohorte puisqu’à 6 mois, 52 % des patients de la cohorte ont une évolution favorable. Dans l’étude MASH-2 (23) (Magnesium for aneurysmal subarachnoid haemorrhage), 25 % des patients ont évolution défavorable (mRS 4 ou 5) ou sont décédés à 3 mois contre 52 % dans notre cohorte. C’est un essai clinique, randomisé, incluant 1204 patients qui compare le magnésium intraveineux versus placebo. La différence du taux de patients avec une évolution défavorable entre l’étude MASH-2 et notre cohorte peut s’expliquer par la différence de gravité des patients avec dans notre cohorte des patients plus grave ; 40 % d’HSA grave (grade WFNS 3-4-5) contre 25 % dans l’étude MASH-2 ; et la définition d’une évolution défavorable, définie dans l’étude MASH-2 par une échelle mRS entre 4 et 6 contre 3 et 6 dans notre étude. Nos chiffres concernant l’évolution des patients sont comparables à ceux de la littérature, bien qu’ils existent quelques différences entre les études. En s’intéressant à la cinétique de récupération, on constate une bonne évolution les 6 premiers mois suivant l’HSA puis une stagnation entre 6 mois et 12 mois.
Quelques troubles cognitifs persistent à 1 an, 7 % des patients présentent des troubles mnésiques et 9 % des troubles de la concentration. Le quotidien des patients est aussi marqué par des troubles thymiques. On note 5 % de dépression à 1 an. L’importance de ces troubles est difficile à évaluer et probablement sous-estimée car nous avons utilisé des questions subjectives et non des échelles spécifiques. De plus, le retour à
25
un état de santé antérieur (mRS = 0 et GOSe = 8) concerne seulement 2 % des patients à 1 an. La qualité de vie après une HSA est donc majoritairement réduite. La capacité au travail est un autre indicateur témoignant d’un retour à l’état antérieur. On observe que 38 % des travailleurs ont repris leur poste antérieur à 1 an. Cependant les travailleurs ne représentent que 44 % de la population de l’étude. La reprise du travail n’est donc pas le reflet d’une récupération totale de l’ensemble de la cohorte. La reprise des activités sociales et personnelles évaluerait probablement mieux la qualité de vie de nos patients.
Dans notre recherche des facteurs pronostiques d’évolution défavorable à 1 an, nous retrouvons les antécédents cardiovasculaires tels que l’HTA, le diabète et la dyslipidémie. L’HTA est un facteur de risque identifié d’HSA par rupture d’anévrisme intracérébral. La majorité des patients présentant un diabète et une dyslipidémie sont également hypertendus. Il s’agit de patients poly-vasculaires et poly-comorbides. Le tabac et la consommation excessive d’alcool qui sont également des facteurs de risque identifiés d’HSA, n’apparaissent pas comme des facteurs d’évolution défavorable dans notre cohorte. Ils sont probablement sous-estimés car non recherchés ou non avoués par le patient. La prise d’un traitement anti-agrégant plaquettaire apparait comme un facteur d’évolution défavorable (p=0,001) avec 58 % de décès. Néanmoins, certaines études mettent en évidence un effet protecteur de l’aspirine avec un effet anti-inflammatoire sur la paroi de l’anévrisme qui réduit le risque de rupture chez les patients présentant un anévrisme cérébral (25). Dans notre cohorte, parmi les 12 patients traités par un anti-agrégant plaquettaire, 8 sont traités par de l’aspirine seule, 2 par clopidogrel seul, 1 par clopidogrel et aspirine ; et 1 par ticagrelor et aspirine. L’association de plusieurs anti-agrégants plaquettaires peut majorer le saignement. De plus, il s’agit de patients plus âgés avec un âge médian à 66 [55-81] et avec de nombreux facteurs de risque cardiovasculaires ; ce qui peut constituer des facteurs confondants.
Concernant l’état neurologique initial des patients, une HSA grave (grade WFNS 3-4-5) et la présence d’une hémorragie ventriculaire ou d’un hématome intra-parenchymateux (échelle de Fisher 4) sont des facteurs de risque de mauvaise évolution (26). Tout comme, la mise en place d’une sédation et d’un support aminergique à la phase initiale témoignant d’une HSA grave. La mise en place d’une DVE, réalisée en cas d’hydrocéphalie aiguë est facteur d’évolution défavorable à 1 an.
26
En effet, l’hydrocéphalie est un facteur de risque identifié de mauvais pronostic neurologique (27). Comme décrit dans la littérature, nous retrouvons que l’HTIC est un facteur de mauvais pronostic (p<0,001). Cette complication touche 44 % des patients dans notre cohorte (28). Le resaignement est aussi décrit comme une complication d’évolution neurologique défavorable et comme un risque de mortalité accrue à la phase initiale. L’ischémie cérébrale dont la définition scanographique est l’apparition d’une hypodensité cérébrale est une complication fréquente d’HSA (48 % des patients) mais cependant elle n’apparait pas comme un facteur de risque d’évolution défavorable (p=0,399). Les données collectées ne permettent pas d’identifier les patients présentant une ischémie cérébrale retardée (29) (30). Néanmoins les patients présentant un vasospasme ont clairement été identifiés (24 %). En’apparaît pas comme un facteur de risque d’évolution défavorable. Les complications de réanimation sont dominées par les complications infectieuses. Les infections pulmonaires, nombreuses (24 % des patients) et le choc septique semblent être des facteurs de pronostic défavorable à 1 an.
Cette cohorte prospective est intéressante car elle est, à notre connaissance la seule cohorte de Basse Normandie recueillant les données des patients admis pour une HSA au centre de référence neurochirurgical des départements du Calvados, de la Manche et de l’Orne. De plus, la connaissance de nos pratiques et du devenir des patients sont indispensables pour améliorer leur prise en charge. Il pourrait être intéressant de poursuivre la cohorte et d’étudier l’évolution des patients à 2 ans voire à 5 ans. La poursuite de la cohorte permettrait également d’augmenter sa puissance et peut être de mettre en lumière d’autres facteurs pronostiques.
27 V CONCLUSION
L’hémorragie sous-arachnoïdienne est associée à une morbi-mortalité élevée. Les survivants présentent des séquelles importantes à long terme. Notre cohorte rapporte 30 % de décès et 47 % d’évolution défavorable à 1 an. Nous avons mis en évidence des facteurs pronostiques d’évolution défavorable tels que : les antécédents d’HTA, de diabète et de dyslipidémie, la prise d’un traitement anti-agrégant, le grade WFNS, l’échelle de Fisher, la sédation, le support aminergique, la mise en place d’une DVE, les complications à type d’HTIC, de resaignement, d’infection pulmonaire et de choc septique. Le suivi des patients est indispensable pour évaluer nos pratiques, élaborer des recommandations et améliorer leur prise en charge. Notre cohorte constitue une base de données qui pourra servir à d’autres projets de recherches. Une plus grande cohorte, avec des données multicentriques permettrait d’affiner nos résultats.
28 VI BIBLIOGRAPHIE
1. Gijn J Van, Rinkel GJE. Subarachnoïd haemorrhage: diagnostic, causes and management. Brain 2001; 124:249-278
2. G. Audibert, S. Bousquet, C. Charpentier, Y. Devaux, P.-M. Mertes. Hémorragie sous-arachnoïdienne : épidémiologie, prédisposition, présentation clinique. Annales Françaises d’Anesthésie et de Réanimation 2007; 26:943–947
3. Macdonald RL, Schweizer TA. Spontaneous subarachnoid haemorrhage. Lancet, 2017; 389:655–66
4. Marie Softeland Sandvei, Pal Richard Romundstad, Tomm Brostrup Müller, Lars Vatten, Ann Vick. Risk factors for aneurysmal subarachnoid hemorrhage in a prospective population study: the HUNT study in Norway. Stroke 2009; 40:1958-1962
5. Jeffrey P. Kanne, Lee B. Talner. Autosomal dominant polycystic kidney disease presentingas subarachnoid hemorrhage. Emerg Radiol 2004; 11:110–112
6. Feigin VL, Rinkel GJ, Lawes CM, Algra A, Bennett DA, van Gijn J, Anderson CS: Risk factors for subarachnoid hemorrhage: an updated systematic review of epidemiological studies. Stroke 2005; 36:2773–2780
7. Longstreth WT Jr, Nelson LM, Koepsell TD, van Belle G: Cigarette smoking, alcohol use, and subarachnoid hemorrhage, Stroke 1992; 23:1242–1249
8. Ruigrok YM, Buskens E, Rinkel GJ: Attributable risk of common and rare determinants of subarachnoid hemorrhage. Stroke 2001; 32:1173–1175
9. E. Sander Connolly, Jr, Alejandro A. Rabinstein, J. Ricardo Carhuapoma, Colin P. Derdeyn, Guidelines for the Management of Aneurysmal Subarachnoid Hemorrhage: A guidelines for Healthcare Professionals From the American Heart Association/American Stroke. Stroke 2012; 43:1711-1737
29
10. Hémorragie sous-arachnoïdienne grave, Conférence d’experts. SFAR 2004
11. Ohkuma H, Tsurutani H, Suzuki S. Incidence and significance of early aneurysmal rebleeding before neurosurgical or neurological management. Stroke 2001; 32:1176 –1180
12. T Steiner, S Juvela, A Unterberg. European stroke organization guidelines for the management of intracranial aneurysms and subarachnoid haemorrhage. Cerebrovasc Dis 2013; 35:93–112
13. Allen GS, Ahn HS, Preziosi TJ, et al. Cerebral arterial spasm a controlled trial of nimodipine in patients with subarachnoid hemorrhage. N Engl J Med 1983; 308 :619–624
14. Gabriel J E Rinkel, Ale Algra. Long-term outcomes of patients with aneurysmal subarachnoid haemorrhage. Lancet Neurol 2011; 10:349–56
15. Jaja BNR, Saposnik G, Lingsma HF, Macdonald E, Thorpe KE, Mamdani M, et al. Development and validation of outcome prediction models for aneurysmal subarachnoid haemorrhage: the SAHIT multinational cohort study. BMJ 2018; 360 :j5745
16. R Loch Macdonald, Tom A Schweizer. Spontaneous subarachnoid haemorrhage. Lancet 2017; 389: 655–66
17. J Suarez, R. Tarr, W R. Selman. Aneurysmal Subarachnoid Hemorrhage. N Engl J Med 2006; 354:387-96.
18. A Molyneux, R Kerr, I Stratton, P Sandercock, M Clarke, J Shrimpton, R Holman. International Subarachnoid Aneurysm Trial (ISAT) Collaborative Group, International Subarachnoid Aneurysm Trial (ISAT) of neurosurgical clipping versus endovascular coiling in 2143 patients with ruptured intracranial aneurysms: a randomised trial. Lancet 2002; 360:1267-1274
30
19. Recommandations de la Société européenne de cardiologie sur la prévention des maladies cardiovasculaires. Congrès european society of cardiology, octobre 2012
20. A Bruno, E Akinwuntan, C Lin, B Close, K Davis, V Baute, T Aryal, D Brooks, DC. Hess, J A. Switzer, FT. Nichols. Simplified Modified Rankin Scale Questionnaire: Reproducibility over the telephone and validation with quality of life. Stroke 2011; 42:2276-2279
21. P. Fayol, H. Carrière, D. Habonimana, P.-M. Preux, J.-J. Dumond.Version française de l’entretien structuré pour l’échelle de devenir de Glasgow (GOS) : recommandations et premières études de validation. Annales de réadaptation et de médecine physique 2004; 47:142–156
22. Wilson JT, Pettigrew LE, Teasdale GM. Structured interviews for the glasgow outcome scale and the extended glasgow outcome scale: guidelines for their use. J Neurotrauma. 1998; 15:573–585.
23. M Dorhout Mees, A Algra, W P Vandertop, F van Kooten, Hans A J M Kuijsten, J Boiten, Robert J van Oostenbrugge, Rustam Al-Shahi Salman, P M Lavados, Gabriel J E Rinkel, Walter M van den Bergh. Magnesium for aneurysmal subarachnoid haemorrhage (MASH-2): a randomised placebo-controlled trial. Lancet 2012; 380 : 44-49
24. P J Kirkpatrick, C L Turner, C Smith, P J Hutchinson, G D Murray. Simvastatin in aneurysmal subarachnoid haemorrhage (STASH): a multicentre randomised phase 3 trial. Lancet Neurol 2014; 13:666-675
25. R M. Starke, N Chalouhi, D Ding, D M. Hasan. Potential Role of Aspirin in the Prevention of Aneurysmal Subarachnoid Hemorrhage. Cerebrovasc Dis 2015; 39:332–342
26. James P. Galea, L Dulhanty. Predictors of outcome in aneurysmal subarachnoid hemorrhage Patients observations from a multicenter data set. Stroke 2017; 48:2958-2963
31
27. René van den Berg;Mahrouz Foumani;Rosalie D. Schröder;Saskia M. Peerdeman;Janneke Horn;Shandra Bipat;W. Peter Vandertop. Predictors of outcome in World Federation of Neurologic Surgeons grade V aneurysmal subarachnoid hemorrhage patients. Crit Care Med 201 ; 39:2722-2727
28. Soehle M, Chatfield DA, Czosnyka M, Kirkpatrick PJ. Predictive value of initial clinical status, intracranial pressure and transcranial Doppler pulsatility after subarachnoid haemorrhage. 2007; 149:575-83
29. Terbrugge, R. Loch Macdonald, Michael N. Diringer, Joseph P. Broderick, Jens P. Dreier An definition of Delayed Cerebral Ischemia after aneurysmal subarachnoid hemorrhage as outcome event in clinical trials and observational studies: proposal of a multidiscipinary research group. Stroke 2010; 41:2391-2395
30. W Duan, Y Pan, C Wang. Risk factors and clinical Impact of Delayed Cerebral Ischemia after Aneurysmal Subarachnoid Hemorrhage: analysis from the China National Stroke Registry. Neuroepidemiology 2018; 50:128–136
32 VII ANNEXES
Annexe 1 : Facteurs de risque d’une hémorragie sous-arachnoïdienne
Figure 2. Risk of SAH occurrence (RRs for longitudinal studies, ORs for casecontrol
studies, and 95% CIs) for smoking, hypertension, alcohol abuse, oral contraception, hormone replacement therapy, ethnicity, hypercholesterolemia, rigorous physical activity, lean BMI, and diabetes by study design. Studies are listed in the ascending order according to year of publication. Diamonds represent pooled estimates, and width of the diamonds represents 95% CIs.
33
Risk factors for subarachnoid hemorrhage: an updated systematic review of epidemiological studies. Stroke 2005; 36: 2773–2780
Annexe 2 : Classification de la World Federation of Neurological Surgeon (WFNS)
Annexe 3 : Classification de Hunt et Hess
34 Annexe 5 : Modified Rankin Scale (mRS)
35 Annexe 7 : Echelle de Glasgow
36 Annexe 8 : Modified Rankin Scale questionnaire
37
40
Annexe 10 : Glasgow Outcome Scale extended (GOSe)
« Par délibération de son Conseil en date du 10 Novembre 1972, l’Université n’entend donner aucune approbation ni improbation aux opinions émises dans les thèses ou mémoires. Ces opinions doivent être considérées comme propres à leurs auteurs ».
VU, le Président de Thèse
VU, le Doyen de la Faculté
VU et permis d’imprimer en référence à la délibération
du Conseil d’Université en date du 14 Décembre 1973
Pour le Président
de l’Université de CAEN et P.O