HAL Id: dumas-02962480
https://dumas.ccsd.cnrs.fr/dumas-02962480
Submitted on 9 Oct 2020HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Valeur pronostique du stroke volume indexé dans
l’hypertension pulmonaire
Maria Azzolini-Jacquin
To cite this version:
Maria Azzolini-Jacquin. Valeur pronostique du stroke volume indexé dans l’hypertension pulmonaire. Médecine humaine et pathologie. 2020. �dumas-02962480�
ANNÉE 2020
THÈSE D’EXERCICE DE MÉDECINE
Valeur pronostique du stroke volume indexé
dans l’hypertension pulmonaire
Soutenue le 22 septembre 2020 à Nice
Par Maria AZZOLINI épouse JACQUIN
Née le 9 octobre 1989 à Ferrara (Italie)
Président du Jury :
Monsieur le Professeur Émile FERRARI
Assesseurs :
Madame le Docteur Delphine BAUDOUY
Monsieur le Docteur Fabien SQUARA
Directrice de Thèse :
UNIVERSITE NICE SOPHIA ANTIPOLIS FACULTE DE MEDECINE
màj27/09/19
Liste des enseignants au 1er septembre 2019 à la Faculté de Médecine de Nice Doyen
Pr. BAQUÉ Patrick Vice-doyens
Pédagogie Pr. ALUNNI Véronique
Recherche Pr DELLAMONICA Jean
Etudiants M. JOUAN Robin Chargé de mission projet Campus Pr. PAQUIS Philippe Conservateur de la bibliothèque Mme AMSELLE Danièle Directrice administrative des services Mme CALLEA Isabelle
Doyens Honoraires M. RAMPAL Patrick M. BENCHIMOL Daniel
UNIVERSITE NICE SOPHIA ANTIPOLIS FACULTE DE MEDECINE
màj27/09/19
1
Liste des enseignants au 1er septembre 2019 à la Faculté de Médecine de Nice PROFESSEURS CLASSE EXCEPTIONNELLE
M. BAQUÉ Patrick Anatomie - Chirurgie Générale (42.01) M. BERNARDIN Gilles Réanimation Médicale (48.02)
Mme BLANC-PEDEUTOUR
Florence Cancérologie – Génétique (47.02)
M. BOILEAU Pascal Chirurgie Orthopédique et Traumatologique (50.02)
M. DARCOURT Jacques Biophysique et Médecine Nucléaire (43.01) M. DRICI Milou-Daniel Pharmacologie Clinique (48.03)
M. ESNAULT Vincent Néphrologie (52-03) M. FUZIBET Jean-Gabriel Médecine Interne (53.01) M. GILSON Éric Biologie Cellulaire (44.03) M. GUGENHEIM Jean Chirurgie Digestive (52.02) M. HASSEN KHODJA Reda Chirurgie Vasculaire (51.04) M. HÉBUTERNE Xavier Nutrition (44.04)
M. HOFMAN Paul Anatomie et Cytologie Pathologiques (42.03) Mme ICHAI Carole Anesthésiologie et Réanimation Chirurgicale
(48.01)
M. LACOUR Jean-Philippe Dermato-Vénéréologie (50.03)
M. LEFTHERIOTIS Georges Chirurgie vasculaire ; médecine vasculaire (51.04) M. MARQUETTE
Charles-Hugo Pneumologie (51.01)
M. MARTY Pierre Parasitologie et Mycologie (45.02)
M. MICHIELS Jean-François Anatomie et Cytologie Pathologiques (42.03) M. MOUROUX Jérôme Chirurgie Thoracique et Cardiovasculaire (51.03) Mme PAQUIS Véronique Génétique (47.04)
M. PAQUIS Philippe Neurochirurgie (49.02)
M. PRADIER Christian Épidémiologie, Économie de la Santé et Prévention (46.01)
M. QUATREHOMME Gérald Médecine Légale et Droit de la Santé (46.03) M. RAUCOULES-AIMÉ Marc Anesthésie et Réanimation Chirurgicale (48.01) M. ROBERT Philippe Psychiatrie d’Adultes (49.03)
M. SCHNEIDER Stéphane Nutrition (44.04)
M. THYSS Antoine Cancérologie, Radiothérapie (47.02) M. TRAN Albert Hépato Gastro-entérologie (52.01)
UNIVERSITE NICE SOPHIA ANTIPOLIS FACULTE DE MEDECINE
màj27/09/19
2
Liste des enseignants au 1er septembre 2019 à la Faculté de Médecine de Nice
PROFESSEURS PREMIERE CLASSE Mme ASKENAZY-GITTARD
Florence Pédopsychiatrie (49.04)
M. BARRANGER Emmanuel Gynécologie Obstétrique (54.03)
M. BÉRARD Étienne Pédiatrie (54.01)
M. BONGAIN André Gynécologie-Obstétrique (54.03) Mme BREUIL Véronique Rhumatologie (50.01)
M. CASTILLO Laurent O.R.L. (55.01)
M. CHEVALLIER Patrick Radiologie et Imagerie Médicale (43.02) M. DE PERETTI Fernand Anatomie-Chirurgie Orthopédique (42.01)
M. FERRARI Émile Cardiologie (51.02)
M. FERRERO Jean-Marc Cancérologie ; Radiothérapie (47.02) M. FONTAINE Denys Neurochirurgie (49.02)
M. GIBELIN Pierre Cardiologie (51.02) M. HANNOUN-LEVI
Jean-Michel Cancérologie ; Radiothérapie (47.02) M. LEVRAUT Jacques Médecine d'urgence (48.05)
M. LONJON Michel Neurochirurgie (49.02)
M. MOUNIER Nicolas Cancérologie, Radiothérapie (47.02) M. PADOVANI Bernard Radiologie et Imagerie Médicale (43.02) M. PASSERON Thierry Dermato-Vénéréologie (50-03)
M. PICHE Thierry Gastro-entérologie (52.01) Mme RAYNAUD Dominique Hématologie (47.01) M. ROSENTHAL Éric Médecine Interne (53.01)
M. STACCINI Pascal Biostatistiques et Informatique Médicale (46.04)
M. THOMAS Pierre Neurologie (49.01)
M. TROJANI Christophe Chirurgie Orthopédique et Traumatologique (50.02)
UNIVERSITE NICE SOPHIA ANTIPOLIS FACULTE DE MEDECINE
màj27/09/19
3
Liste des enseignants au 1er septembre 2019 à la Faculté de Médecine de Nice
PROFESSEURS DEUXIEME CLASSE
Mme ALUNNI Véronique Médecine Légale et Droit de la Santé (46.03) M. ANTY Rodolphe Gastro-entérologie (52.01)
M. BAHADORAN Philippe Cytologie et Histologie (42.02) Mme BAILLIF Stéphanie Ophtalmologie (55.02)
Mme BANNWARTH Sylvie Génétique (47.04)
M. BENIZRI Emmanuel Chirurgie Générale (53.02)
M. BENOIT Michel Psychiatrie (49.03)
M. BERTHET Jean-Philippe Chirurgie Thoracique (51-03) M. BOZEC Alexandre ORL- Cancérologie (47.02) M. BREAUD Jean Chirurgie Infantile (54-02) Mme BUREL-VANDENBOS
Fanny Anatomie et Cytologie pathologiques (42.03) M. CHEVALIER Nicolas Endocrinologie, Diabète et Maladies Métaboliques
(54.04)
Mme CHINETTI Giulia Biochimie-Biologie Moléculaire (44.01)
M. CLUZEAU Thomas Hématologie (47.01)
M. DELLAMONICA Jean Réanimation médicale (48.02) M. DELOTTE Jérôme Gynécologie-obstétrique (54.03)
M FAVRE Guillaume Néphrologie (44-02)
M. FOURNIER Jean-Paul Thérapeutique (48-04)
Mme GIORDANENGO Valérie Bactériologie-Virologie (45.01) Mme GIOVANNINI-CHAMI
Lisa Pédiatrie (54.01)
M. GUÉRIN Olivier Méd. In ; Gériatrie (53.01) M. IANNELLI Antonio Chirurgie Digestive (52.02)
M. ILIE Marius Anatomie et Cytologie pathologiques (42.03) M JEAN BAPTISTE Elixène Chirurgie vasculaire (51.04)
M. ROHRLICH Pierre Pédiatrie (54.01)
M. ROUX Christian Rhumatologie (50.01)
M. RUIMY Raymond Bactériologie-virologie (45.01) Mme SACCONI Sabrina Neurologie (49.01)
M. SADOUL Jean-Louis Endocrinologie, Diabète et Maladies Métaboliques (54.04)
UNIVERSITE NICE SOPHIA ANTIPOLIS FACULTE DE MEDECINE
màj27/09/19
4
Liste des enseignants au 1er septembre 2019 à la Faculté de Médecine de Nice
MAITRES DE CONFÉRENCES DES UNIVERSITÉS - PRATICIENS HOSPITALIERS M. Mme M. AMBROSETTI Damien BERNARD-POMIER G. BRONSARD Nicolas Cytologie et Histologie (42.02) Immunologie (47.03)
Anatomie Chirurgie Orthopédique et Traumatologique (42.01)
M. CAMUZARD Olivier Chirurgie Plastique (50-04) Mme CONTENTI-LIPRANDI
Julie Médecine d'urgence (48-04)
M. DOGLIO Alain Bactériologie-Virologie (45.01)
M DOYEN Jérôme Radiothérapie (47.02)
M. FOSSE Thierry Bactériologie-Virologie-Hygiène (45.01) M. GARRAFFO Rodolphe Pharmacologie Fondamentale (48.03) Mme HINAULT Charlotte Biochimie et biologie moléculaire (44.01) M. HUMBERT Olivier Biophysique et Médecine Nucléaire (43.01) Mme LAMY Brigitte Bactériologie-virologie (45.01)
Mme LONG-MIRA Elodie Cytologie et Histologie (42.02) Mme MAGNIÉ Marie-Noëlle Physiologie (44.02)
M. MASSALOU Damien Chirurgie Viscérale (52-02) Mme MOCERI Pamela Cardiologie (51.02)
M. MONTAUDIE Henri Dermatologie (50.03) Mme MUSSO-LASSALLE
Sandra Anatomie et Cytologie pathologiques (42.03) M. NAÏMI Mourad Biochimie et Biologie moléculaire (44.01) Mme POMARES Christelle Parasitologie et mycologie (45.02)
M. SAVOLDELLI Charles Chirurgie maxillo-faciale et stomatologie (55.03) Mme SEITZ-POLSKI Barbara Immunologie (47.03)
M. SQUARA Fabien Cardiologie (51.02)
M. TESTA Jean Épidémiologie Économie de la Santé et Prévention (46.01)
Mme THUMMLER Susanne Pédopsychiatrie (49-04)
UNIVERSITE NICE SOPHIA ANTIPOLIS FACULTE DE MEDECINE
màj27/09/19
5
Liste des enseignants au 1er septembre 2019 à la Faculté de Médecine de Nice
MAITRE DE CONFÉRENCES DES UNIVERSITÉS
M. DARMON David Médecine Générale (53.03)
Mme GROS Auriane Orthophonie (69)
PROFESSEURS AGRÉGÉS
Mme LANDI Rebecca Anglais
PRATICIEN HOSPITALIER UNIVERSITAIRE
M. DURAND Matthieu Urologie (52.04)
M. SICARD Antoine Néphrologie (52-03)
PROFESSEURS ASSOCIÉS
M. GARDON Gilles Médecine Générale (53.03) Mme MONNIER Brigitte Médecine Générale (53.03) MAITRES DE CONFÉRENCES ASSOCIÉS
Mme CASTA Céline Médecine Générale (53.03) M. GASPERINI Fabrice Médecine Générale (53.03) M. HOGU Nicolas Médecine Générale (53.03)
UNIVERSITE NICE SOPHIA ANTIPOLIS FACULTE DE MEDECINE
màj27/09/19
6
Liste des enseignants au 1er septembre 2019 à la Faculté de Médecine de Nice
Constitution du jury en qualité de 4èmemembre Professeurs Honoraires
M. AMIEL Jean M. GASTAUD Pierre
M ALBERTINI Marc M. GÉRARD Jean-Pierre
M. BALAS Daniel M. GILLET Jean-Yves
M. BATT Michel M. GRELLIER Patrick
M. BLAIVE Bruno M. GRIMAUD Dominique
M. BOQUET Patrice M. HOFLIGER Philippe
M. BOURGEON André M. JOURDAN Jacques
M. BOUTTÉ Patrick M. LAMBERT Jean-Claude
M. BRUNETON Jean-Noël M. LAZDUNSKI Michel
Mme BUSSIERE Françoise M. LEFEBVRE Jean-Claude
M. CAMOUS Jean-Pierre M. LE FICHOUX Yves
M. CANIVET Bertrand Mme LEBRETON Elisabeth
M. CASSUTO Jill-patrice M. MARIANI Roger
M. CHATEL Marcel M. MASSEYEFF René
M. COUSSEMENT Alain M. MATTEI Mathieu
Mme CRENESSE Dominique M. MOUIEL Jean
M. DARCOURT Guy Mme MYQUEL Martine
M. DELLAMONICA Pierre M. ORTONNE Jean-Paul
M. DELMONT Jean M. PRINGUEY Dominique
M. DEMARD François M. SANTINI Joseph
M. DESNUELLE Claude M. SAUTRON Jean Baptiste
M. DOLISI Claude M. SCHNEIDER Maurice
Mme EULLER-ZIEGLER Liana M. TOUBOL Jacques
M. FENICHEL Patrick M. TRAN Dinh Khiem
M . FRANCO Alain M VAN OBBERGHEN Emmanuel
M. FREYCHET Pierre M. ZIEGLER Gérard
M.C.U. Honoraires
M. ARNOLD Jacques M. GIUDICELLI Jean
M. BASTERIS Bernard M. MAGNÉ Jacques
M. BENOLIEL José Mme MEMRAN Nadine
Mlle CHICHMANIAN Rose-Marie M. MENGUAL Raymond
Mme DONZEAU Michèle M. PHILIP Patrick
M. EMILIOZZI Roméo M. POIRÉE Jean-Claude
M. FRANKEN Philippe Mme ROURE Marie-Claire
7
REMERCIEMENTS
AUX MEMBRES DU JURY
A Monsieur le Président du jury, Professeur Émile FERRARI,
Vous me faites l’honneur de présider le jury de ma thèse. Je vous remercie pour votre enseignement, tout autant pédagogique qu’exigeant, et pour l’accueil dans votre service. Merci également d’avoir sacrifié une chemise en gardant un certain nourrisson lors du DU de thrombose.
A mon directeur de thèse, Madame le Docteur Pamela MOCERI,
Ton dévouement au travail, ta rigueur et ta compétence ont toujours été source de grande inspiration pour moi. Merci énormément pour ton aide, ta disponibilité et tes stats… ! Je pense que parfois la seule chose qui me poussait à vaincre la fatigue était de voir tes messages et tes mail envoyés à des heures improbables pour respecter les dates de consigne. Merci aussi de m’avoir initiée à la cardiopédiatrie, que je découvre un peu tard mais que j’aime beaucoup. C’était un grand honneur pour moi de travailler à tes cotés.
A Madame le Docteur Delphine BAUDOUY,
Je te remercie d’avoir accepté de juger mon travail. Ta détermination et ton sérieux sont un exemple pour moi. Je suis très heureuse de continuer à travailler avec toi dans le futur.
A Monsieur le Docteur Fabien SQUARA,
Je te remercie pour ta présence au sein de ce jury. Même si je n’ai pas été ton interne dans le service, j’ai toujours apprécié ta disponibilité et ton tempérament très calme.
AU SERVICE DE CARDIOLOGIE DU CHU DE NICE (passé ou présent)
Au docteur David BERTORA, sois assuré de ma profonde gratitude pour ton enseignement inestimable lors du passage dans ton unité, mais aussi pour ta discrétion et ton aide.
Au docteur Michel THIRY, pour votre bonne humeur et pour m’avoir appris à reconnaître les coronaires.
Au docteur Guillaume THEODORE, pour tes enseignements rythmologiques.
Au docteur Didier SCARLATTI, pour ta motivation lors des cours dans ton bureau, mais surtout pour les protocoles qui porterons à jamais ton nom !
Au docteur Olivier CHICHE, parce que plusieurs fois tu m’as mise devant mes erreurs avec beaucoup de patience et de tact. J’ai énormément appris grâce à toi.
Au Docteur Sithi BUN, lors des gardes j’ai pu brièvement profiter de tes connaissances, qui m’ont enrichie. J’espère te côtoyer dans le futur.
Au docteur Nassim REDJIMI, j’ai profité de tes compétences en coronarographie à plusieurs reprises et j’ai beaucoup appris.
8
Au docteur Charlotte DAVID, j’aime apprendre de l’expérience des autres et ton recrutement au sein du service a été une source de richesse pour moi.
Pour ne pas risquer d’oublier un nom, (vous êtes nombreux quand même !) je dirai un merci collectif et chaleureux à CHACUN des membres de l’équipe paramédicale et administrative. J’ai pu souvent constater votre compétence et votre implication dans le travail.
AU SERVICE DE NEPHROLOGIE DU CHU DE NICE
Au Professeur Vincent ESNAULT, merci de m’avoir accueillie dans votre service lors de mon premier semestre d’internat. Grace à vos visites régulières j’ai pu bien progresser.
Au docteur Aimele MEFTAH, merci parce que tu m’as tout appris au début. Je n’oublierai jamais ton soutien.
A mes cointernes qui sont désormais des docteurs néphrologues : Marine, Thierry, Sonia, Florence. Merci pour vos raisonnements même un peu compliqués, vous avez toujours été gentils et disponibles. (Et avec Florence aussi nous avons été belly sisters : merci pour nos promenades et le café poussette !) AU CH D’ANTIBES
Je remercie les docteurs François BERNASCONI, Alain PROTON, Anne BELLEMAIN, Laurent JACQ, Folco FRATTINI, Kais BOUHARBA et Frédéric SUAVET qui ont participé à ma formation lors du passage dans le service de cardiologie.
Merci à Zigolène, super cointerne au grand sens pratique, et à Maria « la grande », avec qui je partage un prénom et un accent mais malheureusement pas la hauteur.
Merci à toute l’équipe paramédicale et administrative : je n’oublierai jamais nos gouter pain et Nutella (et l’Italie est là ! ah non ça c’est Barilla).
AU CH DE CANNES
Au docteur Thierry TIBI, je vous admire tellement que mon mari vous a surnommé « saint Tibi ». Je pense que cela suffit à vous dire l’estime que j’ai pour vous.
Au docteur Laurent BALI, merci infiniment pour ta patience lorsque je t’accompagnais au bloc. Au docteur Nathalie BERKANE, lors d’une garde vers 2h du matin tu m’as dit : « Il ne faut jamais oublier que la personne sur le brancard a besoin de toi ». Ces mots inspirent toujours ma pratique.
Au docteur Sabine DURERO, merci d’avoir partagé avec moi vos connaissances en médecine vasculaire. Les heures à vos côtés ont été précieuses.
Au docteur Édouard LAMMENS, pour ta bonne humeur permanente et parce que j’ai trouvé la coronaire droite !
Au docteur Laurent LIPRANDI, je garde soigneusement dans ma poche les notes que j’ai prises quand tu décidais de te lancer dans des explications passionnantes et détaillées de rythmologie.
9
Au docteur Andrei LOZBA, tu tenais toujours à partager les cas intéressants en échographie et je t’en remercie.
Au docteur Anne TALBODEC, pour le temps que tu m’as dédié en échographie de stress et pour tes conseils en matière de CD pour enfants.
Au docteur Gilles ZAMMOUR, merci pour ton aide et ta capacité à mettre la bonne ambiance. A ma cointerne camionneuse Charlotte, qui adore les petits-déjeuners !
Et encore une fois un immense merci à toute l’équipe paramédicale et administrative du service de cardiologie : je suis honorée de vous avoir croisés lors de mon parcours.
A l’IAT
Au docteur Alain MIHOUBI, vous avez un talent exceptionnel que je vous remercie d’avoir partagé avec moi. J’ai aimé travailler à vos côtés.
Au docteur Jean-Pierre ELBÈZE, pour votre gentillesse et disponibilité.
Aux docteurs Jacques TEBOUL, Michel TAPIA, Stéphane LOPEZ, je me suis toujours sentie la bienvenue au bloc et vous m’avez énormément appris.
Au docteur Pierre MEYER, vous observer au travail c’est absolument spectaculaire (« On va mettre la pilasse »). Merci de m’avoir soutenue à plusieurs reprises.
Au docteur Julien ADEJEDJ, quelle bonne surprise de retrouver mon interne de Cochin ici sur la Côte d’Azur ! Tu es resté aussi pédagogue que dans mes souvenirs d’externat.
Au docteur Léo CUENIN, j’aime beaucoup discuter avec toi parce que tu m’apprends toujours quelque chose. Je te souhaite le meilleur et j’espère qu’on travaillera ensemble.
Merci également aux docteurs Philippe DURAND, Claude-Jean MARIOTTINI et Laura GAGLIARDI pour leur disponibilité.
Au docteur Michèle MACCARIO, votre talent est impressionnant. C’était une vraie chance de travailler à vos côtés. Merci pour tout.
Au docteur Diane LENA, tu fais de la médecine que j’aime. Tu me l’as dit une fois, je peux maintenant te le dire en retour.
Au docteur Philippe CAMARASA, toujours très patient et de bonne humeur, c’était un bonheur de travailler avec toi.
Au docteur Arnaud DE LA CHAPELLE, merci pour tout ce que tu m’as appris, dans un moment historique très difficile tu as toujours eu le temps pour discuter.
Au docteur Arnaud CAUSERET, combien de temps j’ai passé avec toi à « procaféiner » sur l’avenir. Merci pour tous tes conseils.
10
A Willem, toujours content, merci de m’avoir appris un tas de choses en anesth réa ! A Charlotte, merci de m’avoir soutenue dans des moments un peu tristes au self.
A toute, mais vraiment toute, l’équipe paramédicale et administrative : vous êtes en or ! Au personnel de cardiopédiatrie de Lenval
Au docteur Julien LEPORATI, mon maître. J’admire ta façon de travailler et de parler avec les patients et leurs familles. Tu es un médecin formidable et je ferai trésor de tout ce que j’ai appris en te côtoyant pendant ces derniers mois. Merci.
A Bruno, Maeva, Amandine, Patricia, Stéphanie : merci pour votre accueil !
A mon cointerne Lorenzo, arrête de prendre des expressos s’il te plait. C’est un ristretto que tu dois demander. Sans blague, j’ai compris que tu es quelqu’un de brillant et tu vas faire un très beau métier. A MES COINTERNES (qui sont très nombreux vu la longueur de mon parcours)
Aux plus vieux
A Camille, pour nos échanges en matière cardiologique mais aussi en puériculture (belly sisters !). Ton courage est exemplaire.
A Dan, merci pour ta disponibilité et pour les vastes connaissances que tu as partagées avec nous. A Julien, tu étais interne en dernière année lors de mon arrivée à Nice et j’ai toujours admiré ta profonde gentillesse et ta disponibilité permanente.
A Philippe, forcément tu viens juste après Julien parce que tu l’as remplacé, toujours disponible à nous aider, nous les jeunes. Merci pour toutes les gardes incroyables que j’ai doublées avec toi et pour avoir annoncé ma grossesse devant tout le monde sur la terrasse du Splendid… !
A Jérémy, pour ton aide lors de mon surnombre à l’USIC et pour tes conseils en cardiopédiatrie. A Greg, mon premier contact à Nice : tout le monde avait ton numéro de téléphone parce que tu étais, et tu es toujours, le plus gentil !
A Mika, merci pour tes avis en cardiologie et en gestion de la copropriété. A Gauthier, pour ta gentillesse lors des gardes.
A mes cointernes de promo
A Benjamin (Sartre), je ne te cache pas que tu as été mon point de repère tout au long de ces années d’internat. J’ai toujours écouté tes conseils et admiré ton humanité avec les patients. Merci pour toutes les fois où tu m’as faite rire aux larmes.
A Benjamin (Essayagh), pour tous ces trajets en voiture vers Nîmes ou Aix, avec les quizz musicaux, en essayant de doubler la voiture de Gauthier grâce au télépéage mais ça n’a pas marché (pas du tout à cause de ma conduite irréprochable).
11
Aux plus jeunes
A Aude, tu m’as énormément appris pendant ces derniers mois, que ce soit en cardiopédiatrie comme en thèse &co (sans parler des potins). J’ai pu apprécier ton courage et ta compétence.
A Alex, toujours disponible pour des avis rythmologiques mais surtout informatiques (sauf quand tu te transforme en Dark Poule).
A Momo, merci pour tous tes bon plans, tes conseils, ta gentillesse… l’interne préféré de toute l’équipe de Tzanck il ne faut pas l’oublier !
A Étienne, tu as toujours été disponible pour m’aider et je t’en suis reconnaissante. Je suis heureuse de travailler avec toi.
A Stéphane, comme tu l’as dit, nous avons fait un bon bout d’internat ensemble. Merci !
A Clara, ton soutien a été fondamental pendant mon premier semestre au CHU comme tu le sais et j’apprécie toujours parler et échanger avec toi. Merci infiniment.
A Lolita, ta bonne humeur et ton calme sont source d’inspiration et je tiens toujours en considération tes avis.
A Manu, toujours décidée, nous avons partagé des remplacements un peu partout au CHU et j’ai apprécié ton sens pratique.
A Jules, pour ta détermination que j’ai pu constater ces derniers mois.
A Julie, pour ton courage et ta volonté de t’affirmer avec douceur. Sauf si on oublie le E. A Alex Rodière, ton travail est admirable. Merci beaucoup.
A Baptiste, qui détient le record de survie ininterrompue au CHU… Courage pour la suite ! A Marie, pour ta bonne humeur et ton travail sérieux.
A Nathan, je suis sûre que tu es fort, ça se voit lors de tes powerpoint au staff. A Florian, donc mon futur premier interne ! J’en suis très heureuse.
A Fanny, merci pour avoir partagé le A avec moi, je n’aurais pas pu rêver d’une meilleure cointerne. Je t’admire parce que je vois que tu as vraiment à cœur les patients.
Aux amis niçois
A Benjamin, pour ta bonne humeur, ta douceur et ton courage incroyable. Ne lâche rien. A Marie, merci pour toutes tes attentions et pour avoir toujours tout organisé ! Tu es une superwoman. A Anissa, pour tes blagues, mais aussi parce que tu as à cœur notre petit groupe.
12
A Julie, toujours douce et attentive aux autres, merci. Nous arriverons à organiser un diner, promis ! Et merci à Thibaud, pour ton attention aux enfants.
A Sylvia, ma voisine que je croisais toujours par hasard et devenue ensuite ma copine, merci pour toutes les tchatches et ta disponibilité. Et merci à Bruno qui nous a maintes fois aidés.
A Marco e Lucia, perché condividiamo quest’amore combattuto per la nostra madrepatria. Chissà dove saremo tra qualche anno…?
A Vale, che bello è stato ritrovarsi! Silentini per sempre! A ma famille
Mamma, non hai mai voluto che il fatto di essere mamma ti differenziasse in alcun modo (né in positivo, né in negativo) dai tuoi colleghi. Forse avevi ragione. Ma adesso so quanto merito avevi in più. Quanta fatica, mamma.
Papà, tra pochi giorni potrò finalmente iscrivermi all’Ordine dei Medici. Magari non quello che volevi tu, ma spero che sarai comunque fiero di me.
Kiks, sono fiera di vederti ormai grande, con una famiglia e un lavoro. Megs, sono stata contenta di scambiare le nostre opinioni, anche se in contesti litigiosi o difficili: so che hai un animo retto. Fratelli miei, ogni volta che facciamo qualcosa insieme è una grande gioia per me. Grazie Megghi per tutto il tuo aiuto e benvenuta in famiglia!
Grazie ai miei nonni e ai miei zii per il loro sostegno che sento sempre con me, anche da oltralpe. A mes beaux-parents François et Dominique, merci pour votre soutien en toutes circonstances et en particulier pour l’impression du mémoire et la relecture de la thèse, mais surtout dans nos échanges qui sont toujours très enrichissants.
A mes belles-sœurs et beaux-frères, ainsi qu’à vos enfants, pour la richesse que vous avez apporté dans ma vie. A mes belles grand-mères, merci pour le soutien et l’intérêt que vous porté pour mes études.
A Silvano et Giovanni. Combien de fois pendant mon internat je me suis entendue dire : « Je ne sais pas comment tu fais avec deux enfants ». La vérité, c’est que je ne sais pas comment j’aurais fait sans vous. Haec ornamenta mea.
A mon mari Pierre-Henri, l’amour de ma vie. Tu me connais mieux que moi-même et jamais je n’aurai pu arriver jusqu’ici sans toi. Ces années n’ont pas toujours été faciles, mais tu as été ma safe place, mon chez moi. Je suis tellement fière de toi et de tout ce que tu as accompli. Avec toi, je grandis et notre couple grandit aussi. Je t’aime et je t’aimerai toujours.
13
TABLE DES MATIÈRES
Abréviations 16
Introduction 17
1. Généralités sur l’hypertension pulmonaire 17
1.1 Définition de l’hypertension pulmonaire 17
1.2 Classification clinique de l’hypertension pulmonaire 18
1.3 Épidémiologie 18
1.4 Démarche diagnostique 19
1.5 Pronostic dans l’hypertension pulmonaire 21
1.6 Traitement dans l’hypertension pulmonaire 22
2. Évaluation hémodynamique et échographique dans l’hypertension pulmonaire 24 2.1 Évaluation hémodynamique dans l’hypertension pulmonaire 24 2.2 Évaluation échocardiographique dans l’hypertension pulmonaire 27
3. Le stroke volume ou volume d’éjection systolique 29
Objectifs 32
Matériels et méthodes 33
1. Population 33
1.1 Critères d’inclusion des patients 33
1.2 Données cliniques et biologiques 33
1.3 Échocardiographie 33
1.4 Cathétérisme droit 34
2. Analyse statistique 35
Résultats 36
1. Caractéristiques de la population générale 36
2. Données hémodynamiques et échographiques 38
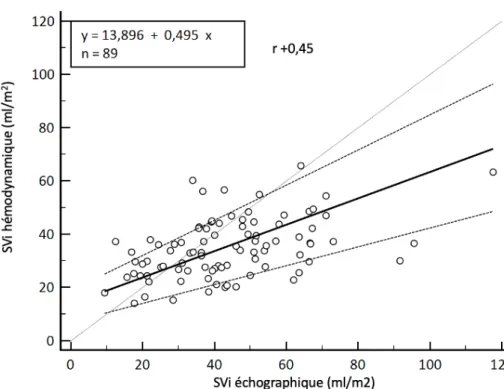
3. Corrélation entre le stroke volume indexé hémodynamique et le stroke volume indexé échographique
39
4. Valeur pronostique du SVi hémodynamique 41
Discussion 46
1. Comparaison de deux méthodes pour le calcul du stroke volume indexé 46 2. Valeur pronostique du stroke volume indexé et d’autres paramètres 47
3. Limites 48 Conclusion 50 Résumé 51 Abstract 52 Bibliographie 53 Serment d’Hippocrate 60
14
ABRÉVIATIONS
AP Artère pulmonaire
BPCO Bronchopneumopathie chronique obstructive CCVD Chambre de chasse du ventricule droit
DC Débit cardiaque
ESC European Society of Cardiology FAC Fractional area change
FEVD Fraction d’éjection ventriculaire droite FEVG Fraction d’éjection ventriculaire gauche GTP Gradient trans-pulmonaire
IC Index cardiaque
IRM Imagerie par résonance magnétique IT Insuffisance tricuspidienne
ITV Intégral temps-vitesse
HTAP Hypertension artérielle pulmonaire HTP Hypertension pulmonaire
OD Oreillette droite
PAPd Pression artérielle pulmonaire diastolique PAPm Pression artérielle pulmonaire moyenne PAPs Pression artérielle pulmonaire systolique Pcap Pression capillaire pulmonaire
POD Pression de l’oreillette droite ROC Receiver operating characteristic RVP Résistances vasculaires pulmonaires
SV Stroke volume
SVi Stroke volume indexé
SVO2 Saturation veineuse centrale en oxygène TAPSE Tricuspid annular plane systolic excursion TDM Tomodensitométrie
TM6M Test de marche de 6 minutes
UW Unité Wood
VD Ventricule droit
VG Ventricule gauche
15
INTRODUCTION
1. Généralités sur l’hypertension pulmonaire
1.1 Définition de l’hypertension pulmonaire
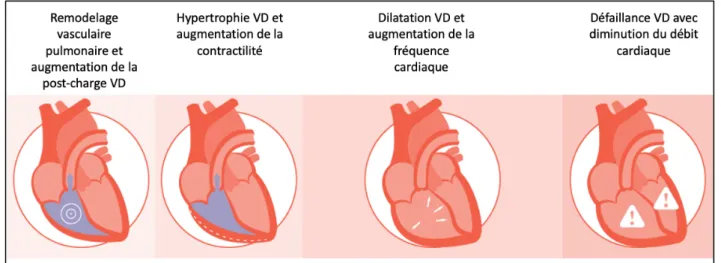
L’hypertension pulmonaire (HTP) est une pathologie caractérisée par l’augmentation des pressions vasculaires pulmonaires et donc de la post-charge ventriculaire droite. Initialement, le ventricule droit (VD) s’hypertrophie pour maintenir un volume d’éjection normale. Ensuite, la dilatation ventriculaire droite compensatrice est suivie par une défaillance cardiaque droite de plus en plus avancée pouvant aboutir au décès.
La définition de l’HTP est hémodynamique. Depuis 2019, l’HTP est définie par une pression artérielle pulmonaire moyenne (PAPm) >20mmHg(1). Il faut tenir compte du fait qu’une augmentation de la PAPm peut être secondaire à plusieurs causes, notamment :
- une augmentation du débit cardiaque - un shunt gauche-droite
- une augmentation de la pression capillaire (Pcap) - une hyperviscosité
- une atteinte des vaisseaux pulmonaires
Si l’HTP est secondaire à une augmentation des Pcap >15mmHg, donc dans la majorité des cas à une pathologie du cœur gauche, elle est dite post-capillaire. En cas de véritable atteinte des vaisseaux pulmonaires, l’HTP est pré-capillaire. Pour s’affranchir de l’effet du débit cardiaque, les résistances vasculaires pulmonaires, définies comme RVP = (PAPm – Pcap) / débit cardiaque (DC), sont inclues dans la définition de l’HTP pré-capillaire. L’HTP pré-capillaire est donc définie par une PAPm > 20 mmHg ET Pcap ≤15 mmHg ET RVP ≥3 UW. L’HTP post-capillaire est définie par une PAPm > 20 mmHg ET Pcap >15 mmHg ET RVP < UW. Enfin, l’HTP est considérée comme mixte lorsqu’elle est caractérisée par une PAPm > 20 mmHg ET Pcap >15 mmHg ET RVP ≥3 UW. Ces définitions sont résumées dans le tableau 1.
Le seuil diagnostique a été récemment baissé de 25 à 20 mmHg. En effet, différentes études ont montré que la PAPm normale au repos est de 14.0±3.3 mmHg, donc une PAPm >20 mmHg est supérieure à +2SD (97,5ème percentile)(2). Les patients avec une atteinte vasculaire pulmonaire mais une PAPm comprise entre 21 et 24mmHg sont à risque de progression. Il a été montré que, chez des patients atteints d’une sclérodermie systémique, 42% des patients avec une PAPm entre 21 et 24mmHg ont développé par la suite une HTP avec PAPm >25 mmHg et le pronostic était
16
défavorable(3). Dans une autre étude, les groupes avec HTP « borderline », entre 21 et 24 mmHg, et avec HTP franche, >25mmHg, étaient plus à risque de décès par rapport à un groupe normal bas avec une PAPm ≤15 mmHg(4).
Le but de cette baisse du seuil n’est pas forcément de traiter plus de patients, mais de les surveiller plus attentivement, surtout en cas de maladie systémique, de suspicion d’HTP post embolique et de maladie pulmonaire chronique.
Tableau 1. Définition de l'hypertension pulmonaire. Adapté de(1). PAPm : pression artérielle pulmonaire moyenne ; Pcap : pression capillaire ; RVP : résistances vasculaires pulmonaires.
Nomenclature Paramètres hémodynamiques Groupes cliniques HTP pré-capillaire PAPm > 20 mmHg Pcap ≤15 mmHg RVP ≥3 UW 1,3,4,5
HTP post-capillaire isolée PAPm > 20 mmHg Pcap >15 mmHg RVP < 3UW
2,5
HTP mixte (pré et post-capillaire) PAPm > 20 mmHg Pcap >15 mmHg RVP ≥3 UW
2,5
1.2 Classification clinique de l’hypertension pulmonaire
L’HTP est classifiée en 5 groupes cliniques, comme indiqué dans le tableau 2(1). 1.3 Épidémiologie
La prévalence globale de l’HTP est peu connue. Pour le groupe 1, la prévalence est estimée à 15/million, dont 5,9 idiopathique(5–7). En Europe, la prévalence est de 15-60/million, tandis que l’incidence est de 5-10/million/an(5). 50% des cas sont desHTAP idiopathiques, héritables et induites par des médicaments et des toxiques. L’âge moyen au diagnostic est de 50-65 ans. En ce qui concerne le groupe 2, une HTP est retrouvée chez 60% des patients avec insuffisance cardiaque à fraction d’éjection réduite, 70% des patients avec insuffisance cardiaque à fraction d’éjection préservée, 100% des cas de valvulopathie mitrale sévère et 65% des patients avec un rétrécissement aortique(8,9). Une HTP du groupe 3 complique fréquemment les pneumopathies interstitielles et les
17
bronchopneumopathies chroniques obstructives (BPCO)(10,11). L’incidence de l’HTP thromboembolique chronique (groupe 4) est de 0,5 à 2% après un épisode d’embolie pulmonaire (12) et on retrouve des antécédents d’embolie pulmonaire chez 74,8% des patients de ce groupe(13). Tableau 2. Classification clinique de l'hypertension pulmonaire.
1. Hypertension artérielle pulmonaire (HTAP) 1.1 Idiopathique
1.2 Héritable
1.3 Induite par des médicaments, des toxiques 1.4 Associée à une : 1.4.1 Connectivite 1.4.2 Infection à VIH 1.4.3 Hypertension portale 1.4.4 Cardiopathie congénitale 1.4.5 Schistosomiase
1.5 Répondeurs à long terme aux inhibiteurs calciques
1.6 Avec atteinte veineuse (maladie veino-occlusive) ou capillaire (hémangiomatose capillaire) marquée
1.7 Persistante du nouveau-né
2. Hypertension pulmonaire causée par les cardiopathies gauches 2.1 Insuffisance cardiaque à fraction d’éjection réduite 2.2 Insuffisance cardiaque à fraction d’éjection préservée 2.3 Valvulopathies
2.4 Cardiopathies congénitales à répercussion post-capillaire
3. Hypertension pulmonaire causée par les maladies pulmonaires et/ou l’hypoxie 3.1 Maladie pulmonaire obstructive
3.2 Maladie pulmonaire restrictive
3.3 Autre maladie pulmonaire avec atteinte mixte obstructive et restrictive 3.4 Hypoxie sans maladie pulmonaire
3.5
Anomalies du développement pulmonaire4. Hypertension pulmonaire par obstruction artérielle pulmonaire 4.1 Hypertension pulmonaire thrombo-embolique chronique 4.2 Autres obstructions artérielles pulmonaires
5. Hypertension pulmonaire de mécanisme peu clair et/ou multifactoriel 5.1 Maladies hématologiques
5.2 Maladies systémiques et métaboliques 5.3 Autres
5.4 Cardiopathies congénitales complexes 1.4 Démarche diagnostique
En cas de suspicion d’HTP, après l’examen clinique, plusieurs examens sont recommandés par la Société Européenne de Cardiologie(14). L’échocardiographie doit définir la probabilité d’HTP en estimant la pression artérielle pulmonaire systolique (PAPs) par la vélocité maximale de l’insuffisance tricuspide(15,16). Les autres signes échographiques à rechercher sont, au niveau des ventricules, une dilatation ventriculaire droite avec un rapport ventricule droit/ventricule gauche >1 et un septum
18
paradoxal ; au niveau de l’artère pulmonaire, un raccourcissement du temps d’accélération pulmonaire ou une encoche systolique au niveau du flux pulmonaire, une dilatation de l’artère pulmonaire > 25 mm et une vélocité protodiastolique du flux d’insuffisance pulmonaire > 2,2 m/s ; au niveau auriculaire, une dilatation de la veine cave inférieure ou encore une dilatation de l’oreillette droite (OD) (Figure 1).
La suspicion clinique et échographique sera ensuite confirmée par cathétérisme droit, qui est indispensable pour les groupes 1 et 4. Des oxymétries étagées seront réalisées si la saturation en O2 dans l’artère pulmonaire est > 75% et en cas de doute sur un shunt gauche-droite. Le débit cardiaque est mesuré par thermodilution ou par la méthode de Fick (17). Un test de vasoréactivité est indiqué dans les cas d’HTP idiopathique, héritable ou induite par des médicaments ou des toxiques ; la réponse est considérée comme positive en cas de diminution de la PAPm ≥10mmHg ET une PAPm ≤40mmHg sans changement de débit cardiaque. Ensuite d’autres examens seront réalisés afin d’affiner le diagnostic étiologique :
- La tomodensitométrie (TDM) thoracique a montré son utilité au niveau diagnostique et pronostique(18). Un diamètre de l’artère pulmonaire ≥29mm et un rapport artère pulmonaire/aorte ascendante ≥1 peuvent suggérer une HTP. Un rapport artère segmentaire / bronche >1 dans 3 ou 4 lobes a une haute spécificité pour HTP(19,20). La TDM permet également de porter un diagnostic de maladie parenchymateuse pulmonaire et maladie veino-occlusive. Des images en verre dépoli sont présentes chez 1/3 des patients HTP(18).
- La scintigraphie de ventilation/perfusion a une meilleure sensibilité par rapport à l’angio-TDM thoracique pour le diagnostic de groupe 4(21).
- L’angioTDM thoracique est réalisée dans le cadre du bilan d’opérabilité dans les cas d’HTP groupe 4 (22), de même que l’angiographie pulmonaire(23).
Figure 1. Algorithme pour le dépistage de l’hypertension pulmonaire en échocardiographie.
19
- Le gold standard pour caractériser les volumes ventriculaires droits est l’imagerie par résonance magnétique (IRM) cardiaque (24–26).
- Une échographie abdominale recherche des signes d’hypertension portale.
- Un bilan génétique, notamment la recherche d’une mutation BMPR2, est proposé en cas d’HTP idiopathique ou familiale. Si cette mutation est négative, ou s’il existe des antécédents personnels ou familiaux de télangiectasie hémorragique, les mutations BMPR2 et ENG sont également recherchées.
1.5 Pronostic dans l’hypertension pulmonaire
Dans l’HTP, en l’absence de traitement, le pronostic est sombre. Le suivi du patient avec évaluation de la sévérité de la pathologie à chaque consultation est donc essentiel. Dans une étude le sexe masculin et l’âge au diagnostic ont montré une valeur pronostique négative(27), mais cela n’a pas été confirmé par d’autres études. L’étiologie a un impact sur le pronostic : l’HTP secondaire aux cardiopathies congénitales a un meilleur pronostic par rapport à l’HTP idiopathique(28). La mortalité liée à l’HTP a diminué pendant les 20 dernières années, grâce à une sensibilisation du corps médical, un diagnostic plus précoce, une stratification du risque et surtout grâce à l’apparition de plusieurs traitements spécifiques. Un registre japonais très récent(29) a mis en évidence une amélioration pronostique sensible, en particulier pour le groupe idiopathique et héritable, cible des traitements modernes. En revanche, le pronostic reste peu favorable dans l’HTAP liée à la sclérodermie(30), le groupe 3 et l’HTAP porto-pulmonaire(31). L’endartériectomie et l’angioplastie pulmonaire ont permis d’améliorer la survie des patients du groupe 4.
La mortalité est également corrélée à la sévérité de la pathologie estimée par la classe WHO(32–35) et également aux capacités à l’effort estimées par le TM6M : la survie est meilleure quand la distance parcourue est >440m(36). De nombreux marqueurs biologiques ont été évalués mais seuls le BNP et le NT-proBNP sont utilisés pour leur valeur pronostique au diagnostic et pendant le suivi(37).
L’étude échographique comprend la surface de l’oreillette droite (OD) et du VD, la quantification de l’insuffisance tricuspidienne (IT), l’index d’excentricité, les paramètres de contractilité VD (strain VD, Tei, TAPSE)(38–45). La valeur de la PAPs n’est pas pronostique(33,34,46). Les facteurs pronostiques à l’IRM cardiaque sont une augmentation du volume VD, une diminution du volume du ventricule gauche (VG), une diminution de la fraction d’éjection ventriculaire droite (FEVD) et une diminution du volume d’éjection ou stroke volume (SV)(24,26,47,48). Le cathétérisme droit précise la pression de l’OD (POD), le DC et l’index cardiaque (IC) et la saturation veineuse en O2. La valeur de PAPm est diagnostique mais non pronostique (27,33,34,46,49). Au-delà du diagnostic, l’indication du bilan hémodynamique reste discutée. En effet, un bilan hémodynamique régulier n’a
20
pas fait les preuves de son utilité, mais il est nécessaire quand une décision thérapeutique en découle. Nous détaillerons plus tard les particularités du bilan hémodynamique et échographique dans l’HTP. La stratification du risque se fait donc en s’appuyant sur plusieurs paramètres, le but étant que le patient soit à bas risque pendant le suivi (Tableau 3).
Tableau 3. Stratification du risque dans l'HTP(14).
1.6 Traitement de l’hypertension pulmonaire
Le traitement se déroule en trois phases(50). En premier lieu des mesures générales sont mises en route, parmi lesquelles le début d’un traitement symptomatique (diurétiques, oxygénothérapie) et le patient est adressé vers un centre de référence. Un traitement spécifique est débuté ensuite et, si la réponse est insuffisante, plusieurs traitements sont associés ou une greffe est envisagée. Nous détaillons par la suite les différentes classes de traitement spécifique.
1) Les inhibiteurs calciques à forte dose (nifédipine 120-140mg, diltiazem 240-720mg, amlodipine 20mg) sont réservés aux patients avec un test de vasoréactivité positif.
2) Les antagonistes du récepteur de l’endothéline bloquent l’action de cette dernière, dont l’activation anormale dans l’HTP est à l’origine d’une vasoconstriction et prolifération cellulaire(51,52). De cette classe font partie l’ambrisentan, le bosentan et le macitentan.
3) Les inhibiteurs de la phosphodiestérase de type 5 (sildénafil, tadalafil, vardenafil) et les stimulateurs de la guanylate cyclase (riociguat) agissent sur la même cascade pour inhiber la
21
dégradation du monoxyde d’azote, qui a un effet vasodilatateur et antiprolifératif. Le riociguat en particulier a montré son efficacité aussi bien dans le groupe 1 que dans le groupe 4.
4) Les analogues de la prostacycline (beraprost, époprosténol, iloprost, tréprostinil) et les agonistes du récepteur de la prostacycline (sélexipag) favorisent l’action de vasodilatation, inhibition plaquettaire et antiproliférative. Le pathway de la prostacycline est inhibé dans l’HTAP(53). Chez les patients avec une HTAP sévère, une trithérapie d’emblée a montré un bénéfice(54). Très récemment, dans l’étude AMBITION, la bithérapie d’emblée par tadalafil et ambrisentan a fait ses preuves pour les patients en classe NYHA II et III(55). Pour l’HTP post-embolique, l’endartériectomie est en effet le traitement de premier choix, qui permet la normalisation clinique et hémodynamique pour la majorité des patients(56–58). Pour les patients inopérables ou avec une HTP récidivante, il reste une place pour les traitements spécifiques(59–61), en particulier le riociguat qui a montré son efficacité sur le test de marche de 6 minutes et les RVP(62). Des résultats encourageants proviennent aussi de l’angioplastie pulmonaire(63–65), réalisée dans des centres expérimentés. Pour minimiser les risques d’œdème de reperfusion, l’angioplastie est réalisée sur 1 ou 2 segments à la fois et chaque patient bénéficie, en moyenne, de 4,8 séances. L’atrioseptostomie au ballon(66,67) reste un traitement de dernier recours en cas de défaillance droite ou syncope malgré un traitement médical optimal. L’échec de la thérapie maximale doit inciter à une inscription précoce sur la liste de transplantation. La survie en cas de greffe, qui est bi-pulmonaire dans la majorité des cas, est de 52-75% à 5 ans, 45-66% à 10 ans.
22
2. Évaluation hémodynamique et échographique dans l’hypertension pulmonaire
2.1 Évaluation hémodynamique dans l’hypertension pulmonaire
Le cathétérisme cardiaque droit représente l’examen de référence du diagnostic de l’HTP, de la détermination de ses paramètres hémodynamiques et donc du traitement qui en découle(68). Dans un centre expérimenté, le taux de complication reste faible, de l’ordre de 1,1%, principalement en rapport avec la voie d’abord et la survenue d’arythmie, dont 0,055% est fatale(69). Outre les complications liées à l’abord vasculaire, la survenue d’arythmie, d’hypotension et l’exposition à la fluoroscopie, le cathétérisme cardiaque a un coût en termes de temps et de ressources économiques. En effet, il nécessite une hospitalisation avec une équipe médicale et paramédicale formée, une évaluation invasive des paramètres hémodynamiques et le repos au lit en cas d’abord fémoral. De plus, comme cela a été montré précédemment, cet examen doit être réalisé au moment du diagnostic mais également de manière répétée au cours du suivi.
Différentes mesures sont réalisées à l’aide d’un cathéter micro-manomètre : • La Pcap en mmHg
• Le débit cardiaque en L/min (indexé en L/min/m2) • Les RVP en unités Wood (UW)
• Le gradient trans-pulmonaire (GTP) en mmHg • La POD en mmHg
• La PAPm en mmHg La pression capillaire :
La mesure de la Pcap permet de distinguer les formes pré-capillaires (≤15mmHg) des formes post-capillaires ou mixtes (> 15mmHg). Le cathéter est monté jusqu’au réseau artériel pulmonaire pour obtenir en télédiastole la pression pulmonaire d’occlusion, qui est un reflet de la Pcap. En cas de doute sur la mesure il est possible de mesurer la saturation, qui doit être ≥90% ou égale à la saturation pulsée systémique ±5%.
Mesure du débit cardiaque :
La mesure du débit cardiaque peut se faire par la méthode dite de thermodilution (recommandée par l’ESC) ou par la méthode de Fick. La technique de thermodilution consiste en l’injection de 10 millilitres de sérum salé froid via le cathéter dans l’OD ; la variation de température est ensuite mesurée dans l’AP. Le débit cardiaque, qui est indirectement proportionnel à la modification de température du sang,
23
est ensuite calculé(70). La méthode de Fick détermine le débit cardiaque via le rapport entre la consommation en oxygène et la différence artério-veineuse du contenu sanguin en oxygène. Cette méthode demande donc la mesure de la VO2, ce qui est moins souvent fait en pratique. Il est possible, mais beaucoup moins précis, d’utiliser la valeur de VO2 indiquée par des nomogrammes en fonction de la taille et du poids du patient (méthode de Fick indirecte). Le débit cardiaque est indexé à la surface corporelle (appelé index cardiaque). Les valeurs normales sont comprises entre 2,4 et 4 L/min/m2. Il est ensuite possible de calculer le SVi à partir de ces mesures.
La concordance entre la thermodilution et la méthode de Fick a été débattue, notamment en présence d’une insuffisance tricuspidienne importante. Depuis les années 80, différentes études ont montré une sous-estimation du débit cardiaque par thermodilution en présence d’une IT(71,72). En 1999 Hoeper et al ont montré au contraire une excellente concordance, même en présence d’un bas débit cardiaque et indépendamment de la sévérité de l’IT(17). Dans une étude plus récente, la méthode de Fick seule paraissait valable, mais la différence entre Fick et thermodilution ne dépendait pas de la présence d’une IT(73). Par ailleurs, le DC par thermodilution a une valeur prédictive supérieure à la méthode de Fick pour prédire la mortalité(74).
Mesure des pressions dans les cavités droites (PAPm et POD) :
Ces mesures de pression sont réalisées au sein des cavités concernées. L’obtention de la PAPm est nécessaire au diagnostic d’HTP. La POD est une mesure de la pression veineuse centrale, mais est influencée aussi par la compliance atriale, la fonctionnalité de la valve tricuspide, la compliance VD. L’élévation de la POD constitue un facteur de risque de mortalité dans des nombreuses cardiopathies(75). Le signe de Kussmaul(76), correspondant à l’augmentation inspiratoire de la POD secondaire à un défaut de compliance VD, est de mauvais pronostic pour patients en attente de greffe. Le gradient trans-pulmonaire :
Le GTP est calculé par soustraction de la Pcap de la PAPd. Il a été retiré de la définition hémodynamique des différents groupes d’HTP au cours du dernier congrès mondial(1) mais faisait partie des recommandations de l’ESC 2015(14) afin d’aider à la distinction entre la forme post capillaire isolée (GTP < 7 mmHg et RVP ≤ 3 mmHg) et la forme mixte (GTP ≥ 7 mmHg et RVP > 3 mmHg).
Les résistances vasculaires pulmonaires :
Les RVP représentent le 75% de la post-charge VD totale et dépendent du diamètre des artères distales et des artérioles. Les RVP sont facilement calculées par la loi de Poiseuille : RVP = (PAPm-Pcap)/DC.
24
Le cathétérisme droit est actuellement utilisé non seulement pour le diagnostic mais aussi pour l’évaluation de la réponse thérapeutique et donc pour l’adaptation du traitement(77). Nous détaillons par la suite les différentes études consacrées à l’analyse de la valeur prédictive des paramètres hémodynamiques.
Tableau 4. Valeur prédictive des paramètres hémodynamiques dans différentes études(77).
• Dans le registre NIH, des années 80(32), la POD (OR 1,99 CI 1,47-2,69), la PAPm (OR 1,16 CI 1,05-1,28), et l’IC (OR 1,67 CI 1.22-2,17) à l’état basal sont corrélés à la survie.
• Dans le registre français(78), POD et IC sont corrélés à la survie, mais pas la PAPm.
• Dans le registre américain REVEAL(27), dédié au groupe 1, une POD >20mmHg (HR 1,79 CI 1,0-3,1) et des RVP >32mmHg (HR 4,08 CI 2,0-8,3) étaient facteurs prédictifs de mortalité. • Dans la cohorte française qui a validé l’utilisation de l’époprosténol(33), à l’état basal, une POD
>12mmHg était associée à une surmortalité. Après 3 mois de traitement, la POD, la PAPm, une augmentation de l’IC <0,5L/min/m2, une diminution des RVP <30% étaient également de mauvais pronostic. Dans cette étude, une PAPm basse à l’état basal et après thérapie était plutôt de mauvais pronostic, témoignant d’une dysfonction ventriculaire droite sévère. • Dans l’étude américaine sur l’époprosténol(44), à l’état basal la POD était associée à survie.
Au suivi, les changements en IC et POD étaient prédictifs de survie.
• Une étude sur l’HTAP liée aux connectivites(79) a aussi confirmé, en analyse univariée, le pouvoir prédictif de POD, IC, PAPm, RVP.
• Une cohorte de patients avec une HTAP liée à la sclérodermie(80) a montré que RVP et SVi ont une valeur pronostique.
25
La saturation veineuse en oxygène (SvO2), très souvent utilisée en réanimation comme indice indirect de débit cardiaque, a également été étudiée dans l’HTP. Par exemple, une étude a montré une corrélation entre SVO2 et BNP chez des patients traités par époprosténol ; la SVO2 été aussi associée au pronostic(81). En effet, les recommandations de l’ESC préconisent la mesure de la POD, de l’IC par thermodilution et aussi de la SVO2 en raison de leur valeur pronostique(14).
Les paramètres cliniques, en particulier la classe NYHA et le TM6M, ne sont pas bien corrélés aux paramètres hémodynamiques. En effet, NYHA et TM6M sont un reflet de la capacité du VD à augmenter le débit en réponse à une augmentation de la demande en O2, alors que les mesures hémodynamiques sont faites en condition de repos.
2.2 Évaluation échocardiographique dans l’hypertension pulmonaire
Comme nous l’avons vu, l’échocardiographie permet d’évaluer les conséquences de l’HTP sur les cavités droites en termes de volume, fonction, mécanisme adaptatif et de mesurer de façon indirecte les pressions pulmonaires. L’échocardiographie reste donc un examen indispensable à but diagnostique, pronostique et dans l’évaluation de la réponse au traitement. En effet, les signes échographiques peuvent précéder la dégradation clinique(82). Plusieurs paramètres échographiques ont démontré leur valeur prédictive. Le TAPSE par exemple, ainsi que le delta TAPSE, sont fortement associés à la mortalité et à la réponse thérapeutique(83,84). Le TAPSE est également bien corrélé avec la FEVD mesurée à l’IRM. L’onde S peut prédire une amélioration de la FEVD(85). Plus récemment le strain ventriculaire droit a aussi fait ses preuves dans cette pathologie(45,86). Toutefois, la géométrie du VD est difficilement étudiable en échographie bidimensionnelle et le gold standard pour la mesure de la FEVD reste l’IRM. En revanche, les valeurs retrouvées en échographie tridimensionnelle sont comparables avec celles obtenues par IRM. Il faut rappeler que la FEVD, la fractional area change (FAC) et le TAPSE sont tous dépendants des conditions de charge et par conséquent ne sont pas de vraies mesures de contractilité intrinsèque(87).
Une IT moyenne ou sévère est associée à un mauvais pronostic dans de nombreuses cardiopathies, surtout gauches(88). Dans l’HTAP, elle est associée à une diminution des capacités à l’effort et à la dysfonction VD(89). L’IT est également responsable d’un remodelage ventriculaire, avec une augmentation de la sphéricité, une dilatation de l’anneau tricuspide, et un tethering de la valve tricuspide, ce qui entraine un cercle vicieux(90–92). La baisse des pressions pulmonaires suite au traitement permet un remodelage inverse, une diminution de l’IT et une amélioration clinique(90). Dans une étude récente, le pronostic à long terme était meilleur dans le groupe de patients sans IT
26
moyenne à sévère(93). L’IT peut aussi fausser des paramètres de fonction systolique tels que le TAPSE, la FEVD, la FAC en tant que voie de décharge pour un VD défaillant(94).
Une augmentation du ratio entre la durée de la systole et de la diastole (SD ratio) est de mauvais pronostic dans l’HTP associée à une cardiopathie congénitale(95). Dans une autre étude, le SD ratio ajusté est prédictif du risque de décès ou greffe tout le long du suivi(96). Une plus grande diminution du ratio a été observée chez les patients recevant une thérapie combinée, conséquence plus du raccourcissement de la systole que de l’allongement de la diastole. Tei a démontré que la systole prolongée est secondaire à une plus longue phase isovolumique, contrebalancée par un temps d’éjection plus court(97). Le ratio SD est une simplification de l’index de Tei.
L’élargissement de l’OD est fréquemment retrouvé chez les patients à plus haut risque. Il dérive d’une insuffisance tricuspide fonctionnelle ou d’une dysfonction diastolique du VD, les deux étant souvent présentes dans l’insuffisance VD(39).
La présence d’un épanchement péricardique a été souvent observée chez les patients les plus graves et constitue, avec l’augmentation de volume de l’OD, un facteur de risque de mortalité et de transplantation(39,98). Déjà en 1989 la présence d’un épanchement péricardique était la seule variable parmi plusieurs paramètres échographiques et hémodynamiques à être corrélée avec la mortalité(99). Dans une étude de 1999, Hinderliter et al ont retrouvé un épanchement péricardique chez 54% des patients et l’abondance de l’épanchement était associée aux paramètres hémodynamiques et échographiques de défaillance VD, ainsi qu’à un mauvais pronostic à un an(100). L’épanchement péricardique dans l’HTP résulte probablement d’un obstacle au retour veineux et lymphatique, suite à l’augmentation de la POD dans la phase la plus avancée de la maladie.
27
3. Le stroke volume ou volume d’éjection systolique
Le stroke volume représente le volume éjecté par un ventricule à chaque battement. Il est habituellement indexé à la surface corporelle. En cathétérisme cardiaque, il est calculé en divisant l’index cardiaque par la fréquence cardiaque. En échographie, il est calculé grâce à une équation de continuité. À l’intérieur d’un conduit, le débit (Q) est le produit de la vitesse moyenne spatiale (V) par la surface (S) : 𝑄 = 𝑉(𝑆. En appliquant cette équation, le débit cardiaque est calculé ainsi : 𝑄 = 𝜋𝑅!∫ 𝑉(𝑡)𝑑𝑡. Le rayon (R) de la surface est calculé à partir de la mesure de la chambre de chasse. La
connaissance par le Doppler pulsé de l’évolution de la Vmax et son intégration en fonction du temps (ITV) rend aisé le calcul du volume d’éjection systolique (VES) : 𝑉𝐸𝑆 = 𝜋𝑅!𝑥𝐼𝑇𝑉. Selon les dernières
recommandations des sociétés savantes en échocardiographie, le volume d’éjection normal moyen va de 66 à 73 ml chez les hommes et de 49 à 55 ml chez les femmes. Les mesures indexées à la surface corporelle sont de 33ml/m2 chez les hommes et de 29 ml/m2 chez les femmes(16). En IRM les valeurs sont globalement plus élevées, 54 ml/m2 chez les hommes et 48 ml/m2 chez les femmes(101).
Le volume d’éjection est un paramètre particulièrement intéressant dans l’HTP. En effet, devant une augmentation de sa post-charge, le VD est capable d’augmenter sa contractilité de 4 à 5 fois, maintenant un volume d’éjection approprié(102). Mais la réponse inotrope est ensuite inhibée et le volume d’éjection diminue(103). Le VD se dilate et le débit cardiaque est maintenu uniquement grâce à une augmentation de la fréquence cardiaque. La défaillance VD surviendra donc à un stade avancé de la maladie, quand en réalité la contractilité est déjà atteinte (Figure 2). L’étude du stroke volume est donc intéressante parce que sa diminution survient à un stade plus précoce de la maladie par rapport à la diminution du débit cardiaque.
28
En 2006 Holverda et al ont étudié la réponse à l’effort chez des patients avec HTP versus un groupe de témoins(104). Le SVi n’augmente pas à l’effort chez ces patients et le débit cardiaque est augmenté seulement en augmentant la fréquence cardiaque, alors que chez les sujets sains il existe une réponse inotrope en plus de celle chronotrope. Ces observations concordent avec une étude antérieure où le volume d’éjection mesuré par tomodensitométrie diminuait à l’effort chez les patients HTP(105). La valeur pronostique du SVi calculé par IRM ou par méthode de Fick a été étudiée par van Wolferen et al(24). Dans cette étude, concernant 64 patients avec HTP, un SVi bas (≤ 25 ml/m2) et une diminution du SVi après 1 an de traitement étaient prédictifs de mortalité. Les mêmes auteurs ont observé qu’un changement de 10 ml/m2 à 1 an de suivi était à considérer comme cliniquement significatif et bien concordant avec le changement dans le TM6M(106). Provencher et al ont montré que le stroke volume et la réponse chronotrope déterminent la distance parcourue au TM6M(107).
Un registre réalisé entre 2006 et 2016 a cherché à mettre en évidence des variables hémodynamiques pronostiques après début du traitement(108). Aucun paramètre hémodynamique n’était prédictif à l’état basal, alors que les critères cliniques (âge, sexe masculin, étiologie idiopathique, NYHA, TM6M) gardaient leur valeur prédictive. Ceci est probablement secondaire aux changements thérapeutiques récents (thérapie initiale plus agressive avec bi- ou trithérapie d’emblée). Après instauration du traitement, un SVi bas et une POD élevée avaient une valeur pronostique. En plus, un SVi bas était toujours prédictif de pronostic négatif même en présence d’autres paramètres positifs (NYHA I ou II, IC > 2,5L/min, TM6M >440m). Le seuil de SVi était de 38ml/m2, correspondant à la limite basse de la normale(101). Ce paramètre est un meilleur indicateur de la fonction ventriculaire droite que l’IC. En effet l’augmentation de la surcharge entraine une augmentation de la fréquence cardiaque ce qui augmente l’IC sans améliorer la performance contractile VD(109). Malgré cela, dans une revue de Galiè et al qui inclut 23 études contrôlées et randomisées(110), nous observons que l’IC a été choisi comme critère de jugement dans 12 études, dont 9 rapportent une amélioration de l’IC après traitement, et seulement une étude rapporte comme critère le stroke volume isolé(111). Il est intéressant de noter que dans 9 études sur 12, l’IC n’a pas changé après traitement : ce qui est en accord avec le fait que le traitement, quand il est administré avant la défaillance droite, va entrainer une baisse des résistances pulmonaires, une amélioration de la contractilité VD et donc finalement une réponse chronotrope négative. Le débit cardiaque reste le même mais la contribution de la réponse chronotrope est beaucoup moins importante quand le traitement est efficace.
Nous retrouvons le même résultat dans une étude sur les facteurs hémodynamiques prédictifs de survie dans l’HTAP liée à la sclérodermie(80). Le pronostic dans ce cas est particulièrement défavorable, possiblement à cause d’une dysfonction myocardique plus importante(112). Dans cette étude, IC, RVP et PAPm n’étaient pas prédictifs une fois ajustés sur la NYHA. En revanche, pour un SVi <30ml/m2, le risque de décès était multiplié par 2. Dans une autre étude qui compare HTAP
29
idiopathique et HTAP liée à la sclérodermie, pour POD et IC comparables, les patients avec sclérodermie avaient un SVi plus bas témoignant d’une atteinte plus importante à la contractilité VD(113).
30
OBJECTIFS
Le suivi des patients avec HTP nécessite actuellement une prise en charge diagnostique et pronostique invasive par cathétérisme droit. Le stroke volume indexé, calculé à partir des mesures hémodynamiques, a montré sa valeur prédictive. Il est possible de calculer ce paramètre également en échographie par équation de continuité.
Les objectifs de cette étude sont les suivants :
- Confirmer dans notre cohorte de patients le rôle pronostique des paramètres hémodynamiques que sont l’index cardiaque et le stroke volume indexé
- Associer les valeurs de paramètres échographiques simples aux paramètres de cathétérisme cardiaque droit : index cardiaque et stroke volume indexé
- Évaluer la valeur pronostique de paramètres échocardiographiques simples dans notre cohorte de patients avec hypertension pulmonaire
31
MATÉRIELS ET MÉTHODES
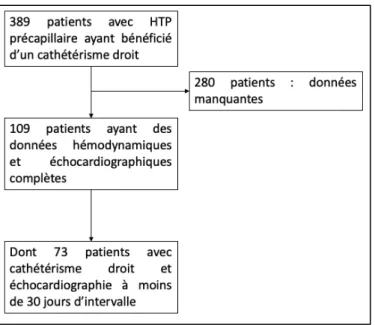
1. Population
Nous avons inclus pour cette étude les données anonymisées de patients suivis au sein du centre de compétence pour la prise en charge de l’hypertension pulmonaire du CHU de Nice. Tous les patients avaient une HTP précapillaire ou mixte. Les patients ayant bénéficié d’une échocardiographie spécialisée ainsi que d’un cathétérisme cardiaque droit ont été sélectionnés. A l’intérieur de ce groupe, nous avons ensuite sélectionné uniquement les patients avec une ETT et un cathétérisme droit réalisés à moins de 30 jours d’intervalle. Le suivi des patients a été réalisé via le registre informatisé des patients ou par contact téléphonique. Les patients avaient au moment de l’échographie cardiaque été prévenus de l’utilisation potentielle des données anonymisées de leur examen à des fins de recherche clinique (information orale et affiche « Cardiogen » et « Respifil » filières maladies rares en salle d’attente).
1.1 Critères d’inclusion des patients
• Tout patient suivi pour HTP avérée ou suspectée au sein du CHU de Nice Critères d’exclusion :
• HTP post-capillaire
• Données manquantes pour l’échographie et/ou le cathétérisme • Présence d’un shunt intra cardiaque
1.2 Données cliniques et biologiques
Les données suivantes, issues du dossier médical informatisé, ont été recueillies : âge, sexe, groupe d’HTP, traitement spécifique, date des examens, poids, taille, surface corporelle, taux de BNP, classe fonctionnelle NYHA, TM6M, âge au premier examen. La date de décès ou de greffe était également notée.
1.3 Échocardiographie
L’échocardiographie 2D a été réalisée sur un appareil Philips EPIQ 7 par deux opérateurs expérimentés dans l’acquisition des mesures du ventricule droit. Toutes les mesures ont été réalisées selon les recommandations de l’American Society of Echocardiography (ASE)(15) et de l’EACVI(16). Les paramètres mesurés en échocardiographie étaient :
32
• Fraction d’éjection ventriculaire gauche (FEVG) (%) • Intégrale temps vitesse (ITV) sous pulmonaire (cm)
• Diamètre de la chambre de chasse ventriculaire droite (CCVD) (mm) • Fréquence cardiaque (bpm)
• Diamètre télé-diastolique du ventricule gauche (DTDVG) (mm) • POD (mmHg)
• Pression artérielle pulmonaire systolique (PAPs) (mmHg) • Diamètre d’admission VD en 4 cavités (DTDVD) (mm) • TAPSE (mm)
• Onde S tricuspide (cm/s) • Surface OD (cm2)
• Présence d’un épanchement péricardique • Présence d’une IT moyenne à sévère 1.4 Cathétérisme cardiaque droit
Le cathétérisme cardiaque droit a été réalisé par les cardiologues interventionnels du CHU de Nice formés à la technique. Les données recueillies sont l’IC (en L/min/m2) et le SVi (en ml/m2) obtenu en divisant l’IC par la fréquence cardiaque. La méthode pour la mesure de l’IC était la thermodilution.
33
2. Analyse statistique
Les valeurs ont été représentées par la moyenne ± écart-typesi le paramètre suit la loi normal sinon par la médiane [IC95%]. La corrélation entre la méthode hémodynamique et celle échographique pour le calcul du SVi a été évaluée avec une méthode de régression linéaire, en particulier par le coefficient « r » de Pearson. Le coefficient de Pearson varie de manière continue de – 1 à 1 et présuppose que la relation qui existerait entre les deux variables soit de nature linéaire. Le signe traduit le sens de la relation linéaire et plus le coefficient se rapproche des extrêmes (- 1 et 1) plus la corrélation est forte. Enfin, il est accompagné d’un test statistique évaluant la probabilité que la valeur de r observée soit différente de 0. Une fois l’évaluation de la corrélation linéaire terminée, l’agrément entre les deux méthodes a été analysé en utilisant la méthode graphique de Bland-Altman, qui apprécie l’écart de valeurs obtenues à l’aide des deux techniques. Cette méthode consiste en la représentation de la différence des valeurs obtenues via les deux techniques par la moyenne des valeurs obtenues. Cette représentation fait également intervenir une limite de concordance supérieure et inférieure à 1,96 déviations standards de la moyenne. Nous avons également associé les paramètres en calculant une régression statistique de Passing Bablock entre paramètre échographique et paramètre hémodynamique, qui nous a permis d’obtenir une droite dont la formule est la suivante : y = ax + b.
L’analyse de survie a été réalisée grâce à une analyse de COX d’abord univariée puis multivariée qui a inclus comme paramètre la prise d’un traitement spécifique de l’HTAP, la classe NYHA, la distance parcourue lors du test de marche de 6 minutes et a testé tous les paramètres dont le p est < à 0,1 en analyse univariée. Le modèle de COX a intégré les variables non fixes dans le temps et chaque mesure répétée a été considérée comme nouvelle ligne d’analyse par le modèle. Les patients perdus de vue ont été censurés lors du suivi après leur dernière consultation mais ont été inclus dans l’analyse. Par la suite des courbes ROC ont été construites pour chaque paramètre pronostic en univarié afin de déterminer l’aire sous la courbe du paramètre et le seuil optimal. Les seuils obtenus par ces courbes ROC ont permis la création des courbes de Kaplan-Meier.