Implication du facteur de transcription
GATA-6 dans la régénération musculaire
Derek Tardif
Department of Experimental Medicine
McGill University, Montreal
August, 2007
A thesis submitted to McGill University in partial
fulfillment of the requirements of the degree of Master of
Science
1+1
Library and Archives Canada Bibliothèque et Archives Canada Published Heritage Bran ch Direction du Patrimoine de l'édition 395 Wellington Street Ottawa ON K1A ON4 Canada395, rue Wellington Ottawa ON K1A ON4 Canada
NOTICE:
The author has granted a non-exclusive license allowing Library and Archives Canada to reproduce, publish, archive, preserve, conserve, communicate to the public by
telecommunication or on the Internet, loan, distribute and sell theses
worldwide, for commercial or non-commercial purposes, in microform, paper, electronic and/or any other formats.
The author retains copyright ownership and moral rights in this thesis. Neither the thesis nor substantial extracts from it may be printed or otherwise reproduced without the author's permission.
ln compliance with the Canadian Privacy Act some supporting forms may have been removed from this thesis.
While these forms may be included in the document page count,
their removal does not represent any loss of content from the thesis.
•
••
Canada
AVIS:
Your file Votre référence ISBN: 978-0-494-51348-4 Our file Notre référence ISBN: 978-0-494-51348-4
L'auteur a accordé une licence non exclusive permettant
à
la Bibliothèque et Archives Canada de reproduire, publier, archiver,sauvegarder, conserver, transmettre au public par télécommunication ou par l'Internet, prêter, distribuer et vendre des thèses partout dans le monde,
à
des fins commerciales ou autres, sur support microforme, papier, électronique et/ou autres formats.L'auteur conserve la propriété du droit d'auteur et des droits moraux qui protège cette thèse. Ni la thèse ni des extraits substantiels de celle-ci ne doivent être imprimés ou autrement reproduits sans son autorisation.
Conformément à la loi canadienne sur la protection de la vie privée, quelques formulaires secondaires ont été enlevés de cette thèse. Bien que ces formulaires aient inclus dans la pagination, il n'y aura aucun contenu manquant.
Résumé
Une régénération musculaire efficace est primordiale chez les mammifères afin de pallier aux éventuels stress apportés par la vie quotidienne (blessures, exercice, pathologie). Cette régénération est dépendante des cellules souches musculaires, les cellules satellites. Suite à une lésion, ces cellules sortent de leur quiescence, prolifèrent et se différencient en muscle fonctionnel. Notre laboratoire a déterminé que le facteur de transcription GA TA-6 est exprimé dans ces cellules satellites. Les travaux présentés dans ce mémoire confirment cette expression dans ce type cellulaire. De plus, il semble que GATA-6 jouerait un rôle dans le maintien de la quiescence des cellules satellites. En effet, la souris haploinsuffisante en GATA-6 montre une expression augmentée de Myf5 ainsi qu'un nombre de cellules Pax7+ plus important. Également, la supression d'une copie du gène GATA-6 chez la souris mdx atténue son phénotype. D'autres expériences sur la souris dont le gène GATA-6 aura été complètement supprimé dans le muscle squelettique permettront de mettre en lumière le rôle de ce facteur dans la régénération musculaire.
Abstract
Efficient muscle regeneration is essential in mammals in order to overcome daily stress such as wounds, exercise and pathologie processes. This regeneration relies on muscle stem cells, the satellite cells. After a lesion, satellite cells are activated, proliferate and differentiate in fonctionnai muscle fibers. Our laboratory has previously shown that the transcription factor GATA-6 is expressed in the satellite cells. The present thesis confirms the expression of this factor in this cell type. Also, it seems that GAT A-6 could be implicated in the maintaining of quiescence of these cells. The GATA-6 heterozygous mouse muscle is characterized by an increase level of Myf5 and Pax7+ cells. Moreover, suppression of one copy of the GATA-6 gene in a muscular dystrophy model mouse, the mdx mice, alleviates its phenotype. Further experiments on a muscle-specifie GATA-6 null mouse will allow a better understanding of the role of GATA-6 in muscle regeneration.
Table des matières
RÉSUMÉ ... 2
ABSTRACT ... 3
TABLE DES MATIE RES ... 4
LISTE DES FIGURES ... 7
LISTE DES TABLE AUX ... 9
LISTE DES ABRÉVIATIONS ... 10
REMERCIEMENTS ... 15
1. INTRODUCTION ... 16
1.1 Anatomie et fonctionnement du muscle squelettique ... 16
1.2 Développement du muscle squelettique ... 17
1.2.1 Origine des cellules musculaires ... 17
1.2.2. Expression des gènes spécifiques au muscle squelettique ... 18
1.3 Régénération musculaire ... 26
1.3.1 Phase dégénérative du muscle ayant subit une lésion ... 26
1.3.2 Phase régénérative du muscle ayant subit une lésion ... 28
1.4. Cellules souches musculaires ... 32
1.4.1. Origine des cellules satellites ... 34
1.4.2. Multipotentialité des cellules satellites ... 35
1.5. Étapes de la régénération musculaire par les cellules satellites ... 36
1.5.1 Quiescence des cellules satellites ... 36
1.5.2 Activation des cellules satellites ... .43
1.5.3 Prolifération des cellules progénitrices ... .44
1.5.4 Différenciation des cellules progénitrices ... .45
1.5.5 Fusion des cellules progénitrices ... 47
1.5.6 Retour à la quiescence des cellules satellites ... 50
1.5. 7 Perte éventuelle de la possibilité des cellules satellites de se renouveler ... 52
1.6 Facteurs de croissance contrôlant la régénération musculaire ... 54
1.6.1 HGF ... 54
1.6.3 IGFs ... 57
1.6.3 TGF-p ... 58
1.6.4 LIF ... 59
1.7 Implication des facteurs Gata dans la régénération musculaire ... 60
1.7.1 Famille des GATA ... 60
1.7.2 GATA-1, -2 et -3 ... 63
1.7.3 GATA-4, -5 et -6 dans le développement cardiaque ... 64
1.7.4 GATA-6 dans le muscle lisse ... 69
1.8 Objectif du projet de recherche ... 72
2. MATERIEL ET METHODES ... 73
2.1 Souris utilisées ... 73
2.2 Lésions musculaires ... 73
2.3 Extraction d' ARN et RT -PCR quantitative ... 74
2.4 Anticorps utilisés et immunohistochimies ... 75
2.5 Analyses statistiques ... 76
3. RÉSULTATS: ... 77
3.1 Expression de GATA-6 dans le muscle squelettique ... 77
3.2 Expression de GAT A-6 dans les cellules satellites ... 80
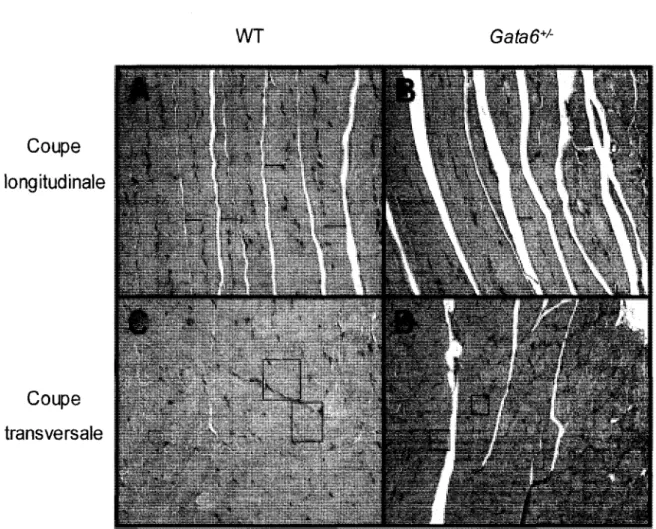
3.3 Phénotype musculaire des souris Gata-6+1-... 83
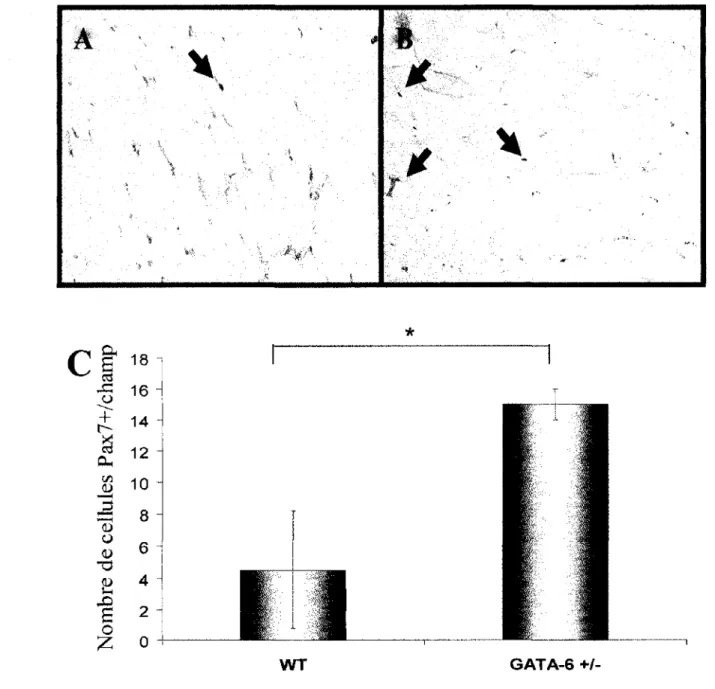
3.4 Les souris haploinsuffisante en GA TA-6 possèdent davantage de cellules satellites ... 85
3.5 La performance en régénération des souris GATA-6 +/-est comparable à celle des souris WT ... 89
3.6 Les souris résultant du croisement mdx :Gata6+/- montrent un patron d'expression des marqueurs musculaires suggérant une diminution de cellules en régénération ... 93
4. DISCUSSION ... 95
4.1 Expression de GATA-6 dans le muscle squelettique ... 95
4.3 Identification des mécanismes moléculaires régulés par GATA-6 ... 99
4.3.1 Interaction GATA-6/p2lcipt ... 99
4.3.2 Activité de GATA-6 sur le locus de Myf5 ... 100
4.4 Identification des mécanismes régulant l'expression de GATA-6 ... 101
4.5 Amélioration du phénotype des souris mdx par le croisement avec les souris Gata6+/-... 1 04 4.6 Conclusion ... 105
RÉFÉRENCE5 ... 107
Liste des Figures
CHAPITRE 1 : INTRODUCTION
Figure 1.1 Production du muscle squelettique à partir des somites chez 1' embryon de souris à e9.75 ... ... 21 Figure 1.2 Différence de morphologie entre des fibres musculaires saines et lésées ... 29 Figure 1.3 Différence de morphologie entre des fibres musculaires saines et nouvellement régénérées ... . 31 Figure 1.4 Progression de la cellule satellite jusqu'à la fibre musculaire régénérée et les facteurs impliqués à chacune des étapes ... 38 Figure 1.5 GATA-4, 5 et 6 possèdent un haut pourcentage d'homologie ... .. 62
CHAPITRE 3: RÉSULTATS
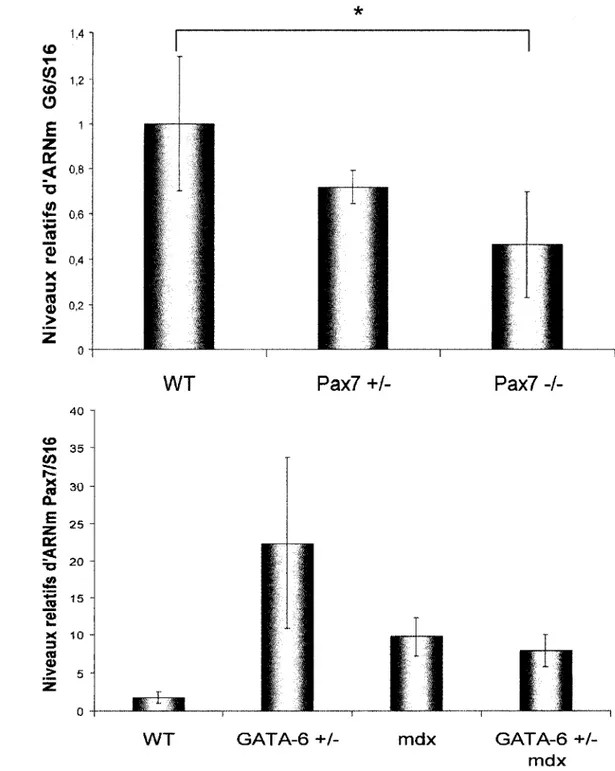
Figure 3.1 GA TA -6 est exprimé dans le cœur, le muscle squelettique, la langue et le diaphragme ... 79 Figure 3.2 L'expression de GAT A -6 est reliée à celle de Pax7 ... . 82 Figure 3.3 Le développement musculaire est affecté chez la souris haploinsuffisante en GATA-6 ... 84 Figure 3.4 Les souris haploinsuffisante en GATA-6 possèdent davantage de cellules satellites ... . 87
Figure 3.5 Une perte partielle des niveaux de GATA-6 modifie le phénotype des souris mdx ... 88 Figure 3.6 Les souris GATA-6 +/-démontre une capacité de régénération semblable aux souris WT ... ... 91
Figure 3.7 Les différences existantes dans les niveaux de mRNA des gènes Myf5, MyoD et Mrf4 entre les souris GATA-6 +/-et WT s'atténuent lors de la régénération ... 92 Figure 3.8 Le croisement des souris mdx avec les souris haploinsuffisante en GATA-6 modifie leur phénotype ... 94
Liste des tableaux
Tableau 1.1 Phénotype des souris dont les gènes Myf5, MyoD, myogenin et Mrf4 ont été inactivés ... 20
Liste des abréviations
ADN ADNe ANF Ants ARN ARNm ATP Bel-XL BDM bHLH BMP BNP BrdU BSA BVL CAT CAVC CCND CD34 CDK Acide désoxyribonucléiqueAcide désoxyribonucléique complémentaire
« Atrial natriuretic factor »
« Antisocial »
Acide ribonucléique
Acide ribonucléique messager Adénosine triphosphate
« B-cellleukemia XL »
Bord dorsomédial
Domaine région basique hélice-boucle-hélice
« Bone morphogenie protein »
« Brain natriuretic factor »
« Bromodeoxyuridine »
«Bovine serum albumin »
Bord ventrolatéral
« chloramphenicole acetyltransferase »
« Complete atrioventricular canal »
Cyclin
« Cluster of differentiation 34 »
C/EBPP CIP/KIP CK e-met CPM CRE CREB CTX DEPC DMD dNTP DORV Drac Duf FACS FGF FGFR Flk FoxO FSH
«
CCAAT/enhancer binding protein-beta »« cyclin-dependant kinase interacting protein/kinase interaction
protein » Creatine kinase
Mesenchymal epithelial transition factor Cellules progénitrices musculaires
« Cyclization recombination »
« cAMP response element-binding »
Cardiotoxine
Di eth ylpyrocarbonate
Dystrophie musculaire de Duchenne Desoxynucleotides triphosphates
«
Double outlet right ventricle »« Drosophila RAC protein »
« Dumbfounded »
« Fluorescence activated cell sorting »
« Fibroblast growth factor»
« Fibroblast growth factor receptor »
« Fetalliver kinase »
«
Forkhead box sub-group 0 »GMC HeLa HGF HSPG IAP IFABP IGF Lb x Ldb Lif LM04 loxP Mbc MCK mdx MEF MEK/ERK Mer
« Glomerular mesangial cells »
« Henrietta Lacks »
« Hepatocyte growth factor »
« Heparan sulfate proteoglycans »
« intestinal alkaline phosphatase »
« intestinal fatty acid binding protein »
« Insulin growth factor »
« Ladybird homeobox homolog »
« LIM domain binding »
« Leukemia inhibitory factor »
« LIM domain only protein 4 »
«Locus ofX-over Pl »
« Myoblast city »
« Muscle creatine kinase »
« X-linked muscular dystrophy »
« MADS box transcription enhancer factor »
« Mitogen-activated protein kinase/extracellular signal-regulated
kinase kinase-Extracellular signal-Regulated Kinase »
MHC MNF/Foxkl MRF MSTN Ms x Myf MyoD Ne NFAT NKX2.5 NKX3.2 nLacZ NO NTX Pax PBS PCR QPCR Rb RT-PCR
« Myosin heavy chain »
« winged-helix/forkhead protein myocyte nuclear factor » « myogenic related factor »
Myostatine
« MSH homeobox » « Myogenic factor»
« Myogenic differentiation »
Notochorde
« Nuclear factor of activated T-cell » « NK2 transcription factor related » « NK3 transcription factor related » ~-D-Galactosidase
« Nitric oxide » Notexine
« Paired Box transcription factor » « Phosphate buffered-saline » « Polymerase chain reaction »
« Quantitative polymerase chain reaction»
« Retinoblastoma »
Sca-1 Sel SF/HGF siRNA sk-a-actin SM22a Smad Sns SRF stAR STK11 TGF-P TN TNFa VSMC Wnt WT YFP
« Stem cell antigen 1 »
« Stem cell leukemia protein »
« Scatter factor/hepatocyte growth factor »
« small interfering RNA»
« skeletal alpha actin »
« Transgelin »
« Mothers against decapentaplegic homolog »
« Sticks and Stones »
« Serum response factor »
« steroidogenic acute regulatory protein »
« Serine/threonine kinase 11 »
« Transforming growth factor beta »
Tube neural
« Tumor necrosis factor alpha »
« V ascular smooth muscle cells »
« wingless-type MMTV integration site family »
« Wild type »
Remerciements
Je tiens tout d'abord à expnmer ma gratitude envers ma superv1seure, Mona Nemer, pour m'avoir donné la chance d'effectuer ma maîtrise dans son laboratoire. Ses précieux conseils m'ont été utiles autant au laboratoire que dans la vie quotidienne. Un grand merci également à Georges Nemer pour la correction de mon mémoire.
Merci à Anne Aries pour m'avoir initié à la biologie moléculaire à mon arrivée au laboratoire et à Romain Georges pour ses multiples heures passées avec moi pour s'assurer que mon projet avançait dans la bonne direction.
Un grand merci aux autres membres des laboratoires Nemer et Drouin pour les heures passées en leur compagnie. La vie au laboratoire est agréable grâce à vous tous. Je quitte une équipe de travail sensationnelle.
Un merci spécial à ma mère Johanne et son mari Sébastien de m'avoir accueilli
dans leur maison à quelques reprises pendant ces trois années.
Finalement, un très, très, très grand merci à ma copine Geneviève pour ces années
passées à me soutenir moralement dans 1' achèvement de ma maîtrise et dans ma
réorientation de carrière. Plus que 3 ans Ge!
Je tiens à remercier le Fond de Recherche en Santé du Québec pour m'avoir octroyé une bourse de maîtrise.
1. Introduction
Chaque année, de nombreuses personnes sont affectées par des maladies congénitales touchant le muscle squelettique telle la dystrophie musculaire de Duchenne (DMD). Le muscle squelettique est un tissu contractile hautement spécialisé composé de syncitiums contenant chacun plusieurs centaines de noyaux post-mitotiques. Les fonctions primaires accomplies par le muscle squelettique incluent l'activité locomotrice, le contrôle postural et la respiration. Chez l'adulte, le maintien de l'intégrité cellulaire est assuré par une contribution régulière, mais extrêmement lente de cellules souches associées aux myofibres (Spalding et al., 2005). Ainsi, lors d'une blessure causée par un traumatisme, une cascade de réponses cellulaires finement orchestrée est mise à contribution afin de reformer rapidement un muscle fonctionnel. À défaut de remplacer les muscles lésés, une perte de la masse musculaire peut entraîner des difficultés de locomotion, de respiration et dans les pires cas, la mort. La connaissance des phénomènes impliqués dans le développement et la régénération musculaire est primordiale pour l'élaboration de traitements visant à améliorer la qualité de vie des patients affectés par ce type de désordre physiologique.
1.1 Anatomie et fonctionnement du muscle squelettique
L'unité basale des muscles squelettiques est la fibre musculaire. Cette fibre est le résultat de la fusion de plusieurs cellules, les myoblastes. À mesure qu'ils maturent, ces myoblastes se mettent à exprimer certaines protéines contractiles comme 1' actine et la myosine, certains enzymes métaboliques et entrent par la suite en contact avec un neurone
moteur. Même si le mécanisme précis n'a pas encore été identifié, il est connu que l'origine des myoblastes et du neurone spécifieront les propriétés contractiles du muscle résultant (Wigmore and Evans, 2002). Ainsi, certaines cellules formeront des fibres musculaires à contraction lente, mais pouvant fournir une contraction maintenue. D'autres auront une contraction plus vive, mais ne pourront pas soutenir celle-ci sur une longue période de temps. Le rapport fibres lentes sur fibres rapides varie en fonction des muscles et déterminera les propriétés contractiles de ce dernier. La contraction musculaire se produit lorsqu'en réponse à un influx nerveux, les chaînes de myosine tirent sur les molécules d'actine et réduisent la longueur de la cellule. La somme des contractions cellulaires résulte en une contraction du muscle. Une vascularisation abondante à proximité assure un apport en nutriments essentiels à un fonctionnement sans faille du muscle. Ainsi, en plus d'un arrangement particulier des myoblastes, l'activité coordonnée d'un muscle est tributaire d'une formation adéquate des nerfs, vaisseaux sanguins et de la matrice extracellulaire autant pendant l'embryogenèse que lors des rondes subséquentes de régénération musculaire chez l'adulte.
1.2 Développement du muscle squelettique
1.2.1 Origine des cellules musculaires
Chez les vertébrés, les cellules musculaires squelettiques du corps sont dérivées du mésoderme paraxial, qui se segmente en somites de parts et d'autres de la notochorde et du tube neural (Christ and Ordahl, 1995). Les somites sont composés de deux parties : le sclérotome, situé ventralement, contribuera à former les cellules nécessaires à
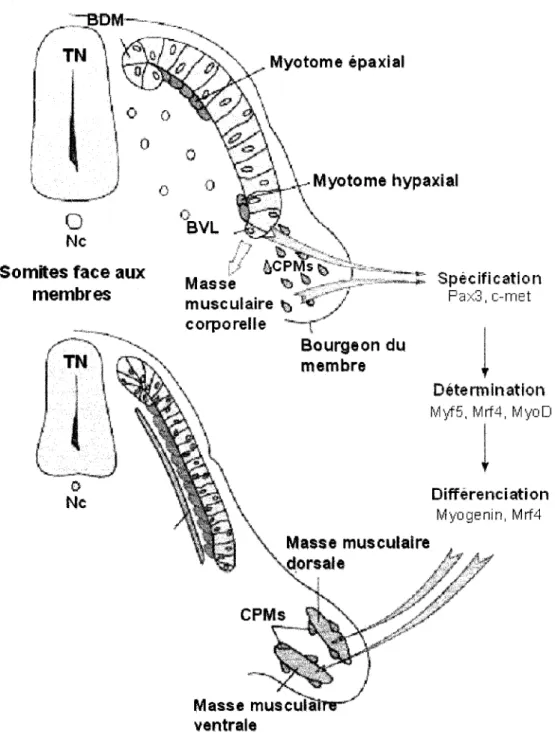
1' établissement du cartilage et des os de la colonne vertébrale (Bagnall et al., 1989; Borycki et al., 1997) ainsi qu'aux lignées cellulaires formant le derme (Brill et al., 1995) et les vaisseaux sanguins (Ambler et al., 2001; Wilting et al., 1995). La partie dorsale, le dermomyotome, donnera naissance au derme du dos ainsi qu'aux muscles squelettiques des membres et du corps. La formation des muscles débute par la délamination progressive des cellules du bord dorso-médial du dermomyotome. Ces cellules migrent sous le dermomyotome et forme le myotome épaxial. Cette structure est à 1' origine des muscles profonds du dos (Cinnamon et al., 2001; Cinnamon et al., 1999; Denetclaw, Jr. et al., 2001; Denetclaw and Ordahl, 2000; Kahane et al., 1998). Pour ce qui est des muscles hypaxiaux et des membres, ils originent de la partie dorsa-latérale du dermomyotome. Suite à leur délamination, ces cellules rejoignent la face ventrale du dermomyotome et forme le myotome hypaxial. Face aux bourgeons des membres, certains myoblastes se détachent, migrent et forment des myotomes secondaires qui contribueront à
1' établissement de la masse musculaire des membres (Figure 1.1 ).
1.2.2. Expression des gènes spécifiques au muscle squelettique
La spécification des cellules vers le destin myoblastique est déjà enclenchée depuis le stade des somites. Chez la souris, les cellules progénitrices du myotome épaxial expriment en premier lieu l'ARNm du facteur de transcription spécifique au muscle Myf5 (Ott et al., 1991). L'expression du messager de MyoD, un autre facteur de transcription musculaire, débute 2,5 jours plus tard dans le myotome différencié (Gerhart et al., 2000; Chen et al., 2001; Sassoon et al., 1989). L'inactivation d'un de ces gènes ne produit par contre que des souris à développement musculaire sensiblement normal (Tableau 1.1 ). Il
était par contre autrefois accepté que la combinaison de ces deux facteurs soit entièrement responsable de la formation du muscle squelettique. En effet, la souris dont les gènes
Myf5 et MyoD (Myf5nLacz;nLacZ/MyoD_1_) avaient été inactivés était caractérisée par une
absence totale de muscle squelettique. Une étude approfondie des cellules progénitrices musculaires montrait qu'elles conservaient leur caractère multipotent et qu'une partie de celles-ci formaient des tissus non-musculaires dans le tronc et les membres (Kablar et al., 1998; Rudnicki et al., 1993). Il a récemment été découvert que l'inactivation génique
Myj5nLacz;nLacz;MyoD_1_ est en fait une triple inactivation. En effet, l'activité du gène Mrf4
semble aussi avoir été supprimée. Le gène nLacZ, qui remplace le domaine basique hélice-loupe-hélice (bHLH) de Myf5 pour l'empêcher de lier l'ADN, semble interférer avec l'expression de Mrf4 par un mécanisme épistatique. Une nouvelle souris dont les
' M ·~'5 M D ' ' . ' (M •~'51oxP;IoxP/M n-I-) . d 1 . d
genes Y.!· et yo ont ete suppnmes y1 • yo , mais ont es mveaux e Mrf4 demeurent inchangés a permis d'observer que Mrf4 peut substituer temporairement à Myf5 et à MyoD dans la myogénèse. La différenciation des myoblastes se produit chez cette souris jusqu'à E12.5 dans les myotomes épaxiaux et hypaxiaux. Ces cellules expriment les marqueurs de différenciation terminaux desmine, myogénine et troponine T. Par contre, la musculature n'est pas présente à cet âge dans les membres, ce qui concorde avec les observations antérieurement effectuées chez la souris MyoD_1_ dont
l'apparition de la musculature est décalée jusqu'à E13.5. Ainsi, contrairement à la souris
Myf5nLacZ;nLacZ;Myon-1
- qui ne développe aucune cellule musculaire, quelques fibres apparaissent vers l'âge de E14.5 chez la souris Myf51oxP;~oxP!MyoD_1_ dans les membres. Or, il semble que Mrf4 ne peut supporter à lui seul la myogénèse dans les membres puisque la souris Myf51oxP;IoxP!MyoD_1_ naît totalement dépourvue de muscle squelettique
Tableau 1.1. Phénotype des souris dont les gènes Myf5, MyoD, myogenin et Mrf4 ont été inactivés.
Gène supprimé Phénotype Références
Absence de la portion distale des côtes résultant en une insuffisance respiratoire et la mort des nouveau-nés
Myf5 (Braun et al., 1992)
Aucun phénotype musculaire apparent Niveaux de Mrf4, myogenin et MyoD inchangés
Aucun phénotype musculaire apparent
MyoD Niveaux de Mrf4 et myogenin inchangés (Rudnicki et al., 1992) Niveaux d' ARNm de Myf5 augmentés
Hypoplasie musculaire sévère
Niveaux de MyoD inchangés (Hasty et al., 1993;
Myogenin
Absence des facteurs de différenciation Nabeshima et al., 1993) terminaux MHC et actin
Phénotype semblable à celui de la souris
Mrf4 Myf5_1_ (Braun and Arnold, 1995) Niveaux de Myf5 diminués
Somites face aux membres
Bourgeon du
membre
Masse musculaire
d.orsate
Masse mus
cula..,...-/
ventrale
1
Dé te rminatlon rv1yf5, rv1rf4, rv1yoDl
Différenciation Myogenin, Mrf4Figure 1.1. Production du muscle squelettique à partir des somites chez l'embryon de souris à e9.75. TN, tube neural; Ne, notochorde; BDM, bord dorsomédial; BVL, bord ventrolatéral; CPM, cellules progénitrices musculaires. Adapté de (Tajbakhsh, 2003).
à ce mveau tout comme la souns Myf5nLacz;nLacz;MyoD-1-. Les auteurs des études précédentes avaient observé que la souris Myf5nLacZ;nLacZ!MyoD_1_ décédait rapidement
après la naissance même lorsqu'un allèle fonctionnel de Myf5 ou de MyoD était présent.
La nouvelle souris Myf51oxP;JoxP/MyoD_1_ peut quant à elle survivre avec un seul allèle de
Myf5 ou MyoD. Ces résultats montrent donc qu'autant la nature que la quantité totale des
MRFs (MyoD, Myf5 et Mrf4) sont importants pour la myogénèse ainsi que pour la survie de la souris (Kassar-Duchossoy et al., 2004).
Le rôle de Mrf4 dans le développement du muscle chez 1' embryon consiste donc à spécifier le destin myoblastique des cellules tout comme Myf5. Les auteurs de l'étude précédente ont proposé un modèle dans lequel Myf5 et Mrf4 seraient les premiers facteurs de transcription spécifiques aux cellules musculaires à être exprimés (Kassar-Duchossoy et al., 2004). Ils agiraient donc au niveau de la prolifération des cellules progénitrices afin de produire assez de cellules pour la formation des muscles squelettiques. Il semble également qu'une absence de Myf5 peut être complémentée par Mrf4, et inversement, lors de la formation des muscles. Ceci est supporté par la souris inactivé pour le gène Myf5. Cette souris montre un retard de développement dans le
myotome épaxial, mais à la naissance la masse musculaire est normale (Kaul et al., 2000). La souris inactivée pour le gène Mrf4 montre, elle aussi, des retards de formation des masses musculaires et meurt à la naissance confirmant ainsi la possibilité pour une souris déficiente en Mrf4 ou Myf5 de former certains muscles tout en affichant des retards de développement musculaire (Patapoutian et al., 1995). Régulé par Myf5 et Mrf4, MyoD serait par la suite exprimé pendant les derniers stades de prolifération avant la sortie du cycle cellulaire des myoblastes. La régulation à la hausse de MyoD permettrait la
différenciation terminale des cellules musculaires avec 1' aide de Mrf4 qui demeure exprimé jusqu'à la fusion des myoblastes. MyoD aurait aussi pour fonction d'activer, en partenariat avec Myf5 et Mrf4, le gène de la myogenin, spécifique à la différenciation musculaire (Kassar-Duchossoy et al., 2004). Ainsi, la présence des Mrfs (Myf5, MyoD, Mrf4 et myogenin) en quantité suffisante est essentielle à la formation des fibres musculaires squelettiques.
Lors de la différenciation des myoblastes, ceux-ci expriment le gène myogénine. Celui-ci apparaît essentiel à la formation des masses musculaires puisque la souris myogenin_1_ meurt rapidement après la naissance du à une absence des muscles
squelettique nécessaires à la survie comme le diaphragme. Par contre, une population de myoblastes non-différenciés est présente en quantité suffisante. En effet, ces cellules n'expriment pas les marqueurs moléculaires du muscle squelettique fonctionnel telles les chaînes lourdes de myosine (myosin heavy chain, MHC) et la créatine kinase musculaire (muscle creatine kinase, MCK) (Hasty et al., 1993; Nabeshima et al., 1993). Dans un muscle normal, la myogenin permet la fusion des myoblastes afin de former d'immenses cellules multinucléées, les syncitiums musculaires, qui maturent par la suite pour devenir contractiles.
Contrairement aux myotomes épaxiaux et hypaxiaux, les cellules responsables de la formation des masses musculaires des membres doivent d'abord se détacher du dermomyotome et migrer vers les membres. Ensuite, les procédés de prolifération et de différenciation se mettent en branle pour former les muscles des pattes avants et arrières. La migration de ces cellules est régulée par l'expression de certains gènes dont Pax3 et
Msx1 (Bober et al., 1994; Epstein et al., 1995; Goulding et al., 1994; Houzelstein et al., 1999). L'expression Pax3 dépendante du gène e-met, codant pour le récepteur au facteur de croissance SF/HGF, permet la migration des cellules progénitrices vers le lieu de différenciation en fonction du signal reçu par ce récepteur (Dietrich et al., 1999). Le gène Lbx1, une autre cible de Pax3 permet également la production d'un facteur de transcription nécessaire à la migration cellulaire vers les bourgeons des membres (Brohmann et al., 2000; Gross et al., 2000; Mennerich et al., 1998). Le contrôle de l'expression de Pax3 est quant à elle régulée par les structures adjacentes par l'intermédiaire des Wnts. Il a récemment été démontré que la protéine kinase A et le facteur de transcription CREB assurait le lien entre le récepteur des Wnts et la transcription de Pax3 dans les cellules progénitrices musculaires (Chen et al., 2005). Il est possible que 1' expression de Pax3 et Ms x 1 freine 1' expression des gènes Myf5 et MyoD puisque la disparition de Pax3 et Ms x 1 lors de 1' atteinte du site de différenciation des progéniteurs coïncide avec la régulation à la hausse de Myf5 et MyoD (Epstein et al., 1995; Odelberg et al., 2000). La souris déficiente en Pax3 (Splotch mouse) montre un développement normal du muscle squelettique au niveau du tronc, mais aucune masse musculaire n'est retrouvée au niveau des membres (Bober et al., 1994). Étant donné le nombre restreint de cellules progénitrices migrant vers les membres, il est généralement accepté que celles-ci ne se contentent pas de se différencier en muscle, mais agissent à titre de cellules souches pour augmenter le pool de myoblastes qui formeront par la suite les masses musculaires (Amthor et al., 1999; Kardon, 1998; Robson et al., 1994). Il a été découvert dans les membres de l'embryon de poulet que Myf5 est exprimé chez ces cellules souches en prolifération alors que MyoD apparaît plus tard lors de la différenciation de celles-ci (Delfini et al., 2000). Ce phénomène suggère fortement que
dans les membres comme dans les myotomes, Myf5 et Mrf4 agissent à titre de régulateur lors de la prolifération et sont relayés par MyoD lorsque les myoblastes sortent du cycle cellulaire pour se différencier.
Lors de la formation des muscles squelettiques, certaines cellules présentes au niveau du centre du dermomyotome migrent vers les myotomes épaxiaux et hypaxiaux ainsi que vers les membres sans toutefois exprimer Myf5, Mrf4 ou MyoD. Ces cellules en prolifération demeurent par contre à proximité des muscles en formation et lorsque cette myogénèse est terminée, s'associent à la membrane des fibres musculaires et entrent en quiescence. Elles sont caractérisées par l'expression de Pax3 et Pax7, deux membres de la famille des facteurs de transcription à boîtes pairées Pax (paired-box) (Relaix et al., 2005). Ces cellules possèdent la capacité de former du muscle squelettique en réponse à
un signal donné. En effet, différents facteurs de croissance peuvent induire 1' expression de Myf5 et MyoD et permettre ainsi l'entrée dans le cycle cellulaire des cellules afin de former des progéniteurs myoblastiques. Ainsi, chez la souris inactivée pour les gènes Mrf4 et Myf5, une certaine quantité de muscle squelettique est formée à partir de ces cellules quoi que moins importante que chez leurs confrères de type sauvage (Kassar-Duchossoy et al., 2005). Certaines de ces cellules continueront à exprimer Pax7 et demeureront à 1' état quiescent bien après la naissance. Celles-ci seront utilisées chez la souris adulte pour remplacer les fibres lésées par une blessure, de 1' exercice ou encore lors de pathologies musculaires. D'ailleurs, les souris déficientes en Pax7 présentent de très sérieux problèmes de régénération musculaire en raison de l'incapacité de ces cellules progénitrices à se maintenir et ainsi permettre la formation de muscle squelettique (Seale et al., 2000; Relaix et al., 2006). Bref, lors de 1' embryogénèse, la majorité des myoblastes
fusionnent pour former les masses musculaires et une infime partie d'entre-elles demeurent à 1' état quiescent pour les rondes subséquentes de régénération.
1.3 Régénération musculaire
Le muscle squelettique adulte des mammifères est caractérisé par un faible taux de renouvellement cellulaire (Decary et al., 1997; Schmalbruch and Lewis, 2000). L'étirement et 1 'usure par frottement quotidien des muscles ne demandent qu'une régénération faible. Seulement 1-2% des fibres musculaires sont remplacées chaque semaine chez une souris saine (Schmalbruch and Lewis, 2000). Par contre, ce système demeure en mesure de répondre rapidement à une blessure importante tel un traumatisme direct causé par une activité physique intensive ou encore lors d'une maladie héréditaire impliquant une dégénérescence musculaire. Cette régénération du muscle squelettique peut être décrite en deux phases :une phase dégénérative suivie d'une phase régénérative.
1.3.1 Phase dégénérative du muscle ayant subit une lésion
Suite à une lésion, le muscle squelettique entre en nécrose. Celle-ci est déclenchée par la cassure du sarcolemme de la fibre musculaire, ce qui résulte en une augmentation de la perméabilité de cette membrane. Aussi, les protéines intracellaires telle la créatine kinase (CK) se retrouvent dans le plasma sanguin, signal déclenchant diverses réactions dans plusieurs organes visant à réparer la fibre lésée. Par exemple, on peut voir que chez l'homme ou chez certains modèles animaux, un stress mécanique ou encore une maladie dégénérative musculaire entraîne une concentration de la CK dans le sang (Coulton et al.,
1988; Nicholson et al., 1979; Percy et al., 1979). La dégénération du tissu musculaire serait enclenchée par la hausse soudaine des inf1ux de calcium suite à la destruction du réticulum sarcoplasmique ce qui augmente l'activité des protéases calcium dépendantes effectuant la dégradation du tissu musculaire (Alderton and Steinhardt, 2000; Armstrong, 1990; Belcastro et al., 1998). À cet effet, la famille des calpaines, protéases Ca2
+-dépendantes, pouvant dégrader les protéines myofibrillaires et cytosquelettiques du muscle sont depuis quelques années reconnues pour être responsable du clivage protéique lors d'une dégénération du muscle suivant une lésion (Kwak et al., 1993). La destruction des fibres peut se fàire localement ou encore être répartie sur l'ensemble de la fibre en fonction de la gravité de la blessure.
Les premières phases de dégénération musculaire sont également caractérisées par l'invasion massive de cellules mononucléées, principalement des cellules inflammatoires et myogéniques. En effet, les facteurs relâchés par le muscle atteint contribuent à activer les cellules inf1ammatoires résidentes dans le muscle qui à leur tour relâchent des signaux chimiotactiques afin d'attirer les cellules du système sanguin vers l'endroit lésé (Tidball, 1995; Rappolee and Werb, 1992). Plus précisement, les neutrophiles sont les premières cellules inflammatoires à envahir le muscle lésé. Une augmentation drastique de leur nombre est observée entre lh et 6h chez des souris ayant subi un exercice sévère ou une blessure à la myotoxine (Fielding et al., 1993; Orimo et al., 1991). Ensuite, les macrophages prennent le relais pour devenir le type de cellules immunitaires dominant environ 48h suivant la lésion (Orimo et al., 1991; Tidball, 1995). Ces cellules infiltrent le site lésé afin de détruire les débris par phagocytose et peuvent également affecter d'autres aspects de la régénération musculaire en activant certaines cellules progénitrices
musculaires (Almekinders and Gilbert, 1986; Lescaudron et al., 1999; Merly et al., 1999; Robertson et al., 1993). Ainsi, la nécrose des fibres musculaires et la présence d'un nombre croissant de cellules mononucléées au site endommagé sont les principales caractéristiques histopathologiques d'une lésion récente du muscle squelettique (Figure 1.2).
1.3.2 Phase régénérative du muscle ayant subit une lésion
La dégénérescence du muscle est rapidement suivie d'une régénération musculaire afin de permettre à l'animal ou à l'homme de reprendre libre cours à ses activités. Certaines études ont démontré qu'en absence de prolifération cellulaire, cette phase de reconstruction du muscle s'avère impossible. En effet, en utilisant de la colchicine, un inhibiteur de division mitotique ou encore en irradiant la région lésée, aucun muscle ne peut être formé (Quinlan et al., 1995; Wakeford et al., 1991; Weller et al., 1991). Ainsi, une expansion suffisante des cellules progénitrices musculaires permet l'atteinte d'un nombre suffisant de myoblastes pour la reconstitution de la masse musculaire (Campion et al., 1984; Grounds et al., 2002; Hawke and Garry, 2001). Avec des techniques de marquage radioactif, la contribution de ce pool de myoblastes à la formation de nouvelles fibres a été confirmée. En effet, les fibres musculaires semblent se régénérer de la même façon que lors de 1' embryogenèse. Ces cellules fusionnent pour les réparer ou encore fusionnent entre elles pour former de nouvelles fibres lors d'une blessure importante (Darr and Schultz, 1987; Snow, 1977; Snow, 1978).
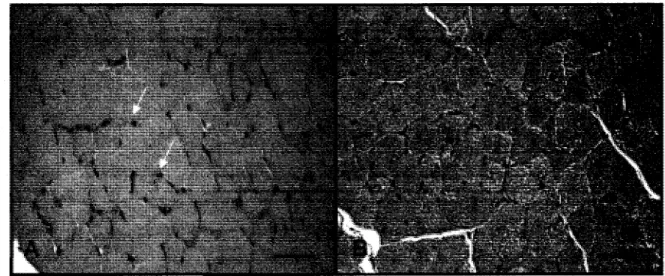
Figure 1.2. Différence de morphologie entre des fibres musculaires saines (A) et 4 jours suivant une lésion à la cardiotoxine (B). Section de gastrocnemius de souris (Mus musculus) de 40 jours en coupe transversale (échelle noire = 100 J..lm). Coloration
Ces fibres nouvellement formées présentent une structure particulière comparativement aux cellules musculaires anciennes (Figure 3.3). En coupe transversale, les nouvelles myofibres sont de petit diamètre et les noyaux sont en position centrale. Au fur et à mesure qu'elles maturent, les fibres vont s'agrandir et les noyaux migreront en périphérie. Les myofibres récentes affichent également une coloration plus basophilique en raison de leur forte synthèse protéique. Celles-ci expriment des isoformes de MHC normalement retrouvée au niveau de l'embryon indiquant ainsi une synthèse récente de fibres musculaires (Hall-Craggs and Seyan, 1975; Whalen et al., 1990). Aussi, en coupe longitudinale, on peut voir que les noyaux se concentrent à 1' endroit où la fibre a été lésée, ce qui indique que la fusion ne se fait pas de façon aléatoire, mais à l'endroit atteint (Blaveri et al., 1999). Un phénomène fréquemment observable est la tendance des fibres à faire des embranchements ou encore à se séparer après la régénération. Cette constatation est rapportée comme étant attribuable à la fusion incomplète des fibres à l'intérieur d'une même lame basale (Blaveri et al., 1999; Blaivas and Carlson, 1991; Bourke and Ontell, 1984). Suivant la phase régénérative, la fibre musculaire normale présentera des caractères physiologiques et morphologiques identiques aux anciennes fibres. Cette récupération chez l'animal est possible grâce à la présence dans le muscle de cellules souches en quiescence.
Figure 1.3. Différence de morphologie entre des fibres musculaires saines (A) et nouvellement régénérées suite à une lésion à la cardiotoxine (10 jours après la lésion) (B). Les fibres nouvellement régénérée sont identifiables par leurs noyaux centraux (flèches noires) comparativement aux fibres matures dont les noyaux sont en position
périphérique (flèches blanches). Section de gastrocnemius de souris (Mus musculus) de
1.4. Cellules souches musculaires
Les cellules souches sont présentes dans la plupart des organes de l'animal (Sun et al., 2003). Elles sont en effet impliquées dans le renouvellement et la réparation de ces derniers. La caractéristique commune de ces cellules souches est leur multipotentialitée. Sous certaines conditions, elles peuvent donc générer plusieurs lignées cellulaires différentes en réponse aux signaux appropriés et donner naissance à des cellules différenciées (division asymétrique) (Lakshmipathy and Verfaillie, 2005). Le muscle squelettique comporte par ailleurs son type de cellules souches, les cellules satellites (Partridge, 2004).
Les cellules satellites constituent une population de cellules mononucléaires non-différenciées présentes dans les muscles squelettiques des mammifères (Campion et al., 1984; Gambie et al., 1978; MAURO, 1961), des oiseaux (Hartley et al., 1992), des reptiles (Kahn and Simpson, Jr., 1974) et des amphibiens (MAURO, 1961; Popiela, 1976). Celles-ci sont présentes dans toutes les fibres musculaires. Plus précisément, ces cellules se retrouvent entre la lame basale et la membrane cellulaire des myofibres matures. Elles sont caractérisées par un ratio surtàce nucléaire/surface cytoplasmique élevé, un nombre réduit d'organelles ainsi qu'un noyau réduit contenant une forte proportion d'hétérochromatine comparativement aux noyaux des fibres (MAURO, 1961). Elles sont seulement identifiables par microscopie électronique ou encore par des immunohistochimies dirigées contre la laminine et la dystrophine, ce qui permet de marquer la lame basale et le sarcolemme de la fibre, respectivement.
La distribution de ces cellules n'est cependant pas répartie uniformément autour de la fibre et leur nombre est dépendant du type de fibre. Une densité de cellules satellites supérieures a été retrouvée à proximité des jonctions neuromusculaires (Wokke et al., 1989; Tennyson et al., 1973) ainsi que près des capillaires (Schmalbruch and Hellhammer, 1977). Ceci suggère que certains facteurs de survie ou de chémoattraction puissent émaner de ces structures afin de concentrer le nombre de cellules satellites à proximité. Ce phénomène suggère également que la fibre musculaire elle-même puisse contrôler son propre pool de cellules satellites. De même, le pourcentage de cellules satellites associées au soleus est deux à trois fois plus élevée qu'au niveau du muscle tibial antérieur adulte ou encore du long extenseur des doigts (Gibson and Schultz, 1982; Rosenblatt et al., 1995; Schmalbruch and Hellhammer, 1977; Snow, 1983). Les causes de cette distribution asymétrique demeurent inconnues, mais pourraient être expliqués par un niveau de stress mécanique variable auxquels sont soumis les muscles étudiés de par leur situation anatomique. La population de cellules satellites est aussi influencée par l'âge de l'animal (mammifères, oiseaux, reptiles et amphibiens). En effet, une importante baisse de la densité de ces progéniteurs est observée durant la croissance post natale. Celle-ci est causée par l'augmentation rapide de la masse musculaire durant la croissance qui dépend exclusivement du pool de cellules satellites. Ainsi à la naissance des jeunes souris, 30% des cellules musculaires sous-jacentes à la lame basale correspondent à des cellules satellites. À deux mois, ce nombre a dramatiquement chuté pour atteindre moins de 5% (Bischoff and Heintz, 1994 ). Après 1' atteinte de la maturité sexuelle, ce chiffre continue à diminuer, mais de façon moins importante (Bockhold et al., 1998; Charge et al., 2002; Gibson and Schultz, 1983; Schultz and Lipton, 1982), syndrome d'une synthèse musculaire moins performante.
1.4.1. Origine des cellules satellites
Deux hypothèses ont été avancées quant à l'origine des cellules satellites. La majorité des chercheurs croient que celles-ci proviennent des somites. En effet, certaines études effectuées avec des cellules somitiques de caille transplantées chez des embryons de poulet appuient cette hypothèse. En regardant les étapes du développement embryonnaire chez ces poulets, il a été observé que les cellules de caille migraient vers les membres du jeune poulet où elles contribuaient à la formation des muscles ainsi qu'à l'établissement des cellules satellites (Armand et al., 1983). L'autre hypothèse stipule que les cellules satellites auraient une origine endothéliale (De Angelis et al., 1999). Les précurseurs myogéniques de la moelle osseuse ont la capacité de participer à la régénération musculaire lorsque injectées dans les vaisseaux sanguins. Par contre, la fréquence de colonisation de ces dernières demeure faible dans le muscle. Ceci suggère donc que ces cellules ont des capacités semblables aux cellules satellites et peuvent contribuer à la régénération musculaire. Aussi, une étude effectuée il y a quelques années montre la présence de précurseurs myogéniques dans l'aorte dorsale. Lorsque mises en culture, ces cellules arborent les mêmes caractéristiques morphologiques et expriment des marqueurs myogéniques et endothéliaux comparables à ceux des cellules satellites retrouvées dans les muscles adultes. Également, ces auteurs mentionnent qu'ils ont réussi à isoler des cellules progénitrices musculaires à partir des membres de mutants PaxT1-et
c-mer1-, deux souris caractérisées par l'absence de toute cellule musculaire au niveau des
pattes. Ces résultats suggèrent que certaines cellules pluripotentes retrouvées au niveau du système vasculaire peuvent se différencier en fonction du tissu perfusé (De Angelis et al., 1999; Minasi et al., 2002). Il reste néanmoins à démontrer que ces cellules forment bien
les cellules définies comme satellites. À noter que les deux hypothèses ne sont pas mutuellement exclusives. En effet, durant les premiers stades de l'embryogénèse, l'endothélium aortique et les somites sont adjacents ce qui suggère une proximité d'origine de ces deux lignées cellulaires (Ordahl, 1999; Pardanaud and Dieterlen-Lievre, 2000). Il n'est donc pas impossible que certaines cellules myogéniques proviennent de l'aorte dorsale tout en étant d'origine somitique. Cette affirmation concorderait aussi avec les observations mentionnant l'hétérogénéité des cellules satellites. Les diverses sous-populations de cellules satellites pourraient être activées de manière spécifique aux fibres et en fonction du type et de 1' étendue des dommages causés à la fibre musculaire.
1.4.2. Multipotentialité des cellules satellites
Les cellules satellites peuvent s'engager dans des processus de différenciation non-musculaires. Celles-ci peuvent adopter un destin ostéogénique ou adipogénique lorsque traitées in vitro avec les protéines morphogéniques de l'os (BMP2) ou encore avec des inducteurs adipogéniques, respectivement (Asakura et al., 2001; Wada et al., 2002b ). Par contre, les cellules satellites sont restreintes aux différentes lignées mésenchymateuses, ce qui est démontré par l'impossibilité pour celles-ci de se convertir en cellules hématopoïétiques (Asakura and Rudnicki, 2002). Une hypothèse en vogue stipule que certaines maladies pourraient être attribuables à une activation déficiente des cellules satellites dans le muscle, ce qui pourrait conduire à la formation de tissus non-musculaires à l'intérieur des muscles. Par exemple, les patients souffrant de dystrophie musculaire de Duchesne présentent régulièrement une augmentation de tissus adipeux à l'intérieur de leurs muscles. Aussi, certaines maladies humaines ont pour symptôme des
formations osseuses ectopiques à l'intérieur des muscles. Une activation aberrante des cellules satellites lors de la régénération musculaire pourrait être à l'origine de cette différenciation des cellules satellites vers des destins autres que musculaires.
1.5. Étapes de la régénération musculaire par les cellules
satellites
Tel que mentionné précédemment, les cellules satellites lorsque non activées ne sont pas dans le cycle cellulaire et leur transcription, quoique présente, est moins active que dans les noyaux des cellules musculaires adjacentes (Schultz et al., 1978; Snow, 1983). Par contre, lorsque nécessaire ces dernières sont activées dans le but de former des nouveaux myoblastes utilisés pour la croissance, la réparation et la régénération (Grounds and Yablonka-Reuveni, 1993; Pavlath and Horsley, 2003). Cette progéniture est alors en mesure de fusionner et de former des fibres musculaires fonctionnelles (Schultz and McCormick, 1994; Hawke and Garry, 2001). La capacité du muscle squelettique à régénérer efficacement démontre la robustesse du processus de régénération musculaire à partir des cellules satellites (Schultz and McCormick, 1994) (Figure 1.4).
1.5.1 Quiescence des cellules satellites
L'étude de la quiescence des cellules satellites s'avère difficile. En effet, le simple fait d'isoler les cellules de leur position anatomique résulte généralement en leur activation. On sait par contre que la quiescence n'est pas un stade inactif. Au contraire, celle-ci est régulée par un contrôle transcriptionnel actif (Yusuf and Fruman, 2003).
Ainsi, au lieu d'isoler ces cellules, des marqueurs des cellules satellites ont été identifiés afin d'approfondir la connaissance des événements de régulation subvenants au niveau de celles-ci. Les marqueurs moléculaires CD34, M-cadherin, Pax?, syndecan-3, syndecan-4 et e-met sont donc présents dans les cellules satellites, mais ne sont pas uniques à celles-ci lorsqu'elles sont en quiescence. Par contre, certaines isoformes de ces protéines sont spécifiques au stade quiescent de ces cellules. Par exemple, une isoforme tronquée du marqueur de surface CD34 est unique aux cellules satellites quiescentes (Beauchamp et al., 2000) de même que l'isoforme [3 de la protéine MNF/FoxK1 (forkhead/winged-helix transcription factor myocyte nuclear factor) (Garry et al., 1997; Yang et al., 1997). Récemment, une étude réalisée au Japon décrivait l'emploi de l'anticorps SM/C2.6 dirigé contre une protéine de surface retrouvée sur les cellules satellites. Les auteurs affirmaient que cette protéine était spécifique à ces cellules (Fukada et al., 2004). Cependant, aucune étude effectuée depuis ne fait mention de cette protéine. D'autres molécules sont aussi exprimées dans les cellules satellites en quiescence tel que myostatin (MSTN), un membre de la super-famille TGF-p. MSTN semble promouvoir le maintien en GO de la cellule puisque chez la souris MSTN1-, le pourcentage de cellules satellites en prolifération est augmenté, ce qui résulte en une masse musculaire démesurée comparativement à la souris de type sauvage (McCroskery et al., 2003).
Quiescence
Cellule satellite Pax7 C-m et..
Activation
Prolifération
Pro géniteur My15 Mtf4 MyoD Fibre musculaire Myosine..
D ifférenc iatio n
Myoblaste Myogenin Mtf4 / MyoO/Fusion
Figure 1.4. Progression de la cellule satellite jusqu'à la fibre musculaire régénérée. Les marqueurs moléculaires de chacune des étapes sont indiqués.
Il est fort probable que cette quiescence soit maintenue par l'activité des différents facteurs de transcription énumérés précédemment. On peut observer chez d'autres lignées cellulaires, que certains membres de la famille des Kruppel, Foxü et Rb peuvent obliger ces cellules à entrer en quiescence tout en permettant un retour dans le cycle cellulaire en réponse aux stimuli appropriés (Yusuf and Fruman, 2003). Des mécanismes épigénétiques pourraient aussi être en cause dans l'induction et le maintien des cellules satellites en GO (Grigoryev et al., 2004). Mis à part les facteurs nucléaires, le maintien de la quiescence pourrait aussi être attribuable à l'environnement des cellules satellites. Une perturbation des systèmes de signalisation dépendant des microfilaments de ces dernières en culture cellulaire a pour conséquence de les mener en quiescence réversible (Dhawan and Helfman, 2004). L'état quiescent peut aussi être dépendant de l'état métabolique et nutritionnel d'une cellule (Gray et al., 2004). Le maintien de l'état de quiescence des cellules satellites est probablement causé par une combinaison de ces facteurs.
Maintenant, comment se fait-il qu'une cellule en GO, non-différenciée et en silence transcriptionnel relatif puisse, lorsqu'activée, former du tissu musculaire? En effet, tous les marqueurs myogéniques habituels de la famille des bHLH (MyoD, Myf5, Mrf4 et Myogénine) sont absents de ces cellules. Par exemple, MyoD n'est pas présent tant au niveau de l' ARN messager que de la protéine (Grounds et al., 1992; Smith et al., 1994; Comelison and Wold, 1997). De plus, malgré le fait qu'une étude utilisant un gène rapporteur ait démontré une activité du locus de Myf5 dans les cellules satellites, aucune protéine n'est détectée (Beauchamp et al., 2000). Le destin myogénique de la cellule satellite est donc fixé par des facteurs de transcription en amont des bHLH. Parmi, les activateurs des bHLH, Pax3 et Pax7 sont exprimés dans les cellules satellites (Tajbakhsh,
2005). Les structures de ces protéines sont très proches et leurs patrons d'expression se recoupent durant le développement embryonnaire (Goulding et al., 1991; Jostes et al., 1990). Pax3 et Pax7 sont impliqués lors du développement musculaire du tronc et des membres et pour certains éléments du système nerveux central (Chi and Epstein, 2002; Manso uri et al., 1999). En plus d'être présent pendant la quiescence, Pax7 est exprimé lors de la phase d'activation et de prolifération, mais rapidement régulé à la baisse pendant la ditlërenciation du muscle (Seale et al., 2000). De faibles niveaux de Pax7 sont présents dans les cellules musculaires murines C2C 12 en prolifération, qui originent de cellules satellites (Blau et al., 1985; Yaffe and Saxel, 1977). Ces observations portent à croire que Pax7 joue un rôle essentiel dans la formation du muscle squelettique à partir des cellules satellites.
1.5.1.1 Spécificité du facteur Pax7 aux cellules satellites dans le muscle adulte
L'expression spécifique de Pax7 aux cellules satellites a été confirmée in vivo par hybridation in situ et par immunohistochimie sur des coupes de muscles frais congelés. Aussi, davantage de cellules Pax7+ sont présentes chez les modèles murins caractérisés par une régénération continue comme les MyoD-1-, les mdx ainsi que les mdx:MyoD_1_
(Seale et al., 2000). La souris déficiente en Pax7 apparaît normale à la naissance, mais une absence de croissance musculaire post-partum mène ces animaux à une taille de 50% inférieur aux souris de type sauvage. Ces souris meurent en deçà de deux semaines (Mansouri et al., 1996; Seale et al., 2000). Ce phénotype est caractérisé par une masse musculaire faible découlant d'une grosseur de fibres musculaires réduites et non pas d'un nombre de fibres inférieur, syndrome d'un arrêt de fusion cellulaire après la naissance. L'absence de cellules satellites dans ces souris a été confirmée par microscopie
électronique et par culture cellulaire. En effet, lorsque tmses en culture, les cellules souches présentes au mveau des muscles ne forment que des adipocytes et des fibroblastes (Seale et al., 2000). Au départ, les auteurs de cette étude croyaient que les souris ne formaient pas de cellules satellites. Cette hypothèse a été démentie par des chercheurs français. Ces derniers ont montré que les cellules satellites se développaient, mais qu'elles mouraient rapidement d'apoptose et que cette fonction anti-apoptotique de Pax7 ne pouvait être complémenté par la présence de Pax3 (Relaix et al., 2006) qui est retrouvé au niveau de certaines cellules satellites (Buckingham et al., 2003). De plus, certains laboratoires ont réussi à obtenir des souris PaxT1- qui ne décédaient pas rapidement après la naissance. Au lieu d'utiliser la souche conventionnelle de souris C57BL/6, l'inactivation génique a été réalisée dans un fond génétique 129Sv/J. Malgré une croissance réduite, un manque de masse musculaire ainsi qu'une absence complète de cellules satellites, ces souris peuvent survivre assez longtemps pour permettre l'évaluation des capacités régénératrices de celles-ci. Ces souris présentent un déficit important de régénération musculaire, mais peuvent quand même former quelques fibres. Ceci suggère la présence de cellules progénitrices musculaires résiduelles chez ces animaux. Une population de myoblastes exprimant Pax3 et MyoD a été isolée à partir des muscles de ces souris PaxT1-. Ces cellules représentent donc une nouvelle population de cellules progénitrices musculaires distinctes des cellules satellites et pourraient, en association avec les cellules satellites, apporter une contribution substantielle aux muscles en régénération. Également, cette étude démontre que Pax7 demeure essentiel pour la survie des cellules satellites (Kuang et al., 2006).
1.5.1.2 Autres facteurs impliqués dans le maintien de l'identité cellulaire des cellules satellites
Puisque Pax7 contribue seulement au maintien des cellules satellites, mais pas à la spécificité du destin myoblastique, d'autres hypothèses ont été mises de l'avant pour expliquer cet engagement vers un destin musculaire. Entre autres, des mécanismes épigénétiques pourraient servir à maintenir la chromatine compactée à certains endroits pour empêcher l'expression des gènes myogéniques. Lors de l'activation des cellules satellites, ces mécanismes pourraient dérouler la chromatine aux endroits clés pour permettre l'expression de ces facteurs musculaires (Grigoryev et al., 2004; Georgopoulos, 2002). Des molécules du cytosquelette spécifiques au muscle squelettique comme la desmine pourraient également contrôler une signalisation cytosquelettique propre au muscle, ce qui assurerait le maintien d'une identité cellulaire de façon plus durable que par des facteurs de transcription, à durée de vie moins longue. Certaines études ont démontré l'importance des signaux extrinsèques dans le maintien de la quiescence des cellules satellites. Par exemple, une petite perturbation de l'environnement des ces dernières provoque leur activation. À ce titre, la vaste majorité des cellules satellites expriment la protéine membranaire M-cadherin (Beauchamp et al., 2000). Celle-ci n'est pas uniformément située sur le pourtour du progéniteur, mais concentré entre la cellule satellite et la fibre musculaire, suggérant un échange d'information entre celles-ci (Irintchev et al., 1994 ).
1.5.2 Activation des cellules satellites
Suivant une lésion des fibres musculaires, les cellules satellites en quiescence sont activées afin d'entrer en mitose dans le but de fabriquer de nouvelles cellules nécessaires au remplacement de ces fibres. La première étape dans l'activation des ces cellules progénitrices est l'augmentation de la transcription et de la traduction protéique. Les mécanismes d'épissage alternatif sont aussi mis en place pour la création d'isoformes spécifiques au stade prolifératif des cellules satellites. Le facteur de transcription MyoD est l'un des premiers à être régulé à la hausse. Des niveaux détectables de cette protéine apparaissent dans les douze heures suivant la lésion (Grounds et al., 1992; Smith et al., 1994). Ce facteur ne semble par contre pas essentiel à l'activation puisque chez les souris MyoD-1-, les cellules entre en prolifération sans délais (Cornelison et al., 2000). Le
marqueur de surface M-cadherin est aussi régulé à la hausse 24 heures suivant la lésion dans le cas de cellules satellites isolées à partir de fibres musculaires (Cornelison and Wold, 1997) et à l'intérieur de 6 heures pour des cultures de myoblastes synchronisées en GO (Sachidanandan et al., 2002). Par la suite, une forme tronquée d'une autre protéine de surface, CD34, est exprimée. Son rôle demeure inconnu, mais des études effectuées sur les cellules hématopoïétiques suggèrent un rôle dans la décision d'activation et d'auto-renouvellement (Sato et al., 1999). Également, l'isoforme
P
du facteur de transcription MNF est supplanté par l'expression de la forme a entre 24 heures et 48 heures suivant la blessure. Une destruction du gène MNF chez la souris a pour effet de retarder l'activation des cellules satellites et de rendre la régénération musculaire moins efficace (Garry et al., 2000).L'environnement cellulaire peut aussi influencer la cinétique d'activation des cellules satellites. En effet, l'entrée en mitose des cellules progénitrices est retardée chez des animaux plus âgés. Une fois activée, leur prolifération demeure cependant normale (Schultz and Lipton, 1982). Ce déclin de réactivité relié à l'âge peut donc être influencé par des facteurs extrinsèques (Conboy et al., 2003; Conboy et al., 2005). L'activation des cellules satellites est donc finement modulée par son emplacement et ses propriétés intrinsèques.
1.5.3 Prolifération des cellules progénitrices
Une fois activées, les cellules satellites entrent dans un stade prolifératif rapide tout en se spécifiant vers un destin strictement musculaire. Cette phase est caractérisée par l'apparition d'une population intermédiaire de progéniteurs identifiable grâce à une régulation à la baisse de CD34 et une augmentation de l'expression du facteur Pax3. Cette étape est fortement régulée par la molécule de signalisation Notch. En effet, une inhibition du signal de cette molécule entraîne la sortie du cycle cellulaire des myoblastes.
À l'opposé, lorsque la signalisation par Notch est activée, par son ligand Delta, dans des cellules musculaires en culture, ces dernières demeurent au stade de progéniteurs (Conboy and Rando, 2002). Certaines études réalisées sur des explants de fibres musculaires suggèrent qu'une augmentation de la protéine cytosolique associée à la membrane, Numb, est responsable de l'engagement des progéniteurs intermédiaires vers la diffërenciation (Conboy and Rando, 2002). En effet, Numb est reconnu pour neutraliser l'effet de Notch et a été associé à la détermination de l'identité cellulaire dans une multitude de processus au cours du développement tant chez les vertébrés que chez les
invertébrés (Carmena et al., 1998; Cayouette and Raff, 2002; Knoblich et al., 1995; Rhyu et al., 1994). Cette signalisation n'est pas intrinsèque, mais activement contrôlée par la cascade de signalisation des Wnts qui agissent directement sur la population de progéniteurs intermédiaires (Holowacz et al., 2006). Finalement, chez des cellules satellites mises en culture, l'activation de Notch-1 promeut la prolifération d'une forme primitive de ces dernières (Numb-/Pax3+/Des-/Myf5-/MyoD-), tandis que son inhibition entraîne les progéniteurs à adopter un destin myoblastique (Numb+/Pax3-/Des+/Myf5+/MyoD+) et leur différenciation subséquente (Conboy and Rando, 2002). Dans 1' ensemble, ces données suggèrent que les molécules de signalisation à proximité des cellules satellites contrôlent leur prolifération et que celle-ci repose essentiellement sur l'interaction Notch-Numb sous le contrôle des Wnts. L'influence de Pax3 et de Myf5 dans la prolifération cellulaire reste à déterminer.
1.5.4 Différenciation des cellules progénitrices
Suivant leur prolifération, les cellules progénitrices du muscle squelettique doivent se différencier pour ensuite pouvoir fusionner et former des fibres musculaires fonctionnelles. Tel que mentionné précédemment, MyoD semble jouer un rôle clé dans cette étape. Des observations réalisées chez les souris MyoD_1_ ont permis la constatation d'une réduction de la capacité de régénération musculaire causée par un nombre réduit de fibres en régénération et une augmentation dans la population de cellules en prolifération (Megeney et al., 1996). Une fréquence accrûe de fibres musculaires divisées chez ces souris suggère aussi une inefficacité du processus de régénération musculaire (Cornelison et al., 2000). Cette souris affiche aussi un taux supérieur d'IGF-1 (Sabourin et al., 1999),
dont le rôle est de promouvoir la prolifération des cellules musculaires en régénération (Florini et al., 1996). Ces effets ne sont pas dus à une malformation congénitale des cellules satellites découlant de l'absence de MyoD pendant l'embryogénèse. Des souris dont le gène MyoD a été inactivé après la naissance par siRNA montre également une régénération musculaire ralentie (Zador et al., 2002). Lorsque des cellules satellites de souris MyoD_1_ sont mises en culture, elles adoptent une morphologie différente
comparativement à celles provenant d'une souris normale. Elles sont de forme étoilée et aplatie en contraste avec la forme ronde et compacte habituellement associée aux cellules satellites (Sabourin et al., 1999). L'absence de sérum dans le milieu de culture cause habituellement un arrêt du cycle cellulaire et la différenciation de myoblastes en culture. Les cellules MyoD_1_ continuent de proliférer sous ces conditions et donnent
éventuellement un nombre réduit de myocytes mononucléés différenciés (Comelison et al., 2000; Sabourin et al., 1999; Yablonka-Reuveni et al., 1999a). M-cadherin, reconnu pour être essentiel à la différenciation et à la fusion des myoblastes est également en quantité moindre dans ces cellules (Comelison et al., 2000; Sabourin et al., 1999; Irintchev et al., 1994; Zeschnigk et al., 1995).
Le rôle de MyoD dans la différenciation des cellules musculaire en prolifération a été précisé par Zhao et al, 2002. En effet, une analyse du promoteur du gène Slug a révélé
la présence de sites de liaison pour MyoD. Une expérience de trans-activation de MyoD sur ce promoteur a permis de démontrer que MyoD pouvait activer le promoteur de la protéine Slug de manière dose-dépendante (Zhao et al., 2002). Slug est une protéine à doigt de zinc de la famille des Snail. Cette protéine est régulée à la hausse lors d'une lésion du tissu musculaire par la cardiotoxine. Cette apparition survient de quatre à dix