NICOLAS DUMONT
ATROPHIE, CROISSANCE ET FONCTION
MUSCULAIRE :
l’impact des leucocytes et de la triade RANK/RANKL/OPG.
Thèse présentée
à la Faculté des études supérieures et postdoctorales de l’Université Laval dans le cadre du programme de doctorat en physiologie-endocrinologie
pour l’obtention du grade de Philosophiae Doctor (Ph.D.)
FACULTÉ DE MÉDECINE UNIVERSITÉ LAVAL
QUÉBEC
2013
Résumé
L’atrophie et les dysfonctions musculaires sont des problèmes courants et d’origines variées. À titre d’exemple l’alitement prolongé, le SIDA, les cancers, l’hypogravité et le vieillissement peuvent tous entraîner une perte de masse et de force musculaire. Malgré les coûts économiques et sociaux élevés, relativement peu d’efforts ont été investis dans la caractérisation des processus qui gouvernent l’atrophie/dysfonction musculaire et dans le développement de traitements plus efficaces. Conséquemment, cette thèse vise à approfondir les connaissances actuelles sur les mécanismes qui régulent l’atrophie/dysfonction et la récupération des muscles atrophiés par sous-utilisation. Tout d’abord, nous avons caractérisé l’impact des leucocytes impliqués lors de la remise en charge du muscle soléaire atrophié par hypogravité. Ainsi, nous avons démontré que les mastocytes étaient activés par la remise en charge et que leur dégranulation orchestrait le recrutement des neutrophiles et des monocytes/macrophages. Ensuite, nos recherches ont indiqué que l’activité des neutrophiles pouvait être régulée en fonction de leur microenvironnement et que leur présence dans les muscles atrophiés et inflammés n’était pas nécessairement associée à l’induction de dommages secondaires. Par la suite, nous avons établi que la présence des macrophages était importante pour permettre la récupération optimale de la force des muscles atrophiés. Nous avons également démontré que l’activité myogénique des macrophages pouvait être optimisée en favorisant leur phénotype anti-inflammatoire avec le facteur de croissance hématopoïétique « macrophage-colony stimulating factor » (M-CSF). Finalement, nous avons caractérisé l’impact du « receptor activator of NF-kB » (RANK) et de son ligand RANKL, une voie signalétique impliquée dans le remodelage osseux et l’ostéoporose, sur l’atrophie/dysfonction musculaire. Nous avons démontré qu’une déficience de RANK ou le blocage de RANKL par l’ostéoprotégérine protègent contre la perte de force des muscles dénervés ou dystrophiques. Ce phénomène est associé à des modifications dans l’expression des protéines favorisant une recaptation plus efficace du calcium. De plus, RANK participe à la reconversion des fibres rapides vers lentes durant la période de remise charge. Globalement, nos travaux permettent de mieux comprendre les mécanismes entourant l’atrophie, la croissance et les dysfonctions musculaires et ouvrent la voie à de nouvelles pistes de traitement pour plusieurs maladies neuro-musculaires.
Abstract
Muscle atrophy and dysfunction are characterized by a loss of muscle mass and force, which are commonly found in many pathologies or conditions such as AIDS, cancers, chronic obstructive pulmonary diseases, cast immobilization, hypogravity, bed rest or aging, to name a few. Muscle atrophy/dysfunction have also very high social and economic costs, but very few laboratories have investigated the cellular and molecular mechanisms behind these muscular problems. The aim of this thesis is therefore to enhance our understanding of different mechanisms governing muscle atrophy/dysfunction and regrowth by using different models of disuse and dystrophy. Thus, we have initially explored the roles of different leucocytes in atrophied and reloaded soleus muscle. Firstly, we looked at the role of mast cells and showed that the mechanical stress associated with muscle reloading is able to stimulate mast cell degranulation, which orchestrates the recruitment of neutrophils and monocytes/macrophages. Secondly, our experiments revealed that neutrophil activity is adaptable and that neutrophil-induced tissue damage is dependent on the microenvironment. In atrophied and reloaded muscles, the presence of neutrophils is not associated with secondary damage or promotion of muscle recovery. Thirdly, we demonstrated that the presence of macrophages is essential for optimal muscle force recovery from atrophy. Fourthly, we showed that the macrophage-colony stimulating factor (M-CSF) promote the myogenic activity of macrophages by stimulating their anti-inflammatory phenotype. Finally, we investigated the impact of the receptor activator of NF-kB (RANK) and its ligand RANKL, a signalling pathway involved in bone remodelling and osteoporosis, on muscle atrophy and dysfunction. Our results showed that the specific deletion of RANK in the muscle or the blockage of RANKL with osteoprotegerin increased significantly force production in denervated and dystrophic muscles. These results were associated with various modifications in calcium handling protein expression favouring efficient calcium uptake. Moreover, we also demonstrated that RANK activation gives preference to the reconversion from fast-to-slow muscle fibers following hindlimb unloading/reloading. Overall, our results bring a better understanding of different mechanisms related to muscle atrophy, dysfunction and regrowth and potentially open new avenues for the treatment of several debilitating skeletal muscle conditions.
Avant-Propos
La présente thèse comporte quatre articles dans lesquels je suis le premier auteur et qui ont été publiés ou acceptés dans des revues scientifiques révisées par les pairs. Ces articles sont présentés en ordre logique et chronologique dans les chapitres 2 à 5. Le premier a été publié en juillet 2007 dans le « Journal of Applied Physiology ». Le second a été publié dans l’ « American Journal of Physiology - Regulatory, Integrative and Comparative Physiology » en décembre 2008. Le troisième article a été publié en mai 2010 dans l’ « American Journal of Pathology », tout comme le sera le quatrième qui vient d’être accepté en octobre 2012 et qui sera publié officiellement en février 2013. Brièvement, ces articles visaient à définir le rôle des mastocytes, des neutrophiles et des macrophages dans la récupération des muscles atrophiés par hypogravité. Dans ces quatre articles j’ai été responsable de la mise au point de la plupart des protocoles, des expérimentations, de l’analyse des résultats et de la rédaction des articles. Mon directeur de recherche, le Dr. Jérôme Frenette, est l’auteur de correspondance sur tous ces articles et il a supervisé et contribué à l’élaboration des objectifs, à la conception du devis expérimental et à la rédaction des articles. Mon co-directeur de recherche, le Dr. Claude H. Côté, a également révisé chacun de ces manuscrits et a apporté une contribution intellectuelle et une expertise particulièrement significative dans le premier article sur lequel il est co-auteur. Dans ce premier article, Mme Katherine Lepage, une stagiaire d’été, a également apporté une contribution importante dans la collecte et l’analyse des données. Finalement, le deuxième article publié en décembre 2008 comporte également un co-auteur, M. Patrice Bouchard, qui a participé à l’élaboration de certains protocoles, à la collecte de données et à la rédaction d’une section de l’article. Les articles publiés sont présentés dans leur forme originale sans modification.
Un cinquième article dont je suis le premier auteur est en préparation et est présenté dans le chapitre 6. Cet article porte sur la triade de protéines RANK/RANKL/OPG qui est bien connue pour son rôle dans la dégradation osseuse, mais dont le rôle dans le tissu musculaire est complètement méconnu. Bien que l’article présenté soit suffisamment avancé pour pouvoir comprendre le phénomène observé et discuter de ses implications, il est tout de même encore incomplet et il est encore nécessaire d’ajouter des expérimentations complémentaires et d’augmenter le nombre d’animaux afin de valider les tendances
observées. Cependant, considérant les aspects innovateurs, les résultats éloquents et le potentiel thérapeutique des découvertes présentées dans cet article nous travaillons à le soumettre à la revue « Nature » vers le début de l’année 2013. Le choix de la revue « Nature » amène aussi une présentation différente de l’article qui comporte ainsi plusieurs figures chargées et un texte concis et dense. Dans cet article, je suis également le premier auteur et j’ai été responsable d’une partie importante de la mise au point des protocoles, de la collecte des données et de l’analyse des résultats. De plus, en étroite collaboration avec le Dr. Jérôme Frenette, nous avons développé les objectifs et les hypothèses en plus de rédiger l’article. Cependant, un travail d’une telle amplitude a nécessité la collaboration de nombreux autres co-auteurs. M. Sébastien Dufresne, étudiant au doctorat, ainsi que les assistants de recherche, M. Patrice Bouchard et Mme Éliane Lavergne, ont apporté une contribution essentielle et importante dans le génotypage, dans la mise au point des protocoles et dans la collecte de données. Des collaborations externes ont également été nécessaires. Le Dr. Josef Penninger a apporté une contribution intellectuelle au projet et nous a fourni les souris modifiées génétiquement. Son associé de recherche, Renu Sarao, a aidé à la mesure de l’expression de RANK/RANKL/OPG dans le muscle squelettique. Finalement, les Drs. Charles Godbout et Paul Pape apportent leurs expertises respectives pour les mesures du calcium.
En plus des articles présentés dans cette thèse, j’ai également eu la possibilité de collaborer sur d’autres projets qui ont mené ou vont mener à d’autres publications en tant que co-auteur. J’ai ainsi réalisé la collecte et l’analyse de données de la section fonctionnelle, ainsi que la rédaction partielle de cette section dans trois études portant sur la dystrophie de Duchenne. Ces études ont été réalisées dans le laboratoire du Dr. Jacques Tremblay. Les deux premières ont été publiées en janvier 2010 dans « Cell Transplantation » et en décembre 2010 dans « Molecular Therapy », alors que la dernière vient d’être récemment soumise dans ce même journal.
Les abréviations utilisées dans le texte sont définies lors de leur première apparition et sont également regroupées dans une liste sous-jacente. Les termes scientifiques anglais ont été généralement utilisés afin de faire le parallèle plus facilement avec la littérature.
« Every solution breeds new problems » Loi de Murphy
Remerciements
Une thèse de doctorat est le fruit de nombreuses années aux études graduées qui demandent effort, passion, curiosité et dépassement de soi. La réalisation de celle-ci n’aurait jamais été possible sans le soutien de nombreuses personnes essentielles à la réussite de ce projet. À tout seigneur tout honneur, mes premiers remerciements vont au Dr. Jérôme Frenette, mon directeur de recherche. Grâce à son expérience, ses connaissances et son dévouement pour ses étudiants (même dans les épreuves les plus difficiles), Jérôme a su faire ressortir le meilleur de moi-même. De plus, Jérôme a été un véritable guide dans ce processus trouvant le juste équilibre entre autonomie et supervision. Par dessus tout, je retiendrai sa capacité de synthèse et sa faculté à structurer sa pensée, deux atouts que j’ai développés grâce à lui et qui sont essentiels à la survie d’un chercheur dans le monde scientifique actuel. Comme l’a si bien dit Voltaire : « Je vous écris une longue lettre parce que je n'ai pas le temps d'en écrire une courte ». Jérôme, merci pour tout et pour m’avoir appris à écrire une lettre courte.
Mes seconds remerciements vont évidemment à l’autre grand architecte de mes études supérieures, mon co-directeur le Dr. Claude H. Côté. Pour moi, Claude est un modèle d’équilibre de par ses qualités professionnelles et personnelles. Sa présence quasi-quotidienne dans le laboratoire a été la source de réponses à d’innombrables questions, ainsi qu’à des discussions sur tous les sujets possibles et imaginables allant de l’ingéniosité des Mac, jusqu’aux éternelles accusations de dopage contre Lance Armstrong. Cette co-direction m’a permis d’élargir grandement ma compréhension de la recherche et de l’enseignement. Claude, merci pour ton support constant et pour ton sens critique qui amène à voir toujours plus loin...et surtout n’arrête jamais de fouiner !
Mes études supérieures n’auraient jamais pu être les mêmes sans les gens que j’ai côtoyés jour après jour dans le laboratoire. Un merci tout spécial à notre assistant de recherche, Patrice Bouchard qui grâce à ses capacités pédagogiques m’a appris tous les rudiments de la recherche. Mes études auraient été beaucoup plus difficiles sans son aide précieuse. Patrice, maintenant que s’achèvent mes études je pourrai toujours suivre à distance tes idées extrémistes et/ou provocatrices puisque tu devrais pouvoir m’accepter sur Facebook. Mes
plus sincères remerciements aussi à Éliane Lavergne dont l’expertise et les efforts ont été d’une aide précieuse pour la fin de mon doctorat. Éliane, ta rigueur et ton dévouement sont des exemples à suivre. Je dois également une fière chandelle aux étudiants au doctorat qui m’ont précédé dans le laboratoire, les Drs. Charles Godbout et Germain Houngbedji. Leurs connaissances et leur point de vue expérimenté de la vie étudiante ont été d’une grande aide pour le novice que j’étais. Un énorme merci aussi à tous les stagiaires (Katherine Lepage, Rosalie Bilodeau, Marilou Pouliot, Marjorie Bastien, Keven Lemieux, Antoine Boulanger-Piette) et aux étudiants à la maîtrise (Sébastien Dufresne, Mélissa De la Durantaye, Rachelle Gosselin) pour leur aide directe ou indirecte sur mes projets et pour avoir participé à l’agréable ambiance régnant dans le laboratoire. Sébastien, je te souhaite bon succès dans ton doctorat, tu as tout ce qu’il faut pour réussir et j’aurai plaisir à collaborer avec toi plus tard et surtout à aller manger une bonne bouffe ou prendre un verre (gagné à la suite d’un pari). Finalement, jamais ces dernières années n’auraient été les mêmes sans la présence de mon homologue féminine au doctorat, Élise Duchesne. Bien que provenant du cheminement particulier, Élise m’a accompagné dans tous les remous des études supérieures. Son support, sa présence, ses opinions et ses idées ont été précieux pour moi à travers les hauts et les bas de la recherche, mais aussi de la vie en général. Au cours de ces années s’est forgée non seulement une relation de travail qui perdurera dans le temps, mais surtout une amitié sincère. Élise, merci.
Un merci également aux membres des différents labos que nous avons côtoyés au cours de nos passages à travers tous les différents axes de recherche ! Merci spécialement aux membres du laboratoire du Dr. André Marette, du Dr. Jacques Tremblay, du Dr. Patrice Poubelle, du Dr. Josef Penninger et à ceux des différents groupes de neuroscience. Ces collaborations sont essentielles au bon avancement de la recherche. Merci aussi aux Drs. Benoît Lapointe et Richard Débigaré qui m’ont accompagné lors des différentes étapes de mes études supérieures et qui m’ont apporté un point de vue extérieur qui m’a permis de mieux me situer dans mon cheminement.
Jamais ces années d’étude n’auraient été les mêmes sans le support et l’amour inconditionnel de ma famille, de ma belle-famille et de mes amis. Ma mère Danielle, mon
père Michel, mon frère Frédéric et mon filleul Alexandre, vous êtes très précieux pour moi et votre amour me permettra de franchir toutes les épreuves. Merci pour votre support et pour avoir stimulé ma curiosité et mon esprit tout au long de ma vie, je vous aime. À tous mes amis proches (que je ne nommerai pas tous ici…mais vous devriez vous reconnaître), la sincérité et la profondeur de notre amitié m’étonnera toujours. Sans toutes ces soirées, ces discussions à cœur ouvert, ces voyages, ces moments de détentes, de sport ou de folie, ma vie n’aurait jamais été la même. Vous m’avez donné l’énergie qui m’a permis de passer à travers ce doctorat, je vous aime. Finalement, merci à mon amoureuse, Émilie. Ton énergie, ta joie de vivre, ton soutien et ta présence dans ma vie sont source d’un grand bonheur pour moi, ce qui a eu d’innombrables répercussions positives dans mes études. Te savoir à mes côtés pour le post-doctorat m’a donné le courage d’avancer...et…enfin ce sera fini la distance. Merci pour la vie que l’on partage et le monde que l’on bâti, je t’aime.
En dernier lieu, je me dois de remercier les organismes subventionnaires qui m’ont soutenu financièrement tout au long de mon cheminement académique. Merci à la Fondation de l’Université Laval pour m’avoir donné ma première bourse, à l’Association des chercheurs et chercheuses étudiant à la Faculté de médecine (ACCEM) ainsi qu’à l’Association des étudiants de Laval inscrits aux études supérieures (AÉLIÉS) pour leur soutien financier à mes congrès, au Fond de recherche en santé du Québec (FRSQ) pour la bourse de doctorat qui m’a donné un certain confort pendant mes études doctorales et aux Instituts de recherche en santé du Canada (IRSC) pour leur contributions financière allouée pour mon post-doctorat.
Table des matières
Résumé ... ii
Abstract ... iii
Avant-Propos ... iv
Remerciements ... vii
Table des matières ... x
Liste des tableaux ... xv
Liste des figures ... xvi
Liste des abréviations ... xviii
Chapitre 1 : Introduction ... 1
1.1 Problématique ... 1
1.2 Structure et fonction du muscle squelettique ... 3
1.2.1 Composition musculaire : du muscle au sarcomère ... 3
1.2.2 Phénotype des fibres musculaires ... 6
1.2.3 Cycle excitation / contraction / relaxation ... 8
1.2.3.1 Relâchement du calcium ... 8
1.2.3.2 Contraction musculaire ... 9
1.2.3.3 Recaptation du calcium ... 10
1.2.3.4 Calcium et types de fibres ... 13
1.2.3.5 Pathologies associées à un mauvais contrôle du calcium ... 15
1.2.4 Propriétés contractiles ... 16
1.3 Mécanismes d’atrophie, de dysfonction et de croissance musculaire ... 18
1.3.1 Types d’atteintes musculaires ... 18
1.3.2. Mécanismes régulant l’atrophie et la croissance musculaire ... 20
1.3.2.1 Structure et fonction du muscle atrophié ... 20
1.3.2.2 Apoptose et dégradation protéique ... 22
1.3.2.3 Croissance musculaire ... 25
1.4 Réaction inflammatoire dans le muscle squelettique ... 29
1.4.1 Atrophie et inflammation ... 29
1.4.2 Mastocytes ... 31
1.4.3 Neutrophiles... 34
1.4.4 Monocytes/macrophages ... 35
1.4.5 Résolution de l’inflammation ... 40
1.5 Interrelations entre dégradation musculaire et osseuse ... 42
1.5.1 Physiologie de la dégradation osseuse... 42
1.5.2 La voie RANK/RANKL/OPG dans l’os ... 43
1.5.3 La voie RANK/RANKL/OPG dans les tissus non osseux ... 46
1.5.4 Voies signalétiques activées par RANK et atrophie/dysfonction musculaire ... 48
1.5.4.1 Voies dépendantes du calcium et atrophie musculaire ... 49
1.5.4.2 TRAF-6 et l’atrophie musculaire ... 51
1.5.4.3 NF-kB et atrophie musculaire ... 52
1.5.4.4 Voies MAPK et atrophie musculaire ... 53
Chapitre 2 : Les mastocytes peuvent moduler l’accumulation leucocytaire et la fonction du muscle squelettique suite à un protocole de suspension et de remise
en charge ... 57
Résumé ... 59
Abstract ... 60
2.1 Introduction ... 61
2.2 Material and methods ... 62
2.2.1 Experimental protocol ... 62
2.2.3 Measurement of mechanical properties ... 63
2.2.3 Tissue preparation and immunohistochemical and histological stainings ... 63
2.2.4 Statistical analysis... 64
2.3 Results ... 64
2.3.1 Effect of HU and reloading on morphological and contractile properties... 64
2.3.2 Influence of mast cell inhibition on leukocyte accumulation and muscle function .. 65
2.3.3 Impact of mast cell activation by CMP 48/80 on leukocyte accumulation and muscle function ... 66
2.4 Discussion ... 66
2.4.1 Mast cell and neutrophil recruitment ... 67
2.4.2 Mast cells and macrophage accumulation ... 68
2.4.3 Modulation of inflammation and muscle function ... 69
2.5 Perspectives and conclusion ... 70
2.6 Acknowledgments ... 70
2.7 Grants ... 70
2.8 References ... 71
2.9 Figures, tables and legends ... 74
Chapitre 3: Les dommages secondaires aux muscles squelettiques induits par les neutrophiles : Une réponse calculée et contrôlée suite à un protocole de remise en charge post-hypogravité. ... 81
Résumé ... 83
Abstract ... 84
3.1 Introduction ... 85
3.2 Material and methods ... 86
3.2.1 Animals ... 86
3.2.2 Neutrophil depletion and flow cytometry analysis ... 87
3.2.3 Isometric contractile properties and tissue freezing ... 87
3.2.4 Contractile properties of soleus muscles incubated in vitro with LPS ... 88
3.2.5 Immunohistochemistry and cell counting ... 88
3.2.6 Assessment of muscle fiber injury ... 89
3.2.7 Myeloperoxidase assays ... 89
3.2.8 Statistical analysis... 90
3.3 Results ... 90
3.4 Discussion ... 92
3.5 Perspectives and significance ... 95
3.6 Acknowledgments ... 96
3.7 References ... 97
Chapitre 4 : Les macrophages protègent contre l’atrophie et favorisent la récupération musculaire in vivo et in vitro : un mécanisme dépendant
partiellement de la molécule IGF-1 ... 111
Résumé ... 113
Abstract ... 114
4.1 Introduction ... 115
4.2 Material and Methods ... 116
4.2.1 Animals ... 116
4.2.2 Monocyte/macrophage depletion ... 116
4.2.3 Isometric contractile properties ... 117
4.2.4 Immunohistochemistry and cell counting ... 117
4.2.5 Cell culture and myotube atrophy ... 118
4.2.6 Macrophage/myotube co-cultures ... 118
4.2.7 Myotube diameter analysis ... 119
4.2.8 Protein content and Western blots ... 120
4.2.9 Statistical analyses... 120
4.3 Results ... 121
4.3.1 In vivo model of mice hindlimb unloading and reloading ... 121
4.3.2 In vitro model of myotube atrophy and regrowth ... 121
4.4 Discussion ... 122
4.5 Grants ... 126
4.6 References ... 127
4.7 Figures and legends ... 131
Chapitre 5 : Les macrophages différentiés avec le M-CSF promeuvent la croissance des muscles squelettiques atrophiés et des myotubes C2C12 ... 137
Résumé ... 139
Abstract ... 140
5.1 Introduction ... 141
5.2 Material and Methods ... 142
5.2.1 Animals and experimental procedures ... 142
5.2.2 Isometric contractile properties ... 142
5.2.3 Immunohistochemistry / immunofluorescence and cell counting ... 143
5.2.4 Histology and muscle cross-sectional area ... 144
5.2.5 Cell cultures ... 144
5.2.6 FACS analysis ... 145
5.2.7 Western blots ... 145
5.2.8 Protein synthesis and degradation ... 146
5.2.9 Statistical analyses... 146
5.3 Results ... 147
5.3.1 In vivo model ... 147
5.3.2 In vitro co-culture model ... 148
5.4 Discussion ... 149
5.6 Acknowledgments ... 152
5.7 References ... 153
5.8 Figures and legends ... 157
Chapitre 6: RANK/RANKL/OPG est une voie nouvelle et importante dans la dysfonction et la physiopathologie du muscle squelettique. ... 168
Abstract ... 171
6.1 Brief introduction ... 172
6.2 Material and methods ... 173
6.2.1 Mice ... 173 6.2.2 Cell cultures ... 173 6.2.3 Western Blots ... 174 6.2.4 PCR ... 174 6.2.5 Immunohistochemistry / immunofluorescence ... 175 6.2.6 Contractile properties ... 176 6.2.7 Calcium measurements ... 176 6.2.8 SERCA activity ... 176 6.2.9 ELISA ... 177 6.2.10 Statistical analyses ... 177
6.3 Results and discussion ... 177
6.3.1 RANK/RANKL/OPG expression in healthy and wasted sketetal muscles. ... 177
6.3.2 Effect of RANK ablation on muscle contractile properties ... 178
6.3.3 Effect of RANK ablation on muscle fiber phenotype ... 179
6.3.4 RANK/RANKL interaction and Ca2+ signalling ... 180
6.3.5 RANK/RANKL interaction and Ca2+ handling proteins ... 180
6.3.5.1 Deletion of RANK favours expression of protein involved in Ca2+ uptake... 180
6.3.5.2 RANK deletion modifies SERCA phenotype and activity ... 181
6.3.6 RANK/RANKL interaction activates several signalling pathways ... 183
6.3.6.1 RANK influences different signalling pathways involved in fiber type determination 183 6.3.6.2 RANK influences signalling pathways involved in muscle wasting ... 183
6.4 Conclusion ... 184
6.5 References ... 185
6.6 Figures and legends ... 189
6.7 Supplementary figures, tables and legends ... 197
Chapitre 7 : Conclusion et perspectives ... 208
7.1 Impact des mastocytes sur le recrutement leucocytaire et la fonction musculaire dans un modèle de remise en charge post-hypogravité. ... 208
7.2 L’influence des neutrophiles sur la récupération des muscles atrophiés dans un modèle de remise en charge post-hypogravité. ... 211
7.3 L’impact des macrophages sur la récupération du muscle atrophié dans un modèle de remise en charge post-hypogravité. ... 213
7.3.1 La présence des macrophages est essentielle à la récupération musculaire optimale. ... 213
7.3.2 Le potentiel thérapeutique de l’optimisation de l’activité des macrophages ... 214
7.4 La triade RANK/RANKL/OPG, un nouvel acteur dans la physiopathologie musculaire. ... 216
7.4.1 La suppression de l’activité de RANK protège contre la dysfonction musculaire... 216
7.4.2 Potentiel thérapeutique des thérapies anti-RANK dans les pathologies musculaires. ... 219
7.5 Retour sur l’objectif principal ... 221
Bibliographie ... 222
Annexe 1 ... 247
Annexe 2 ... 248
Liste des tableaux
TABLE 2-1: THE IMPACT OF HINDLIMB UNLOADING AND RELOADING ON MUSCLE MASS AND
CONTRACTILE CHARACTERISTICS... 80
TABLE 3-1: DEPLETION OF CIRCULATING NEUTROPHILS FOLLOWING LY6G/LY6C ANTIBODY
INJECTION. ... 109
TABLE 3-2: INITIAL ABSOLUTE MUSCLE FORCE ... 110 TABLE 6-1: CONTRACTILE AND PHYSICAL PROPERTIES OF SOL AND EDL MUSCLES FOLLOWING
DENERVATION. ... 205
TABLE 6-2: CONTRACTILE AND PHYSICAL PROPERTIES OF SOL AND EDL MUSCLES INJECTED WITH
OPG IN MDX MICE. ... 206
TABLE 6-3 : CONTRACTILE AND PHYSICAL PROPERTIES OF SOL MUSCLE FOLLOWING HINDLIMB
Liste des figures
FIGURE 1-1 : STRUCTURE ET ORGANISATION GÉNÉRALE DU MUSCLE SQUELETTIQUE. ... 5
FIGURE 1-2: CARACTÉRISTIQUES GÉNÉRALES DES TYPES DE FIBRES MUSCULAIRES. ... 6
FIGURE 1-3 : CANAUX PRINCIPAUX CONTRÔLANT LE RELÂCHEMENT ET LA RECAPTATION DU CALCIUM LORS DU MÉCANISME D’EXCITATION : CONTRACTION MUSCULAIRE. ... 10
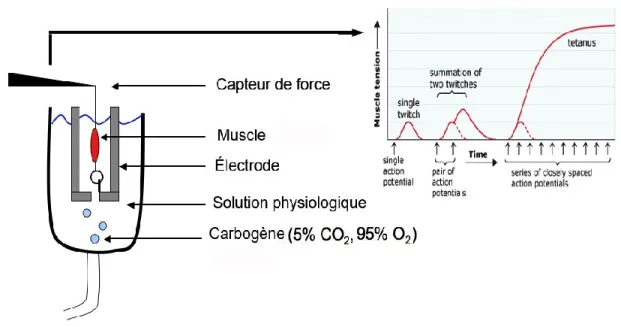
FIGURE 1-4 : SYSTÈME DE MESURE EX VIVO DES PROPRIÉTÉS CONTRACTILES DE MUSCLES SQUELETTIQUES. ... 17
FIGURE 1-5 : INTERACTIONS ENTRE LES PRINCIPALES VOIES DE DÉGRADATION PROTÉIQUE DANS LE MUSCLE SQUELETTIQUE. ... 25
FIGURE 1-6 : SIGNALISATION INTRACELLULAIRE DE LA VOIE AKT, LA PRINCIPALE VOIE DE SYNTHÈSE PROTÉIQUE DANS LE MUSCLE SQUELETTIQUE. ... 26
FIGURE 1-7 : PRINCIPALES ÉTAPES DE LA MYOGÉNÈSE DU MUSCLE SQUELETTIQUE ET LES FACTEURS MYOGÉNIQUES ASSOCIÉS. ... 28
FIGURE 1-8 : ÉVOLUTION DE LA SP0 ET DE LA RÉACTION INFLAMMATOIRE DANS LE MUSCLE SOL DE RONGEUR SOUMIS À UN PROTOCOLE D’HYPOGRAVITÉ ET DE REMISE EN CHARGE. ... 31
FIGURE 1-9 : ORIGINES, FONCTIONS ET MARQUEURS PRINCIPAUX DES DIFFÉRENTS PHÉNOTYPES DE MONOCYTES ET MACROPHAGES. ... 37
FIGURE 1-10 : L’INFLAMMATION ET LA MYOGENÈSE SONT DEUX PHÉNOMÈNES SE PRODUISANT EN PARALLÈLE. ... 39
FIGURE 1-11 : REPRÉSENTATION DES DIFFÉRENTES PHASES QUI CARACTÉRISENT LA RÉACTION INFLAMMATOIRE. ... 41
FIGURE 1-12 : PRINCIPALES VOIES SIGNALÉTIQUES ACTIVÉES PAR LA LIAISON RANK/RANKL. ... 46
FIGURE 1-13 : SIGNALISATION INTRACELLULAIRE DES PRINCIPALES VOIES SIGNALÉTIQUES DÉPENDANTES DU CALCIUM. ... 50
FIGURE 1-14 : EFFETS DES VOIES NF-KB CLASSIQUE ET ALTERNATIVE SUR LA DIFFÉRENTIATION ET LA FONCTION DES MYOBLASTES ET DES MYOTUBES. ... 53
FIGURE 2-1: MAST CELLS IN UNLOADED AND RELOADED SKELETAL MUSCLES. ... 74
FIGURE 2-2: MAST CELLS STABILIZATION AND LEUKOCYTE ACCUMULATION. ... 76
FIGURE 2-3: MAST CELLS AND RECOVERY OF MUSCLE CONTRACTILE PROPERTIES... 77
FIGURE 2-4: CMP 48/80 AND MAST CELL DEGRANULATION ... 78
FIGURE 2-5: CMP 48/80 AND LEUKOCYTE ACCUMULATION ... 79
FIGURE 3-1: BLOOD NEUTROPHIL DEPLETION ... 102
FIGURE 3-2: LEUKOCYTE ACCUMULATION FOLLOWING INJECTION OF LY6G/LY6C ANTIBODY ... 103
FIGURE 3-3: ATROPHIED MUSCLE RECOVERY IN NEUTROPHIL-DEPLETED MICE ... 104
FIGURE 3-4: EVOLUTION IN SOLEUS MUSCLE FORCE FOLLOWING 6 H OF INCUBATION WITH OR WITHOUT LPS... 105
FIGURE 3-5: CROSS-SECTIONS OF MOUSE SOLEUS MUSCLES STAINED WITH PROCION ORANGE DYE FOLLOWING 6 H OF INCUBATION. ... 106
FIGURE 3-6: PERCENTAGE OF INJURED MUSCLE FIBERS STAINED WITH PROCION ORANGE DYE FOLLOWING 6 H OF INCUBATION. ... 107
FIGURE 3-7: MYELOPEROXIDASE ACTIVITY OF SOLEUS MUSCLES INCUBATED WITH OR WITHOUT LPS FOR 4 H. ... 108
FIGURE 4-1: MACROPHAGE AND NEUTROPHIL CONCENTRATIONS IN CONTROL AND RELOADED SOLEUS MUSCLES ... 131
FIGURE 4-2 : ABSOLUTE AND SPECIFIC MUSCLE FORCE PRODUCTION IN CONTROL AND RELOADED SOLEUS MUSCLES ... 132
FIGURE 4-3: IDENTIFICATION OF MACROPHAGE PHENOTYPE USING COX-2 PROTEIN EXPRESSION ... 133
FIGURE 4-4: MYOTUBE DIAMETERS AND LENGTH IN MONO- AND CO-CULTURES FOLLOWING LOW SERUM MEDIUM-INDUCED MYOTUBE ATROPHY AND IGF-1 NEUTRALIZATION ... 134
FIGURE 4-5: PROTEIN CONTENT OF MYOTUBES ... 135
FIGURE 4-6: MYOSIN HEAVY CHAIN CONTENT OF MONO- AND CO-CULTURES FOLLOWING LOW SERUM MEDIUM-INDUCED MYOTUBE ATROPHY AND IGF-1 NEUTRALIZATION ... 136
FIGURE 5-1: NEUTROPHIL AND MACROPHAGE POPULATIONS FROM CONTROL AND RELOADED
SOLEUS MUSCLES ... 157
FIGURE 5-2: CONTRACTILE PROPERTIES AND FIBER DIAMETERS OF CONTROL AND RELOADED SOLEUS MUSCLES. ... 159
FIGURE 5-3: EXPRESSION OF MYOGENIC AND ATROPHIC PROTEINS IN AMBULATORY AND RELOADED SOLEUS MUSCLES ... 161
FIGURE 5-4: CHARACTERIZATION OF BMDM PHENOTYPES. ... 163
FIGURE 5-5: EVOLUTION OF MYOTUBE RECOVERY FROM ATROPHY... 164
FIGURE 5-6: PROTEIN SYNTHESIS AND DEGRADATION IN CULTURED MYOTUBES... 165
FIGURE 5-7: EXPRESSION OF MYOGENIC AND ATROPHIC PROTEINS IN CULTURED MYOTUBES. ... 166
FIGURE 6-1: RANK/RANKL/OPG TRIAD IN SKELETAL MUSCLE. ... 189
FIGURE 6-2: RANK CONTROLS MUSCLE FUNCTION AND FIBER TYPING... 191
FIGURE 6-3: RANK DEPLETION MODIFIES CALCIUM REGULATORY AND SIGNALLING PROTEINS. ... 193
FIGURE 6-4: THE EFFECTS OF RANK/RANKL INTERACTION ON DIFFERENT SIGNALLING PATHWAYS. ... 195
FIGURE S6-1 : DENERVATION DOES NOT AFFECT SIGNIFICANTLY RANKL/OPG RATIO IN THE SERUM. ... 197
FIGURE S6-2: THE EFFECT OF RANK DEPLETION ON FIBER TYPE PROPORTION FOLLOWING DENERVATION. ... 198
FIGURE S6-3: THE EFFECTS OF RANK/RANKL INTERACTION ON CALCIUM REGULATORY PROTEINS. ... 199
FIGURE S6-4 : RANK DEPLETION MODIFIES SERCA ISOFORM EXPRESSION. ... 200
FIGURE S6-5: THE EFFECTS OF RANK/RANKL INTERACTION TO DIFFERENT SIGNALLING PATHWAYS. ... 202
FIGURE S6-6 : RANK SIGNALLING PATHWAYS IN SKELETAL MUSCLES. ... 204
FIGURE 7-1 : ACTIONS INTRACELLULAIRES POTENTIELLES DE RANK DANS LE MUSCLE SQUELETTIQUE. ... 218
Liste des abréviations
[Ca2+]i Concentration intra-cytosolique en ions calcium
½ RT Half relaxation time 4E-BP1 eIF4E-binding protein ADN Acide désoxyribonucléique
ADP Adénosine diphosphate
AHA L-azidohomoalanine
AMPc/cAMP Adénosine monophosphate cyclique / Cyclic adenosine monophosphate ANOVA Analysis of variance
APC Allophycocyanin
ARNm/mRNA Acide ribonucléique messager / Messenger ribonucleic acid
ATP Adénosine triphosphate
Bax Bcl-2-associated X protein
bFGF Basic fibroblast growth factor BMDM Bone marrow-derived macrophage
CaMK Calmoduline kinase
CCR2 C-C chemokine receptor-2
CaMK Ca2+/calmodulin-dependent protein kinase CMP 48/80 Compound 48/80
COX Cyclooxygénase
CSQ Calséquestrine
CX3CR1 CX3C chemokine receptor-1
DAG Diacylglycérol
DAMP Damage-associated molecular pattern DHPR Dihydropyridine receptor
DMEM Dulbecco's Modified Eagle Medium
DMSO Diméthylsulfoxyde
E:C Excitation-contraction
EDL Extensor digitorium longus
EGTA Ethylene glycol tetraacetic acid
ERK1/2 Extracellular signal-regulated kinase 1/2 FACS Fluorescence Activated Cell Sorting FBS Fetal bovine serum
FITC Fluorescein isothiocyanate Fizz-1 Found in inflammatory zone-1 FKBP12 FK506 binding protein
fMLP N-Formyl-L-methionyl-L-leucyl-L-phenylalanine
FOXO Forkhead box O
GAPDH Glycéraldéhyde-3-phosphate déshydrogénase G-CSF Granulocyte-colony stimulating factor
GSK-3 Glycogen synthase kinase-3 HDAC Histone deacétylase
HS Horse serum
HU Hindlimb unloading
IFN- Interféron-
Ig Immunogène
IGF-1 Insulin growth factor-1
IGF-1R Insulin growth factor-1 receptor
IKK IkB kinase
IL Interleukine
i.m. intramusculaire
iNOS Inducible nitric oxide synthase i.p. Intrapéritonéal
IP3 Inositol 1,4,5-trisphosphate
IP3R Inositol 1,4,5-trisphospate receptor
i.v. intraveineux
JNK1 c-Jun N-terminal kinase-1
Lf Longueur des fibres
LPS Lipopolysaccharide
LXA4 Lipoxine-A4
MAPK Mitogen-activated protein kinase
mck Muscle creatine kinase
MCP-1 Macrophage chemoattractant protein-1 M-CSF Macrophage-colony stimulating factor MCU Mitochondrial Ca2+ uniporter
MIP Macrophage inflammatory protein
MLC Myosin light chain
MPC Myogenic precursor cells
MPO Myéloperoxidase
MPOC Maladie pulmonaire obstructive chronique mPTP Mitochondrial permeability transition pore MRF Myogenic regulatory factor
mTOR Mammalian target of rapamycin MuRF-1 Muscle ring finger-1
Myf-5 Myogenic factor-5
MyHC Myosin heavy chain
MyoD Myoblast determination protein
NADPH Nicotinamide adenine dinucleotide phosphate hydrogen
NCX Sodium-calcium exchanger
NFATc Nuclear factor of activated T-cells NF-kB Nuclear factor-kB
OPG Ostéoprotégérine
P0 Force maximale
p70S6K p70-ribosomal S6 kinase
PAF Platelet-activating factor
Pax7 Paired box 7
PBS Phosphate buffered saline
PE Phycoerythrin
PG Prostaglandine
Pi3K phosphoinositide 3-kinase
PIP2 Phosphatidyl-inositol-diphosphate
PKA, PKB, PKC Protéine kinase A/B/C
PLB Phospholamban
PLC Phospholipase C
PMCA Plasma membrane Ca2+ ATPase PVDF Polyvinylidene difluoride
RANK Receptor activator of NF-kB RANKL Receptor activator of NF-kB ligand
RS / SR Réticulum sarcoplasmique / Sarcoplasmic reticulum ROC Receptor-operated channel
ROS Reactive oxygen species
RPMI Roswell Park Memorial Institute medium RT-PCR Real-time polymerase chain reaction
RyR Ryanodine receptor
SAC Stretch-activated channels Sca-1 Stem cell antigen-1
SEM Standard error of the mean
Ser Sérine
SERCA Sarco-endoplasmic reticulum Ca2+ ATPase
SIDA/AIDS Syndrome de l'immunodéficience acquise / Acquired immunodeficiency syndrome
SLN Sarcolipine
SOC Store-operated channel
SOL Soléaire / Soleus
sP0 Force maximale spécifique
TGF- Tumor growth factor-
Thr Thréonine
TLR Toll like receptor
TNF- Tumor necrosis factor- TPT Time to peak tension
TRAF TNF receptor associated factor
TRAIL TNF-related apoptosis-inducing ligand TRP Transient receptor potential
VDAC Voltage dependent anion channel VEGF Vascular endothelial growth factor
Chapitre 1 : Introduction
1.1 Problématique
Le muscle squelettique représente en moyenne 36% et 45% de la masse corporelle totale de la femme et de l’homme, respectivement (1). Outre ses fonctions dans le mouvement et la locomotion, les muscles squelettiques servent également au support postural, à la respiration, au métabolisme et à la thermogenèse (2). Parmi ses nombreuses facultés, le muscle squelettique possède une capacité d’adaptation très élevée et peut modifier sa masse et son volume en fonction des stimuli mécaniques externes. Ainsi un entraînement en force, par exemple, induira une hypertrophie musculaire alors qu’à l’inverse un alitement prolongé entraînera une atrophie musculaire. Cette grande plasticité peut également être la source de nombreux problèmes dans plusieurs conditions et pathologies. À titre d’exemple, l’immobilisation d’un membre, les maladies pulmonaires obstructives chroniques (MPOC), l’insuffisance cardiaque, le SIDA, le cancer, l’hypogravité, l’alitement prolongé, la dénervation et le vieillissement peuvent tous entraîner une diminution de la masse et de la force musculaire (3-5). Une atrophie/dysfonction musculaire importante aura également de graves conséquences sur les fonctions respiratoires, rénales, métaboliques (diabète), osseuses (ostéoporose) et ultimement une dysfonction sévère de tous ces systèmes entraînera la mort de l’individu. En effet, il a été avancé qu’environ 30% des décès associés aux cancers sont causés par l’atrophie musculaire généralisée (6).
En plus des impacts néfastes importants sur la qualité de vie des patients, l’atrophie musculaire engendre un coût économique élevé expliqué par une perte de productivité et par des frais directs et indirects au système de santé. Par exemple, l’atrophie musculaire associée au vieillissement engendre un coût annuel estimé à 18 milliards de dollars au États-Unis seulement (7). De surcroît, il est possible de prévoir que le vieillissement de la population et l’augmentation de la sédentarité accroîtront encore plus la prévalence et la gravité des problèmes liés à l’atrophie/dysfonction musculaire.
La présente thèse portera plus particulièrement sur l’atrophie/dysfonction musculaire causée par la sous-utilisation et plus spécifiquement suite à des modèles d’hypogravité et de
dénervation. Ces deux conditions sont fréquemment rencontrées en réadaptation suite à une immobilisation par plâtre, à un alitement prolongé, ou à une lésion nerveuse. Différents types de traitement visant à promouvoir la croissance suite à une atrophie musculaire sont déjà utilisés en réadaptation tels que la supplémentation alimentaire en acides aminés essentiels (ex : leucine), les exercices physiques et fonctionnels, les thérapies hormonales, les modalités anti-inflammatoires et la stimulation électrique (8-12). Malheureusement, ces traitements ont une efficacité modérée et présentent souvent plusieurs effets secondaires laissant ainsi les professionnels de la santé à court d’outils pour contrer l’atrophie/dysfonction musculaire (13). Une meilleure compréhension des tenants et aboutissants associés à l’atrophie/dysfonction et à la récupération musculaire semble donc nécessaire pour améliorer les traitements offerts aux patients.
Dans cette optique, la présente thèse vise à apporter une contribution à l’avancement des connaissances sur certains processus méconnus et négligés liés à l’atrophie/dysfonction musculaire, afin d’optimiser les traitements actuels et d’ouvrir de nouvelles avenues thérapeutiques. L’introduction de cette thèse permettra au lecteur de se familiariser avec les différents concepts nécessaires à la compréhension des prochains chapitres, soit : la structure et la fonction du muscle squelettique (section 1.2), les mécanismes d’atrophie/dysfonction et de croissance musculaire (section 1.3), les différents acteurs inflammatoires (section 1.4) et les interactions entre les systèmes musculaires et osseux en lien avec la triade RANK/RANKL/OPG (section 1.5). Le cœur de la thèse sera constitué des articles portant sur l’impact des mastocytes (chapitre 2), des neutrophiles (chapitre 3) et des macrophages (chapitres 4 et 5) dans l’atrophie/dysfonction et la croissance musculaire. De plus, les rôles et fonctions et de la triade RANK/RANKL/OPG dans l’atrophie/dysfonction seront abordés au chapitre 6. Finalement, une dernière section est réservée à la conclusion et aux perspectives qu’offrent ces résultats de recherche (chapitre 7).
1.2 Structure et fonction du muscle squelettique
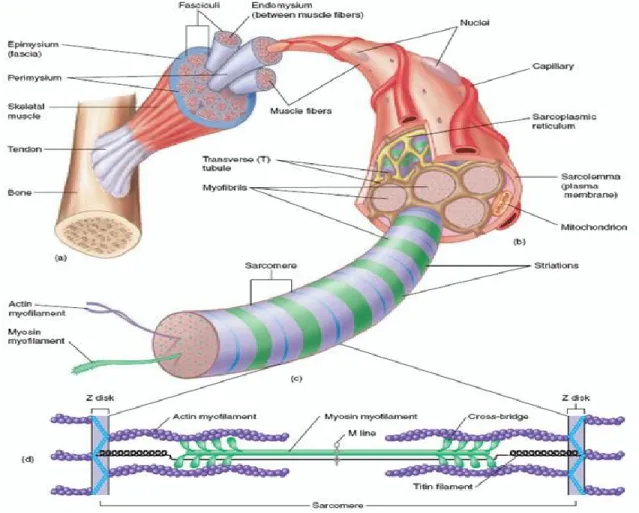
1.2.1 Composition musculaire : du muscle au sarcomère
Globalement, les muscles squelettiques sont composés majoritairement de longues cellules cylindriques nommées fibres musculaires, d’un réseau organisé de vaisseaux sanguins et de nerfs, ainsi que d’une matrice extracellulaire. Les muscles squelettiques sont très structurés et chaque muscle est sous-divisé en quelques centaines à plusieurs milliers de faisceaux musculaires qui, à leur tour, comprennent environ une dizaine à une centaine de fibres musculaires (Figure 1-1) (14). Le muscle, les faisceaux et les fibres musculaires sont chacun enveloppés par une membrane de tissu conjonctif nommée respectivement épimysium, périmysium et endomysium. Ces membranes sont constituées principalement de collagène de type I et III (15). Sous l’endomysium, la fibre musculaire possède également sa propre membrane, le sarcolemme, doté d’une couche externe, la membrane basale (constituée de collagène, fibronectine, laminine et de nombreuses glycoprotéines) et d’une couche interne, la membrane plasmique (double couche de phospholipide) (2). Les différentes enveloppes conjonctives jouent des rôles de support structural, de protection contre les stress mécaniques, d’isolant électrique et confèrent également l’élasticité au muscle. De plus, leur prolongement forme le tendon qui sert à transmettre la force jusqu’à l’os pour permettre le mouvement.
La fibre musculaire possède de nombreuses caractéristiques qui la distinguent des autres cellules du corps. Premièrement, le diamètre des fibres est très variable (entre 10 et 100 m chez l’homme) et leur longueur l’est encore plus (entre 2 mm et 30 cm, chez l’homme) (2). Cette morphologie distinctive confère de nombreuses particularités à la fibre musculaire. Tout d’abord, la fibre musculaire est multinucléée afin de répondre à la grande demande en synthèse protéique de la cellule. Les noyaux se retrouvent au pourtour de la fibre directement sous la membrane plasmique. Le nombre de noyaux varie en fonction du diamètre et de la longueur de la fibre et plusieurs études indiquent que chaque noyau couvre un territoire relativement constant, soit environ 2x104 à 5x104 m3 (16-18). Cependant, cette dernière affirmation reste controversée puisque d’autres études révèlent que sous certaines conditions une faible corrélation existe entre la taille des fibres et le nombre de noyaux (19). Une autre particularité de la fibre musculaire est son état
post-mitotique, c’est-à-dire qu’elle ne peut pas se diviser par mitose. Afin d’assurer sa croissance et sa régénération, la fibre musculaire possède de nombreuses cellules satellites localisées entre le sarcolemme et la membrane basale. Celles-ci représentent entre 2 à 10% des noyaux musculaires, soit environ 2x105 à 1x106 cellules satellites / gramme de muscle, dépendamment du muscle, de l’âge et de l’espèce (20). Bien que les cellules satellites soient quiescentes à l’état de repos, elles sont commises à devenir des cellules musculaires suite à leur activation par un traumatisme, un stress mécanique ou un stimulus de croissance musculaire (21).
Le cytoplasme de la fibre est constitué majoritairement (à 85%) de centaines de myofibrilles regroupées en parallèle entre lesquelles se retrouvent les organelles (ex : mitochondries), le cytosquelette, des granules de glycogène et des gouttelettes de lipides (Figure 1-1) (2). Le diamètre des myofibrilles est relativement constant entre 1 et 2 micromètres et le nombre de myofibrilles est le déterminant principal de la grosseur de la fibre (22). Chaque myofibrille est entourée d’un reticulum sarcoplasmique (RS) servant d’entrepôt pour le calcium. Les myofibrilles sont constituées d’un bout à l’autre par des sarcomères arrangés en séries. Le sarcomère représente l’unité contractile de base de la fibre musculaire grâce à la présence des filaments minces et épais. Les filaments minces sont composés de deux chaînes d’actine assemblées en spirale, entourées d’une molécule filiforme nommée tropomyosine qui comporte à intervalle régulier des complexes protéiques appelés troponine (C, T et I). Les filaments minces sont attachés à une extrémité à des protéines d’alpha-actinine qui forment les bordures extérieures des sarcomères que l’on appelle disques Z. Les filaments épais sont composés de molécules de myosine constituées de deux chaînes lourdes de myosine (« myosin heavy chain », MyHC) formant le corps et les têtes du filament et de quatre chaînes légères de myosine (« myosin light chain », MLC) qui s’attachent au niveau du cou des chaînes lourdes. Les chaînes lourdes sont ancrées au centre du sarcomère à la ligne M qui est formée principalement de protéine M, de créatine kinase musculaire, de skelemine et de myomésine. Les chaînes lourdes et légères se chevauchent partiellement dans les sarcomères, mais leur interaction est limitée par la présence du complexe troponine-tropomyosine qui masque les sites de liaison de la myosine sur l’actine afin de limiter la contraction.
Plusieurs protéines constituent le cytosquelette de la fibre musculaire et jouent un rôle important dans le maintien de la structure et de l’intégrité de la fibre à l’état de repos et pendant la contraction. Par exemple, les filaments intermédiaires, principalement constitués de desmine, entourent les disques Z des sarcomères et les relient soit à une autre myofibrille, à une organelle (ex : mitochondries) ou au sarcolemme (23). La dystrophine, les laminines et les intégrines sont des protéines structurales très importantes qui font le lien entre le cytosquelette et la matrice extracellulaire. Leur rôle est très important pour la transmission de la force et le maintien de l’intégrité musculaire (24-26). La matrice extracellulaire, quant à elle, sert de support aux cellules. Elle est composée principalement de glycoaminoglycanes, de protéoglycanes, de collagène, d’élastine et de glycoprotéines. En plus du rôle de support structural, la matrice extracellulaire est également impliquée dans les propriétés mécaniques du muscle, dans la migration cellulaire, dans la signalisation cellulaire et dans l’entreposage de facteurs de croissance (27).
1.2.2 Phénotype des fibres musculaires
Avant de poursuivre plus en détail l’analyse de la structure et de la fonction musculaire, il est important de mettre en évidence le fait qu’il existe différents types de fibres musculaires. En effet, il a été observé il y a plus d’un siècle par le scientifique français Louis Antoine Ranvier que les lapins possédaient des muscles rouges, dont la contraction était lente et soutenue, et des muscles blancs, dont la contraction était plus rapide et de plus courte durée (28). Depuis ce temps beaucoup de scientifiques se sont attardés aux différences entre les fibres blanches et rouges et une classification basée sur les propriétés contractiles et sur le métabolisme a été développée (Figure 1-2). Ainsi, quatre types de fibres sont généralement reconnus, soit les fibres de type I, IIA, IIX et IIB (29). Les fibres de type I sont stimulées à basse fréquence par le motoneurone (environ 20 Hz) et ont une contraction lente pouvant être soutenue pendant une longue période de temps, ainsi qu’un métabolisme oxydatif (30). À l’opposé, les fibres de type IIX et IIB sont stimulées à haute fréquence par le motoneurone (environ 100 Hz), ont une contraction rapide, sont peu endurantes et possèdent un métabolisme glycolytique. Les fibres de type IIB ne se retrouvent pas chez l’homme mais sont très présentes chez de nombreuses autres espèces dont les rongeurs. Les fibres IIA sont plutôt du type intermédiaire avec une contraction rapide, une endurance moyenne et un métabolisme autant oxydatif que glycolytique. La proportion en chaque type de fibre des muscles varie en fonction de la tâche que doit remplir ce muscle. Ainsi, les muscles posturaux comme le soléaire (SOL) contiennent une quantité élevée de fibres lentes (90% chez l’homme, 85% chez le rat et 40-50% chez la souris), alors que les muscles ayant plutôt des rôles phasiques comme l’extenseur des orteils (« extensor digitorium longus », EDL) possèdent une quantité élevée de fibres de type IIX/IIB (40% chez l’homme, 55% chez le rat et 80% chez la souris) (31).
Cependant la proportion des différents types de fibre n’est pas définitive dans un muscle et peut être influencée par la génétique et par l’environnement. La composante génétique s’observe facilement sur la ligne de départ d’un marathon où l’on retrouve souvent une grande quantité d’africains de l’est (ex : Éthiopie, Kenya) comparativement à la ligne de départ d’un 100 m qui regroupe beaucoup plus d’individus ayant des origines d’Afrique de l’ouest (ex : Côte d’Ivoire, Sénégal, Nigéria). D’une façon plus objective, il a été démontré que les caucasiens possèdent une proportion significativement plus élevée en fibres de type I et moins élevée en fibres IIA que les afro-américains (provenant surtout de l’Afrique de l’ouest) (32). À la composante génétique s’ajoute la composante environnementale qui peut grandement influencer la distribution des types de fibre musculaire. Parmi les facteurs influençant le type de fibre on retrouve l’activité neuronale, le stress mécanique, ainsi que la composante hormonale. L’exercice physique est un excellent exemple de stimulus pouvant influencer le phénotype des fibres musculaires. Par exemple, un entraînement en force tel que le « bodybuilding » provoque une transition partielle des fibres de type I au profit des fibres de type IIX, alors qu’un entraînement aérobique favorise la transition des fibres IIB vers les fibres I et IIA (33, 34). Les conditions atrophiques peuvent également influencer la distribution des types de fibres. Par exemple, une période de sous-utilisation (ex : apesanteur, alitement, immobilisation) entraîne un changement du type de fibre de lent vers rapide, associé à une atrophie musculaire supérieure dans les fibres lentes (35). À l’inverse, certaines conditions comme le vieillissement induisent plutôt une atrophie plus importante des fibres de type II, ainsi qu’une augmentation de la proportion des fibres de type I au détriment du type II (36).
Cependant, les différences entre les types de fibres musculaires ne se limitent pas seulement au métabolisme et au type de myosine. En effet, plusieurs autres différences peuvent être observées, particulièrement en ce qui a trait aux nombreuses protéines régulant le système excitation : contraction (E:C) (37). Le système E:C englobe les processus physiologiques neuromusculaires permettant la transformation du stimulus électrique en une réponse mécanique. Le fonctionnement du système E:C et les distinctions entre les différents phénotypes musculaires seront abordés dans les prochaines sections.
1.2.3 Cycle excitation / contraction / relaxation
1.2.3.1 Relâchement du calciumBien que 99% du calcium du corps soit entreposé dans les os, le calcium libre régule plusieurs processus physiologiques comme la signalisation intracellulaire, l’activité enzymatique, la croissance/prolifération cellulaire et l’apoptose de nombreux types cellulaires (38). Dans le muscle squelettique, le calcium est également la molécule clé de la contraction musculaire. Des mécanismes précis et ordonnés contrôlent le relâchement et la captation du calcium intramusculaire (39). À l’état de repos, la concentration de calcium intracellulaire ([Ca2+]i) est très faible dans le cytosol (10-7 M). Le calcium est plutôt
entreposé en grande concentration à l’extérieur de la cellule (10-3 M), dans les mitochondries (10-5 M) ou dans des réservoirs intracellulaires (entre 10-3 et 10-4 M) appelés citernes terminales du RS qui englobent chaque myofibrille (40, 41). D’autres ions comme le Na+ et le Cl- se retrouvent également en plus grande quantité à l’extérieur de la cellule, alors que le K+ est plus concentré dans la cellule, ce qui confère à la cellule une polarisation membranaire nette de -90 mV (42).
La stimulation électrique d’un nerf permettra le relâchement d’acétylcholine dans la fente synaptique par le bouton terminal de l’axone. Les récepteurs à l’acétylcholine situés sur la membrane plasmique vont provoquer l’ouverture des canaux ioniques sodiques et induire conséquemment une dépolarisation du potentiel membranaire passant temporairement de -90 mV à +30 mV. Le potentiel d’action se propagera alors à travers toute la fibre musculaire grâce à la présence de milliers d’invaginations dans la membrane sarcoplasmique, nommées tubules T. Les tubules T sont rattachés à la citerne terminale du RS qui contient une grande quantité de calcium. Le potentiel d’action membranaire va provoquer un changement de conformation des récepteurs à la dihydropyridine (DHPR) qui sont sensibles aux variations de voltage. Ce changement de conformation des DHPR va se transmettre à des canaux calciques situés sur la citerne terminale, les récepteurs à la ryanodine de type 1 (« ryanodine receptor-1 », RyR1), grâce à l’interaction physique entre les deux types de récepteurs (43). Le RyR1 est un tétramère dont chacune des 4 portions est reliée par la présence d’une petite protéine régulatrice nommée « FK506 binding protein » (FKBP12, aussi appelé calstabine). Le FKBP12 régule l’activité du RyR1 en rendant plus
lente et plus difficile l’ouverture du canal calcique tout en augmentant la conductibilité et la stabilité du récepteur une fois ouvert (44). L’ouverture rapide des RyR1 entraîne la libération du calcium contenu dans le RS, faisant passer la [Ca2+]i de 10-7 à 10-5.
Bien que plus marginaux, d’autres canaux ioniques peuvent également participer à la libération du calcium du RS. Ainsi, le récepteur pour l’inositol 1,4,5-trisphospate (IP3R)
n’est pas sensible au voltage mais peut être stimulé par l’inositol 1,4,5-trisphospate (IP3)
provenant de l’activation de la phospholipase C (PLC) par un récepteur couplé à une protéine G (45). L’activation des IP3R permet le relâchement de calcium de façon lente et
graduelle et ses effets seraient beaucoup plus importants dans le maintien de l’homéostasie que dans la contraction musculaire (46). Tout comme pour les RyR1, le FKBP12 jouerait également un rôle stabilisateur sur les IP3R (47).
Dans le muscle squelettique, la libération du calcium d’origine intracellulaire est le mécanisme principal induisant la contraction musculaire (48). Bien que la présence de calcium dans le milieu extracellulaire ne soit pas nécessaire afin d’induire la contraction, certaines études ont démontré une fatigabilité accrue lors de contractions prolongées en absence de calcium extracellulaire ex vivo (49, 50). Parmi les canaux contrôlant l’entrée de calcium à partir de l’espace extracellulaire se trouve les « transient receptor potential » (TRP) qui comporte 7 sous-familles de récepteurs cationiques membranaires qui sont principalement perméables aux ions Ca2+. Ces canaux ne sont pas sensibles au voltage et sont plutôt activés : 1) par des ligands (« receptor-operated channel », ROC), 2) par le stress mécanique (« stretch-activated channel », SAC), ou 3) par la vidange des réserves internes de calcium du RS (« store-operated channel », SOC) (51). Ces mécanismes ont été décrits initialement dans les cellules non-contractiles, mais il a été démontré plus récemment qu’ils avaient aussi un rôle à jouer dans le muscle squelettique (52, 53).
1.2.3.2 Contraction musculaire
En période de repos la contraction musculaire est inhibée par la présence du complexe troponine-tropomyosine sur le filament d’actine. Le calcium libéré massivement du RS par les RyR1 ira se lier à la troponine C induisant un changement de conformation du complexe
troponine-tropomyosine et la libération des sites de liaison de la MyHC sur les filaments d’actine (54). Il est à noter que la sensibilité des myofilaments au calcium peut être modulée en fonction de différentes variables comme la température, le pH, la longueur des sarcomères et le niveau de phosphorylation des MLC (55). Ensuite, la formation d’un complexe actomyosine entraînera l’activation de l’activité ATPase de la MyHC et la libération rapide d’une molécule d’adénosine diphosphate (ADP) et d’un phosphate inorganique. Le passage de la MyHC d’une haute à une faible teneur énergétique induira l’inclinaison de la tête de la MyHC de 90° à 45° provoquant le glissement de l’actine en direction de la ligne M et conséquemment le raccourcissement du sarcomère. La fixation d’une nouvelle molécule d’adenosine triphosphate (ATP) sur la tête de la MyHC diminuera l’affinité actine-myosine ce qui déclenchera le détachement du pont et le retour de la MyHC à haute teneur énergétique dans sa position originelle. La recaptation du calcium cytosolique est nécessaire afin de permettre le retour du muscle à l’état de repos.
1.2.3.3 Recaptation du calcium
La fibre musculaire possède plusieurs mécanismes permettant de diminuer la [Ca2+]i, soit :
la recaptation du calcium dans le RS, la sortie du calcium dans l’espace extracellulaire, l’accumulation du calcium dans les mitochondries et finalement la présence de tampon calcique dans le cytosol (Figure 1-3).
Figure 1-3 : Canaux principaux contrôlant le relâchement et la recaptation du calcium lors
La majeure partie du calcium contenu dans le cytosol (70 à 80%) sera retournée dans le RS grâce à la pompe « sarco-endoplasmic reticulum Ca2+ ATPase » (SERCA) (57). Le gradient de concentration de calcium étant très élevé entre le RS et le cytosol, SERCA a besoin de l’énergie libérée par l’hydrolyse de l’ATP pour pomper le calcium contre le gradient de concentration (58). Pour faciliter le travail de la pompe SERCA, le gradient de concentration à l’intérieur du RS est diminué grâce à la présence de calséquestrine (CSQ), une molécule qui a la capacité de lier de nombreux ions calcium (40 à 80 ions) (59). L’activité de la pompe SERCA est limitée par la présence d’une petite protéine, le phospholamban (PLB), qui diminue l’affinité de SERCA pour le calcium (60). L’activité inhibitrice du PLB sur SERCA peut être diminuée par la phosphorylation du phospholamban (p-PLB) sur son site sérine-16 (ser-16) par la voie de signalisation protéine kinase A (PKA) ou encore sur son site thréonie-17 (thr-17) par la voie « Ca2+ /calmodulin-dependent protein kinase II » (CaMKII) (61). Il existe également un homologue fonctionnel du PLB, la sarcolipine (SLN) qui joue un rôle similaire sur la régulation de l’activité de SERCA malgré que son affinité pour SERCA soit plus faible que celle du PLB (62). Cependant, la SLN possède un site de liaison sur SERCA et aussi sur PLB et la combinaison de PLB et SLN optimise encore plus leur potentiel inhibiteur (60). La phosphorylation de la SLN sur son site thréonine-5 par la CaMKII libère son activité inhibitrice sur SERCA (63).
Par la suite, le calcium peut également être retiré du cytosol grâce à des canaux calciques membranaires permettant les échanges ioniques entre l’intra et l’extracellulaire. Un des principaux canaux est l’échangeur sodium-calcium (NCX) qui se sert du gradient électrochimique du sodium pour exporter un ion calcium en échange de l’importation de trois ions sodium (64). Généralement, ce canal sert à expulser les ions calciques vers le milieu extracellulaire, cependant il peut aussi fonctionner en mode inverse lorsque la membrane est dépolarisée et que la [Na+]i est élevée (65). Une autre pompe, la « plasma
membrane Ca2+ ATPase » (PMCA), quant à elle, se sert de l’énergie de l’ATP pour sortir les ions calcium de la cellule (2 ions Ca2+ pour 1 ATP) (66). La pompe NCX possède une faible affinité pour le calcium mais une grande capacité de transport, alors qu’inversement la pompe PMCA a une grande affinité pour le calcium mais une faible capacité de transport
(67). Cette complémentarité entre les pompes est très utile pour la cellule. En effet, la pompe NCX est particulièrement utile lorsque la [Ca2+]i est très élevée, alors que la pompe
PMCA sert plutôt à l’homéostasie du calcium en période de repos (67).
Les mitochondries ont également leur rôle à jouer dans la gestion du calcium. En effet, la fibre musculaire se compose de deux phénotypes de mitochondries. Les premières ont une forme plutôt allongée et se retrouvent à proximité des citernes terminales du RS et les secondes ont un plus gros diamètre et sont localisées dans l’ensemble de la fibre (68). Des analyses plus approfondies ont démontré que les mitochondries à proximité des citernes terminales sont en fait physiquement reliées au RS et possèdent la capacité de capter le calcium relâché par le RS (69). L’influx de calcium à travers la membrane externe de la mitochondrie se fait grâce aux canaux « voltage dependent anion channel » (VDAC) et le transport à travers la membrane interne de la mitochondrie se produit principalement à l’aide des canaux « mitochondrial Ca2+ uniporter » (MCU). La proximité des mitochondries avec la source principale de calcium (le RS), ainsi que la différence de potentiel des mitochondries (-180 mV) facilitent l’influx rapide des ions calciques vers celles-ci (70). L’efflux de calcium des mitochondries est beaucoup plus lent et se produit plutôt à l’aide des canaux NCX (71). La sommation de la captation de calcium par l’ensemble des mitochondries pourrait compter jusqu’à 10% de la captation totale du calcium et serait assez importante pour influencer la vitesse de relaxation, ainsi que l’intensité et la fréquence des excitations calciques (« calcium sparks »), dans les fibres riches en mitochondries (72, 73).
Finalement, la parvalbumine, une autre petite protéine du cytosol, possède une forte affinité pour le calcium (10-8 M) et peut jouer un rôle de tampon calcique. La parvalbumine ne se retrouve pas chez l’homme, mais elle est présente dans les muscles rapides de plusieurs mammifères comme les rongeurs (74). L’implication de la parvalbumine dans la relaxation du muscle est encore controversée, mais il est suggéré qu’elle joue un rôle suffisamment important dans la recaptation du calcium pour influencer partiellement la vitesse de contraction et de relaxation musculaire dans certains muscles comme l’EDL de souris (75, 76).
1.2.3.4 Calcium et types de fibres
Le calcium est géré de façon différente chez les fibres lentes et rapides. À titre d’exemple, au repos la [Ca2+]i est environ deux fois plus élevée dans les muscles lents que dans les
muscles rapides (77, 78). Cette augmentation de la [Ca2+]i est associée, entre autre, à une
plus grande perméabilité des canaux SAC localisés sur la membrane plasmique (78). Cependant, les fibres à contraction rapide libèrent et recaptent le calcium d’une façon plus brève et massive que les fibres lentes (37, 79). Ainsi, plusieurs différences existent entre les fibres lentes et rapides en regard à l’expression des protéines régulatrices du calcium. Par exemple, au niveau du relâchement du calcium, les fibres rapides possèdent plus de DHPR (3 à 5 fois plus) et de RyR1 (2 fois plus) que les fibres lentes rendant la libération du calcium du RS plus rapide (37, 80). De plus, les fibres rapides possèdent un RS beaucoup plus vaste que les lentes (81).
Les protéines impliquées dans la contraction musculaire sont également exprimées différement selon le type de fibre. Premièrment, les fibres rapides possèdent des isoformes rapides de MyHC qui hydrolysent l’ATP et libèrent l’ADP beaucoup plus promptement que l’isoforme lent de MyHC rendant la contraction plus puissante (82). Deuxièmement, la sensibilité au calcium est différente entre les fibres rapides et lentes, malgré qu’il soit difficile de tirer des conclusions définitives de la littérature à cause du grand nombre de facteurs pouvant affecter la sensibilité au calcium (température, acidité, longueur des sarcomères, etc.) (37). Globalement, les fibres lentes initient leur contraction à une plus faible [Ca2+]i que les fibres rapides, toutefois la pente d’augmentation de la force en
fonction de la [Ca2+]i est beaucoup plus abrupte dans les fibres rapides (83). Les différents
isoformes des protéines contractiles et les modifications post-translationnelles de ces protéines seraient responsables de cette réponse accrue des fibres rapides à l’augmentation de la [Ca2+]i. Par exemple, la troponine C de type rapide possède un site de liaison de plus
pour le calcium que la troponine C de type lente, ce qui facilite le déplacement de la tropomyosine (37). De plus, certaines modifications post-translationnelles, comme la phosphorylation de protéines telles la MLC, la tropomyosine et la troponine augmentent la sensibilité au calcium et sont plus importantes dans les muscles rapides (84).