U.F.R. DE SANTE DE ROUEN NORMANDIE --- ANNEE UNIVERSITAIRE 2018 2019 N° : THESE POUR LE DOCTORAT EN MEDECINE Par BASSE Clémence Née le 24/12/1984 à Suresnes (92)
PRESENTEE ET SOUTENUE PUBLIQUEMENT LE 4 OCTOBRE 2019
Radiothérapie post-opératoire pour les tumeurs épithéliales thymiques : données RYTHMIC
PRESIDENT DU JURY : Pr Frédéric Di Fiore
DIRECTEURS DE THESE : Dr SuzannaBota& Dr Sébastien Thureau MEMBRES DU JURY : Pr Luc Thiberville, Pr Bernard Dubray
Titre : Radiothérapie post-opératoire pour les tumeurs thymiques : données RYTHMIC
Résumé :
Introduction. Les tumeurs épithéliales thymiques sont des tumeurs rares intrathoraciques pour lesquelles le traitement principal est la chirurgie. La radiothérapie post-opératoire (PORT) fait partie du traitement en cas de tumeurs agressives ou de résection incomplète. La base de données RYTHMIC recense les patients atteints de tumeurs thymiques sur le territoire précédemment étudié, sur 274 patients, si la décision de réaliser une PORT était concordante avec les recommandations de et si les modalités de la PORT suivaient les recommandations internationales. Méthodes. Grâce à un suivi de 5 ans de cette même cohorte, nous analysons ici la survie sans récidive (RFS) ainsi que la survie globale (OS)
thymome. Résultats. Sur les 274 patients analysés, 84 patients ont été perdus de vue et 3 . Après un suivi médian de 5,1 années, 39 (21%) ont récidivé. La survie sans récidive est de 41,1mois (95% CI : 29,2-53,0). Concernant la majorité des récidives, elles étaient localisées dans la plèvre pour le groupe PORT (n=12 soit 44%), versus dans le médiastin pour le groupe non-PORT (n=8 soit 67%) laissant penser que la PORT puisse réduire les récidives médiastinales. La étaient significativement inférieure en cas de résection incomplète (p=0,04 et p=0,002). Nous avons observé 12 décès. Conclusion. Ce travail montre un risque de
initiaux prédisent mal la récidive. En revanche la chirurgie incomplète reste le facteur pronostic et prédictif majeur de rechute.
Mots-clés : tumeur épithéliale thymique, thymome, carcinome thymique, radiothérapie post-opératoire, classification
Jury : Pr Frédéric Di Fiore (président), Pr Bernard Dubray, Pr Luc Thiberville, Dr Suzanna Bota (co-directrice), Dr Sébastien Thureau (co-directeur)
U.F.R. DE SANTE DE ROUEN NORMANDIE --- ANNEE UNIVERSITAIRE 2018 2019 N° : THESE POUR LE DOCTORAT EN MEDECINE Par BASSE Clémence Née le 24/12/1984 à Suresnes (92)
PRESENTEE ET SOUTENUE PUBLIQUEMENT LE 4 OCTOBRE 2019
Radiothérapie post-opératoire pour les tumeurs épithéliales thymiques : données RYTHMIC
PRESIDENT DU JURY : Pr Frédéric Di Fiore
DIRECTEURS DE THESE : Dr Suzanna Bota & Dr Sébastien Thureau MEMBRES DU JURY : Pr Luc Thiberville, Pr Bernard Dubray
Par délibération en date du 3 mars 1967, la faculté a arrêté que les opinions émises dans les dissertations qui lui seront présentées doivent être considérées comme propres à leurs auteurs
ANNEE UNIVERSITAIRE 2018 - 2019 U.F.R. SANTÉ DE ROUEN
---
DOYEN : Professeur Benoît VEBER
ASSESSEURS : Professeur Michel GUERBET
Professeur Agnès LIARD-ZMUDA Professeur Guillaume SAVOYE
I - MEDECINE
PROFESSEURS DES UNIVERSITES PRATICIENS HOSPITALIERS
Mr Frédéric ANSELME HCN Cardiologie Mme Gisèle APTER Havre Pédopsychiatrie Mme Isabelle AUQUIT AUCKBUR HCN Chirurgie plastique Mr Jean-Marc BASTE HCN Chirurgie Thoracique
Mr Fabrice BAUER HCN Cardiologie
Mme Soumeya BEKRI HCN Biochimie et biologie moléculaire Mr Ygal BENHAMOU HCN Médecine interne
Mr Olivier BOYER UFR Immunologie
Mme Sophie CANDON HCN Immunologie
Mr François CARON HCN Maladies infectieuses et tropicales Mr Philippe CHASSAGNE HCN Médecine interne (gériatrie)
Mr Vincent COMPERE HCN Anesthésiologie et réanimation chirurgicale Mr Jean-Nicolas CORNU HCN Urologie
Mr Antoine CUVELIER HB Pneumologie
Mr Jean-Nicolas DACHER HCN Radiologie et imagerie médicale
Mr Stéfan DARMONI HCN Informatique médicale et techniques de communication
Mr Pierre DECHELOTTE HCN Nutrition Mr Stéphane DERREY HCN Neurochirurgie Mr Frédéric DI FIORE HCH-CB Cancérologie
Mr Fabien DOGUET HCN Chirurgie Cardio Vasculaire
Mr Jean DOUCET SJ Thérapeutique - Médecine interne et gériatrie Mr Bernard DUBRAY CB Radiothérapie
Mr Frank DUJARDIN HCN Chirurgie orthopédique - Traumatologique Mr Fabrice DUPARC HCN Anatomie - Chirurgie orthopédique et
traumatologique
Mr Eric DURAND HCN Cardiologie
Mr Bertrand DUREUIL HCN Anesthésiologie et réanimation chirurgicale Mme Hélène ELTCHANINOFF HCN Cardiologie
Mr Manuel ETIENNE HCN Maladies infectieuses et tropicales Mr Thierry FREBOURG UFR Génétique
Mr Pierre FREGER HCN Anatomie - Neurochirurgie Mr Jean François GEHANNO HCN Médecine et santé au travail
Mr Emmanuel GERARDIN HCN Imagerie médicale Mme Priscille GERARDIN HCN Pédopsychiatrie M. Guillaume GOURCEROL HCN Physiologie Mr Dominique GUERROT HCN Néphrologie Mr Olivier GUILLIN HCN Psychiatrie Adultes Mr Didier HANNEQUIN HCN Neurologie
Mr Claude HOUDAYER HCN Génétique
Mr Fabrice JARDIN CB Hématologie
Mr Luc-Marie JOLY HCN
Mr Pascal JOLY HCN Dermato Vénéréologie Mme Bouchra LAMIA Havre Pneumologie
Mme Annie LAQUERRIERE HCN Anatomie et cytologie pathologiques Mr Vincent LAUDENBACH HCN Anesthésie et réanimation chirurgicale Mr Joël LECHEVALLIER HCN Chirurgie infantile
Mr Hervé LEFEBVRE HB Endocrinologie et maladies métaboliques Mr Thierry LEQUERRE HB Rhumatologie
Mme Anne-Marie LEROI HCN Physiologie Mr Hervé LEVESQUE HB Médecine interne Mme Agnès LIARD-ZMUDA HCN Chirurgie infantile Mr Pierre Yves LITZLER HCN Chirurgie cardiaque
Mr Bertrand MACE HCN Histologie, embryologie, cytogénétique
M. David MALTETE HCN Neurologie
Mr Christophe MARGUET HCN Pédiatrie
Mme Isabelle MARIE HB Médecine interne Mr Jean-Paul MARIE HCN Oto-rhino-laryngologie Mr Loïc MARPEAU HCN Gynécologie / Obstétrique
Mr Stéphane MARRET HCN Pédiatrie Mme Véronique MERLE HCN Epidémiologie
Mr Pierre MICHEL HCN Hépato-gastro-entérologie M. Benoit MISSET (détachement) HCN Réanimation médicale Mr Jean-François MUIR (surnombre) HB Pneumologie
Mr Marc MURAINE HCN Ophtalmologie
Mr Christophe PEILLON HCN Chirurgie générale Mr Christian PFISTER HCN Urologie
Mr Jean-Christophe PLANTIER HCN Bactériologie - Virologie Mr Didier PLISSONNIER HCN Chirurgie vasculaire Mr Gaëtan PREVOST HCN Endocrinologie
Mr Jean-Christophe RICHARD (détachement) HCN Réanimation médicale - Médecine
Mr Vincent RICHARD UFR Pharmacologie
Mme Nathalie RIVES HCN Biologie du développement et de la reproduction Mr Horace ROMAN (disponibilité) HCN Gynécologie - Obstétrique
Mr Jean-Christophe SABOURIN HCN Anatomie - Pathologie Mr Guillaume SAVOYE HCN Hépato-gastrologie Mme Céline SAVOYE COLLET HCN Imagerie médicale Mme Pascale SCHNEIDER HCN Pédiatrie
Mr Michel SCOTTE HCN Chirurgie digestive Mme Fabienne TAMION HCN Thérapeutique Mr Luc THIBERVILLE HCN Pneumologie Mr Christian THUILLEZ (surnombre) HB Pharmacologie
Mr Hervé TILLY CB Hématologie et transfusion M. Gilles TOURNEL HCN Médecine légale
Mr Olivier TROST HCN Chirurgie maxillo-faciale Mr Jean-Jacques TUECH HCN Chirurgie digestive Mr Jean-Pierre VANNIER (surnombre) HCN Pédiatrie génétique
Mr Benoît VEBER HCN Anesthésiologie - Réanimation chirurgicale
Mr Pierre VERA CB
Mr Eric VERIN HB Service Santé Réadaptation Mr Eric VERSPYCK HCN Gynécologie obstétrique Mr Olivier VITTECOQ HB Rhumatologie
Mme Marie-Laure WELTER HCN Physiologie
MAITRES DE CONFERENCES DES UNIVERSITES PRATICIENS HOSPITALIERS
Mme Noëlle BARBIER-FREBOURG HCN Bactériologie / Virologie Mme Carole BRASSE LAGNEL HCN Biochimie
Mme Valérie BRIDOUX HUYBRECHTS HCN Chirurgie vasculaire Mr Gérard BUCHONNET HCN Hématologie
Mme Mireille CASTANET HCN Pédiatrie
Mme Nathalie CHASTAN HCN Neurophysiologie
Mme Sophie CLAEYSSENS HCN Biochimie et biologie moléculaire Mr Moïse COEFFIER HCN Nutrition
Mr Serge JACQUOT UFR Immunologie
Mr Joël LADNER HCN Epidémiologie, économie de la santé Mr Jean-Baptiste LATOUCHE UFR Biologie cellulaire
Mr Thomas MOUREZ (détachement) HCN Virologie
Mme Muriel QUILLARD HCN Biochimie et biologie moléculaire Mme Laëtitia ROLLIN HCN Médecine du travail
Mr Mathieu SALAUN HCN Pneumologie
Mme Pascale SAUGIER-VEBER HCN Génétique Mme Anne-Claire TOBENAS-DUJARDIN HCN Anatomie
Mr David WALLON HCN Neurologie
Mr Julien WILS HCN Pharmacologie
PROFESSEUR AGREGE OU CERTIFIE
Mr Thierry WABLE UFR Communication
Mme Mélanie AUVRAY-HAMEL UFR Anglais
II - PHARMACIE
PROFESSEURS
Mr Thierry BESSON Chimie thérapeutique
Mr Roland CAPRON (PU-PH) Biophysique
Mr Jean COSTENTIN (Professeur émérite) Pharmacologie
Mme Isabelle DUBUS Biochimie
Mr François ESTOUR Chimie organique
Mr Loïc FAVENNEC (PU-PH) Parasitologie
Mr Michel GUERBET Toxicologie Mme Isabelle LEROUX - NICOLLET Physiologie
Mme Christelle MONTEIL Toxicologie
Mme Martine PESTEL-CARON (PU-PH) Microbiologie
Mr Rémi VARIN (PU-PH) Pharmacie clinique
Mr Jean-Marie VAUGEOIS Pharmacologie
Mr Philippe VERITE Chimie analytique
MAITRES DE CONFERENCES
Mme Cécile BARBOT Chimie générale et minérale
Mr Jérémy BELLIEN (MCU-PH) Pharmacologie
Mr Frédéric BOUNOURE Pharmacie galénique
Mr Abdeslam CHAGRAOUI Physiologie
Mme Camille CHARBONNIER (LE CLEZIO) Statistiques
Mme Elizabeth CHOSSON Botanique
Mme Marie Catherine CONCE-CHEMTOB Législation pharmaceutique et économie de la santé
Mme Cécile CORBIERE Biochimie
Mr Eric DITTMAR Biophysique
Mme Nathalie DOURMAP Pharmacologie
Mme Isabelle DUBUC Pharmacologie
Mme Dominique DUTERTE- BOUCHER Pharmacologie
Mr Abdelhakim ELOMRI Pharmacognosie
Mr Gilles GARGALA (MCU-PH) Parasitologie Mme Nejla EL GHARBI-HAMZA Chimie analytique
Mme Marie-Laure GROULT Botanique
Mr Hervé HUE Biophysique et mathématiques
Mme Laetitia LE GOFF Parasitologie Immunologie
Mme Hong LU Biologie
M. Jérémie MARTINET (MCU-PH) Immunologie
Mme Marine MALLETER Toxicologie
Mme Sabine MENAGER Chimie organique
Mme Tiphaine ROGEZ-FLORENT Chimie analytique
Mr Mohamed SKIBA Pharmacie galénique
Mme Malika SKIBA Pharmacie galénique
Mme Christine THARASSE Chimie thérapeutique
Mr Frédéric ZIEGLER Biochimie
PROFESSEURS ASSOCIES
Mme Cécile GUERARD-DETUNCQ Pharmacie officinale Mr Jean-François HOUIVET Pharmacie officinale
PROFESSEUR CERTIFIE
Mme Mathilde GUERIN Anglais
ASSISTANT HOSPITALO-UNIVERSITAIRE
Mme Anaïs SOARES Bactériologie
ATTACH
LISTE DES RESPONSABLES DES DISCIPLINES PHARMACEUTIQUES
Mme Cécile BARBOT Chimie générale et minérale
Mr Thierry BESSON Chimie thérapeutique
Mr Roland CAPRON Biophysique
Mme Marie-Catherine CONCE-CHEMTOB Législation et économie de la santé
Mme Elisabeth CHOSSON Botanique
Mme Isabelle DUBUS Biochimie
Mr Abdelhakim ELOMRI Pharmacognosie
Mr Loïc FAVENNEC Parasitologie
Mr Michel GUERBET Toxicologie
Mr François ESTOUR Chimie organique
Mme Isabelle LEROUX-NICOLLET Physiologie Mme Martine PESTEL-CARON Microbiologie
Mr Mohamed SKIBA Pharmacie galénique
Mr Rémi VARIN Pharmacie clinique
M. Jean-Marie VAUGEOIS Pharmacologie
III MEDECINE GENERALE
PROFESSEUR DES UNIVERSITES MEDECIN GENERALISTE
Mr Jean-Loup HERMIL (PU-MG) UFR Médecine générale
MAITRE DE CONFERENCES DES UNIVERSITES MEDECIN GENERALISTE Mr Matthieu SCHUERS (MCU-MG) UFR Médecine générale
PROFESSEURS ASSOCIES A MI-TEMPS MEDECINS GENERALISTES
Mme Laëtitia BOURDON UFR Médecine générale Mr Emmanuel LEFEBVRE UFR Médecine générale Mme Elisabeth MAUVIARD UFR Médecine générale Mr Philippe NGUYEN THANH UFR Médecine générale Mme Marie Thérèse THUEUX UFR Médecine générale
MAITRES DE CONFERENCES ASSOCIE A MI-TEMPS MEDECINS GENERALISTES
Mr Pascal BOULET UFR Médecine générale
Mr Emmanuel HAZARD UFR Médecine générale
Mme Marianne LAINE UFR Médecine générale
Mme Yveline SEVRIN UFR Médecine générale
ENSEIGNANTS MONO-APPARTENANTS
PROFESSEURS
Mr Serguei FETISSOV (med) Physiologie (ADEN)
Mr Paul MULDER (phar) Sciences du médicament
Mme Su RUAN (med) Génie informatique
MAITRES DE CONFERENCES
Mr Sahil ADRIOUCH (med) Biochimie et biologie moléculaire (Unité Inserm 905)
Mme Gaëlle BOUGEARD-DENOYELLE (med) Biochimie et biologie moléculaire (UMR 1079)
Mme Carine CLEREN (med) Neurosciences (Néovasc) M. Sylvain FRAINEAU (med) Physiologie (Inserm U 1096)
Mme Pascaline GAILDRAT (med) Génétique moléculaire humaine (UMR 1079)
Mr Nicolas GUEROUT (med) Chirurgie expérimentale Mme Rachel LETELLIER (med) Physiologie
Mr Antoine OUVRARD-PASCAUD (med) Physiologie (Unité Inserm 1076) Mr Frédéric PASQUET Sciences du langage, orthophonie
Mr Youssan Var TAN Immunologie
Mme Isabelle TOURNIER (med) Biochimie (UMR 1079)
CHEF DES SERVICES ADMINISTRATIFS : Mme Véronique DELAFONTAINE HCN - Hôpital Charles Nicolle HB - Hôpital de BOIS GUILLAUME
CB - Centre Henri Becquerel CHS - Centre hospitalier spécialisé du rouvray CRMPR - Centre régional de médecine physique et de réadaptation SJ Saint Julien Rouen
COMPOSITION DU JURY ---
Président du jury : Pr Frédéric Di Fiore
Membres du jury : Pr Bernard Dubray et Pr Luc Thiberville
---
«
promouvoir la santé dans tous ses éléments, physiques et mentaux, individuels et sociaux. Je respecterai toutes les personnes, leur autonomie et leur volonté, sans aucune discrimination
vulnérables ou menacées dans leur intégrité ou leur dignité. Même sous la contrainte, je ne ferai pas usage de mes connaissances contre
des décisions envisagées, de leurs raisons et de leurs conséquences. Je ne tromperai jamais r les
laisserai pas influencer par la soif du gain ou la recherche de la gloire.
souffrances. Je ne prolongerai pas abusivement les agonies. Je ne provoquerai jamais la mort délibérément.
i et les perfectionnerai pour assurer au mieux les services qui me seront demandés.
promesses ; que je »
REMERCIEMENTS ---
Au Pr Frédéric Di Fiore,
pour votre soutien dans mes projets professionnels.
Au Pr Dubray, merci pour votre écoute, votre disponibilité, et pour votre soutien constant dans mes projets professionnels.
Au Pr Luc Thiberville,
thymiques, merci pour votre regard paternel et bienveillant, et pour votre soutien.
A mes co-directeurs de thèse :
-Au Dr Suzanna Bota, q -pneumologie, merci pour ton dynamisme et ta bonne humeur ;
praticiens du Centre Henri Becquerel, oncologues médicaux, oncologues radiothérapeutes, médecins des soins de support, radiologues, médecins nucléaristes, anesthésistes, chirurgiens qui ont contribué à ma formation de médecin au cours : Dr Corinne Veyret, Pr Frédéric Di Fiore, Dr Florian Clatot, Dr Cécile Guillemet, Dr Sophie Gouérant, Dr Marianne Leheurteur, Dr Cristian Moldovan, Dr Camille Petrau, Dr Olivier Rigal, Dr Isabelle Tennevet, Dr Jean-Christophe Thery, Dr Cristina Alexandru, Pr Bernard Dubray, Dr Sébastien Thureau, Dr Hugues Auvray, Dr Ahmed Benyoucef, Dr Chantal Hanzen, Dr Ovidiu Veresezan.
Au Pr Hervé Tilly, ancien directeur du Centre Henri Becquerel, merci pour votre aide dans la
Association des Jeunes Oncologues Rouennais).
Au Pr Freger et au Pr Veber, respectivement ancien doyen et actuel doyen de la faculté de -CHU.
sur le thème des tumeurs thymiques en France à travers le réseau RYTHMIC.
cadres de santé, aides-soignantes, kinésithérapeutes, psychologues, qui ont participé aux soins écoute, votre aide et votre soutien lorsque des situations médicales et humaines délicates se sont présentées.
Merci aux infirmières de nuit pour les bons moments passés ensemble lors des gardes. J ressenti qui règne dans le monde hospitalier la nuit, et apprécié la
aux bananes plantain : un régal !
Au personnel administratif : merci pour votre collaboration dans mon travail en tant .
Aux brancardiers : merci pour votre humour et votre humeur joviale en toute circonstance.
Aux médecins hématologues du Centre : merci pour votre présence et votre compagnonnage lors de mon stage dans votre service.
Aux pneumologues du CHU Charles Nicolle, au Dr Van Mossevelde, au Dr Morisse-Pradier : on stage parmi vous. Merci pour la rigueur des enseignements dispensés. Merci à mes co-internes de pneumologie pour la bonne humeur en stage.
Au Dr Hili et au Dr Mocanu, les oncologues responsables de mon stage à Evreux : merci pour
Aux gastro-entérologues du CHU Charles Nicolle, au Pr Di Fiore, au Pr Michel, au Dr Gangloff, au Dr Sefrioui, à mes co-internes de gastro-entérologie : merci pour ce passage formateur dans votre service.
Au Pr Tamion, aux médecins réanimateurs et à mes co-internes anesthésistes-réanimateurs : merci pour vos caractères détonants et les bons moments passés ensemble, notamment lors de -café du matin... Ce stage en réanimation était indispensable à ma
e ; cela
de calme les situations médicales où le pronostic vital est rapidement en jeu.
Aux médecins du C investigation c : merci au Dr
V -CHU dans son unité. Merci au Pr Pierga, Pr Le
Tourneau, au Dr Cottu, et au Dr Pipernau, pour leurs enseignements exigeants.
Centre Léon Bérard à Lyon (Dr Cassier, Dr -Sarcome (Pr Blay, Pr Ray-Coquard, Dr Dufresne et Dr Brahmi), à mes co-internes de ce stage. Merci aux infirmières, pour leur gentillesse et leur amitié.
translationnelle U932 i à Paris, au
e. Mon travail consistait à détecter la présence de checkpoints immunitaires sur des tumeurs rares. Au Pr Soumelis, qui , qui a soutenu ce travail et mes projets, tant professionnellement internationale de chercheurs, avec laquelle
e.
-internes n
Lavaud, Dr Colomba, Dr Albiges, Dr Baciarello, Dr Naltet, Dr Loriot, Dr Pautier, Dr Leary, .
Au Dr Florence Beauvais, amie et conseillère depuis le début de mon cursus médical.
Au Pr Alain Baglin.
Au Dr Laurent Mignot.
Au Pr Alain Castaigne.
A ma famille, à mes proches, à mes amis, qui me soutiennent dans ma vie privée comme dans ma vie de jeune médecin.
A Marco, Eugenia, Floriane, Clarisse, Pierre, Gabby, Mélanie, Emma, Nadège, qui me .
A Sophie, pour tes fous rires. A Emmanuel pour ton aide. A Hadi, Sunthavy, Flore. A Camille, Carla, Sarantis.
A Mister German.
A ma tante Brigitte et à ma mère, mes inconditionnelles supportrices. .
A tous mes co-internes, qui ont su adoucir , notamment à Marine, Bérangère, Romain, Juliette, Laetitia.
SOMMAIRE --- COMPOSITION DU JURY p.15 p.16 REMERCIEMENTS p.17 SOMMAIRE p.23 I INTRODUCTION p.25 I 1. Rappels p.25 I - 1. a. Epidémiologie p.25 I 1. b. Histologie p.26 I 1. c. Classification p.27 I 2. Traitement p.28 I 2. a. Chirurgie p.28 I 2. b. Chimiothérapie p.29 I 2. c. Radiothérapie p.30 I 2. d. Surveillance p.31 I 2. e. Perspectives p.31
I 3. Contexte de ce travail de thèse p.31
I 3. a. RYTHMIC Réseau Tumeurs ThymiQUES et Cancer p.31
I 4. Objectif du présent travail p.32
II DISCUSSION p.33
II 1. La PORT semble réduire les récidives médiastinales p.33 II 2.
saines p.34
II 3. La survie globale est peu contributive dans ce travail car les tumeurs
thymiques sont de bon pronostic p.35
III CONCLUSION ... p.36
IV TABLEAUX ET FIGURES p.37
Table 1 : Patients characteristics p.38
Table 2 : Recurence-free survival : analysis of predictive factors p.39
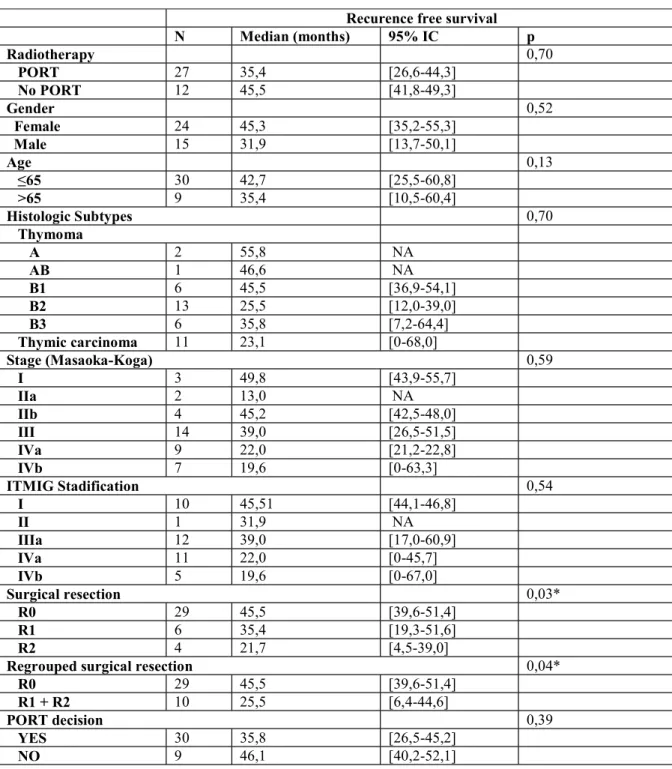
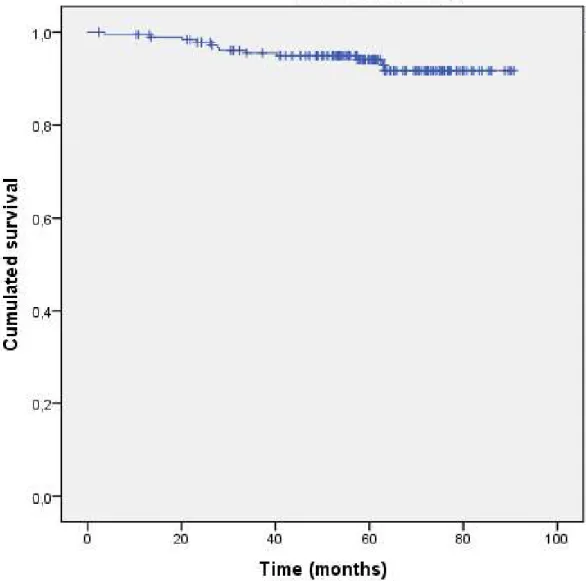
Figure 1A : Recurrence free survival p.40
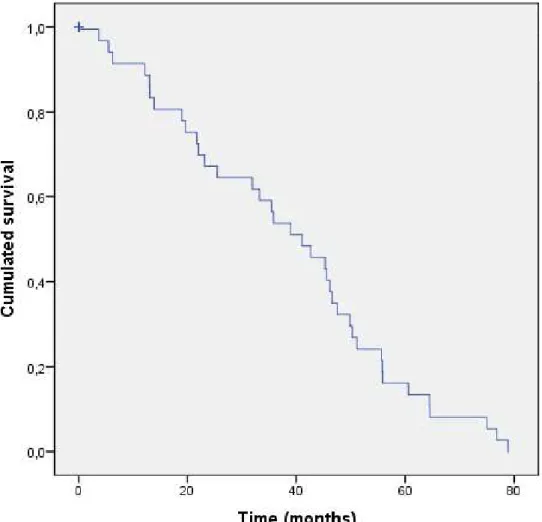
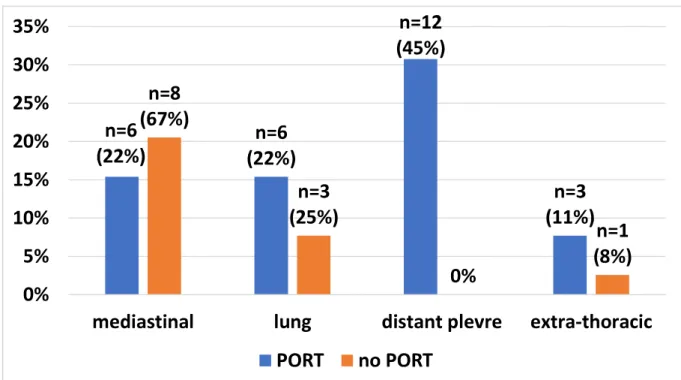
Figure 1B : Site of the first relapse (n=39) p.41 Figure 1C : Recurrence free survival considering PORT p.42
Figure 2A : Overall survival p.43
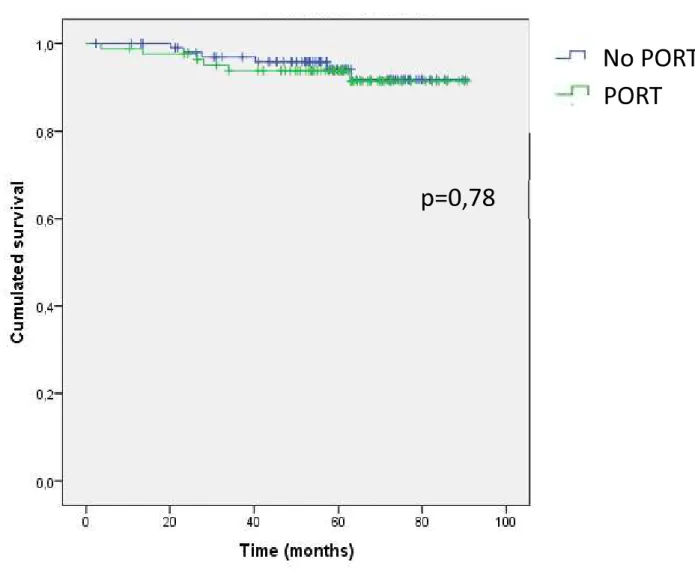
Figure 2B : Overall survival considering PORT p.44
Supplemental Figure 1 p.45
V BIBLIOGRAPHIE p.46
VI ARTICLE en anglais . p.51
I - INTRODUCTION ---
I 1. Rappels
I - 1. a. Epidémiologie
Le thymus est une glande médiastinale qui apparaît dès la sixième semaine de développement
est le siège de la maturation des lymphocytes T au début de la vie : les thymocytes immatures en provenance de la moelle osseuse se différencient au sein du thymus en lymphocytes T CD4 (auxiliaire) et T CD8 (cytotoxique) capables de reconnaître les antigènes [1].
us [2] Les tumeurs épithéliales thymiques (TET), incluant thymomes (90%) et carcinomes thymiques (10%) sont des tumeurs rares médiastinales (250 nouveaux cas par an en France) [3, 4]. Les données de la littérature ainsi que les recommandations sont de ce fait principalement tirées de cohortes rétrospectives [5].
Les hommes sont touchés autant que les femmes [6 se situe vers 55 ans [3, 6]. Il ne semble pas y avoir de facteurs environnementaux ou infectieux favorisant la
e TET [6].
Les TET sont souvent richement infiltrées en lymphocytes T. Leur relargage dans la circulation générale [7] favorise la survenue de maladies auto-immunes [8].
La découverte est fortuite dans 65% des cas, et est accompagnée de signes de compression médiastinale dans 35% des cas (douleur, toux, dyspnée, syndrome cave). Dans 10 à 75% des cas, des pathologies auto-immunes sont associées, dont principalement la myasthénie, mais
[3]
Au sein des TET, les carcinomes thymiques ont un moins bon pronostic que les thymomes avec un plus fort taux de rechute et des rechutes plus précoces [6]. Cependant les TET sont des tumeurs à progression lente et mènent rarement au décès [9].
I 1. b. Histologie
Les thymomes sont subdivisés en sous-types (A, AB, B1, B2, B3) en fonction de leur aspect morphologique et de leur infiltration en lymphocytes. La World Health Organization (WHO) a publié des recommandations en 2014 pour aider au diagnostic anatomopathologique des TET [10].
Tableau des sous-types histologiques des tumeurs thymiques[3].
Cependant ces tumeurs étant rares et présentant des aspects microscopiques variables et et al. [11]) entre une analyse par un médecin anatomopathologiste travaillant dans un centre généraliste comparativement à un médecin anatomopathologiste travaillant dans un centre expert des TET.
lgré les efforts récents et al. [12], les facteurs pronostics des TET semblent multifactoriels, il retient 3 paramètres pouvant
le statut de résécabilité initiale de la tumeur. Ce dernier paramètre étant évoqué sur une large
pronostic indépendant le plus significatif associé à la survie [13]. Suster et al. proposait en 2006 une autre classification en trois bras
considérés comme des TET bien différenciée, puis les thymomes B3 considérés comme des TET modérément différenciés ; et enfin les carcinomes thymiques considérés comme des TET peu différenciés [12].
I 1. c. Classification
Les thymomes sont classés depuis 1994 selon la classification de Masaoka-Koga, établie au Japon sur 79 cas [14].
(International Thymic Malignancies group / International Association for the Study of Lung cancer) a été établie pour classer aussi bien les thymomes que les carcinomes thymiques dans une seule et même classification
été élaborée après
répertoriant les données de 8145 patients atteints de TET traités entre 2000 et 2010. cependant controversée [9, 15]. et al. sur 188 patients français atteints de TET [16] ne montre en effet pas de corrélation significative entre le nouveau stade TNM et la survie globale.
Stade Description
I Tumeur totalement encapsulée sans envahissement microscopique de la capsule IIA Envahissement miscroscopique
IIB Envahissement macroscopique dans la graisse péri-thymique; dans le thymus; Adhérences macroscopiques, sans invasion, à la plèvre médiastinale ou au péricarde
III Extension macroscopique aux organes adjacents (péricarde, gros vaisseaux, poumon IVA Tumeur avec implants pleuraux ou péricardiques
IVB Métastase ganglionnaires es organes distants
-IASLC validée en 2016 [18]
I 2. Traitement [3] I 2. a. Chirurgie
Le traitement optimal de la tumeur ainsi que de la
graisse périthymique. Les recommandations chirurgicales sont la thymectomie totale emportant le thymome avec tout le thymus associé à une exérèse de la graisse périthymique.
préférentielle. Cependant, la thoracotomie antérieure bilatérale avec sternotomie transverse peut être préconisée pour de volumineuses tumeurs nsion à la plèvre ou au poumon. La chirurgie vidéo-assistée peut être utilisée pour des tumeurs de petit volume et encapsulées
opsie est alors recommandée pour établir le diagnostic [19-22].
I 2. b. Chimiothérapie [3]
En cas de tumeur ,
radiothérapie séquentielle en cas de non résécabilité malgré la chimiothérapie néoadjuvante. Trois à quatre
radiothérapie post-opératoire.
La réponse tumorale après une chimiothérapie néoadjuvante est de 70% à 80%, avec un taux de résection chirurgicale complète compris entre 30% et 50%.
Cependant près de 20% à 30% des patients ne sont pas éligibles à la chirurgie après séquentielle.
est systématiquement discutée en réunion de concertation pluridisciplinaire.
La chimiothérapie
post-En cas de maladie métastatique ou récidivante, non résécable, la chimiothérapie exclusive est le traitement standard.
Le protocole CAP - Cisplatine (50 mg/m²), Adriamycine (50 mg/m²), Cyclophosphamide (500 mg/m²) [9] est le protocole le plus utilisé. Les associations de carboplatine et paclitaxel et de VIP (Vinblastine-Ifosfamide-Cisplatine) sont des alternatives après le CAP [23].
Les récidives surviennent dans 10 à 15% des cas de tumeurs opérés tout stade confondu. La survie sans récidive moyenne est de 5 ans [3 - 7 ans] [24]. Dans ces cas-là une reprise de - taxanes, ou sels de platine - etoposide est utilisée.
I 2. c. Radiothérapie
Les recommandations actuelles concernant la radiothérapie médiastinale post-opératoire proposent uniquement cette dernière aux patients à haut risque de récidive. Ces pratiques sont
issues s poolées et en
multicentrique ou même prospective.
La radiothérapie post-opératoire (ou PORT - Post Operative RadioTherapy) est ainsi indiquée dans tous les cas où les marges de résection sont incomplètes (R1).
Quand les marges sont saines (R0), les recommandations proposées [3, 25]
stades de Masaoka-Koga de 1994 encore utilisés en pratique courante, et non pas sur la nouvelle classification International Thymic Malingnancies Interest Group) de 2016 :
-en cas de marges R0, la PORT est indiquée dans les thymomes stades III ; elle pas indiquée dans les stades I ; elle est controversée dans les stades II mais doit être discutée en
-capsulaire [26] ; -la PORT est recommandée dans les carcinomes thymiques peu importe le stade puisse être discutée dans les stades I ;
-concernant les stades IV, quelle que , recommandation [27].
La radiothérapie adjuvante doit débuter dans les trois mois suivant la chirurgie.
Concernant les doses à délivrer -30]. Cependant, les
cas de résection complète, et 56 Gy avec surimpression sur les zones à risque en cas de résection incomplète.
radiothérapie thoracique externe ITMIG [31].
En cas de tumeur en place non opérable, la radiothérapie est souvent associée de façon séquentielle ou concomitante à la chimiothérapie ; des doses supérieures à 60 Gy sont habituellement délivrées dans ce contexte.
Le récent travail de MW Jackson et al. TET stades IIB et III (de la classification de Masaoka-Koga) avec marges R1, grâce à une large cohorte de 4056 patients sélectionnés entre 2004 et 2012 [32]. Liao et al. [33] encouragent la PORT dans les thymomes stade III (de la classification de Masaoka-Koga) avec marges saines R0 face à des allongement de la survie sans progression de façon significative chez les patients traités. Cependant les auteurs
facteur indépendant de maladie cardiovasculaire à distance.
I 2. d. Surveillance
La surveillance se fait par un scanner thoraco-abdomino-pelvien pendant 5 ans, à réaliser annuellement en cas de stade I/II opéré, et tous les 6 mois pendant 2 ans puis annuellement pour les stades III/IV ou avec envahissement des marges de résection.
I 2. e. Perspectives
a été testé en phase II dans les TET avec des résultats intéressants mais avec une forte toxicité auto-immune [34].
Treatme European Thoracic Oncology Platform (ETOP). Cet
essai teste le Nivolumab (anti-PD1) (anti CTLA-4) chez
les patients atteints de thymome B3 avancé ou en rechute, ou de carcinome thymique (NCT03134118). Un essai de phase I/II avec le pembrolizumab dans les TET est aussi en cours au MD Anderson Cancer Center, Texas (NCT03295227) [35].
I 3. Contexte de ce travail de thèse
I 3. a. RYTHMIC Réseau Tumeurs ThymiQUES et Cancer En France, le réseau national « RYTHMIC » a été créé à Cancer (INCa) en 2012 afin,
prise en charge de ces patients.
Gustave Roussy en région parisienne, le CHU de Lyon, le CHU de Strasbourg, le CHU de Rennes, le CHRU de Tours, le Réseau Oncolie de Franche-Comté, le CHU de Montpellier, le CHU de Nancy, le CHU de Toulouse, le Centre Oscar Lambret à Lille, le CHU de Caen, le
Une RCP nationale et régionale ont lieu tous les 15 jours. Les dossiers difficiles sont discutés, tous les nouveaux cas de TET sur le territoire français sont répertoriés. La base de données est gérée IFCT (Intergroupe Francophone de Cancérologie Thoracique).
I 3. b. Mémoire de DES
Dans un précédent travail, nous avons observé si la décision de radiothérapie post-opératoire prise en RCP nationale RYTHMIC suivait les recommandations
(travail réalisé sur 274 patients enregistrés dans la base RYTHMIC du 01/11/2011 au 30/11/2014), et nous avons étudié si les pratiques de radiothérapie respectaient les recommandations Ce précédent travail portait sur 274 patients, 243 (89%) atteints de thymome, et 31 (11%) atteints de carcinome thymique. La décision de la RCP nationale RYTHMIC était concordante avec les recommandations chez 221 patients (92%) des 241 patients ayant un stade II- -opératoire a été prise pour 117 patients (43%). La radiothérapie a finalement été réalisée chez 101 patients. Le principal motif de non-réalisation de PORT était le délai depuis la chirurgie (> 3mois). Les contraintes de doses de la radiothérapie étaient majoritairement conformes aux recommandations exceptées dans 4 cas.
Ce premier travail a donné lieu à une publication en 2017 dans le Journal of Thoracic oncology [36].
I 4. Objectif du présent travail
principal de ce travail cette même cohorte (survie globale et survie sans récidive) à 5 ans de la discussion en RCP nationale RYTHMIC pour la prise en charge post-chirurgicale.
II DISCUSSION --- II 1. La PORT semble réduire les récidives médiastinales
Ce travail évalue à 21% le risque de récidive dans les 5 années suivant une thymectomie pour tumeur épithéliale thymique (39 récidives sur 187 patients pour lesquels les données de survie étaient disponibles). Le taux de récidive parmi les stades I-II est de 7,1% ; il est de 39,3% parmi les carcinomes thymiques. Ceci est relativement concordant avec les données de la littérature : le travail du SPFC (Staging and Prognostic Factors Committee)
(International Association for the Study of Lung Cancer) sur 7982 patients analysés de façon rétrospective sur 10 ans, rapporte un taux de récidive de 8% et de 25% respectivement dans les thymomes I-II et les carcinomes thymiques [17, 37, 18]. On note cependant un plus grand taux de récidive parmi les carcinomes thymiques dans notre travail. La littérature rapporte une durée médiane de survie sans récidive de 3 à 4 ans pour les stades III, comparativement à 2,9 mois dans notre travail [18].
La médiane de survie sans récidive est de 41,1mois (95% CI: 29,2-53,0), Figure 1A. Ceci est inférieur aux résultats retrouvés dans s bases de données : Liu et al. retrouve une taux supérieur de realisation de PORT dans les stades I (25% versus 7% dans notre analyse) et dans les Thymomes A (17% versus 6% dans notre analyse) ; une survie de 68 mois est retrouvée dans une cohorte retrospective de 198 patients (suivi sur 4 ans), dont 30% a reçu de la PORT [38, 39].
La méthodologie de notre travail ne permet pas de montrer le bénéfice de la PORT pour les tumeurs agressives. En effet n
groupe PORT et non-PORT concernant la survie sans récidive, ni la survie globale (Figure 1C et Figure 2B), ce qui a déjà été décrit dans la littérature [38]. Cependant nous soumettons
que la PORT réduit un surrisque de récidive, mais que nos résultats restent non statistiquement significatifs :
- es récidives se situent majoritairement au niveau de la plèvre pour les patients ayant reçu de la PORT (44% des récidives ayant reçu de la PORT). En revanche, les récidives
médiastinales sont plus fréquentes 7%). Etant
donné que la PORT est indiquée dans les cas de tumeurs thymiques les plus à risque de récidive, le fait que la majorité des récidives médiastinales soient dans le groupe non-PORT
;
- la PORT est associée à un plus fort taux de récidive (32% dans le groupe PORT versus 12% dans le groupe non-PORT, p=0,001), on rappelle que la PORT est indiquée dans les cas les plus agressifs à risque de récidive majoré. En effet les groupes de populations initiaux comparables : le groupe de patients non-PORT comporte une majorité des stades I (22%) et II (28%) alors que le groupe de patients PORT comporte une majorité des stades II (16%) et III (17%). De plus la majorité des chirurgies R0
reçu de PORT (66%) versus une majorité de chirurgies avec des marges R1 ont été traitées par PORT (94%), (Table 1).
Nos données montrent que ni le stade de la maladie (classification Masaoka-Koga ou ITMIG), ni le sous- aleur prédictive de récidive.
II
Nos données confirment en revanche
une survie sans récidive statistiquement amélior saines : médiane de survie de 45,5 mois (95% CI : 39,6-51,4) pour les patients avec des marges R0 versus 25,5 mois (95%CI : 6,4-44-6) dans le groupe de patients avec des marges R1 ou R2, p=0,04 (Supplemental Figure 1). De même la résection complète R0 est associée de façon significative à une meilleure OS, p=0,002).
II 3. La survie globale est peu contributive dans ce travail car les tumeurs thymiques sont de bon pronostic
Nous avons comptabilisé 12 décès (6,4%) parmi les 187 patients pour lesquels nous avions les données de survie. Les tumeurs thymiques
pas atteinte dans notre travail (Figure 2A). Les patients ont une survie globale de 96% à 3 ans, et de 94% à 5 ans, ce qui est retrouvé dans la littérature (90% de survie globale à 5 ans dans
Liu et al. [17]).
(p=0.78) (Figure 2B). La survie globale était significativement moins bonne en cas de récidive (p=0,001).
Si la radiothérapie post-opératoire est controversée dans les stades II-III principalement à cause des toxicités tardives (cardiaques notamment) [40-42],
travail peut être dû au très bon pronostic des patients atteints de tumeurs épithéliales thymiques. Un suivi à plus long terme de cette cohorte semble indispensable pour définir
III CONCLUSION ---
as associée à une modification de la survie sans récidive ni de la survie globale,
de ce traitement. a priori moins à risque
-ne recevant pas de PORT- récidive dans 67% des cas au niveau médiastinal, alors que la population plus à risque et recevant la PORT récidive quant à elle à 44% au niveau médiastinal. Cependant ce travail ne permet pas de définit quelle sous-population de patients du groupe PORT bénéficie réellement du traitement adjuvant.
Ce travail encourage une surveillance rapprochée dans les 5 premières années post-chirurgie afin de détecter précocement les récidives médiastinales, compte tenu du taux de récidive (67%) notamment chez les patients . Ce qui permettrait
IV TABLEAUX ET FIGURES ---
Table 1:
Characteristics Total n (%) PORT No PORT p
Total 187 (100%) 84 (45%) 103 (55%)
Age in years (médiane [min-max]) 62 [17-86]
Gender 0,55
Female 93 (50%) 44 (47%) 49 (53%)
Male 94 (50%) 40 (43%) 54 (57%)
Histologic type per WHO classification = 0,0075*
Thymoma 159 (85%) 65 (41%) 94 (59%) A 17 (11%) 1 (2%) 16 (17%) AB 37 (23%) 6 (9%) 31 (33%) B1 29 (18%) 10 (15%) 19 (20%) B2 53 (33%) 31 (48%) 22 (23%) B3 23 (14%) 17 (26%) 6 (7%) Thymic carcinoma 28 (15%) 19 (68%) 9 (32%) Stage (Masaoka-Koga) < 0,0001* Stage I 45 (24%) 3 (7%) 42 (93%) Stage Iia 40 (21%) 11 (27%) 29 (73%) Stage IIb 42 (22%) 19 (45%) 23 (55%) Stage III 35 (19%) 31 (89%) 4 (11%) Stage Iva 15 (8%) 14 (93%) 1 (7%) Stage IVb 10 (6%) 6 (60%) 4 (40%) ITMIG Stadification < 0,0001* Stage I 129 (69%) 37 (29%) 92 (71%) Stage II 7 (4%) 5 (71%) 2 (29%) Stage IIIa 26 (14%) 22 (85%) 4 (15%) Stage IIIb - - - Stage Iva 19 (10%) 17 (89%) 2 (11%) Stage IVb 6 (3%) 3 (50%) 3 (50%) Surgical Resection < 0,0001* R0 151 (81%) 51 (34%) 100 (66%) R1 32 (17%) 30 (94%) 2 (6%) R2 4 (2%) 3 (75%) 1 (25%) Neoadjuvant chemotherapy 17 (9%) 12 5 CAP 9 7 2 VIP 1 1 - Platine-Etoposide 2 1 1 Cisplatine-Pemetrexed 1 - 1 Cisplatine 1 1 - CAP + BEP 1 1 - Unknown 1 1 -
TABLE 2 : Recurrence-free survival analysis of predictive factors
Recurence free survival
N Median (months) 95% IC p Radiotherapy 0,70 PORT 27 35,4 [26,6-44,3] No PORT 12 45,5 [41,8-49,3] Gender 0,52 Female 24 45,3 [35,2-55,3] Male 15 31,9 [13,7-50,1] Age 0,13 30 42,7 [25,5-60,8] >65 9 35,4 [10,5-60,4] Histologic Subtypes 0,70 Thymoma A 2 55,8 NA AB 1 46,6 NA B1 6 45,5 [36,9-54,1] B2 13 25,5 [12,0-39,0] B3 6 35,8 [7,2-64,4] Thymic carcinoma 11 23,1 [0-68,0] Stage (Masaoka-Koga) 0,59 I 3 49,8 [43,9-55,7] IIa 2 13,0 NA IIb 4 45,2 [42,5-48,0] III 14 39,0 [26,5-51,5] IVa 9 22,0 [21,2-22,8] IVb 7 19,6 [0-63,3] ITMIG Stadification 0,54 I 10 45,51 [44,1-46,8] II 1 31,9 NA IIIa 12 39,0 [17,0-60,9] IVa 11 22,0 [0-45,7] IVb 5 19,6 [0-67,0] Surgical resection 0,03* R0 29 45,5 [39,6-51,4] R1 6 35,4 [19,3-51,6] R2 4 21,7 [4,5-39,0]
Regrouped surgical resection 0,04*
R0 29 45,5 [39,6-51,4]
R1 + R2 10 25,5 [6,4-44,6]
PORT decision 0,39
YES 30 35,8 [26,5-45,2]
NO 9 46,1 [40,2-52,1]
Figure 1B . Site of the first relapse
V BIBLIOGRAPHIE ---
[1] Kuby J. Immunology. 6ème edition. Dunod. 2016
[2] http://espacetechniciensdelaboratoire.blogspot.com/2015/05/le-thymus.html [3] Référentiel RYTHMIC 2016 disponible sur http://www.rythmic.org
[4] Groupe de travail SOR : Ruffié P, Gory-Delabaere G, Fervers B, Lehmann M, Regnard JF, Resbeut M .Standards, Options et Recommandations pour la prise en charge des patients atteints de tumeurs épithéliales du thymus. Volume 86, numéro 4, Avril 1999
[5] Girard N, Ruffini E, Marx A, Faivre-Finn C, Peters S. Thymic epithelial tumours: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2015; 26 Suppl 5: v40-55
[6] Engels EA. Epidemiology of thymoma and associated malignancies. J Thorac Oncol. 2010 Oct; 5(10 Suppl 4): S260 S265
[7] Buckley C, Douek D, Newsom-Davis J, Vincent A, Wilcox N. Mature, long-lived CD4+ and CD8+ T cells are generated by the thymoma in myasthenia gravis. Ann Neurol. 2001;50:64 72
[8] Souadjian JV, Enriquez P, Silverstein MN, Pépin J-M. The spectrum of diseases associated with thymoma. Arch Intern Med. 1974;134:374 79
[9] Fukui T and Yokoi K. The new classifications for thymic epithelial tumors: benefits and problems. J Thorac Dis. 2017 Nov; 9(11): 4165 4168
[10] Marx A, Ströbel P, Badve SS, Chalabreysse L, Chan JK, Chen G, de Leval L, Detterbeck F, Girard N, Huang J, Kurrer MO, Lauriola L, Marino M, Matsuno Y, Molina TJ, Mukai K, Nicholson AG, Nonaka D, Rieker R, Rosai J, Ruffini E, Travis WD. ITMIG consensus statement on the use of the WHO histological classification of thymoma and thymic
carcinoma: refined definitions, histological criteria, and reporting. J Thorac Oncol. 2014 May; 9(5):596-611
[11] Sakakura N, Tateyama H, Nakamura S, Taniguchi T, Usami N, Ishikawa Y, Kawaguchi K, Yokoi K. Diagnostic reproducibility of thymic epithelial tumors using the World Health Organization classification: note for thoracic clinicians. Gen Thorac Cardiovasc Surg. 2013 Feb; 61(2):89-95
[12] Suster S, Moran CA. Thymoma classification: current status and future trends. Am J Clin Pathol. 2006 Apr; 125(4):542-54
[13] Regnard J-F, Magdeleinat P, Dromer C, et al. Prognostic factors and long-term results after thymoma resection: a series of 307 patients. J Thorac Cardiovasc Surg. 1996;112:376-384
[14] Koga K, Matsuno Y, Noguchi M, Mukai K, Asamura H, Goya T, Shimosato Y. A review of 79 thymomas: modification of staging system and reappraisal of conventional division into invasive and non-invasive thymoma. Pathol Int. 1994 May; 44(5):359-67
[15] Huang J. A new staging system for thymoma--will it improve outcomes? J Thorac Cardiovasc Surg 2016; 151: 20-2
[16] Meurgey A, Girard N, Merveilleux du Vignaux C, Maury JM, Tronc F, Thivolet-Bejui F, Chalabreysse L.Assessment of the ITMIG Statement on the WHO Histological Classification and of the Eighth TNM Staging of Thymic Epithelial Tumors of a Series of 188 Thymic Epithelial Tumors.J Thorac Oncol. 2017 Oct; 12(10):1571-1581
[17] Detterbeck FC, Nicholson AG, Kondo K et al. The Masaoka-Koga stage classification for thymic malignancies: clarification and definition of terms. J Thorac Oncol 2011; 6: S1710-1716
[18] Detterbeck FC, Stratton K, Giroux D et al. The IASLC/ITMIG Thymic Epithelial Tumors Staging Project: proposal for an evidence-based stage classification system for the forthcoming (8th) edition of the TNM classification of malignant tumors. J Thorac Oncol 2014; 9: S65-72
[19] Davenport E, Malthaner RA. The role of surgery in the management of Thymoma: a systematic review. Ann Thorac Surg 2008; 86: 673-84.
[20] Levasseur P, Khalil A, Menestrier M, et al. First intensive radical exeresis surgery in invasive thymomas- results from a serie of 284 operated thymomas. Basel: Karger, 1989. [21] Attaran S, Acharya M, Anderson JR, et al. Does surgical debulking for advanced stages of thymoma improve survival? Interact Cardiovasc Thorac Surg 2012;15:494-7
[22] Toker A, Sonett J, Zielinski M, et al. Standard Terms, Definitions and Policies for Minimally Invasive Resection of Thymoma. J Thoracic Oncol 2011;6:S1739-42.
[23] Grassin F, Paleiron N, André M, et al. Combined etoposide, ifosfamide and cisplatin in the treatment of patients with advanced thymoma and thymic carcinoma: a French experience. J Thorac Oncol 2010; 5 : 893-7
[24] Girard N, Ruffini E, Marx A, Faivre-Finn C, Peters S. Thymic epithelial tumours: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2015; 26 Suppl 5: v40-55
[25] Girard N, Ruffini E, Marx A, Faivre-Finn C, Peters S. Ann Oncol (2015) 26 (suppl 5): v40-v55
[26] Korst RJ, Kansler AL, Christos PJ, Mandal S. Adjuvant radiotherapy for thymic epithelial tumors: a systematic review and meta-analysis. Ann Thorac Surg 2009; 87: 1641 - 7 [27] Loehrer PJ, Sr, Kim K, Aisner SC, et al.Cisplatin plus doxorubicin plus cyclophosphamide in metastatic or recurrent thymoma: final results of an intergroup trial. The Eastern Cooperative Oncology Group, Southwest Oncology Group, and Southeastern Cancer Study Group. J Clin Oncol 1994; 12: 1164-8
[28] Gomez D, Komaki R, Yu, J, et al. Radiation therapy definitions and reporting guidelines for thymic malignancies. J Thorac Oncol 2011;6: S1743-8
[29] Fuller CD, Ramahi EH, Aherne N, et al. Radiotherapy for thymic neoplasms. J Thorac Oncol 2010;5:S327-35
[30] Zhu G, He S, Fu X, et al.Radiotherapy and prognostic factors for thymoma: a retrospective study of 175 patients.Int J Radiat Oncol Biol Phys 2004;60:1113-9
[31] Gomez D, Komaki R, Yu, J, et al. Radiation therapy definitions and reporting guidelines for thymic malignancies. J Thorac Oncol 2011;6: S1743-8
[32] Jackson MW, The Impact of Postoperative Radiotherapy for Thymoma and Thymic Carcinoma J Thorac Oncol.2017 ; Vol. 12 No. 4: 734-744
[33] Liao J.The role of postoperative radiation therapy for completely resected stage III thymoma and e ect of higher heart radiation dose on risk of cardiovascular disease: A retrospective cohort study IntJSurg. 2018 May;53:345-349
[34] Giaccone G, Thompson J, Crawford J, et al. Pembrolizumab in patients with recurrent thymic carcinoma: results of a phase II study. J Clin Oncol 2017;35:abstr 8573
[35] Girard N. Use of immune checkpoint inhibitors in thymic epithelial tumors. Mediastinum. 2018 ; 2 :34
[36] Basse C, Thureau S, Bota S, Dansin E, Thomas PA, Pichon E, Lena H, Massabeau C, Clément-Duchene C, Massard G, Westeel V, Quantin X, Oulkhouir Y, Danhier S, Lerouge D, Tanguy R, Thillays F, Le Pechoux C, Dubray B, Thiberville L, Besse B, Girard N. Multidisciplinary Tumor Board Decision Making for Postoperative Radiotherapy in Thymic Epithelial Tumors: Insights from the RYTHMIC Prospective Cohort.. J Thorac Oncol. 2017 Nov;12(11):1715-1722
[37] Brierly JD, Gospodarowicz MK, Wittekind C. Thymic Tumors. In: TNM classification of malignant tumors. 8th Edition. Oxford, UK. John Wiley & Sons, 2017. p.74
[38] Liu Q, Gu Z, Yang F, Fu J, Shen Y, Wei Y, et al. The role of postoperative radiotherapy for stage I/II/III thymic tumor-results of the ChART retrospective database. J Thorac Di.s 2016; 8: 687-695
[39] Wang Y, Xu L, Du T, Gao Y, Wu Z, Luo D. A Nomogram Predicting Recurrence and Guiding Adjuvant Radiation for Thymic Carcinoma After Resection. Ann Thorac Surg. 2018;106:257-263
[40] Kleikamp G, Schnepper U, Körfer R. Coronary artery and aortic valve disease as a long-term sequel of mediastinal and thoracic irradiation. Thorac Cardiovasc Surg. 1997 Feb; 45(1):27-31
[41] Yeoh E, Holloway RH, Russo A, Tippett M, Bermingham H, Chatterton B, Horowitz M. Effects of mediastinal irradiation on oesophageal function. Gut. 1996 Feb; 38(2):166-70. [42] Shulimzon T, Apter S, Weitzen R, et al. Radiation pneumonitis complicating mediastinal radiotherapy postpneumonectomy. Eur Respir J. 1996;9(12):2697 9
VI ARTICLE en anglais --- ORIGINAL ARTICLE
Updated analysis of the prospective cohort of patients with thymic epithelial tumors discussed at a multidisciplinary tumor board for postoperative radiotherapy. Insights from RYTHMIC
Clémence Basse1, Sébastien Thureau2, Suzanna Bota3, Eric Dansin4, Pascal-Alexandre Thomas5, Eric Pichon6, Hervé Lena7, Julien Maziere8, Lucile Durin8, Christelle Clément-Duchene9, Gilbert Massard10, Virginie Westeel11, François Thillays12, Xavier Quantin13, Youssef Oulkhouir14, Delphine Lerouge15, Ronan Tanguy16, Coralie Frenoux17, Pierre Fournel18, Cécile Le Pechoux19, Bernard Dubray20, Luc Thiberville21, Benjamin Besse22, Nicolas Girard23
Authors information :
1 Clémence BASSE :
clembasse@hotmail.fr; Medical Oncology Department, Center Henri Becquerel, Rouen
2 Sébastien THUREAU : sebastien.thureau@chb.unicancer.fr; Radiotherapy Department,
Center Henri Becquerel, Rouen
3 Suzanna BOTA : suzanna.bota@chu-rouen.fr, Respiratory Medicine Department, CHU
Rouen
4 Eric DANSIN : e-dansin@o-lambret.fr ; Respiratory Medicine Department, Center Oscar
5 Pascal-Alexandre THOMAS : pascal-alexandre.thomas@ap-hm.fr; Thoracic Surgery
Department, CHU Marseille
6 Eric PICHON : e.pichon@chu-tours.fr ; Respiratory Medicine Department, CHU Tours 7 Hervé LENA : h.lena@rennes.unicancer.fr , Respiratory Medicine Department, CHU
Rennes
8 Julien MAZIERES: mazieres.j@chu-toulouse.fr; Respiratory Medicine Department, CHU
Toulouse
8 Lucile DURIN : luciledurin@hotmail.fr; Respiratory Medicine Department, CHU Toulouse 9 Christelle CLEMENT-DUCHENE : c.clementduchene@nancy.unicancer.fr ; Respiratory
Medicine Department, Institut de Cancérologie de Lorraine, Nancy
10 Gilbert MASSARD : gilbert.massard@chru-strasbourg.fr ; Thoracic Surgery Department,
CHRU Strasbourg
11 Virginie WESTEEL : virginie.westeel@univ-fcomte.fr ; Respiratory Medicine Department,
CHRU Besançon
12 François THILLAYS : Francois.Thillays@ico.unicancer.fr; Radiotherapy Department ;
13 Xavier QUANTIN : x-quantin@chu-montpellier.fr ; Respiratory Medicine Department,
CHRU Montpellier
14 Youssef OULKHOUIR : oulkhouir-y@chu-caen.fr; Respiratory Medicine Department,
CHU Caen
15 Delphine LEROUGE : d.lerouge@baclesse.unicancer.fr; Radiotherapy Department,
François Baclesse Centre, Caen
16 Ronan TANGUY : ronan.tanguy@lyon.unicancer.fr; Radiotherapy Department, Léon Bérad
17 Coralie FRENOUX : CFrenoux@chu-grenoble.fr; Medical Oncology department, CHU
Grenoble
18 Pierre FOURNEL : Pierre.FOURNEL@icloire.fr; Medical Oncology Department, Saint
Etienne
19 Cécile LE PECHOUX : cecile.lepechoux@gustaveroussy.fr; Radiotherapy Department,
Institut Gustave Roussy, Villejuif
20 Bernard DUBRAY: bernard.dubray@chb.unicancer.fr; Radiotherapy Department, Center
Henri Becquerel, Rouen
21 Luc THIBERVILLE : luc.thiberville@univ-rouen.fr ; Respiratory Medicine Department,
CHU Rouen
22 Benjamin BESSE : benjamin.besse@gustaveroussy.fr ; Medical Oncology Department,
Institut Gustave Roussy, Villejuif
23 Nicolas GIRARD : nicolas.girard2@curie.fr, Medical Oncology Department, Institut Curie, Paris Corresponding author: Nicolas Girard, Phone: +33 144324606 Fax: +33 153104017 E-mail: nicolas.girard2@curie.fr
ABSTRACT
INTRODUCTION
Thymic Epithelial Tumors (TETs) are rare intrathoracic malignancies for which surgery represents the mainstay of the treatment strategy. Postoperative radiotherapy (PORT) to the anterior mediastinal postoperative bed has been historically a standard of care. Through the prospective RYTHMIC cohort of patients, we previously assessed whether PORT decisions were in accordance with ESMO/RYTHMIC guidelines, and ultimately implemented in a cohort of 274 patients; we also verified how ITMIG definitions and recommendations for dose-volume constraints were actually followed in a real practice setting.
METHODS
Through a more prolonged follow-up, we further analysed the outcomes of those patients. RESULTS
From a total of 274 patients enrolled in the cohort analysed for PORT decision-making, 187 were analysed with available data (84 lost of follow-up, 3 wit exclusion criteria). After a median follow-up of 5.1 years, 39 (21%) patients had presented TET recurrence: 27 (32%) in the PORT group, and 12 (12%) in the no-PORT group (p=0.001). Median recurrence-free survival (RFS) was 41.1 (95% CI: 29.2-53.0) months. The most frequent site of relapses among the PORT group was pleura (44%), versus the mediastinum in the no-PORT group (67%). RFS and OS were significantly superior in case of complete resection (p=0.04, and p=0,002). Only 12 patients had died.
CONCLUSIONS
Our data highlight the low - 21% - risk of TET recurrence after a follow-up of 5 years, and the excellent outcome of patients in terms of OS. A longer follow-up is needed in order to
highlight differences in OS between groups. Our data show the limited value of stage and histology to predict recurrences, while completion of surgical resection remains the most significant prognostic and predictive factor for recurrences. Ultimately, we did not identify PORT as being significantly associated with RFS and OS. However, the lack of difference in RFS and OS between groups can be explain by a reduced risk of relapse in the PORT group. Further studies are needed to help identify subgroups of population who can beneficiate from PORT. The higher rate of extra-mediastinal relapses in the no-PORT group encourage us to implement a more frequent control of the disease after surgery.
Keywords: Thymic epithelial tumor, thymoma, thymic carcinoma, postoperative radiotherapy, classification
INTRODUCTION
Thymic Epithelial Tumors (TETs) are rare intrathoracic malignancies [1, 2]. TETs are classified according to the World Health Organization (WHO) system, that distinguishes thymomas from thymic carcinomas [1]. Thymomas are further divided into five subtypes (A, AB, B1, B2, and B3) based upon the morphology of epithelial tumor cells, the relative proportion of the non-tumoral lymphocytic component, and resemblance to normal thymic architecture [3]. TETs are historically staged according to the Masaoka-Koga staging system [4], which is now replaced by the 8th TNM staging classification [5,6].
Surgery represents the mainstay of the treatment strategy. Recurrence rates after surgery range from 10%-20% in Masaoka-Koga stage I-II thymomas to 35% in stage III thymomas and stage I-II thymic carcinomas, and 60% in stage IV thymoma and stage III thymic carcinomas [7]. While numerous recurrences actually occur in the pleura [8], postoperative radiotherapy (PORT) to the anterior mediastinal postoperative bed has been historically a standard of care [2, 9]. Recent reports from large databases [10-17], as well as pooled analyses of retrospective studies [15], lead to consider the potential benefit after radiotherapy as highly debatable after complete resection of thymoma, even invasive (stage II-III) [10-13, 15-17]; in thymic carcinoma, PORT has consistently been identified as associated with better recurrence-free and overall survival [11, 13, 14, 17]. As no randomized or even prospective study has been conducted to assess the effect of PORT on recurrence rate or survival, available guidelines are of low levels of evidence [2, 9].
Réseau tumeurs THYMiques
data for more than 2,500 patients with TET, for whom management was systematically discussed on a real-time, prospective basis at a national multidisciplinary tumor board (MTB). Decisions are based on national recommendations, as well as those from the European Society for Medical Oncology (ESMO) Clinical Practice Guidelines [2]. In a previous study [19], we assessed whether postoperative radiotherapy (PORT) decisions at the MTB were in accordance with ESMO/RYTHMIC guidelines, and ultimately implemented in a cohort of 274 patients; we also verified how ITMIG definitions and recommendations for dose-volume constraints were actually followed in a real practice setting.
In this study, through a more prolonged follow-up, we further analysed the outcomes of this well-defined cohort of patients, to further provide with data regarding recurrence rate, recurrence-free and overall survival in patient who did receive PORT after resection of TET.
MATERIAL AND METHODS
Prospective cohort through multidisciplinary tumor board
RYTHMIC is dedicated to the management of TETs. It was appointed in 2012 by the French Institut National du CAncer (INCA) as part of a rare cancer program [18]. The RYTHMIC MTB takes place twice a month using web-based conferencing system and patients characteristics, treatments, and follow-up are prospectively collected in the network database. MTB decisions are based on the European Society for Medical Oncology (ESMO) Clinical Practice Guidelines [2]. According to ESMO/RYTHMIC guidelines, PORT is not indicated after complete resection of Masaoka-Koga stage I thymoma; PORT is considered for stage II thymoma in case of aggressive histology (type B2, B3) or extensive transcapsular invasion (stage IIB). PORT is recommended after complete resection of stage III/IVA thymoma. For
completely resected thymic carcinomas, PORT is optional for stage I tumors, and is recommended for stage II-IVA tumors. PORT is also recommended in case of incomplete resection.
With regards to follow-up, recommendation of the expert consensus for the ESMO guidelines is to perform computed tomography scan every year for completely resected stage I/II tumors, and every 6 months for 2 years, then yearly, for stage III/IV or R1-2 tumors, for 5 years. Follow-up may then be bi-annual for stage I-II tumors, and annual for stage III/IV tumors.
Cohort of patients
Follow-up has to be continued for 10-15 years given the possible occurrence of late recurrences.
Registration of all patients diagnosed with TET is recommended as a part of good clinical practice for oncologists. As of July 2019, 2,689 patients are registered in the RYTHMIC database, which is hosted by the French Intergroup (Intergroupe Francophone de Cancérologie Thoracique, IFCT) and is compliant to General Data Protection Regulation; the database was approved by the French Authorities (Commission Nationale Informatique et Libertés DR-2016-231).
Inclusion criteria for this analysis were the following: 1) histologically-confirmed TET, 2) surgical resection of the tumor, 3) discussion at the RYTHMIC MTB about whether PORT should be delivered. All consecutive patients for whom PORT was discussed at the MTB from 2012 to 2015 were identified from the RYTHMIC prospective database, and a complete review of medical records was performed.
As previously published [19], a total of 274 patients, including 243 (89%) with thymoma and 31 (11%) with thymic carcinoma, were analyzed. Decision of the MTB was in accordance with guidelines in 221 (92%) of the 241 patients with stage I-III TET. MTB decision of
delivering PORT was made for 117 (43%) patients. PORT was ultimately initiated in 101 patients. The most frequent reason for not delivering PORT was excessive (>3 months) delay after surgery. Dose-volume constraints defined by the International Thymic Malignancy Interest Group were followed in all but 4 patients.
Data collection
The data (including patients baseline characteristics, histology, stage, surgery data, and decision for PORT by the MTB) had previously been collected from the RYTHMIC database, and completed by a review of patients medical records. Masaoka-Koga and TNM stage were assessed according to ITMIG recommendations, using clinical, imaging, and pathological findings [4, 5]. Outcome of patients was retrieved for occurrence and site of recurrence and survival directly from the medical records at each site of the RYTHMIC network.
Statistical analyses
All patients were included in the statistical calculations. Categorical variables were compared using the Chi-square test and continuous variables by the Mann-Whitney non-parametric test. Survival was assessed using the Kaplan-Meier method. Recurrence-free survival was calculated from the date of surgery to the date of relapse, with censoring at the date of last follow-up if the patient had not presented with disease recurrence. Overall survival (OS) was calculated from the date of surgery to the date of death, censoring at the last follow-up date if the patient was alive. Relevant parameters were studied for influence on survival by univariate analysis using the Log Rank test. The differences were considered as statistically significant at the 0.05 level. All analyses were performed using the SPSS software program (Chicago, IL), version 23.0.
RESULTS
Patients characteristics
From a total of 274 patients enrolled in the cohort analysed for PORT decision-making, 84 patients were lost of follow-up, including 81 thymomas and 3 thymic carcinomas; 79% of those patients had TNM stage I TET. Three patients were excluded of the analysis for exclusion criteria. The current analysis then relies on 187 patients with available follow-up (Table 1): overall, there were 159 (85%) thymomas, and 28 (15%) thymic carcinomas; among thymomas, 65 patients (41%) received PORT, and 94 patients (59%) did not; and among thymic carcinoma 19 patients (68%) received PORT, and 9 (32%) did not. These figures were in line with that of the whole cohort of 274 patients [19]. As previously reported, the following characteristics were significantly associated with a decision of delivering PORT: thymic carcinoma (p<0.001) and type B3 thymoma (p<0.001) vs. other subtypes, higher Masaoka-Koga (p<0.001) and 8th TNM (p<0.001) stages vs. lower stages, incomplete resection vs. complete resection (p<0.001).
Indications for PORT
Indications and decision-making for PORT in the whole cohort of 274 patients had previously been described [19]. For this group of 187 patients with available follow-up data, the 84 patients for whom PORT was delivered were the following, according to the Masaoka-Koga staging system: 3 patients with stage I TETs, including 1 thymic carcinoma and 2 thymoma with a R1 resection; 11 patients with stage IIa TET, including 4 carcinomas, 2 type B3 thymomas, 4 type AB or B2 thymomas with R1 resection, and 1 type AB thymoma with effraction during surgery; 19 patients with stage IIb TET received PORT, including 1 thymic carcinoma, 4 type B3 thymomas, and 14 thymomas of other histology with R1 resection; 22
stage III, and 20 stage IVa/b TET had PORT after surgical resection. Overall, PORT was delivered according to the ESMO clinical practice guidelines in all but 4 patients. Meanwhile, the absence of PORT administration either based on the MTB decision or ultimately delays or comorbidities or poor medical condition - in the other 106 patients was in accordance with the guidelines in 91 patients. For 6 patients stage IVa or IVb no recommendation could be given. Nine patients did not received PORT in contradiction with recommandations for the following reasons : 6 patients because of their old age and comorbidities, 1 patient because of a preexisting cardiomyopathy, 1 patient because of post surgery complications, and 1 patient with an atypic carcinoid tumor.
Overall, PORT delivery was significantly associated with higher stage (whatever staging system used Masaoka-Koga or TNM; p<0.001), more aggressive histology (p<0.001).
Recurrence-free survival
After a median follow-up of 5.1 years, 39 (21%) patients out of the 187 had presented with TET recurrence: 27 (32%) in the PORT group, and 12 (12%) in the no-PORT group (p=0.001). Median recurrence-free survival (RFS) was 41.1 (95% CI: 29,2-53,0) months (Figure 1A). Overall, 14 (36%) patients developed recurrences in the mediastinum, 21 (54%) in the lung or the pleura, and 4 (10%) at other sites (Figure 1B). Among the relapses, 44% of patients had relapses in the mediastinum in the PORT group, versus 67% in the no-PORT group. Recurrence-free survival was significantly lower in case of complete resection (p=0.019). (Table 2). In our cohort, stage, histology, accordance of PORT decision with guidelines, and actual delivery of PORT (Figure 1C) were not significantly associated with RFS (p=0.24, p=0,33, p=0.13, and p=0.31, respectively).
At the time of analysis, 12 patients had died, including 5 deaths related to disease progression (4 patients had invasive stage IIB-IV - thymic carcinoma, and 1 had type B2, stage IVA thymoma), 3 deaths related to other malignancy (breast cancer, lung cancer, and sarcoma), 1 death related to oesotracheal fistula (PORT had been delivered), 1 death related to cardiovascular event (no PORT had been delivered), and 2 deaths for other reason. 3- and 5-year overall survival (OS) rates were 96% and 94% (Figure 2A). Completion of resection was associated with a significantly higher OS (p=0.002). OS was not significantly associated with PORT delivery (p=0.78) (Figure 2B). OS was significantly lower in case of occurrence of a tumor recurrence (p=0.001).
DISCUSSION
Taking advantage of the RYTHMIC network infrastructure, our analysis is to our knowledge, the first study to assess the outcome of a large cohort of patients with resected TET for whom decision-making for PORT was made through the unique setting of systematic prospective discussion at an expert MTB, according to pre-established guidelines and with the insurance of PORT delivery in accordance with standard quality criteria, as previously reported [19]. Our data highlight the low - 21% - risk of TET recurrence after a follow-up of 5 years, and the excellent outcome of patients in terms of OS. Our data show the limited value of stage and histology to predict recurrences, while completion of surgical resection remains the most significant prognostic and predictive factor for recurrences. Ultimately, we did not identify PORT as being significantly associated with RFS and OS, what may challenge the current recommendations for the delivery of PORT, as well as the follow-up schedule of patients after surgical resection of TET. However, population were note comparable in this work: population receiving PORT had higher stages and mostly uncomplete surgical resection.