Les effets synergiques des cytokines pro-inflammatoires et des cytokines impliquées dans l’homéostasie sur les réponses des lymphocytes T CD8 aux antigènes
Par Julien Gagnon
Programme d’études supérieures en immunologie
Thèse présentée à la Faculté de médecine et des sciences de la santé en vue de l’obtention du grade de philosophiae doctor (Ph.D.) en immunologie
Sherbrooke, Québec, Canada 15 avril 2016
Subburaj Ilangumaran, Ph.D. (directeur) Gilles Dupuis Ph.D . (co-directeur) Klaus Klarskov Ph.D. (co-directeur)
Patrick McDonald Ph.D. (interne du programme d’immunologie) Guylain Boulay Ph.D. (externe du programme d’immunologie)
Martin Guimond Ph.D. (examinateur externe)
RÉSUMÉ
Les effets synergiques des cytokines pro-inflammatoires et des cytokines impliquées dans l’homéostasie sur les réponses des lymphocytes T CD8 aux antigènes
Par Julien Gagnon
Programme d’études supérieures en immunologie
Thèse présentée à la Faculté de médecine et des sciences de la santé en vue de l’obtention du grade de Philosophiae Doctor (Ph.D.) en immunologie. Faculté de médecine et des sciences de la santé, Université de Sherbrooke, Sherbrooke, Québec, Canada, J1H 5N4
L’IL-7 et l’IL-15 sont des cytokines impliquées dans l’homéostasie des lymphocytes T CD8 naïfs et mémoires respectivement. Lors d’une réponse immunitaire, certaines cytokines pro-inflammatoires, comme l’IL-6 et l’IL-21, sont produites par les cellules du système immunitaire inné. Nous avons observé que certaines cytokines de ces deux groupes (homéostasie et pro-inflammatoires), peuvent avoir un effet synergique sur la fonction des lymphocytes T CD8. Spécifiquement, l’incubation des lymphocytes T CD8 naïfs avec l’IL-6 ou l’IL-21, en présence d’IL-7 ou d’IL-15 cause une forte prolifération qui est indépendante de l’antigène. De plus, la combinaison d’IL-15 avec l’IL-6 ou l’IL-21 entraîne une prolifération préférentielle des lymphocytes T mémoires, tandis que la combinaison avec l’IL-7 entraîne une prolifération des lymphocytes T naïfs. La stimulation des lymphocytes T CD8 avec l’IL-6 ou l’IL-21, en présence d’IL-7 ou d’IL-15, entraîne une augmentation de la phosphorylation en tyrosine de STAT5 ainsi qu’une augmentation de liaison à l’ADN.
Nous avons étudié l’effet d’une pré-stimulation des cellules T CD8 naïves par les cytokines synergiques sur leur réponse subséquente à un antigène. Nous avons observé qu’une pré-stimulation avec l’IL-6 ou l’IL-21, en présence d’IL-7 ou d’IL-15, même pour une courte durée de 24 heures, augmente leur sensibilité aux antigènes, entraînant une robuste prolifération et une forte augmentation de cytotoxité spécifique à l’antigène gp33. Nous avons observé que les cytokines pro-inflammatoires en combinaison avec l’IL-7 induisent une augmentation accrue de la prolifération chez les lymphocytes T CD8 exprimant un TCR transgénique de forte affinité (P14), ainsi que les cellules exprimant un TCR de faible affinité (H-Y). De plus, la combinaison synergique de cytokines entraîne une forte expression du récepteur de l’IL-2R (CD132), ainsi qu’une augmentation de la production d’IL-2 après stimulation antigénique. Une forte augmentation de l’expression de CD8 et de CD45, ainsi qu’une diminution drastique de l’expression de CD5 peut expliquer l’augmentation de l’avidité fonctionnelle du TCR suite à une stimulation avec les combinaisons de cytokines synergiques. La stimulation des lymphocytes T CD8 avec les combinaisons de cytokines, induit une augmentation de la phosphorylation de LAT ainsi qu‘AKT. Cependant, la stimulation subséquente du CD3 n’entraîne pas d’augmentation de la phosphorylation de LAT ainsi qu’AKT chez les lymphocytes T CD8 pré-stimulés avec les combinaisons de cytokines. Nous avons aussi observé que les lymphocytes T CD8 stimulés avec les combinaisons de cytokines augmentent l’expression de CD62L, ce qui peut favoriser leur migration vers les ganglions lymphatiques.
En conclusion, la production de cytokines pro-inflammatoires (IL-6, IL-15, IL-21) par les cellules du système immunitaire inné lors d’une infection ou d’une inflammation, ainsi que la présence constitutive d’IL-7, peuvent stimuler la prolifération et l’activation des lymphocytes T CD8 de façon non spécifique à l’antigène. Cette stimulation entraîne une augmentation de l’avidité fonctionnelle de leur TCR causant ainsi une forte prolifération ainsi que l’acquisition de fonctions effectrices spécifiques. Cette liaison entre le système immunitaire inné et adaptatif, médiée par les cytokines pro-inflammatoires et les cytokines homéostatiques joue un rôle très important dans l’élimination des pathogènes ainsi que dans le développement de maladies auto-immunitaires.
SUMMARY
Increased antigen responsiveness of CD8 T cells after cytokine primings
By Julien Gagnon Immunology program
Thesis presented at the Faculty of medicine and health sciences for partial fulfillement of the Philosophiae Doctor (Ph.D.) degree in immunology, Faculty of medicine and health
Homeostasis of naive and memory CD8+ T lymphocytes is dependent on two cytokines IL-7 and IL-15, respectively. During an immune response to an infection, cells of the innate immune system produce several pro-inflammatory cytokines. We have observed that these two groups of cytokines, namely proinflammatory and homeostatic, can have a synergistic effect on CD8 T lymphocytes. Specifically, incubation of naive CD8 T cells with IL-6 or IL-21 in the presence of IL-7 or IL-15 induced strong proliferation in an antigen independent manner. While the combination of IL-6 or IL-21 with IL-15 induced strong proliferation of memory CD8 T cells, naïve CD8 T cells responded better to the combination with IL-7. These stimulatory cytokine combinations elicited strong STAT5 phosphorylation and it’s binding to DNA in CD8 T cells.
We investigated the effect of priming CD8 T cells with the synergistic combination of IL-6 or IL-21 and IL-7 on their subsequent response to antigen. We observed that cytokine priming for only 24 hours enhanced their sensitivity to antigen, resulting in strong proliferation, effectors functions and cytotoxicity. These effects were observed with CD8 T cells expressing transgenic TCR with strong (P14) or weak (H-Y) affinity towards cognate peptide antigens. Priming CD8 T cells with the synergistic combination of cytokines increased the expression of IL-2 receptor gamma (CD132) and augmented the production of IL-2 when stimulated with antigen. These cells also expressed elevated levels of CD8 and CD45, as well as down modulate CD5, and these events may underlie the increased TCR avidity. Stimulation of CD8 T cells with the synergistic combination of cytokines induced phosphorylation of LAT and AKT. However, subsequent TCR stimulation did not further increase these phosphorylation events. We have observed that CD8 T cells primed with the synergistic combinations of cytokines up regulated CD62L, which could promote their migration through lymph nodes.
In conclusion, inflammatory cytokines such as (IL-6, IL-15, IL-21) secreted by cells of the innate immune system during an infection or non-infectious inflammation, and basal levels of the homeostatic cytokine IL-7 can act in synergy with inflammatory cytokines to activate CD8 T lymphocytes in an antigen independent manner. This stimulation also results in an increase in the functional avidity of their TCR, as indicated by strong antigen responsiveness with increased proliferation and display of effectors functions. This connection between the innate and adaptive system mediated by inflammatory cytokines may play an important role in pathogen clearance and possibly in the development of autoimmune diseases.
TABLE DES MATIÈRES
RÉSUMÉ ... I SUMMARY ... III TABLE DES MATIÈRES ... V LISTE DES FIGURES ... VII LISTE DES TABLEAUX ... IX LISTE DES ABRÉVIATIONS UTILISÉES ... X
CHAPITRE 1 - INTRODUCTION ... 1
1. SYSTÈME IMMUNITAIRE ... 1
1.1. Réponse immunitaire innée ... 1
1.2. Réponse immunitaire adaptative par les lymphocytes T... 2
2. GÉNÉRATION, MATURATION ET SÉLECTION DES LYMPHOCYTES T ... 3
3. ACTIVATION DES LYMPHOCYTES TCD8 NAÏFS ... 5
4. GÉNÉRATION DES LYMPHOCYTES TCD8 MÉMOIRES ... 7
5. RÔLES DES LYMPHOCYTES TCD4 DANS L’ACTIVATION ET LA TOLÉRANCE. ... 9
6. HOMÉOSTASIE DES LYMPHOCYTES T ... 11
6.1. Lymphocytes T naïfs ... 12
6.2. Lymphocytes T mémoires ... 14
6.3. Lymphopénie ... 14
6.4. Maladies auto-immunes induites par la lymphopénie ... 16
6.5. Cytokines impliquées dans la génération de maladies auto-immunes ... 18
7. CYTOKINES ET LEURS RÉCEPTEURS ... 20
7.1. Famille des cytokines ... 20
7.2. Rôles biologiques de l’IL-2, l’IL-4, l’IL-7, l’IL-9 et l’IL-15 ... 23
7.3. Rôles biologiques de l’IL-21... 23
7.4. Rôles biologiques de l’IL-6 ... 28
7.5. Récepteurs des cytokines partageant la chaîne gamma commune (c) ... 28
7.6. Récepteur des cytokines partageant la chaîne commune gp130... 32
8. SIGNALISATION DES RÉCEPTEURS DE CYTOKINES ... 33
8.1. Signalisation des récepteurs de cytokines de la famille c ... 35
8.2. Signalisation des récepteurs de cytokines de la famille gp130 ... 39
9. INHIBITION DE LA VOIE DE SIGNALISATION DES CYTOKINES ... 41
9.1. Récepteurs de cytokines solubles ... 41
9.3. Phosphatases ... 42
9.4. « Suppressor of cytokines signaling » (SOCS) ... 43
10. SIGNALISATION DU TCR ... 47
10.1. Caractéristiques du récepteur du TCR ... 47
10.2. Affinité et avidité du TCR ... 47
10.3. Initiation de la signalisation par le complexe du TCR ... 48
10.4. Organisation spatio-temporelle du complexe du TCR... 52
10.5. Signalisation distale du TCR ... 53
CHAPITRE 2 - ARTICLE 1 ... 56
RÉSUMÉ ... 58
ABSTRACT ... 60
INTRODUCTION ... 60
MATERIALS AND METHODS ... 62
RESULTS ... 66 DISCUSSION ... 84 ACKNOWLEDGMENTS ... 87 REFERENCES ... 87 CHAPITRE 3 ARTICLE 2 ... 94 RÉSUMÉ ... 96 ABSTRACT ... 98 INTRODUCTION ... 99 RESULTS ... 101 DISCUSSION ... 116 METHODS ... 119 ACKNOWLEDGMENTS ... 122 REFERENCES ... 122 CHAPITRE 4 ... 126 INTRODUCTION ... 127 MATÉRIELS ET MÉTHODES ... 128 RÉSULTATS ... 130 CHAPITRE 5 - DISCUSSION ... 141 CHAPITRE 6 - CONCLUSION ... 155 REMERCIEMENTS ... 157 RÉFÉRENCES ... 158
LISTE DES FIGURES
Figure 1 : Développement des lymphocytes T dans le thymus. ... 4
Figure 2 : Trois signaux afin d’engendrer une réponse immunitaire optimale ... 7
Figure 3 : Influence des cytokines pro-inflammatoires dans la génération des lymphocytes T CD8 mémoires. 8 Figure 4 : Polarisation des lymphocytes T CD4 dépendante des cytokines ... 11
Figure 5 : Effets de la lymphopénie sur la diversité de la population de lymphocytes T. ... 17
Figure 6 : Rôles biologiques de l’IL-21. (Leonard et al., 2008)... 27
Figure 7 : Récepteurs de la famille de l’IL-2. ... 29
Figure 8 : Phénotypes et nombre relatif de lymphocytes T CD8+ avant, pendant l’activation et lors de la génération de lymphocytes T CD8+ mémoires. ... 31
Figure 9 : Signalisation des cytokines par la voie des JAK/STAT. ... 34
Figure 10 : Signalisation du récepteur de l’IL-21. ... 38
Figure 11 : Signalisation du récepteur de l’IL-6. ... 40
Figure 12 : Inhibition des voies de signalisation des récepteurs de cytokines ... 46
Figure 13 : Initiation de la signalisation du TCR par agrégation. ... 49
Figure 14 : Ségrégation du complexe du TCR. ... 51
Figure 1. IL-6 induces proliferation of CD8+ T cells in the presence of IL-7 or IL-15. ... 68
Figure 2 : Comparison of the synergistic effects of IL-6 and IL-21 in stimulating proliferation CD8+ T cells in the presence of IL-7 or IL-15. ... 70
Figure 3. IL-6 stimulates proliferation of naïve and memory CD8+ T cells in synergy with IL-7 or IL-15. .... 73
Figure 4. Concomitant stimulation of CD8+ T lymphocytes by IL-6 or IL-21 augments STAT5 phosphorylation and its DNA-binding activity induced by IL-7 or IL-15. ... 77
Figure 5. Pre-stimulation of CD8+ T cells with IL-6 and IL-7 lowers the TCR signaling threshold. ... 79
Figure 6. Cytokine-stimulated CD8+ T cells display increased cytolytic activity following Ag re-stimulation. ... 81
Figure 7. Cytokine stimulation of P14 cells induces a distinct phenotypic differentiation program compared to stimulation via the TCR. ... 83
Figure 1. Brief exposure to IL-7 and IL-6 or IL-21 is sufficient to ‘prime’ naive CD8 T cells to proliferate robustly upon subsequent antigen stimulation. ... 103
Figure 2. Cytokine priming strongly enhances antigen-induced cytolytic activity in naive CD8 T cells. ... 105
Figure 3. Cytokine priming of naive CD8 T cells rapidly enhances antigen-induced secretion of IFN and IL-2. ... 107
Figure 4. Increased proliferation of cytokine-primed P14 cells to antigen requires autocrine IL-2 stimulation. ... 109
Figure 5. Cytokine priming augments TCR-stimulated proliferation independently of costimulation. ... 112 Figure 6. Cytokine priming rapidly downmodulates CD5 via induction of its transcriptional repressor E47. 115
Figure 1: L’affinité du TCR influence le phénotype des lymphocytes T CD8 après une stimulation de 2 jours avec les cytokines. ... 132 Figure 2: La préstimulation avec l’IL-7 en combinaison avec l’IL-6 ou l’IL-21 augmente la sensibilité du récepteur CD8 ... 134 Figure 3: La préstimulation avec l’IL-7 en combinaison avec l’IL-6 ou l’IL-21 augmente la sensibilité du récepteur CD8 ... 136 Figure 4: La stimulation de lymphocytes T CD8 avec l’IL-7 en combinaison avec l’IL-6 ou l’IL-21 entraine une forte expression de CD45. ... 138 Figure 5: La stimulation avec l’IL-6 et l’IL-21 en combinaison avec l’IL-7 augmente la présence de GM1. 140
LISTE DES TABLEAUX
Tableau 1 : Implications de l’IL-21 et de la lymphopénie dans le développement de maladies auto-immunes. ... 19 Tableau 2 : Implications de l’IL-6 et de la lymphopénie dans le développement de maladies auto-immunes . 19 Tableau 3 : Famille de récepteurs des cytokines de type I et de type II ... 22 Tableau 4 : Phénotypes des souris déficientes en cytokines ou en leurs récepteurs de la famille IL-2 ... 36
LISTE DES ABRÉVIATIONS UTILISÉES ADN Acide désoxyribonucléique
Ag Antigène
AP1 Activator Protein-1
CPA Cellule présentatrice d’antigène ARN Acide Ribonucléique
Bad Bcl-2-associated death promoter Bax Bcl-2–associated X
CBM Cytokine binding module CCR C-C chemokine receptor CD Cluster of differentiation
CMH Complexe majeur d’histocompatibilité CRP C rective protein CXCR C-X-C chemokine receptor DAG Diacylglycérol Dc Cellule dendritique DN Double négatif DP Double positif
EAE Experimental autoimmune encephalomyelitis FACS Fluorescence-activated cell sorting
FERM F for 4.1 protein, E for ezrin, R for radixin and M for moesin Foxp3 forkhead box P3
GAS IFN activation sequence GDP Guanosine diphosphate
GEF Guanine nucleotide exchange factors Glut-1 Glucose transporter
GM-CSF Granulocyte-macrophage colony-stimulating factor Gp Glycosylated protein
Grb2 Growth factor receptor-bound protein 2 GTP Guanosine-5'-triphosphate
IFN Interferons
Ig Immunoglobulin
IRES IFN-stimulated response elements Itk IL2-inducible T-cell kinase
JAK Janus kinase
Kd dissociation constant Lat Linker of Activated T cells
Lck Lymphocyte-specific protein tyrosine kinase LIF Leukemia inhibitory factor
LIP Lymphopenia-induced proliferation
LPS Lipopolysaccharides
M Molaire
MAPK Mitogen-activated protein kinases NF-AT Nuclear factor of activated T-cells
NK Natural killer
PAMP Pathogen-associated molecular patterns PI3K Phosphoinositide 3-kinase
PIAS Protein inhibitors of activated STAT
PIP3 Phosphatidylinositol (3,4,5)-triphosphate (PtdIns(3,4,5)P3)
PLC Phospholipase C
PRR Patron de reconnaissance de pathogène PTB Phosphotyrosine-binding domain
PTP1B Protéine-tyrosine phosphatase 1B RET Récemment émigrés du thymus RFI Intensité de fluorescence relative SCF Side Scatter
SH2 Src Homology 2
SOCS Suppressor of cytokine signaling SP Simple positive
Tcm Lymphocyte T mémoire central TCR T cell receptor
Tem Lymphocyte T mémoire effecteur
Tg Transgénique
Th Lymphocyte T helper
Tfh Lymphocyte T helper folliculaire TLR Toll-like receptors
TNF Tumor necrosis factors Treg Lymphocyte T régulateur
CHAPITRE 1 - INTRODUCTION
Dans cette introduction, nous allons aborder l’importance des cytokines dans la génération, le maintien et le fonctionnement du système immunitaire.
1. Système immunitaire
Le système immunitaire est composé d’un ensemble d’organes formés de tissus et de cellules dont l’objectif est de protéger l’organisme contre les pathogènes (virus, bactéries, parasites et champignons) et contre des cellules cancéreuses. Le système immunitaire comporte plusieurs organes lymphoïdes, dont la moelle osseuse, les ganglions lymphatiques, la rate et le thymus. Certaines cellules du système immunitaire patrouillent l’organisme grâce au réseau sanguin et lymphatique, tandis que d’autres cellules sont résidentes de tissus.
Une réponse immune se déroule de façon ordonnée et comporte deux phases. La première qui débute par une reconnaissance spécifique à un type de pathogène (immunité innée) et qui évolue vers la deuxième phase, la réponse spécialisée (immunité acquise). La coordination de la réponse immunitaire est dirigée par des messagers solubles, appelés cytokines.
1.1. Réponse immunitaire innée
Le système immunitaire se divise en deux sections : le système immun inné et le système immun adaptatif. La réponse immunitaire innée est la réponse initiale contre un pathogène et ne génère pas de mémoire immunitaire. À la suite de l’invasion d’un pathogène à travers la couche de cellules épithéliales, il sera phagocyté par les macrophages, les cellules dendritiques et les neutrophiles. Les cellules phagocytaires détectent et s’activent grâce aux récepteurs de patrons de reconnaissance de pathogène (PRRs) qui reconnaissent les motifs moléculaires associés aux pathogènes (PAMPs) (Palm et al., 2009). Les PAMPs reconnus par les PRR doivent être uniquement exprimés par les pathogènes et doivent représenter une diversité de pathogènes. La réponse immunitaire innée résorbe l’infection en
induisant de l’inflammation, en phagocytant les pathogènes, en produisant des substances bactéricides et en recrutant d’autres cellules phagocytaires. Lors de la réponse initiale par les cellules du système immunitaire inné, il y a une production de cytokines pro-inflammatoires qui auront un effet subséquent sur le développement de la réponse immunitaire spécifique (Curtsinger et al., 1999).
1.2. Réponse immunitaire adaptative par les lymphocytes T
Les cellules phagocytaires activées (macrophages et cellules dendritiques) migrent vers les ganglions lymphatiques afférents au site d’infection. Les cellules phagocytaires dégradent les pathogènes en petits peptides qui sont ensuite exprimés à la surface cellulaire grâce au complexe majeur d’histocompatibilité (CMH). Il existe 2 types de CMH, le CMH de classe I, qui présente aux lymphocytes T CD8 des peptides provenant du cytosol de la cellule, ainsi que le CMH de classe II qui présente aux lymphocytes T CD4 des peptides provenant de particules phagocytées. Ces cellules présentatrices d’antigènes (CPA) activent le récepteur de lymphocyte T (TCR) d’un lymphocyte T CD4 qui reconnaît spécifiquement cet antigène présenté par un CMH de classe II. Une fois activés, les lymphocytes T CD4 produisent des cytokines permettant de diriger la réponse immunitaire vers une réponse humorale, en activant les lymphocytes B ou une réponse cellulaire en activant les lymphocytes T CD8 cytotoxiques. Les lymphocytes T CD8 quittent les ganglions lymphatiques et migrent vers le site d’infection. Les lymphocytes T activés reconnaissent spécifiquement, grâce à leur TCR, les antigènes présentés par un CMH de classe I exprimé par les cellules et les tuent grâce à leur action cytotoxique (Lefrancois et al., 2010).
La réponse immunitaire adaptative a un inconvénient, elle nécessite plusieurs jours afin de générer une réponse immunitaire spécifique. Par contre, elle possède l’avantage de générer beaucoup de lymphocytes mémoires spécifiques aux pathogènes, ce qui permet d’écourter la durée d’une réinfection par le même pathogène.
2. Génération, maturation et sélection des lymphocytes T
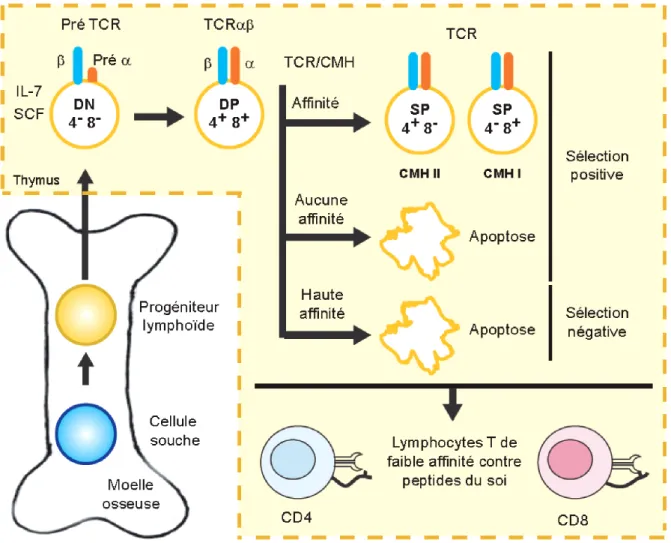
Les cellules du système immunitaire sont originaires de cellules souches hématopoïétiques provenant de la moelle osseuse. Les cellules lymphoïdes précurseures des lymphocytes T migrent de la moelle osseuse au thymus (Akashi et al., 2000). Lors de la première étape de la maturation, les cellules lymphoïdes n’expriment pas le TCR, ni les marqueurs de surface CD4 ou CD8, ils sont nommés double négatif (DN) (Takahama, 2006). L’IL-7 et le SCF sont deux cytokines essentielles à la maturation des lymphocytes T. En absence de ces cytokines, il a une diminution importante de génération de lymphocytes T (Akashi et al., 2000). Le récepteur des lymphocytes T (TCR) est formé d’une chaîne bêta et alpha qui est exprimée après recombinaison. Durant la phase DN3 les thymocytes expriment la chaîne bêta, par la suite ces thymocytes vont exprimer le CD4 et le CD8 à leur surface, ces cellules sont nommées double positif (DP) (Hayday et al., 2006). À cette étape, le TCR alpha est exprimé après recombinaison des gènes. La formation de dimère des chaînes TCR alpha et bêta va générer une très grande diversité de récepteurs (1x1013) (Nikolich-Zugich et al., 2004). Cette diversité va ensuite être modelée par la sélection thymique afin d’éliminer les lymphocytes T exprimant un TCR autoréactif ou les TCR qui ne reconnaissent aucun antigène. La première étape est la sélection positive. Les lymphocytes T expriment à leur surface une seule recombinaison du TCR. Lors de la sélection positive, les lymphocytes T dont le TCR reconnaît un peptide du soi présenté par une molécule du CMH (classe I ou II) vont survivre, tandis que les lymphocytes T dont le TCR ne reconnaît rien meurt par négligence (~98 %). Par la suite, la sélection négative entraîne l’élimination par apoptose des lymphocytes T reconnaissent trop fortement les peptides du soi (~1 %) (Sprent et al., 2008). Les lymphocytes T expriment à leur surface le CD4 ou le CD8 selon leur interaction avec le CMH-II ou le CMH-I respectivement (Hayday et al., 2007) (Figure 1). Seulement 1 à 2 % des thymocytes survivent à la sélection thymique (Bevan, 1997). Cependant, la sélection n’est pas parfaite, une proportion de lymphocytes T autoréactifs échappent à la sélection thymique et se retrouvent en périphérie (Parish et al., 2008). Ces lymphocytes T autoréactifs sont contrôlés par la tolérance immune.
Figure 1 : Développement des lymphocytes T dans le thymus. Inspiré de (Fridkis-Hareli et al., 2004).
3. Activation des lymphocytes T CD8 naïfs
Après leur développement, les lymphocytes T CD8+ naïfs émigrent hors du thymus et colonisent les organes lymphoïdes périphériques. Les lymphocytes T CD8+ sont impliqués dans la reconnaissance et la destruction de cellules infectées par des pathogènes ainsi que des cellules tumorales. La réponse des lymphocytes T CD8+ passe par quatre phases : l’activation, l’expansion clonale, la contraction et la génération de lymphocytes T CD8+ mémoires.
Les lymphocytes T CD8 nécessitent 3 signaux pour atteindre leur activité maximale. Le premier signal provient du TCR qui reconnaît un peptide présenté par une molécule de CMH de classe I. Le TCR des lymphocytes T CD8 reconnaît des peptides (9-11 acides aminés de long) présentés par un CMH-I. Le CMH-I est exprimé de façon ubiquitaire par presque toutes les cellules nucléées de l’organisme. Le CMH-I présente à sa surface membranaire des peptides qui ont été synthétisés à l’intérieur de la cellule (peptide du soi, peptides viraux ou de pathogènes intracellulaires) (Bonilla et al., 2010). Les CPA peuvent aussi faire de la présentation croisée, c’est-à-dire qu’un pathogène extracellulaire qui a été phagocyté peut-être présenté par le CMH-I (Heath et al., 2001). Dans la plupart des cas, les lymphocytes T CD8 naïfs sont activés dans les ganglions lymphatiques (Huber et al., 2009) par présentation croisée avec les cellules dendritiques. Le résultat de cette rencontre va dépendre du stade de maturation des cellules dendritiques. La présentation d’un Ag par une cellule dendritique immature va entraîner la tolérance (ignorance, délétion, anergie) tandis que la présentation d’un Ag par une cellule dendritique mature entraîne l’activation des lymphocytes T CD8 (Steinman et al., 2003).
Les cellules dendritiques matures expriment des molécules de co-stimulation qui sont nécessaires pour l’activation des lymphocytes T CD8. Le récepteur CD28 des lymphocytes T CD8 interagit avec les molécules CD80 et le CD86 exprimé par les CPA matures. Les CPA peuvent murir de deux façons, la stimulation des récepteurs de motifs de reconnaissance de pathogènes (PRR) comme les TLR, ainsi que par l’interaction avec un lymphocyte T CD4 activé exprimant le CD40 ligand (Bennett et al., 1998). La combinaison de la signalisation du TCR et de la stimulation des molécules de co-stimulation entraînent l’activation des lymphocytes T CD8.
Cependant, il a été rapporté dans la littérature que même si les DC expriment fortement les molécules de co-stimulation, certains Ag induisent peu ou pas l’activation des lymphocytes T CD8 (Fujii et al., 2004).
Afin d’obtenir une activation maximale, un troisième signal est nécessaire. Le troisième signal est fourni par les interférons de type I (IFN et ), l’IFN, et l’IL-12. Ces cytokines pro-inflammatoires sont produites par les cellules du système immunitaire inné comme les CPA activées. Il a été montré qu’en absence d’IL-12 ou d’IFN les lymphocytes T CD8 naïfs purifiés proliféraient peu in vitro lorsqu’ils étaient exposés à un Ag présenté par une CPA artificielle exprimant des molécules de costimulation. Cependant, la prolifération des lymphocytes mémoires est indépendante des cytokines pro-inflammatoires (Curtsinger et al., 1999). Il a été aussi montré que la présence d’IL-12 augmentait la production de lymphocytes T effecteurs (Gately et al., 1991) et que les IFN/ augmentaient leur survie (Marrack et al., 1999) et la production d’IFN(Nguyen et al., 2002).
Les lymphocytes T CD8+ activés produisent de l’IL-2 qui agit de manière autocrine et stimule l’expansion clonale et la différenciation en cellules effectrices. L’expansion clonale des lymphocytes T effecteurs est indépendante du TCR, mais est soutenue par des cytokines IL-2, IL-7 et IL-15 (Mercado et al., 2000 ; Badovinac et al., 2002). Les lymphocytes T effecteurs sont cytotoxiques et peuvent engendrer l’apoptose spécifique des cellules infectées par la libération de granules (granzyme B et perforines) ou par l’activation de la voie de Fas/FasL des cellules cibles (Harty et al., 2002). Les lymphocytes T CD8+ effecteurs ont une expression plus importante de certains marqueurs de surface, dont le CD69, IL-2R (CD25), IL-2R (CD122) c (CD132), CD44, et à la baisse de CD62L.
En conclusion, la réponse optimale des lymphocytes T CD8 nécessite 3 signaux (figure 2). Le premier signal se fait par la signalisation du TCR à la suite de la rencontre d’un Ag présenté par un CMH-I exprimé sur une CPA mature. La CPA mature exprime des ligands de co-stimulation qui va induire le signal numéro deux en stimulant le CD28 exprimé chez les lymphocytes T CD8. Le troisième signal est induit par les cytokines pro-inflammatoires comme IL-12, IFN et IFN produit par les CPA matures.
Figure 2 : Trois signaux afin d’engendrer une réponse immunitaire optimale Inspiré de l’article (Gutcher et al., 2007)
4. Génération des lymphocytes T CD8 mémoires
Les lymphocytes T mémoires sont issus de l’activation de lymphocytes T naïfs suite à la rencontre avec un antigène présenté par un CMH et reconnu spécifiquement par le TCR de ces lymphocytes. À la suite de l’activation, il y a une expansion clonale et l’acquisition de capacités effectrices et finalement l’élimination des pathogènes. Lorsque l’infection est résolue, 95 % des lymphocytes effecteurs entrent en apoptose et seulement 5 % se transforment en lymphocytes T mémoires (Stemberger et al., 2009). La contraction de la réponse immunitaire des cellules T CD8 est causée par l’absence de stimulation antigénique, l’épuisement des ressources en cytokines et à l’induction de l’AICD par IL-2 (Refaeli et al., 1998 ; Marrack et al., 2000). Les processus et les facteurs qui déterminent la sélection d’un lymphocyte T CD8 activé pour une différenciation en cellule mémoire ne sont pas encore bien connus.
Les lymphocytes T mémoires se caractérisent par une augmentation de la rapidité, de la magnitude et de la sensibilité à la réponse à un antigène (Jameson et al., 2009). Les lymphocytes T mémoires ont des phénotypes variés, mais peuvent se classer en deux catégories : les lymphocytes T mémoires centraux et effecteurs. Les
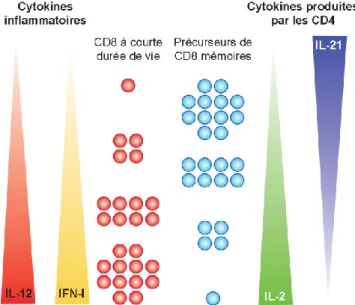
lymphocytes T mémoires centraux (Tcm) expriment fortement le CD62L et le CCR7 leur permettant de migrer vers les ganglions lymphatiques et la rate (Sallusto et al., 2004). Tandis que les lymphocytes mémoires effecteurs (Tem) expriment faiblement ces molécules de surface cellulaire et se retrouvent dans les organes non lymphoïdes (poumon, foie et intestin) possiblement à l’endroit d’inflammation où ils ont le plus de possibilités de rencontrer leur antigène (Refaeli et al., 1998 ; Masopust et al., 2001). Les cellules Tem ont une capacité de réponse immédiate à un pathogène . Certaines cytokines pro-inflammatoires peuvent influencer la génération de lymphocytes T mémoires (figure 3). Une inflammation importante et des cytokines pro-inflammatoires comme l’IL-2 et l’IL-12 entraînent une augmentation du nombre de lymphocytes T effecteurs de courte durée de vie tandis que le déclin de l’inflammation va engendrer des lymphocytes T mémoires centraux (D’cruz et al., 2009). De plus, il a été montré que la surexpression de l’IL-21 entraîne une augmentation du nombre de lymphocytes T CD8 mémoires (Allard et al., 2007).
Figure 3 : Influence des cytokines pro-inflammatoires dans la génération des lymphocytes T CD8 mémoires.
5. Rôles des lymphocytes T CD4 dans l’activation et la tolérance.
Les lymphocytes T CD4 ont un rôle primordial dans l’orchestration de la réponse immune adaptative en sécrétant des cytokines impliquées dans l’activation de la réponse humorale ou cellulaire. Les lymphocytes T CD4 ont aussi un rôle important dans la maturation des CPA. Le TCR des lymphocytes T CD4 reconnaît des peptides présentés par une CMH-II. Contrairement au CMH-I qui est exprimé par la majorité des cellules, le CMH-II est exprimé seulement par les cellules présentatrices d’antigènes (CPA). Afin d’activer un lymphocyte T CD4, il faut qu’il y ait reconnaissance par le TCR d’un Ag présenté par un CMH-II ainsi que l’interaction de molécules de co-stimulation (CD40L/CD40) (Ridge et al., 1998). Le lymphocyte CD4 activé produira de l’IL-12 (Cella et al., 1996). Cette activation favorise la transprésentation d’un Ag phagocyté par le CMH-I. La présence d’IL-12 peut favoriser le rejet de greffe et l’élimination de tumeurs solides (Curtsinger et al., 2007).
Les lymphocytes T CD4 ont un rôle fondamental dans l’activation des lymphocytes T CD8 (figure 4). Les lymphocytes T CD4 peuvent être polarisés vers plusieurs phénotypes (Th1, Th2, Th17, Tfh, Treg) qui auront un impact important sur l’orientation de la réponse immune. Le micro-environnement de cytokines joue un rôle primordial dans la polarisation des lymphocytes T CD4. Les lymphocytes T CD4 de type Th1 ont besoin d’une stimulation avec de l’IL-12 pour produire de l’IFN, du TNF-, de l’IL-2, et induire une défense contre des pathogènes intracellulaires (virus, bactéries) ou contre des cellules cancéreuses. Les lymphocytes Th2 nécessitent une stimulation avec de l’IL-4 afin de produire de l’IL-4, l’IL-5, l’IL-13 afin d’induire une réponse humorale contre des pathogènes extracellulaires. (Moss et al., 2004 ; Coffman, 2006 ; Rochman et al., 2009). La génération des Th17 nécessite la présence d’IL-6 ou d’IL-21 en combinaison avec du TGF ainsi que l’activation du facteur de transcription RORt (Korn et al., 2007). L’IL-21 est aussi impliqué dans la prolifération et l’expansion de lymphocytes Th17. Les Th17 sont l’une des sources importantes d’IL-21. L’IL-23 est important pour stabiliser le phénotype Th17. Certaines cytokines du micro-environnement peuvent antagoniser la différenciation des autres sous-types de lymphocytes T CD4. Il a été récemment montré que l’IL-21 et IL-6 bloquent la différenciation des lymphocytes T régulateurs inductibles (iTreg)
favorisant ainsi une polarisation vers les Th17 et une réponse inflammatoire impliquée dans certaines pathologies (Monteleone et al., 2008). De plus, l’IL-21 semble renverser l’effet inhibiteur des lymphocytes régulateurs iTreg (Li et al., 2008).
La polarisation des lymphocytes T CD4 vers un sous-type est importante pour une réponse immunitaire adéquate envers un type de pathogène en particulier. Une réponse de type Th1 est impliquée dans l’élimination des pathogènes intracellulaires, tandis qu’une réponse de type Th2 est impliquée dans l’élimination des pathogènes extracellulaires. Cependant, l’expansion non contrôlée des lymphocytes Th1 peut entraîner des maladies auto-immunes et inflammatoires tandis qu’une dérégulation de la réponse Th2 peut entraîner des maladies atypiques telles que les allergies et l’asthme. Les lymphocytes Th17 semblent aussi impliqués dans la réponse contre certains types de pathogènes, mais pourraient être aussi impliqués dans des pathologies auto-immunes et inflammatoires (Bettelli et al., 2007).
Les lymphocytes T CD4 folliculaires (Tfh) sont impliqués dans l’activation des lymphocytes B dans les centres germinaux des organes lymphoïdes secondaires induisant ainsi la permutation somatique, la commutation isotypique et la sélection des lymphocytes B de forte affinité. Les Tfh et les lymphocytes B matures expriment le CXCR5 qui leur permet de migrer vers les centres germinaux. Le développement de Tfh est dépendant de l’IL-6, l’IL-21 ainsi que de l’activation de STAT3 et Bcl-6 (Nurieva et al., 2008a ; Nurieva et al., 2009). Les souris déficientes en IL-21 n’ont pas de Tfh, de centre germinatif et les lymphocytes B ne peuvent pas faire la commutation isotypique (Nurieva et al., 2008a).
Les lymphocytes T CD4 régulateurs (Treg) ont un rôle important dans le contrôle de l’auto-immunité. Les lymphocytes T régulateurs sont caractérisés par une expression constitutive du récepteur CD25 et aussi par l’expression du facteur de transcription Foxp3. Les souris mutantes pour Foxp3 ou pour l’IL-2 développent des maladies auto-immunes (Fontenot et al., 2003 ; Sakaguchi, 2004).
Figure 4 : Polarisation des lymphocytes T CD4 dépendante des cytokines Inspiré de l’article (King et al., 2008)
6. Homéostasie des lymphocytes T
Le nombre de lymphocytes T dans l’organisme reste relativement constant au cours de la vie même après une réponse immune, une lymphopénie et l’involution du thymus à l’âge adulte. La quantité constante de lymphocytes T dans l’organisme permet de déduire que des mécanismes de contrôle sont présents permettant de réguler la survie, la prolifération et l’apoptose. Il existe plusieurs mécanismes afin d’assurer le maintien du nombre de lymphocytes en périphérie, ces mécanismes varient selon l’état (naïfs ou mémoire) et selon le contexte de prolifération (normal ou lymphopénique) des lymphocytes T.
Pathogènes intracellulaire Pathogènes extracellulaire Tolérance Inflammation Formation du centre germinatif des follicules
6.1. Lymphocytes T naïfs
Les lymphocytes T naïfs sont des cellules dont le TCR exprimé à leur surface n’a pas encore été exposé ou n’a pas encore reconnu un antigène spécifique. Ces lymphocytes T peuvent être différentiés des lymphocytes T effecteurs ou mémoires par une faible expression du CD44 à leur surface cellulaire, l’expression de la molécule de CD44 à la surface des lymphocytes T indique qu’ils sont activés ou qu’ils sont des lymphocytes T mémoires. Ces lymphocytes T naïfs ont la caractéristique de se diviser que très rarement en condition normale (Sprent et al., 2008). La prolifération basale des lymphocytes T naïfs n’entraîne pas de modification de leur phénotype (Rocha et al., 1989). Dans la périphérie, les lymphocytes T naïfs doivent recevoir deux signaux pour survivre, une stimulation par l’IL-7 et une faible stimulation du TCR par un peptide du soi présenté par une molécule de CMH (Sprent et al., 2003b ; Boyman et al., 2007).
L’IL-7 est une cytokine essentielle afin de maintenir les lymphocytes T naïfs en périphérie. L’IL-7 est produite de façon constitutive par les cellules stromales et épithéliales de plusieurs organes, dont le thymus, la moelle osseuse, les intestins, la rate et les ganglions périphériques (Lee et al., 2005). Le nombre de lymphocytes T reste constant dans l’organisme dû à la quantité restreinte d’IL-7. La déplétion d’IL-7 par des anticorps anti-IL-7, la déficience en IL-7 ou de l’une des chaînes du récepteur engendre une diminution ou l’absence lymphocytes T naïfs (Kondrack et al., 2003). Contrairement à ce qui a été observé chez les souris mutantes, les souris transgéniques pour l’IL-7 ont une augmentation marquée de lymphocytes T naïfs (Mertsching et al., 1995 ; Kieper et al., 2002). En raison de la quantité restreinte d’IL-7 produite par l’organisme, les cytokines telles que l’IL-2, l’IL-4, l’IL-6 et l’IL-15 permettent la survie des lymphocytes T CD8+ et l’internalisation du récepteur de l’IL-7
(Park et al., 2004).
Les lymphocytes T ayant survécu à la sélection thymique sont ceux pouvant reconnaître faiblement des antigènes du soi présentés par un CMH de classe I pour les lymphocytes T CD8 et les CMH de classe II pour les CD4. Lorsque ces lymphocytes T émigrent en périphérie, ils dépendent aussi d’une stimulation faible de leur TCR. L’importance de la signalisation du TCR dans la survie des lymphocytes T
en périphérie a été montrée par le transfert de lymphocytes T chez des souris déficientes en CMH ainsi que chez des souris dont on pouvait induire la perte d’expression du TCR (Brocker, 1997 ; Tanchot et al., 1997 ; Polic et al., 2001). De plus, les lymphocytes T entrent en compétition entre eux pour les peptides du soi afin de recevoir leurs signaux de survie (Hayday et al., 2007). Les lymphocytes T CD8 ayant une plus forte affinité pour un antigène du soi vont proliférer davantage. L’affinité des TCR pour leur Ag corrèle avec l’expression de CD5 à la surface cellulaire. Les lymphocytes T CD8 qui expriment un haut niveau de CD5 prolifèrent davantage, indiquant un TCR de plus forte affinité contre un antigène du soi (Azzam et al., 2001 ; Kieper et al., 2004). L’avidité du TCR des lymphocytes T CD4 semble être contrôlée de façon similaire (Kassiotis et al., 2003). Cette concurrence pour les peptides du soi permet de favoriser une diversité des TCR puisque des TCR ayant la même affinité pour un antigène du soi doivent entrer en compétition afin d’obtenir un signal de survie (Moses et al., 2003). Pour survivre, les lymphocytes doivent migrer vers les ganglions lymphatiques afin de recevoir leurs signaux de survie. Les lymphocytes T naïfs expriment fortement le CD62L (L-sélectine) et le CCR7 leur permettant de migrer vers les ganglions. Les cellules réticulaires fibroblastiques de la zone T des ganglions lymphatiques sont les principales sources d’IL-7 et de CCL19 le ligand du CCR7 (Link et al., 2007 ; Surh et al., 2008).
Afin de favoriser les lymphocytes T récemment émigrés du thymus (RET) qui exprime une nouvelle diversité de TCR, les RET expriment plus fortement l’IL-7R (CD127), leur permettant d’avoir un avantage sur les lymphocytes déjà résidents de la périphérie (Hassan et al., 2001).
Le nombre de lymphocytes T naïfs versus mémoires est relativement stable, mais tend à favoriser les lymphocytes T mémoires avec l’âge, dû à l’involution du thymus et la génération de lymphocytes T mémoires induite par la rencontre de pathogènes au cours de la vie (Surh et al., 2005).
6.2. Lymphocytes T mémoires
Pour survivre dans l’organisme, les lymphocytes T mémoires ont besoin principalement d’IL-15 pour leur prolifération, mais aussi de l’IL-7 pour leur survie (Sprent et al., 2003b ; Boyman et al., 2007 ; Surh et al., 2008). Chez les souris IL-15 transgéniques (IL-15tg), la population de lymphocytes T mémoires est beaucoup plus élevée (Fehniger et al., 2001). Au contraire, chez les souris déficientes en IL-15 ou en IL-15R il y a une diminution importante de lymphocytes T mémoires (Zhang et al., 1998). Les lymphocytes T mémoires n’ont pas besoin d’une stimulation de leur TCR pour leur survie en périphérie (Tough et al., 1994). De plus, ils expriment fortement le CD127 (IL-7R) du récepteur de 7 et le CD122 (IL-2/15R) du récepteur de l’IL-15 (Boyman et al., 2007). Contrairement aux lymphocytes T naïfs, les lymphocytes T mémoires se divisent une fois aux deux à trois semaines afin de compenser la disparition de lymphocytes morts par l’apoptose (Tough et al., 1994). La limitation de la taille de la population de lymphocytes T mémoires est contrôlée par la quantité limitante d’IL-15 produite principalement par les monocytes, les macrophages et les cellules dendritiques (DC) après activation (Dubois et al., 2002 ; Schluns et al., 2004).
6.3. Lymphopénie
La lymphopénie est caractérisée par une perte de l’homéostasie, c’est-à-dire, par une diminution drastique de la quantité de lymphocytes T due principalement à une infection virale, à la chimiothérapie ou à une irradiation (Surh et al., 2005). La prolifération induite par la lymphopénie (LIP) est un processus impliqué dans la division des lymphocytes restant afin d’atteindre le nombre normal de lymphocytes T dans l’organisme (Ge et al., 2002) (figure 5). La prolifération LIP survient aussi lors de la génération du compartiment du système immunitaire en périphérie chez les souris néonatales (Min et al., 2003). L’apport massif de lymphocytes T émigrant du thymus (RET) chez les souris néonatales assure une diversité des TCR ce qui n’est pas le cas chez les individus adultes. Lors d’une lymphopénie, il y a une augmentation de la quantité d’IL-7 circulante due à l’absence de l’utilisation par les lymphocytes T (Bolotin et al., 1999) L’augmentation de la concentration d’IL-7 et la diminution de la
concurrence pour les peptides du soi entraînent la prolifération des lymphocytes T CD8 naïfs. De plus, il a été montré qu’il y avait une synergie entre la signalisation du TCR et celle du récepteur de l’IL-7 augmentant ainsi leur prolifération (Seddon et al., 2002). La prolifération LIP induit une perte du phénotype naïf et une acquisition du phénotype ressemblant aux lymphocytes mémoires effecteurs (CD44Hi) (Goldrath et al., 2000). La transformation du phénotype des lymphocytes T naïfs en phénotype mémoire effecteur leur permet de répondre plus efficacement à une stimulation antigénique permettant une certaine protection immunitaire lors d’une lymphopénie (Khoruts et al., 2005). Chez la souris, les lymphocytes T se divisent de 1 à 5 fois durant 2 à 3 semaines. La prolifération des lymphocytes T CD8 est plus prononcée que celle des lymphocytes T CD4. Lorsque le nombre normal de lymphocytes T est atteint, le phénotype ressemblant au mémoire et les capacités effectrices sont perdus. Contrairement à une réponse immunitaire qui engendre l’expansion d’un clone spécifique, LIP induit la prolifération de tous les lymphocytes envers des peptides du soi présentés par le CMH des cellules dendritiques (DC) conservant ainsi la diversité restante des TCR (Sprent et al., 2008).
Les lymphocytes T CD8 mémoires nécessitent seulement l’IL-7 ou l’IL-15 pour leur prolifération LIP et se divisent de façon beaucoup plus intense que les lymphocytes T naïfs lors d’une lymphopénie (Cheung et al., 2009). La prolifération préférentielle des lymphocytes T mémoires possèdent l’avantage de favoriser les lymphocytes possédant des TCR qui sont reconnus pour réagir contre un pathogène. Lors d’une lymphopénie causée par une infection virale, des cytokines pro-inflammatoires telles que l’IL-12, l’IL-18, l’IFN-type I, l’IFN sont produites. Ces cytokines vont augmenter la prolifération des lymphocytes T mémoires en induisant la production IL-15 (Tough et al., 2001).
6.4. Maladies auto-immunes induites par la lymphopénie
À l’âge adulte, la lymphopénie engendre une perte de la diversité des TCR puisque les lymphocytes T générés sont des clones des lymphocytes T restant dans l’organisme (figure 5). De plus, l’involution du thymus à l’âge adulte réduit grandement l’apport de lymphocytes T exprimant, de nouveaux TCR (Khoruts et al., 2005). La prolifération engendrée par une lymphopénie nécessite la stimulation du TCR par un peptide du soi, la prolifération de certains lymphocytes T autoréactifs peut être favorisée (Figure 5). Durant une période de lymphopénie, les lymphocytes T ayant une plus forte avidité pour un peptide du soi, présentés par un CMH, ont un potentiel prolifératif plus important (Kassiotis et al., 2003a ; Ge et al., 2004). Les lymphocytes T peuvent être activés en l’absence de molécules de co-stimulation (Prlic et al., 2001) et migrer dans le tissu périphérique (Hagen et al., 2004). La concentration d’IL-7 et d’IL-15 est augmentée lors d’une lymphopénie et ces cytokines sont aussi impliquées dans le développement d’une réponse auto-immune. Il a été montré que ces cytokines renversaient l’anergie des lymphocytes T (Teague et al., 2006). La prolifération et l’activation de lymphocytes T autoréactifs combinées à la perte de la tolérance par les T régulateurs entraînent le développement de l’auto-immunité. L’incidence faible de maladies auto-immunes suggère que des mécanismes sont présents pour contrôler les lymphocytes T autoréactifs. La lymphopénie seule n’est pas suffisante pour induire des maladies auto-immunitaires suggérant que des facteurs environnementaux (virus, cytokines pro-inflammatoires), des prédispositions génétiques (CMH, cytokines pro-inflammatoires) et bris de l’un ou des mécanismes de tolérance (déplétion des Treg) sont nécessaires afin d’induire le développement de maladies auto-immunes.
Figure 5 : Effets de la lymphopénie sur la diversité de la population de lymphocytes T.
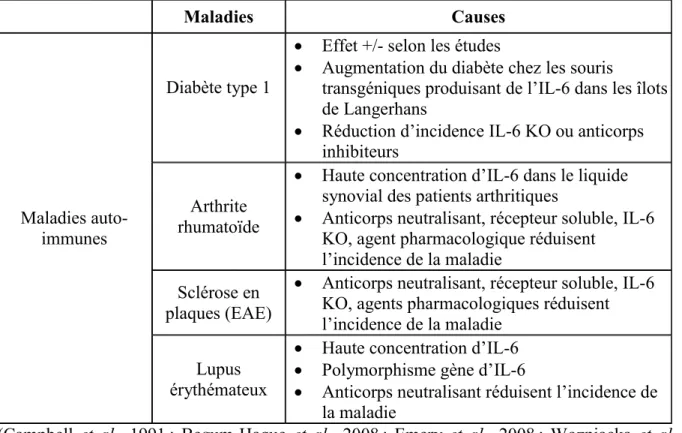
6.5. Cytokines impliquées dans la génération de maladies auto-immunes Des études ont démontré que plusieurs maladies auto-immunes se développent après une lymphopénie et sont aussi intimement associées à certaines cytokines pro-inflammatoires comme l’IL-6 et l’IL-21 (Datta et al., 2008 ; Tajima et al., 2008) (Tableau 1 et 2). Le diabète de type I, l’arthrite rhumatoïde, le lupus érythémateux, la maladie cœliaque et la maladie de Crohn sont tous associés à une diminution de la fonction splénique et à une atrophie des organes lymphoïdes secondaires. De plus, des infections par le virus de l’influenza, de la varicelle, de la rubéole, du virus du Nil sont associées à des lymphopénies transitoires. Le virus d’immunodéficience humaine VIH entraîne une lymphopénie sévère des lymphocytes T CD4. Les traitements antiviraux qui favorisent la reconstitution lymphocytaire favorisent aussi le développement de maladies auto-immunes plus fréquentes et plus sévères (Khoruts et al., 2005).
Tableau 1 : Implications de l’IL-21 et de la lymphopénie dans le développement de maladies auto-immunes. Maladies Causes Maladies auto-immunes Diabète type 1*
La déficience en IL-21 ou IL-21R protège contre la maladie
IL-21 augmente la pathologie Susceptibilité génétique
Inhibe la formation des T régulateurs Génération Th17 Arthrite rhumatoïde* Sclérose en plaques (EAE)* Maladie cœliaque* Maladie de Crohn* Lupus érythémateux*
(Bubier et al., 2007 ; Andersson et al., 2008 ; Fina et al., 2008 ; Garrote et al., 2008 ; Liu et al., 2008 ; Spolski et al., 2008 ; Datta et al., 2009)
* Implication de la lymphopénie
Tableau 2 : Implications de l’IL-6 et de la lymphopénie dans le développement de maladies auto-immunes
Maladies Causes
Maladies auto-immunes
Diabète type 1
Effet +/- selon les études
Augmentation du diabète chez les souris
transgéniques produisant de l’IL-6 dans les îlots de Langerhans
Réduction d’incidence IL-6 KO ou anticorps inhibiteurs
Arthrite rhumatoïde
Haute concentration d’IL-6 dans le liquide synovial des patients arthritiques
Anticorps neutralisant, récepteur soluble, IL-6 KO, agent pharmacologique réduisent
l’incidence de la maladie Sclérose en
plaques (EAE)
Anticorps neutralisant, récepteur soluble, IL-6 KO, agents pharmacologiques réduisent l’incidence de la maladie
Lupus érythémateux
Haute concentration d’IL-6 Polymorphisme gène d’IL-6
Anticorps neutralisant réduisent l’incidence de la maladie
(Campbell et al., 1991 ; Begum-Haque et al., 2008 ; Emery et al., 2008 ; Wozniacka et al., 2008)
7. Cytokines et leurs récepteurs
Les cytokines et leurs récepteurs ont des fonctions cruciales dans la génération, l’homéostasie et les capacités effectrices des lymphocytes T. Dans cette section, il sera question de la classification des cytokines et de leurs récepteurs, leurs rôles biologiques et de leurs principales voies de signalisation.
7.1. Famille des cytokines
Les cytokines sont classifiées selon l’homologie des chaînes de leurs récepteurs qui se divisent en deux types. L’ectodomaine des récepteurs de type I possède un CBM (cytokine binding module) formé de deux domaines fibronectines de type III. On retrouve dans ce CBM un motif de résidus cystéines et prolines bien conservé (WSXWS) permettant de lier une vaste gamme de cytokines ayant une structure protéique tridimensionnelle formée de 4 hélices alpha (hormones, interleukines, colony-stimulating factors) (Nicola et al., 1998 ; Wang et al., 2009). Les récepteurs de type I ont une grande divergence en raison de la partie cytoplasmique de leur récepteur, mais possèdent un motif semblable à tous les récepteurs de type I (Box 1 et 2) formé d’une hélice alpha hydrophobe riche résidus proline qui est impliquée dans la liaison de la tyrosine kinase Janus-Kinases (Jaks). Les récepteurs de cytokines n’ont pas d’activité kinase intrinsèque, ils doivent s’associer à des protéines kinases afin de pouvoir induire une signalisation. Les récepteurs de cytokines de type I dépendent principalement de la voie de JAKs/STAT afin de transmettre un signal du récepteur membranaire au noyau (voir section signalisation). Le développement de la génomique a permis de découvrir une grande variété de cytokines en identifiant des motifs conservés par les cytokines et leurs récepteurs (Foster et al., 2004). Cependant, ce type d’approche ne permettait pas d’associer les cytokines et les récepteurs nouvellement découverts créant ainsi des cytokines et des récepteurs orphelins.
Certaines cytokines utilisent des complexes de récepteurs formés de deux ou trois chaînes. Les récepteurs de type I se sous-divisent en trois classes qui se caractérisent par le partage d’une chaîne commune (c, c, gp130) (Tableau 3).
(Gadina et al., 2001). La combinaison de la chaîne commune et une chaîne alpha ou bêta spécifique à la cytokine forment le récepteur de forte affinité.
Les récepteurs de type II se caractérisent aussi par un motif CBM formé de deux domaines fibronectines de type III. Cependant, le motif WSXWS n’est pas présent dans le domaine fibronectine II, mais est remplacé par un nombre variable de résidus cystéines et de prolines. Les récepteurs de cytokines de type II se divisent en deux familles : ceux de la famille de l’interféron (IFN), ceux de la famille de l’IL-10 (IL-10, IL-19, IL-20, IL-22, IL-24, IL-26, IL-28A, IL-28B et IL-29) (Tableau 3). Les récepteurs de type II utilisent aussi la voie des JAK/STAT afin d’engendrer leur signalisation.
Dans les prochaines sections, nous allons nous concentrer sur les cytokines et les récepteurs de type I, plus principalement la famille c et la famille gp130.
Tableau 3 : Famille de récepteurs des cytokines de type I et de type II
*Inspiré de l’article de (Gadina et al., 2001) Famille de récepteurs de cytokines Chaîne partagée Cytokines Molécules de signalisation JAK STAT Type I c
IL-2, IL-7, IL-9, IL-15
JAK1, JAK3 STAT5 IL-21 STAT3, STAT1 IL-4 STAT6
c GM-CSF, IL-3, IL-5 JAK2 STAT5
gp130 IL-6, IL-11, CNTF, LIF, OSM JAK1, JAK2, Tyk2 STAT3 STAT1 Type II IFN/IL-10
IFN, IFN, JAK1,
Tyk2 STAT1, STAT2 IFN JAK1, JAK2 STAT1 IL-10 JAK1, Tyk2 STAT3
7.2. Rôles biologiques de l’IL-2, l’IL-4, l’IL-7, l’IL-9 et l’IL-15
Les cytokines de la famille c sont importantes pour la génération, le développement, l’activation et l’homéostasie des lymphocytes T. Comme mentionné précédemment, l’IL-7 est importante pour la génération et le maintien de la population de lymphocytes T naïfs tandis que les lymphocytes mémoires nécessitent de l’IL-7 pour leur survie et de l’IL-15 pour leur prolifération.
L’IL-2 est principalement impliquée dans l’expansion clonale des lymphocytes T activés, dans la contraction des lymphocytes T CD8 effecteurs à la fin de la réponse immunitaire et dans la génération et le maintien de lymphocytes T CD4 régulateurs. L’IL-4 est impliquée dans la polarisation des lymphocytes T CD4 vers un phénotype de type Th2 qui oriente la réponse immunitaire vers une réponse de type humorale. L’IL-9 est une cytokine de la famille c qui est produite principalement par un nouveau type de lymphocytes T CD4 appelé Th9. L’IL-4 et le TGF sont nécessaires afin de polariser un lymphocyte T CD4 en Th9. L’IL-9 agit principalement sur les mastocytes, les lymphocytes T régulateurs, les cellules Th17 et les CPA en induisant certaines cytokines. L’IL-9 est impliquée dans l’inflammation allergique, dans certains cas elle peut aggraver les maladies auto-immunes et augmenter l’élimination de certains parasites (Noelle et al., 2010).
7.3. Rôles biologiques de l’IL-21
La chaîne alpha du récepteur de l’IL-21 est la dernière chaîne de récepteur appartenant à la famille c à avoir été découverte en 2000 (Ozaki et al., 2000 ; Parrish-Novak et al., 2000). L’IL-21R a été trouvé par bio-informatique en identifiant les séquences codant pour les motifs qui caractérisent les récepteurs de cytokines de type I (voir section famille cytokine). Cette technique ne permet toutefois pas d’identifier le ligand du récepteur. L’IL-21 a été identifié en transfectant la chaîne du récepteur IL-21R chez des cellules BaF3, ces cellules ont été ensuite misent en contact avec le surnageant d’une centaine de lignées cellulaires stimulées au PMA (Parrish-Novak et al., 2000). Cette technique a permis d’identifier que des cellules CD3 positives produisent le ligand.
L’IL-21R est exprimée chez les lymphocytes B, les lymphocytes T, les « natural killer » (NK) DC, les macrophages et les kératinocytes (Spolski et al., 2008). L’expression de l’IL-21R est augmentée lors de leur l’activation (Mehta et al., 2004 ; Spolski et al., 2008). L’expression de l’IL-21R est régulée à la hausse lors de l’activation des lymphocytes T et est dépendant du facteur de transcription Sp1 (Wu et al., 2005). Le patron d’expression cellulaire de l’IL-21R indique que l’IL-21 agit à la fois sur le système immunitaire inné et acquis.
L’IL-21 est produite principalement après activation des lymphocytes T CD4 de type Th17 et des cellules NKT (Figure 6). La présence d’IL-6 ou d’IL-21 entraîne aussi la production d’IL-21 par les Th17. De plus, il a été montré que l’IL-7 et l’IL-15 pouvaient induire la production d’IL-21 chez des lymphocytes T CD3+ humains, cette production était augmentée lors d’ajout d’IL-21 (Caprioli et al., 2008). La région régulatrice du promoteur de l’IL-21 contient trois sites de liaison pour NF-AT, et en absence du site NF-AT, il n’y a pas de production d’IL-21 après une stimulation avec le calcium ionophore ionomycine. Le promoteur de l’IL-21 contient une séquence d’activation IFN (GAS) qui peut lier les facteurs de transcriptions STAT. L’inhibition de STAT3 bloque la production d’IL-21 après stimulation avec l’IL-21.
Il a été récemment rapporté qu’un certain sous-type de lymphocytes T CD8 (Tc17) pouvait produire de l’IL-21 lorsqu’il était stimulé avec de l’IL-6 ou de l’IL-21 en présence de TGF- en présence d’anti-CD3 (Huber et al., 2009 ; Ortega et al., 2009). Cependant, ces lymphocytes T CD8 étaient moins cytotoxiques in vitro, mais engendraient un plus grand rejet des tumeurs in vivo (Hinrichs et al., 2008). Les lymphocytes T CD8 qui sont activés par un antigène en présence d’IL-21 expriment moins le CD44 et le CD25 (IL-2R) et produisent moins d’IFN. Ces lymphocytes produisent plus d’IL-2, et expriment plus fortement le CD62L à leur surface ce qui leurs permettent de migrer aux ganglions expliquant partiellement les effets de rejet de tumeurs in vivo.
La surexpression de l’IL-21 entraîne une accumulation de lymphocytes T CD8 ayant un phénotype mémoire central dans les ganglions et dans la rate ainsi qu’une réduction de la proportion de lymphocytes T naïfs (Allard et al., 2007).
L’IL-21 peut agir comme co-stimulateur en augmentant la capacité cytotoxique ainsi que la production d’IFN par les lymphocytes T CD8 (Parrish-Novak et al., 2000). De plus, la surexpression d’IL-21 ou l’injection d’IL-21 augmente l’élimination virale et empêche l’épuisement des lymphocytes T CD8 lors d’une infection chronique (Elsaesser et al., 2009). L’IL-21 agit de façon synergique avec l’IL-7, l’IL-15 et l’IL-18 afin d’augmenter la production d’IFN par les lymphocytes T CD8 après stimulation antigénique (Strengell et al., 2003 ; Alves et al., 2005 ; Zeng et al., 2005). De plus, il a été montré que l’IL-21 a un effet synergique avec l’IL-7 ou l’IL-15 en augmentant la prolifération des lymphocytes T CD8 naïfs (Alves et al., 2005) et effecteurs (Zeng et al., 2005 ; Liu et al., 2007).
Les souris déficientes en IL-21 n’ont pas d’anomalies notables en ce qui concerne la génération des lymphocytes, mais montrent une déficience pour ce qui est de la réponse cytotoxique des lymphocytes T CD8 (Zeng et al., 2005). L’IL-21 en combinaison avec l’IL-15 entraîne une régulation à la hausse de l’expression du CD28 à la surface des lymphocytes T CD8 (Alves et al., 2005).
La présence d’IL-21 lors de la maturation des DC semble inhiber leur maturation en réduisant l’expression du CMH-II et en empêchant la maturation induite par le LPS (Brandt et al., 2003). De plus, l’IL-21 augmente l’expression de SOCS1 et SOCS3 chez les DC inhibant leur fonction (Strengell et al., 2006).
L’IL-21 est impliquée dans la production d’anticorps et chez les souris IL-21-/- IL-21R-/- il y a une augmentation des IgE et une diminution des IgG. Les souris mutantes pour l’IL-4 et l’IL-21 ont une déficience en anticorps (IgG et certains IgM) semblable à ce que nous observions chez les souris XSCID suggérant une collaboration entre l’IL-4 et l’IL-21 dans la production d’anticorps (Ozaki et al., 2002). Les souris IL-21 transgéniques ont une augmentation marquée d’IgG et d’IgM sans toutefois avoir une différence dans la quantité d’IgE. L’IL-21 entraîne l’apoptose des lymphocytes B fraichement isolés ou B stimulés avec CD40 ou avec un anticorps anti-IgM. L’IL-21 semble induire l’apoptose des lymphocytes B qui ne sont pas complètement activés. Cependant, la stimulation du BCR et le CD40 chez des lymphocytes B activés au LPS semblent prévenir l’effet proapoptotique de l’IL-21. Ces résultats indiquent que l’IL-21 serait impliquée dans la maturation des lymphocytes B dépendante des
lymphocytes T et dans l’inhibition des lymphocytes B autoréactifs (Jin et al., 2004 ; Leonard et al., 2008).
L’IL-21 serait impliquée dans la formation des centres germinaux dans les organes lymphoïdes secondaires (Vogelzang et al., 2008). Cette zone permet la costimulation des lymphocytes B par les lymphocytes T CD4 induisant ainsi la permutation somatique, le « class switch » et la sélection de lymphocytes B de forte affinité. Les lymphocytes T CD4 de cette zone ne correspondraient pas au sous-type Th1 ou Th2, mais plutôt à un nouveau sous-type nommé Th folliculaire (Tfh). Les Tfh produisent principalement de l’IL-10 et de l’IL-21 et se caractérisent par l’expression du CXCR5 qui leur permet de migrer vers les centres germinaux à l’intérieur des ganglions. L’IL-21 et l’IL-6 sont impliquées dans la formation des Tfh, car l’absence de ces deux cytokines inhibe la formation des Tfh et des centres germinaux. L’une des hypothèses est que la formation des Tfh soit intimement liée au Th17, ces deux sous-types de lymphocytes T CD4 dépendent de l’IL-21 et de l’IL-6 et du facteur de transcription STAT3 pour leur génération. Cependant, les Tfh ne nécessitent pas de TGF- ou le facteur de transcription RORt (Nurieva et al., 2008b ; Silver et al., 2008). L’IL-21 influence aussi les cellules NK en augmentant la prolifération, la cytotoxicité et la production d’IFN suite à une stimulation avec l’IL-15 (Sivori et al., 2003 ; Brady et al., 2004 ; Leonard et al., 2008).
L’IL-21 est aussi impliquée dans plusieurs pathologies, dont les maladies inflammatoires chroniques de l’intestin, comme la maladie de Crohn et de la colite ulcéreuse. Les maladies inflammatoires de l’intestin résultent d’une cascade d’évènements cellulaires orchestrée par des cytokines inflammatoires sécrétées par des cellules lymphoïdes et non lymphoïdes. L’IL-21 est fortement exprimée chez les patients souffrant de la maladie de Crohn et de la colite ulcéreuse (Fantini et al., 2008). L’IL-21 est aussi impliquée dans plusieurs types de cancers, dont le myélome multiple qui est un néoplasme de lymphocytes B activé et différentié de façon terminale. L’IL-21 entraînerait la prolifération et l’inhibition de l’apoptose des cellules du myélome multiple (Brenne et al., 2002 ; Menoret et al., 2008).
L’IL-21 ne semble pas appartenir au paradigme Th1/Th2, car les premiers articles à ce sujet indiquent que l’IL-21 favorise la polarisation vers le phénotype Th1
en induisant le facteur de transcription T-bet, la production d’IFN (Strengell et al., 2002) et en inhibant la production d’IgE (Ozaki et al., 2002 ; Shang et al., 2006). De plus, la présence de l’IL-21 a été montrée importante dans la polarisation Th1 et la production d’IFN dans la maladie de Crohn et de la colite ulcéreuse (Monteleone et al., 2005). Cependant, des études contradictoires ont montré que l’IL-21 semble bloquer la polarisation des lymphocytes T CD4 Th1 en inhibant la production d’IFN (Mehta et al., 2004 ; Suto et al., 2006). Finalement, il a été découvert que l’IL-21 était produite par un nouveau sous-type de lymphocytes T CD4 « helper » nommé Th-17 dû à sa production d’IL-17. Les Th-17 sont la principale source d’IL-21 et leur découverte résout le paradigme Th1/Th2.
Figure 6 : Rôles biologiques de l’IL-21. (Leonard et al., 2008)
7.4. Rôles biologiques de l’IL-6
L’IL-6 est une cytokine pléiotropique ayant des effets sur la régulation immune, l’hématopoïèse, l’inflammation et l’oncogenèse (Kishimoto, 2010). L’IL-6 est principalement exprimée par les CPA activées (DC, macrophages, lymphocytes B) et par des cellules non hématopoïétiques dont les kératinocytes, fibroblastes, cellules épithéliales et astrocytes (Dienz et al., 2009). L’IL-6 est produite par une variété de stimulus, dont l’IL-1, le TNF- et le LPS. L’IL-6 est un facteur de survie pour les lymphocytes T CD4 puisqu’il favorise l’expression de Bcl-2. L’IL-6 augmente la prolifération et l’activation des lymphocytes T. La présence d’IL-6 lors de l’activation des lymphocytes T CD4 augmente la production d’IL-4 et favorise ainsi la réponse de type Th2. L’IL-6 serait aussi importante pour la génération des Th17.
Chez les souris IL6-/-, il y a une diminution du nombre de leucocytes au site inflammatoire (Romano et al., 1997). L’IL-6 est impliquée dans la réponse inflammatoire, régule à la hausse la protéine C réactive (CRP), le fibrinogène et la protéine amyloïde A dans le sérum (Kishimoto, 2005).
7.5. Récepteurs des cytokines partageant la chaîne gamma commune (c) Les récepteurs de cytokines de la famille de c font partie de la famille de récepteurs de cytokines de type I. Ces récepteurs comptent plusieurs membres (IL-2, IL-4, IL-7, IL-9, IL-15, IL-21) et partagent la même chaîne c (Figure 7).