© Emma Roy, 2020
La maladie pulmonaire obstructive chronique et la
chirurgie pour cancer pulmonaire
Mémoire
Emma Roy
Maîtrise en sciences cliniques et biomédicales - avec mémoire
Maître ès sciences (M. Sc.)
La maladie pulmonaire obstructive chronique et la
chirurgie pour cancer pulmonaire
Mémoire
Emma Roy
Sous la direction de :
François Maltais, directeur de recherche
Yves Lacasse, codirecteur de recherche
iii
Résumé
Les patients atteints de maladie pulmonaire obstructive chronique (MPOC) sont généralement considérés comme ayant une survie à long-terme inférieure et un taux de complications post-opératoires plus élevé, lorsque comparés avec des patients non-MPOC, à la suite d’une chirurgie de résection pour cancer pulmonaire. Ce qui demeurait à préciser était de savoir si l’on avait également un impact sur la survie et sur le décours post-opératoire chez les patients ayant une MPOC de sévérité légère à modérée. Ce projet visait donc à caractériser et à comparer l’évolution post-opératoire de patients MPOC et non-MPOC en termes de complications et de survie à long-terme à la suite d’une chirurgie pour cancer pulmonaire ainsi que d’évaluer l’effet de la sévérité de la MPOC sur ces points.
Dans cette étude, nous avons pu constater que la proportion de patients MPOC est élevée chez les patients opérés pour cancer pulmonaire et que ceux-ci ont en effet tendance à développer davantage de complications en post-opératoire. Nous n’avons constaté aucune influence statistiquement significative de la MPOC ou de sa sévérité sur la survie à long-terme à la suite de la chirurgie cependant. Les résultats de cette étude s’appliquent principalement aux patients ayant une MPOC de sévérité légère à modérée.
iv
Abstract
Patients suffering from chronic obstructive pulmonary disease (COPD) are generally considered to have diminished long-term survival and higher rate of post-operative complications, when compared with non-COPD, following a resection surgery for lung cancer. What remained to be clarified was to know if the presence of mild to moderate COPD has an impact on survival and on post-operative evolution. This project aimed at characterizing and comparing the post-operative course of COPD and non-COPD patients in terms of complications and long-term survival following a surgery for lung cancer and to evaluate the effect of the severity of COPD on these outcomes.
In this study, we observed that the proportion of patients with COPD was high in patients operated for lung cancer and that they indeed developed more complications in the post-operative period. However, we found no statistically significant influence of COPD or of its severity on long-term survival following the surgery. The results of this study are mainly applicable to mild and moderate COPD patients.
v
Table des matières
RÉSUMÉ _____________________________________________________________________ III ABSTRACT __________________________________________________________________ IV TABLE DES MATIÈRES _______________________________________________________ V LISTE DES ABRÉVIATIONS __________________________________________________ VII REMERCIEMENTS _________________________________________________________ VIII AVANT-PROPOS _____________________________________________________________ X INTRODUCTION ______________________________________________________________ 1 CHAPITRE 1 : LE CANCER PULMONAIRE ______________________________________ 2
1.1ÉPIDÉMIOLOGIE ____________________________________________________________ 2 1.2ÉTIOLOGIES _______________________________________________________________ 3
1.2.1 Tabagisme ____________________________________________________________________ 3 1.2.2 Autres facteurs de risque _________________________________________________________ 4 1.3HISTOLOGIE _______________________________________________________________ 5 1.3.1 Le cancer pulmonaire non à petites cellules __________________________________________ 5 1.3.2 Le cancer pulmonaire à petites cellules _____________________________________________ 5 1.4INVESTIGATION ET OPÉRABILITÉ _______________________________________________ 6
1.4.1 Résécabilité ___________________________________________________________________ 6 1.4.2 Opérabilité ____________________________________________________________________ 7
1.4.2.1 Détermination du risque chirurgical ____________________________________________ 8 1.4.2.2 Impression du clinicien ______________________________________________________ 8
1.5TRAITEMENT _______________________________________________________________ 9 1.5.1 Chirurgie _____________________________________________________________________ 9 1.5.2 Autres modalités thérapeutiques ___________________________________________________ 9 1.6PRONOSTIC _______________________________________________________________ 10
CHAPITRE 2 : LA MALADIE PULMONAIRE OBSTRUCTIVE CHRONIQUE ________ 11
2.1PRÉSENTATION CLINIQUE ____________________________________________________ 11 2.1.1 Généralités __________________________________________________________________ 11 2.1.2 Obstruction bronchique _________________________________________________________ 12 2.1.2.1 Classification de GOLD ____________________________________________________ 12 2.1.3 Comorbidités et complications ___________________________________________________ 13 2.2ÉPIDÉMIOLOGIE ___________________________________________________________ 15 2.2.1 Les défis entourant l’établissement des valeurs de prévalence de la MPOC ________________ 15 2.3ÉTIOLOGIES ______________________________________________________________ 16 2.3.1 Tabagisme ___________________________________________________________________ 16 2.3.2 Autres étiologies ______________________________________________________________ 17
CHAPITRE 3 : LE CANCER PULMONAIRE CHEZ LES PATIENTS MPOC __________ 19
3.1PRÉVALENCE DE LA MPOC CHEZ LES PATIENTS ATTEINTS DE CANCER PULMONAIRE _____ 19 3.2LIENS PHYSIOPATHOLOGIQUES ENTRE CANCER PULMONAIRE ET MPOC _______________ 20 3.3LA CHIRURGIE POUR CANCER PULMONAIRE CHEZ LES MPOC : ÉTAT DES CONNAISSANCES 20
vi
3.3.1 La chirurgie de réduction du volume pulmonaire _____________________________________ 24
CHAPITRE 4 : PROBLÉMATIQUE, OBJECTIFS ET HYPOTHÈSES DE RECHERCHE 25
4.1PROBLÉMATIQUE __________________________________________________________ 25 4.2OBJECTIFS ________________________________________________________________ 25 4.3HYPOTHÈSES ______________________________________________________________ 26
CHAPITRE 5 : ARTICLE SCIENTIFIQUE _______________________________________ 27
MANUSCRIT : VERSION FINALE SOUMISE ___________________________________________ 27
RÉSUMÉ: ____________________________________________________________________ 28 ABSTRACT: __________________________________________________________________ 30 INTRODUCTION ____________________________________________________________ 31 METHODS _________________________________________________________________ 31 Study population ___________________________________________________________________ 31 Data collection ____________________________________________________________________ 32 Statistical analysis _________________________________________________________________ 33 RESULTS __________________________________________________________________ 34 DISCUSSION _______________________________________________________________ 36 CONCLUSION ______________________________________________________________ 38 ACKNOWLEDGEMENTS _________________________________________________________ 39
DECLARATION OF INTEREST STATEMENT __________________________________________ 39 REFERENCES _________________________________________________________________ 40 LEGEND FOR FIGURE __________________________________________________________ 48
CHAPITRE 6 : DISCUSSION ___________________________________________________ 50
6.1MPOC OU AUTRES COMORBIDITÉS : À QUI LA FAUTE ? _____________________________ 50
6.2LIMITATIONS MÉTHODOLOGIQUES DE L’ÉTUDE ___________________________________ 51
CONCLUSION ET PERSPECTIVES _____________________________________________ 53
CONCLUSION ________________________________________________________________ 53 PERSPECTIVES _______________________________________________________________ 53
vii
Liste des abréviations
% Pourcentage
ACCP American College of Chest Physicians
AJCC American Joint Committee on Cancer
COPD Chronic obstructive pulmonary disease
CPT Capacité pulmonaire totale
CVF Capacité vitale forcée
DLCO Capacité de diffusion au monoxyde de carbone
ERS European Respiratory Society
ESTS European Society of Thoracic Surgery
FEV1 Forced expiratory volume in 1 second
FVC Forced vital capacity
GOLD Global Initiative for Chronic Obstructive Lung Disease
MPOC Maladie pulmonaire obstructive chronique
NCI National Cancer Institute
OMS Organisation mondiale de la santé
RV Residual volume
TLC Total lung capacity
VATS Video-assisted thoracoscopic surgery
VEMS Volume expiré maximal en 1 seconde
VR Volume résiduel
viii
Remerciements
Lorsque j’ai débuté un stage de recherche à l’été 2015, je ne me doutais pas que ce projet me mènerait à la réalisation d’une maitrise. Naviguer dans un parcours de maitrise tout en poursuivant mon doctorat en médecine aura certainement été un défi, mais un défi empli d’une myriade d’apprentissages. Mes études de 2e cycle m’auront donné des outils qui me
seront aussi utiles quotidiennement dans mon travail de médecin et j’en suis reconnaissante. Plusieurs personnes ont été importantes pour moi lors de ce parcours et je tiens à les remercier.
Au Dr François Maltais, mon directeur de maitrise : merci de m’avoir prise sous votre aile d’abord comme stagiaire d’été. Merci pour vos conseils et pour avoir partagé avec moi cette passion pour la recherche qui vous anime. J’ai pu constater, grâce à vous, à quoi ressemble le quotidien d’un clinicien-chercheur et également l’importance du travail d’équipe, autant en recherche qu’en clinique, mais surtout lorsqu’on cherche à conjuguer les deux. Au Dr Yves Lacasse, mon co-directeur : vous m’avez souvent amenée à voir les choses sous un nouvel angle, en offrant un regard nouveau sur des résultats, un type d’analyse, etc. Vous m’avez aidée à développer un sens critique qui m’amène maintenant à nuancer davantage lorsque je lis les résultats d’une étude. Merci également pour m’avoir aidée à prioriser l’essentiel. Je suis privilégiée d’avoir pu travailler avec vous comme directeurs de recherche et chacun à votre façon, vous demeurerez des modèles pour moi dans ma pratique.
Merci aux infirmières et professionnelles de recherche de mon équipe. Votre soutien au centre de recherche et lors des congrès m’a toujours fait sentir comme une partie de l’équipe. Merci à l’équipe de la biobanque, particulièrement à Christine Simard et à Sabrina Biardel, dont l’aide précieuse m’a permis à plusieurs moments de pouvoir continuer à avancer dans mon projet.
Merci à Serge Simard, pour toutes ces heures où vous m’avez expliqué ce qui restait flou pour moi dans le monde des statistiques. Votre générosité et votre patience sont dignes de mention.
ix
Merci à mes amis qui m’ont toujours encouragée dans mes projets et qui ont partagé avec moi les hauts comme les bas des dernières années. Un merci particulier à Catherine et à Audrey, mes amies, collègues de MD-MSc et voisines de bureau au centre de recherche. Sans votre amitié, votre sens de l’humour et votre écoute, mon passage au centre de recherche n’aurait pas été le même.
Finalement, un merci tout spécial à mes parents, à mes sœurs et à mon amoureux pour votre présence et votre soutien constants. Je suis chanceuse d’être si bien entourée. Merci pour tout.
x
Avant-propos
Au cœur de ce mémoire se trouve l’article « Lung cancer resection and postoperative outcomes in COPD : A single-center experience », dont je suis la première auteure et qui a été récemment publié dans le journal Chronic Respiratory Disease (1). Cet article se penche sur l’évolution post-opératoire des patients MPOC à la suite d’une résection pour cancer pulmonaire.
La soumission initiale de l’article a été faite le 14 janvier 2020 et il a été accepté après révision le 19 avril 2020. L’article a été publié en ligne le 29 mai 2020. La version de l’article que l’on retrouve dans ce mémoire est la version finale soumise au journal.
J’ai travaillé sur ce projet dont le protocole avait été élaboré avant mon arrivée au centre de recherche et dont les investigateurs étaient Dr François Maltais, Dr Yves Lacasse et Dre Paula Antonia Ugalde. Dans le cadre de ce projet de recherche, j’ai participé à la collecte des données et j’ai rédigé la première ébauche de l’article qui a ensuite été retravaillée avec l’aide des co-auteurs avant la soumission. J’ai également participé aux discussions en lien avec l’interprétation des résultats et les révisions de l’article. J’ai donc écrit environ 70% de l’article.
Les co-auteurs de cet article sont Justine Rheault, Marc-Antoine Pigeon, Paula Antonia Ugalde, Christine Racine, Serge Simard, Gabriel Chouinard, Alexandre Lippens, Yves Lacasse et François Maltais. Justine Rheault, Marc-Antoine Pigeon, Gabriel Chouinard et Alexandre Lippens ont contribué à la collecte des données. Christine Racine a contribué à toute la portion du projet impliquant la collaboration avec la Biobanque. Serge Simard a réalisé les analyses statistiques, la première ébauche de la section Statistical analysis et a collaboré aux discussions en lien avec les questions des réviseurs au sujet des analyses. Dr Ugalde, Dr Lacasse et Dr Maltais ont travaillé à l’élaboration de ce projet. Dr Maltais et Dr Lacasse ont aussi contribué à la rédaction et aux révisions de l’article.
1
Introduction
Ce mémoire a comme point central un article scientifique portant sur l’évolution post-opératoire des patients atteints de MPOC à la suite d’une résection pour cancer pulmonaire. Pour que le lecteur puisse apprécier l’importance d’approfondir ce sujet, quelques concepts doivent d’abord être développés.
Le premier chapitre portera sur le cancer pulmonaire et on y mettra en relief en particulier les concepts de résécabilité et d’opérabilité des patients. Suivra un chapitre sur la MPOC, où le lecteur constatera entre autres l’importance de la réalisation d’une spirométrie pour le diagnostic. Ces deux pathologies pulmonaires pouvant être présentes chez un même patient, le chapitre suivant se penchera sur la coexistence de ces deux maladies et explorera la littérature portant sur la chirurgie pour cancer pulmonaire chez les patients MPOC. Ce parcours mettra en lumière la pertinence de ce projet de recherche que nous avons réalisé afin de répondre aux incertitudes qui persistaient dans la littérature actuelle en ce qui concerne l’impact sur la survie et sur le décours post-opératoire d’une MPOC de sévérité principalement légère à modérée chez des patients opérés pour cancer pulmonaire. Le lecteur pourra ensuite parcourir l’article scientifique qui a été produit à la suite de la réalisation de ce projet de recherche. Après quelques points de discussion suivra la section perspective où certaines réflexions retenues au terme de cette rédaction seront partagées au lecteur.
2
CHAPITRE 1 : Le cancer pulmonaire
1.1 Épidémiologie
Le cancer pulmonaire est un cancer fréquent ; qui plus est, il est la principale cause de mortalité par cancer au pays (2). C’est une maladie qui est causée dans la grande majorité des cas par la cigarette. Le tabagisme étant un facteur de risque modifiable, ce cancer constitue donc un véritable problème de santé publique.
En 1912, le médecin Isaac Adler avait réussi à répertorier l’existence de 374 cas de carcinomes pulmonaires dans la littérature – un exploit pour l’époque – qu’il rapporta dans un ouvrage sur le cancer pulmonaire (3). Au moment de la publication de cet écrit d’intérêt historique, les cancers primaires du poumon étaient encore considérés comme des maladies très rares, mais Adler suspectait que plusieurs cas de cancer pulmonaire recevaient en fait un diagnostic de tuberculose, une maladie à laquelle les médecins étaient davantage sensibilisés à l’époque (3). D’ailleurs, il était d’avis que les cancers pulmonaires étaient vraisemblablement plus fréquents qu’on ne le croyait communément à l’époque et que leur incidence était en augmentation (3). Les prochaines lignes – l’existence même et la pertinence du présent mémoire s’y justifient – vous apprendront que Dr Adler avait vu juste sur ce dernier point, car l’incidence de nos jours doit être à des années-lumière de ce qu’elle a pu être à l’époque.
En effet, si le cancer pulmonaire était considéré rarissime au début du 20e siècle, la réalité est
toute autre aujourd’hui. Au Canada, on estimait en 2017 qu’il était le cancer le plus fréquent (2). Au pays, on posera ce diagnostic chez 1 homme sur 11 et chez 1 femme sur 14 durant leur existence (2). Cette probabilité est grande et le semble d’autant plus lorsque l’on considère la létalité de ce cancer. Ce dernier point sera élaboré ultérieurement dans le présent mémoire. Dans une perspective plus globale, cette maladie représente également un fardeau significatif mondialement. En 2018, il y aurait eu plus de 2 millions nouveaux cancers pulmonaires diagnostiqués à travers le monde d’après les estimations du Global Cancer Observatory (4).
3
La mortalité par cancer pulmonaire a augmenté de façon importante après la fin de la première guerre mondiale en Angleterre et dans plusieurs autres pays industrialisés (5). Nous savons aujourd’hui que le taux de mortalité par cancer pulmonaire avoisine son taux d’incidence, étant donné la pauvre survie qui y est associée (6).
Lopez et collègues (7) ont produit en 1994 un modèle en 4 phases particulièrement intéressant, afin de décrire le déroulement de « l’épidémie du tabagisme [Notre traduction] ». La mortalité attribuable au tabagisme ne se manifeste que plusieurs décennies après la montée de sa prévalence (7). Plus spécifiquement, après l’adoption de masse du tabagisme, cela prend deux ou trois décennies avant que les décès en lien avec le cancer pulmonaire ne commencent à être observés (7). Cela peut prendre 30 à 40 ans après le plafonnement de la prévalence du tabagisme avant que le taux de décès par cancer pulmonaire n’atteigne son propre sommet dans une population (7). Dans plusieurs pays à haut revenu, les taux de mortalité par cancer pulmonaire sont désormais à la baisse chez les hommes (6). Puisqu’elles n’ont, en général, pas commencé à fumer aussi tôt que les hommes, on observe un délai dans ces tendances chez les femmes, un retard féminin dans l’épidémie du tabagisme (6, 8). Dans les endroits qui ont été touchés en premier par l’épidémie du tabagisme, chez les femmes de 50 à 74 ans, les taux de mortalité par cancer pulmonaire sont normalement stables ou en diminution, tandis qu’ils augmentent encore dans certains endroits ayant adopté plus tard le tabac (8).
1.2 Étiologies
1.2.1 Tabagisme
L’association entre le cancer pulmonaire et le tabagisme était étudiée par les scientifiques il y a déjà plusieurs décennies (5, 9, 10). Il y a plus de 50 ans, le rapport « Smoking and Health: Report of the Advisory Committee to the Surgeon General of the Public Health Service » était publié par le gouvernement américain (11). Dans cette publication, on reconnaissait la causalité de l’association entre le tabagisme et le cancer pulmonaire (11). Le modèle de l’épidémie du tabagisme développé par Lopez et al. (7) permet de s’expliquer pourquoi il a été si difficile au départ de faire le lien entre le tabagisme et ses conséquences sur la santé.
4
Le délai de plusieurs décennies existant entre la montée du tabac et celle des décès reliés au cancer pulmonaire a complexifié l’identification des dangers reliés au tabagisme.
À présent, nous savons que la majorité des cancers pulmonaires sont causés par le tabagisme (12). Cette habitude de vie serait responsable de 75 à 90% du risque de cancer du poumon (13). Les différents types histologiques de cancer pulmonaire, que ce soit le carcinome à petites cellules, le carcinome épidermoïde, l’adénocarcinome ou le carcinome à grandes cellules, sont tous associés au tabagisme, mais ce sont chez les deux premiers types que l’on retrouve l’association la plus forte (14).
1.2.2 Autres facteurs de risque
Plusieurs facteurs environnementaux ont été mis en lien avec le cancer pulmonaire. L’exposition au radon (15), à l’amiante, à la pollution et aux radiations ionisantes seraient associées avec le cancer pulmonaire (12). Dans une publication rassemblant les données de 13 études cas-témoin menées en Europe, la concentration résidentielle de radon était associée au cancer du poumon avec une relation dose-réponse linéaire (16). D’autres chercheurs ont suggéré qu’il y aurait une action synergique additive entre le radon et le tabagisme dans le risque de développer le cancer du poumon (15). L’amiante a également une interaction avec le tabagisme lorsqu’on regarde la mortalité par cancer pulmonaire, qui serait supérieure à l’addition des risques individuels de ces facteurs (17). Enfin, un autre facteur environnemental ayant été associé avec le cancer pulmonaire est l’utilisation résidentielle de charbon pour la cuisson ou le chauffage (18).
La maladie pulmonaire obstructive chronique (MPOC), en particulier sa forme emphysémateuse (19, 20), est également un facteur de risque indépendant dans le développement du cancer pulmonaire et cela, même après avoir tenu compte du tabagisme (21). De plus en plus, on se penche sur des gènes qui pourraient amener une susceptibilité génétique au cancer pulmonaire et certains gènes, variantes et mutations ont même déjà été identifiés comme étant des causes potentielles ou des contributeurs potentiels du cancer du poumon (22, 23).
5
1.3 Histologie
Deux grands types histologiques doivent être distingués dans le cancer pulmonaire : le cancer pulmonaire non à petites cellules et le cancer pulmonaire à petites cellules.
1.3.1 Le cancer pulmonaire non à petites cellules
Le cancer pulmonaire non à petites cellules représente environ 85% des cancers du poumon (24). L’adénocarcinome, le carcinome épidermoïde ainsi que le carcinome à grandes cellules sont les trois types histologiques qui font partie de cette famille (25).
En 1995, une étude par Travis et collègues (26) a permis de faire ressortir un changement dans la distribution des types histologiques des cancers pulmonaires survenu dans les dernières décennies. Dans cette étude, durant la période de 1983 à 1987, l’adénocarcinome est devenu le type histologique de cancer pulmonaire le plus fréquent, devançant ainsi le carcinome épidermoïde (26).
1.3.2 Le cancer pulmonaire à petites cellules
Le deuxième grand type de cancer pulmonaire est le carcinome à petites cellules (25). Ce cancer se développe à partir de cellules neuroendocriniennes (25). Ce type histologique présente une évolution généralement agressive et a un pronostic défavorable. On retrouve ce type de cancer dans environ 15-17% des cancers pulmonaires (24, 26). Lorsqu’on pose le diagnostic, plus de la moitié des patients ont déjà une atteinte à distance (26). C’est indubitablement le type histologique ayant le pire pronostic (26). C’est un cancer qui survient chez des fumeurs dans la grande majorité des cas (27).
Assez tôt, des auteurs ont insisté sur l’importance de considérer le cancer pulmonaire à petites cellules de façon isolée, soulevant qu’il était différent des autres cancers pulmonaires sur plusieurs plans dont la présentation clinique, la réponse au traitement et le pronostic (27, 28).
6
Cette distinction demeure pertinente aujourd’hui puisque les traitements proposés et le pronostic seront différents selon le type histologique.
1.4 Investigation et opérabilité
1.4.1 Résécabilité
Lorsqu’un patient est investigué pour un cancer pulmonaire, le médecin doit se demander si ce cancer est résécable. Dans le dictionnaire en ligne des termes sur le cancer du National
Cancer Institute (NCI), « résécable » est défini comme « pouvant être enlevé par la chirurgie
[Notre traduction] » (29). Dans un même ordre d’idée, le concept de résécabilité dans ce mémoire exprime la confiance que l’on pourra chirurgicalement retirer l’entièreté de la tumeur du patient.
Pour déterminer si un cancer est résécable, on doit en connaitre l’étendue. La détermination du stade du cancer, une mesure de son étendue, permet au clinicien d’avoir une idée du pronostic du patient et des traitements qu’il pourra lui offrir, car ceux-ci sont grandement influencés par le stade du cancer (30-32). Le stade est déterminé à l’aide de trois paramètres principaux : la taille de la tumeur ainsi que son envahissement direct de certaines structures (le T), l’atteinte des ganglions (le N) et la présence de métastases (le M) (33). Il existe une classification pour chacune de ces variables et la combinaison des trois classifications (le TNM) chez un patient nous permet d’obtenir le stade. Dans le cancer pulmonaire, le stade va de IA à IV en ordre croissant de sévérité (33).1
Plusieurs facteurs doivent être pris en compte lorsqu’on établit le stade TNM d’un patient. Dans le cancer du poumon, pour déterminer le T, on recherche la taille de la tumeur, puis on considère l’atteinte de différentes structures clés : la bronche souche, la carène, les plèvres viscérale et pariétale, la présence et l’étendue de pneumonite obstructive ou d’atélectasie, l’envahissement dépassant le poumon (diaphragme, nerf récurrent laryngé, vertèbres, etc.) et
7
enfin, l’existence d’autres nodules pulmonaires (33). Chacun de ces éléments est associé à un stade T selon la sévérité de l’atteinte qui y est associée. Pour déterminer le N, on regarde si des ganglions sont atteints et à quel endroit ils se trouvent : le N augmentera avec une atteinte médiastinale ou sous-carénale et encore davantage s’il y a une atteinte controlatérale ou une atteinte scalène ou sus-claviculaire (33). Enfin, le M consiste en la présence de métastase à distance, ce qui, dans la 7e édition du TNM, inclut également la présence de
nodule controlatéral, de nodules pleuraux ou d’un épanchement péricardique ou pleural malin (33).
À titre d’exemple, prenons un cancer pulmonaire de stade IV, qui est l’exemple le plus extrême. On désignerait stade IV un cancer qui est métastatique, soit qui s’est répandu à distance de la tumeur primaire. Un patient ayant un cancer primaire du poumon et se présentant avec une métastase cérébrale et des métastases hépatiques aurait un cancer pulmonaire de stade IV. En général, on considère qu’un cancer pulmonaire métastatique n’est pas résécable (34) puisque le cancer, s’étant déjà répandu de façon systémique, ne pourra être enlevé dans sa totalité.
L’American College of Chest Physicians (ACCP) recommande que les patients atteints de cancer pulmonaire non à petites cellules de stade I et II soient opérés s’ils n’ont pas de contrindication à la chirurgie (30). La chirurgie est parfois proposée également chez certains stades III après des traitements néo-adjuvants, donc des traitements qui précèdent la chirurgie comme la chimiothérapie par exemple (31).
1.4.2 Opérabilité
Il faut distinguer l’opérabilité de la résécabilité, qui sont des termes différents (35). En 1966, dans un écrit portant sur l’opérabilité et la résécabilité dans le cancer pulmonaire, Clifton définissait ce premier concept ainsi : « Operability means only that the patient can be
expected to survive the operative procedure planned or likely to be necessary » (34). Avec
une telle définition, on considère l’état de santé du patient dans la balance. Par ailleurs, Clifton soulignait aussi le caractère évolutif des critères utilisés pour définir l’opérabilité, au
8
fil des avancées dans les différents champs de la médecine, ainsi que leur caractère parfois subjectif, deux points particulièrement pertinents (34).
1.4.2.1 Détermination du risque chirurgical
L’ACCP a élaboré un algorithme pour l’évaluation physiologique d’un patient avant une chirurgie de résection pulmonaire (36). En premier lieu, le risque cardiovasculaire du patient doit être évalué (36) en fonction d’un algorithme d’investigation adapté à partir de celui développé en collaboration par l’European Respiratory Society (ERS) et l’European Society
of Thoracic Surgery (ESTS) (37). Selon sa condition cardiovasculaire, le patient pourra être
redirigé pour subir des investigations ou recevoir des traitements supplémentaires avant de poursuivre son bilan cancérologique (36). Du côté respiratoire, le patient doit réaliser une spirométrie ainsi qu’une mesure de la diffusion au monoxyde de carbone (DLCO) et en fonction de l’étendue de la résection prévue, il sera possible de calculer les valeurs attendues en post-opératoire (36). Selon les résultats obtenus, le patient pourrait avoir à passer des tests supplémentaires qui exposeront sa tolérance à l’effort et l’ensemble de ces informations permettront de stratifier son risque opératoire (36).
Les auteurs précisent dans l’algorithme que plusieurs autres facteurs peuvent influencer le risque réel comme l’approche chirurgicale et les comorbidités du patient entre autres et devraient être pris en compte dans l’estimation du risque (36).
1.4.2.2 Impression du clinicien
Bien que l’algorithme produit par l’ACCP fournisse des éléments objectifs auxquels se fier pour apprécier le risque chirurgical, il existe une multitude de paramètres cliniques supplémentaires pouvant agir sur le risque réel (36), rendant ainsi la quantification du risque chirurgical très ardue. En effet, cet algorithme est centré principalement sur le calcul de la fonction respiratoire post-opératoire, sur la fonction cardiovasculaire et sur la tolérance à l’effort au besoin (36). Par conséquent, l’impact de toutes les autres comorbidités du patient est estimé de façon subjective par le médecin traitant. C’est pour cette raison que le clinicien doit aussi exercer son jugement devant chaque individu, qu’il doit considérer dans sa
9
globalité. Ces perceptions, combinées à l’expérience du chirurgien, peuvent influencer les options de traitement qui seront considérées. En outre, tous les chirurgiens ne seront pas prêts à tolérer le même niveau de risque pour une chirurgie. Naturellement, les options doivent également être discutées avec le patient pour déterminer ses attentes et qu’il puisse prendre une décision éclairée.
1.5 Traitement
1.5.1 Chirurgie
Le meilleur traitement à l’heure actuelle pour espérer guérir d’un cancer pulmonaire de stade précoce est la résection chirurgicale de ce dernier (36). Plusieurs approches sont possibles : la chirurgie peut se faire par thoracotomie, soit sous vision directe, à l’aide d’une large incision, ou via thoracoscopie, soit à l’aide d’une caméra vidéo et d’une ou plusieurs incisions beaucoup plus petites permettant d’insérer des instruments dans la cavité pour procéder à l’intervention. La thoracoscopie étant moins invasive et moins morbide, elle est devenue au fil du temps l’approche chirurgicale à privilégier lorsque possible (38, 39).
Selon le stade du cancer et selon si la résection est complète ou non, la conduite subséquente sera déterminée (suivi seul, chimiothérapie ou radiothérapie post-opératoire, etc.).
1.5.2 Autres modalités thérapeutiques
Il existe plusieurs autres modalités thérapeutiques dans le traitement du cancer pulmonaire. La chimiothérapie, la radiothérapie, la radiothérapie stéréotaxique et la thérapie ciblée en sont quelques-unes. Certains de ces traitements, comme la chimiothérapie et la radiothérapie, peuvent être institués avant la résection de la tumeur dans le but d’en diminuer la taille, on les nommera alors des traitements néo-adjuvants. D’autres fois, ils seront débutés après la chirurgie afin d’éliminer les cellules cancéreuses qui pourraient être toujours présentes, ce seront alors des traitements adjuvants. Enfin, ils peuvent être les seuls traitements offerts au patient si l’étendue de la maladie est trop importante ou si le patient est considéré inopérable. Dans cette dernière situation, il pourrait également être jugé plus adéquat de ne pas traiter le
10
cancer, mais plutôt d’offrir un suivi au patient et de lui proposer des soins dont le but sera de pallier les symptômes.
1.6 Pronostic
Le cancer pulmonaire est le plus meurtrier de tous les cancers. Au Canada, on projetait que le nombre de décès causés par ce cancer en 2017 serait plus grand que le total de ceux attribués aux cancers du sein, du côlon et du pancréas réunis (2).
Dans une étude publiée par Coleman et al. en 2011, on estimait qu’au Canada, la survie relative standardisée pour l’âge à 5 ans des patients atteints de cancer pulmonaire était de 18,4% pour la période 2005-2007 (40). Les données utilisées pour la population du Canada dans cette étude incluaient des registres provenant de l’Alberta, de la Colombie-Britannique, du Manitoba et de l’Ontario et permettaient tout de même de couvrir près de 65% de la population du pays. Devant de tels chiffres, le lecteur est à même de constater que le pronostic du cancer pulmonaire est plutôt mauvais.
Alors qu’on a observé une nette amélioration dans la survie pour de nombreux cancers, la hausse de survie dans le cancer pulmonaire a été plus modeste dans les dernières décennies (41). Entre les périodes 1975 à 1977 et 2004 à 2010, la survie à 5 ans est passée de 12 à 18% aux États-Unis (41). Bien que cela représente une amélioration, ces résultats demeurent peu satisfaisants, considérant la fréquence de ce cancer. Il faut toutefois préciser que la survie dans le cancer pulmonaire varie de façon importante selon le stade du cancer (42). À l’aide d’une base de données de cas de cancer pulmonaire non à petites cellules, Goldstraw et collègues (42) ont déterminé la survie des patients selon le stade de leur cancer. En utilisant les stades cliniques basés sur la 7e édition du TNM, ils obtenaient une survie de 82% à 5 ans
pour les stades IA, qui tombait à 47% chez les stades IIB pour atteindre 6% chez les patients ayant un stade IV (42).
11
CHAPITRE 2 : La maladie pulmonaire obstructive
chronique
2.1 Présentation clinique
2.1.1 Généralités
Selon le Global Initiative for Chronic Obstructive Lung Disease (GOLD), la MPOC est « une maladie caractérisée par des symptômes respiratoires persistants et par une obstruction bronchique qui est secondaire à des anomalies des voies aériennes et/ou alvéolaires, habituellement causée par l’exposition significative à des particules ou gaz délétères [Notre traduction] » (43). Typiquement, l’obstruction n’est pas entièrement réversible (25). Le GOLD est un important regroupement qui travaille sur la MPOC et il propose des lignes directrices sur le traitement et la prise en charge de ces patients (43). D’après cette organisation, on doit soupçonner la présence de cette maladie chez des individus avec « dyspnée, toux chronique ou produisant des expectorations, et/ou ayant une histoire d’exposition à des facteurs de risque pour la maladie [Notre traduction] » (43). Outre ces symptômes, sont également possibles une sensation d’oppression thoracique et un wheezing (43). Deux phénotypes classiques sont décrits dans la MPOC, soit la bronchite chronique et l’emphysème. Cela étant dit, la MPOC est à présent considérée comme une pathologie hétérogène comprenant plusieurs autres phénotypes (44), mais leur détail dépasse le but de ce mémoire et nous nous concentrerons sur les deux phénotypes mentionnés ci-haut.
En 1959, dans un article où il mettait en lumière un manque de clarté et d’uniformité dans le diagnostic de la bronchite chronique, Fletcher proposait que la bronchite chronique soit diagnostiquée chez des patients ayant une toux productive, « présente la majorité des jours pour au moins trois mois pour au moins deux hivers consécutifs [Notre traduction] » (45). De plus, on précisait qu’il n’y avait pas d’autre cause locale pouvant expliquer le symptôme (45, 46). Le diagnostic de bronchite chronique est donc un diagnostic clinique (47).
En revanche, l’emphysème est plutôt associé à des concepts d’anatomie (47). Lors d’un symposium tenu en 1958, un regroupement de chercheurs britanniques définissait
12
l’emphysème comme « une condition du poumon caractérisée par l’augmentation au-delà de la normale de la taille des espaces aériens distaux aux bronchioles terminales causée par la dilatation ou par la destruction de leurs parois [Notre traduction] » (47).
2.1.2 Obstruction bronchique
Une obstruction bronchique qui n’est pas entièrement réversible à la spirométrie permet de porter un diagnostic de MPOC lorsqu’elle est associée à un tableau clinique compatible et à une exposition à risque, le plus souvent le tabac (48). Dans les lignes directrices sur le diagnostic et la prise en charge de la MPOC rédigées en collaboration par l’American College
of Physicians, par l’American College of Chest Physicians, par l’American Thoracic Society
et par l’European Respiratory Society, on recommande que la spirométrie soit réalisée seulement chez les individus qui présentent des symptômes respiratoires lorsque l’on veut dépister l’obstruction bronchique (48). Le GOLD présente également la spirométrie comme une étape nécessaire dans l’obtention d’un diagnostic de MPOC (43). L’obstruction bronchique est définie par un indice de Tiffeneau (rapport du volume expiré maximal en 1 seconde [VEMS] sur la capacité vitale forcée [CVF]) post-bronchodilatateur qui est inférieur à 0,70 (43). Chez des individus ayant des facteurs de risque de la maladie et présentant des symptômes respiratoires concordants, cela permet le diagnostic (43).
2.1.2.1 Classification de GOLD
Le regroupement GOLD utilise une classification nous permettant d’établir la sévérité de l’obstruction bronchique à l’aide de la spirométrie (43). Chez un patient ayant une obstruction bronchique avérée (indice de Tiffeneau < 0,70), on utilise la valeur du VEMS post-bronchodilatateur pour définir la sévérité de l’obstruction (43). Les valeurs suivantes de VEMS en pourcentage de la prédite sont associées à la sévérité de la MPOC correspondante (grade GOLD) : VEMS ³ 80%, légère (GOLD 1); VEMS 50 à 79%, modérée (GOLD 2); VEMS 30 à 49%, sévère (GOLD 3); VEMS < 30%, très sévère (GOLD 4) (43, 49). Les patients porteurs d’une MPOC ont une maladie dont la sévérité est pour la majorité légère ou modérée (50).
13
À présent, il existe aussi un autre outil utilisé pour évaluer la MPOC, soit l’outil « ABCD », qui permet une classification à partir des symptômes du patient et de son historique d’exacerbations (43).
2.1.3 Comorbidités et complications
Plusieurs comorbidités se retrouvent fréquemment chez les patients porteurs d’une MPOC. Dans une étude transversale menée auprès de 1216 patients MPOC, Dal Negro et collègues rapportaient que plus du deux tiers des patients présentaient au minimum deux comorbidités cliniquement pertinentes (51). La prévalence des différentes catégories de comorbidités augmentait graduellement de concert avec la sévérité de la MPOC, mais deux types de comorbidités faisaient exception : après une augmentation jusque chez les GOLD 3, la prévalence des maladies cardiovasculaires et des maladies métaboliques s’effondrait chez les GOLD 4 (51). Les auteurs émettaient l’hypothèse que les taux de mortalité associés à ces conditions sont probablement plus grands chez les GOLD 4 (51). Dans cette étude, les comorbidités de type cardiovasculaire étaient celles que l’on retrouvait le plus souvent chez les patients MPOC, les plus fréquentes parmi celles-ci étant l’hypertension artérielle et la maladie cardiaque ischémique (51). Une autre étude avait trouvé que les patients ayant une MPOC de sévérité GOLD 2 et de sévérité GOLD 3 ou 4 avaient un risque plus important de maladie cardiovasculaire, mais aussi de diabète et d’hypertension (52). Les patients GOLD 3 et 4 ayant été analysés ensemble dans cette étude (52), il n’est pas possible de comparer le résultat obtenu directement avec celui des GOLD 4 de l’étude de Dal Negro et autres. Une étude réalisée à l’aide de données provenant d’une base de données administratives en Allemagne a quant à elle comparé la prévalence de plusieurs comorbidités chez des patients MPOC et non-MPOC, appariés pour le sexe et l’âge (53). Les auteurs de cette étude ont rapporté une prévalence plus élevée, entre autres, d’hypertension artérielle, d’insuffisance cardiaque congestive, d’insuffisance rénale chronique, de diabète, d’ostéoporose, de reflux gastro-œsophagien et de dépression chez les MPOC, mais n’avaient pas pu ajuster leurs résultats pour le tabagisme (53). En ce qui concerne la dernière comorbidité mentionnée, Hill et collègues, quelques années plus tôt, s’étaient intéressés à l’anxiété et à la dépression chez
14
les patients MPOC et recommandaient aux médecins œuvrant auprès ceux-ci d’être à l’affut de symptômes suggestifs de ces problématiques de santé (54).
On retrouve une atteinte de la capacité fonctionnelle chez les patients MPOC, qui s’explique par la pathologie respiratoire, mais potentiellement aussi par d’autres acteurs agissant au niveau systémique (55). La dysfonction musculaire est également une conséquence et comorbidité importante de la MPOC (56).
Dans certains cas, le fait que le patient soit atteint de MPOC complexifie le diagnostic d’une comorbidité, comme l’ont soulevé, à titre d’exemple, Hawkins et collègues (57) lorsqu’ils ont mis en lumière les multiples défis se présentant aux cliniciens qui tentent de porter un diagnostic d’insuffisance cardiaque chez un patient atteint de MPOC et vice-versa.
D’autres auteurs se sont intéressés à la prévalence d’anémie (58), à la prévalence d’ostéoporose et d’ostéopénie (59), à l’incidence de fibrillation auriculaire (60), à l’incidence d’accident vasculaire cérébral (61) et au risque de thrombo-embolie veineuse (62) chez les patients MPOC. La question des comorbidités chez le patient MPOC pourrait être l’objet d’un chapitre entier tant de problématiques différentes ont été étudiées en lien avec cette maladie. Ces quelques références sont proposées pour ouvrir la porte au lecteur qui s’intéresse à la question.
Enfin, la MPOC est un facteur de risque indépendant dans le développement du cancer pulmonaire (21). La coexistence de ces deux maladies sera d’ailleurs abordée davantage plus loin dans le présent mémoire. De plus, certaines complications peuvent survenir dans la MPOC et parmi celles-ci on compte l’hypertension artérielle pulmonaire (63) ainsi que l’insuffisance cardiaque droite (64). Enfin, la MPOC est parfois une maladie mortelle, étant responsable de 4,4% des décès chez les canadiens de 40 ans et plus en 2011 (65).
15
2.2 Épidémiologie
Le fardeau de la MPOC est en augmentation à travers le monde. S’il était estimé par l’Organisation mondiale de la santé (OMS) que la MPOC était la quatrième cause de décès en importance mondialement en 2015, il est maintenant projeté qu’elle en deviendra la troisième cause en 2030 (66).
Une méta-analyse de 2015, rassemblant des études utilisant la spirométrie pour définir la MPOC, estimait la prévalence globale de cette condition à 11,7% en 2010 chez les adultes de 30 ans et plus (67). Une autre étude, menée parmi 12 sites à travers le monde et utilisant les critères du Global Initiative for Chronic Obstructive Lung Disease (GOLD) pour le diagnostic de la MPOC, chez des sujets de 40 ans et plus cette fois, rapportait une prévalence de la MPOC de toute sévérité qui était très variable selon l’endroit et avait relevé une prévalence globale de la MPOC de sévérité modérée ou plus sévère de 10,1% à travers tous les sites (68). Enfin, au Canada, 12% des adultes de 35 à 79 ans étaient atteints d’une obstruction bronchique à la spirométrie attribuable à la MPOC, selon les résultats obtenus aux troisième et quatrième cycles (2012 à 2015) de l’Enquête canadienne sur les mesures de
la santé (69).
2.2.1 Les défis entourant l’établissement des valeurs de prévalence de la MPOC
Plusieurs défis se présentent lorsque l’on cherche à déterminer la prévalence de la MPOC. Un problème majeur dans l’établissement de la prévalence de la MPOC est que de nombreux patients reçoivent un diagnostic de MPOC sans documentation spirométrique, pourtant un élément essentiel dans l’établissement de ce diagnostic. Dans une étude portant sur des patients du réseau des vétérans (Veteran Health Administration) aux États-Unis, sur 93 724 patients nouvellement diagnostiqués avec la MPOC entre juillet 2003 et juin 2004, seulement 36,7 % d’entre eux avaient été soumis à une spirométrie dans la période entourant le diagnostic (70). Chez un nombre appréciable de patients, le diagnostic de MPOC est donc posé sans avoir obtenu de confirmation de l’obstruction bronchique. Ce problème n’est assurément pas isolé aux États-Unis.
16
Le sous-diagnostic de la MPOC est aussi une problématique importante (69). Les résultats obtenus aux troisième et quatrième cycles (2012 à 2015) de l’Enquête canadienne sur les
mesures de la santé ont permis de constater une différence importante entre la proportion de
diagnostic auto-rapporté de MPOC et la proportion d’individus souffrant d’obstruction bronchique lorsque soumis à une spirométrie (69). Chez les individus de 35 à 79 ans, alors que seulement 3% rapportaient avoir reçu un diagnostic de MPOC, ce sont 12% qui présentaient une obstruction bronchique attribuable à la MPOC (69). De tous les patients ayant une obstruction bronchique confirmée par la spirométrie, 89% n’avaient jamais reçu le diagnostic de MPOC (69). Le même problème existe ailleurs dans le monde, puisque d’autres études, menées en France (71) et en Pologne (50) notamment, ont levé le voile sur le sous-diagnostic des maladies obstructives chroniques dans certaines régions de leur pays respectif. Sous-diagnostic, diagnostic posé sans que le patient n’ait passé de spirométrie, diagnostic erroné sont donc autant de facteurs pouvant fausser les données de certaines études. Un excellent chapitre se penchant sur le sujet pourrait intéresser le lecteur qui désire approfondir la question (72).
2.3 Étiologies
2.3.1 Tabagisme
Le plus important facteur de risque pour le développement de la MPOC est le tabagisme (73). Aux États-Unis, le rapport du Surgeon General de 1984 indiquait déjà dans ses conclusions que 80 à 90% des cas de MPOC au pays étaient imputables à cette habitude de vie (74). Bien qu’il soit incontestable que le tabagisme est le principal acteur dans le développement de la MPOC, il ne peut expliquer à lui seul l’entièreté du fardeau de la maladie dans la population (73). En effet, dans une publication de 2010 de l’American Thoracic Society, la fraction étiologique dans la population (population-attributable fraction) avait été relevée dans plusieurs études et les estimations obtenues étaient généralement inférieures à 80% (73). Cela signifie que d’autres facteurs que le tabac entrent en jeu dans la MPOC (73).
17 2.3.2 Autres étiologies
Le déficit en alpha-1-antitrypsine est une cause moins fréquente de MPOC. Ce sont 1 à 2% des cas qui seraient dus à ce déficit (75). L’alpha-1-antitrypsine est une protéine principalement produite au foie (76) et qui, après avoir été libérée dans la circulation sanguine, se rend au poumon pour le protéger en inhibant l’élastase neutrophilique, une enzyme protéolytique (75). L’équilibre protéinases-inhibiteurs au poumon est donc perturbé par un déficit en alpha-1-antitrypsine (75). En 1964, Eriksson suspectait déjà que la génétique avait un rôle dans à jouer le déficit en alpha-1-antitrypsine, grâce à l’étude d’une famille comprenant quelques patients emphysémateux (77). On sait maintenant que c’est une mutation au gène SERPINA1, produisant l’allèle Z, qui est la plus fréquente à ce jour reconnue pour causer un déficit sévère chez les homozygotes (76). La protéine anormale va rester coincée dans les hépatocytes, ce qui pourrait potentiellement être la cause d’une cirrhose (75, 76). D’autre part, sa faible présence dans la circulation sanguine et dans le poumon peut entrainer, dans le cas d’un déficit sévère, une destruction du parenchyme pulmonaire avec un emphysème panacinaire précoce (75). Il est probable que d’autres gènes puissent être impliqués dans le développement de la MPOC (73) et plusieurs méthodes ont d’ailleurs été proposées pour tenter de les identifier (78). Enfin, il est également avancé que l’existence d’une prédisposition génétique associée à certaines expositions environnementales (ex : le tabagisme) pourrait être impliquée dans le développement de la maladie (79).
L’asthme serait associé à une augmentation du risque de développer la MPOC (80). Une étude de cohorte publiée en 2016, particulièrement intéressante pour avoir effectué un suivi de 50 ans, a aussi rapporté que la présence d’asthme dans l’enfance était associée à la MPOC, définie par la spirométrie, à l’âge adulte (81).
Dans le même ordre d’idée, la combustion de biomasse (par exemple dans certains fours dans les pays en développement) serait associée à la présence de MPOC chez les femmes (73). D’autres auteurs s’étant intéressés au risque d’hospitalisation pour MPOC ou de décès attribué à la MPOC estiment que la pollution de l’air ambiant (notamment par la fumée de bois et par les particules fines liées au trafic) pourrait être associée à une augmentation du
18
risque de développer cette maladie (82). De plus, certaines expositions occupationnelles ont aussi été associées à la MPOC (73).
Dans une étude publiée en 2007 menée auprès d’une population chinoise, on associait l’exposition au tabagisme passif à une prévalence plus grande de MPOC (83). D’autres formes de tabagisme pourraient potentiellement contribuer au développement de la MPOC, notamment l’utilisation de la pipe à eau qui serait associée à un VEMS diminué en comparaison avec le fait de ne pas fumer (84). La marijuana fumée, quant à elle, aurait possiblement un effet synergique sur le risque de MPOC lorsqu’associée à la cigarette (85). Une consommation considérable de marijuana avait été définie dans cette étude comme un minimum de 50 joints de marijuana fumés (85). Cependant, cette dernière étude n’avait pas démontré d’augmentation du risque de MPOC devant une histoire de marijuana fumée sans utilisation de cigarettes, mais la puissance de l’étude était insuffisante sur ce point (85). En conclusion, bien qu’il ne fasse aucun doute que le tabagisme est une cause importante de MPOC, il faut savoir que d’autres causes existent et en particulier, il faut penser à la possibilité d’un déficit en alpha-1-antitrypsine ou à d’autres facteurs de risque lorsque le contexte clinique le suggère.
19
CHAPITRE 3 : Le cancer pulmonaire chez les patients
MPOC
3.1 Prévalence de la MPOC chez les patients atteints de cancer pulmonaire
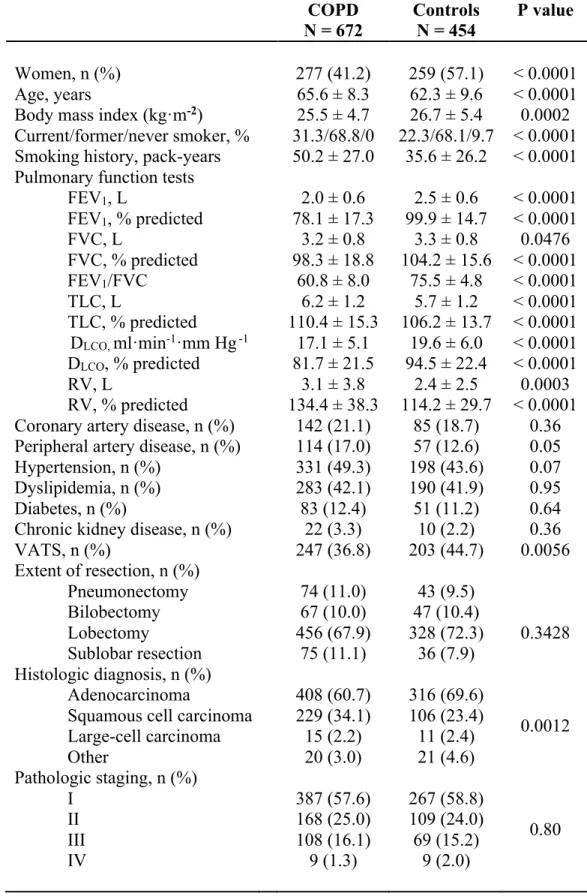
Chez 294 patients diagnostiqués avec un cancer pulmonaire et qui avaient réalisé des tests de fonction respiratoire, Loganathan et al. (86) ont trouvé une prévalence de la MPOC de 72,8% chez les hommes et de 52,5% chez les femmes. Une autre étude (21) a rapporté des résultats assez semblables, ayant obtenu une prévalence de la MPOC de sévérité GOLD 1 ou plus de 60% (hommes et femmes confondus) chez des patients référés à un centre tertiaire pour un cancer pulmonaire. Une étude menée plus récemment, au Japon, a rapporté une prévalence de la MPOC de 54,4% chez des patients avec un cancer pulmonaire nouvellement diagnostiqué et soumis à une bronchoscopie (87). Les études mentionnées n’ayant pas exactement les mêmes critères d’inclusion, il n’est pas surprenant d’avoir certaines différences dans les résultats, cela étant dit, les résultats ci-haut sont tous en faveur d’une prévalence élevée de la MPOC dans le cancer pulmonaire.
La majorité des patients porteurs d’une MPOC au moment du diagnostic de la néoplasie pulmonaire et soumis à une bronchoscopie ont une obstruction bronchique de sévérité légère ou modérée (87). Cela correspond également avec la sévérité de la majorité des patients MPOC que l’on retrouve en pratique de première ligne, qui est principalement légère ou modérée (50).
En résumé, la MPOC est une atteinte dont la fréquence est grande chez les patients atteints de cancer pulmonaire. Cette constatation est d’une importance clinique majeure, car la présence d’une maladie respiratoire supplémentaire représente un défi additionnel pour la détermination de l’opérabilité d’un patient par le clinicien, avec un impact potentiel sur les traitements qui seront offerts.
20
3.2 Liens physiopathologiques entre cancer pulmonaire et MPOC
Le tabagisme est un facteur de risque dans le développement à la fois du cancer pulmonaire et de la MPOC (12). Ce n’est donc pas surprenant que l’on retrouve une prévalence si importante de MPOC chez les patients atteints de cancer pulmonaire. Cependant, le tabagisme n’explique pas tout. Sachant qu’au moins 25 % des fumeurs vont développer une MPOC cliniquement significative après 25 ans de tabagisme (88) et que la majorité des cancers pulmonaires sont associés au tabac, on pourrait s’attendre à une proportion de MPOC qui avoisine ces chiffres chez les patients atteints de cancer pulmonaire. Cependant, ce n’est pas le cas. Dans une étude par Young et al. (21), des patients atteints de cancer pulmonaire ayant une histoire tabagique positive ont été appariés pour le sexe, l’âge et l’histoire tabagique avec des sujets provenant de la population générale (témoins) ayant également une histoire tabagique positive. La prévalence de MPOC était nettement supérieure chez les patients atteints de cancer pulmonaire, malgré l’appariement pour l’histoire tabagique (21). En effet, on a rapporté une prévalence de la MPOC de sévérité modérée ou plus sévère qui était 6 fois plus grande chez les patients atteints de cancer pulmonaire que chez les témoins dans les groupes appariés (21). Même lorsque l’on tient compte du tabagisme, le cancer pulmonaire demeure plus fréquent chez les MPOC. La MPOC est elle-même un facteur de risque indépendant dans le développement du cancer pulmonaire (21).
Plusieurs autres avenues sont explorées pour tenter d’expliquer le lien observé entre la MPOC et le cancer pulmonaire. On compte parmi les hypothèses étudiées l’inflammation chronique (89), le stress oxydatif (90) et la susceptibilité génétique au développement de ces pathologies (19).
3.3 La chirurgie pour cancer pulmonaire chez les MPOC : état des
connaissances
L’influence de la MPOC sur l’évolution clinique à la suite d’une chirurgie pour cancer pulmonaire a été étudiée par plusieurs chercheurs. Cependant, quelques points demeurent problématiques lorsque l’on veut comparer les résultats de certaines études.
21
D’abord, d’un point de vue méthodologique, il faut savoir que les chercheurs ne définissent pas tous le diagnostic de MPOC de la même façon. Dans une étude par Zhai et al. (91) on utilisait le diagnostic médical auto-rapporté pour définir la MPOC. Ces derniers se sont intéressés à l’influence de la MPOC sur la survie après une chirurgie pour cancer pulmonaire de stade précoce (91). Dans cette étude, les patients MPOC avaient une survie à 5 ans significativement inférieure à celle des non-MPOC et la MPOC était également associée à une survie inférieure en analyse multivariée (91). Cette étude ayant une population de grande taille (N=902) (91), elle aurait pu présenter des résultats très intéressants si la MPOC avait été définie à l’aide de critères spirométriques.
De l’avis de l’auteure de ce mémoire, il n’est pas satisfaisant d’utiliser le diagnostic médical auto-rapporté, car le diagnostic médical de la MPOC lui-même n’est pas toujours effectué correctement. Pour illustrer ce propos, soulignons les résultats d’une étude britannique effectuée auprès de cliniques de médecine générale, où on avait fait passer une spirométrie à 125 patients qui avaient reçu préalablement un diagnostic de MPOC sans avoir subi de spirométrie et 31% d’entre eux n’avaient aucune obstruction bronchique (92). On peut donc penser qu’il peut y avoir un surdiagnostic lorsqu’on n’utilise pas la spirométrie. D’un autre côté, il est également possible que le diagnostic auto-rapporté conduise à une sous-estimation de la prévalence de la maladie (93, 94). En effet, l’étude RECOIL (95) publiée récemment relevait que dans une population de patients atteints de cancer pulmonaire, 60% des patients ayant une obstruction bronchique à la spirométrie n’étaient pas connus antérieurement comme atteints de MPOC. En se fiant à ces divers résultats, on peut craindre que l’absence de spirométrie expose à un risque élevé de diagnostic erroné et donc de mauvaise classification des patients. Il va sans dire qu’une mauvaise répartition des patients dans les groupes à l’étude aurait pour effet d’altérer la fiabilité des résultats obtenus. Enfin, le diagnostic auto-rapporté rend impossible la gradation de la sévérité de la MPOC chez les patients. Le lecteur peut également se référer à nouveau à la section 2.2.1 Les défis entourant l’établissement des valeurs de prévalence de la MPOC pour quelques points de réflexion supplémentaires.
22
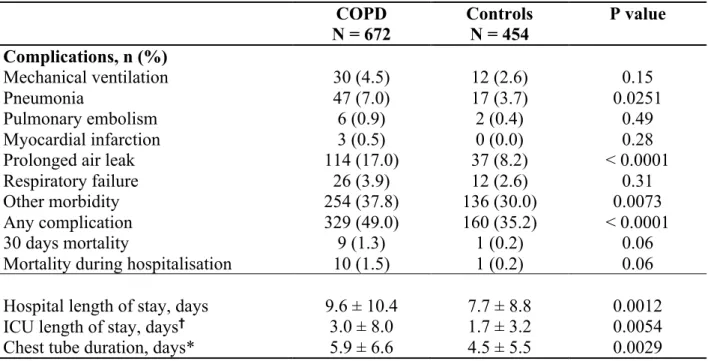
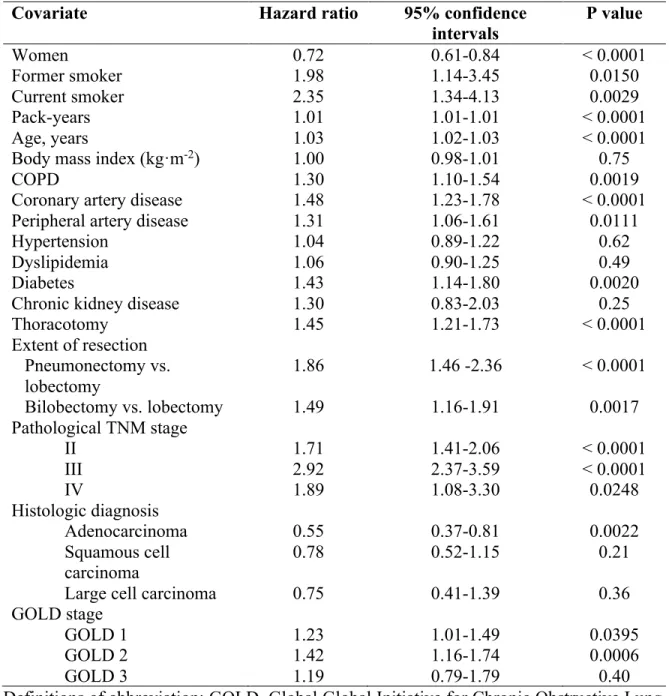
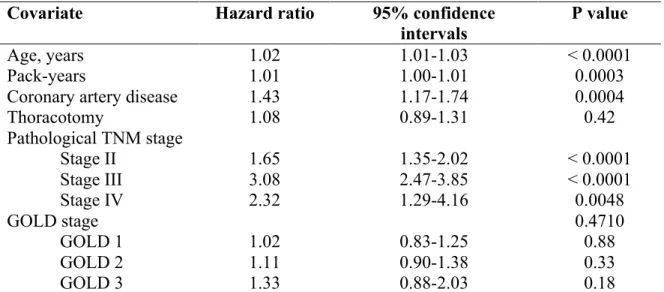
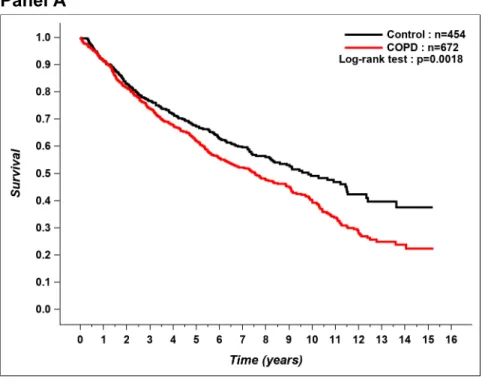
L’évolution en post-opératoire de la chirurgie pour cancer pulmonaire des patients ayant une MPOC modérée à sévère a été investiguée par plusieurs auteurs (96, 97). Sekine et collègues (96) ont publié une étude en 2002, dans laquelle ils avaient défini la MPOC comme un VEMS £ 70% de la prédite et un indice de Tiffeneau £ 70%, et les autres patients avaient été classés dans le groupe non-MPOC. La proportion de patients présentant au moins une complication pulmonaire était plus élevée chez les MPOC (96). Il y a également eu davantage de décès à 30 jours chez les MPOC (96). Il n’y avait pas de différence entre les deux groupes en ce qui concerne la survie à long-terme, sauf lorsqu’on regardait la survie intercurrente (qui tient compte des décès non associés au cancer), qui était abaissée chez les MPOC (96). Iwasaki et collègues (98), pour leur part, n’ont pas trouvé de différence significative entre la survie globale à 5 ans de patients MPOC modérés en comparaison avec des MPOC sévères après une chirurgie pour cancer pulmonaire, mais notons que leur étude comportait des groupes de petite taille. Nakajima et coauteurs (99) se sont attardés, de leur côté, au devenir des patients ayant une MPOC sévère à très sévère tandis que les patients n’ayant pas de MPOC sévère avaient été considérés les témoins. La survie à long-terme était diminuée chez les patients MPOC sévère et très sévère et la survie à 30 jours était également moins bonne dans ce groupe, mais il faut noter que les 3 patients décédés durant cette période étaient également porteurs d’une pneumonie interstitielle (99).
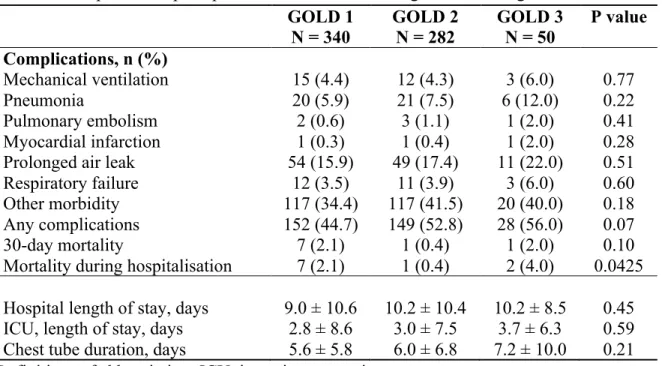
Certaines études se sont penchées sur l’effet de différents degrés de sévérité de la MPOC sur l’évolution post-opératoire de ces patients, mais elles comprenaient relativement peu de patients ayant une MPOC légère (100-102). Dans l’étude de Yoshida et al (100), la survenue de complications pulmonaires en post-opératoire augmentait tandis que la survie sans récurrence diminuait avec l’augmentation de la sévérité de la MPOC. De leur côté, Sekine et co-auteurs (101) ont trouvé que la présence d’une MPOC GOLD 3 était associée avec une survie à long-terme inférieure, comparativement à des patients non-MPOC, à la suite d’une résection pour cancer pulmonaire, ce qui n’était pas le cas pour une MPOC GOLD 1 ou GOLD 2. Une étude plus récente a examiné la survenue de complications pulmonaires post-opératoires chez des patients ayant une MPOC peu sévère (principalement des patients ayant une MPOC légère et quelques patients ayant une MPOC modérée) (103). La proportion de complications pulmonaires post-opératoires était plus élevée chez les patients MPOC par
23
rapport à ceux ayant une fonction respiratoire normale (103). Les résultats de cette étude étaient très intéressants en raison du fait qu’on étudiait les patients ayant une MPOC légère à modérée, même si le nombre de patients ayant une MPOC légère y demeurait relativement peu élevé (103).
Bugge et co-auteurs (104) se sont intéressés, pour leur part, à l’influence de la MPOC sur la survie après une chirurgie pour cancer pulmonaire non à petites cellules chez des patients ayant un cancer de stade I et II. Les patients étaient séparés en trois groupes : le groupe MPOC sévère à très sévère, le groupe MPOC légère à modérée et le groupe avec une fonction respiratoire normale (104). Les patients ayant une MPOC sévère avaient une survie cumulative inférieure, tandis que les deux autres groupes (MPOC légère à modérée et fonction respiratoire normale) avaient une survie cumulative comparable entre eux (104). Les patients ayant une MPOC sévère avaient une survie cumulative significativement diminuée à 2 et à 5 ans en comparaison avec les deux autres groupes (104). Il est à noter que l’approche chirurgicale était via thoracotomie dans la majorité des cas (93%) dans cette étude (104).
Enfin, une complication particulière pouvant survenir dans la période post-opératoire mérite d’être soulignée, soit la fuite d’air prolongée. Un VEMS abaissé et le pourcentage d’emphysème à la tomodensitométrie sont des facteurs associés à la fuite d’air prolongée après une résection pulmonaire (105, 106). Évidemment, on retrouve fréquemment un VEMS abaissé chez les patients atteints de MPOC et bien que ce ne soit pas tous les patients MPOC qui souffrent également d’emphysème, on retrouve tout de même cette pathologie chez plusieurs d’entre eux.
À la lumière de cette littérature, l’évolution des patients ayant une MPOC sévère à la suite d’une résection pour cancer pulmonaire apparait bien définie, tandis qu’il persiste une incertitude par rapport à l’influence d’une MPOC légère à modérée sur celle-ci. Sachant que les patients ayant une MPOC légère ou modérée représentent la majorité des patients MPOC diagnostiqués et investigués pour un cancer pulmonaire (87), il apparait nécessaire que leur devenir en post-opératoire de chirurgie pour cancer pulmonaire soit bien caractérisé.
24 3.3.1 La chirurgie de réduction du volume pulmonaire
Une particularité de l’impact de la résection pulmonaire sur la physiologie pulmonaire des patients MPOC se doit d’être abordée. De façon paradoxale, on croit qu’une chirurgie combinée où on enlève à la fois une lésion et du parenchyme afonctionnel serait carrément bénéfique chez certains patients emphysémateux (107). On appelle ce genre d’intervention un ²lung volume reduction surgery², donc une chirurgie où on va diminuer le volume pulmonaire (107). De façon surprenante, après une résection pour cancer pulmonaire, il arrive même que certains patients se retrouvent avec un VEMS post-opératoire supérieur à celui en pré-opératoire (108). Dans une étude menée auprès de patients ayant subi une lobectomie pour cancer pulmonaire, Sekine et co-auteurs ont trouvé pour leur part que le ratio du VEMS obtenu en post-opératoire sur le VEMS post-opératoire prédit était significativement plus élevé chez les MPOC (qui avaient un VEMS pré-opératoire de 70% de la prédite ou moins) que chez les non-MPOC (109). Ce phénomène est donc un point de réflexion supplémentaire lorsqu’on considère une résection pulmonaire chez un patient ayant une fonction respiratoire altérée, puisque la perte de fonction pulmonaire après la chirurgie chez un MPOC ne sera parfois pas aussi importante que ce que l’on aurait calculé.
25
CHAPITRE 4 : Problématique, objectifs et hypothèses de
recherche
4.1 Problématique
Le cancer pulmonaire est la principale cause de mortalité par cancer au pays (2), ce qui en fait à la fois un problème d’actualité et un enjeu en termes de santé publique vu son association au tabagisme dans la majorité des cas (12). Le cancer pulmonaire et la MPOC coexistent fréquemment (21, 86, 87). Le meilleur traitement à visée curative pour le cancer pulmonaire de stade précoce est la chirurgie (36). Bien que l’évolution post-opératoire à la suite d’une résection pulmonaire des patients ayant une MPOC sévère soit mieux connue, l’influence de la MPOC légère à modérée sur le devenir post-opératoire de ces patients est incertaine. Considérant que les patients MPOC atteints de cancer pulmonaire ont majoritairement une MPOC légère ou modérée (87), il est primordial que leur devenir post-opératoire soit bien caractérisé.
4.2 Objectifs
Les objectifs de ce projet étaient les suivants :
a) Déterminer quelle est la proportion de patients souffrant d’une MPOC chez les patients opérés pour un cancer pulmonaire;
b) Déterminer si le taux de complications post-opératoires à la suite d’une chirurgie pour cancer pulmonaire est plus élevé chez les MPOC que chez les patients ayant une fonction respiratoire normale;
c) Évaluer si la sévérité de la MPOC influence la survenue de complications post-opératoires à la suite d’un telle chirurgie;
d) Vérifier si la survie à long-terme à la suite de la chirurgie est diminuée chez les MPOC en comparaison avec les patients ayant une fonction respiratoire normale.
26
4.3 Hypothèses
Nous pensions que les patients MPOC subiraient plus de complications dans la période post-opératoire, à la suite d’une résection de cancer pulmonaire, et que leur survie à long-terme serait inférieure en comparaison avec des patients ayant une fonction respiratoire normale. Nous pensions également que la survenue des complications post-opératoires augmenterait avec la sévérité de la MPOC.
27
CHAPITRE 5 : Article scientifique
Manuscrit : version finale soumise
Le texte des pages qui suivent consiste en la version finale du manuscrit soumis pour publication et publié le 29 mai 2020 dans le journal Chronic Respiratory Disease (SAGE
journals). Cet article a été rédigé en anglais. L’article en tant que tel sera précédé d’un résumé
en français qu’on ne retrouve pas dans l’article final, mais ajouté pour le lecteur, le reste du mémoire étant rédigé en français.
Titre de l’article:
Lung cancer resection and postoperative outcomes in COPD: A single-center experience.
Citation complète de l’article :
Roy E, Rheault J, Pigeon MA, Ugalde PA, Racine C, Simard S, Chouinard G, Lippens A, Lacasse Y and Maltais F. Lung cancer resection and postoperative outcomes in COPD: A single-center experience. Chron Respir Dis. 2020;17:1479973120925430.
Le lecteur peut aussi accéder à l’article en ligne via les sites web suivants : - Pubmed : https://pubmed.ncbi.nlm.nih.gov/32468842/
- SAGE journals: