HAL Id: hal-02809731
https://hal.inrae.fr/hal-02809731
Submitted on 6 Jun 2020HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
conditions environnementales
Jimmy Laurent
To cite this version:
Jimmy Laurent. Estimation du transfert de la bactérie phytopathogène Pseudomonas syringae en milieu poreux sous diverses conditions environnementales. [Stage] France. Université Montpellier 2 (Sciences et Techniques) (UM2), FRA. 2011, pp.28. �hal-02809731�
Université Montpellier II
J
J
i
i
m
m
m
m
y
y
L
L
a
a
u
u
r
r
e
e
n
n
t
t
Etudiant en M1 BGAE BIMP SM Rapport de stage FMOM202 2010/2011
E
E
s
s
t
t
i
i
m
m
a
a
t
t
i
i
o
o
n
n
d
d
u
u
t
t
r
r
a
a
n
n
s
s
f
f
e
e
r
r
t
t
d
d
e
e
l
l
a
a
b
b
a
a
c
c
t
t
é
é
r
r
i
i
e
e
p
p
h
h
y
y
t
t
o
o
p
p
a
a
t
t
h
h
o
o
g
g
è
è
n
n
e
e
P
P
s
s
e
e
u
u
d
d
o
o
m
m
o
o
n
n
a
a
s
s
s
s
y
y
r
r
i
i
n
n
g
g
a
a
e
e
e
e
n
n
m
m
i
i
l
l
i
i
e
e
u
u
p
p
o
o
r
r
e
e
u
u
x
x
s
s
o
o
u
u
s
s
d
d
i
i
v
v
e
e
r
r
s
s
e
e
s
s
c
c
o
o
n
n
d
d
i
i
t
t
i
i
o
o
n
n
s
s
e
e
n
n
v
v
i
i
r
r
o
o
n
n
n
n
e
e
m
m
e
e
n
n
t
t
a
a
l
l
e
e
s
s
.
.
Encadré par:Caroline L. Monteil (caroline.monteil@avignon.inra.fr) François Lafolie (lafolie@avignon.inra.fr) Cindy E. Morris (cindy.morris@avignon.inra.fr)
Unité de pathologie végétale Unité EMMAH
Domaine St Maurice Domaine St Paul – Site Agroparc
Sommaire
I. Introduction ... 3
II. Matériels et méthodes ... 7
1. Sites et prélèvements des colonnes de sol ... 7
2. Souches bactériennes, conditions de culture et suspensions ... 7
3. Caractérisation du potentiel zêta ... 9
4. Estimation du transport de P. syringae en milieu poreux ... 9
5. Estimation du transport de P. syringae à travers le sol ... 11
6. Isolement et quantification de P. syringae et des bactéries totales. ... 11
III. Résultats ... 13
1. Le taux de transfert de P. syringae en milieu poreux dépend de la souche et de la force ionique de la solution, mais n’est pas lié à son potentiel zêta. ... 13
2. Le taux de transfert des populations de P. syringae à travers les colonnes sol est de l’ordre de grandeur de ceux observés avec les colonnes de sable... 13
3. Le taux de transfert des populations de P. syringae du manteau neigeux dans un milieu poreux est supérieur à celle des bactéries totales. ... 15
4. Le sol est un réservoir potentiel de P. syringae dans lequel les populations peuvent survivre plusieurs mois... 15
IV. Discussion... 15
V. Conclusion... 21
I.
Introduction
Depuis plus d’un demi-siècle, le développement de moyens de lutte contre les agents phytopathogènes s’est toujours exclusivement focalisé sur leur biologie, leur écologie et leur génétique en relation avec leur hôte. Cependant, dans le cadre d’une agriculture durable, il apparaît nécessaire aujourd’hui d’étendre les paradigmes d’histoire de vie des pathogènes en dehors du contexte agricole (Morris et al., 2009). Récemment, Morris et al. (2008) ont mis en évidence l’ubiquité de l’agent phytopathogène P. syringae dans des substrats non agricoles et ont proposé un cadre d’histoire de vie environnemental, étroitement lié au cycle de l’eau. En plus des plantes cultivées (Hirano and Upper, 2000; Sarkar and Guttman, 2004), P. syringae a en effet été isolée dans l'eau de pluie et de nuage (Amato et al., 2007; Constantinidou et al., 1990; Sands et al., 1982), dans les rivières (Morris et al., 2010; Morris et al., 2008), les plantes sauvages (Mohr et al., 2008; Morris et al., 2008) ou encore le manteau neigeux saisonnier (Morris et al., 2008). L'ensemble de ces observations a soulevé de nouvelles questions sur la façon dont chaque compartiment du cycle de l'eau structure la population pathogène et comment le transfert d'un compartiment à l'autre peut affecter la dynamique des populations de P. syringae, et tout particulièrement dans les eaux de surface. Son ubiquité et la diversité de ses populations dans les eaux de source à travers le monde (Morris et al., 2010) suggèrent que P. syringae peut être transportée avec les eaux de pluie et de fonte des neiges à travers le sol, et que ce transfert pourrait impacter sur l’abondance et la structure des populations dans les eaux de surface. Des expériences préliminaires menées avec des lysimètres par le laboratoire allaient en ce sens.
L’occurrence et le transfert de nombreux organismes pathogènes à travers le sol ont été étudiés afin de caractériser le risque sanitaire qu’elles représentaient lors de pollutions des nappes phréatiques. Des observations en laboratoire et sur le terrain ont montrées que des micro-organismes pouvaient migrer à travers le sol sur plusieurs mètres de profondeur comme sur plusieurs kilomètres de distance (Abu-Ashour et al., 1994; Chen, 1988; Stevik et al., 2004). Parmi les micro-organismes étudiés dans le transport bactérien, on trouve différentes souches de l’espèce E. coli, ou différentes espèces du genre Pseudomonas (Pseudomonas aeruginosa et Pseudomonas fluorescens par exemple) (Kim et al.,
2009; Liu et al., 2007; Williams and Fletcher, 1996; Won et al., 2007).
Les microorganismes étant en suspension dans la solution aqueuse, ils peuvent donc être assimilés à des particules colloïdales et donc les mêmes principes régissant le transfert de colloïdes peuvent être appliqués à leur transport dans le sol. Le sol se caractérise par un ensemble de couches de matière organique et minérale, dont l’épaisseur, la structure physique et chimique varient en fonction de la géologie, de la topographie, du climat et de la couverture végétale. En tant que milieu poreux complexe, le sol est composé d’une phase solide correspondant aux particules minérales de différentes tailles, mais comprend aussi des zones renfermant de l’air ou de l’eau. Différents facteurs influencent le transport bactérien dans le sol et peuvent être de nature biologique ou physico-chimique. Parmi les facteurs biologiques modulant le transport bactérien, on peut citer les flagelles permettant aux cellules de se déplacer (Camper et al., 1993; Jacobs, 2007), ou la production d’exopolysaccharides augmentant la viscosité des bactéries (Rijnaarts et al., 1996; Rijnaarts et al., 1999). En revanche, les premières barrières limitant le transport bactérien en milieu poreux sont d’ordres physico-chimiques et comprennent la filtration et l’adhésion des bactéries aux particules du milieu. La filtration des micro-organismes est modulée par leur forme et leur taille, mais aussi par la porosité du milieu poreux, son niveau de saturation en eau et l’obstruction des pores (Stevik et al., 2004). L’adhésion quant à elle, est influencée par des interactions électrostatiques entre la bactérie et le milieu poreux, dépendant de la force ionique de l’eau, de son potentiel hydrogène (pH), de l’hydrophobicité des cellules ainsi que la vitesse de flux de la suspension dans le milieu (Jacobs, 2007). Les phénomènes d’attraction / répulsion entre la charge globale des cellules (potentiel zêta) et celle du milieu poreux constituent les premiers éléments qui déterminent l’adhésion des bactéries (Gannon et al., 1991; Redman et al., 2004). Afin de sélectionner des candidats pour l’étude du transport bactérien en milieux poreux homogène, nous avons donc caractérisé le potentiel zêta d’un ensemble de souches suivant leur position phylogénétique en émettant l’hypothèse que le transfert de P. syringae en milieux poreux dépendait du potentiel zêta de ses populations. Dans un second temps nous avons comparé les taux de transferts observés dans les colonnes de sable à ceux obtenus avec l’inoculation de colonnes de sol prélevées dans des prairies de trois sites des Alpes du Sud. Ce travail devrait mener à une meilleure compréhension sur le rôle du sol comme moteur de diversification et de sélection des populations de P. syringae des eaux provenant de
Figure 1. Mode opératoire pour le prélèvement des colonnes de sol. Un trou de 2 m² dans la neige
a d’abord été creusé, puis sur 30cm de profondeur dans le sol sous-jacent. Le tube en PVC était ensuite posé sur un affleurement, le bord biseauté contre le sol. Progressivement le sol a été retiré autour de la colonne, en même temps que le tube a été enfoncé. Une fois, la colonne prête, elle était refermée des deux extrémités de manière à éviter les échanges avec l’extérieur.
Tableau 1. Caractéristiques des souches de P. syringae.
Souche Groupe génomiquea HR sur tabac Activité glaçogène Agressivité
sur melon Isolation Source
CC0440 Groupe 2a + + + Melon (tige) Morris et al ., 2000
B728a Groupe 2b + + + Haricot Hirano et al. , 1997
CC94 Groupe 2b + + + Melon Morris et al ., 2000
SZ-030 SZ-030 - + - Eau, culture Morris et al ., 2000
Cit7 Cit7 + + + Orange (feuille) Lindow, 1985
1448a Groupe 3 + + + Haricot Sarkar and Guttman, 2004
UB-370 UB-370 + NA - Eau Morris et al ., 2010
USA-032 USA-032 + + - Eau Morris et al ., 2010
USA-102 USA-102 + + + Eau Morris et al ., 2010
TA022 TA003 + + + Eau Morris et al ., 2010
CC1513 Groupe 4 + NA - Hutchinsia alpina Morris et al ., 2008
DC3000 Groupe 1 + + - Tomate Cuppels, 1986
CC0663 TA002 - + - Primula Morris et al ., 2008
TA020 TA020 + - NA Eau Morris et al ., 2010
TA006 TA006 + - NA Eau Morris et al ., 2010
CC1524 CC1524 - - NA Eau, biofilms Morris et al ., 2008
UB-246 UB-246 - - NA Eau Morris et al ., 2010
a
la fonte des neiges ou des précipitations vers les eaux de surface.
II.
Matériels et méthodes
1. Sites et prélèvements des colonnes de sol
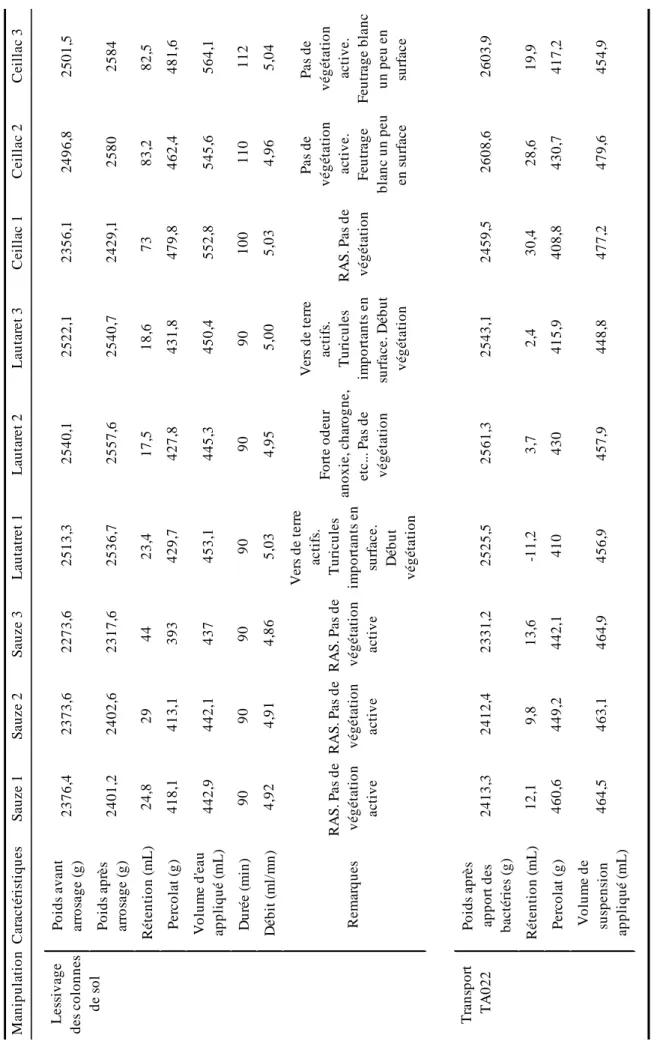
Des colonnes de sol ont été prélevées dans trois prairies alpines dans les Alpes du Sud : Super Sauze (2000 m, 44° 20’ 57’’ N, 06° 42’ 36’’ E), Col du Lautaret (2100 m, 45° 02’ 09" N, 06° 24’ 00" E) et Ceillac (2200 m, 44° 38’ 06’’ N, 06° 47’ 21’’ E). Les deux premiers sites ont été échantillonnés le 4 avril 2011 et le troisième le 8 avril 2011. Le sol était recouvert de neige entre 70 et 130 cm qui avait commencé à fondre. Au printemps, les prairies sont dominées par des graminées, herbacées et légumineuses. Trois colonnes de sol par site (L = 20 cm, ∅ = 10 cm) ont été prélevées grâce à des tubes de PVC (Figure 1). Les colonnes de sol ont été transportées dans une glacière et conservées 4 mois au réfrigérateur jusqu’au début des manipulations.
2. Souches bactériennes, conditions de culture et suspensions
Les souches de référence utilisées dans cette étude représentaient l’ensemble des groupes génomiques de l’espèce P. syringae définis par Morris et al. (2010). Leur nom, leur position taxonomique, leur isolation et leurs caractéristiques biologiques ont été données dans le Tableau 1. Toutes les suspensions bactériennes ont été réalisées à partir de cultures sur milieu King B (KB) (King et al., 1954) incubées 48h à température ambiante et issues de souches pures conservées dans le glycérol à -80°C. Chaque suspension a été préparée soit avec de l’eau distillée stérile, soit avec une solution de CaCl2 stérile. Deux concentrations de CaCl2 ont été testées : 0,06 g / L ou à 0,7 g / L, soit
l’équivalent d’une conductivité de 100 µS / cmet de 1000 µS / cm. Les concentrations bactériennes ont été ajustées avec un spectrophotomètre. La résistance à la Rifampicine, Rifamycine, Ampicilline, Tétracycline et Streptomycine a également été caractérisée sur certaines souches sélectionnées en étalant 500 µL d’une suspension à 108 colony forming unit (cfu) / mL sur milieu KBC enrichi de l’un des antibiotiques (de 50 à 200 mg / L). La composition des milieux a été donnée dans le tableau 2.
Figure 2. Dispositif expérimental pour l’estimation du transport de P. syringae à travers les colonnes de sable de Fontainebleau. La suspension bactérienne sous agitation et la solution de CaCl2
étaient injectées dans les colonnes de sable de Fontainebleau stérile grâce à une pompe péristaltique. Le percolat était récupéré dans un flacon stérile enveloppé de papier Kraft pour le protéger des rayons UV. L’ensemble des flacons était recouvert de parafilm et de papier aluminium de manière à éviter les échanges avec l’extérieur.
Tableau 2. Composition des milieux. Les quantités sont données pour 1 L de milieu. (Clesceri et al.,
1989; King et al., 1954; Martin and Foster, 1957; Mohan and Schaad, 1987; Shilo, 1957). Le cycle d’autoclave est de 121°C pendant 20 min.
K2HPO4 1,5 g Tryptone soja broth 3 g K2HPO4 1,5 g MgSO4 7H2O 1,5 g Agar 15 g MgSO4 7H2O 1,5 g Protéose peptone 15 g H2O qsp 1 L Protéose peptone 15 g
Agar 16 g Agar 15 g
Glycérol 12,6 g Cycloheximide 50 mg / L Glycérol 12,6 g
H2O qsp 900 mL H2O qsp 1 L H3BO3 1,5 g H2O 100 mL Cycloheximide 200 mg / L Céphalexine 80 mg / L Rifamycine 200 mg / L KB KBC Après autoclavage: Si antibiotique: TSA Après autoclavage: A part
1. Caractérisation du potentiel zêta
Le potentiel zêta représente la charge électrique d’une particule dans des conditions données. Elle se caractérise en mesurant une mobilité électrophorétique d’une solution en réponse à un champ électrique. Le potentiel zêta de chacune des souches pour chaque concentration en CaCl2 a été
déterminée pour des suspensions de 107 cfu / mL suivant la théorie de Smoluchowski (Elimelech et al., 2000). Chaque mesure a été effectuée avec un Zêtasizer Nano (Malvern Instruments ltd, Malvern, UK). Plusieurs mesures ont été effectuées par souche / condition, avec plusieurs cultures.
2. Estimation du transport de P. syringae en milieu poreux
Le transport de P. syringae en milieu poreux a été estimé en mesurant un taux de transfert d’une souche pure à travers des colonnes de Plexiglas (L = 15 cm, Ø 5 cm) (voir Figure 2) remplies d’un milieu homogène (sable de Fontainebleau, propriétés données dans le Tableau 3). Pour une souche, la mesure a été faite sur trois colonnes et répétée trois fois avec une culture différente. Chaque colonne a été préalablement stérilisée à l’alcool, remplie avec 480 g de sable nettoyé, autoclavé deux fois à 125°C pendant 45 minutes sous 1 bar de pression, puis séché à 105°C pendant 24 heures. Une suspension bactérienne à 107 cfu / mL a été injectée pendant 30 minutes à 0,6 ml / min après avoir préalablement rincé et saturé la colonne avec une solution de CaCl2 stérile à 0,06 g / L ou 0,7 g / L.
Cette même solution a ensuite été injectée pendant 13h30 suivant le même flux que pour la suspension. Les percolats ont été récoltés dans des flacons stériles à l’abri de toute entrée d’air. La taille des populations de P. syringae a été déterminée dans l’inoculum avant injection, dans l’inoculum après injection, dans la solution stérile contenant le sable stérile et les percolats. L’absence de contamination par le matériel utilisé a également été vérifiée.
Le transport de P. syringae et des bactéries totales cultivables associées au manteau neigeux a également été estimé à travers ce même dispositif. Un échantillon de neige (5 kg des 10 premiers cm en contact avec le sol) a été prélevé à Ceillac (site décrit auparavant) le 8 avril 2011 avec des sacs et des outils stériles. Il a été fondu à température ambiante durant la nuit et conservé à 4 °C jusqu’à traitement. Les colonnes ont été préparées et saturées avec l’eau de fonte de la neige. La percolation a été réalisée suivant les mêmes conditions que décrites précédemment et la taille des populations des
Figure 3. Dispositif expérimental pour l’estimation de la survie et du transport de P. syringae à travers les colonnes de sol prélevées dans les Alpes du Sud. De l’eau distillée ou une suspension
bactérienne étaient pompées et pulvérisées goutte à goutte sur la surface des colonnes de sol. Les colonnes étaient posées sur une plaque perforée stérile permettant de maintenir le sol dans la colonne tout en laissant passer les liquides. Le percolat était dirigé dans un flacon par un entonnoir stérile. L’espace entre le goulot et les bords de l’entonnoir était recouvert de papier aluminium.
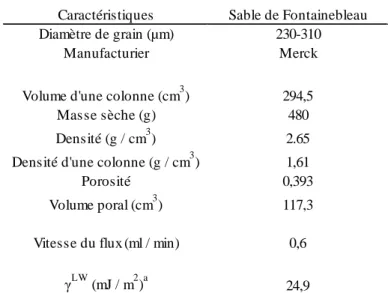
Tableau 3. Caractéristiques des colonnes de sable de Fontainebleau (Jacobs, 2007)
Caractéristiques Sable de Fontainebleau
Diamètre de grain (µm) 230-310
Manufacturier Merck
Volume d'une colonne (cm3) 294,5
Masse sèche (g) 480
Densité (g / cm3) 2.65
Densité d'une colonne (g / cm3) 1,61
Porosité 0,393
Volume poral (cm3) 117,3
Vitesse du flux (ml / min) 0,6
γLW (mJ / m2)a 24,9
a
Composante de Lifshitz-van der Walls de l’énergie de surface des grains de sable
bactéries totales cultivables et de P. syringae a été déterminée dans les mêmes sous échantillons.
3. Estimation du transport de P. syringae à travers le sol
Le transport de P. syringae à travers le sol a été déterminé en simulant une pluie d’eau distillée contenant 108 cfu / L d’une souche marquée, naturellement résistante à un antibiotique, sur les colonnes de sol prélevées en montagne. La pluie a été simulé pendant 1h30 à raison d’une intensité de 20 mm / h (Figure 3 pour le dispositif). La taille des populations a ensuite été comparée à celle de l’inoculum et corrigée par le taux de recouvrement pour déterminer un taux de transfert.
Avant l’inoculation, la taille des populations autochtones de P. syringae dans l’eau du sol a été évaluée en simulant une pluie d’eau distillée dans les mêmes conditions, et en saturant la colonne en eau. Une fois les écoulements terminés, les percolats ont été immédiatement traités pour déterminer la taille des populations bactériennes ainsi que de l’eau distillée stérile ayant été transportée dans le simulateur de pluie pour le témoin négatif.
4. Isolement et quantification de P. syringae et des bactéries totales.
Le traitement des échantillons dépendait de leur nature. La taille des populations bactériennes dans la neige et les percolas obtenus à partir des colonnes de sol a été déterminée par la méthode de concentration, dilution et étalements sur des milieux sélectifs, de sorte à obtenir un seuil de détection de 55 cfu / L pour les bactéries totales et 5 cfu / L pour P. syringae. Les bactéries totales cultivables ont été comptées sur milieu TSA, la taille des populations de P. syringae a été déterminée sur milieu KBC (milieu B de King avec cycloheximide et céphalexine) (King et al., 1954) et celle de la population des souches naturellement résistantes aux antibiotiques sur KBC + antibiotique. La composition des milieux est donnée dans le Tableau 2. La taille des inocula des souches pures ainsi que celles des percolats des colonnes de sable, a été déterminée par dilution et étalements sur milieu KB (King et al., 1954) suivant un seuil de détection de 103 cfu / L. Pour chaque milieu, les étalements ont été incubés à température ambiante et un comptage des colonies a été effectué entre 48 et 96 heures après traitement.
Pour chaque échantillon, la production d’un pigment fluorescent sur KB ou KBC a été vérifiée ainsi que l’absence de l’enzyme cytochrome c oxydase sur un minimum de 30 colonies comme décrit
-40 -35 -30 -25 -20 -15 -10 -5 0 U S A -3 2 B 7 2 8 a C C 0 4 4 0 C it 7 C C 6 6 3 U S A -1 0 2 C C 9 4 U B -3 7 0 T A -2 2 1 4 4 8 a C C 1 5 1 3 U B -2 4 6 D C 3 0 0 0 S Z -0 3 0 T A -6 T A -2 0 C C 1 5 2 4 p o te n ti e l z ê ta ( m V ) A -40 -35 -30 -25 -20 -15 -10 -5 0 B B728a CC0663 UB246
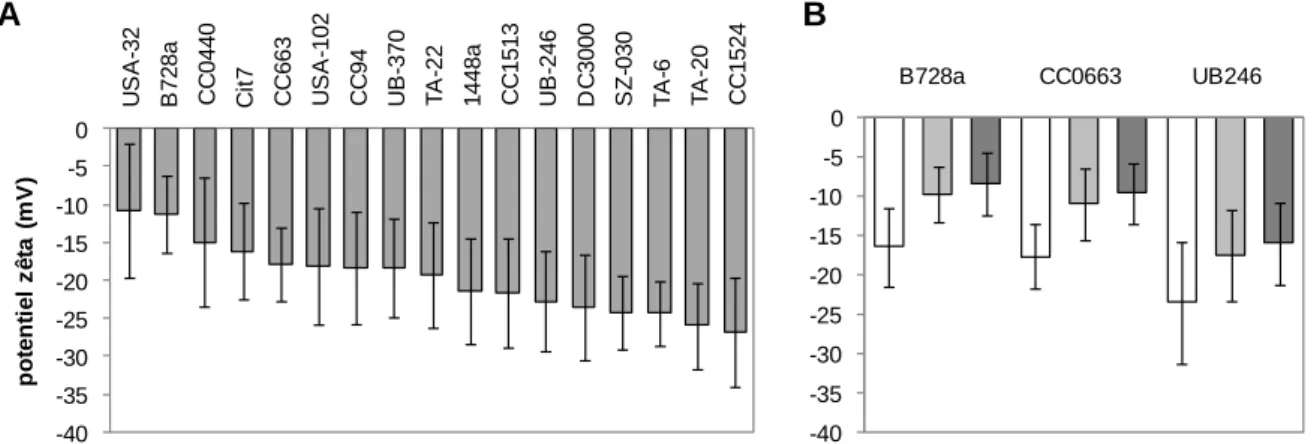
Figure 4. Variabilité du potentiel zêta membranaire de P. syringae. Les barres d’erreurs
correspondent aux écarts types calculés par l’appareil de mesure. (A) Potentiel zêta des 17 souches de référence dans une solution de conductivité de 100µS / cm. (B) Potentiel zêta de trois souches de référence en fonction de la conductivité électrique de la solution 100 µS / cm (blanc), 600 µS / cm² (gris clair) 1200 µS / cm (gris foncé).
0 20 40 60 80 100 120 140 C C 9 4 S Z 3 0 U B 2 4 6 B 7 2 8 a U S A 1 0 2 D C 3 0 0 0 D C 3 0 0 0 * T A 0 2 2 T A 0 2 2 * T a u x d e t ra n s fe rt % B Ab a c Cc A A ABC B
Figure 5. Transport de P. syringae à travers les colonnes de sable de Fontainebleau. Les taux de
transfert correspondent aux ratios du nombre de bactéries injecté dans la colonne et celui dans les percolats, multipliés par le taux de multiplication. Pour chaque concentration de CaCl2 (0,06 g / L pour
les barres en gris clair et 0,7 g / L pour celles en gris foncé dont les noms sont annotés d’une *), les moyennes associées avec la même lettre ne sont pas significativement différentes (test de Student, p < 0,05). Les barres d’erreurs correspondent aux erreurs standards.
par Morris et al. (2008), afin de confirmer l’identité de P. syringae.
III.
Résultats
1. Le taux de transfert de P. syringae en milieu poreux dépend de la souche et de la force ionique de la solution, mais n’est pas lié à son potentiel zêta.
Le transfert de P. syringae en milieux poreux a été estimé sur 7 souches dont le choix s’est porté de manière à représenter l’ensemble des 17 potentiels zêta caractérisés dans une solution à 100 µS / cm. Ces derniers ont montré une variabilité intra-spécifique des moyennes de 12 mV avec un minimum de -27 mV et un maximum de -11 mV (voir figure 4A). Cette valeur ne dépendait pas de la position dans l’arbre phylogénétique défini par Morris et al. (2010). Plus la force ionique de la solution augmentait, et plus le potentiel zêta des souches diminuait (Figure 4B). En outre, les mesures ont mis en évidence une plus grande variabilité au sein de chaque souche qu’entre souches. Les extrêmes pouvaient être distants jusqu’à 40mV pour certaines souches ce qui témoignait d’une grande hétérogénéité des propriétés de charge au sein de chaque population.
Les 7 souches choisies (CC94, SZ-30, UB-246, B728a, USA102, DC3000 et TA022) avaient des taux de transfert significativement différents pour certaines et d’autres non (test de Student, p < 0,05) (Figure 5). Seul 5 % de la population de DC3000 traversait les colonnes de sable alors que pour B728a, USA102 et TA022, ce taux montait à 40%. Ces taux n’étaient pas corrélés de manière significative à leur potentiel zêta moyen (Pearson, p > 0,05). Pour les deux souches (DC3000 et TA022) testées avec une solution de conductivité 10 fois supérieure, le taux de transfert augmentait d’un facteur de 2 alors que potentiel zêta diminuait quand la conductivité augmentait.
2. Le taux de transfert des populations de P. syringae à travers les colonnes sol est de l’ordre de grandeur de ceux observés avec les colonnes de sable.
La résistance à 3 concentrations (50, 100 et 200 mg / L) de 5 antibiotiques cités précédemment a été caractérisée parmi les souches CC94, B728a, DC3000 et TA022 et a permis de trouver un seul candidat pour le suivi du transfert de P. syringae à travers les colonnes de sol préalablement lessivées : la souche TA022, résistante à 200 mg / L de Rifampycine. L’absence de cette résistance dans les communautés du sol a été vérifiée avec tous les percolats. La souche TA022 a systématiquement été détectée dans les percolats après inoculation de la colonne, et la taille de ses populations représentait
0 20 40 60 80 100
Sauze Lautaret Ceillac
T a u x d e t ra n s fe rt %
Figure 6. Taux de transfert de la souche TA022 naturellement résistante à la rifampicine à travers les colonnes de sol prélevées dans les trois sites des Alpes du Sud. Le taux de transfert
correspond au ratio de la concentration de la souche dans le percolat et celle de la concentration injectée dans la colonne, multiplié par le taux de recouvrement. Il n’y avait pas de différence significative entre les moyennes des sites (Kruskall-Wallis, p < 0,05). Les barres d’erreurs correspondent aux erreurs standards.
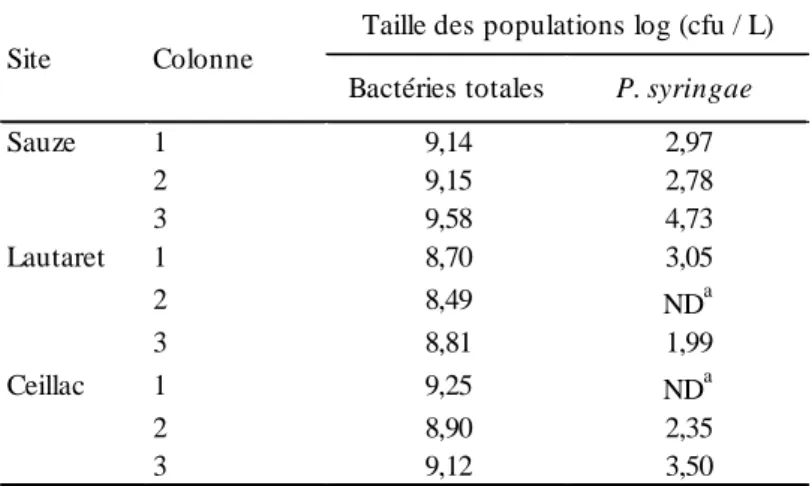
Tableau 5. Taille des populations extraites des colonnes de sol des Alpes du Sud.
Bactéries totales P. syringae
Sauze 1 9,14 2,97 2 9,15 2,78 3 9,58 4,73 Lautaret 1 8,70 3,05 2 8,49 NDa 3 8,81 1,99 Ceillac 1 9,25 NDa 2 8,90 2,35 3 9,12 3,50 Colonne
Taille des populations log (cfu / L) Site
a
Lorsque la taille des populations était en dessous du seuil de détection
entre 9 et 14 % de la taille de l’inoculum (Figure 6). De la même manière que pour les lessivages, il n’y avait pas d’effet du site sur la taille des populations ni pour des bactéries totales cultivables (≈ 109 cfu / L), ni pour P. syringae souche TA022 (Kruskall-Wallis, p < 0,05).
3. Le taux de transfert des populations de P. syringae du manteau neigeux dans un milieu poreux est supérieur à celle des bactéries totales.
Les transferts des populations de P. syringae et des bactéries totales cultivables d’un échantillon de neige ont été estimés avec les colonnes de sable. La taille des populations dans l’inoculum étaient respectivement de l’ordre de 5,90.104 cfu / L et 3,20.107 cfu / L. Les populations de P. syringae présentaient un taux de transfert 8,6 fois plus élevé que celui des bactéries totales (78,7 % ± 15,5 contre 9,1% ± 1,4, test de Mann-Witney U, p < 0,1).
4. Le sol est un réservoir potentiel de P. syringae dans lequel les populations peuvent survivre plusieurs mois.
Les colonnes prélevées dans les Alpes du Sud avaient un poids et une humidité comparables sauf celles de Ceillac qui étaient plus sèches (voir tableau 4). Elles étaient restées intactes après 4 mois de conservation au réfrigérateur sauf celles du Col du Lautaret dans lesquelles ont été observés un nombre de tericules important et dont la n°2 présentait une forte odeur d’anoxie. Les percolats récupérés après la simulation de pluie étaient de volume homogène, caractérisés par une flore totale cultivable d’environ 109 cfu / L dans lesquels P. syringae a été détectée dans 7 d’entre eux. Il n’y avait pas d’effet du site sur la taille des populations des bactéries totales cultivables et de P. syringae arrachées des colonnes (Kruskall-Wallis, p < 0,05, voir tableau 5 pour les données). P. syringae n’a pas été détectée dans le percolat n°2 du Col de Lautaret qui témoignait d’une anoxie.
IV.
Discussion
Les connaissances sur l’écologie des bactéries phytopathogènes dans les habitats non agricoles et leur rôle dans l’épidémiologie des maladies qu’elles provoquent sont limitées aux études menées sur P. syringae par le laboratoire. Récemment, les travaux de Morris et al. (2010) ont montré que l’espèce était systématiquement présente dans les eaux de source à travers le monde suggérant son transport via
C e il la c 3 2 5 0 1 ,5 2 5 8 4 8 2 ,5 4 8 1 ,6 5 6 4 ,1 1 1 2 5 ,0 4 P a s d e v é g é ta ti o n a c ti v e . F e u tr a g e b la n c u n p e u e n su rf a c e 2 6 0 3 ,9 1 9 ,9 4 1 7 ,2 4 5 4 ,9 C e il la c 2 2 4 9 6 ,8 2 5 8 0 8 3 ,2 4 6 2 ,4 5 4 5 ,6 1 1 0 4 ,9 6 P a s d e v é g é ta ti o n a c ti v e . F e u tr a g e b la n c u n p e u e n s u rf a c e 2 6 0 8 ,6 2 8 ,6 4 3 0 ,7 4 7 9 ,6 C e il la c 1 2 3 5 6 ,1 2 4 2 9 ,1 7 3 4 7 9 ,8 5 5 2 ,8 1 0 0 5 ,0 3 R A S . P a s d e v é g é ta ti o n 2 4 5 9 ,5 3 0 ,4 4 0 8 ,8 4 7 7 ,2 L a u ta re t 3 2 5 2 2 ,1 2 5 4 0 ,7 1 8 ,6 4 3 1 ,8 4 5 0 ,4 9 0 5 ,0 0 V e rs d e t e rr e a c ti fs . T u ri c u le s im p o rt a n ts e n su rf a c e . D é b u t v é g é ta ti o n 2 5 4 3 ,1 2 ,4 4 1 5 ,9 4 4 8 ,8 L a u ta re t 2 2 5 4 0 ,1 2 5 5 7 ,6 1 7 ,5 4 2 7 ,8 4 4 5 ,3 9 0 4 ,9 5 F o rt e o d e u r a n o x ie , c h a ro g n e , e tc .. . P a s d e v é g é ta ti o n 2 5 6 1 ,3 3 ,7 4 3 0 4 5 7 ,9 L a u ta tr e t 1 2 5 1 3 ,3 2 5 3 6 ,7 2 3 ,4 4 2 9 ,7 4 5 3 ,1 9 0 5 ,0 3 V e rs d e t e rr e a c ti fs . T u ri c u le s im p o rt a n ts e n su rf a c e . D é b u t v é g é ta ti o n 2 5 2 5 ,5 -1 1 ,2 4 1 0 4 5 6 ,9 S a u z e 3 2 2 7 3 ,6 2 3 1 7 ,6 4 4 3 9 3 4 3 7 9 0 4 ,8 6 R A S . P a s d e v é g é ta ti o n a c ti v e 2 3 3 1 ,2 1 3 ,6 4 4 2 ,1 4 6 4 ,9 S a u z e 2 2 3 7 3 ,6 2 4 0 2 ,6 2 9 4 1 3 ,1 4 4 2 ,1 9 0 4 ,9 1 R A S . P a s d e v é g é ta ti o n a c ti v e 2 4 1 2 ,4 9 ,8 4 4 9 ,2 4 6 3 ,1 S a u z e 1 2 3 7 6 ,4 2 4 0 1 ,2 2 4 ,8 4 1 8 ,1 4 4 2 ,9 9 0 4 ,9 2 R A S . P a s d e v é g é ta ti o n a c ti v e 2 4 1 3 ,3 1 2 ,1 4 6 0 ,6 4 6 4 ,5 C a ra c té ri st iq u e s P o id s a v a n t a rr o sa g e ( g ) P o id s a p rè s a rr o sa g e ( g ) R é te n ti o n ( m L ) P e rc o la t (g ) V o lu m e d 'e a u a p p li q u é ( m L ) D u ré e ( m in ) D é b it ( m l/ m n ) R e m a rq u e s P o id s a p rè s a p p o rt d e s b a c té ri e s (g ) R é te n ti o n ( m L ) P e rc o la t (g ) V o lu m e d e su sp e n si o n a p p li q u é ( m L ) M a n ip u la ti o n L e ss iv a g e d e s c o lo n n e s d e s o l T ra n sp o rt T A 0 2 2 T a b le a u 4 . C a r a c té r is ti q u e s d e s c o lo n n e s d e s o l p r é le v é e s d a n s le s A lp e s d u S u d .
l’eau à travers le sol. Des expériences préliminaires menées au laboratoire ayant confirmé son passage effectif à travers le sol, nous avons mis au point un modèle simple en conditions abiotiques pour quantifier le taux de transfert de P. syringae à travers des colonnes d’un milieu poreux homogène. Puis nous avons validé ces observations avec des colonnes de sol collectées dans plusieurs prairies des Alpes du Sud, ces dernières représentant un milieu abiotique et biotique complexe auquel les bactéries sont réellement confrontées lors de leur dissémination avec le cycle de l’eau.
Nous avons montré que P. syringae pouvait être transportée à travers des colonnes de sable avec des taux de transfert significativement différents entre plusieurs souches. Deux souches de la même espèce bactérienne peuvent donc avoir des capacités de rétention différentes en milieu poreux, ce qui n’avait jamais été montré auparavant. Cependant, le taux de transfert des souches n’était pas corrélé avec leur potentiel zêta, et augmentait avec la force ionique de la solution. L’ensemble de ces observations était donc à l’opposé de ce que nous attendions. En effet, le taux de transfert d’un colloïde devrait diminuer plus le potentiel zêta tend vers 0 mV (Elimelech et al., 2000). Ensuite suivant la théorie DLVO, une augmentation de la force ionique de la solution, tant pour des électrolytes monovalents que divalents, devrait favoriser la rétention des bactéries dans le milieu poreux (Kim et al., 2009; Redman et al., 2004; Rijnaarts et al., 1999). Mais notre choix s’était porté sur des solutions de CaCl2 de 100 à 1000 µS / cm afin que nos représentations soient le plus proche
possible des caractéristiques de l’eau de source des Alpes du Sud. Or les forces ioniques utilisées dans la littérature sont au minimum dix à mille fois supérieures à la plus forte que nous ayons utilisé, et ne sont pas toujours de la même composition chimique, ce qui rend les comparaisons difficiles (Kim et al., 2009; Won et al., 2007). Cependant, d’autres propriétés de P. syringae que nous n’avons pas caractérisé, auraient pu expliquer ces observations, comme l’hydrophobicité des souches ou la production de structures extracellulaires telles que les exopolysaccharides (EPS) ou les lipopolysaccharides (LPS). En effet il a été montré que ces structures sont responsables d’interactions stériques entre la surface des micro-organismes et celles des particules de la phase solide à travers laquelle les bactéries sont transportées (Jacobs, 2007; Liu et al., 2007; Rijnaarts et al., 1999; Williams and Fletcher, 1996).
Ces résultats ne nous assuraient pas qu’il se passerait la même chose dans la réalité, mais les taux de transfert obtenus avec la pulvérisation de la souche de P. syringae TA022 et les colonnes de sol prélevées en montagne sont la preuve formelle et quantitative du passage de l’espèce à travers le sol, ce qui est un résultat majeur pour l’équipe de recherche. Même si il existe parfois des différences d’un facteur de 4, les taux de transfert de cette souche en colonne de sol sont du même ordre de grandeur que ceux en colonnes de sable. Aucune différence significative entre sites n’a été constatée, bien que les colonnes provenant du Col de Lautaret aient tendance à moins retenir de bactéries. Ces colonnes étaient caractérisées par la présence de tericules en surface, témoin de la présence de vers de terres actifs dans les colonnes. Leur activité de fouissage entraine la formation de « tunnels » qui peuvent former des flux préférentiels pour le transport de l’eau et donc diminuer la filtration des populations dans les colonnes (McClaine and Ford, 2002). En outre, le taux de transfert était particulièrement important pour l’une des colonnes de ce site (25 %). Elle était caractérisée par une forte odeur d’anoxie et une taille des communautés bactériennes moins importante dans les percolats de lessivage, ce qui aurait pu améliorer le taux de transfert de la souche TA022. Cependant, d’autres propriétés liées à la texture du sol, sa composition ou sa porosité peuvent affecter le mouvement bactérien (Abu-Ashour et al., 1994). Leur caractérisation future pourrait améliorer la compréhension du transfert de P. syringae à travers le sol.
En outre, nous avons montré que les populations de P. syringae de la neige, étaient mieux transportées que les bactéries totales cultivables. En effet, ces dernières étaient environ huit fois plus retenues dans les colonnes de sable, ce qui peut s’expliquer de plusieurs manières. Tout d’abord, il est possible que les propriétés physiques (potentiel zêta, hydrophobicité) et biologiques (mobilité, production d’EPS et LPS) de P. syringae permettent un meilleur transfert en milieu poreux. D’autre part, il a récemment été montré que la combinaison de plusieurs espèces bactériennes influençait leur taux de transfert et pouvait soit le favoriser, soit le réduire (Stumpp et al., 2011). On peut donc supposer que les interactions de P. syringae avec la microflore totale peuvent avoir un effet sur son taux de transfert en empêchant son adsorption aux grains du milieu.
A travers l’ensemble de ces expériences, nous avons donc pu mieux caractériser le transfert de P. syringae en milieu poreux. Mais elles nous ont aussi permis de mettre en évidence la survie de P.
syringae dans le sol durant plusieurs mois à basse température. En effet, P. syringae été détectée dans les eaux de lessivage des colonnes de sol dans des concentrations comprises entre 102 et 105 cfu / L ce qui correspond aux tailles des populations trouvées dans les eaux de source par Morris et al. (2010). En revanche, nous n’avons pas caractérisé le phénotype et le génotype de ces souches, ce qu’il pourrait être intéressant de faire afin de voir si le sol sélectionnait certains types de souches. Si oui, nous pourrions alors voir si elles correspondaient à celles ayant les taux de transfert les plus importants, observés avec les colonnes de sable. Cependant, il est impossible de savoir de quelle zone du sol de la colonne, les populations quantifiées dans les percolats provenaient réellement. En effet, il est possible qu’elles correspondaient à celles abritées par la litière (couche superficielle du sol constituée de débris végétaux), récemment identifié comme réservoir important de P. syringae (données non publiées). Dans l’écosystème alpin, la litière pourrait alors servir de source constante d’inoculum pour l’eau du sol, puis celle des réseaux hydrologiques.
V.
Conclusion
Ce travail a contribué à une meilleure compréhension des voies de dissémination de P. syringae à travers le sol et d’une manière générale, à travers le cycle de l’eau. Grâce à ce travail préliminaire qui devrait faire l’objet d’une publication d’un article, nous avons :
• montré qu’il n’y avait pas de lien entre les propriétés de charge de surface avec son taux de transfert en milieu poreux et que l’augmentation de la force ionique de diminuait pas le taux de transfert.
• observé des taux de transfert différents suivant la souche de l’espèce.
• confirmé que P. syringae pouvait traverser un profil de sol et que ces taux de transferts étaient de même ordre de grandeur que ceux obtenus en conditions abiotiques.
• mis en évidence la survie de P. syringae dans le sol pendant plusieurs mois et retrouvé les mêmes tailles de populations dans les lessivages et dans les eaux de sources
• pu acquérir la maitrise des dispositifs expérimentaux nécessaires à nos observations, tant au niveau de la mise en place des dispositifs, que des protocoles de stérilisations particuliers que nous avons du appliquer.
VI.
Références
Abu-Ashour J, Joy DM, Lee H, Whiteley HR, Zelin S (1994). Transport of microorganisms through soil. Water Air & Soil Poll 75: 141-158.
Amato P, Parazols M, Sancelme M, Laj P, Mailhot G, Delort AM (2007). Microorganisms isolated from the water phase of tropospheric clouds at the Puy de Dome: major groups and growth abilities at low temperatures. FEMS Microbiol Ecol 59: 242-254.
Camper AK, Hayes JT, Sturman PJ, Jones WL, Cunningham AB (1993). Effects of motility and adsorption rate coefficient on transport of bacteria through saturated porous media. Appl Env Microbiol 59: 3455-3462.
Chen M (1988). Pollution of ground water by nutrients and fecal coliforms from lakeshore septic tank systems. Water Air & Soil Poll 37: 407-417.
Clesceri LS, Franson MAH, Greenberg AE, Trussell RR (1989). Standard methods for the examination of water and wastewater. American Public Health Association.
Constantinidou H, Hirano SS, Baker LS, Upper CD (1990). Atmospheric dispersal of ice nucleation-active bacteria: the role of rain. Phytopathology 80: 934-937.
Elimelech M, Nagai M, Ko CH, Ryan JN (2000). Relative insignificance of mineral grain zeta potential to colloid transport in geochemically heterogeneous porous media. Environ Sci Tech 34: 2143-2148.
Gannon JT, Manilal VB, Alexander M (1991). Relationship between cell surface properties and transport of bacteria through soil. Appl Env Microbiol 57: 190-193.
Hirano SS, Upper CD (2000). Bacteria in the leaf ecosystem with emphasis on Pseudomonas syringae - a pathogen, ice nucleus, and epiphyte. Microbiol Mol Biol Rev 64: 624-653.
Jacobs A (2007). Transport bactérien en milieux poreux : Expérimentations et Modélisation, Migration de bactéries issues de boues de STEP. Thèse.
Kim HN, Bradford SA, Walker SL (2009). Escherichia coli O157: H7 transport in saturated porous media: role of solution chemistry and surface macromolecules. Environ Sci Tech 43: 4340-4347. King EO, Ward MK, Raney DE (1954). Two simple media for the demonstration of pyocyanin and fluorescin. J Lab Clin Med 44: 301-7.
Liu Y, Yang CH, Li J (2007). Influence of extracellular polymeric substances on Pseudomonas aeruginosa transport and deposition profiles in porous media. Environ Sci Tech 41: 198-205.
Martin WR, Foster JW (1957). Adaptation patterns in the utilization of the stereoisomers of tartaric acid by a pseudomonad. J Bacteriol 73: 683.
McClaine JW, Ford RM (2002). Characterizing the adhesion of motile and nonmotile Escherichia coli to a glass surface using a parallel plate flow chamber. Biotech Bioeng 78: 179-189.
Mohan SK, Schaad NW (1987). An improved agar plating assay for detecting Pseudomonas syringae pv. syringae and P. syringae pv. phaseolicola in contaminated bean seed. Phytopathology 77: 1390-1395.
Mohr TJ, Liu H, Yan S, Morris CE, Castillo JA, Jelenska J et al (2008). Naturally occurring nonpathogenic isolates of the plant pathogen Pseudomonas syringae lack a type III secretion system and effector gene orthologues. J Bacteriol 190: 2858-2870.
Morris CE, Bardin M, Kinkel LL, Moury B, Nicot PC, Sands DC (2009). Expanding the paradigms of plant pathogen life history and evolution of parasitic fitness beyond agricultural boundaries. PLoS Pathog 5: e1000693.
Morris CE, Sands DC, Vanneste JL, Montarry J, Oakley B, Guilbaud C et al (2010). Inferring the evolutionary history of the plant pathogen Pseudomonas syringae from its biogeography in headwaters of rivers in North America, Europe, and New Zealand. mBio 1: 1 - 10.
Morris CE, Sands DC, Vinatzer BA, Glaux C, Guilbaud C, Buffiere A et al (2008). The life history of the plant pathogen Pseudomonas syringae is linked to the water cycle. ISME Journal 2: 321-334. Redman JA, Walker SL, Elimelech M (2004). Bacterial adhesion and transport in porous media: Role of the secondary energy minimum. Environ Sci Tech 38: 1777-1785.
Rijnaarts HHM, Norde W, Bouwer EJ, Lyklema J, Zehnder AJB (1996). Bacterial deposition in porous media related to the clean bed collision efficiency and to substratum blocking by attached cells. Environ Sci Tech 30: 2869-2876.
Rijnaarts HHM, Norde W, Lyklema J, Zehnder AJB (1999). DLVO and steric contributions to bacterial deposition in media of different ionic strengths. Colloid Surface B 14: 179-195.
Sands DC, Langhans VE, Scharen AL, de Smet G (1982). The association between bacteria and rain and possible resultant meteorological implications. J Hungarian Meteorol Serv 86: 148-152.
Sarkar SF, Guttman DS (2004). Evolution of the core genome of Pseudomonas syringae, a highly clonal, endemic plant pathogen. Appl Env Microbiol 70: 1999-2012.
Shilo M (1957). The enzymic conversion of the tartaric acids to oxaloacetic acid. J Gen Microbiol 16: 472.
Stevik TK, Aa K, Ausland G, Hanssen JF (2004). Retention and removal of pathogenic bacteria in wastewater percolating through porous media: a review. Water Res 38: 1355-1367.
Stumpp C, Lawrence JR, Hendry MJ, Maloszewski P (2011). Transport and bacterial interactions of three bacterial strains in saturated column experiments. Environ Sci Tech.
Williams V, Fletcher M (1996). Pseudomonas fluorescens adhesion and transport through porous media are affected by lipopolysaccharide composition. Appl Env Microbiol 62: 100.
Won J, Kim JW, Kang S, Choi H (2007). Transport and adhesion of Escherichia coli JM109 in soil aquifer treatment (SAT): one-dimensional column study. Environ Monit Asses 129: 9-18.