Protection des protéines recombinantes sécrétées chez
l’hôte d’expression Nicotiana benthamiana par expression
hétérologue du canal ionique M2 du virus de l’Influenza
Thèse
Philippe Varennes-Jutras
Doctorat en biologie végétale
Philosophiæ doctor (Ph. D)
Québec, Canada
Protection des protéines recombinantes sécrétées chez
l’hôte d’expression Nicotiana benthamiana par expression
hétérologue du canal ionique M2 du virus de l’Influenza
Thèse
Philippe Varennes-Jutras
Sous la direction de :
Dominique Michaud, directeur de recherche
Frank Sainsbury, codirecteur de recherche
Marc-André D’Aoust, codirecteur de recherche
Résumé
Les systèmes d’expression végétaux sont utilisés couramment pour la production hétérologue de protéines recombinantes complexes. Des contraintes biochimiques dans le système de sécrétion cellulaire, comme l’abondance de protéases peu spécifiques ou des variations de pH d’un organite à l’autre, compromettent toutefois l’expression de plusieurs protéines d’intérêt. Des approches ont été développées pour améliorer l’environnement intracellulaire dans la plante hôte de manière à accroître la qualité et le rendement des protéines sécrétées. Dans ce projet, nous avons évalué l’impact de l’homéostasie du pH dans le système de sécrétion cellulaire des feuilles du Nicotiana benthamiana sur l’expression et la stabilité des protéines recombinantes. Nous démontrons le potentiel du canal ionique M2 du virus de l’Influenza comme nouvel outil pour augmenter le pH des compartiments acides du système de sécrétion cellulaire, une approche éventuellement utile pour la stabilisation des protéines sensibles aux milieux acides. En lien avec l’influence bien documentée du pH sur l’activité des protéases cellulaires, nous montrons ensuite qu’une modification du pH induite par l’expression du canal M2 influence les profils de dégradation de protéines de fusion sensibles à la protéolyse, des observations qui confirment l’impact du pH sur l’activité protéolytique des cellules végétales et qui suggèrent le potentiel du canal ionique M2 comme protéine accessoire pour augmenter la stabilité et le rendement des protéines recombinantes in planta. Finalement, nous abordons l’impact du canal ionique M2 sur l’expression des protéines endogènes à l’échelle de la cellule. Nous démontrons qu’une altération du pH dans le système de sécrétion en réponse à l’expression du canal ionique a des effets étendus sur le protéome foliaire, affectant la teneur de protéines retrouvées dans plusieurs compartiments cellulaires incluant les chloroplastes, le cytosol et la vacuole. Nous rapportons aussi l’établissement d’un ‘protéome hybride’ dans les plantes exprimant M2, composé de protéines caractéristiques aussi bien de plantes témoins non infectées que de plantes agroinfectées exprimant activement des protéines de défense. En résumé, nos données mettent en évidence le rôle de l’homéostasie du pH sur le protéome des cellules végétales et l’impact significatif du gradient de pH dans le système de sécrétion cellulaire sur la stabilité et le rendement des protéines recombinantes sensibles à l’acidité ou à la protéolyse.
Abstract
Plant expression systems are commonly used for the heterologous production of complex recombinant proteins. However, biochemical conditions in the plant cell secretory pathway, such as the presence of poorly-specific proteases or pH variations from one organelle to another, impair the expression of several potentially useful proteins. Approaches have been developed to improve the cellular environment of the host plant in such a way as to increase the quality and yield of secreted recombinant proteins. In this project, we assessed the impact of pH homoeostasis in the leaf cell secretory pathway of wild tobacco Nicotiana benthamiana on the expression and stability of recombinant proteins. We demonstrate the potential of Influenza virus proton channel M2 as a new tool to increase pH in acidic compartments of the cell secretory pathway, eventually useful to stabilize acid-labile recombinant proteins. In line with the well-established influence of pH on cell protease activities, we then show that pH modification induced by the expression of the M2 channel influences the degradation profile of fusion proteins susceptible to proteolysis, thus confirming the impact of pH on protease activities in plant cells and highlighting the potential of M2 as an accessory protein to increase the stability and yield of recombinant proteins in planta. Finally, we describe the impact of the M2 proton channel on the expression of endogenous proteins at the cellular scale. We show that pH alteration in the secretion system upon M2 expression has cell-wide effects on the leaf proteome, affecting the content of proteins found in various cell compartments including the chloroplast, the cytosol and the vacuole. We report the establishment of a ‘hybrid proteome’ in leaf cells expressing the proton channel, composed of protein clusters characteristic of both control, non-infected plants and agroinfected plants actively expressing defense-related proteins. Overall, our data highlight the central role of pH homeostasis on the proteome of plant cells and the strong impact of pH gradient in the cell secretory pathway on the stability and yield of acidic pH-labile and protease-susceptible recombinant proteins.
Table des matières
Résumé...iii
Abstract...iv
Table des matières...v
Liste des tableaux...ix
Liste des figures...x
Liste des abréviations...xii
Remerciements...xv
Avant-propos...xvii
Chapitre 1...1
1.1 La moléculture végétale, un secteur émergent des biotechnologies...2
1.2 La problématique des gradients de pH en moléculture...5
1.3 Le canal ionique M2, un régulateur ectopique des gradients de pH?...7
1.4 Les hypothèses de travail du projet...11
1.5 Les objectifs de recherche du projet...12
Chapitre 2...19
2.1 Brève mise en contexte...20
2.2 Résumé...21
2.3 Abstract...22
2.4 Introduction...23
2.5 Materials and methods...25
2.5.1 Plasmid constructs...25
2.5.2 Plant-based expression...26
2.5.3 Protein extraction...26
2.5.4 Western blotting and densitometric protein quantification...27
2.5.5 Imaging and data analysis...27
2.5.6 Statistical analysis...28
2.6.1 pH changes along the cell secretory pathway...28
2.6.2 Impact of M2 on pH along the secretory pathway...31
2.6.3 M2 co-expression stabilizes an acid-susceptible peptide linker...33
2.6.4 M2 co-expression increases the yield of recombinant HA subtypes...35
2.7 Concluding remarks...36
2.8 Acknowledgments...37
2.9 Supporting information...37
Chapitre 3...40
3.1 Brève mise en contexte...41
3.2 Résumé...42
3.3 Abstract...43
3.4 Introduction...44
3.5 Results and discussion...45
3.5.1 M2 proton channel co-expression promotes the accumulation of GFP variant pHluorin in
leaves...45
3.5.2 A fusion protein system for peptide cleavage monitoring in the cell secretory pathway...48
3.5.3 The
Q47PCystaTag–Q47P fusions are differentially susceptible to proteolytic cleavage in
planta...52
3.5.4 Proteolytic processing of the
Q47PCystaTag–Q47P fusions in planta is pH-dependent...55
3.6 Conclusion...58
3.7 Materials and methods...58
3.7.1 Fusion protein design and in silico protein modelling...58
3.7.2 Plasmid constructs...59
3.7.3 Transient expression in Nicotiana benthamiana...59
3.7.4 Protein extraction...60
3.7.5 pHluorin quantification...60
3.7.6 RNA extraction and quantitation...61
3.7.7 Microscopy analysis...61
3.7.8 Quantitative ELISA...62
3.8 Acknowledgments...63
3.9 Supporting information...63
Chapitre 4...69
4.1 Brève mise en contexte...70
4.2 Résumé...71
4.3 Abstract...72
4.4 Introduction...73
4.5 Results and discussion...75
4.5.1 Agroinfiltration alters the leaf proteome of N. benthamiana...75
4.5.2 Agroinfiltration triggers a classical biotrophic pathogen-inducible defense response in leaves
...77
4.5.3 M2 channel expression attenuates the host plant response to agroinfiltration...80
4.5.4 Proteome alterations in agroinfected leaves are transcriptionally and post-transcriptionally
determined...85
4.6 Conclusion...88
4.7 Materials and methods...89
4.7.1 Transgene constructs...89
4.7.2 Transient expression in leaves...90
4.7.3 Protein extraction...90
4.7.4 iTRAQ sample preparation and labeling...91
4.7.5 Mass spectrometry...91
4.7.6 Database searching...92
4.7.7 BLAST searches and GO enrichment analyses...92
4.7.8 Immunoblotting and protein quantitation by densitometry...93
4.7.9 RNA extraction and quantification of mRNA transcripts...93
4.7.10 Statistical analyses...94
4.8 Acknowledgments...94
Chapitre 5...121
5.1 Retour sur les hypothèses du projet...122
5.1.1 Retour sur l’Hypothèse 1, relative à l’impact d’une élévation du pH sur la stabilité des
protéines recombinantes sensibles aux conditions acides...123
5.1.2 Retour sur l’Hypothèse 2, relative à l’impact d’une élévation du pH sur l’activité des
protéases endogènes et la stabilité des protéines recombinantes exprimées...125
5.1.3 Retour sur l’Hypothèse 3, relative à l’influence de l’homéostasie du pH dans le système de
sécrétion cellulaire sur l’ensemble du protéome foliaire endogène...126
5.2 Quelques idées pour la suite...128
Références...130
Annexe I -
Fusion protein design for heterologous expression in plants...144
Annexe II - Engineering recombinant virus-like nanoparticles from plants for cellular delivery...145
Annexe III - An accessory protease inhibitor to increase the yield and quality of a tumour-targeting
mAb in Nicotiana benthamiana leaves...146
Annexe IV - A chimeric affinity tag for efficient expression and chromatographic purification of
heterologous proteins from plants...147
Annexe V - Companion protease inhibitors for the in situ protection of recombinant proteins in
plants...148
Annexe VI - Production of a tumour-targeting antibody with a human-compatible glycosylation
profile in N. benthamiana hairy root cultures...149
Annexe VII - Tomato cystatin SlCYS8 as a stabilizing fusion partner for human serpin expression in
plants...150
Liste des tableaux
Chapitre 3
Table 3.1 | Expected susceptibility of selected peptide linkers to plant proteases of different
mechanistic classes...50
Table S3.1 | Aliphatic index and instability index values calculated for the
Q47PCystaTag–Q47P fusions
using the EXPASY server ProtParam tool...68
Chapitre 4
Table S4.1 | Complete list of confidently identified proteins following iTRAQ analysis...99
Table S4.2 | The 60 most upregulated proteins in mock-agroinfiltrated leaves compared to
uninfiltrated control leaves...100
Table S4.3 | The 60 most downregulated proteins in mock-agroinfiltrated leaves compared to
uninfiltrated control leaves...102
Table S4.4 | The 60 most upregulated proteins in M2 vector-transfected leaves compared to
mock-agroinfiltrated leaves...104
Table S4.5 | The 60 most downregulated proteins in M2 vector-infiltrated leaves compared to
mock-agroinfiltrated leaves...106
Table S4.6 | The 100 most abundant proteins in uninfiltrated control leaves...108
Table S4.7 | The 100 most abundant proteins in mock-agroinfiltrated leaves...112
Table S4.8 | The 100 most abundant proteins in M2-channel expressing leaves...116
Liste des figures
Chapitre 1
Figure 1.1 | Modèle à porte pour le transport de protons dans le canal ionique M2...9
Chapitre 2
Figure 2.1 | Measurement of plant cell secretory pathway pH by pHluorin targeting to different
subcellular organelles...30
Figure 2.2 | Impact of M2 ion channel co-expression on pH of secretory pathway compartments...32
Figure 2.3 | Effect of M2 ion channel co-expression on the stability of an acid-susceptible fusion
protein...34
Figure 2.4 | Effect of M2 ion channel co-expression on the expression of recombinant
hemagglutinins...36
Figure S2.1 | Impact of M2 expression on pH of the plant cell cytosol...38
Figure S2.2 | Time course of M2 expression and effects on pH in subcellular compartments of the
secretory pathway...39
Chapitre 3
Figure 3.1 | Recombinant pHluorin expression in the secretory pathway of N. benthamiana cells...47
Figure 3.2 |
Q47PCystaTag–Q47P fusions and peptide linkers designed for the experiments...49
Figure 3.3 | In silico modelling of the
Q47PCystaTag–Q47P fusion hybrids...51
Figure 3.4 | Expression and stability of the
Q47PCystaTag–Q47P hybrids in N. benthamiana leaves... 54
Figure 3.5 | Stability of the
Q47PCystaTag–Q47P hybrids expressed alone (–) or along with M2 (+) in N.
benthamiana leaves...56
Figure 3.6 | A comparison of relative stability indices for the
Q47PCystaTag–Q47P hybrids expressed
alone or along with M2 in N. benthamiana leaves...57
Figure S3.1 | Intrinsic stability of GFP variant pHluorin in neutral to mildly-acidic pH conditions...64
Figure S3.2 | Complement to Figure 3.3: Structural models for the remaining 12
Q47PCystaTag–Q47P
fusion hybrids...65
Figure S3.3 | Complement to Figure 3.5: Relative amounts of
Q47PCystaTag–Q47P hybrids and free
(released) cystatin domains in leaves expressing the fusions alone (–) or along with
M2 (+)...66
Figure S3.4 | Complement to Figure 3.5: Intrinsic stability of
Q47PCystaTag–Q47P fusion hybrids in
neutral to mildly-acidic pH conditions...67
Chapitre 4
Figure 4.1 | Soluble protein content and proteome changes in non-infiltrated (control, Ctrl), mock
(‘empty’) vector-transfected (Agro) and M2 channel vector-transfected (M2) leaves 6 d
post-agroinfiltration...76
Figure 4.2 | GO enrichment analysis of iTRAQ-quantified proteins up- (A, in blue) or downregulated
(B, in red) by at least twofold in mock vector-infiltrated leaves compared to non-infiltrated
control leaves...79
Figure 4.3 | GO enrichment analysis of iTRAQ-quantified proteins up- (A, in blue) or downregulated
(B, in red) by at least twofold in M2 vector-infiltrated leaves compared to agroinfiltrated
leaves...81
Figure 4.4 | Venn diagrams for the proteins up- (blue) or down- (red) regulated in two [test] treatments
compared to the third [reference] treatment...83
Figure 4.5 | Relative distribution curves for the 100 most abundant proteins in control (Ctrl,
non-infiltrated), mock-infiltrated (Agro) and M2 channel-transfected (M2) leaves...84
Figure 4.6 | Relative abundance of Rubisco subunits and PR proteins in control (Ctrl, non-infiltrated),
mock-infiltrated (Agro) and M2-transfected (M2) leaves...86
Figure 4.7 | RT-qPCR analysis of Rubisco and defense-related protein transcripts in RNA extracts of
control (Ctrl), mock-infiltrated (Agro) and M2-transfected (M2) leaves...87
Figure S4.1 | Complement to Fig. 4.1–Soluble protein content over 12 d in uninfiltrated leaves or
agroinfiltrated leaves expressing or not the M2 proton channel...96
Figure S4.2 | Complement to Fig. 4.2–GO enrichment analysis of iTRAQ-quantified proteins up- (A, in
blue) or down- (B, in red) regulated by at least twofold in mock vector-infiltrated leaves
compared to uninfiltrated control leaves...97
Figure S4.3 | Complement to Fig. 4.3–GO enrichment analysis of iTRAQ-quantified proteins up- (A, in
blue) or down- (B, in red) regulated by at least twofold in M2 vector-infiltrated leaves
compared to agroinfiltrated leaves...98
Liste des abréviations
ARNm ARN messager
AACT Alpha-1-antichymotrypsine humaine
ADN; DNA Acide désoxyribonucléique; desoxyribonucleic acid ADNc; cDNA ADN complémentaire, complementary DNA
ANOVA Analyse de variance; analysis of variance
AP Alkaline phosphatase
Arg Arginine
Asp Acide aspartique
ATP Adénosine triphosphate
BiP Chaperone binding proteins
BLAST Basic Local Alignment Search Tool
CaMV Cauliflower Mosaic Virus
CathD, E Cathepsin D or E
Ctrl Control
Cys Cystatin
DPI Days post infiltration
EK Entérokinase
ELISA Enzyme-linked immunosorbent assay
EV Mock infiltration with an empty vector
FWT Fresh weight tissue
GFP Green fluorescent protein
GLM General Linear Model
Gly Glycine
GO Gene Ontology
HA; HAB Haemagglutinin, HA influenza B
His Histidine
HPLC High performance liquid chromatography
HRV 3C Human Rhinovirus 3C protease
HSP Heat shock protein
IgG Immunoglobulin G
IMAC Immobilized metal ion affinity chromatography
LB Luria-Bertani medium
LegC13 Legumain C13
LSD Least Significant Difference
M10 Metalloproteinase 10
mAb Monoclonal antibody
MES 2-[N-morpholino]ethanesulfonic acid
NaCl Sodium chloride (chlorure de sodium)
NOS Nopaline synthase
p19 Silencing suppressor
PBS Phosphate-buffered saline
PCR Polymerase chain reaction (réaction de polymérase en chaîne)
PDI Protein disulphide isomerase
PMSF Phenyl-methylsulfonyl fluoride
PR Pathogenesis-related protein (Protéine reliée à la pathogénèse)
Pro Proline
ProtK Proteinase K
RNAi RNA interference
RT-qPCR Reverse transcriptase-quantitative PCR
RuBisCO Ribulose-1,5-bisposphate carboxylase/oxygenase
SD Standard deviation (Écart-type)
SDS-PAGE Sodium dodecyl sulfate-polyacrylamide gel electrophoresis
SE Standard error (Erreur-type)
Ser Sérine
SlCYS8 Huitième sous-unité de la multicystatine de tomate
SP Signal peptide
TEAB Triethylammonium bicarbonate
TEV Tobacco etch virus
TGN Trans-Golgi Network
Thr Thrombin
TMD Transmembrane domain
Trp Tryptophane
TSP Total soluble proteins
Vir Virulence protein
Remerciements
Je tiens à remercier en premier lieu mon directeur de thèse, le Prof. Dominique Michaud, de m’avoir fait confiance et pour son soutien indispensable à la réussite de mes nombreux projets durant mes études doctorales. J’aimerais également remercier mon codirecteur, le Dr Frank Sainsbury, de m’avoir transmis sa passion pour la science et pour nos nombreuses rencontres où il m’a aidé à recentrer mes projets. Un merci tout particulier à mon codirecteur, le Dr Marc-André D’Aoust, pour m’avoir accueilli à bras ouverts dans son équipe chez Medicago et pour l’intérêt qu’il a constamment démontré à la réalisation de mes projets. Mon parcours académique n’aurait pas été le même sans l’appui de mes directeurs. Un grand merci.
Merci aux membres de l’équipe de M. Michaud : Stéphanie R., Marielle, Jonathan, Stéphanie G., Anne-Marie et Antoine. Vous avez contribué, de près ou de loin, à la réussite de mon projet, ce fut un plaisir de travailler avec vous. Un merci particulier à Marie-Claire pour son soutien incroyable et pour son écoute. Merci pour les belles, et nombreuses, discussions que nous avons eues dans ton bureau.
J’aimerais remercier le Prof. Charles Goulet pour son intérêt et son aide dans l’interprétation de mes résultats, nos discussions ont réellement contribué à l’avancement de mon projet.
Je remercie par ailleurs l’ensemble du personnel, du corps professoral et des étudiants de l’Envirotron. Ils ont contribué à créer un environnement de travail agréable et stimulant.
Je remercie la compagnie Medicago et l’ensemble de son personnel. Merci pour le temps et l’énergie que vous avez consacrés à mes projets. J’ai grandement appris, au plan professionnel et personnel, grâce à cette collaboration. J’aimerais remercier particulièrement Pierre-Olivier Lavoie et Louis-Philippe Hamel.
Je n’oublie pas mes collaborateurs en Italie. Merci au Dr Marcello Donini et à toute l’équipe de l’ENEA pour les stages que j’ai réalisés.
Je remercie l’équipe du Centre SEVE, Anne-Marie Simao et Chantal Binda, pour tout ce qu’elles ont fait pour moi. Elles ont toujours été présentes pour m’encourager dans mes nombreux projets.
Merci à ma famille qui a toujours été là dans les moments les plus difficiles. Merci à mes grands-parents pour leur écoute et leur soutien. Un merci spécial à mon père qui a été présent à toutes les étapes de mes études, sans lui mon projet n’aurait pu se réaliser.
Finalement, le plus important, merci à Hélène mon amour qui partage sa vie avec moi depuis tant d’années. Ensemble, nous avons surmonté plusieurs défis et fait tant de sacrifices durant nos études. J’ai toujours senti son amour et son soutien malgré la distance qui nous séparait et les nombreuses fins de semaine à travailler.
Avant-propos
Ce projet de doctorat a été réalisé sous la direction du Professeur Dominique Michaud et la codirection des Drs. Frank Sainsbury et Marc-André D’Aoust. Les résultats présentés ont été obtenus, entre autres, grâce à la collaboration exceptionnelle de notre partenaire industriel, Medicago inc. J’ai planifié et réalisé l’essentiel des travaux de laboratoire décrits dans cette thèse, puis rédigé les premières versions des manuscrits à publier. Mes superviseurs ont joué un rôle important dans l’analyse et l’interprétation des résultats et m’ont aidé à coordonner mes expériences en fonction d’objectifs préétablis en début de projet (Chapitre 1). Les coauteurs des articles inclus dans la thèse ont contribué aux expériences et à la correction des manuscrits, avant et pendant les processus de publication.
La thèse est composée de cinq chapitres comportant une revue de littérature, la définition des hypothèses et objectifs du projet, les résultats obtenus et les conclusions à en tirer. Le Chapitre 1 est une brève synthèse de la littérature scientifique pertinente au sujet d’étude, complétée des hypothèses de travail et des objectifs de recherche définis pour le projet. Les résultats obtenus sont ensuite présentés, sous la forme d’articles scientifiques rédigés en anglais et publiés (ou en voie de l’être) dans des périodiques scientifiques avec comité de lecture. Le Chapitre 2 (Article 1), paru dans le périodique Biotechnology Journal en 2015, décrit les résultats du projet relatifs à la modulation du pH dans le système de sécrétion cellulaire et à l’impact d’une expression hétérologue du canal ionique M2 sur la stabilité de protéines sensibles aux milieux acides. Le Chapitre 3 (Article 2), soumis récemment pour publication dans Plant Biotechnology Journal, confirme l’impact du pH sur l’activité des protéases dans le système de sécrétion et le potentiel du canal M2 pour la stabilisation post-transcriptionnelle des protéines recombinantes sensibles à la protéolyse. Le Chapitre 4 (Article 3), soumis sous peu pour publication dans Plant Physiology, décrit l’influence d’un changement de pH dans le système de sécrétion sur l’ensemble du protéome cellulaire de la plante hôte. Enfin, un retour sur les hypothèses et objectifs du projet est fait au Chapitre 5, complété d’une brève conclusion générale et de perspectives d’avenir sur l’utilité et l’amélioration des outils développés en cours de projet.
Chapitre 1
La question des gradients de pH en moléculture végétale
L'insertion d'un transgène codant pour une protéine étrangère dans une cellule hôte permet de produire à grande échelle des protéines dites recombinantes, utiles aussi bien à des fins pharmaceutiques qu’à des fins industrielles ou pour la recherche en laboratoire (Sack et al., 2015a). Les progrès rapides des dernières décennies en biotechnologie ont permis l’expression et la production d’une diversité toujours plus grande de ces protéines. Plusieurs produits recombinants sont aujourd’hui utilisés dans l’industrie biopharmaceutique pour la formulation de vaccins, d'anticorps ou de médicaments (Daniell et al., 2015; Davies, 2010). Malgré des succès certains, la mise au point de systèmes de production améliorés ou alternatifs toujours mieux adaptés aux propriétés structurales et biochimiques uniques de chaque polypeptide exprimé demeure pertinente pour améliorer le rendement et la qualité des produits finaux. Des progrès significatifs ont été réalisés au fil des ans pour développer des hôtes d'expression plus efficaces ou mieux adaptés aux protéines d’intérêt. Malgré des limitations évidentes sur le plan cellulaire, la bactérie Escherichia coli, un organisme procaryote, domine le marché des hôtes d'expression hétérologue et s’avère toujours utile en pratique pour le développement initial d'activités commerciales ou comme un point de référence pour la mise au point de plates-formes d'expression alternatives (Chen, 2012). Des progrès significatifs ont aussi été accomplis ces dernières années pour l'utilisation des levures qui, en comparaison aux procaryotes, ont la capacité d’opérer une maturation post-traductionnelle complexe des protéines exprimées, souvent essentielle pour assurer leur stabilité ou leur activité in vivo (Celik and Calık, 2012). L’emploi de cellules de mammifères demeure également répandu pour la fabrication de plusieurs protéines pharmaceutiques à structure complexe, en raison de leur capacité à générer des protéines ou des assemblages protéiques identiques ou presque à leurs contreparties retrouvées chez l’humain (Zhu, 2012; Zustiak et al., 2014).
1.1 La moléculture végétale, un secteur émergent des biotechnologies
Bien que toujours très répandus, les systèmes d’expression cellulaires présentent en revanche des limitations sur le plan pratique, comme des rendements limités et des risques de contamination pathogénique dans le cas des cellules animales, ou l’expression de produits protéiques divergeant de la protéine naturelle dans le cas des cellules microbiennes. Dans ce contexte, et afin de répondre à une demande toujours grandissante dans le monde pour des protéines recombinantes de qualité, des efforts
considérables ont été déployés depuis vingt ans dans le développement de systèmes d’expression alternatifs qui répondent aux normes de sécurité en vigueur et qui permettent de fabriquer à faible coût des composés stables et biologiquement actifs. Dans ce contexte, plusieurs groupes de recherche se sont attardés au potentiel des plates-formes d’expression basées sur les plantes ou les cellules végétales (Lico et al., 2012; Rybicki, 2010; Davies, 2010).
La « moléculture végétale », une sous-discipline émergente des biotechnologies moléculaires, se définit comme le développement de plantes ou de cellules végétales génétiquement modifiées pour la production à grande échelle de composés utiles, souvent des protéines. Cette approche permet, entre autres, de réduire les coûts de production de base en amont du processus de purification (Kaufman and Kalaitzandonakes, 2011) et d’obtenir des rendements protéiques élevés par unité de biomasse ou de surface cultivée (De Muynck et al., 2010; Tremblay et al., 2010). Depuis une quinzaine d’années, plusieurs composés protéiques ont été exprimés avec succès dans les plantes, incluant des protéines thérapeutiques (Paul and Ma, 2011; Streatfield, 2007), des vaccins (D’Aoust et al., 2008) et des anticorps recombinants utilisés à diverses fins (Ma et al., 2015; Lombardi et al., 2012; De Muynck et al., 2010). L’engouement des chercheurs et de l’industrie pour les végétaux comme alternative aux systèmes d’expression classiques s’explique, d’un point de vue biologique, par les voies de biosynthèse et de maturation des protéines chez ces organismes, très semblables à celles mises en place chez les mammifères en général, et l’humain en particulier (De Muynck et al., 2010; Twyman et al., 2003).
Techniquement, les plantes sont modifiées génétiquement par l’insertion d’un transgène, ou gène recombinant, portant la séquence de la protéine à exprimer. Deux approches sont utilisées en moléculture végétale pour l’expression d’une protéine étrangère, impliquant soit la production de lignées transgéniques stables, soit l’expression transitoire du matériel génétique introduit dans les tissus d’une plante non modifiée :
LIGNÉES TRANSGÉNIQUES–Une plante transgénique est produite par l’intégration d’un
transgène d'intérêt dans le génome d’une cellule hôte utilisée ensuite pour régénérer une plantule modifiée en conditions in vitro (Ahmad et al., 2012). Cette modification du code génétique de la cellule receveuse est ensuite fixée dans la plante par la production séquentielle d’individus de générations filles à partir de la plantule régénérée, qui permet de stabiliser le locus génétique intégré au sein de la descendance. En pratique, le temps nécessaire à l’établissement d’une lignée transgénique stable demeure important dans
plusieurs cas, ce qui s’avère une limitation majeure pour leur adoption par une industrie biopharmaceutique soumise à des marchés en constante et rapide évolution. Si l’utilisation de lignées végétales transgéniques demeure une avenue possible en moléculture (Sack et al., 2015b; Reuter et al., 2014; De Buck et al., 2013; Chung et al., 2011), leur utilité à des fins agronomiques apparaît mieux assurée, notamment pour la protection des cultures contre les mauvaises herbes, les insectes nuisibles ou les agents phytopathogènes.
EXPRESSION TRANSITOIRE–Comme alternative aux lignées transgéniques stables,
l’expression transitoire consiste à exprimer une ou des protéines exogènes dans la plante hôte, après insertion du transgène dans des cellules non modifiées. Cette technique n’implique pas l’intégration permanente des séquences codantes dans le génome végétal et gagne en popularité en raison de sa capacité à permettre la production de quantités considérables de protéines recombinantes d’intérêt en quelques jours seulement (Sainsbury and Lomonossoff, 2014). Le procédé d’expression transitoire se base en général sur l’utilisation d’un vecteur génique bactérien, Agrobacterium tumefaciens, introduit par infiltration (ou agroinfiltration) dans les tissus de la plante hôte. L'ADN encodant la protéine d'intérêt, préalablement inséré dans le génome de la bactérie, est transféré post-agroinfiltration dans les cellules foliaires de la plante pour être transcrit puis traduit. Un avantage clé des systèmes d'expression transitoire est qu’ils procurent des résultats expérimentaux ou des produits commerciaux en quelques jours, plutôt qu’après plusieurs mois dans le cas de lignées transgéniques (Vézina et al., 2009; Phan et al., 2013).
Bien qu'une gamme de plantes aient été utilisées jusqu’ici en moléculture végétale, incluant des espèces modèles comme Arabidopsis thaliana (Nykiforuk et al., 2006), la luzerne Medicago sativa (Bellucci et al., 2007) ou la tomate Solanum lycopersicum (Sharma et al., 2008), le tabac (Nicotiana tabacum) et ses espèces cousines (Nicotiana spp.) demeurent des hôtes de choix pour la production de composés organiques divers, incluant les protéines (Tremblay et al., 2010). Les espèces du genre Nicotiana, notamment le tabac sauvage Nicotiana benthamiana, présentent plusieurs avantages sur le plan pratique, incluant notamment une biomasse foliaire importante permettant de produire de grandes quantités de protéines par expression transitoire ou de façon continue dans des lignées transgéniques (Rybicki, 2010; Daniell et al., 2001). D’autres avantages de ces plantes incluent une manipulation génétique aisée des tissus foliaires, la possibilité de les cultiver sur de grandes superficies et leur absence de la chaîne alimentaire humaine (De Muynck et al., 2009; Tremblay et al., 2010).
Malgré plusieurs avantages, l’expression de transgènes pour la production de protéines dans les plantes, y compris chez le tabac, est influencée par des facteurs endogènes difficilement contrôlables qui peuvent avoir une incidence négative considérable sur les rendements ou la qualité des produits. Pour les plantes comme pour tout hôte d’expression, la production de protéines recombinantes d’intérêt médical présente par exemple des défis techniques associés à la présence d’enzymes protéolytiques endogènes, à l’établissement de gradients de pH d’un compartiment cellulaire à l’autre et à l’abondance relative de protéines et de composés organiques endogènes pouvant affecter l’intégrité de la protéine exprimée et nuire à sa purification à partir des tissus sources (Robert et al., 2015). Des progrès considérables ont été réalisés depuis dix ou vingt ans pour aborder ces défis en contexte de production hétérologue, impliquant dans plusieurs cas le développement parallèle de « protéines de fusion » par génie protéique. La fusion de deux (ou plusieurs) protéines hétérologues –ou partenaires de fusion– peut avoir un impact positif significatif sur l’accumulation et la purification des protéines recombinantes dans les plantes (Sainsbury et al., 2016, 2013). Sur cette base, le présent projet s’est attardé au développement d’une gamme de protéines de fusion, avec pour but général d’étudier les effets de l’environnement cellulaire sur l’intégrité des protéines recombinantes exprimées dans les feuilles du N. benthamiana. Nous nous sommes intéressés en particulier à caractériser les impacts d’une manipulation ectopique du pH dans le système de sécrétion cellulaire des feuilles de la plante hôte sur le rendement en protéines recombinantes et les profils protéomiques endogènes établis dans la plante hôte.
1.2 La problématique des gradients de pH en moléculture
Le haut degré de compartimentation des cellules eucaryotes, qui permet de séparer les voies métaboliques au sein d’entités physiques distinctes, assure l’établissement des conditions environnementales spécifiques requises pour un fonctionnement optimal et intégré du métabolisme pris dans son ensemble. La compartimentation cellulaire permet aussi la création de gradients électrochimiques de part et d’autre des membranes lipidiques, essentiels pour générer l’ATP nécessaire aux nombreuses fonctions endergoniques du métabolisme et du développement cellulaires. Dans une cellule à métabolisme actif, des environnements intracellulaires de pH variés
sont observés d’un organite à l’autre, allant d’un état neutre dans le cytosol ou le réticulum endoplasmique (RE) à des états acide ou alcalin dans des compartiments comme la vacuole, l’apoplaste ou le stroma chloroplastique. De manière plus spécifique, nous nous sommes intéressés au pH du système de sécrétion cellulaire, par où transitent plusieurs protéines recombinantes d’intérêt clinique pendant leur maturation post-traductionnelle. Au moment de leur biosynthèse, les protéines destinées à la sécrétion cellulaire passent d'abord du cytosol au RE, puis vers des compartiments cellulaires progressivement plus acides (Paroutis et al., 2004). L'acidification du milieu débute tout de suite en aval du RE, dans le cis-Golgi où le pH est d'environ 6,7 puis dans le trans-Golgi où il peut être aussi faible que pH 6,0. Cette baisse du pH se poursuit ensuite dans les vésicules de Golgi, où le pH peut descendre jusqu’à 5,2 (Casey et al., 2010).
De tels gradients de la teneur en protons d’un compartiment cellulaire à l’autre jouent un rôle biologique essentiel puisque plusieurs protéines endogènes dépendent de pH spécifiques pour le maintien de leur intégrité structurale ou de leur activité. La teneur en protons est importante aussi parce que la balance des réactions de ‘protonation’ et de ‘déprotonation’ dans le milieu dicte la charge fondamentale des macromolécules et influence plusieurs réactions métaboliques (Casey et al., 2010). Dans le système de sécrétion cellulaire, une régulation stricte du pH contribue à la maturation et au transport vectoriel des protéines sécrétées. Les polypeptides néo-synthétisés, repliés et glycosylés dès leur passage dans le RE pour adopter une configuration tridimensionnelle propice à leur activité biologique, sont transportés ensuite dans l'appareil de Golgi, constitué de compartiments vésiculaires spécialisés où s’opèrent les étapes finales des processus de transport et de maturation. Les protéines en transit, encore immatures dans plusieurs cas, y sont alors modifiées de nouveau par d’autres enzymes, notamment des protéases, puis emmagasinées dans les vésicules de sécrétion du réseau trans-golgien pour être livrées à leur destination finale dans le milieu extracellulaire ou dans un compartiment cellulaire alternatif (Paroutis et al., 2004). Plusieurs facteurs contribuent à l’établissement des gradients de pH de part et d’autre des membranes lipidiques. En particulier, les ATPases à protons (ATPases–H+), ou pompes à protons, jouent un rôle important dans l’acidification des organites cellulaires via leur fonction de transfert protonique à partir du cytosol. Plus spécifiquement, deux facteurs contribuent, de concert, au changement progressif du pH observé dans le sentier de sécrétion cellulaire : (i) une augmentation graduelle du nombre de pompes à protons du RE en direction du réseau trans-golgien, qui favorise une accumulation préférentielle des protons dans l'appareil de Golgi; et (ii) une diminution
progressive de la perméabilité membranaire dans la voie de sécrétion, qui favorise une forte rétention des protons dans les derniers compartiments du système (Paroutis et al., 2004). Bien qu’important sur le plan biologique, un tel gradient de pH dans le système de sécrétion cellulaire peut en revanche s’avérer problématique dans un contexte de moléculture végétale en compromettant la stabilité, et par conséquent l’accumulation, de plusieurs protéines recombinantes. C’est le cas, en particulier, des protéines et des peptides dits ‘sensibles au pH’, dont la structure, la stabilité et l’activité sont directement compromises par une teneur élevée en protons dans le milieu. Dans ce contexte, le présent projet avait pour premier objectif d’évaluer dans quelle mesure une altération ciblée du pH dans le système de sécrétion intracellulaire pouvait permettre de stabiliser des protéines recombinantes sensibles au pH dans l’hôte d’expression végétal N. benthamiana. Un second objectif était d’établir si une telle manipulation du gradient de pH dans le système de sécrétion pouvait influencer les fonctions métaboliques de l’hôte végétal à l’échelle du protéome et, par ricochet, la stabilité des protéines exprimées, recombinantes ou endogènes.
1.3 Le canal ionique M2, un régulateur ectopique des gradients de pH?
Nous avons sélectionné pour ce faire un transporteur protéique bien caractérisé du virus de l’Influenza, le canal ionique M2, capable en théorie d’induire une modification significative du gradient de pH dans le système de sécrétion des cellules foliaires de la plante hôte. Le canal M2 a été découvert dans les années 1980 dans le cadre d’études sur la caractérisation du virus de l'Influenza (Lamb et al., 1985; Holsinger et al., 1994). Synthétisée à partir d’un morceau d'ARNm dérivé du segment 7 du gène de l'Influenza (Henkel and Weisz, 1998), la protéine M2 a été très étudiée en recherche médicale comme molécule cible éventuelle pour limiter la propagation des épidémies de grippe (Cady et al., 2009; Schnell and Chou, 2008). Sur le plan biologique, le canal M2 est requis pour la réplication du virus dans les cellules infectées. Son rôle principal serait de favoriser l’entrée d’ions dans le lumen des virions au moment de l'infection et de moduler le pH dans les compartiments intracellulaires au moment de la fabrication de nouvelles particules virales (Cady et al., 2009).
Sur le plan fonctionnel, la protéine M2 a pour propriété de former un canal ionique transmembranaire composé de quatre sections à rôles bien définis : (i) les 24 premiers
acides aminés, en région N-terminale, qui forment un domaine extracellulaire –ou ectodomaine– astructuré dirigeant l'incorporation de la protéine dans le virion en formation; (ii) les acides aminés 25 à 46, qui forment un domaine transmembranaire impliqué dans l’assemblage des sous-unités de la protéine au sein du canal multimérique et, ultérieurement, dans le transport des ions de part et d’autre des membranes lipidiques; (iii) les acides aminés 47 à 61, qui forment une hélice cytosolique amphiphilique assurant l'intégrité fonctionnelle du canal et la localisation membranaire du virion; et (iv) les acides aminés 62 à 97, en région C-terminale, qui forment un domaine cytosolique désordonné permettant des interactions avec les protéines de la matrice virale (Wang et al., 2011; Grigoryan et al., 2011; Sharma et al., 2010). Le domaine cytosolique de la protéine protège également le pore du canal contre une fermeture précoce de l'ectodomaine exposé à un pH acide (Chen et al., 2008). Le canal ionique, à fonction sélective, est un homotétramère intramembranaire stabilisé par des ponts disulfures (Holsinger and Lamb, 1991). Durant sa synthèse, la protéine M2 est co-traduite en parallèle aux autres protéines du virus, insérée dans le RE puis transportée jusqu'à la membrane plasmique des cellules infectées (Henkel and Weisz, 1998). Le canal ionique est perméable aux ions Na+ et son activité est régulée par une conformation stricte de la protéine régie par la teneur en protons, de manière à ne pas permettre des variations de pH trop importantes qui pourraient compromettre la survie du virus (Grigoryan et al., 2011). Dans le système de sécrétion, l’impact du canal ionique M2 augmente progressivement dans l'appareil de Golgi à mesure que le pH diminue, jusqu'à l'atteinte d'un plateau à pH 5,4.
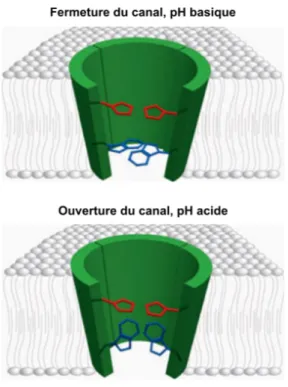
Un tel pH acide permet l'ouverture du canal via des interactions complexes entre certains de ses acides aminés constituants (Sharma et al., 2010; Wang et al., 2011; Pinto and Lamb, 2006). Deux modèles ont été proposés pour expliquer le passage des protons dans le canal de M2, soit (i) le modèle à porte et (ii) le modèle à navette, qui impliquent tous deux le résidu histidine-37 (His-37) du domaine transmembranaire de la protéine :
(i) Selon le modèle à porte, la présence de protons sur le résidu His-37 engendre, en situation de faible pH, l'ouverture du canal par répulsion électrostatique. Un fil d'eau continu se forme alors et il y a échange de protons entre les milieux aqueux communicants, de part et d’autre de la membrane lipidique. Des changements de conformation spatiale des résidus His-37 et tryptophane (Trp)-41 sont requis pour ce modèle (Figure 1.1). L'ouverture de la porte, qui se produit en quelques millisecondes, est associée à un changement de structure du canal impliquant les hélices alpha du domaine
transmembranaire, qui permet un élargissement du canal favorable au mouvement des protons (Wang et al., 2011).
Figure 1.1 | Modèle à porte pour le transport de protons dans le canal ionique M2. Sont
représentées sur la figure les sous-unités du canal formant le domaine transmembranaire (acides aminés 24–44, en vert), qui porte les résidus Trp-41 agissant comme ‘porte’ (en bleu) et les résidus His-37 régulant leur conformation tridimensionnelle (en rouge). Le schéma supérieur montre le canal en position fermée, lorsque le pH extérieur est basique. Les résidus His-37 sont alors non chargés et les résidus Trp-41 sont en position couchée, de manière à obstruer le pore près du domaine cytosolique. Inversement, le schéma inférieur montre le canal en position ouverte, une conformation adoptée lorsque le pH extérieur est acide. Les résidus His-37 sont alors chargés, ce qui induit un changement de conformation des résidus Trp-41 pour rendre possible le transport de protons H+ (Figure adaptée de Pinto et al., 2006).
(ii) Selon le modèle à navette, un atome d’azote sur le groupement imidazole du résidu His-37 capture un proton du côté externe du canal pour former un intermédiaire biprotoné, avant qu’un autre azote ne libère le proton du côté interne. L'état initial du résidu histidine est retrouvé par tautomérisation ou simple retournement de l'anneau imidazole, permettant la poursuite du processus. Ce modèle implique un changement de
configuration continuel de l’acide aminé vecteur; il permettrait d'expliquer le faible taux de transport des protons et la saturation du canal généralement observée à pH très acide (Cady et al., 2009).
Des études structurales sur le domaine transmembranaire de la protéine ont permis de démontrer que la conformation des hélices alpha est fortement modulée par le changement de pH, supportant du même fait l’hypothèse d’un rôle critique des acides aminés His-37 et Trp-41 dans le processus de transport protonique (Wang et al., 2011). À pH élevé, les hélices transmembranaires ont une configuration très serrée et la porte du canal est verrouillée par une interaction étroite entre les résidus Trp-41 et un acide aspartique en position 44 (Asp-44). Inversement, une déstabilisation du canal est induite à pH acide, qui permet son ouverture par un changement de configuration tridimensionnelle du résidu Trp-41 et une interaction alors possible avec le résidu His-37 (Grigoryan et al., 2011). Ensemble, la partie C-terminale du tétramère et les ponts disulfures en région N-terminale maintiennent la structure en place pour empêcher une déformation complète de la protéine (Cady et al., 2009). L’ouverture du canal ionique est augmentée lorsque le pH du côté N-terminal de la protéine M2 est faible et celui du côté C-terminal est élevé, la situation inverse étant très rarement observée en raison de la conformation même du canal qui dirige, par définition, un flux unidirectionnel (Schnell and Chou, 2008). En raison des études détaillées déjà publiées sur la structure et le fonctionnement du canal M2, cette protéine s’avérait d’intérêt dans le cadre de ce projet comme outil moléculaire pour altérer l’homéostasie du pH dans le système de sécrétion cellulaire et pour étudier les impacts d’une modulation des balances protoniques sur la stabilité des protéines recombinantes sécrétées et l’intégrité du protéome endogène de l’hôte végétal utilisé pour les exprimer.
1.4 Les hypothèses de travail du projet
Trois hypothèses principales et neuf sous-hypothèses ont été testées dans le cadre du présent projet, telles que formulées ci-dessous :
H
YPOTHÈSEPRINCIPALENO. 1 R
ELATIVE À L’
IMPACT D’
UNE ÉLÉVATION DU PH
DANS LE SYSTÈMEDE SÉCRÉTION CELLULAIRE SUR LA STABILITÉ DES PROTÉINES RECOMBINANTES SENSIBLES AUX CONDITIONS ACIDES« Une élévation du pH dans le système de sécrétion cellulaire stabilise les protéines recombinantes sensibles aux pH acides dans les feuilles de l’hôte végétal N. benthamiana utilisé pour les exprimer. »
Sous-hypothèse 1.1 L’expression transitoire du canal ionique M2 dans les feuilles du N. benthamiana augmente le pH dans le lumen des compartiments acides du système de sécrétion cellulaire.
Sous-hypothèse 1.2 Une élévation du pH dans les compartiments acides du système de sécrétion cellulaire favorise la stabilité de liens peptidiques sensibles au pH intégrés à des protéines de fusion recombinantes dans les feuilles du N. benthamiana.
Sous-hypothèse 1.3 Une élévation du pH dans les compartiments acides du système de sécrétion cellulaire favorise l’expression et la stabilité de protéines recombinantes d’intérêt clinique sensibles au pH dans les feuilles du N. benthamiana.
H
YPOTHÈSEPRINCIPALENO. 2 R
ELATIVE À L’
IMPACT D’
UNE ÉLÉVATION DU PH
DANS LE SYSTÈMEDE SÉCRÉTION CELLULAIRE SUR L’
ACTIVITÉ DES PROTÉASES ENDOGÈNES RÉSIDANTESET LA STABILITÉ DES PROTÉINESRECOMBINANTESEXPRIMÉES« Une élévation du pH dans le système de sécrétion cellulaire associée à l’expression hétérologue du canal ionique M2 influence le profil d’activités des protéases endogènes et la stabilité des protéines recombinantes dans les feuilles du N. benthamiana utilisé comme hôte d’expression. »
Sous-hypothèse 2.1 Le profil d’activités des protéases du système de sécrétion cellulaire est influencé par une modulation du pH associée à l’expression du canal ionique M2. Sous-hypothèse 2.2 Une altération du profil d’activités des protéases du système de
sécrétion cellulaire induite par expression du canal M2 favorise l’accumulation de protéines recombinantes sensibles à la protéolyse.
Sous-hypothèse 2.3 Une altération du profil d’activités des protéases du système de sécrétion cellulaire influence la stabilité de protéines de fusion recombinantes intégrant un lien peptidique sensible à la protéolyse.
H
YPOTHÈSEPRINCIPALENO. 3 R
ELATIVE À L’
INFLUENCE DE L’
HOMÉOSTASIE DU PH
DANS LE SYSTÈMESÉCRÉTIONCELLULAIRE SURLEPROTÉOMEFOLIAIREENDOGÈNEPRISDANSSONENSEMBLE« Une élévation du pH dans le système de sécrétion cellulaire induite par expression hétérologue du canal ionique M2 a un effet généralisé sur le protéome cellulaire endogène dans les feuilles du N. benthamiana utilisé comme hôte d’expression. »
Sous-hypothèse 3.1 Une élévation du pH dans le système de sécrétion cellulaire induite par expression du canal M2 altère l’ensemble du protéome cellulaire dans les feuilles. Sous-hypothèse 3.2 Une altération généralisée du protéome cellulaire induite par le canal M2 influence la teneur en protéines de défense dans le système de sécrétion cellulaire et, par ricochet, l’équilibre des profils protéiques liés aux métabolisme primaire et secondaire.
Sous-hypothèse 3.3 Une telle altération généralisée du protéome cellulaire par le canal M2 se traduit par une régulation des biosynthèses protéiques aux niveaux transcriptionnel et post-traductionnel.
1.5 Les objectifs de recherche du projet
Douze grands objectifs ont été poursuivis pour traiter des différentes hypothèses et sous-hypothèses formulées à la section précédente :
O
BJECTIFSI–IV E
NLIEN AVEC L’
HYPOTHÈSE PRINCIPALE NO. 1,
RELATIVE À L’
IMPACTDU CANALM2
SUR LE PH
ET À SES EFFETS SUR LA STABILITÉ DES PROTÉINES RECOMBINANTES SENSIBLES AU PH
ACIDESDANSLESYSTÈMEDESÉCRÉTIONCELLULAIREQuatre objectifs, les Objectifs I, II, III et IV, ont été poursuivis pour tester la première hypothèse du projet relative aux impacts d’une modulation du pH dans le lumen du système de sécrétion cellulaire sur la stabilité des protéines sensibles aux pH acides. Le but ultime de ces objectifs était de confirmer l’effet positif éventuel d’une élévation ectopique du pH dans les compartiments acides du système de sécrétion sur l’accumulation des protéines recombinantes exprimées, par expression hétérologue du canal ionique M2. Les quatre objectifs sont détaillés brièvement ci-dessous; des informations techniques plus détaillées sont données plus loin, dans le premier article original du corps de la thèse (Chapitre 2).
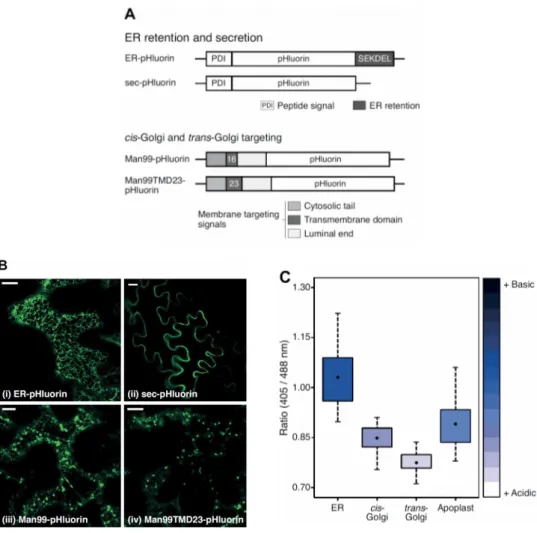
Objectif I Élaborer un outil diagnostic moléculaire pour la détection et la mesure des variations de pH d’un compartiment à l’autre dans le système de sécrétion cellulaire des feuilles du N. benthamiana.
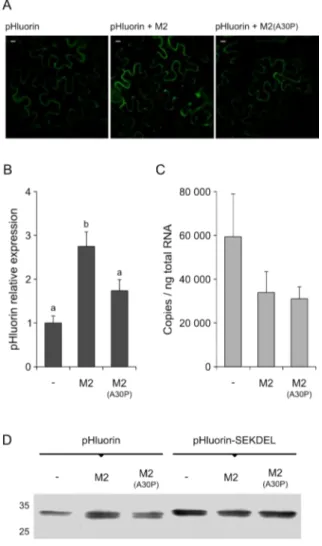
Des constructions génétiques ont été générées pour accumuler la pHluorin, un variant fonctionnel de la Green fluorescent protein (GFP), dans différents compartiments du système de sécrétion cellulaire. Quatre compartiments du système ont été ciblés, à savoir le RE, le cis-Golgi, le trans-Golgi et le milieu apoplastique. Les taux relatifs (ou ratios) d’émission de fluorescence de la pHluorin à des longueurs d’onde de 405 et 488 nm varient avec le pH du milieu (Miesenböck et al., 1998). Les taux de fluorescence de la protéine à ces deux longueurs d’onde dans les quatre compartiments ciblés ont été quantifiés par analyse d’images en microscopie confocale, avec pour but de confirmer des ratios de fluorescence variables associés à des pH différents du RE à l’apoplaste.
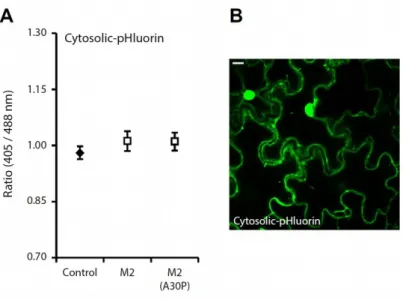
Objectif II Quantifier, en utilisant la pHluorin comme rapporteur, les variations de pH éventuellement induites par l’expression du canal ionique M2 dans le système de sécrétion cellulaire des feuilles du N. benthamiana. La pHluorin ciblée dans les différents compartiments du système de sécrétion cellulaire a été exprimée dans les feuilles de la plante hôte conjointement avec le canal M2, et ses profils de fluorescence comparés ensuite aux profils mesurés sans co-expression du transporteur protonique. Un mutant inactif du canal M2, le variant simple A30P (Holsinger et al., 1994), a été utilisé comme témoin négatif pour les tests de co-expression afin de lier les modifications de pH éventuellement détectées en co-co-expression au transfert de protons dirigé par la protéine virale.
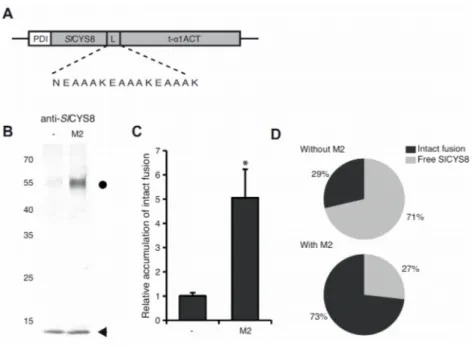
Objectif III Évaluer l’effet d’une élévation du pH associée au canal M2 dans le système de sécrétion cellulaire sur la stabilité in planta d’une protéine de fusion intégrant des protéines jointes par une séquence peptidique sensible aux pH acides.
Nous avons produit, il y a quelques années, des protéines de fusion permettant d’exprimer efficacement une serpine humaine d’intérêt clinique dans les feuilles du N. benthamiana (Sainsbury et al., 2013). L’une de ces fusions incluait un peptide de liaison, le peptide N(EAAAK)3, ayant pour propriété unique de s’autocliver à pH acide. Tel qu’attendu, la fusion intégrant ce peptide n’était pas stable dans le système de sécrétion cellulaire de la plante, en raison selon nous d’un pH légèrement trop acide dans l’appareil de Golgi. Afin de valider cette idée et afin d’évaluer le potentiel du peptide N(EAAAK)3 comme modèle d’étude pour la stabilisation in planta des séquences peptidiques sensibles au pH, nous avons exprimé de nouveau cette fusion dans la plante, avec ou sans le canal ionique M2, puis évalué sa stabilité relative avec ou sans altération du pH environnant.
Objectif IV Évaluer l’effet d’une élévation de pH associée au canal M2 dans le système de sécrétion cellulaire sur le taux d’expression d’antigènes viraux d’intérêt clinique sensibles ou non aux pH acides.
Il est bien documenté dans la littérature scientifique que le canal M2, par son action de transfert protonique, stabilise la structure de plusieurs hémagglutinines, des protéines de surface du virus de l’Influenza, dans les cellules animales infectées (Schnell and Chou, 2008). Il nous apparaissait pertinent, sur cette base, de vérifier si l’effet stabilisateur du canal pouvait aussi être observé dans des cellules végétales exprimant des hémagglutinines produites à des fins prophylactiques. Quatre sous-types d’hémagglutinines différentiellement sensibles aux pH acides ont été exprimés avec ou sans le canal M2 puis quantifiés pour évaluer dans quelle mesure une élévation du pH environnant pouvait contribuer à la stabilité de protéines recombinantes d’intérêt clinique montrant une sensibilité particulière aux conditions acides.
O
BJECTIFSV–VIII E
N LIEN AVEC L’
HYPOTHÈSE PRINCIPALE NO. 2,
RELATIVE À L’
IMPACT D’
UNE ÉLÉVATION DU PH
SUR L’
ACTIVITÉ DES PROTÉASES FOLIAIRES ENDOGÈNES ET LA STABILITÉ DES PROTÉINESRECOMBINANTESSENSIBLESAUX PROTÉASESDANSLESYSTÈMEDESÉCRÉTIONCELLULAIREQuatre objectifs, les Objectifs V, VI, VII et VIII, ont été poursuivis pour tester la seconde hypothèse principale du projet, relative à une altération indirecte du profil d’activités des protéases endogènes par l’effet du canal ionique M2 sur le pH de milieu. Nous avons développé, pour ce faire, un ensemble de protéines de fusion portant des liens peptidiques différentiellement sensibles à la protéolyse, de manière à permettre le suivi d’endopeptidases de familles diverses éventuellement retrouvées dans le système de sécrétion cellulaire. Le but ultime de ces expériences était de démontrer, d’une part, que l’activité de certaines protéases était dépendante du pH dans le système de sécrétion cellulaire; et, d’autre part, qu’une modulation du pH induite par le canal M2 pouvait avoir un impact indirect, positif ou négatif, sur la stabilité de protéines recombinantes exprimées en parallèle. Les quatre objectifs poursuivis pour ces démonstrations sont détaillés brièvement ci-dessous; des informations techniques additionnelles sont données plus loin, dans le deuxième article original du corps de la thèse (Chapitre 3).
Objectif V Évaluer l’impact d’une élévation du pH associée au canal M2 dans le système de sécrétion cellulaire sur la dégradation protéolytique d’une protéine recombinante modèle.
Il est bien documenté que la GFP (et ses variants) est modérément stable dans le système de sécrétion cellulaire, comparé à leur très haute stabilité dans le compartiment cytoplasmique (Sainsbury et al., 2013). Le taux d’accumulation du variant pHluorin ciblé vers l’apoplaste a été étudié ici afin d’évaluer l’impact d’un changement de pH sur sa stabilité dans le système de sécrétion. Sachant que la pHluorin n’est pas sensible aux conditions acides (Schulte et al., 2006), une altération de son taux d’accumulation en présence du canal M2 devait nous permettre de conclure, de manière préliminaire, à un effet indirect de la protéine virale sur la stabilité in planta de protéines recombinantes insensibles au pH, lié à ses effets en amont sur le pH du milieu et l’activité des protéases endogènes.
Objectif VI Confectionner un ensemble de protéines de fusion à sites de clivage distincts sur la base de modèles structuraux générés in silico.
Des protéines hybrides intégrant deux partenaires de fusion liés par une séquence peptidique sensible à un groupe ou une famille de protéases ont été conçues in silico, puis leur séquence codante synthétisée et insérée dans un vecteur d’expression pour le suivi
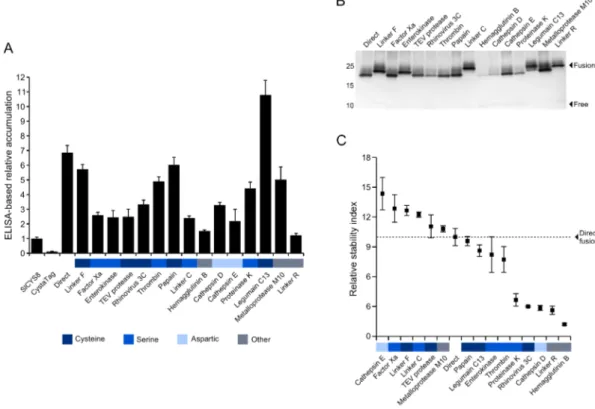
de leur stabilité in planta. Nous avons démontré antérieurement qu’un inhibiteur de protéases de la tomate, la cystatine SlCYS8, était stable dans le système de sécrétion cellulaire des feuilles du N. benthamiana (Robert et al., 2013). Une version inactive de cette protéine, le variant Q47P, et une version de ce variant portant un motif poly-histidine (poly-His) utile à des fins de purification ont été utilisées comme partenaires de fusion pour la confection des hybrides. Une quinzaine de séquences peptidiques ont été sélectionnées pour lier les deux partenaires, de manière à générer un ensemble de fusions à site de clivage protéolytique unique et distinct. Des modèles structuraux ont été générés in silico pour confirmer la stabilité thermodynamique éventuelle des différents hybrides et l’accessibilité des peptides de liaison aux protéases de la plante. Des constructions génétiques ont ensuite été produites pour l’expression de ces hybrides dans le système de sécrétion des feuilles du N. benthamiana.
Objectif VII Comparer le taux d’accumulation et la stabilité des différentes fusions protéiques dans le système de sécrétion des feuilles de la plante hôte. Nous avons démontré, déjà, que la séquence peptidique liant deux partenaires de fusion pouvait avoir un impact significatif sur la stabilité et l’accumulation de l’hybride résultant dans les feuilles du N. benthamiana (Sainsbury et al., 2013). Nous avons comparé ici les taux de clivage et d’accumulation des hybrides Q47P développés à l’objectif précédent, dans le but de déterminer pour chacun un « index de stabilité » corrélé au taux de clivage protéolytique de son peptide de liaison.
Objectif VIII Évaluerl’impact d’une modulation du pH associée au canal M2 sur la stabilité relative des fusions Q47P dans le système de sécrétion cellulaire.
Il est connu que l’activité des protéases est souvent dépendante du pH (van der Hoorn, 2008). Sur cette base, les hybrides de fusion Q47P ont été exprimés en présence ou non du canal ionique M2 dans les feuilles du N. benthamiana afin d’estimer l’impact d’une modulation ectopique du pH sur leur index de stabilité. L’idée était d’établir formellement dans quelle mesure l’effet premier du canal M2 sur le pH environnant pouvait aussi influencer la stabilité de séquences peptidiques recombinantes insensibles au pH dans le système de sécrétion par un effet indirect sur l’activité des protéases endogènes.
O
BJECTIFSIX–XII E
N LIEN AVEC L’
HYPOTHÈSE PRINCIPALE NO. 3,
RELATIVE À L’
IMPACT D’
UNE ÉLÉVATIONDU PH
DANS LE SYSTÈMEDE SÉCRÉTION CELLULAIRE SURLE PROTÉOME CELLULAIRE ETLES PRINCIPALESCOMPOSANTESDUMÉTABOLISMEQuatre objectifs spécifiques, les Objectifs IX, X, XI et XII, ont été poursuivis pour tester la troisième hypothèse principale du projet, relative à l’homéostasie du pH dans l’appareil de Golgi et à son importance sur l’intégrité du protéome à l’échelle de la cellule. Il est bien connu qu’un changement de pH affecte l’activité protéolytique endogène chez les plantes et que les protéases jouent un rôle essentiel dans l’équilibre synthèse– dégradation des protéines à tous les niveaux dans la cellule (Schuhmann and Adamska, 2012; Zybailov et al., 2009). Notre groupe de recherche a démontré, par ailleurs, qu’une altération ciblée des activités protéolytiques dans un compartiment cellulaire spécifique pouvait se traduire par un ajustement du protéome à l’échelle de la cellule (Badri et al., 2009; Goulet et al., 2010b). Une approche protéomique de type iTRAQ a été adoptée ici pour comparer les taux d’accumulation d’environ 1,200 protéines endogènes provenant de compartiments cellulaires variés, dans les feuilles du N. benthamiana exprimant ou non le canal ionique M2. Les quatre objectifs pour cette partie du projet sont détaillés brièvement ci-dessous; des informations techniques additionnelles sont données plus loin, dans le troisième article original du corps de la thèse (Chapitre 4).
Objectif IX Comparer le protéome de feuilles agroinfiltrées du N. benthamiana à celui de plantes témoins non infiltrées.
Objectif X Comparer le protéome de feuilles agroinfiltrées du N. benthamiana exprimant ou non le canal ionique M2.
Objectif XI Évaluer l’impact des processus d’agroinfiltration et d’altération du pH par le canal M2 sur les protéines associées aux fonctions métaboliques primaires et de défense de la plante hôte.
Des extraits protéiques foliaires de plantes témoins et de plantes agroinfiltrées exprimant ou non le canal M2 ont été traités par une analyse en spectrométrie de masse de type iTRAQ. Une telle analyse permet une comparaison quantitative détaillée du protéome d’échantillons considérés deux à deux, utile notamment pour évaluer le spectre