HAL Id: dumas-01635612
https://dumas.ccsd.cnrs.fr/dumas-01635612
Submitted on 15 Nov 2017HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Effet de la modification du contexte azoté sur la
dynamique de croissance et de développement des
légumineuses à graines de saison fraîche
Michel Guarinoni
To cite this version:
Michel Guarinoni. Effet de la modification du contexte azoté sur la dynamique de croissance et de développement des légumineuses à graines de saison fraîche . Agronomie. 2017. �dumas-01635612�
Effet de la modification du contexte azoté sur
la dynamique de croissance et de
développement des légumineuses à graines
de saison fraîche
Par : Michel GUARINONI
Soutenu à Rennes, le 13 septembre 2017
Devant le jury composé de :
Président : Matthieu CAROF
Maître de stage : Michel Edmond GHANEM Enseignant référent : Safya MENASSERI
Autres membres du jury : Virginie PARNAUDEAU
Les analyses et les conclusions de ce travail d'étudiant n'engagent que la responsabilité de son auteur et non celle d’AGROCAMPUS OUEST
Ce document est soumis aux conditions d’utilisation
«Paternité-Pas d'Utilisation Commerciale-Pas de Modification 4.0 France» disponible en ligne : http://creativecommons.org/licenses/by-nc nd/4.0/deed.fr AGROCAMPUS OUEST CFR Angers CFR Rennes Année universitaire : 2016 - 2017 Spécialité : Ingénieur Agronome Spécialisation / option :
Sciences et Productions Végétales (SPV) / Ingénierie des Agrosystèmes
Mémoire de Fin d'Études
d’Ingénieur de l’Institut Supérieur des Sciences agronomiques, agroalimentaires, horticoles et du paysage
de Master de l’Institut Supérieur des Sciences agronomiques, agroalimentaires, horticoles et du paysage
Remerciements
Merci à toutes les personnes qui m’ont accompagné au cours de ce stage. Notamment à Michel et Hélène, mes encadrants, pour leurs conseils, leurs connaissances, leurs avis éclairés, et surtout leur gentillesse. J’ai sincèrement apprécié ce stage sous leur direction.
Je remercie mes parents, mes amis, et Pierre pour leur soutien et leurs visites au Maroc, qui m'ont permises de découvrir (encore plus !) ce beau pays. Chefchaouen, Merzouga, Aït Ben Haddou et le Djebel Toubkal n'auraient pas été les mêmes sans eux…
Merci à l’Agence Universitaire de la Francophonie pour son soutien financier.
Evidemment, un grand merci à toute l’équipe du laboratoire de physiologie végétale de l’ICARDA de Rabat, notamment à Sara, Amal, et Alice, pour tous ces chebakias partagés et savourés ! اركش ج لايز
Table des matières
Remerciements ...5
Table des figures...11
Table des tableaux ...13
Table des annexes ...15
Introduction ...1
I) Etat de l'art ...3
A) Méthode de culture et d'inoculation de légumineuses en hydroponie ...3
B) La fixation symbiotique du diazote atmosphérique ...3
1) Les nodules, organes de fixation du diazote atmosphérique ...3
2) Fonctionnement cellulaire et coût énergétique de la symbiose pour la plante hôte ...5
3) Les effets d'un apport transitoire de nitrate sur la fixation biologique de l'azote ...5
C) Conclusions ...9
II) Objectifs du stage ...11
III) Matériel et Méthodes ...11
A) Mise au point de protocoles ...11
1) Matériel végétal et conditions de culture ...11
2) Détermination d'une solution nutritive adaptée aux légumineuses ...11
3) Protocole d'inoculation ...13
B) Effet du changement de la source d'azote sur la dynamique de croissance et de développement des légumineuses à graines ...13
1) Matériel végétal ...13
2) Conditions de culture et plan expérimental ...13
3) Protocole de modification de la source azotée...15
4) Variables mesurées ...15
5) Analyse statistique ...17
IV) Résultats ...17
A) Mise au point de protocoles ...17
1) Solution nutritive adaptée aux légumineuses ...17
2) Protocoles d'inoculation ...17
B) Effet du changement de la source d'azote ...19
1) Suivi des plants au cours de la phase de facilitation de la nodulation ...19
2) Suivi des plants au cours de la phase d'exposition au nitrate ...19
3) Dynamique de croissance et de développement au cours de la phase de changement de la source d'azote ...19
4) Teneur en azote total ...23
V) Discussion ...25
A) Mise au point de protocoles ...25
1) Solution nutritive adaptée aux légumineuses ...25
2) Protocoles d'inoculation ...25 1 2 1 1 2 2 2 3 3 5 6 6 6 6 6 7 7 7 7 8 8 9 9 9 9 9 10 10 10 10 12 13 13 13 13
B) Effets du changement de la source d'azote sur la dynamique de croissance et de développement
des légumineuses...27
1) La fixation symbiotique aboutit-elle au même état final de croissance et de développement que l'absorption racinaire ? ...27
2) Le changement de source d'azote induit-il des modifications de la dynamique de croissance et de développement ? ...27
3) Le changement de source d'azote implique-t-il une carence azotée ? ...29
C) Perspectives et limites ...33 Conclusion ...37 Bibliographie ...39 Annexes...1 14 14 14 15 17 19 20
Table des figures
NB : Lorsqu’aucune source n’est mentionnée, l’illustration est une réalisation personnelle
Figure 1 : Fixation du N2 et transformation en formes réactives dans les nodules
Figure 2 : Métabolisme des produits photosynthétiques au sein des nodules Figure 3 : Double effet répressif du nitrate sur les nodules
Figure 4 : Schéma du montage hydroponique employé Figure 5 : Photographie du montage hydroponique employé Figure 6 : Plan expérimental mis en place
Figure 7 : Photographie de l'expérience, en chambre de culture
Figure 8 : Schéma explicatif du déroulement de l'expérience de modification du contexte azoté Figure 9 : Effet de la solution nutritive sur la production de biomasse et la teneur en azote total de légumineuses testées
Figure 10 : Suivi de la nodulation des légumineuses testées après application des protocoles d'inoculation
Figure 11 : Photographies de nodules obtenus avec les protocoles d'inoculation testés
Figure 12 : Suivi de la nodulation des plants de lentille inoculés ou non au cours de la phase de facilitation de la nodulation
Figure 13 : Suivi des paramètres de croissance et de développement au cours de la phase de modification de la source d'azote (variété Bakria)
Figure 14 :Suivi des paramètres de croissance et de développement au cours de la phase de modification de la source d'azote (variété Chakkouf)
Figure 15 : Suivi de la teneur en azote total des plants de lentille au cours de la phase de modification de la source d'azote
Table des tableaux
NB : Lorsqu’aucune source n’est mentionnée, l’illustration est une réalisation personnelle
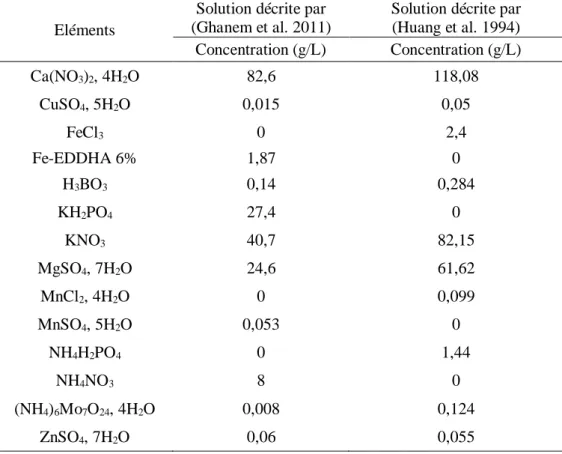
Tableau 1 : Composition des solutions nutritives testées
Tableau 2 : Composition des solutions nutritives (azotée et carencée en azote) utilisées lors du test des protocoles d'inoculation et lors de l'expérience de modification de la source d'azote disponible aux légumineuses (Ghanem et al. 2011)
Tableau 3 : Description des traitements appliqués lors de l'expérience de modification de la source d'azote disponible aux légumineuses
Table des annexes
NB : Lorsqu’aucune source n’est mentionnée, l’illustration est une réalisation personnelle
ANNEXE I : Protocole de stérilisation des graines de légumineuses
ANNEXE II : Description de la solution de culture pour Rhizobiums utilisée lors des protocoles d'inoculation
1 Introduction
L’année 2016 a été déclarée année internationale des légumineuses à graines par la soixante-huitième Assemblée générale des Nations Unies (FAO, 2015). Ceci montre que les légumineuses suscitent un intérêt agricole et environnemental à échelle mondiale.
Les légumineuses regroupent des végétaux appartenant à la famille des Fabacées, dont l’une des caractéristiques anatomique est la fructification sous forme de gousses (Aykroyd, Doughty, 1964). Toutefois, dans ce rapport, nous nous limitons aux légumineuses de saison fraîche (lentille et pois chiche particulièrement) (Stoddard et al., 2006).
Les légumineuses ont la particularité de pouvoir fixer le diazote (N2) atmosphérique.
Cette particularité repose sur une possibilité d’association symbiotique entre une légumineuse et des bactéries fixatrices d’azote, naturellement présentes dans le sol, du genre Rhizobium principalement (Masson-Boivin et al., 2009 ; Murray et al., 2016). Toutefois, il est également reconnu que dans un contexte de fertilisation azotée, les légumineuses privilégient un prélèvement de l’azote du sol, plutôt que de l’azote atmosphérique (Streeter, Wong, 1988 ; Jeudy et al., 2010), rendant improbable la réalisation de ces deux phénomènes en parallèle. Certains scientifiques considèrent qu’il peut être bénéfique de réaliser un apport azoté précoce sur les cultures de légumineuses (Mahon, Child, 1979 ; Clayton et al., 2004), bien que l’on connaisse mal les effets d’une exposition au nitrate sur la reprise de la fixation du N2
atmosphérique. Nous voulons notre démarche assez proche de ce qu’il se passerait naturellement dans ce contexte. Donc contrairement à ce qui a été fait dans la bibliographie, c’est-à-dire l’observation des effets d’un apport azoté à des plantes fixant le N2 (Jensen, 1986 ;
Fujikake et al., 2002 ; Voisin et al., 2003 ; Naudin et al., 2011), nous nous intéressons à l’effet de l’arrêt d’un apport de nitrate sur des plantes en mesure de fixer le diazote atmosphérique.
Ce mémoire de fin d’études tente d’apporter des éléments de réponse à la question des effets de la modification de la source d’azote sur la dynamique de croissance et de développement des légumineuses à graines, et éventuellement évoquer la question d'un possible stress azoté chez les légumineuses, principalement lors du passage d’une source d’azote à une autre.
Ce mémoire se divise en quatre parties. Une première partie est consacrée à une étude bibliographique, une seconde partie traite du matériel et méthodes. La troisième partie est consacrée à l’étude de nos résultats, qui seront discutés et confrontés à la bibliographie dans une quatrième partie.
Phloème Xylème
Cellule infectée de nodule
Bactéroïde N2 NH3 N2 e -ATP NH4+ NH4+ Glutamine Glutamate Uréides Amides Asparagine Acides organiques Nitrogénase
Figure 1 - Fixation du N2 et transformation en formes réactives dans les
2 I) Etat de l'art
A) Méthode de culture et d'inoculation de légumineuses en hydroponie
La culture expérimentale de légumineuses en hydroponie est assez courante, toutefois, peu de solutions nutritives spécifiques aux légumineuses ont été décrites. De nombreux travaux font appel à des solutions nutritives initialement destinées à d’autres cultures (Lauter, Munns, 1986 ; Tavori et al., 2004 ; Flowers et al., 2010) notamment la tomate (Tavori et al., 2004). Bien qu’il existe des références concernant la composition de solution nutritives, cette dernière peut varier en complexité, allant de 6 composés (Rigaud, Puppo, 1975) à 17 (Khan et al., 2015), et en teneurs en éléments ((Khan et al., 2015 ; Samineni et al., 2011). En outre, la vérification de l’équilibre des charges ioniques n’est jamais mentionnée. Dans la plupart des cas, la culture hydroponique n’est que transitoire (2 à 3 semaines), et ne s’étend pas sur toute la durée du cycle de culture des légumineuses (Ralston, Imsande, 1983).
Afin de favoriser la fixation symbiotique du N2 atmosphérique et la survie à long terme
des plants, la solution nutritive employée dans le dispositif hydroponique doit contenir tous les éléments impliqués dans la nutrition de la plante hôte et/ou du Rhizobium (O’hara et al., 1988). Sont considérés comme éléments essentiels à la symbiose légumineuse-Rhizobium : C, H, O, N, P, S, K, Ca, Mg, Fe, Mn, Cu, Zn, Mo, B (O’hara et al., 1988).
Les protocoles d'inoculation des légumineuses en phase liquide sont rares, peu répétés, et ne concernent que des inoculations pratiquées sur plants adultes. En général, les graines sont semées en terre (ou dans du sable), et inoculées par aspersion d’une solution contenant de l’inoculum bactérien puis transférées vers un dispositif hydroponique. Toutefois, un protocole d’inoculation de plants âgés cultivés en hydroponie, par trempage dans une solution de Rhizobiums en suspension a été décrit (Ralston, Imsande, 1983). Une autre méthode d’inoculation, consistant à verser une suspension de Rhizobiums directement dans une solution nutritive hydroponique dépourvue de nitrate, a également été décrite (Barker et al., 2006 ; Jeudy et al., 2010).
B) La fixation symbiotique du diazote atmosphérique
1) Les nodules, organes de fixation du diazote atmosphérique
La fixation biologique de l’azote est rendue possible par des bactéries du genre Rhizobium, des protéobactérie aérobies, diazotrophes, naturellement présentes dans la rhizosphère (Masson-Boivin et al., 2009). Les Rhizobiums induisent la formation de nodules racinaires où a lieu la symbiose, ainsi que la fixation et l’assimilation du diazote atmosphérique. Ces nodules renferment des Rhizobiums qui ont subi une forte différenciation en bactéroïdes. Les bactéroïdes sont des formes capables de fixer le diazote au sein des nodules (Geddes, Oresnik, 2016).
Dans les nodules, la fixation du N2 atmosphérique est possible grâce à une enzyme
nitrogénase bactérienne (Masson-Boivin et al., 2009) associée à une nitrogénase réductase. La nitrogénase catalyse la réduction du N2 en ammoniac (NH3) (Figure 1). Le NH3 est ensuite
transformé au sein du bactéroïde en ammonium (NH4+), qui est la forme de transfert entre le
bactéroïde et le nodule (Udvardi, Poole, 2013). L’activité de la nitrogénase est fortement inhibée par la présence d’O2. Les cellules des nodules contiennent de la leghémoglobine, une
protéine soluble, fixatrice de dioxygène. La leghémoglobine permet de contrôler le flux d’O2
PEP Glucose
Saccharose Phloème
Xylème
Cellule infectée de nodule
Bactéroïde Oxaloacétate Malate Pouvoir réducteur ATP Acides organiques Malate Glycolyse
Figure 2 - Métabolisme des produits photosynthétiques au sein des nodules (adapté de Becana et Sprent, 1987)
3
2) Fonctionnement cellulaire et coût énergétique de la symbiose pour la plante hôte Le métabolisme des bactéroïdes est dépendant de celui de la plante hôte, apportant le carbone organique nécessaire à la fixation du diazote. La fixation du N2, transformé en NH3 est
opérée lors de la réaction suivante, coûteuse en énergie : N2 + 8H+ + 8e- + 16ATP 2NH3 +
H2 + 16ATP + 16Pi (Geddes, Oresnik, 2016). Les molécules d’ATP et les électrons (pouvoir
réducteur) sont fournis par l’oxydation des glucides (saccharose, glucose) et des acides organiques (malate, succinate et glutamate) issus de la photosynthèse (Figure 2). Le NH3 est
ensuite transformé en NH4+, qui sert à la production d’uréides et d’amides (Figure 1). Ces
derniers étant les formes de transfert, dites « réactives » (White et al., 2007), de l’azote depuis les nodules, à destination de la plante hôte (Becana, Sprent, 1987). La distribution des acides organiques aux nodules se fait par les vaisseaux conducteurs du phloème (Gordon et al., 1999), les produits azotés de la fixation symbiotique sont exportés vers la plante via le xylème (Becana, Sprent, 1987).
Une désactivation de l’activité des nodules, par une exposition de courte durée au NO3-,
entraine une réallocation immédiate du carbone vers la plante (Naudin et al., 2011). Ceci suggère que le développement des nodules est un processus nécessiteux en carbone, et qui a lieu aux dépens de la croissance des organes aériens aux stades précoces (Voisin et al., 2002 ; Naudin et al., 2011). Ainsi, les nodules qui fixent activement le diazote atmosphérique constituent d’importants puits, détournant une grande portion des produits de la photosynthèse (plus de 25% de la production nette) (Minchin et al., 1981). Ce carbone récemment assimilé assurerait l’alimentation des nodules en composés carbonés, mais aussi l’entretien de ces derniers (Minchin et al., 1981 ; Witty et al., 1983). Notons que les nodules ne présentent aucun tissu de réserves, ce qui rend les bactéries qui y sont présentes constamment dépendantes de leur hôte (Kouchi et al., 1986).
3) Les effets d'un apport transitoire de nitrate sur la fixation biologique de l'azote
a) Effets du nitrate sur la nodulation
Du point de vue de la nodulation, la présence de NO3- en forte concentration (>10mM)
dans le sol affecte l’association symbiotique entre la luzerne et les Rhizobiums, notamment en altérant le développement des nodules, ce qui entraîne une diminution de la fixation du N2
(Zancarini et al., 2012). De manière plus générale, un apport de NO3- entraine une réponse
systémique réprimant la formation de nodules et leur activité. L’application précoce de fertilisants azotés sur des cultures de légumineuses inhibe le phénomène de nodulation, en affectant toutes les étapes de cette dernière : diminution de la probabilité de liaison des Rhizobiums, et diminution de la déformation des poils absorbants, et diminution du nombre de succès d’infections (Streeter, Wong, 1988). Selon le contexte azoté, les transporteurs de composés azotés sont en mesure d’initier une cascade de réponses, par l’intermédiaire de phyto-hormones (auxine, cytokinines, gibbérellines, acide abscissique), augmentant ou réprimant la nodulation et l’activité des nodules (Murray et al., 2016), et modulant ainsi le nombre de nodules et leurs masses (Streeter, Wong, 1988). L'effet de l’apport de nitrate sur la nodulation dépend du stade phénologique au cours duquel il est réalisé. Un apport de nitrate au cours de la phase végétative d’une légumineuse inoculée coïncide avec la période de croissance et d’initiation des nodules, et se traduit par une réduction de ces phénomènes. Alors qu’un apport de nitrate effectué au cours de la floraison ou du remplissage des grains coïncide avec une période au cours de laquelle le nombre et la taille des nodules n’augmentent plus, et se traduit donc par une diminution de la biomasse de nodules alors que le nombre de ces derniers reste
NO3 -NO3 -NO3- NO3 -NO2 -NO N2O N2 NH 4 + NH4+ ATP Pouvoir réducteur Glutamate Glutamine Asparagine Amides Uréides Saccharose Glucose Acides organiques Phloème Xylème
Cellule infectée de nodule
Bactéroïde Nitrogénase Vers les racines Voie privilégiée Voie réprimée Transformation inhibée Absence Effet inhibiteur
4 constant (Streeter, Wong, 1988).
Inversement, un arrêt de l’apport de nitrate induit une réponse racinaire et systémique influençant le développement des nodules en faveur d’un prélèvement du N2 atmosphérique
(pour des plantes inoculées) (Jeudy et al., 2010). Si la privation de nitrate est prolongée, la croissance des nodules existants est accrue, puis de nouveaux nodules sont générés. Avant le développement de novo de nodules, il y a une réallocation des produits photosynthétiques préférentiellement vers les racines, plutôt que vers les organes aériens (Jeudy et al., 2010).
b) Effets du nitrate sur l'activité des nodules
Une exposition au NO3- a également un effet sur l’activité des nodules. Cet effet varie
selon la concentration en NO3-, la durée de l’exposition, et le stade de développement au cours
duquel elle survient (Naudin et al., 2011). Globalement, lors d'une exposition à du NO3-, la
fixation biologique du N2 est diminuée (Norhayati et al., 1988 ; Voisin et al., 2002), voire
supprimée, quelle que soit sa concentration, sa durée, et le stade phénologique (Oghoghorie, Pate, 1971 ; Streeter, Wong, 1988). Indépendamment du stade de développement, une exposition au nitrate induit aussi une diminution de l’activité enzymatique (nitrogénase principalement) des nodules (Streeter, Wong, 1988), ce qui perturbe le métabolisme de ces derniers (Neo, Layzell, 1997). Ceci a pour conséquences une diminution de la fixation du N2 et
une dégénérescence des nodules où les bactéroïdes ne sont plus actifs, car plus alimentés en composés photosynthétiques. Ces phénomènes sont dus à une réallocation des produits carbonés de la photosynthèse vers les racines plutôt que vers les nodules, ce qui favorise l’absorption racinaire du NO3- et désavantage la fixation symbiotique du N2 (Francisco, Akao,
1993 ; Fujikake, 2003 ; Naudin et al., 2011).
L’effet négatif du NO3- sur les nodules est donc double (Figure 3). D’une part, les nodules
ne sont plus alimentés en composés photosynthétiques, et d’autre part, l’activité enzymatique des nodules est inhibée. Cependant, (Fujikake, 2003) rapporte que dans des cas de stress nitraté précoce, de faible intensité et de courte durée, la fixation du N2 serait accrue après la
suppression du NO3-.
c) Le rétablissement de la nodulation et de l'activité des nodules après une exposition au nitrate
Le rétablissement de l’activité spécifique des nodules après la suppression du NO3- varie
selon le stade végétatif au cours duquel le stress nitraté est appliqué, ainsi que selon la durée et l’intensité de ce stress. Chez le Soja, une exposition modérée au NO3- (5mM), de courte durée,
en début de cycle, entraine une diminution de la croissance des nodules, qui reprend rapidement après la suppression du stress nitraté (Fujikake, 2003). Selon les cas, les nodules peuvent avoir été plus ou moins endommagés (amincissement des parois endodermiques) (Streeter, Wong, 1988). Par conséquent, le délai de regain de l’activité des nodules dépendra de la vitesse de reprise de l’activité enzymatique, de l’endommagement des nodules, et de la capacité de génération de nouveaux nodules fonctionnels (Voisin et al., 2003). A l’échelle de la plante entière, l’application de NO3- entraîne un changement de la composition de la sève élaborée,
influençant l’activité des nodules. Toutefois, si un regain de l’activité enzymatique est régulièrement constaté, peu d’informations abordent la question du délai de regain d’une activité enzymatique optimale, n’impliquant pas de retard de croissance ou de développement, après une exposition au nitrate.
5
d) Conséquences agronomiques
De nombreuses études s’accordent sur le fait qu’un apport précoce de NO3- sur des
légumineuses conduirait à de meilleurs rendements. Ceci est expliqué par le fait que cet apport de NO3- augmente significativement la production précoce de biomasse aérienne. Les
légumineuses ont alors une surface photosynthétique plus importante, qui permet de produire davantage de produits carbonés utilisables par les nodules, une fois le nitrate du sol totalement consommé (Rigaud, 1981 ; Fujikake et al., 2002). Une autre étude avance que l’application précoce de fertilisant azoté ne serait que peu bénéfique (McKenzie et al., 2001). Pour certains, la fixation symbiotique du N2 atmosphérique ne permet pas une production de biomasse et une
accumulation d’azote aussi importantes qu’en contexte de fertilisation azotée (Oghoghorie, Pate, 1971 ; Mahon, Child, 1979 ; Jensen, 1986). Parmi eux, il est avancé qu’aux stades précoces de la nodulation, les plantes privées de NO3- accuseraient un retard de croissance par
rapport aux plantes disposant de NO3- (Gibson, 1966). Ce retard de croissance serait dû au délai
nécessaire à l’effectivité de la fixation symbiotique, alors qu’il n’y a pas de NO3- dans le sol,
induisant un stress azoté (Mahon, Child, 1979), ou à un coût en carbohydrate plus important de la fixation du N2 que de l’absorption de NO3- (Mahon, 1977), limitant la production de
biomasse.
Il est important de noter que le recours à l’absorption du NO3- ou à la fixation symbiotique
du N2 dépend fortement des variétés, des souches bactériennes, du stade phénologique et des
facteurs environnementaux (teneur en NO3-, disponibilité en carbone, disponibilité en eau,
température) (Becana, Sprent, 1987).
C) Conclusions
En premier lieu, en ce qui concerne la culture et l’inoculation de légumineuses en hydroponie, la bibliographie n’est pas satisfaisante. Il n’existe pas de solution nutritive spécifique aux légumineuses, et les solutions évoquées sont extrêmement variables en composition, et l’équilibre des charges ioniques n’est jamais mentionné. De même, le protocole d’inoculation consistant à verser une solution de Rhizobium dans une solution hydroponique ne nous semble pas satisfaisant. Effectivement, la population de Rhizobium n’est pas contrôlable, et des modifications de la composition de la solution nutritive pourraient survenir, sans être exclusivement imputable au développement des plants. Le protocole nécessitant de travailler sur des plants semés en terre n’est pas envisageable, puisque la composition minérale de cette dernière ne serait pas contrôlable. Le protocole consistant à tremper les racines des plants dans une suspension de Rhizobiums nous paraît exploitable, en subissant quelques modifications pour pouvoir être appliquée sur des graines.
En second lieu, la bibliographie aborde l’effet du changement de mode de nutrition azotée sur la croissance et le développement racinaire des légumineuses, sur le développement des nodules, sur l’activité enzymatique et sur la composition des sèves de la plante hôte. En revanche, elle aborde peu ses conséquences sur la croissance et le développement des organes aériens, et la question du délai de réactivation des mécanismes relatifs à la fixation symbiotique du N2 après une exposition au NO3-, alors que certains scientifiques avancent qu’une exposition
précoce à du nitrate permettrait un meilleur développement et une meilleure production de biomasse par des plantes fixant le N2.
Bouchon de laine minérale inerte Graine Support Bac Pompe d’aération Solution nutritive Diffuseur d’air Tuyau d’aération
Figure 4 - Schéma du montage hydroponique employé
6 II) Objectifs du stage
Compte tenu de la bibliographie, nous nous fixons comme objectifs de répondre aux questions suivantes :
1) Quelle solution nutritive utiliser pour cultiver des légumineuses en hydroponie, et comment réaliser une inoculation effective en phase liquide ?
2) Quels sont les effets d’un changement de source d’azote sur la dynamique de croissance et de développement des légumineuses à graines ?
a. Pour des plantes ayant le même niveau de développement, la fixation symbiotique du N2 atmosphérique permet-elle d’atteindre le même niveau de
croissance et de développement que l’absorption du NO3- ?
b. Est-ce que le changement de source d’azote induit un retard de croissance ? c. Est-ce que cet éventuel retard est dû à une carence azotée ?
III) Matériel et Méthodes A) Mise au point de protocoles
1) Matériel végétal et conditions de culture
Les essais de protocoles sont conduits sur la lentille (Lens culinaris) et le pois chiche (Cicer arietinum). Pour la lentille, nous travaillons avec la variété Bakria (inscrite au catalogue d’homologation officiel marocain en 1989 et la variété la plus cultivée au Maroc), pour le pois chiche, nous travaillons avec la variété Farihane (homologuée en 1994 et la variété la plus cultivée au Maroc).
Le montage hydroponique que nous utilisons consiste en des bacs en plastiques de 20L remplis de solution nutritive aérée par une pompe (Air pump 400, EHEIM GmbH, Deizisau, Allemagne), sur lesquels reposent des plaques métalliques en inox percées. Les trous permettent l’insertion d’une graine ou d’une plante (soutenues par un bouchon de laine minérale inerte) dans le montage (Figures 4 et 5).
Les expériences sont conduites en chambre de culture, dont les paramètres environnementaux sont fixés pour correspondre à des conditions optimales de croissance: l’humidité relative de l’atmosphère de la chambre de culture est fixée à 65% (Imtiaz et al., 2017), la température à 23°C (Singh et al., 2015), la photopériode à 14h (Rasool et al., 2013). Dans les zones exploitées de la chambre de culture, la densité de flux de photons photosynthétiques est comprise en 300 et 600 µmol.m-2.s-1. Les solutions nutritives sont aérées
en permanence, remises à niveau tous les 2 jours, et leur pH est ajusté à 6,5 (Khan et al., 2016). Une fois par semaine, les solutions nutritives sont complètement renouvelées.
2) Détermination d'une solution nutritive adaptée aux légumineuses
Nous testons deux solutions nutritives hydroponiques, respectant les conditions décrites dans la littérature (O’hara et al., 1988) sur pois chiche et lentille. Toutes deux sont adaptées de solutions d’Hoagland et Arnon (Hoagland, Arnon, 1950), l'une décrite par (Huang et al., 1994) (Tableau 1) et l'autre par (Ghanem et al., 2011) (Tableau 1). Nous disposons de 4 bacs hydroponiques, chaque bac contenant 10 graines de l’une des deux espèces étudiées (lentille ou pois chiche), et l’une des deux solutions nutritives testées. Les solutions nutritives sont aérées et renouvelées chaque semaine, pendant 4 semaines, en chambre de culture.
Au terme de ces 4 semaines, nous évaluons la production de biomasse permise par chaque solution en mesurant la masse sèche des plants après séchage pendant 48h à 60°C, ainsi que la
Tableau 1 - Description des solutions nutritives testées sur lentille et pois chiche
Tableau 2 - Description des solutions nutritives (azotée et carencée en azote) utilisées (Ghanem et al. 2011) lors du test des protocoles d'inoculation et lors de l'expérience de modification de la source d'azote disponible aux légumineuses
Eléments
Solution décrite par (Ghanem et al. 2011)
Solution décrite par (Huang et al. 1994) Concentration (g/L) Concentration (g/L) Ca(NO3)2, 4H2O 82,6 118,08 CuSO4, 5H2O 0,015 0,05 FeCl3 0 2,4 Fe-EDDHA 6% 1,87 0 H3BO3 0,14 0,284 KH2PO4 27,4 0 KNO3 40,7 82,15 MgSO4, 7H2O 24,6 61,62 MnCl2, 4H2O 0 0,099 MnSO4, 5H2O 0,053 0 NH4H2PO4 0 1,44 NH4NO3 8 0 (NH4)6Mo7O24, 4H2O 0,008 0,124 ZnSO4, 7H2O 0,06 0,055 Eléments Solution N + Solution N- Concentration (g/L) Concentration (g/L) Ca(NO3)2, 4H2O 82,6 17,9474 CaSO4, H2O 0 43,0425 CuSO4, 5H2O 0,015 0,015 Fe-EDDHA 6% 1,87 1,87 H3BO3 0,14 0,14 KCl 0 26,0925 KH2PO4 27,4 27,4 KNO3 40,7 5 MgSO4, 7H2O 24,6 24,6 MnSO4, 5H2O 0,053 0,053 NH4Cl 0 5,349 NH4NO3 8 0 (NH4)6Mo7O24, 4H2O 0,008 0,008 ZnSO4, 7H2O 0,06 0,06
7 teneur en azote total dans leur partie aérienne.
3) Protocole d'inoculation
Nous utilisons un protocole destiné à l’inoculation de racines de soja cultivé en hydroponie (Ralston, Imsande, 1983), que nous avons modifié de façon à pouvoir réaliser une inoculation de graines, dite inoculation « précoce », ainsi qu’une inoculation de racines sur plants âgés de 3 semaines, dite « tardive ».
Une solution de culture de Rhizobiums est préparée (Annexe 1). Elle contient un mélange de souche de Rhizobium leguminosarium spécifique à la lentille et de 3 souches de Rhizobiums, non spécifiques mais récupérées dans le sol d’une parcelle de pois chiche non fertilisée.
Pour l’inoculation précoce, les graines sont stérilisées (Annexe 2), après avoir été hydratées à l’eau distillée pendant 24h, puis sont inoculées par immersion dans la solution de culture de Rhizobiums en phase logarithmique tardive (environ 108 cellules/mL) pendant 24h, à 28°C, avec agitation. Pour l’inoculation tardive, des plants âgés de 3 semaines cultivés en hydroponie dans la solution nutritive adaptée (cf. Résultats III.A.1.) sont sortis du montage hydroponique, leurs racines sont rincées par 3 bains d’eau distillées successifs de 3 minutes chacun, avant d’être plongées dans la solution de culture de Rhizobiums avec agitation pendant 1h à 28°C. Des graines et plants témoins sont trempés dans le milieu de culture destinés aux Rhizobiums, non inoculé, et stérilisé.
Ainsi, dans un premier temps, 10 graines de pois chiches et 10 graines de lentilles sont disposés dans deux montages hydroponiques (1 pour chaque espèce) avec une solution nutritive dépourvue d’azote (Tableau 2). Après 3 semaines, les plantes subissent le protocole d’inoculation tardive décrit précédemment, et 10 nouvelles graines de chaque espèce subissent le protocole d’inoculation précoce, et sont placées dans 2 autres montages hydroponiques (1 pour chaque espèce) où la solution nutritive est dépourvue d’azote. Le taux de nodulation par bac hydroponique est suivi quotidiennement, une plante étant considérée comme présentant des nodules dès l’apparition d’un premier nodule visible à l'œil sur cette dernière.
B) Effet du changement de la source d'azote sur la dynamique de croissance et de développement des légumineuses à graines
1) Matériel végétal
L’expérience est menée sur les mêmes espèces et variétés de légumineuses que précédemment. En ce qui concerne la lentille, une variété plus récente a été ajoutée Chakkouf (homologuée en 2009) à la variété Bakria, plus ancienne. En ce qui concerne le Pois chiche, une variété plus récente a été ajoutée Arifi (homologuée en 2009) à la variété Fariahne, plus ancienne.
2) Conditions de culture et plan expérimental
Cette expérience est menée dans les mêmes conditions que précédemment. Les bacs hydroponiques (Figure 4) sont remplis avec la solution nutritive adéquate (cf. Résultats, III.A.1) carencée en azote ou non (Tableau 2), selon la modalité de chaque bac. Les plantes seront soumises à 4 traitements différents (Tableau 3).
Seize bacs hydroponiques sont disposés aléatoirement dans la chambre de culture (Figures 6 et 7). Chaque bac correspond à une combinaison des modalités de chaque traitement. Il y a 2 traitements se déclinant en 2 modalités chacun : le traitement azoté (carencé ou non-carencé en nitrate), l’inoculation des plants (inoculés ou non-inoculés). Les bacs contiennent 20 individus de la même espèce et de la même variété.
Tableau 3 - Description des traitements appliqués lors de l'expérience de modification de la source d'azote disponible aux légumineuses
Traitement Inoculation Apport de nitrate Mode de nutrition azotée associé
1 oui oui Absorption racinaire de nitrate
2 oui non Fixation symbiotique de N2
3 non oui Absorption racinaire de nitrate
4 non non Aucun - témoin négatif
Figure 6 - Plan expérimental mis en place
Figure 7 - Photographie de l'initiation de l'expérience de modification de la source d'azote disponible aux légumineuses
8 3) Protocole de modification de la source azotée
Dans un premier temps, tous les bacs hydroponiques contiennent de la solution nutritive carencée en NO3- (Figure 8, phase de facilitation de la nodulation). Dans un second temps, une
fois que tous les individus ayant subi l’inoculation précoce présentent au moins un nodule visible à œil nu, la solution nutritive de tous les bacs est remplacée par de la solution nutritive contenant du NO3- (Figure 8, phase d’exposition au nitrate). Dans un troisième temps, lorsque
l’exposition a effacé tout éventuel retard de croissance, les solutions nutritives sont de nouveau changées (Figure 8, phase de contexte azoté différencié). Les bacs correspondant à la modalité carencée du traitement azoté sont remplis avec de la solution nutritive carencée en NO3-. Ceux
correspondant à la modalité non-carencée du traitement azoté sont remplis avec la solution contenant du NO3-. Lors de ce changement de solution nutritive, les plantes qui ont subi une
inoculation précoce subissent une inoculation tardive, répétée chaque semaine lors du renouvellement des solutions nutritives.
Lors de l’initiation de la phase de différenciation du contexte azoté, quatre individus exposés à chaque combinaison de modalités sont prélevés et mesurés, de même une fois par semaine, pendant 4 semaines.
4) Variables mesurées
a) Paramètres de croissance et de de développement
La croissance et le développement des plants sont suivis par méthodes non destructives au cours de la phase d’exposition au nitrate. Ainsi, la hauteur de la tige principale et le nombre de feuilles émises par cette dernière sont relevés chaque semaine jusqu’à ce que les plants, inoculés ou non, ne constituent plus qu’une seule population homogène.
La réponse de la croissance des plantes à la modification du contexte azoté est évaluée par l’étude de paramètres mesurés : la hauteur de la tige principale (Namvar, Sharifi, 2011), la production de biomasse (masses aériennes fraîche et sèche), la surface foliaire (somme de l'indice de surface foliaire de chaque feuille d'un plant, par 3000C Portable area meter ; LI-COR Biosciences - Lincoln NE, Etats-Unis) (Singh, 1991). La matière sèche est obtenue après séchage à 60°C dans une étuve pendant 48h (Zancarini et al., 2012).
En parallèle, le développement des plants est suivi par comptage du nombre de feuilles émis par la tige principale. Lors du premier et du dernier relevé, le stade de développement est déterminé grâce à l’échelle BBCH (Bayer, BASF, Ciba-Geigy, Hoechst) destinée au pois (Lancashire et al., 1991). Pour ce faire, nous évaluons la maturité des fleurs et gousses présents sur les plants lors de ces relevés. Un stade de développement moyen est estimé en arrondissant la moyenne des échelons BBCH atteints par les plants à l'entier inférieur.
b) Azote total
Afin d’apprécier la nutrition azotée des plantes, nous déterminons, lors de chaque prélèvement, la teneur en azote total dans les organes aériens par la méthode Kjeldahl (Baethgen, Alley, 1989), permettant d'obtenir la teneur en azote total dans un échantillon de 1g de manière efficace. La phase de digestion du matériel végétal a été adaptée d’autres protocoles de dosages d’azote total (Houba et al., 2004 ; Novozamsky et al., 1983), moins toxiques selon le matériel disponible au laboratoire. Nous calculons ensuite la teneur en azote total dans les plantes entières sèches en mg d’azote/plante (par le produit entre la teneur en azote total obtenue précédemment (en mg/g) et la biomasse aérienne sèche).
Figure 8 - Schéma explicatif du déroulement de l'expérience de modification de la source d'azote disponible aux légumineuses testées
Figure 9 - Effet de la solution nutritive sur la production de biomasse et la teneur en azote total des légumineuses testées. (A) Production de biomasse aérienne sèche selon la solution testée (B) Teneur en azote total dans la partie aérienne des plants selon la solution testée
9 5) Analyse statistique
L’ensemble des tests statistiques sont réalisés à l’aide du logiciel R (R Core Team, 2017). Un test T de Student est appliqué aux matières sèches aériennes et aux teneurs en azote total des plantes cultivés dans les deux solutions nutritives testées, après vérification de la normalité de la distribution et de l'homogénéité des variances des variables comparées.
Afin de déterminer la date d’initiation de la phase de changement de source d'azote, il est nécessaire de montrer que l’ensemble des plants constitue une population homogène, ainsi, deux tests statistiques sont réalisés. Un test T de Student est réalisé sur la hauteur de la tige principale selon les deux modalités d’inoculation, après vérification de la normalité de la distribution de cette variable, et de l’homogénéité de sa variance. Ainsi qu’un test de Khi² sur le nombre de feuilles émis par la tige principale selon les deux modalités d’inoculation.
Par la suite, des ANOVA, dont le seuil de significativité est fixé à 5% sont réalisées afin d'expliquer chaque variable par les combinaisons de modalités de traitement azoté et de traitement d’inoculation, avec vérification de la normalité de distribution des résidus (test de Shapiro-Wilk sur les résidus), et de l’homogénéité des variances (test de Bartlett), afin de déterminer si les combinaisons de traitements ont un effet sur les variables de croissances mesurées. Enfin, des tests de Tukey sont réalisés grâce au package "agricolae" sur R (Mendiburu, 2017), afin de déterminer si des sous populations (correspondant à certaines modalités) sont distinguables dans la population échantillonnée.
Pour le nombre de feuilles sur la tige principale (variable disrète), l’effet discriminant des modalités est étudié grâce à un modèle linéaire généralisé. S’agissant de comptages, nous leur appliquerons la fonction de lien logarithme (erreurs de type Poisson). En ce qui concerne l'étude des teneurs en azote total, s'agissant de proportion, nous leur appliquerons la fonction de lien logit (erreurs de type binomiales). Un test de Tukey est ensuite appliqué grâce au package "multcomp" sur R (Hothorn et al., 2016), permettant d'appliquer un test de Tukey après la réalisation d'un modèle linéaire généralisé.
IV) Résultats
A) Mise au point de protocoles
1) Solution nutritive adaptée aux légumineuses
La masse de matière sèche aérienne produite est significativement plus importante chez les lentilles et pois chiches cultivés dans la solution décrite par Ghanem et al. (2011) que dans celle décrite par Huang et al. (1994) (Figure 9A), observation confirmée par le test T de Student (p-value = 9,89e-5 et 1,52e-7 pour la lentille et le pois chiche respectivement). De même, la teneur en azote total est significativement plus importante chez les individus cultivés dans la solution décrite par Ghanem et al. (2011) que pour ceux cultivés dans la soltion décrite par Huang et al. (1994) (Figure 9B), observation confirmée par le test T de Student (p-value = 6,63e-5 et 3,49e-12 pour la lentille et le pois chiche respectivement).
2) Protocoles d'inoculation
En ce qui concerne l’inoculation précoce (Figure 10A et 10C), les premières nodulations (Figure 11) surviennent 13 jours après l’inoculation pour la lentille, et après 20 jours pour le pois chiche. La nodulation est totale (taux de nodulation = 1) 16 jours après inoculation pour la lentille, et 27 jours après inoculation pour le pois chiche.
Figure 10 - Suivi de la nodulation des légumineuses testées après application des protocoles d'inoculation. (A) Suivi du taux de nodulation de lentilles ayant subi le protocole d'inoculation précoce (B) Suivi du taux de nodulation de lentilles ayant subi le protocole d'inoculation tardive (C) Suivi du taux de nodulation de pois chiches ayant subi le protocole d'inoculation précoce (D) Suivi du taux de nodulation de pois chiches ayant subi le protocole d'inoculation tardive
Figure 11 - Photographies de nodules obtenus avec les protocoles d'inoculation testés (observation à la loupe binoculaire), après 30 jours d'expérience. (A) Nodules obtenus sur lentille avec le protocole d'inoculation précoce (B) Nodules obtenus sur lentilles avec le protocole d'inoculation tardive (C) Nodules obtenus sur pois chiche avec le protocole d'inoculation précoce
10
surviennent 10 jours après l’inoculation des racines de lentilles, et 18 jours après l’inoculation des racines de pois chiche. La nodulation est totale 12 jours après inoculation pour la lentille, et 26 jours après inoculation pour le pois chiche.
B) Effet du changement de la source d'azote
1) Suivi des plants au cours de la phase de facilitation de la nodulation
Malgré la réussite du protocole d'inoculation lors de sa mise au point, les plants de pois chiche n'ont montré aucun signe de nodulation au cours de cette expérience. Dans la suite de ce rapport, les résultats et discussions seront présentés uniquement pour la lentille.
Pour les deux variétés de lentille, les premières nodulations surviennent 13 jours après le semis et l’inoculation précoce et la nodulation est totale (taux de nodulation = 1) dès 18 jours (Figure 12).
A la fin de cette phase, la hauteur des plants est significativement différente selon la modalité du traitement d’inoculation (T-test de Student, p-value = 3,05e-10), les plantes inoculées étant globalement plus hautes. De même pour le nombre de feuilles émises par la tige principale (Khi², p-value = 0,001), les plantes inoculées émettant globalement plus de feuilles.
2) Suivi des plants au cours de la phase d'exposition au nitrate
Après 14 jours d’exposition au nitrate, (34 jours après semis et inoculation), la hauteur des plants est significativement différente selon la modalité du traitement d’inoculation (T-test de Student : p-value < 0,001), les plants inoculés étant toujours globalement les plus hauts. En revanche, le nombre de feuilles émises par la tige principale n’est pas différent selon la modalité du traitement d’inoculation (Khi² : p-value = 0,02).
Après 28 jours d’exposition au nitrate (soit 48 jours après le semis), la hauteur des plants est identique qu’il y ait eu inoculation ou non (T-test de Student : p-value=0,36). Il en est de même pour le nombre de feuilles émis (Khi² : p-value = 0,28).
3) Dynamique de croissance et de développement au cours de la phase de changement de la source d'azote
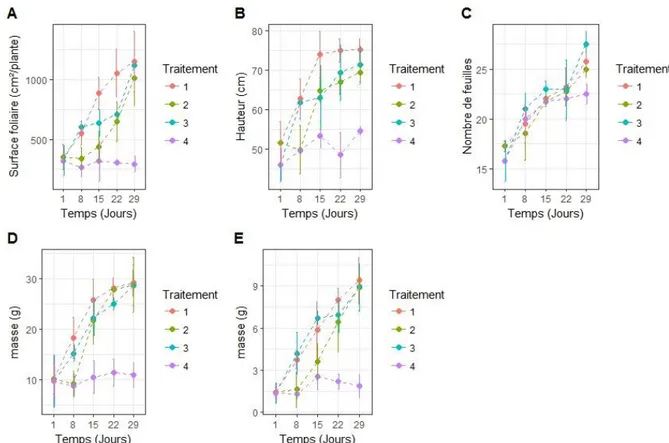
a) Surface foliaire
En ce qui concerne la variété Bakria (Figure 13A), au cours des 8 premiers jours de traitements, la surface foliaire des plants reste constante, et l'ANOVA ne montre aucune différence significative entre les traitements. Au 15ème jour de traitements, l'ANOVA montre des différences significatives entre les surfaces foliaires selon les traitements subis. Le test de Tukey montre une différence significative entre les plants disposant de NO3-, dont la surface
foliaire a fortement augmenté (+1000 cm².plante-1) et les autres, dont la surface foliaire est
restée stable. Au-delà, le test de Tukey montre une différence significative entre les plants disposant de NO3- (dont la surface foliaire est importante et stable), les plants susceptibles de
fixer le N2 (dont la surface foliaire augmente, sans égaler celle des plants disposant de NO3-),
et les plants dépourvus de toutes sources d'azote (dont la surface foliaire est restée constante). Pour la variété Chakkouf (Figure 14A), l'ANOVA montre une différence significative entre les traitements dès le 8ème jour de traitement et le test de Tukey montre une différence
significative entre les plants disposant de NO3- (dont la surface foliaire augmente) et les plants
qui en sont privés (dont la surface foliaire reste stable). Ensuite, le test de Tukey montre une différence significative entre les plants disposant de NO3- et inoculés (dont la surface foliaire
est plus importante), les plants privés de toutes sources d'azote (dont la surface foliaire est stable et faible), et les plants disposant de NO3- non inoculés et ceux susceptibles de fixer le N2 (dont
Figure 12 - Suivi de la nodulation des plants de lentille inoculés ou non au cours de la phase de facilitation de la nodulation. (A) Plants de la variété Bakria (B) Plants de la variété Chakkouf
Figure 13 – Suivi des paramètres de croissance et de développement au cours de la phase de modification de la source d'azote (variété Bakria). (A) Suivi de la surface foliaire (B) Suivi de la hauteur de la tige principale (C) Suivi du nombre de feuilles émises par la tige principale (D) Suivi de la production de biomasse aérienne fraîche (E) Suivi de la production de biomasse aérienne sèche
11
la surface foliaire est intermédiaire aux deux autres). En fin d'expérience, le test de Tukey montre que la surface foliaire des plants disposant de NO3- et de ceux susceptibles de fixer le
N2 est identique (environ 1100 cm².plante-1), alors que celle des plants privés de toutes sources
d'azote est restés stable et faible (environ 250 cm².plante-1).
b) Hauteur de la tige principale
La hauteur de la tige principale des plants de la variété Bakria (Figure 13B) est significativement différente selon le traitement subi (ANOVA) à partir du 8ème jour de traitements. Le test de Tukey montre que les plants disposant de NO3- et ceux susceptibles de
fixer le N2 évoluent de la même manière. Leur tige principale croît fortement jusqu'au 15ème
jour de traitement (+20cm), puis plus faiblement ensuite (+5cm). La hauteur de la tige principale des plants privés de toutes sources d'azote augmente peu tout au long du traitement (+5cm).
En ce qui concerne la variété Chakkouf (Figure 14B), l'ANOVA indique un effet significatif du traitement subi sur la hauteur de la tige principale dès le 8ème jour de traitement. A cette date, le test de Tukey montre une différence entre les plants disposant de NO3- (dont la
hauteur de la tige augmente) et plants qui en sont privés (dont la hauteur reste stable). A partir du 15ème jour, le test de Tukey montre que les plants disposants de NO3- et ceux susceptibles de
fixer le N2 évoluent de la même façon d'une part (tige plus grande : plus de 70cm) et que les
plants privés de toutes sources d'azote évoluent de manière différente d'autre part (hauteur de tige stable, et faible: 50cm).
c) Production de biomasse aérienne
La biomasse aérienne fraîche produite par les plants de la variété Bakria (Figure 13D) est significativement différente selon le traitement subi à partir du 8ème jour de traitements (ANOVA). Le test de Tukey montre que les plants disposant de NO3- et ayant été inoculés ont
produit plus de biomasse aérienne que les autres, dont la biomasse aérienne fraîche est restée constante. Au 15ème jour de traitements, le test de Tukey montre que la biomasse aérienne
fraîche des plants disposant de NO3- (60g) est significativement différente de celle des plants
privés de NO3-, qui est restée plutôt stable et faible. Au-delà du 22ème jour de traitements, le test
de Tukey montre des différences entre la biomasse aérienne fraîche des plants disposant de NO3- (stable autour de 60g), la biomasse aérienne fraîche des plants privés de toutes sources
d'azote (restée stable autour de 10g), et la biomasse aérienne fraîche des plants susceptibles de fixer le N2 (environ 30g), qui a augmenté, sans égaler celle des plants disposant de NO3-.
Pour la biomasse aérienne sèche des plants de cette variété (Figure 13E), l'ANOVA ne montre aucune différence significative entre les traitements jusqu'au 8ème jour de traitements. Au 15ème jour de traitements, l'ANOVA est significative, et le test de Tukey montre des
différences significatives entre les plants disposant de NO3- (dont la masse sèche augmente :
+7g), et les plants qui en sont privés (dont la masse sèche reste constante : environ 2,5g). Au-delà de cette date, le test de Tukey indique une différence significative entre la biomasse aérienne sèche des plants disposant de NO3- (qui augmente et atteint 20g en fin d'expérience),
la biomasse les plants privés de toutes sources d'azote (constante, faible: 2,5g), et les plants susceptibles de fixer le N2 dont la production de biomasse aérienne sèche est intermédiaire:
environ 8g).
La biomasse aérienne fraîche des plants de la variété Chakkouf (Figure 14D) est significativement différente selon le traitement subi à partir du 8ème jour de traitements (ANOVA). A cette date, le test de Tukey montre une différence significative entre les plants
Figure 14 – Suivi des paramètres de croissance et de développement au cours de la phase de modification de la source d'azote (variété Chakkouf). (A) Suivi de la surface foliaire (B) Suivi de la hauteur de la tige principale (C) Suivi du nombre de feuilles émises par la tige principale (D) Suivi de la production de biomasse aérienne fraîche (E) Suivi de la production de biomasse aérienne sèche
Figure 15 – Suivi de la teneur en azote total des plants de lentille au cours de la phase de modification de la source d'azote. (A) Pour la variété Bakria (B) Pour la variété Chakkouf
12
disposant de NO3- (dont la biomasse aérienne fraîche augmente atteint 16g) et ceux qui en sont
privés (dont la biomasse aérienne fraîche n'augmente pas). A partir du 15ème jour de traitements,
le test de Tukey indique que les biomasses aériennes fraîches des plants disposant de NO3- et
de ceux susceptibles de fixer le N2 ne sont pas significativement différentes entre elles (masses
élevées, supérieures à 20g, puis proches de 30g en fin d'expérience), mais sont significativement différentes de la biomasse aérienne fraîche des plants privés de toutes sources d'azote (restée constante tout au long du traitement, autour de 10g).
Pour la biomasse aérienne sèche des plants de cette variété (Figue 11E), l'ANOVA montre un effet significatif du traitement dès le 8ème jour d'expérience. A cette date, le test de Tukey montre une différence significative entre les plants disposant de NO3- (dont la biomasse
aérienne sèche augmente : +3g), et les plants qui en sont privés (dont la biomasse aérienne reste stable : 1,5g). A partir du 22ème jour de traitements, le test de Tukey montre que les biomasses
aériennes sèches des plants disposant de NO3- et de ceux susceptibles de fixer le N2 ne sont pas
significativement différentes entre elles (masses élevées, supérieures à 6g, puis d'environ 9g en fin d'expérience), mais sont significativement différentes de la biomasse aérienne sèche des plants privés de toutes sources d'azote (restée constante et faible).
d) Nombre de feuilles et stade de développement
Quelle que soit la variété, le nombre de feuilles émises par la tige principales des plants (Figures 13C et 14C), augmente de manière constante et similaire quel que soit le traitement subi (modèle linéaire généralisé non significatif), passant d'environ 17 feuilles en moyenne au début des traitements à environ 26 en fin d'expérience pour la variété Bakria, et à environ 26 feuilles pour la variété Chakkouf. En fin d'expérience, le modèle linéaire généralisé montre une différence significative entre les traitements, et le test de Tukey indique que les plants privés de toutes sources d'azote enregistrent un plus faible nombre de feuilles émises (23 pour Bakria et 22 pour Chakkouf).
En ce qui concerne le stade de développement atteint en fin d'expérience (Tableau 4), quelle que soit la variété, l'échelon BBCH atteint par les plants disposant de nitrate et par ceux susceptibles de fixer l'azote atmosphérique est le même (échelon 75, soit: 50% des gousses ont atteint leur longueur finale et les grains sont gonflés). En revanche, les plants privés de toutes sources d'azote présentent un retard, atteignant l'échelon 73 (soit : 30% des gousses ont atteint leur longueur finale et les grains sont gonflés) pour la variété Bakria, et l'échelon 65 (soit: 50% de fleurs ouvertes et peu de gousses formées) pour la variété Chakkouf.
4) Teneur en azote total
Au début de la phase de traitements, quelle que soit la variété, le modèle linéaire généralisé ne montre pas de différences significatives entre les teneurs en azote total des plants subissant les différents traitements (Figure 15). En ce qui concerne la variété Bakria (Figure 15A), le modèle linéaire généralisé expliquant la teneur en azote total des plants par les traitements subis est significatif à partir du 8ème jour de traitements. Le test de Tukey montre des différences significatives entre les plants disposant de NO3- (traitements 1 et 3) (dont la teneur en azote
total est d'environ 2,75 mg.g-1 de matière sèche), les plants susceptibles de fixer le N2
atmosphérique (traitement 2) (dont la teneur en azote total est constante, à environ 2,3 mg.g-1 de matière sèche), et les plants privés de toutes sources d'azote (traitement 4) (dont la teneur en azote total a fortement baissé à près de 1 mg.g-1). Entre le 8ème et le 22ème jour de traitements,
13
manière constante, passant de 2,75 à 3,5 mg.g-1 de matière sèche. La teneur en azote total des plants susceptibles de fixer le N2 est restée constante, autour de 2,75 mg.g-1 de matière sèche.
La teneur en azote total des plants privés de toutes sources d'azote a augmenté, atteignant environ 1,8 mg.g-1 de matière sèche. Le test de Tukey montre une différence significative entre les plants disposant de NO3-, ceux susceptibles de fixer le N2 et ceux privés de toutes sources
d'azote. Au terme de l'expérience, le test de Tukey montre des différences entre : les plants disposant de NO3-, dont la teneur en azote total a encore augmenté (atteignant environ 2,75
mg.g-1), ceux susceptibles de fixer le N2, dont la teneur en azote total a fortement augmenté
(+0,75 mg.g-1, atteignant 3 mg.g-1 de matière sèche), et ceux privés de toutes sources d'azote,
dont la teneur en azote total est restée constante.
Pour la variété Chakkouf, initialement, la teneur en azote total (Figure 15B) est d’environ 1,25 mg.g-1, puis augmente fortement à près de 3 mg.g-1 au cours des 8 premiers jours de la
phase au sein des plants disposant de NO3- et ayant été inoculés (traitement 1). Les plants
disposant de NO3- mais n'ayant pas été inoculés (traitement 3) présentent une teneur en azote
total qui augmente, légèrement moins, atteignant un peu plus 2,5 mg.g-1. Les plants privés de
NO3- mais ayant été inoculés (traitement 2) voient leur teneur en azote augmenter pour atteindre
2,25 mg.g-1 environ. Enfin, les plants privés de toutes sources d'azote (traitement 4) ont une teneur en azote total qui augmente également pour atteindre 2 mg.g-1. Quel que soit le traitement
subi, la teneur en azote total reste constante entre le 8ème et le 15ème jour de traitements, avant de raugmenter, passant à 3,5 mg.g-1 dans les plants disposant de NO3- et inoculés (traitement
1), à 3,4 mg.g-1 pour les plants susceptibles de fixer le N
2 (traitement 2), à 2,5 mg.g-1 pour les
plants dépourvus de NO3- mais ayant été inoculés, et un peu plus de 2 mg.g-1 pour les plants
privés de toute source d'azote. Au terme de l'expérience, les plants disposant de NO3- (traitement
1 et 3) atteignent une teneur en azote total d'environ 3,6%, ceux qui sont susceptibles de fixer le NO3- ont une teneur en azote total d'environ 3 mg.g-1, enfin, les plants privés de toutes formes
d'azote ont une teneur en azote total moindre, d'environ 2,5 mg.g-1. Quelle que soit la date, les
modèles linéaires généralisés montrent que le traitement a un effet sur cette teneur en azote total. Le test de Tukey montre que pour les deux variétés, la teneur en azote total des plants disposant de NO3- et ayant été inoculés est significativement supérieure à celle des plants
disposant de NO3- non inoculés, elle-même significativement supérieure à celle des plants
susceptibles de fixer le N2, elle-même significativement supérieure à celle des plants privés de
toutes sources d'azote.
V) Discussion
A) Mise au point de protocoles
1) Solution nutritive adaptée aux légumineuses
La solution nutritive décrite par Ghanem et al. (2011) permet une meilleure production de biomasse aérienne, et une meilleure accumulation d’azote dans les organes aériens. Le changement de contexte azoté devant être le seul facteur de stress, et les autres conditions environnementales devant être optimales, nous privilégierons cette solution nutritive dans la suite de nos expériences. De plus, nous disposons également de cette même solution ajustée à une teneur en azote minimale (tout en respectant les impératifs d’égalité des charges ioniques) (Tableau 2).
2) Protocoles d'inoculation
14
quel que soit le type d’inoculation (précoce ou tardive) (Figure 10). Les protocoles d’inoculation que nous avons testés sont donc efficaces.
Notons toutefois que l’inoculation tardive aboutit à une nodulation totale (taux de nodulation=1) plus rapidement que l’inoculation précoce (4 jours de moins pour la lentille, 1 jour de moins pour le pois chiche) (Figure 10), que la lentille commence à présenter des nodules avant le pois chiche (7 à 8 jours avant) et atteint une nodulation totale avant ce dernier (11 à 17 jours avant). Les changements de solutions nutritives n’auront donc pas lieu en même temps pour la lentille et le pois chiche dans la suite des expériences.
B) Effets du changement de la source d'azote sur la dynamique de croissance et de développement des légumineuses
1) La fixation symbiotique aboutit-elle au même état final de croissance et de développement que l'absorption racinaire ?
Les plants cultivés en condition permettant la fixation symbiotique du N2 présentent donc
une croissance considérable, voire identique à celle des plants disposant de NO3-, en fin
d'expérience, toujours significativement différente de celle des plants privés de toutes sources d'azote. Ceci suggère que la fixation symbiotique du diazote a bien été réactivée après la suppression du NO3-.
Après l’arrêt des apports de NO3-, la fixation symbiotique du N2 atmosphérique permet
d’atteindre le même stade de développement que l’absorption racinaire du NO3- (selon l’échelle
BBCH utilisée) en fin d’expérience (Tableau 4). De même, le recours à l’un ou à l’autre des phénomènes n’influence pas la phénologie des plants (Figures 13C et 14C).
En revanche, l'état final de croissance atteint par les plants susceptibles de fixer le N2
varie selon la variété. Dans le cas de la variété Chakkouf, le mode de nutrition azotée est sans effet sur l'état de croissance final des plants (Figure 14), donc après l'arrêt de l'apport de NO3-,
la fixation symbiotique du N2 permet d'atteindre le même état de croissance que l'absorption
racinaire de NO3-. Ce n'est pas le cas pour la variété Bakria (Figure 13). Hormis pour la hauteur
(Figure 13B), la fixation symbiotique du N2 ne permet pas d'atteindre le même état de croissance
que l'absorption racinaire de NO3-. En revanche, les états de croissance atteints pour chaque
variable mesurée est significativement différent de ceux atteint par les plants privés de toutes sources d'azote. Donc dans le cas de la variété Bakria, la fixation symbiotique du N2, permet
une croissance significative, mais qui n'atteint pas le niveau de celle de l'absorption racinaire de NO3-.
Ainsi, après une fertilisation azotée précoce, la fixation symbiotique du N2 reprend et peut
aboutir à des états de croissance et de développement similaires à ceux atteints avec une fertilisation continue. Contrairement à ce qui a été avancé par (McKenzie et al., 2001), l'application précoce de fertilisant azoté est bénéfique. Effectivement, alors que la fixation symbiotique, en l'absence de fertilisation azotée précoce, ne permet pas d'atteindre une même croissance que la fertilisation azotée (Mahon, Child, 1979 ; Jensen, 1986), elle le permet (d'après nos résultats) en cas de fertilisation azotée précoce. Ceci est en accord avec ce qui est proposé par (Rigaud, 1981 ; Fujikake et al., 2002).
2) Le changement de source d'azote induit-il des modifications de la dynamique de croissance et de développement ?
Au début de la phase de modification de la source d'azote, les plants ne présentent statistiquement aucune différence de croissance ou de développement et constituent une population homogène, quelle que soit la variable de croissance ou de développement étudiée