UNIVERSITE CADI AYYAD
FACULTE DE MEDECINE ET DE PHARMACIE
MARRAKECH
DOYEN HONORAIRE
: Pr. MEHADJI Badie-azzamann
VICE DOYENS HONORAIRES
: Pr. FEDOUACH Sabah
: Pr. AIT BEN ALI Said
: Pr. BOURAS Najib
ADMINISTRATION
DOYEN
: Pr. Abdelhaq ALAOUI YAZIDI
VICE DOYEN A LA RECHERCHE ET
COOPERATION
VICE DOYEN AUX AFFAIRES
PEDAGOGIQUES
: Pr. Ahmed OUSEHAL
: Pr. Abdelmounaim ABOUSSAD
PROFESSEURS D’ENSEIGNEMENT SUPERIEUR
Pr. ABBASSI
Hassan
Gynécologie-Obstétrique
Pr. ABOUSSAD
Abdelmounaim
Pédiatrie
Pr. AIT BEN ALI
Said
Neurochirurgie
Pr. ALAOUI YAZIDI
Abdelhaq
Pneumo-phtisiologie
Pr. BELAABIDIA
Badia
Anatomie-Pathologique
Pr. BOUSKRAOUI
Mohamed
Pédiatrie
Pr. EL HASSANI
Selma
Rhumatologie
Pr. EL IDRISSI DAFALI
My abdelhamid Chirurgie
Générale
Pr. ESSADKI
Omar
Radiologie
Pr. FIKRI
Tarik
Traumatologie
Pr. KISSANI
Najib
Neurologie
Pr. RAJI
Abdelaziz
Oto-Rhino-Laryngologie
Pr. SBIHI
Mohamed
Pédiatrie
Pr. SOUMMANI
Abderraouf
Gynécologie-Obstétrique
PROFESSEURS AGREGES
Pr. ABOUFALLAH
Abderrahim
Gynécologie – Obstétrique
Pr. AMAL
Said
Dermatologie
Pr. AIT SAB
Imane
Pédiatrie
Pr. ASRI
Fatima
Psychiatrie
Pr. ASMOUKI
Hamid
Gynécologie – Obstétrique
Pr. BEN ELKHAIAT
Ridouan
Chirurgie – Générale
Pr. BOUMZEBRA
Drissi
Chirurgie Cardiovasculaire
Pr. CHABAA
Leila
Biochimie
Pr. ESSAADOUNI
Lamiaa
Médecine Interne
Pr. FINECH
Benasser
Chirurgie – Générale
Pr. GHANNANE
Houssine
Neurochirurgie
Pr. GUENNOUN
Nezha
Gastro – Entérologie
Pr. LATIFI
Mohamed
Traumato – Orthopédie
Pr. LOUZI
Abdelouahed
Chirurgie générale
Pr. MAHMAL
Lahoucine
Hématologie clinique
Pr. MANSOURI
Nadia
Chirurgie maxillo-faciale Et stomatologie
Pr. MOUDOUNI
Said mohamed
Urologie
Pr. MOUTAOUAKIL
Abdeljalil
Ophtalmologie
Pr. SAMKAOUI
Mohamed
Anesthésie-Réanimation
Pr. SARF
Ismail
Urologie
Pr. YOUNOUS
Saïd
Anesthésie-Réanimation
Pr. AKHDARI
Nadia
Dermatologie
Pr. TAHRI JOUTEH HASSANI Ali
Radiothérapie
Pr. SAIDI
Halim
Traumato - Orthopédie
PROFESSEURS ASSISTANTS
Pr. ADERDOUR
Lahcen
Oto-Rhino-Laryngologie
Pr. ADMOU
Brahim
Immunologie
Pr. AMINE
Mohamed
Epidémiologie - Clinique
Pr. ATTAR
Hicham
Anatomie - Pathologique
Pr. BAHA ALI
Tarik
Ophtalmologie
Pr. BOURROUS
Monir
Pédiatrie
Pr. CHERIF IDRISSI EL
GANOUNI
Najat Radiologie
Pr. DAHAMI
Zakaria
Urologie
Pr. DIOURI AYAD
Afaf
Endocrinologie et maladies métaboliques
Pr. EL ADIB
Ahmed rhassane
Anesthésie-Réanimation
Pr. EL FEZZAZI
Redouane
Chirurgie - Pédiatrique
Pr. EL HATTAOUI
Mustapha
Cardiologie
Pr. EL HOUDZI
Jamila
Pédiatrie
Pr. ETTALBI
Saloua
Chirurgie - Réparatrice
Pr. HERRAG
Mohamed
Pneumo-Phtisiologie
Pr. KHALLOUKI
Mohammed
Anesthésie-Réanimation
Pr. LAOUAD
Inas
Néphrologie
Pr. LMEJJATTI
Mohamed
Neurochirurgie
Pr. MAHMAL
Aziz
Pneumo - Phtisiologie
Pr. MANOUDI
Fatiha
Psychiatrie
Pr. NEJMI
Hicham
Anesthésie - Réanimation
Pr. OULAD SAIAD
Mohamed
Chirurgie - Pédiatrique
Pr. TASSI
Nora
Maladies - Infectieuses
P
……… ………
INTRODUCTION
1………
MATERIEL ET METHODES
3I. Recrutement des malades……… 4
II. Méthodologie de travail……… 4
III. Base de données……… 4
………
RESULTATS
5 I. Données épidémiologiques……… 61- Période et fréquence d'inclusion……… 6
2- Age ……… 7 3- Niveau socio-économique……… 7 4- Origine géographique……… 8 5- Antécédents……… 8 5.1- Gestité et parité……….. 8 5.2- Avortement spontané ……… 8 5.3- Grossesse gémellaire……… 9 5.4- Age à la ménarche………… 9 5.5- Ménopause……… 9 5.6- Contraception oestro-progestative……… 10 5.7- Antécédent de cancer……… 10
5.8- Hystérectomie et ligature tubaire. ……… 10
5.9- Tabagisme……… 10
5.10-Autres antécédents……… 10
II- Données cliniques……… 11
1- Symptômes……… 11
2- Circonstances de découverte ……… 12
4- délai de diagnostic……… 15
III- Données paracliniques……… 15
1- Echographie……… 15 2- Tomodensitométrie……… 16 3- Radiographie standard……… 16 4- Marqueurs tumoraux……… 16 5- Bilan préopératoire……… 17 IV- Le traitement ……… 17 1- Traitement Chirurgical……… 17 2- La chimiothérapie……… 19 V- Evolution……… 19
VI- données anatomopathologiques……… 19
1- Type histologique……… 19
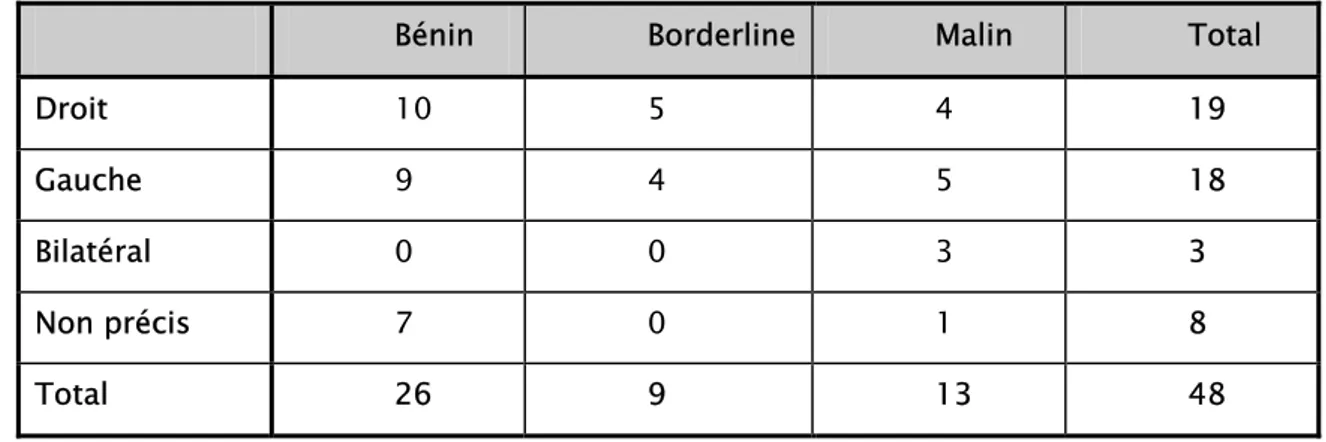
2- Latéralité……… 20
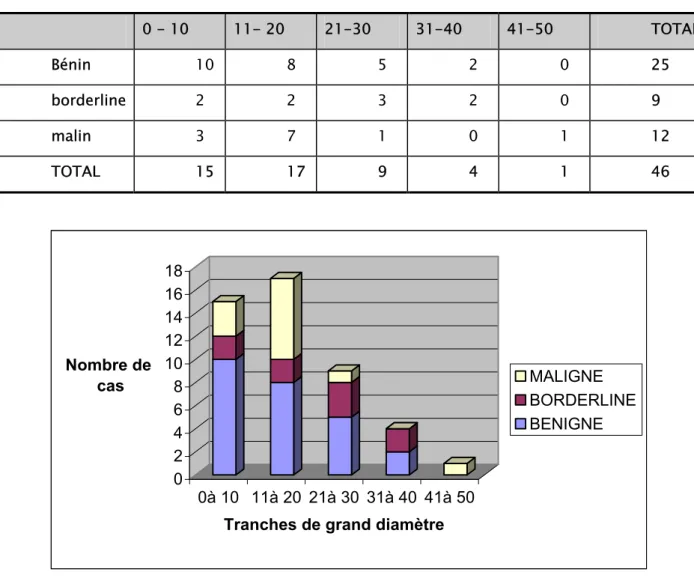
3- Taille tumoral……… 20
4- Nature kystique ou solidokystique……… 21
5- Caractère multiloculaire……… 22
6- Paroi……… 22
7- Présence de végétations……… 23
8-Contenu ……… 23
9- Nodule pariétal……… 24
10- Type intestinal ou endocervical……… 24
11- Stratification……… 24
12- Architecture……… 25
13- Présence d'autres composantes tumorales……… 26
14- Grade histologique……… 26
15- Stade de la FIGO……… 27
……… ICONOGRAPHIE 29 ………
DISCUSSION
37 I- Données épidémiologiques……… 38 1- Incidence et fréquence ……… 38 2- Age……… 393-Antécédents et les facteurs de risque. ……… 40
3.1- Facteurs reproductives et hormonaux……… 40
3.2- Le tabagisme……… 42
3.3- Facteurs constitutionnels……… 43
3.4- Facteurs médicaux……… 45
II- Pathogénie……… 45
III- Diagnostic clinique……… 47
1- Symptômes……… 47
2- Examen Physique……… 47
3- Délai diagnostique ……… 49
IV- Diagnostic paraclinique……… 49
1- L'imagerie……… 49
1.1- L'échographie……… 49
1.2- Le scanner……… 50
1.3- L'imagerie par résonance magnétique ……… 51
2- La biologie ……… 51
2.1- Les marqueurs tumoraux……… 51
2.2-L'hémogramme……… 55
3- Bilan d'exclusion d'une tumeur primitive extra-ovariennne……… 55
V- Prise en charge thérapeutique……… 55
1- Moyen……… 56
1.2- Chimiothérapie……… 57 1.3- Radiothérapie ……… 58 2- Indications thérapeutique……… 59 2.1- Tumeurs bénignes……… 59 2.2- Tumeurs borderlines……… 59 2.3- Tumeurs malignes……… 60 VI- Pronostic……… 61
1- Tumeurs mucineuses borderlines……… 61
2- Tumeurs mucineuses malignes……… 62
VII- Etude anatomopathologique……… 64
1- Classification de l'OMS……… 64
2- Autres classifications et controverses……… 69
2.1- Carcinome mucineux non invasif ……… 69
2.2- Carcinome mucineux micro-invasif……… 70
3- Nodules muraux……… 72 4- Examen Extemporané……… 73 5- Diagnostic différentiel……… 74 6- Le pseudomyxome péritonéal……… 77 ………
CONCLUSION
82 …… ………ANNEXES
85RESUMES
BIBLIOGRAPHIE
I
Les tumeurs mucineuses de l'ovaire sont des tumeurs épithéliales. Elle sont caractérisées par une prolifération de cellules mucosécrétantes rappelant l'épithélium endocervical ou intestinal. Elles sont classées en tumeurs bénignes, borderlines et malignes.
La grande majorité d'entre elles sont bénignes (80%).Dix pour cent de ces tumeurs sont borderlines. Dix pour cent sont malignes. Les tumeurs mucineuses malignes de l'ovaire, partagent avec les autres tumeurs épithéliales, un pronostic sombre dû au diagnostic, le plus souvent tardif.
Les tumeurs mucineuses ovariennes se distinguent par des facteurs de risque, une pathogénie, des critères diagnostiques, une thérapeutique ainsi qu'un pronostic différents par rapport aux autres tumeurs épithéliales.
Notre étude rétrospective a pour objectif d'étudier les aspects épidémiologiques, cliniques, thérapeutiques et anatomopathologiques des tumeurs mucineuses de l'ovaire diagnostiquées au service d'anatomie pathologique du CHU MOHAMMED VI de Marrakech.
M
M
A
A
T
T
E
E
R
R
I
I
E
E
L
L
&
&
M
M
E
E
T
T
H
H
O
O
D
D
E
E
S
S
I- Recrutement des malades
Notre étude est descriptive et rétrospective.
La durée de l'étude est de 7 ans: de janvier 2001 à décembre 2007.
Le diagnostic positif était confirmé au service d'anatomie pathologique du CHU MOHAMMED VI de Marrakech.
II- Méthodologie de travail
Cette étude rétrospective a porté sur 48 cas.
Elle a inclue toutes les tumeurs mucineuses de l'ovaire, dont le diagnostic anatomopathologique a été posé au service d'anatomie pathologique du CHU MOHAMMED VI à marrakech.
Nous avons exclu 3 cas de tumeurs mucineuses malignes car l'origine ovarienne de la tumeur n'a pas pu être confirmée.
Différents paramètres ont été exploités à partir des comptes rendus d'anatomie pathologique, et des dossiers médicaux du service de gynécologie obstétrique du CHU MOHAMMED VI de Marrakech.
Une fiche d'exploitation préétablie a permis le recueil de données épidémiologiques, cliniques, paracliniques, thérapeutiques et anatomopathologiques.
III- Base de données:
La base de données est résumée dans une fiche d'exploitation (voir annexes).
Les critères diagnostiques utilisés sont ceux de l'OMS (voir chapitre classification de l'OMS)
La stadification de la FIGO (voir annexes), a été choisie afin de faciliter la comparaison avec les autres études.
R
I- Données épidémiologiques:
Notre série était constituée de 48 patientes ayant des tumeurs mucineuses ovariennes.
Quarante trois patientes ont été opérées au CHU et 5 ont été opérées dans des cliniques privées.
Dix neuf dossiers médicaux ont été trouvés aux archives du service de gynécologie obstétrique.
1. Période et fréquence :
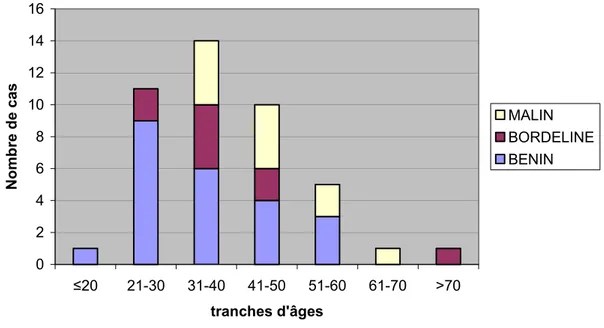
La période d'étude était de 7 ans (de janvier 2001 à décembre 2007) Le recrutement annuel moyen était de 6,85 patientes (figure 1)
0 2 4 6 8 10 12 14 2001 2002 2003 2004 2005 2006 2007 Les années nom bre de c a s MALIN BORDERLINE BENIN
Figure 1: Répartition des cas selon les années
Le recrutement annuel différait selon les années avec un maximum pendant l'année 2006. Durant cette année, 12 cas étaient diagnostiqués.
2- Age
Les données sur l'âge étaient disponibles chez 43 cas, soit dans les dossiers médicaux, soit dans les renseignements cliniques des comptes rendus anatomopathologiques.
L'âge moyen observé au moment du diagnostic était de:
- 36 ans avec des extrêmes allant de 20 à 60 ans pour les tumeurs bénignes. - 38 ans avec des extrêmes allant de 24 à 82 ans pour les tumeurs borderlines. - 42 ans avec des extrêmes allant de 35 à 66 ans pour les tumeurs malignes.
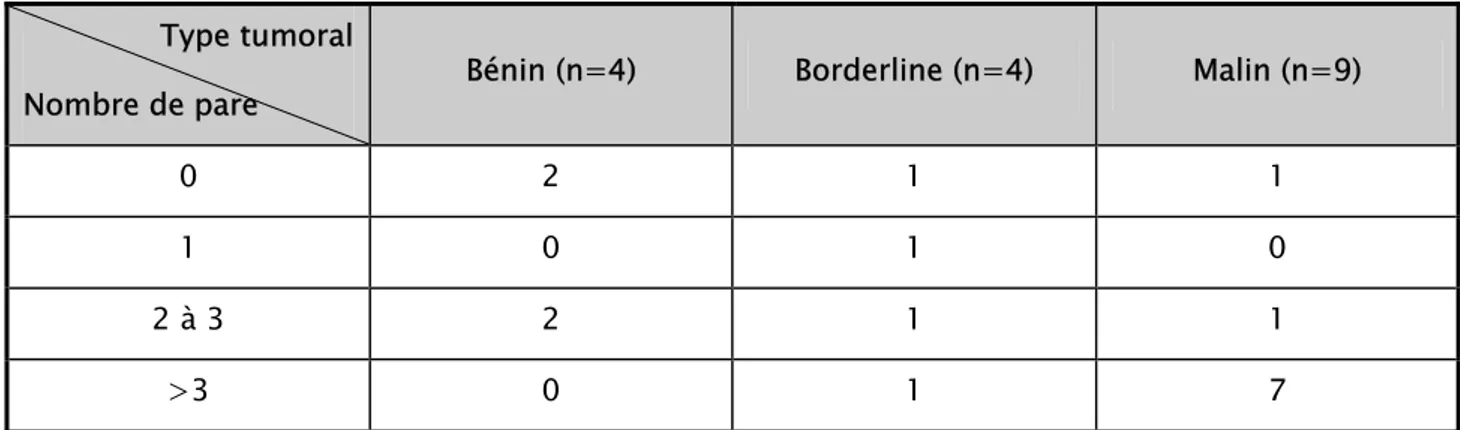
0 2 4 6 8 10 12 14 16 ≤20 21-30 31-40 41-50 51-60 61-70 >70 tranches d'âges No mb re d e cas MALIN BORDELINE BENIN
Figure 2: Répartition des patientes selon les tranches d'âges
3- Niveau socio-économique:
Toutes nos patientes avaient un niveau socio-économique bas sans aucune prise en charge par un organisme de sécurité sociale.
4- Origine géographique:
La plupart des patientes était originaire de Marrakech (15/19). Les autres patientes étaient originaires des provinces de Safi, d'Essaouira, et de Ouarzazate.
5- Antécédents:
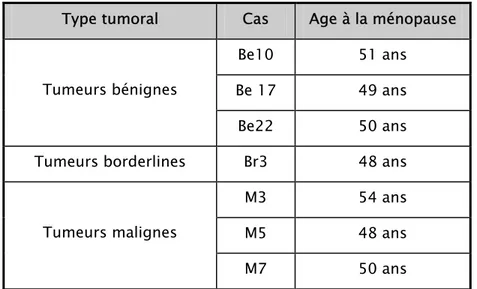
5.1Gestité et parité:
Les données sur ces deux paramètres étaient disponibles chez 17 cas.
Les patientes qui présentaient des cystadénocarcinomes sont multipares dans 8/9 cas. Une patiente était nulligeste et était suivie pour infertilité primaire pendant 8 ans.
Quatre patientes ayant des tumeurs mucineuses borderlines: deux étaient multipares, 1 était primipare et 1 était nulligeste.
Quatre patientes ayant des tumeurs mucineuses bénignes: deux étaient multipares, et 2 étaient nulligestes.
Tableau I : Parité des patientes:
Type tumoral
Nombre de pare Bénin (n=4) Borderline (n=4) Malin (n=9)
0 2 1 1 1 0 1 0
2 à 3 2 1 1
>3 0 1 7
5.2 Avortement spontané:
Un cas de cystadénocarcinome mucineux avait un antécédent personnel de 3 avortements spontanés.
5.3Grossesse gémellaire :
Aucune grossesse gémellaire n'a été signalée dans notre série.
5.4 Âge à la ménarche:
L'âge moyen à la ménarche était soit : -13,5 ans pour les tumeurs malignes. -14 ans pour les tumeurs borderlines. -13 ans pour les tumeurs bénignes.
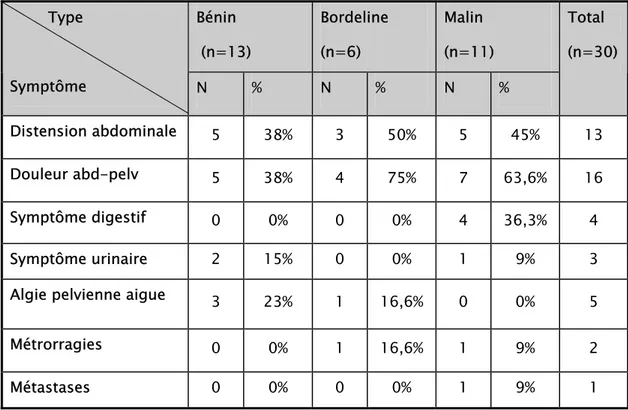
5.5 Ménopause:
Sept patientes (17,5%) étaient ménopausées soit: - 3 cas de tumeurs malignes
- 1cas de tumeur borderline. - 3 cas de tumeurs bénignes.
L'âge à la ménopause de ces patientes est résumé dans le tableau 2.
Tableau II: Age à la ménopause.
Type tumoral Cas Age à la ménopause
Be10 51 ans
Be 17 49 ans Tumeurs bénignes
Be22 50 ans
Tumeurs borderlines Br3 48 ans
M3 54 ans
M5 48 ans
Tumeurs malignes
M7 50 ans
M: observation de tumeur maligne; Br: observation de tumeur Borderline; Be: observation de tumeur bénigne.
5.6 La contraception oestro-progestative :
Les données sur l'antécédent de prise de contraception oestro-progestative étaient disponibles chez 15 cas.
Trois patientes soit (20%) avaient un antécédent d'utilisation de contraception oestroprogestive.
5.7 Antécédent de cancer:
La recherche des antécédents personnels et familiaux de cancers du sein, de l'ovaire, du colon, de l'endomètre et de la prostate était négative.
Aucune patiente, n'avait un antécédent de cancer biliaire, pancréatique, ou gastrique.
5.8 Hystérectomie et ligature tubaire:
Une patiente ayant une tumeur bénigne avait un antécédent d'hystérectomie. Aucune patiente n'avait un antécédent de ligature tubaire.
5.8 Tabagisme
Aucune de nos patientes n'avait un antécédent de tabagisme actif. La notion de tabagisme passif n'a pas été notée dans les dossiers médicaux.
5.9 Autres antécédents:
Certains cas de notre série présentaient d'autres antécédents: - un diabète chez une patiente
- un rhumatisme articulaire aigue sans atteinte cardiaque chez une patiente. - Une insuffisance rénale chronique chez une patiente.
II- Données cliniques
1. Symptômes
Les symptômes cliniques n'ont pas pu être précisés Chez 15 patientes.
Chez les autres patientes, la répartition des symptômes dépendait du type anatomopathologique (Tableau 3)
La douleur abdomino-pelvienne était le symptôme le plus retrouvé dans notre série (72%), suivie de la distension abdominale (54%).
Par ailleurs, 7 cas soit (72%) de tumeurs malignes présentaient plusieurs symptômes en même temps. Des signes digestifs étaient associés soit à une distension abdominale ou à des douleurs abdominales chez 4 patientes.
Les signes digestifs étaient un syndrome occlusif chez 2 cas, et une constipation récente chez 2 autres patientes.
La pollakiurie était le signe urinaire présent chez 2 cas de tumeurs bénignes et 1 cas de tumeur maligne.
Les algies pelviennes aigues, étaient dues chez deux de nos cas à une torsion d'annexe, et chez une autre patiente à une rupture tumorale. Ces trois patientes avaient des tumeurs bénignes.
Tableau III : Répartition des symptômes selon le type tumoral.
Abd-pelv: abdomino-pelvienne , N: Nombre de cas.
2-Circonstances de découverte:
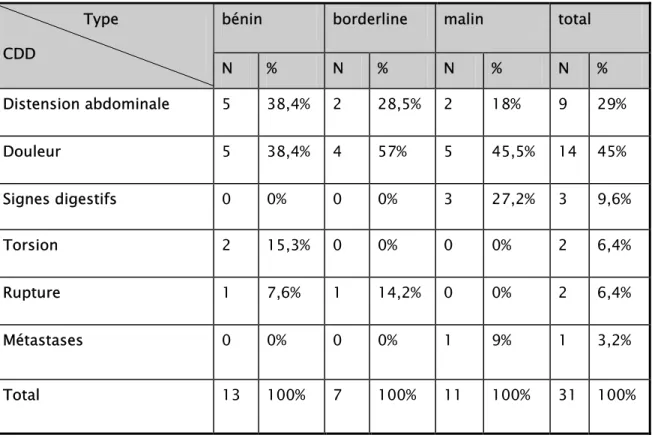
Les circonstances de découverte (CDD) différaient selon le type tumoral. Ainsi, les phénomènes aigus, telles la torsion et la rupture étaient observés surtout en cas de tumeurs bénignes.
La douleur était la circonstance de découverte la plus fréquemment rencontrée en cas de tumeurs borderlines ou malignes avec respectivement 4 cas, soit (57%) et 5 cas, soit (38%).
La répartition des circonstances de découverte selon le type tumoral est détaillée dans le tableau 4, et les figures (3-4-5)
Bénin (n=13) Bordeline (n=6) Malin (n=11) Type Symptôme N % N % N % Total (n=30) Distension abdominale 5 38% 3 50% 5 45% 13 Douleur abd-pelv 5 38% 4 75% 7 63,6% 16 Symptôme digestif 0 0% 0 0% 4 36,3% 4 Symptôme urinaire 2 15% 0 0% 1 9% 3
Algie pelvienne aigue 3 23% 1 16,6% 0 0% 5
Métrorragies 0 0% 1 16,6% 1 9% 2
Tableau IV: Circonstances de découverte selon le type tumoral
bénin borderline malin total Type CDD N % N % N % N % Distension abdominale 5 38,4% 2 28,5% 2 18% 9 29% Douleur 5 38,4% 4 57% 5 45,5% 14 45% Signes digestifs 0 0% 0 0% 3 27,2% 3 9,6% Torsion 2 15,3% 0 0% 0 0% 2 6,4% Rupture 1 7,6% 1 14,2% 0 0% 2 6,4% Métastases 0 0% 0 0% 1 9% 1 3,2% Total 13 100% 7 100% 11 100% 31 100% 39% 38% 0% 15% 8% 0%
distension abdominale douleur signes digestifs torsion rupture
Figure 4: Répartitions des Circonstances de découverte des tumeurs borderlines. 18% 46% 27% 0% 0% 9%
distension abdominale douleur signes digestifs
torsion rupture métastase
Figure 5:Répartition des Circonstances de découverte des tumeurs malignes
3-Examen physique:
Il a révélé des anomalies chez toutes nos patientes (100% des patientes dont on dispose de dossier médical (19 cas)).
A l'examen abdominal, une masse abdomino-pelvienne a été palpée chez 18 patientes (94%).
Les touchés pelviens ont révélé des anomalies chez toutes les patientes. - Une masse latéro-utérine a été retrouvée chez 63% des cas
- une masse mal limitée plus ou moins des nodules a été retrouvée chez 4 patientes ayant des tumeurs malignes soit (44%).
29%
57% 0% 0% 14%
4-Délai de diagnostic :
Le délai moyen du diagnostic était de 5 mois (avec des extrêmes de 1 mois à 1 an) pour les tumeurs malignes, de 13 mois pour les tumeurs borderlines (avec des extrêmes de 6 à 24 mois), et de 15 mois pour les tumeurs bénignes (avec des extrêmes de 10 à de 36 mois).
III- Données paracliniques:
Les données des examens paracliniques étaient disponibles chez 19 cas.
1- Echographie
Une échographie abdomino-pelvienne de première intention a été réalisée chez 19 patientes (100% des patientes dont on dispose du dossier médical).
L'échographie était réalisée dans un but diagnostique (tableau 5). Lors de cet examen des éléments de bilan d'extension ont aussi été recherchés.
Tableau V: Données de l'examen échographique.
T. bénigne (n=5) T. borderline (n=4) T. maligne (n=10)
N % N % N %
Suspicion d'origine ovarienne 5 100% 4 100% 8 80%
multiloculaire 5 100% 3 75% 7 70% Parois épaisses 0 0% 3 75% 10 100% Végétations 0 0% 3 75% 5 50% Partiellement hyperéchogène 0 0% 3 75% 8 80% Ascite 0 0% 2 50% 4 40% Etude de l'ovaire CL 3 60% 4 100% 7 70% CL: controlatéral ; T: tumeur
2 - Tomodensitométrie:
Six patientes soit (31%) avaient bénéficié d'une TDM abdomino-pelvienne. Quatre patientes avaient une tumeur maligne. Une patiente avait une tumeur borderline et une autre patiente avait une tumeur bénigne.
La TDM abdomino-pelvienne était réalisée dans le cadre d'un bilan d'extension de tumeurs échographiquement suspectes de malignité. Cependant, on n'a pas pu relevé du dossier médical l'objectif de la TDM dans le cas de la tumeur bénigne.
3 - Radiographies standards:
La radiographie du thorax a été réalisée chez toutes nos patientes dans le cadre du bilan préopératoire. Dans les cas de tumeurs malignes et borderlines, la radiographie du thorax était réalisée comme bilan d'extension en plus du bilan préopératoire.
Un épanchement pleural minime a été trouvé chez une patiente ayant une tumeur maligne. La ponction pleurale n'a pas été réalisée. Cependant, cet épanchement était probablement d'origine métastatique, puisque cette patiente présentait aussi des métastases hépatiques.
Chez 2 patientes, des radiographies d'abdomen sans préparation étaient réalisées en raison d'un tableau de syndrome occlusif.
4- Marqueurs tumoraux:
Aucune patiente (dont les dossiers sont exploitables) n'a eu le dosage des marqueurs tumoraux en préopératoire.
Par ailleurs, Le dosage du CA125 a été réalisé chez un cas de tumeur maligne en post-opératoire, et avant la chimiothérapie. Son taux était normal.
5 -Bilan préopératoire:
Toutes nos patientes (19 cas) (dont on disposait du dossier médical) avaient bénéficié d’un bilan préopératoire qui a compris:
- Un groupage sanguin, - Un bilan d’hémostase.
- Une numération formule sanguine.
La numération formule sanguine avait mis en évidence une anémie hypochrome microcytaire chez 4 patientes soit (21%). deux cas de tumeurs malignes et un cas de tumeur borderline et un autre cas de tumeur bénigne. La recherche de tumeur intestinale chez ces patientes n'a pas été réalisée.
La fonction rénale a été explorée chez 9 patientes. Une glycémie à jeun chez 7 patientes, et un électrocardiogramme chez 6 patientes.
IV-Le traitement :
1-Le traitement chirurgical:
1.1 Les voies d'abord :
Tous les cas (dont on dispose du dossier médical) ont été traités par une laparotomie médiane sus et sous ombilicale.
1.2 Le geste chirurgical
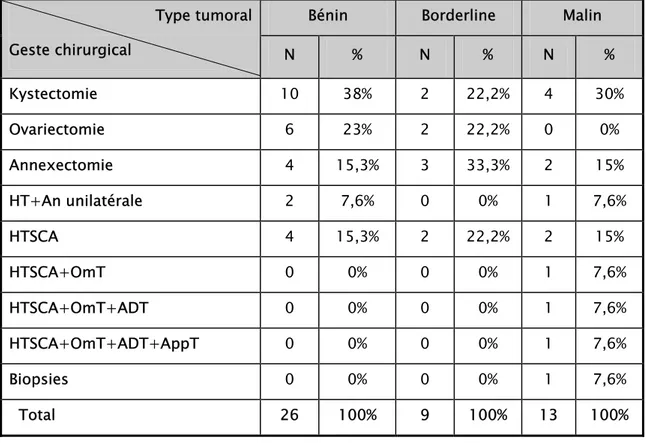
Les données sur le geste chirurgical initial étaient disponibles chez toutes les patientes, soit dans les dossiers médicaux soit dans les comptes rendus anatomopathologiques.
Le geste chirurgical initial est détaillé dans le tableau 6. L'objectif de ces gestes chirurgicaux était, pour la plupart des cas, d'avoir une confirmation anatomopathologique du diagnostic.
Une reprise chirurgicale pour totalisation du geste initial (HTSCA+ ommentectomie + appendicectomie +/- curage ganglionnaire) a été réalisée chez 4 cas de tumeurs malignes, et 2 cas de tumeurs borderlines.
Trois des 4 cas de tumeurs malignes qui ont eu une reprise chirurgicale pour totalisation du geste initial avaient une tumeur limitée à l'ovaire.
Les deux cas de tumeurs borderlines qui ont eu une reprise chirurgicale pour totalisation, avaient soit une tumeur rompu accidentellement en peropératoire (observation Br3), soit une microinvasion (observation Br4).
Tableau VI: Répartition des malades selon le geste chirurgical initial.
Bénin Borderline Malin Type tumoral Geste chirurgical N % N % N % Kystectomie 10 38% 2 22,2% 4 30% Ovariectomie 6 23% 2 22,2% 0 0% Annexectomie 4 15,3% 3 33,3% 2 15% HT+An unilatérale 2 7,6% 0 0% 1 7,6% HTSCA 4 15,3% 2 22,2% 2 15% HTSCA+OmT 0 0% 0 0% 1 7,6% HTSCA+OmT+ADT 0 0% 0 0% 1 7,6% HTSCA+OmT+ADT+AppT 0 0% 0 0% 1 7,6% Biopsies 0 0% 0 0% 1 7,6% Total 26 100% 9 100% 13 100%
N: nombre de cas; HT: hystérectomie totale; An : annexectomie ; HTSCA: hystérectomie totale sans conservation annexielle; OmT: omentectomie; ADT: curage ganglionnaire ; AppT: Appendicectomie.
2-La chimiothérapie:
Les cas de tumeurs malignes chez qui on dispose de données sur la thérapeutique post – chirurgicale (6 patientes) ont été adressées au service d'oncologie quand le diagnostic de malignité a été posé. Cependant, une surveillance clinique et échographique tous les 3 mois pendant 2 ans, a été indiquée chez les cas de tumeurs borderlines.
V. Evolution:
Seules les données sur l'évolution à court terme étaient disponibles.
Toutes les patientes dont les données sur l'évolution étaient disponibles ont eu une évolution sans incidents sauf chez un cas. Cette patiente, ayant une tumeur maligne, a présenté un ictère 5 jours après la chirurgie. L'ictère était expliqué selon les données du dossier médical par les nodules de carcinose péritonéale qui comprimaient les voies biliaires extra hépatiques.
VI- Données Anatomopathologiques
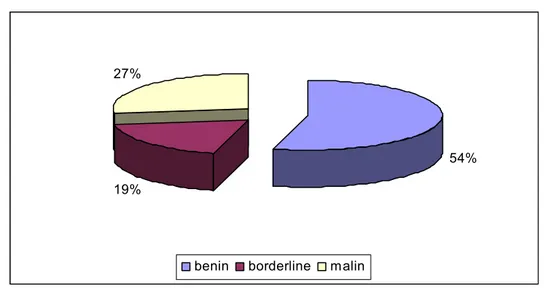
:1 -Types histologiques:
Figure 6: Répartition des tumeurs selon le type histologique.
54% 19%
27%
Parmi les malades de notre série: - 54% avaient une tumeur bénigne. - 19% avaient une tumeur borderline. - 27% avaient une tumeur maligne.
Deux cas de tumeurs borderlines avec microinvasion ont été diagnostiqués.
2 - Latéralité:
La bilatéralité était observée dans 3 cas de tumeurs malignes (23%); cependant aucune tumeur bénigne ou borderline n'était bilatérale (tableau 7).
Tableau VII: Répartition des tumeurs mucineuses selon la latéralité
Bénin Borderline Malin Total
Droit 10 5 4 19 Gauche 9 4 5 18 Bilatéral 0 0 3 3 Non précis 7 0 1 8 Total 26 9 13 48
3- La taille tumorale:
La majorité des tumeurs malignes (58%) avait un grand diamètre compris entre 10 et 20 cm.
La plus grande tumeur était maligne, avec un grand diamètre de 45 cm. La moyenne de taille des tumeurs malignes était de 19,2 cm.
La moyenne de taille des tumeurs borderlines était de 19,7 cm. La moyenne de taille des tumeurs bénignes était de 18,3 cm
Tableau VIII: Répartition des tumeurs selon les tranches de grand diamètre 0 - 10 11- 20 21-30 31-40 41-50 TOTAL Bénin 10 8 5 2 0 25 borderline 2 2 3 2 0 9 malin 3 7 1 0 1 12 TOTAL 15 17 9 4 1 46 0 2 4 6 8 10 12 14 16 18 Nombre de cas 0à 10 11à 20 21à 30 31à 40 41à 50 Tranches de grand diamètre
MALIGNE BORDERLINE BENIGNE
Figure7: Répartition des tumeurs selon les tranches de grand diamètre
4- Nature kystique et solido-kystique:
La majorité des tumeurs malignes était solido- kystique (78%), Aucune tumeur bénigne n'était solido-kystique (tableau 9)
Tableau IX:Répartition des tumeurs selon leur nature kystique ou solido-kystique kystique Solido-kystique bénin 26 0 borderline 7 2 malin 4 9 Total 37 11
5 – Caractère multiloculaire :
La majorité des tumeurs était multiloculaire qu'elles soient bénignes (78%), borderlines (100%) ou malignes (77%) (Tableau 9).
Tableau X: Répartition des tumeurs selon leur caractère, multi ou uniloculaire.
Multiloculaire uniloculaire Non précisé
Bénin 15 4 7
Borderline 9 0 0
Malin 7 2 4
TOTAL 31 6 11
6- La paroi:
La paroi des tumeurs malignes était epaisse chez tous les cas de tumeurs malignes.
Tableau XI: Epaisseur de la paroi selon le type tumoral
Bénin (n=26) Borderline (n=9) Malin (n=13)
Fine 21 1 0
Epaisse 5 8 12
7– Présence de végétations:
Les végétations endokystiques étaient présentes dans 4 tumeurs borderlines et 4 tumeurs malignes.
Les végétations exokystiques étaient associées aux végétations endokystiques dans 2 tumeurs malignes et une tumeur borderline.
Nous avons noté l'absence de végétations au niveau des tumeurs bénignes.
8- Contenu
Le contenu mucoïde (tableau 10) a été observé dans: - 64% des tumeurs bénignes
- 100% des tumeurs borderlines - 87,5% des tumeurs malignes.
Le contenu séreux est décrit dans les tumeurs mucineuses de l'ovaire quelque soit leur type.
Tableau XII: Contenu des tumeurs mucineuses
Bénigne (n=14) Borderline (n=6) Malin (n=8) Total (n=28) Type Contenu N % N % N % N % Mucoïde 9 64,2% 6 100% 7 87,5% 22 78,5% Séreux 3 21,4% 0 0% 0 0% 3 10,7% Mixte 2 14,2% 0 0% 1 12,5% 3 10,7% N: nombre de cas
9- Nodule pariétal:
Il a été retrouvé chez un cas de tumeur maligne. Cette tumeur était de type intestinal, et moyennement différenciée.
Le nodule pariétal était carcinomateux, et moins différencié que le reste de la tumeur.
10-Type intestinal et endocervical:
Le type intestinal était largement prédominant (90%) parmi les tumeurs malignes. Cependant le type endocervical était plus fréquent dans les tumeurs bénignes (60%).
Soixante quinze pour cent des tumeurs borderlines étaient de type intestinal.
Tableau XIII: Répartition des tumeurs selon le type intestinal ou endocervical
Bénin Borderline Malin
N % N % N % Intestinal 8 40% 6 75% 9 90% Endocervical 12 60% 2 25% 1 10% Total 20 100% 8 100% 10 100% N: nombre de cas
11- Stratification:
Tableau XIV: Nombre d'assises cellulaires
Bénin Borderline Malin
1 16 0 0
2 à 3 0 7 1
3 à 4 0 2 6
>4 0 0 6
12- Architecture:
Au sein de la même tumeur, nous avons retrouvé plusieurs anomalies architecturales. Les anomalies architecturales étaient prédominantes dans les tumeurs malignes.
Les tumeurs malignes étaient souvent organisées en glandes soit 57% et en tubes soit 61%.
Tableau XV: Anomalies architecturales
Tumeurs bénignes Tumeurs borderlines Tumeurs malignes
Papilles 2 4 5 Glandes 0 1 6 Tubes 0 0 8 Cryptes 0 1 3 Kystes 0 2 2 Amas compact 0 0 1 NP 24 4 3 NP:non précisé
13- Présence d'autres composantes tumorales:
L'extraction des données sur la présence d'autres composantes tumorales au sein des tumeurs malignes ou borderlines était possible pour 16 patientes soit (72%).
Les tumeurs malignes comportaient une composante bénigne et/ou borderline dans 7 cas soit (53%).
Toutes Les tumeurs borderlines comportaient une composante bénigne.
Tableau XVI: Répartition des tumeurs selon la composante tumorale associée
T. maligne T. borderline + bénin 1 9 +borderline 1 - +bénin+borderline 5 - NP 6 0 Total 13 9 NP: non précisé
14-Le grade histologique
Tableau XVII: Répartition des tumeurs selon le degré de différentiation Différentiation Tumeurs malignes Tumeurs borderlines
Bien différenciée 2 8
Moyennement différenciée 11 1
Peu différenciée 0 0
Les tumeurs malignes étaient souvent moyennement différenciées (84%). Quatre vingt huit pou cent des tumeurs borderlines étaient bien différenciées.
15- Stade de la FIGO:
La classification de la FIGO a été adoptée car nous avons considéré que les tumeurs de notre série étaient ovariennes primitives et non métastatiques. En effet, en cas de tumeur métastatique, c'est la classification TNM de l'organe d'origine qui sera adoptée.
Nous n'avons pas pu confirmer avec précision l'exactitude du stade tumoral car plusieurs gestes chirurgicaux nécessaires à cette stadification n'étaient pas réalisés chez la majorité des patientes (cytologie péritonéale, curage ganglionnaire, omentectomie, ….)
Tableau XVIII: Répartition des tumeurs selon les stades de la FIGO
Malignes Borderlines Bénignes
N % N % N % IA 5 38,4% 6 66,6% 25 96,1% IB 0 0% 0 0% 0 0% IC 1 7% 2 22,2% 1 3,8% IIA 1 7% 0 0% 0 0% IIB 0 0% 0 0% 0 0% IIC 0 0% 0 0% 0 0% IIIA 0 0% 0 0% 0 0% IIIB 2 14% 1 11,1% 0 0% IIIC 2 14% 0 0% 0 0% IV 2 14% 0 0% 0 0% TOTAL 13 100% 9 100% 26 100%
Toutes les tumeurs bénignes étaient de stade I.
Six tumeurs borderlines étaient de stade IA. Deux tumeurs borderlines étaient de stade Ic à cause d'une rupture capsulaire (dont une était associée à un pseudomyxome péritonéale). Une tumeur borderline était de stade IIIB à cause des implants péritonéaux non invasifs.
16- Rupture capsulaire:
Une rupture capsulaire préopératoire a été observée dans un cas de tumeur mucineuse benigne.
La rupture capsulaire préopératoire dans un cas de tumeur borderline de type intestinal, était associée à un pseudomyxome péritonéal de grade 0 de Sugarbarker. L'appendicectomie n'était pas réalisée chez ce cas.
Un cas de rupture capsulaire accidentelle a été signalé en peropératoire chez un autre cas de tumeur borderline.
I
Photo 1 : Image échographique d'une masse pelvienne de 15 cm de diamètre anéchogène, contenant des cloisons fines. La paroi du kyste est fine et régulière.
Diagnostic histologique: cystadénome mucineux de l'ovaire.
Photo2: Echographie d'une masse pelvienne latéro-utérine, droite, arrondie de 11 cm de diamètre, anéchogène, séparé en logettes par de fines cloisons et contenant une plage hyperéchogène.
Photo 3 : Image échographique d'une masse pelvienne gauche, avec deux composantes, hyperéchogène, et anéchogène. La composante anéchogène contient des cloisons fines.
(a)
(b)
masse : ) b ( avec reconstruction sagitale ) a ( en coupe axiale pelvienne -TDM abdomino : 4 Photokystique, abdomino- pélvienne, cloisonnée. La paroi et les cloisons sont fines (flèches). Absence de végétation endokystique.
Photo 5 : image tomodensitométrique d'une masse solido- kystique abdomino-pelvienne cloisonnée, à paroi épaissie.
Diagnostic histologique: tumeur mucineuse borderline de l'ovaire.
Photo 6 : images tomodensitométriques d'une masse abdomino-pelvienne solido-kystique associée a une ascite de grande abandance.
Photo 7 : Pièce d’hystérectomie total avec omentectomie : Tumeur mucineuse kysique à contenu gélatineux épais.
Photo 9: Tumeur ovarienne kystique bénigne. Revêtement unistratifié cubique
de type intestinal (HE X 200)
Photo 10 :Tumeur ovarienne kystique bénigne. Revêtement unistratifié cubique de type intestinal
Photo 11: Tumeur ovarienne kystique borderline multiloculaire, cavités tapissées par un revêtement unistratifié
mucineux de type intestinal ( HE x200)
Photo 12 : Tumeur ovarienne kystique borderline multiloculaire,
cavités tapissées par un revêtement unistratifié mucineux de type intestinal. Les cavités sont rapprochées mais non fusionées.(HE x 400)
Photo 13 : Tumeur ovarienne kystique borderline :
D
I – Données épidémiologiques:
1- Incidence et fréquence:
L'incidence des tumeurs mucineuses avec ses trois composantes bénigne, borderline et maligne n'a pas été évaluée dans la littérature. Cependant, certaines études ont évalué l'incidence des tumeurs malignes.
L'étude menée par Quirk [1] sur 11 registres de surveillance de cancer aux Etats Unis a répertorié entre 1992 et 1999, 23484 cas de tumeurs ovariennes primitives borderlines et malignes. L'incidence des tumeurs mucineuses malignes était de 1,22 cas pour 100 000 femmes. Dans cette même étude, la proportion des tumeurs mucineuses malignes parmi les cancers ovariens était de 7,5%.
Dans une étude Américaine, menée par Hart et Norris [2] portant sur 688 tumeurs mucineuses (bénignes, borderlines et malignes), seulement 22 tumeurs, soit (3%) étaient des carcinomes invasifs.
En effet, L'incidence des tumeurs mucineuses était revue à la baisse ces dernières années, pour deux raisons principales:
1. L'exclusion systématique et rigoureuse par un bilan clinique et paraclinique exhaustif,
des tumeurs mucineuses secondaires, d'origine non ovarienne [3].
2. L'exclusion des cas de pseudomyxome péritonéal dont l'origine est intestinale dans la
quasi majoritée des cas [3].
Dans notre série, 27% des tumeurs mucineuses sont malignes. Ce pourcentage parait très important par rapport aux données récentes de la littérature. Cependant, ça peut s'expliquer par plusieurs paramètres:
- Un recrutement plus important des tumeurs suspectes de malignité grâce au statut de centre de référence des centres hospitaliers universitaires.
-Un effet probable du facteur ethnique sur la prévalence des carcinomes mucineux de l'ovaire [6].
2- L'âge:
La moyenne d'âge des tumeurs mucineuses dans notre série était respectivement pour les tumeurs bénignes, borderlines, et malignes de 36 ans ,38 ans et 42 ans.
Nous avons comparé notre série avec la série Australienne sur la population générale de S J. Jordan [4], la série Japonaise de F. Kikkawa [5], la série Espagnole de Rodriguez et Prat [6] et la série Américaine de Hart et Norris [2] (tableau 13).
On constate le jeune âge de nos cas par rapport aux études Japonaise et Australienne. La série Espagnole, présente par contre des résultats assez similaires aux notre. Les patientes de la série Américaine, étaient plus jeunes.
Tableau XIX: Comparaison de la moyenne d'âge des patientes selon les études.
Notre série (n=46) Kikkawa [5] (n=400) Jordan[4] (n=323) Rodriguez[6] (n=75) Hart&Norris[2] (n= 136) Bénin 36 ans 43,9 ans 50 ans Non étudié Non étudié Borderline 38 ans 44,7 ans 49 ans 40 ans 35 ans
Malin 42 ans 49,7 ans 50 ans 39 ans 35 ans
Le jeune âge de nos patientes peut être dû soit au nombre limité de nos cas, soit au jeune âge de la population marocaine comparée aux populations Japonaise et Australienne. En effet L'espérance de vie dans ces deux pays dépasse les 80 ans [7].
Les études qui comparent l'âge des patientes atteintes de tumeur ovarienne selon le type histologique montrent que les tumeurs mucineuses de l'ovaire surviennent chez des patientes plus jeunes. L'étude épidémiologique Américaine de Quirk [1] qui porte sur 23484 tumeurs ovariennes, a montré que 54 % des cas de tumeurs mucineuses surviennent entre l'âge de 30-59 ans, contre seulement 45% pour les tumeurs séreuses. L'étude australienne cas-
témoin de Purdie et al [8] montre que l'âge moyen des cas de tumeurs mucineuses malignes est de 47 ans, contre 57 ans pour les tumeurs non mucineuses .
3- Les antécédents et les facteurs de risque:
3.1-Les facteurs reproductifs et hormonaux
a-La parité:
Il est communément connu que la parité diminue le risque des cancers ovariens. Cependant, cet effet protecteur est apparemment plus important dans les formes non mucineuses comparé aux formes mucineuses[4-9-10].
Parazzini [9] a mené une étude cas – controle en Italie, portant sur 680 cancers épithéliaux ovariens primitifs. Dans cette étude, la parité réduit le risque des cancers non mucineux mais elle ne réduit pas le risque des carcinomes mucineux.
L'étude Canadienne cas- témoin de Risch et al [10], portant sur 450 cas de carcinomes ovariens primitifs a aussi trouvé que la parité protège contre les tumeurs non mucineuses mais ne protège pas contre les tumeurs mucineuses.
Une autre étude cas- témoin sur la population générale a été menée entre 2002 et 2005 en Australie par Jordan et al [4]. Les données des cas de tumeurs mucineuses bénignes (n=133), borderlines (n=143) et malignes (n=43) ont été comparées à un groupe témoin de la population générale. Cette étude a montré que le risque de tumeurs mucineuses avec leurs 3 types n'est pas associé à la parité.
Cependant, Kurian [11] a analysé 10 études cas contrôle de cancers ovariens épithéliaux aux USA, avec 1834 patientes dont 254 cas de cancers mucineux. Il a constaté que la parité protège contre tous les types histologiques de cancer ovarien y compris le mucineux. Mais, les femmes incluses dans cette étude étaient généralement diagnostiquées entre 1970 et 1980. On sait maintenant que le diagnostic des tumeurs ovariennes métastatiques comme étant primitives durant cette période était courant [3], et peut biaiser ces résultats.
Dans notre série, 89% des cas de tumeurs malignes étaient multipares. Ce résultat suggère que la parité n'a pas protégé ces patientes contre les tumeurs mucineuses.
L'antécédent de prise de contraception orale était de l'ordre de 20% dans notre série. La comparaison de notre résultat avec celui de Parazzini [9] (tableau 20) révèle une similitude des pourcentages. L'explication est rapportée par cette même étude et par l'étude de Risch et al [10]. Ils ont trouvé que le risque des carcinomes mucineux n'est pas associé à la contraception orale, Contrairement aux tumeurs non mucineuses où elle a un effet protecteur. Jordan et al [4] avaient trouvé aussi l'absence de relation entre les tumeurs mucineuses avec leurs 3 types et la prise de contraception orale.
Cependant kurian [11], avait montré dans sa série, que la contraception orale protège contre tous les cancers épithéliaux de l'ovaire y compris, les mucineux.
Mais récemment, une méta-analyse a été publiée [12] et montre en effet, que la contraception orale protège contre les tumeurs ovariennes, mais que cette protection est moins importante contre les tumeurs mucineuses.
Le support biologique de ces différences vient probablement, du fait, qu'histologiquement, les tumeurs mucineuses ovariennes sont similaires aux adénocarcinomes du col utérin. Le risque de ce dernier n'est pas réduit par la contraception orale [13] ni par la parité [14].
Tableau XX: Fréquence d'utilisation de la contraception orale
Antécédent de prise de C O Notre série Série de Parazzini [9]
Oui 20% 13,5 %
jamais 80% 86,5 %
c- la grossesse gémellaire:
Dans une analyse combinée de 8 études cas- témoins, Witeman et al [15] ont trouvé que les mères de jumeaux ont moins de risque de cancers non mucineux de l'ovaire, comparées aux mères ayant eu des grossesses uniques. Cependant, cet effet protecteur n'était pas retrouvé pour les cancers ovariens mucineux.
d- Le traitement hormonal substitutif :
Une grande étude cohorte anglaise publiée en 2007 dans la revue" lancet "[16] et qui évalue le risque du cancer ovarien associé à l'utilisation du traitement hormonal substitutif (THS), a inclus 948 576 femmes ménopausées avec un suivi de 5,3 années. Plusieurs conclusions ont été apportées :
ª Les femmes qui utilisent couramment le THS ont significativement plus de risque de développer et de décéder d'un cancer ovarien que les non utilisatrices du THS.
ª Les femmes qui utilisent couramment le traitement hormonal substitutif, ont une incidence de cancer ovarien qui augmente avec la durée d'utilisation. Cette incidence ne diffère pas avec le type de préparation utilisée, ni avec ses constituants ni avec le mode d'administration.
ª Le risque de cancer ovarien associé à la prise du traitement hormonal substitutif varie significativement selon la nature histologique de la tumeur (p<0.0001). En effet, le risque relatif chez les femmes qui utilisent couramment le THS comparées aux non utilisatrices est plus important pour les tumeurs séreuses que pour les tumeurs mucineuses, endométroides ou les tumeurs à cellules claires.
Dans notre série, aucun cas d'utilisation de THS n'a été rapporté.
3.2 Le tabagisme:
Il est l'un des principaux facteurs de risque des tumeurs mucineuses de l'ovaire. En effet l'étude Australienne de Jordan [4] sur les tumeurs mucineuses bénignes, borderlines, et malignes avec respectivement 133, 147, et 43 cas a montré que le tabagisme actif augmente significativement le risque des 3 types tumoraux.
Une autre grande étude Américaine de kurian et al [11], portant sur 1834 cas de cancers ovariens y compris 254 cas de carcinomes mucineux avait montré que le tabagisme augmente le risque de carcinome mucineux sans augmenter le risque de carcinome séreux. Ce résultat était aussi rapporté par l'étude Américaine cas contrôle multicentrique de Marchbanks et al [18].
Cette différence reflète peut être une sensibilité plus grande des cellules mucineuses aux carcinogènes environnementaux. Ainsi une hypothèse d'interaction gène - environnement a émergé afin d'expliquer cet effet sur les cellules mucineuses. En effet, Il est très probable que le tabac entraîne des mutations dans le gène K-ras, un gène dont les anomalies prédominent dans les tumeurs mucineuses ovariennes comparées aux tumeurs non mucineuses [17]. Une association entre le tabac et la mutation K-ras est déjà suggérée dans des études sur le cancer du poumon, du colon, et du pancréas [19-20]. Ces spéculations, incitent à d'autres investigations in vitro, sur le patient et en population générale.
Dans notre série, aucune patiente n'était tabagique active à cause peut être de la faible prévalence du tabagisme parmi les femmes Marocaines [7]. Mais l'effet probable d'un tabagisme passif ne peut pas être éliminé.
3.3-Les facteurs constitutionnels
Les cancers ovariens héréditaires sont une entité bien établie. Des études épidémiologiques avaient estimé qu'ils constituent approximativement 5 à 10 % des cancers ovariens épithéliaux [22].
Le Risque Relatif (RR) estimé est de 2,5 à 3,5 en cas d'antécédents familiaux de cancer de l'ovaire et de 4 en cas de cancer(s) du sein [23]. Ce risque excède jusqu'à 30 fois celui de la population générale dans les syndromes héréditaires de prédisposition au cancer. Ces données suggèrent la possibilité d'un risque génétique de développement d'une tumeur de l'ovaire. Ce risque s'intègre dans le cadre des syndromes héréditaires de prédisposition au cancer pour lesquels les connaissances ont réellement explosé depuis une dizaine d'années. Tant dans le domaine de la recherche génétique que dans celui des applications cliniques [23].
Deux formes de risque génétique pour le développement d'une tumeur épithéliale de l'ovaire sont à distinguer [23]:
¾ les prédispositions majeures avec un risque relatif supérieur à 10, sont essentiellement liées à deux syndromes, BRCA-1 et BRCA-2 ( Breast Cancer type 1 ou 2) associant un cancer du sein et de l'ovaire chez une même patiente ou des parents proches, et le syndrome HNPCC (Hereditary Non Polyposis Colon Cancer) encore dénommé syndrome
de " Lynch II " associant un cancer colique à forte pénétrance et d'autres tumeurs ( gastriques, hépatobiliaires, du tractus urinaire, du système nerveux central) dont le cancer ovarien.
¾ Les prédispositions mineures avec un risque relatif voisin ou inférieur à 10, pour lesquelles la tumeur de l'ovaire est une lésion mineure dans un syndrome génétique de composition plus hétérogène. Dans ce cadre, les cancers de l'ovaire d'apparition isolée et/ou sporadique sont liés à des mutations de gènes impliqués dans la prolifération cellulaire, oncogènes et gènes suppresseurs de tumeurs [23].
Le risque héréditaire des tumeurs ovariennes diffère selon les types tumoraux. En effet, de nombreuses études ont montré que ce risque est plus important pour les tumeurs non mucineuses comparées aux tumeurs mucineuses [22].
Une étude Américaine cas contrôle multicentrique de Tung et al [22], a dévoilé une forte association des tumeurs non mucineuses de l'ovaire avec l'antécédent familial de premier degré de cancer de l'ovaire, du sein, du colon ou de la prostate. Cependant, cette association est plus faible pour les tumeurs mucineuses.
Cette étude vient conforter les autres études qui montrent la faible association des tumeurs mucineuses de l'ovaire avec l'antécédent familial ou personnel de cancer [4].
En effet, Jordan et al [4], n'ont pas trouvé de relation significative entre l'histoire familiale de cancer ovarien ou mammaire et les tumeurs mucineuses avec leurs 3 types: bénins, borderlines et malins.
Les recherches moléculaires apportent des explications à ces résultats. En effet, la majorité des patientes atteintes de cancers ovariens héréditaires sont porteuses de mutations BRCA1 et BRCA2. Cependant, ces mutations sont rencontrées surtout dans les tumeurs non mucineuses de l'ovaire et sont rares dans les tumeurs mucineuses [24].
Notre série vient confirmer les données de la littérature. En effet, nous n'avons rapporté aucun cas d'histoire familiale de cancer.
Risch et al [10] ainsi que Purdie et al [8] ont trouvé que la ligature tubaire ainsi que l'hystérectomie protègent contre les tumeurs mucineuses et les tumeurs non mucineuses de l'ovaire.
Cette protection est due peut être à l'effet préventif de l'hystérectomie et la ligature tubaire contre l'arrivée au niveau du péritoine de carcinogènes environnementaux.
Nous avons noté dans notre série un cas d'antécédent personnel d'hystérectomie. Aucun cas de ligature tubaire n'a été relevé dans notre série.
II- Pathogénie:
Deux théories se confrontent pour expliquer la tumorogenèse des tumeurs mucineuses de l'ovaire: la théorie de l'apparition de novo des cancers mucineux, et celle de la filiation bénin-malin en passant par la tumeur borderline et la tumeur non invasive [25].
En faveur de la théorie de séquence bénin-malin, plusieurs arguments ont été évoqués:
1- Arguments épidémiologiques:
1.1-La fréquence:
Le diagnostic de tumeurs mucineuses bénignes est posé 4 fois plus que les tumeurs borderlines et 40 fois plus que les tumeurs malignes [4]. Ceci suggère qu'une partie des tumeurs bénignes devient borderline, et une partie des tumeurs borderlines se transforme en tumeurs malignes.
1.2- Lâge:
L'âge des patientes est aussi un argument en faveur de la filiation bénin-malin. Ainsi l'âge des cas de tumeurs malignes est plus avancé que celui des cas de tumeurs borderlines et bénignes [5-18]. Cette différence d'âge peut être expliquée par le temps nécessaire pour la transformation du bénin au malin
1.3-Les facteurs de risque:
Les tumeurs bénignes, malignes et borderlines partagent les mêmes facteurs de risque [4]. Cette constatation est observée aussi dans d'autres séquences tumorales comme celle de l'adénome colorectal au carcinome, l'oesophagite de Barrett à l'adénocarcinome oesophagien et de la kératose actinique au carcinome spinocellulaire [4].
2-Arguments histologiques:
À l'instar des autres études [2-6], nous avons retrouvé un contingent bénin et borderline dans la majorité des tumeurs malignes, ainsi q'un contingent bénin dans toutes les tumeurs borderlines. Ce résultat suggère fortement la progression du bénin au malin passant par le borderline.
3-Arguments génétiques:
Plusieurs études sur les altérations génétiques des tumeurs mucineuses ont montré que la mutation du codon 12/13 du gène K-ras est plus fréquente dans les tumeurs mucineuses, bénignes, borderlines et malignes, par rapport aux autres tumeurs épithéliales où cette mutation reste rare [17-26]. En plus, la mutation K-ras est plus fréquente dans les tumeurs borderlines comparées aux tumeurs bénignes. Elle est plus fréquente dans les tumeurs malignes comparées aux borderlines. Ceci suggère que la mutation K-ras se produit dans un stade très précoce de la tumorogenèse [17].
4-Arguments radiologiques:
Horiuchi et al [27] ont montré qu'approximativement la moitié des carcinomes ovariens y compris le carcinome mucineux avaient une apparence bénigne dans des échographies faites des mois avant le diagnostic. Ce résultat est en faveur d'une évolution du bénin au malin d'une partie de ces tumeurs. Cependant, ces mêmes résultats suggèrent qu'une partie de ces tumeurs peut apparaître de novo [27].
III- Diagnostic clinique:
1- Symptômes:
Les symptômes les plus fréquents en cas de tumeurs mucineuses sont la douleur et la distension abdominale. Cependant, moins de 20% des cas sont découverts à l'occasion de métrorragies ou de ménorragies [2].
L'étude cas témoin de Goff [28] sur les symptômes de cancers ovariens suggère que les femmes qui souffrent de douleurs abdominales/pelviennes, de distension abdominale ou de dyspepsie pendant moins de 12 mois, et qui surviennent au moins 12 fois par mois doivent être explorées à la recherche de cancer ovarien (la sensibilité pour un diagnostic précoce ou tardif est respectivement de 56.7% et 79.5%) .
Notre étude vient confirmer cette distribution des symptômes. Elle montre que la distension abdominale et la douleur sont les symptômes prédominants.
2- Examen physique:
La revue de la littérature ne nous a pas permis de déceler des différences entre les tumeurs mucineuses et les tumeurs non mucineuses lors de l'examen physique.
Cet examen commence par l’inspection et la palpation de l’abdomen et des aires ganglionnaires. La distension abdominale peut être due au développement abdomino-pelvien de la masse elle-même dont le pôle supérieur sera palpé au-dessus de la symphyse pubienne ou même de l’ombilic. Elle se caractérise par sa convexité vers le haut confirmée par sa matité à la percussion. Elle peut aussi être due à l'ascite dont la matité est nette dans les flancs et concave vers le haut [28].
A travers la paroi on peut palper les nodules péritonéaux indurés notamment au niveau de l'épiploon où ils peuvent être très volumineux (“gâteau tumoral épiploïque“) [28]. Parfois l’inspection découvre un nodule ou une induration ombilicale appelé « nodule de Sœur
Mary Joseph » et qui correspond à une infiltration cancéreuse de l’ombilic. Il faut poursuivre par la recherche d'adénopathies inguinales ou sus-claviculaires [28].
Au spéculum le col a un aspect normal mais du sang peut provenir de l’utérus. Il peut être dévié et abaissé alors que dans les fibromes utérins, il est le plus souvent suspendu [28]. Les touchers pelviens permettent de soupçonner l'origine annexielle de la tumeur. Dans les stades précoces il s’agit d’une masse latéro-utérine uni- ou bilatérale perçue à travers le cul-de-sac vaginal. Elle est bien limitée, arrondie, rénitente . Elle est séparée de l’utérus par un sillon et peut être mobilisée indépendamment sans faire bouger l’utérus [28]. Aux stades avancés, il existe une prolifération tumorale qui envahit progressivement le petit bassin, fixant la tumeur à l’utérus et colonisant le cul-de-sac de Douglas. Les touchers perçoivent le pôle inférieur de ce bloc tumoral qui comble le pelvis plus qu'il ne l'infiltre. On constate la présence d’une masse indurée irrégulière polylobée bloquée dans le petit bassin. Le cul-de-sac de Douglas est occupé par des nodules tumoraux alors que généralement les paramètres ne sont pas infiltrés[72]. Ces mêmes constats ont été rapportés lors de l'examen clinique des tumeurs aux stades avancés de notre série.
En aucune circonstance, l’examen clinique ne permet d’éliminer le risque de malignité devant une masse pelvienne ou annexielle , en revanche 4 éléments cliniques permettent fortement de l'évoquer :
- l'ascite
- la fixité et la dureté aux touchers pelviens
- les nodules pariétaux ou douglassiens évoquant la carcinose péritonéale - l’altération de l’état général
La variabilité de la symptomatologie pourrait conduire à décrire de multiples formes cliniques [28].
Les formes compliquées des kystes ovariens à type de torsion ou de rupture n'éliminant en aucun cas l’éventualité de la malignité. L’occlusion intestinale peut être une forme révélatrice d’une carcinose évoluée comme elle peut être un signe d'un néoplasme colique primitif dans le cadre de métastase ovarienne.
Lors de ces interventions d’urgence, les meilleures conditions pour une chirurgie cancérologique ne sont pas toujours réunies [28].
3- Le délai de diagnostic:
Les tumeurs ovariennes sont connues par leur caractère silencieux d’où leur diagnostic tardif responsable de leur mauvais pronostic.
Une étude américaine rétrospective de LH Smith, publiée en 2005 [29], s'est intéressée au délai diagnostic des cancers ovariens afin de vérifier le caractère silencieux de ces tumeurs. Cette étude portait sur 1985 cas de cancers ovariens, 6024 cas de cancers du sein et 10941 femmes témoins tirées des registres de surveillance épidémiologique de la Californie. Les principaux résultats de ce travail sont les suivants:
¾ Les patientes avec un cancer ovarien présentaient des symptômes cliniques avant les patientes qui présentaient un cancer du sein.
¾ Le délai diagnostique devant la distension abdominale et la douleur abdominale était respectivement de 10 à 12 mois, et de 7 à 9 mois.
D'après cette étude, il parait que le cancer ovarien n'est pas silencieux puisque les symptômes peuvent être présents des mois avant le diagnostic.
Le délai moyen dans notre série entre les premiers symptômes et le diagnostic est plus important pour les tumeurs bénignes (15 mois) comparé aux tumeurs borderlines (13 mois) et aux tumeurs malignes (5mois).
IV- Diagnostic paraclinique:
1-L'imagerie
1.1 L'échographie
Le diagnostic de tumeurs ovariennes repose essentiellement sur l'échographie pelvienne qui doit être faite par voie mixte, sus-pubienne et transvaginale [30-31].
L'échographie permet, sur l'analyse précise des critères échographiques, d'établir une présomption de malignité [30-31].
Le compte rendu d'échographie doit être clair, précis et complet et doit mentionner [30-31]:
¾ La technique utilisée
¾ La phase du cycle chez les femmes non ménopausées ¾ Le siège des lésions
¾ Le caractère uni- ou bilatéral ¾ La taille
¾ La structure : liquidienne pure, mixte à prédominance liquidienne ou à prédominance solide, la structure solide homogène ou hétérogène.
En cas de kyste ou de lésion à prédominance kystique, le compte rendu d'échographie doit mentionner l'épaisseur des parois, la présence de septums, uniques ou multiples, la présence de papilles ou de végétations endokystiques et exokystiques. L'existence ou non de signes associés (épanchement du Douglas ou ascite, adénopathies, retentissement sur les cavités rénales) [30-31].
En échographie, les signes évocateurs de malignité sont [30-31]:
¾ Des cloisons épaisses supérieures ou égales à 3 mm, irrégulières, présentant à leur surface de petites végétations
¾ Des cloisons nombreuses groupées dans une partie de la tumeur
À l'inverse, quelques cloisons peu nombreuses, fines, régulières se voient surtout dans les tumeurs bénignes. Mais tous les intermédiaires sont possibles.
Dans notre étude, l'échographie était l'examen demandé en première intention et toutes les tumeurs malignes et borderlines étaient suspectes de malignité à l'examen échographique.
1.2 Le scanner:
Le scanner est nécessaire dans les tumeurs volumineuses (supérieures à 10 cm) qui ne peuvent pas être étudiées en totalité par voie endovaginale (sonde à haute fréquence).
Les examens sans et avec injection de produit de contraste intraveineux, sont surtout réalisés dans le but [30-31]:
1. de rechercher un contingent tissulaire qui serait un signe de malignité ; 2. de préciser l'état de l'autre ovaire ;
3. de réaliser un bilan d'extension plus précis.
Dans notre série, un scanner abdomino-pelvien était réalisé chez 6 patientes.
1.3-L'imagerie par résonance magnétique:
L'imagerie par résonance magnétique (IRM) présente deux intérêts principaux par rapport aux moyens d'imagerie déjà cités [30-31]:
¾ En cas de masse de grande taille, posant le problème de son origine (utérine, ovarienne ou intestinale) ; l'imagerie par résonance magnétique permet une meilleure étude topographique;
¾ En cas de diagnostic différentiel avec d'autres lésions bénignes (endométriose, certains tératomes matures) : elle peut aider au diagnostic en permettant une approche de caractérisation tissulaire et modifier l'approche thérapeutique par coelioscopie ou laparotomie, en milieu oncologique ou non.
2- La biologie:
En dehors du bilan préopératoire, deux bilans biologiques sont à demandé systématiquement en cas de tumeur ovarienne [32]: les marqueurs tumoraux, et l'hémogramme.
2.1 Les marqueurs tumoraux:
Les marqueurs tumoraux sont des molécules présentes à des concentrations plus élevées dans les urines, le sang ou les tissus de malades atteints de certaines pathologies [32].
Elles sont produites par la tumeur elle-même ou par l'organisme, en réponse à la présence de certains cancers ou de certaines pathologies non cancéreuses [32]. Dans le cancer de l'ovaire, parmi les marqueurs tumoraux possibles figure le CA125, le CA19.9, le CA72.4, le CEA …. Le CA125 est la molécule la plus étudiée et la plus utilisée. Le dosage de CA125 est
considéré comme un moyen de dépistage, seul ou en association avec d'autres techniques (échographie pelvienne, doppler) [29], comme un facteur pronostique [33], et comme une méthode de différenciation entre la nature bénigne ou maligne [5]. Il est considéré également comme un élément prédictif d'une réponse thérapeutique. Cependant, Le manque de spécificité et de sensibilité de ce marqueur en cas de tumeurs mucineuses explique les questions soulevées par l'utilisation du dosage du CA125dans cette indication [32-34].
L'étude Japonaise de F. Kikkawa [5] a évalué les différents marqueurs tumoraux chez des patientes atteintes de 3 types de tumeurs mucineuses. Un dosage du CA125, CA19-9, CA72-4 et du CEA a été effectué en préopératoire chez toutes les patientes. L'étude de la sensibilité et la spécificité de ces 4 marqueurs a révélé la supériorité du CA72-4 suivis du CEA dans la distinction entre les tumeurs mucineuses malignes et borderline d'une part et les tumeurs bénignes d'autre part [5] ( figures 8 et 9 ).
Engelen et all, avaient raporté que le CA19-9 est plus fréquemment élevé que le CA125 dans les tumeurs mucineuses borderlines [35].
Plusieurs études sur un nombre limité de cas de cancers mucineux ont montré une plus grande sensibilité du CA19-9 et du CEA comparée au CA125 [36-37].
Ces études suggèrent que le dosage du CA19-9 et/ou du CA72-4 est vivement recommandé devant la découverte d'un kyste multiloculaire d'origine ovarienne probable.
Par ailleurs, le CA125 n'est pas spécifique des tumeurs ovariennes épithéliales. Il est aussi augmenté en cas d'autres tumeurs malignes, comme le cancer de l'endomètre et certains cancers pancréatiques ainsi que dans des pathologies bénignes, comme l'endométriose, les léiomyomes utérins, et les pathologies inflammatoires pelviennes [32].
Aucune patiente de notre série, n'a eu le dosage des marqueurs tumoraux en préopératoire. Cela peut être dû à un coût élevé de cet examen.
Figure 8 : Répartition du niveau sérique des marqueur tumoraux en préopératoire (F.Kikkawa et al) [5]
Absence de différences claires entre les tumeurs borderlines et les cancers pour les 4 marqueurs. Cependant, plusieurs cas de tumeurs borderlines et malignes présentent un niveau remarquablement haut de marqueurs tumoraux [5].
Figure 9: le ROC des marqueurs tumoraux (F.Kikkawa et al) [5]
ROC: Receiver Operating Characteristic ( le receveur de fonctionnement caractéristique) AUC: Area Under the ROC curve (L'espace en dessous de la courbe ROC)
Pour mieux étudier l'utilité des marqueurs tumoraux dans la distinction des tumeurs borderlines et malignes d'une part, et les tumeurs bénignes d'autre part, Kikkawa [5] a utilisé le receveur de fonctionnement caractéristique, ou la courbe (ROC). L'espace en dessous de la courbe (AUC), est plus important pour le CA72-4 (AUC=0,807), suivi du CEA (AUC=0,684), ce qui reflète une meilleure sensibilité du CA72-4.
Selon les séries, les métastases représentent entre 6 à 10% des tumeurs ovariennes malignes. Ces métastases sont souvent d'origine colo-réctale ou gastrique [59]. Ces deux tumeurs digestives peuvent se manifester par une anémie secondaire à un saignement occulte. L'hémogramme va confirmer et caractériser cette anémie.
3- Bilan d'exclusion d'une tumeur primitive extra-ovarienne.
L'évaluation préopératoire des patientes chez qui une masse ovarienne est suspectée doit exclure la possibilité d'un cancer extra-ovarien primitif (gastrique, colorectal, appendiculaire, mammaire …) [32].
- toute patiente présentant un saignement digestif occulte, ou des symptômes d'obstruction intestinale doivent bénéficier d'une colonoscopie.
- Les symptômes ou les signes de pathologie gastro-intestinale haute doivent être investigués.
- D'autres examens peuvent être réalisés selon l'orientation diagnostic.
IV- Prise en charge thérapeutique:
La prise en charge thérapeutique des tumeurs mucineuses de l'ovaire est assez similaire à celle des autres tumeurs épithéliales. Cependant, quelques particularités de ces tumeurs sont à prendre en considération lors des différentes étapes thérapeutiques.
Plusieurs attitudes thérapeutiques existent mais nous allons nous limiter à l'attitude conseillée par les protocoles Français [38,39].