1
Synthèse de nanoparticules riches en carbone par
polymérisation en dispersion
Mémoire
Audrey Picard-Lafond
Maîtrise en chimie
Maître ès sciences (M. Sc.)
Québec, Canada
© Audrey Picard-Lafond, 2017
2
Synthèse de nanoparticules riches en carbone par
polymérisation en dispersion
Mémoire
Audrey Picard-Lafond
Sous la direction de :
III
Résumé
L’intérêt porté aux nanomatériaux de carbone est en croissance en raison de leur potentiel pour une variété d’applications. Le réseau d’atomes de carbone hybridés sp2, commun à tous les matériaux de
cette famille, engendre d’excellentes propriétés électroniques et optiques modulées par la forme, la taille et la dimensionnalité du réseau carboné. Parmi ces nanomatériaux, les nanoparticules de carbone (CNP) disposent d’un potentiel singulier en raison de leurs propriétés de photoluminescence, leur photostabilité et leur faible toxicité. En conséquence, l’application des CNP en biomédecine, en optoélectronique et en photocatalyse est grandement étudiée. Néanmoins, les méthodes de synthèse et les techniques de séparation actuelles représentent des limitations à leur mise en œuvre. L’usage de température élevée (>100 °C) nuit au contrôle précis de la forme et de la taille des CNP, les rendements réactionnels sont faibles et la surface du matériau est chimiquement inerte.
Dans ce projet, l’objectif est d’établir une méthode de synthèse de CNP palliant aux limitations des procédés actuels. Autrement dit, nous tentons de développer une méthode permettant un contrôle précis de la forme et de la taille des particules en évitant l’utilisation de températures élevées. La stratégie est basée sur la polymérisation en dispersion d’unités organiques riches en alcynes, utilisées comme source métastable de carbone. D’une part, la polymérisation de monomères riches en alcynes permet de synthétiser en une étape simple des polyynes qui, en raison de leur instabilité, réagissent spontanément pour produire un matériau composé majoritairement d’atomes de carbone hybridés sp2. D’autre part, la polymérisation en dispersion assure un contrôle morphologique des
particules durant la synthèse. En plus de l’objectif principal, la fonctionnalisation en surface des particules est envisagée en exploitant la réactivité d’alcynes résiduels de la structure carbonée. Aussi, nous tentons d’échanger le monomère alcynique afin de bonifier les propriétés de photoluminescence des particules issues du procédé.
IV
Abstract
The interest in carbon nanomaterials is expanding due to their potential for various applications. The network of sp2-hybridized carbon atoms, common to all materials of this family, generates excellent
electronic and optical properties which are modulated by the shape, the size and the dimensionality of the carbon network. Among these nanomaterials, carbon nanoparticles (CNP) have a singular potential due to their photoluminescence properties, their photostability and their low toxicity. Accordingly, the application of CNP in biomedicine, optoelectronics and photocatalysis is greatly studied. However, the current synthetic methods and separation techniques represent limitations to their implementation. The use of high temperatures (>100 °C) hinders the precise control over shape and size of the CNP, the synthetic yields are low and the materials’ surface is chemically inert.
In this project, the objective is to establish a route for CNP synthesis which surpasses the limitations of the current preparation methods. In other words, we are trying to develop a method allowing a precise control of the particles’ shape and size, while avoiding the use of high temperatures. The strategy is based on the dispersion polymerization of alkyne-rich organic units, used as a metastable carbon source. On one hand, the polymerization of alkyne-rich monomers allows the one-step synthesis of polyynes which, due to their instability, react spontaneously to produce a material composed mainly of sp2-hybridized carbon atoms. On the other hand, dispersion polymerization
ensures a morphological control of the particles during their synthesis. Adding to the main objective, surface functionalization of the particles is intended by exploiting the reactivity of residual alkynes in the carbon structure. Also, we try to exchange the alkyne-rich monomer in order to improve the photoluminescence properties of the particles obtained from the developed process.
V
Table des matières
Résumé ... III Abstract ... IV Table des matières ... V Liste des tableaux ... VII Liste des figures ... VIII Liste des schémas ... XII Liste des abréviations ... XIII Remerciements ...XVI Avant-propos ...XVII
1. Introduction ... 1
1.1. Les matériaux riches en carbone ... 1
1.2. Les nanoparticules de carbone ... 3
1.2.1. Découverte ... 3 1.2.2. Nomenclature et structures ... 4 1.2.3. Méthodes de synthèse ... 5 1.2.4. Propriétés de photoluminescence ... 11 1.2.5. Intérêts ... 16 1.2.6. Problématiques ... 17 1.3. Les polyynes ... 18
1.3.1. Réactivité : instabilité photochimique et thermique ... 19
1.3.2. Précurseurs à la synthèse de matériaux riches en carbone sp2... 19
1.4. Les nanoparticules de polymère ... 21
1.4.1. Polymérisation en dispersion par couplage de Sonogashira ... 22
1.5. Objectifs du projet de maîtrise ... 23
1.6. Méthodologie ... 24
2. Chapitre 2 ... 26
2.1. Résumé ... 27
2.2. Abstract ... 28
2.3. Introduction ... 29
2.4. Materials and Methods ... 31
2.4.1. Chemicals and Materials ... 31
2.4.2. Instrumentation ... 31
VI
2.4.4. Preparation of POLY-3 NPs ... 33
2.4.5. Preparation of POLY-1, POLY-3 and POLY-4 NPs ... 33
2.4.6. UV irradiation of POLY-1 NPs ... 34
2.4.7. Preparation of POLY-1@5 NPs ... 34
2.5. Results and Discussion ... 35
2.6. Conclusion ... 45
2.7. Acknowledgements ... 45
2.8. Supporting Information (SI) ... 46
2.9. References... 55
3. Chapitre 3 ... 58
3.1. Résumé ... 59
3.2. Abstract ... 60
3.3. Introduction ... 61
3.4. Results and discussion ... 63
3.5. Conclusion ... 69
3.6. Experimental section ... 70
3.6.1. Chemicals and materials ... 70
3.6.2. Instrumentation ... 70 3.6.3. Synthesis ... 71 3.7. Aknowledgements ... 72 3.8. Supporting information ... 72 3.9. References... 79 4. Conclusion ... 81 4.1. Limitations ... 83 4.2. Perspectives du projet ... 84
4.2.1. Synthèse de nanoparticules hybrides TPE/octatétrayne ... 84
4.2.2. Oxygénation de la surface ... 87
4.2.3. Polymérisation en miniémulsion ... 87
4.2.4. Utilisation de l’acétylène gazeux ... 89
VII
Liste des tableaux
Tableau 1.1. Particularités des procédés de polymérisation en milieu dispersé. Tableau adapté de Shboul et al.43 ... 21
VIII
Liste des figures
Figure 1.1. Représentations du diamant et du graphite par modèle moléculaire boules-bâtonnets. .... 1 Figure 1.2. Représentations de formes allotropiques du carbone d'hybridation sp2 par modèle
moléculaire boules-bâtonnets. ... 2 Figure 1.3. Résultats obtenus des recherches de Xu et al.4 (A) Profil d’électrophorèse de la
suspension de suie brute issue de l’ablation par arc électrique, (B) profil d’électrophorèse du carbone fluorescent isolé de la suspension brute, (C) fractions de ce carbone
fluorescent sous irradiation UV (365 nm), (D) image de tomographie AFM pour la fraction orange du carbone fluorescent. ... 3 Figure 1.4. Sous-catégories de CNP selon leur structure, où les groupements fonctionnels potentiels
en périphérie des structures ont été négligés par souci de clarté. ... 4 Figure 1.5. Méthodes de synthèse descendantes de CNP à partir de matériaux riches en carbone. .. 6 Figure 1.6. Méthodes de synthèse ascendantes de CNP à partir de précurseurs moléculaires riches
en carbone. ... 9 Figure 1.7. Préparation de GQD luminescents par auto-assemblage et pyrolyse du HBC.
Représentation adaptée de Liu et al.18 ... 10
Figure 1.8. Résultats obtenus des recherches de Sun et al.10 (A) Schématisation de l’effet de
l’attachement d’espèces organiques à la surface des CNP sur les propriétés optiques, (B) solutions aqueuses des CNP passivées de PEGet excitées aux longueurs d’onde indiquées, (C) spectres d’émission d’une solution aqueuse des CNP passivées de PPEI-EI (λexc = 400 nm à gauche puis incrément de 20 nm pour chaque spectre subséquent
vers la droite). ... 12 Figure 1.9. (A) Diagramme énergétique simplifié d’un procédé UCPL, où les niveaux vibrationnels ont
été négligés par souci de clarté. (B) Spectre 3D de photoluminescence de CNP
démontrant des propriétés d'UCPL. Résultats obtenus des recherches de Li et al.23 ... 14
Figure 1.10. Schématisation de l'émission d'une CNP portant des groupements fonctionnels en surface agissant comme sites émissifs. ... 15 Figure 1.11. Produits d'addition et de cyclisation obtenus de la polymérisation d'unités 1,3-butadiynes
entre eux, où R est un substituant organique quelconque. L'encadré ombragé dénote le motif polydiacétylène (PDA). ... 19 Figure 1.12. Synthèse de microsphères de carbone par polymérisation en suspension d’un dérivé
1,3,5,7-octatétrayne puis pyrolyse subséquente. Résultats SEM obtenus des travaux de Ding et al. 41 ... 20
Figure 1.13. Images SEM de l'organogel du 1,8-diaryl-1,3,5,7-octatétrayne (a) avant et (b) après irradiation UV. Résultats obtenus des travaux de Nabeo et al.42 ... 21
Figure 1.14. Mécanisme de formation de nanoparticules par polymérisation en dispersion. ... 23 Figure 1.15. Étude du comportement de particules munies de TPE sous irradiation UV sans
IX
Figure 2.1. (a) Synthetic pathway for the transformation of alkyne-rich compound 1 to CNPs (POLY-1 NPs) of precise shape and size and (b) reaction of octatetrayne units of the particle’s polymeric backbone into a disordered sp2 carbon-rich matrix. ... 30
Figure 2.2. SEM images of POLY-3 NPs with (a) desilylation and isolation of 2 prior to polymerization and (b) in situ desilylation with potassium fluoride prior to polyermization. The scale bar represents 1 µm. ... 36 Figure 2.3. TEM images of POLY-1 NPs from homocoupling dispersion polymerization of compound
1: (a) Wide shot (b) close-up. The scale bars represent 2 µm and 500 nm, respectively. 38 Figure 2.4. (a) Particle diameter d as a function of monomer concentration for POLY-1 NPs. The
shaded area represents the regime where bidisperse samples were obtained. Error bars represent the polydispersity as standard deviation from the mean diameter. (b) TEM image of the 12.8 mM bidisperse sample. (c) TEM image of the isolated 170 nm
population from this sample. The scale bars represent 2 µm. ... 39 Figure 2.5. Solid-state MAS 13C NMR spectra of dried POLY-1 NPs (≈100 nm diameter) before and
after UV irradiation. The diamond shapes indicate signals associated with PVPVA in the particles' matrix. ... 41 Figure 2.6. (a) Normalized absorption and (b) fluorescence spectra of compounds 5, POLY-1 NPs
and POLY-1@5 NPs in toluene (λexcitation = 330 nm). ... 42
Figure 2.7. (a) Dark field and (b) fluorescence microscopy images of POLY-1@5 NPs drop casted on a glass substrate. Excitation for fluorescence acquisition ranges from 300 to 400 nm and emission ranges from 410 to 450 nm. ... 44 Figure 2.8. Size distribution histograms from TEM image analysis of POLY-3 NPs with (a) desilylation
and isolation of compound 2 prior to polymerization and (b) in situ desilylation prior to polymerization. ... 46 Figure 2.9. Size distribution histograms from TEM image analysis of POLY-1 NPs for (a) duplicates
and (b) scale-up sample. ... 47 Figure 2.10. TEM images of POLY-1 NPs obtained from the different concentrations of compound 1
tested. The scale bars represent 500 nm. ... 48 Figure 2.11. Size distribution histograms of POLY-1 NPs obtained from TEM image analysis for the
tested concentrations. ... 49 Figure 2.12. Size distribution histogram and (b) TEM image of POLY-4 NPs obtained from the
polymerization of 1,3-bis(TMS)butadiynylbenzene. The scale bar represents 1 μm. ... 50 Figure 2.13. Size distributions histograms obtained from TEM image analysis of POLY-1 NPs
samples before and after UV irradiation. ... 51 Figure 2.14. FT-IR recorded in ATR mode for POLY-1 NPs (97 nm diameter) and PVPVA powders. 51 Figure 2.15. XPS spectra of POLY-1 NPs with (a) 97-nm and (b) 65-nm diameter. ... 52 Figure 2.16. (a) Deconvoluted C 1s XPS spectra of 80-nm POLY-1 NPs and (b) its associated
X
Figure 2.17. TEM image of POLY-1@5 NPs showing mild aggregation. ... 54 Figure 2.18. 1H NMR spectrum of compound 1. ... 54
Figure 2.19. 13C NMR spectrum of compound 1. ... 55
Figure 3.1. (A) Previously reported transformation of alkyne-rich particles with an ortho-substituted benzene ring as a linker to form carbon-rich particles.13 (B) Presented work on the
transformation of diyne-containing TPE particles upon UV irradiation. (C) Upcoming work on the transformation of tetrayne-rich particles comprising TPE moieties in order to form a hybrid AIE/carbon-rich structure with distinct optical properties. ... 62 Figure 3.2. TEM images of P1 synthesized at a 6.4 mM concentration of 1 on (A) 102 mmol scale and (B) 1.02 mol scale. ... 64 Figure 3.3. Particle diameter d of P1 as a function of monomer 1 concentration. Error bars represent
the polydispersity as standard deviation from the mean diameter. More information regarding each data point is found in Figures 3.7 and 3.8. ... 65 Figure 3.4. (A) Absorption spectra of 1, 1’, P1 and P1’ dispersed in 1-PrOH, (B) Fluorescence spectra
of 1, P1 and P1’. The spectrum of 1 is taken in the solid state with an excitation
wavelength of 350 nm, whereas spectra of P1 and P1’ are taken as dispersion in 1-PrOH at an excitation wavelength of 380 nm. ... 67 Figure 3.5. Solid-state MAS 13C NMR spectra of dried P1 and P1’. ... 68
Figure 3.6. Size distribution histogram from TEM images analysis for the scale up synthesis of P1 at 6.4 mM. Distribution was completed with analysis of more than 200 particles. ... 72 Figure 3.7. TEM images of P1 obtained from different concentrations of 1. The scale bar represent
1 µm in all images shown. ... 73 Figure 3.8. Size distribution histograms of P1 obtained from TEM image analysis for the tested
concentrations. More than 200 particles were analyzed per sample. ... 74 Figure 3.9. XPS spectrum of P1 ... 75 Figure 3.10. (A) Size distribution histogram and (B) TEM image of P1’, obtained from the UV
irradiation of P1 under 300 nm light. The scale bar represents 1 µm and the histogram was built from the analysis of over 200 particles. ... 76 Figure 3.11. Fluorescence spectra of P1 and P1’ normalized at the 600 nm band to show the change
in contribution of the bands upon irradiation. The spectra are taken as dispersions in 1-PrOH at an excitation wavelength of 380 nm. ... 77 Figure 3.12. XRD spectrum of P1 and P1'. ... 77 Figure 3.13. TEM images of collapsed P1 particles after refluxing in 1-PrOH for 5 h. ... 78 Figure 3.14. (A) Absorption and (B) fluorescence spectra of P1 before and after (P1*) refluxing in
1-PrOH for 5h. (C) Fluorescence spectrum normalized at the 600 nm band to show negligible change in the bands’ proportion upon the thermal treatment. The spectra are taken as dispersions in 1-PrOH at an excitation wavelength of 380 nm... 78
XI
Figure 3.15. FT-IR spectra of 1, P1 and P1’, showing disappearance of C-H stretching of terminal alkynes (3280 cm-1) and terminal C≡C stretching (2102 cm-1) upon polymerization of 1
into P1 particles. P1 and P1’ show only minor differences in their spectra. ... 79 Figure 4.1. Modulation de l’AIE de dérivés simples par l’augmentation de la conjugaison du
système π ou l’introduction de groupements électrodonneurs et éléctroaccepteurs. Les couleurs des flèches du diagramme d’énergie (gauche) et des composés (droite)
représentent qualitativement l’émission obtenue en fonction des modifications de chacun des composés.52 ... 85
Figure 4.2. Modifications possibles du monomère pour moduler l’AIE des nanoparticules produites. 86 Figure 4.3. Schéma envisageable pour la polymérisation en miniémulsion du
XII
Liste des schémas
Schéma 1.1. Synthèse de GQD par condensation oxydative d'un polyphénylène dentritique.21 ... 11
Schéma 1.2. Couplages de Glaser entre deux alcynes ou deux 1,3-butadiynes terminaux pour générer des 1,4-butadiynes et des 1,3,5,7-octatétraynes respectivement. La lettre R représente un substituant organique quelconque. ... 18 Schéma 1.3. Synthèse de CNP par l’irradiation d'un organogel composé de
1,8-diaryl-1,3,5,7-octatétraynes.42 ... 20
Schéma 1.4. Synthèse de nanoparticules de polymère par couplage de Songoshira selon les
conditions rapportées par Anwar et al.47 ... 22
Schéma 1.5. Méthodologie prévue pour la synthèse de CNP. (A) Polymérisation en dispersion par couplage catalysé de type Glaser, (B) Nucléation et croissance des chaînes polymères, (C) Polymérisation des octatétraynes par additions et cyclisations, générant une
structure majoritairement composée d’atomes de carbone hybridés sp2. ... 24
Schéma 2.1. (a) Synthesis of POLY-3 NPs (b) POLY-1 NPs and (c) POLY-4 NPs. ... 35 Schéma 2.2. Functionalization of POLY-1 NPs with 5. ... 43 Schéma 3.1. Synthesis of P1 particles from Glaser-type Pd/Cu-catalyzed homocoupling dispersion
polymerization. ... 63 Schéma 3.2. Exposition of P1 to UV irradiation. ... 66 Schéma 4.1. Rétrosynthèse envisagée pour l’obtention de
XIII
Liste des abréviations
ABS Absorption
ACQ Extinction induite par agrégation
AIE Émission induite par agrégation
AFM Microscopie à force atomique
ATR Réflectance totale atténuée
a.u. Unité arbitraire
BQ p-Benzoquinone cm Centimètre CND Nanopoint de carbone CNP Nanoparticules de carbone CNT Nanotube de carbone CPC Chlorure de cétylpyridinium
CPN Nanoparticule de polymère conjugué
CQD Point quantique de carbone
d Diamètre
𝑑̅ Diamètre moyen
DBO 1,8-Dioctyl-1,3,5,7-octatétrayne
DMPA 2,2-Diméthoxy-2-phénylacétophénone
DMSO Diméthylsulfoxyde
EDE Émission dépendante de l’excitation
EDTA Acide éthylène diamine tétraacétique
eq. Équivalent
eV Électron-volt
FT-IR Spectroscopie infrarouge à transformée de Fourierr
g Gramme
GO Oxyde de graphène
GQD Point quantique de graphène
h Heure
HBC Hexabenzocoronène
HRMS Spectrométrie de masse à haute résolution
Hz Hertz hν Onde lumineuse IR Infrarouge J Constante de couplage RMN kHz Kilohertz M Molaire
MAS Rotation à l’angle magique
Mcritique Masse molaire critique
mg Miligramme MHz Mégahertz min Minute mL Mililitre mm Milimètre mM Milimolaire
XIV
mmol Milimole
mol Mole
nm Nanomètre
NMR Résonance magnétique nucléaire
PAH Hydrocarbure aromatique polycyclique
PDA Polydiacétylène
PDI Indice de polydispersité
PEG Polyéthylène glycol
PL Photoluminescence
POLY(DBO) Poly(1,8-dioctyl-1,3,5,7-octatétrayne)
PPEI-EI Poly(propionyléthylèneimine-co-éthylèneimine)
ppm Partie par million
PVPVA Poly(1-vinylpyrrolidone-co-vinyl acétate)
s Seconde
SEM Microscopie électronique à balayage
T Tesla
TDDFT Théorie de la fonctionnelle de la densité dépendante du temps
TEM Microscopie électronique à transmission
THF Tétrahydrofurane
TLC Chromatographie sur couche mince
TMS Triméthylsilyle
TMSA Triméthylsilylacétylène
TMSBD (Triméthylsilyl)butadiyne
TPE Tétraphényléthène
TTAB Bromure de tétradécyltriméthylammonium
TX-45 Triton X-45
QD Points quantiques
UCPL Conversion ascendante de photon
UV Ultra-violet
XPS Spectrométrie photoélectronique X
XRD Diffraction des rayons X
λém Longueur d’onde d’émission
λexc Longueur d’onde d’excitation
° Degré °C Degré Celsius µm Micromètre δ Déplacement chimique Δ Chaleur σ Écart-type ∼ Environs ≈ Approximativement égal
XV
« Success is a science; if you have the conditions, you get the result. »
XVI
Remerciements
Mes premiers remerciements vont au Professeur Jean-François Morin, qui a accepté de diriger mes travaux de maîtrise sur un projet possédant peu d’antécédents au laboratoire. Sa présence assidue est primordiale au succès de tout projet de recherche. Je le remercie de m’avoir fait confiance et de m’avoir permis d’apprendre, de grandir et de devenir une meilleure scientifique.
J’aimerais ensuite remercie mes collègues actuels du laboratoire : Patrick, Charles-Olivier, Joël, Maude, Dandan et particulièrement Maxime qui m’a aidé à fonder mes premières racines en chimie organique. Je tiens aussi à mentionner Caroline, Samuel et Antoine qui ont quitté, mais qui m’ont également apporté plusieurs conseils. Ceux qui m’ont côtoyée savent que le « brainstorming » est pour moi un processus d’apprentissage indispensable. Je les remercie aussi pour les moments non-professionnels passés, entre autres, à écouter Pol Martin à Saint-Agathe.
Je remercie la Pr. Anna Ritcey pour l’accès à l’équipement de son laboratoire, mais aussi ses étudiants qui m’ont acceptée dans leur espace de travail. Dans le même ordre d’idée, j’aimerais aussi remercier le Pr. Denis Boudreau pour l’accès aux équipements de son laboratoire. Un merci très particulier à Mélina et Marie-Pier qui m’ont accueillie avec une grande curiosité scientifique pour compléter mes analyses. Merci aussi à Kim et Matthieu pour votre assistance en RMN des solides. Merci aux professionnels de recherche et aux techniciens: Rodica N. Plesu, François Paquet-Mercier, Pierre Audet, Pascale Chevalier, Richard Janvier et André Ferland. Votre encadrement est primordial pour le succès des étudiants de notre université. Merci aussi à Philippe Dufour que j’ai peu côtoyé dans le cadre de mon projet, mais qui s’est grandement impliqué dans mon parcours académique et professionnel.
Je veux également remercier mes parents qui m’ont permis de devenir la femme que je suis autant au niveau professionnel que personnel. Votre implication dans mes études me permet de me dépasser. Sans cet appui, je n’aurais pu me rendre aussi loin. Merci aussi à tous les autres membres de ma famille et de ma belle-famille pour vos encouragements.
Finalement, je me dois de remercier mon conjoint François qui, depuis cinq ans, entend parler de chimie au moins 300 jours par année. Merci de ta patience et d’avoir continué à croire en moi dans mes moments de doute. Tu es mon encrage qui me ramène à la rive lorsque la mer s’emballe.
XVII
Avant-propos
Ce travail de maîtrise a mené à la soumission de l’article scientifique suivant :
« Low-Temperature Synthesis of Carbon-Rich Nanoparticles with Clickable Surface for Functionalization »
Audrey Picard-Lafond and Jean-François Morin.
Département de Chimie and Centre de recherche sur les matériaux avancés (CERMA), 1045 Ave. de la médecine, Université Laval, Québec, Canada G1V 0A6.
Il a été soumis au journal Langmuir (American Chemical Society) le 13 janvier 2017, puis accepté le 11 mai 2017. Le Chapitre 2 de ce mémoire présente cet article intégralement sans modification, incluant la section « Informations supplémentaires » à la suite du manuscrit.
Ma contribution à ce manuscrit est très significative. J’ai effectué la synthèse complète des monomères, des nanoparticules et du ligand. J’ai fait la caractérisation complète des matériaux étudiés. J’ai également fait la rédaction complète de l’article, corrigé par Pr. Morin, ainsi que la section « Informations supplémentaires » qui l’accompagne.
XVIII
Ce travail de maîtrise a aussi mené à la soumission d’un deuxième article scientifique s’intitulant :
« Tetraphenylethene-Diyne Hybrid Nanoparticles from Glaser-type Dispersion Polymerization » Audrey Picard-Lafond, Maxime Daigle and Jean-François Morin.
Département de Chimie and Centre de recherche sur les matériaux avancés (CERMA), 1045 Ave. de la médecine, Université Laval, Québec, Canada G1V 0A6.
Il a été soumis au journal RSC Advances (Royal Society of Chemistry) le 21 avril 2017, puis accepté le 13 juillet 2017. Le Chapitre 3 de ce mémoire présente cet article intégralement sans modification, incluant la section « Informations supplémentaires » à la suite du manuscrit.
Ma participation à la soumission de ce manuscrit est très importante. J’ai effectué la synthèse du monomère et des nanoparticules ainsi que leur caractérisation complète. J’ai également rédigé l’article dans son entièreté, incluant la section « Informations supplémentaires », qui fut ensuite corrigé par Maxime Daigle, étudiant au doctorat en chimie, et Pr. Morin.
1
1.
Introduction
1.1. Les matériaux riches en carbone
Le carbone élémentaire existe sous plusieurs formes allotropiques naturelles telles que le diamant et le graphite. Le premier consiste en un réseau étendu d’atomes de carbone d’hybridation sp3, alors que le second réseau ne contient que des atomes de carbone hybridés sp2. Ces deux
structures, dont l’organisation spatiale des atomes est régulière et périodique, sont dites cristallines. Au contraire, le carbone amorphe se différencie par l’absence d’ordre positionnel des atomes à longue distance.
Figure 1.1. Représentations du diamant et du graphite par modèle moléculaire boules-bâtonnets.
Il est connu depuis plusieurs années déjà que d’autres formes allotropiques du carbone peuvent se former naturellement. Ces formes se différencient par des altérations dans le motif de liaisons périodiques du diamant ou du graphite. En 1985, une molécule de carbone sphérique, appelée le buckminsterfullerène et abbréviée C60, fut découverte par Kroto, Curl et Smalley, qui leur
a valu le prix Nobel de chimie en 1996.1 Cette structure est composée de 60 atomes de carbone
d’hybridation sp2, formant 20 hexagones et 12 pentagones dont les sommets représentent les
atomes de carbone et les arêtes les liaisons covalentes qui les unissent. Cette découverte a mené à la formation de la famille des fullerènes qui inclue les molécules de carbone sphériques et ellipsoïdes creuses comme le C60, le C70 et autres formes tubulaires. C’est en 1991 que Sumio Ijima fit la
première synthèse de nanotubes de carbone (CNT), une structure composée de feuillets d’atomes de carbone d’hybridation sp2 enroulés sur eux-mêmes de façon à former un tube.2 Plus tard, en 2004,
2
d’atomes de carbone d’hybridation sp2 arrangés en un réseau hexagonal bidimensionnel.3 Cette
structure est à la base du graphite, des nanotubes de carbone ainsi que des fullerènes qui ont été présentés ci-haut.
Figure 1.2. Représentations de formes allotropiques du carbone d'hybridation sp2 par modèle
moléculaire boules-bâtonnets.
Depuis ces découvertes, la famille des nanomatériaux de carbone offre une gamme de matériaux prometteurs pour différentes applications grâce à leurs excellentes propriétés optoélectroniques. Comme plusieurs autres matériaux, les propriétés et les fonctions des nanomatériaux de carbone peuvent être modulées par l’altération de leur forme, leur taille et leur dimensionnalité. Le repliement d’un feuillet de graphène sur lui-même pour former un CNT ou la coupe en bandes d’un feuillet de graphène pour former un nanoruban en sont de bons exemples.
Parmi les matériaux de carbone connus à ce jour, les nanoparticules de carbone (CNP) forment une nouvelle classe de nanomatériaux fluorescents dont les méthodes de synthèse, les propriétés optiques et les applications sont grandement étudiées. Dans ce mémoire, les CNP seront mises en relief afin d’expliquer les problématiques actuelles qui y sont rattachées et subséquemment fournir une piste de solution.
3
1.2. Les nanoparticules de carbone 1.2.1. Découverte
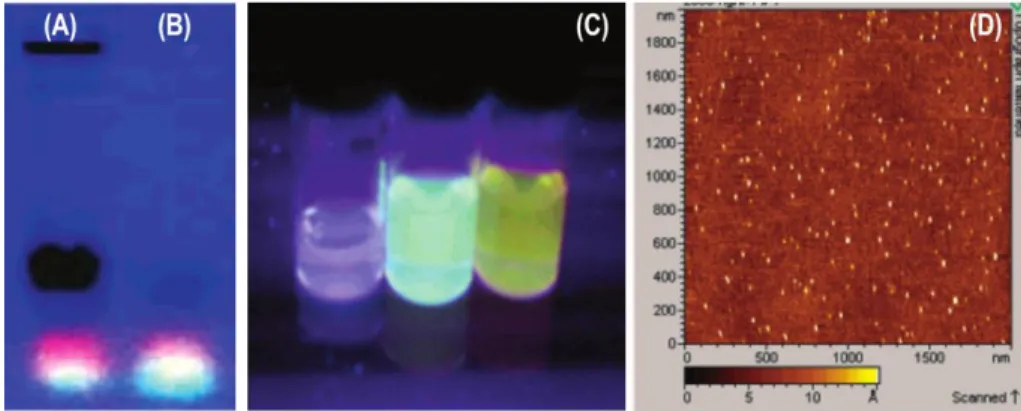
Les nanoparticules de carbone fondent une classe récente parmi les nanomatériaux de carbone, considérant leur découverte en 2004 par Xu et al.4 Leur obtention fut accidentelle, alors que
les chercheurs désiraient établir une méthode de purification de CNT issue de l’ablation par arc électrique. Cette méthode est reconnue pour générer un produit brut très impur. Ainsi, pour séparer les CNT d’intérêt, les chercheurs ont eu recours à l’électrophorèse préparative à l’aide d’un gel d’agarose 1%. Leur méthode a mené à la découverte de deux nouvelles classes de nanomatériaux de carbone. L’une de ces classes contient de courts segments de carbone tubulaire, et l’autre est un mélange de nanoparticules de carbone fluorescentes, qui ont été mises en lumière dans les années subséquentes grâce à cette propriété optique. Ces premières CNP isolées ont pu être séparées en plusieurs fractions ayant une luminescence particulière sous lumière UV. En analysant ces fractions par la méthode d’analyse élémentaire, les chercheurs ont identifié 54% de carbone et 40% d’oxygène. L’analyse par microscopie à force atomique (AFM) a permis de confirmer une structure particulaire d’une hauteur moyenne de 1 nm.
Figure 1.3. Résultats obtenus des recherches de Xu et al.4 (A) Profil d’électrophorèse de la
suspension de suie brute issue de l’ablation par arc électrique, (B) profil d’électrophorèse du carbone fluorescent isolé de la suspension brute, (C) fractions de ce carbone fluorescent sous irradiation UV (365 nm), (D) image de tomographie AFM pour la fraction orange du carbone fluorescent.
4
1.2.2. Nomenclature et structures
Le terme « nanoparticule de carbone » est utilisé, de façon assez générale, pour caractériser plusieurs matériaux de carbone dont la taille est nanométrique. Les CNP sont souvent aussi rapportées sous le nom de « point de carbone », dont la définition plus rigoureuse stipule qu’au moins l’une des dimensions est inférieure à 10 nm en taille, et que la fluorescence fait partie des propriétés intrinsèques du matériau.5 Au niveau de la structure atomique, les CNP sont constituées
d’atomes de carbone d’hybridation sp2 et/ou sp3 ainsi que de groupements fonctionnels oxygénés
et/ou azotés. L’arrangement bi- ou tridimensionnel de ces atomes est variable, menant à des nomenclatures plus spécifiques. À ce jour, il n’y pas de consensus clair pour la nomenclature de ces différentes structures de CNP. Par souci de clarté, nous définirons ici les structures concernées selon trois catégories : les points quantiques de graphène (GQD), les points quantiques de carbone (CQD) et les nanopoints de carbone (CND).
Un GQD est une section circulaire d’une monocouche de graphène munie de fonctions chimiques en périphérie. Les GQD sont dits anisotropiques en raison de leurs dimensions latérales qui sont plus élevées que la hauteur, limitée à celle de l’atome. Les CQD ont une composition chimique similaire aux GQD, mais ils se distinguent par une multicouche de segments circulaires de graphène plutôt qu’une couche unique. Finalement, les CND, eux, sont décrits comme une matrice sphérique dont l’intérieur est majoritairement amorphe. Il est cependant possible de retrouver certains domaines graphitiques dans ces structures.
Figure 1.4. Sous-catégories de CNP selon leur structure, où les groupements fonctionnels potentiels en périphérie des structures ont été négligés par souci de clarté.
5
1.2.3. Méthodes de synthèse
En raison de la variété des structures de CNP existantes, plusieurs approches pour leur synthèse sont rapportées. De façon générale, ces méthodes de préparation peuvent être séparées en deux catégories : les méthodes ascendantes et descendantes. Par définition, une méthode descendante, ou en anglais « top-down », nécessite un système complexe qui sera décomposé en plus petits fragments. En contrepartie, une méthode ascendante, appelée en anglais « bottom-up », nécessite plutôt un élément de base à assembler pour bâtir un système final plus complexe. Les sections ci-dessous décrivent les méthodes de synthèse de CNP les plus populaires, divisées selon leur catégorie respective.
1.2.3.1. Méthodes descendantes
Les méthodes descendantes pour la synthèse de CNP requièrent un matériau de carbone comme unité de départ. Ce dernier est sectionné par une disruption chimique ou mécanique en plus petits fragments afin d’induire de nouvelles structures et propriétés. Par exemple, le graphite sous sa forme massique est non fluorescent et insoluble. L’application d’un traitement chimique ou mécanique permet de fractionner ce matériau et ainsi le doter de nouvelles propriétés de fluorescence et de solubilité. En raison de la nature intrinsèque des matériaux de départ, soit qu’ils sont dérivés de la famille du graphène, les CNP obtenues de ces synthèses sont graphitiques et correspondent ainsi à des GQD ou des CQD en fonction de leur dimensionnalité.
Tel qu’indiqué à la Figure 1.5, plusieurs méthodes de synthèse de CNP entrent dans la catégorie des méthodes descendantes. En raison de la variété des procédés existants, seulement un exemple de chacune de ces méthodes sera détaillé dans cette section. La revue détaillée de différentes méthodes de synthèse peut être obtenue dans la littérature scientifique.6,7
6
Figure 1.5. Méthodes de synthèse descendantes de CNP à partir de matériaux riches en carbone.
L’oxydation acide est un traitement chimique typiquement effectué sous conditions très acides à reflux, et mène à l’introduction de groupements fonctionnels oxygénés à la surface des particules. Un exemple de ce type de traitement utilise la suie de gaz naturel pour faire la synthèse de CNP.8 Dans cette méthode, une suie de carbone est collectée sur la paroi d’un bécher en verre
placé au-dessus de la flamme d’un bruleur au gaz naturel. Cette suie est ensuite mise à reflux dans une solution d’acide nitrique concentré (HNO3, 5 M) pendant plusieurs heures. La solution résultante
est centrifugée puis le surnageant neutralisé avant d’être dialysé pour obtenir des CNP graphitiques pures et solubles de ∼ 5 nm de diamètre avec une photoluminescence dans le domaine du bleu.
L’oxydation électrochimique est une autre méthode, cette fois-ci mécanique, pour la préparation de CNP par voie descendante. Dans un exemple de cette méthode, un voltage est appliqué sur une électrode de graphite dans une solution aqueuse de phosphate monosodique (NaH2PO4 0,1 M) servant d’électrolyte. Avec l’augmentation du temps d’électro-oxydation, l’anode de
graphite est consommée dans la solution d’électrolyte. Cette solution est centrifugée pour retirer le dépôt non fluorescent, puis le surnageant est purifié par ultrafiltration avec des membranes de différentes coupures de poids moléculaires pour obtenir des CNP cristallines de tailles et de photoluminescence variées (λém = 445 – 510 nm).9
GQD
CQD C60
GO
Graphite CNT Oxydation acide
Oxydation électrochimique Traitement hydrothermal Ablation laser
7
Une autre méthode de synthèse descendante mécanique est l’ablation par arc électrique. Cette technique fut initialement mise en place pour la synthèse des fullerènes, mais fut ensuite appliquée pour la synthèse sélective de CNT. C’est d’ailleurs à partir de la purification de CNT obtenus par cette méthode que les premières CNP fluorescentes ont été découvertes (section 1.2.1).4 Dans ce procédé, un plasma produit par l’arc électrique est généré entre deux
électrodes de graphite. La vapeur de carbone collectée est composée de matériaux riches en carbone sp2 (ex. des feuilles de graphite, des CNT, des fullerènes, du carbone amorphe, etc.) selon
les conditions de synthèse utilisées. Dans les conditions appliquées lors de leur découverte, les CNP obtenues possédaient un diamètre de 1 nm et moins de 18 nm de dimension latérale, avec une luminescence variable selon la taille des particules isolées.
La synthèse par ablation laser est une méthode physique utilisée similaire à l’ablation par arc électrique. Dans ce système, un laser est envoyé sur une cible de graphite placée dans un four chauffé à très haute température. La vapeur de carbone formée prend de l’expansion puis est refroidie sur un doigt collecteur. Tout comme l’ablation par arc électrique, cette méthode fut d’abord utilisée pour la synthèse de CNT, mais elle est maintenant applicable à synthèse de CNP. Un exemple est l’ablation laser d’une cible de carbone en présence de vapeur d’eau et d’argon comme gaz transporteur à 900 °C et 75 kPa.10 Cependant, l’échantillon brut est composé de nanoparticules
de carbone de tailles variées non luminescentes. Afin d’arriver à un matériau aux propriétés optiques intéressantes, l’échantillon est traité dans une solution aqueuse d’acide nitrique à reflux, puis passivé en attachant des espèces organiques telles que le polyéthylène glycol (PEG) ou le poly(propionyléthylèneimine-co-éthylèneimine) (PPEI-EI) à la surface. Les CNP de ∼ 5 nm présentent une photoluminescence dépendante de l’excitation (voir section 1.2.4.1.), alors que les CNP plus grosses (30 – 50 nm) sont moins luminescentes même avec leur passivation en surface.
La méthode hydrothermale est une technique de synthèse en milieu aqueux à haute température et pression de vapeur qui est aussi utilisée pour la synthèse de CNP. Dans un exemple de ce type de procédé, des feuilles de graphène sont oxydées en milieu acide (H2SO4, HNO3), ce qui
a pour effet d’introduire des groupements fonctionnels oxygénés (ex. carbonyles, alcools, acides carboxyliques, époxydes, etc.) qui rendent les feuilles solubles en milieu aqueux. Après purification par filtration, ces oxydes de graphène (GO) sont dispersés dans de l’eau en milieu basique. La
8
dispersion subit ensuite le traitement dit de désoxydation hydrothermale dans un autoclave à 200 °C pour 10 heures. La suspension résultante est filtrée pour récupérer la solution contenant des nanoparticules de graphène de 10 nm de diamètre caractérisées par une fluorescence bleue.11
1.2.3.2. Méthodes ascendantes
Les méthodes ascendantes pour la synthèse de CNP requièrent l’utilisation de molécules organiques ou de polymères divers comme unité de départ. Typiquement, ces matières de départ subissent une carbonisation par l’exposition à diverses sources de chaleur. En variant les composés chimiques et la méthode de carbonisation en jeu, il est possible de moduler les propriétés des CNP. Entre autres, l’utilisation de précurseurs contenant des atomes ou groupements fonctionnels spécifiques permet d’obtenir les fonctionnalités résultantes en surface des particules. Par exemple, l’utilisation du chitosan, qui contient des amines dans sa structure, permet de générer des nanoparticules de carbone avec des fonctionnalités amines à sa surface si les conditions de carbonisation sont optimales.12 De façon similaire, la stabilité colloïdale et la solubilité des CNP
peuvent être contrôlées en choisissant un précurseur approprié. L’utilisation du chlorure de cétylpyridinium (CPC), un surfactant cationique, comme source de carbone permet de générer des nanoparticules dotées d’une surface amphiphile. Le CPC possède une haute teneur en carbone et des systèmes π hétéroaromatiques permettant de contribuer à la fluorescence des CNP formées.13
9
Figure 1.6. Méthodes de synthèse ascendantes de CNP à partir de précurseurs moléculaires riches en carbone.
La synthèse de CNP par la carbonisation peut s’effectuer à l’aide de plusieurs sources de chaleur telles que la fournaise,14 l’autoclave,13 la torche plasma,15 et le four micro-ondes.16 Un
exemple simple usant de la fournaise est la pyrolyse de sels d’acide éthylène diamine tétraacétique (EDTA) soumis à 400 °C sous atmosphère inerte. Après centrifugation pour retirer les fractions insolubles, le produit récupéré contient des CNP solubles aux propriétés d’émission uniques selon les paramètres utilisés (pH, solvant, λexc).17 Dans un même ordre d’idées, la technologie micro-ondes
peut être appliquée pour la carbonisation de molécules simples, comme l’acide citrique et l’éthylènediamine.16 L’acide citrique est une source de carbone contenant des groupements
carboxyliques facilitant la déshydratation et la carbonisation. L’éthylènediamine, quant à elle, sert d’agent de passivation et de dopant pour introduire des atomes d’azote dans la structure des CNP.
Les nanoparticules obtenues de ces carbonisations sont généralement amorphes en raison de la structure non graphitique des matériaux de départ. Ainsi, les CNP obtenues appartiennent généralement à la catégorie des CND. Des nanoparticules graphitiques peuvent cependant être obtenues par synthèse ascendante en utilisant l’hexabenzocoronène (HBC), un hydrocarbure
CND Saccharose O2 Carbonisation Déshydratation extrême Chitosan EDTA Acide citrique
Et autres glucides et molécules simples…
10
aromatique polycyclique (PAH), comme précurseur.18 Les unités HBC sont auto-assemblées en
colonne puis leur pyrolyse permet de former du graphite artificiel. C’est une étape terminale d’exfoliation oxydative et de fonctionnalisation qui permet de rendre ces CNP, de ∼ 60 nm de diamètre et 2-3 nm d’épaisseur, solubles et photoluminescentes.
Figure 1.7. Préparation de GQD luminescents par auto-assemblage et pyrolyse du HBC. Représentation adaptée de Liu et al.18
En plus de la carbonisation, la déshydratation extrême de sources de carbone est aussi utilisée pour la synthèse de CNP. Plusieurs exemples simples s’effectuent à l’aide de glucides comme matériau de départ.19 Ces derniers sont déshydratés en utilisant de l’acide sulfurique
concentré (H2SO4), ce qui génère un matériau carboné qui est ensuite brisé en nanoparticules
individuelles par un traitement avec l’acide nitrique (HNO3). Ces nanoparticules carbogènes sont par
la suite passivées par des molécules terminées en amine. L’émission résultante du matériau est dépendante de l’excitation (voir section 1.2.4.1.) et peut être modulée en fonction du glucide de départ (soit le glucose ou l’amidon) et le temps du traitement à l’acide nitrique.19 D’autres travaux
employant le saccharose ont subséquemment été rapportés, où le contrôle sur la carbonisation s’effectue seulement avec l’utilisation d’acide sulfurique.20 La synthèse mène à des CNP de 1-2 nm
avec une luminescence verte sans passivation en surface.
Une autre approche de synthèse ascendante particulièrement ciblée pour la production de GQD procède par synthèse organique en phase liquide.21 De larges PAH contenant de 132 à 170
atomes de carbone conjugués sont synthétisés à partir d’un précurseur polyphénylène dendritique sur lequel sont appliquées des réactions de condensation oxydative développées par Scholl.22 Les
soucis de stabilité et de solubilité de ces unités sont surmontés par des groupements solubilisants attachés de façon covalente en périphérie des unités.
11
Schéma 1.1. Synthèse de GQD par condensation oxydative d'un polyphénylène dentritique.21
1.2.4. Propriétés de photoluminescence
Les CNP possèdent plusieurs propriétés optiques particulières très intéressantes qui augmentent leur potentiel pour diverses applications (section 1.2.5.2). Les propriétés de photoluminescence des CNP varient en fonction de la voie de synthèse employée, que leur structure soit cristalline ou non. Les différents exemples des méthodes de synthèse présentés à la section 1.2.3 mènent à des propriétés uniques à chacun des cas. Un changement des paramètres réactionnels, pour une même voie de synthèse, peut affecter les propriétés optiques retirées du matériau. En conséquence, peu de tendances structure-propriétés sont établies et l’origine de la photoluminescence des CNP est encore un sujet de discussion actif dans la communauté scientifique. Dans les sections suivantes, nous aborderons les deux types de propriétés de photoluminescence les plus répandues des CNP, avec des exemples pour les appuyer. Une section sur l’origine de la photoluminescence des particules de carbone est également inclue.
1.2.4.1. Émission dépendante de l’excitation
L’émission dépendante de l’excitation (EDE), une des propriétés très distinctives des CNP, stipule que la longueur d’onde d’émission de fluorescence est affectée par la longueur d’onde qui est employée pour exciter l’échantillon. Un exemple intéressant est celui de CNP synthétisées par ablation laser (exemple exposé à la section 1.2.3.1.).10 Les CNP obtenues de cette méthode n’ont
pas de photoluminescence particulière à leur état brute. Cependant, lorsque ces dernières sont oxydées en surface puis passivées de molécules organiques, des propriétés d’EDE sont obtenues
12
(Figure 1.8 (A)). Dans une première expérience, les chercheurs ont passivé les CNP de chaînes PEG. En excitant la dispersion aqueuse à des longueurs d’onde d’excitation (λexc) allant de 400 nm à
694 nm, une coloration allant du bleu au rouge peut être observée plus la longueur d’onde d’excitation est élevée (Figure 1.8 (B)). Dans une deuxième expérience, les chercheurs ont passivé les CNP de PPEI-EI puis ont collecté des spectres de photoluminescence à différentes λexc
(Figure 1.8 (C)). Encore une fois, l’étude démontre l’effet d’EDE, où plus la longueur d’onde d’excitation est élevée, plus la fluorescence obtenue sera de longueur d’onde élevée également.
Figure 1.8. Résultats obtenus des recherches de Sun et al.10 (A) Schématisation de l’effet de
l’attachement d’espèces organiques à la surface des CNP sur les propriétés optiques, (B) solutions aqueuses des CNP passivées de PEGet excitées aux longueurs d’onde indiquées, (C) spectres d’émission d’une solution aqueuse des CNP passivées de PPEI-EI (λexc = 400 nm à gauche puis
incrément de 20 nm pour chaque spectre subséquent vers la droite).
Tel qu’énoncé précédemment, les CNP brutes obtenues de l’ablation laser sont non luminescentes. Les molécules organiques greffées en surface, le PEG et le PPEI-EI, sont également non émissives aux longueurs d’onde visibles. Ainsi, la luminescence obtenue doit provenir du système de passivation en surface des CNP. Il est noté également que seule la passivation des CNP de 5 nm de diamètre fut efficace pour témoigner de l’EDE. Les CNP de 30-50 nm de diamètre, bien qu’elles soient passivées, ne mènent à aucune luminescence.10
PEG ou PPEI-EI PEG ou PPEI-EI Émission de la surface passivée (A) (B) (C) λexc= 400 nm ABS
13
1.2.4.2. Conversion ascendante de photon
Dans un système propice à la fluorescence, l’absorption d’un photon par un électron de l’état fondamental permet une excitation pour atteindre un état électronique plus élevé. Après relaxation vibrationnelle, l’électron peut se désexciter de façon radiative pour retourner à son état fondamental. Ce processus est la fluorescence usuellement observée, où l’énergie libérée est plus faible que celle d’abord fournie au système. La photoluminescence par conversion ascendante de photon (UCPL) est un processus par lequel un système absorbe plus d’un photon afin de générer une émission de lumière plus énergétique que l’excitation fournie au système. Ce mécanisme multi-photon est retrouvé dans plusieurs CNP. Contrairement à la fluorescence usuelle, un électron de l’état fondamental absorbe deux photons de basse énergie, en passant par un état intermédiaire, pour être excité à un niveau électronique supérieur. Dans ce cas-ci, la recombinaison radiative jusqu’à l’état fondamental permet l’émission d’un photon dont l’énergie est plus haute que celle utilisée pour son excitation (Figure 1.9 (A)).
Un exemple de synthèse de CNP au caractère UCPL est obtenu par l’oxydation électrochimique en milieu alcalin d’électrodes de graphite.23 Dans une expérience de
spectrofluorimétrie, il a été observé que les CNP de tailles inférieures à 3,8 nm peuvent être excitées par de faibles énergies (λexc = 500 – 1000 nm), et détenir des longueurs d’onde d’émission de 325 à
425 nm (Figure 1.9 (B)). Une observation additionnelle intéressante de leur expérience est que la longueur d’onde d’émission obtenue est dépendante de l’excitation. D’autres exemples de la littérature rapportent la synthèse de CNP présentant de l’UCPL, mais dont la longueur d’onde d’émission est indépendante de celle d’excitation.24-25
14
Figure 1.9. (A) Diagramme énergétique simplifié d’un procédé UCPL, où les niveaux vibrationnels ont été négligés par souci de clarté. (B) Spectre 3D de photoluminescence de CNP démontrant des propriétés d'UCPL. Résultats obtenus des recherches de Li et al.23
1.2.4.3. Origine de la photoluminescence
L’origine de la photoluminescence des CNP est un sujet très discuté dans la littérature.5,26 La
photoluminescence très variable observée d’une méthode de synthèse à l’autre peut être justifiée par différentes explications scientifiques : le confinement quantique, les états de surface et la composition du cœur de carbone.
Le confinement quantique est observé dans les matériaux semi-conducteurs où les électrons sont limités dans une ou plusieurs dimensions. Ce phénomène est bien connu pour les nanocristaux colloïdaux de semi-conducteurs inorganiques appelés points quantiques pour cette raison. Cependant, le confinement peut aussi se produire dans les matériaux de carbone semi-conducteurs dérivés du graphène. Des chercheurs ont effectué des calculs par la théorie de la fonctionnelle de la densité dépendante du temps (TDDFT) pour démontrer que la photoluminescence des GQD est modulée par la taille des unités confinés.27 Par exemple, pour un cas de GQD sans défauts ni
groupements fonctionnels, ils ont calculé la longueur d’onde d’émission obtenue selon des diamètres de GQD allant de 0,46 à 2,31 nm. Le résultat révèle que plus la taille du GQD est élevée, plus la longueur d’onde d’émission l’est également.
E
UCPL
(B) (A)
15
La composition du cœur de carbone peut également être à l’origine de la photoluminescence des CNP. Tel qu’exposé à la section 1.2.2, les CND ont une structure pouvant inclure à la fois des atomes de carbone d’hybridation sp2 ou sp3. Ceci suggère qu’une conjugaison électronique π doit
exister, mais elle demeure irrégulière et discontinue en petits fragments de façon à former des domaines aromatiques et aliphatiques coexistants. 26 Dans cet ordre d’idées, des chercheurs ont
investigué les propriétés optiques de CNP en développant un système modèle composé de PAH aux concentrations variables dans une matrice de polymère.28 Leurs résultats suggèrent que l’émission
dépendante de l’excitation pourrait provenir d’une excitation sélective des divers PAH, ayant des écarts énergétiques différents, et de transfert d’énergie entre ces PAH.
L’état de surface est également rapporté comme l’origine de la photoluminescence de plusieurs CNP. Tel que mentionné dans la section 1.2.3, plusieurs méthodes de synthèse génèrent un cœur riche en carbone, mais dont la surface est hybridée de groupements fonctionnels. Ces derniers correspondent à des pièges émissifs par lesquels il peut y avoir transfert d’énergie (Figure 1.10). Pour vérifier si la photoluminescence observée provient effectivement des sites de surface, il est possible de faire un traitement au plasma sur les particules afin de retirer les groupements fonctionnels en surface. Si l’émission perçue est inchangée, la photoluminescence observée ne provenait pas de ces sites de surface.23
Figure 1.10. Schématisation de l'émission d'une CNP portant des groupements fonctionnels en surface agissant comme sites émissifs.
16
Plusieurs nanoparticules ne présentent pas de fluorescence sans passivation. Tel que mentionné à plusieurs reprises, les méthodes de synthèse mènent à des structures uniques dont les propriétés de photoluminescence sont également affectées. Ainsi, la photoluminescence peut se présenter sous différents phénomènes (EDE, UCPL) qui peuvent être expliqués selon différentes théories en fonction de la taille, de la composition interne et de l’état de surface du matériau obtenu.
1.2.5. Intérêts
1.2.5.1. Avantages particuliers
Les CNP présentent plusieurs attributs favorables qui sont également retrouvés dans les semi-conducteurs inorganiques traditionnels appelés points quantiques (QD).29 Parmi ces
caractéristiques, comptons l’émission dépendante de la taille et de l’excitation (section 1.2.4.2), la résistance au photo-blanchiment et la facilité de bioconjugaison. L’atout particulier des CNP est qu’elles ne possèdent pas les limitations associées aux QD. Entre autres, il est bien connu que les QD sont intrinsèquement toxiques et sont composés de métaux rares contrairement au carbone qui est abondant, bénin et peu couteux. Aussi, alors que les QD sont obtenus par des étapes de préparation complexes, fastidieuses, coûteuses et peu efficaces, les CNP sont produites à grande échelle de façon peu coûteuse selon plusieurs méthodes de synthèse (section 1.2.3.) De surcroit, les CNP sont supérieures aux QD et aux pigments organiques en termes de solubilité, d’inertie chimique et de facilité de fonctionnalisation.30,31
1.2.5.2. Applications
Les propriétés de photoluminescence des CNP, en plus de leurs avantages particuliers, permettent à ce matériau d’être envisagé dans plusieurs applications. La littérature scientifique regorge d’études appliquant les CNP en imagerie biomédicale en raison de leur faible toxicité.32-34 De
plus, le domaine de l’énergie peut tirer profit de l’incorporation de CNP dans plusieurs dispositifs. D’une part, les CNP peuvent être utilisées comme photocatalyseurs pour la réduction efficace du CO2 grâce à leur habilité de donneur d’électron.35 D’autre part, les CNP peuvent être utilisées comme
sensibilisateurs dans les cellules solaires grâce à leur forte absorption lumineuse dans le domaine du proche infrarouge.21,36 Elles peuvent aussi être utilisées dans des couches composites servant à
17
convertir la lumière UV récoltée du soleil en lumière moins énergétique et ainsi augmenter l’efficacité de la cellule solaire.37
En ajout aux applications biologiques et énergétiques, certaines méthodes de synthèse de CNP permettent de viser plus d’une application simultanément. Des CNP photoluminescentes obtenues d’une condensation hydrothermale entre l’acide citrique et l’éthylène diamine ont pu être appliquées comme encres d’impression pour produire des motifs multicouleurs à l’échelle du micromètre.38 Ces particules ont aussi été incorporées dans des composites fonctionnels
envisageables pour des applications anti-contrefaçon. Finalement, les chercheurs ayant développé ces CNP ont aussi appliqué ces dernières comme biosenseurs capables de détecter le Fe(III) dans un biosystème par l’extinction de fluorescence des CNP. Ainsi, les applications des CNP sont très variées en fonction des propriétés générées par leur synthèse.
1.2.6. Problématiques
Les problèmes actuels associés aux nanoparticules de carbone découlent principalement de leurs méthodes de synthèse. Pour préparer des matériaux de carbone hautement définis, le meilleur moyen est d’avoir un contrôle précis sur les paramètres de réaction. Il est possible d’ajuster les conditions de certaines voies de synthèse afin d’obtenir préférentiellement un type de nanomatériau de carbone spécifique, c’est-à-dire des CNT, du GO ou des CNP. Cependant, la majorité des méthodes produisant des CNP, telles que l’ablation laser ou la combustion d’hydrocarbures, génère des matériaux impurs, non uniformes et non reproductibles. Ce problème est causé par l’utilisation de températures élevées, soit supérieures à 100 °C, où le contrôle des paramètres structuraux est trop limité pour atteindre une haute définition. Ce désavantage de synthèse limite l’applicabilité industrielle des CNP obtenues actuellement.
En plus de l’insuffisance du contrôle structurel, les méthodes courantes sollicitent des extractions laborieuses afin de séparer les CNP des réactifs de départ résiduels ou de produits secondaires (CNT, GO, etc.). De surcroit, ceci mène à de faibles rendements réactionnels, rendant les procédés difficilement applicables à grande échelle même si les matériaux de départ sont peu coûteux.
18
Finalement, bien que leur stabilité chimique soit supérieure à celle des QD, les CNP sont souvent chimiquement inertes en surface. Ainsi, pour arriver à fonctionnaliser le matériau et lui fournir des propriétés additionnelles, l’incorporation préalable de groupements oxygénés réactifs est nécessaire. En plus d’ajouter une étape à leur préparation, ces procédés de passivation introduisent une variété de groupements fonctionnels (carbonyle, époxyde, alcool, etc.) à des endroits non spécifiques de la surface. La reproductibilité de la passivation et de la fonctionnalisation subséquente en est donc affectée.
1.3. Les polyynes
Une méthode prometteuse pour préparer des nanomatériaux de carbone qui sont thermodynamiquement stables, sans avoir recourt à de hautes températures, est d’utiliser des précurseurs riches en alcynes.39 L’alcyne est un groupement fonctionnel métastable facile à
transformer sans ajout excessif d’énergie. Ce dernier est suffisamment réactif pour être utilisé dans plusieurs réactions de chimie organique, mais aussi assez stable pour être préparé et manipulé sans subir de décomposition significative. Les alcynes terminaux peuvent aussi être couplés entre eux dans des conditions variées pour former des polyynes. Le couplage de Glaser est un exemple bien connu employant un catalyseur de cuivre (I) pour permettre la formation de 1,3-butadiynes symétriques à partir d’alcynes terminaux placés en conditions basiques en présence d’oxygène.40 Ce
couplage peut aussi être utilisé pour la synthèse de 1,3,5,7-octatétraynes à partir d’unités 1,3-butadiynes terminaux. La formation de ces séquences prolongées d’alcynes permet d’exploiter une réactivité particulière aux polyynes pour synthétiser des matériaux de carbone en conditions douces.
Schéma 1.2. Couplages de Glaser entre deux alcynes ou deux 1,3-butadiynes terminaux pour générer des 1,4-butadiynes et des 1,3,5,7-octatétraynes respectivement. La lettre R représente un substituant organique quelconque.
19
1.3.1. Réactivité : instabilité photochimique et thermique
Les polyynes, qu’ils soient organisés ou non, peuvent polymériser entre eux par des mécanismes d’additions et de cyclisation lorsqu’ils sont exposés un stimulus externe tel que de la lumière ou de la chaleur (Figure 1.11).41 Certaines structures issues de ces polymérisations sont
bien connues, telles que le polydiacétylène (PDA) qui résulte d’une addition-1,4 entre des polyynes adjacents. Ces polymérisations peuvent être induites à des températures relativement basses, c’est-à-dire sous 100 °C, ou par exposition à la lumière UV.
Figure 1.11. Produits d'addition et de cyclisation obtenus de la polymérisation d'unités 1,3-butadiynes entre eux, où R est un substituant organique quelconque. L'encadré ombragé dénote le motif polydiacétylène (PDA).
1.3.2. Précurseurs à la synthèse de matériaux riches en carbone sp2
La littérature scientifique témoigne du succès de l’utilisation de polyynes comme précurseurs pour la préparation de matériaux de carbone.39 Un exemple particulier démontre qu’il est possible
d’obtenir des microsphères de carbone à partir du 1,8-dibutyl-1,3,5,7-octatétrayne (DBO).41 Dans
cette synthèse, la première étape est de polymériser le DBO en suspension pour obtenir des microsphères du polymère (poly(DBO)). Alors que la polymérisation des unités 1,3,5,7-octatétraynes est induite par un chauffage à 80 °C, la forme sphérique du polymère est assurée par une solution aqueuse d’alcool polyvinylique qui stabilise les particules résultantes. Le désavantage de cette méthode est qu’elle requiert la carbonisation à 800 °C de l’échantillon afin d’obtenir une
Addition-1,2
Addition-1,6 Addition-3,6
Cyclisation Addition-1,4
20
transformation des alcynes résiduels en atomes de carbone d’hybridation sp2. Également, la taille
des particules de carbone obtenues par cette méthode est de l’ordre du micron, ce qui dépasse largement l’ordre de grandeur visé par les applications du domaine nanoscopique.
Figure 1.12. Synthèse de microsphères de carbone par polymérisation en suspension d’un dérivé 1,3,5,7-octatétrayne puis pyrolyse subséquente. Résultats SEM obtenus des travaux de Ding et al. 41
Un autre exemple de l’utilisation de polyynes pour la synthèse de matériaux de carbone sphériques provient des travaux du groupe du Pr. Morin.42 En 2012, l’irradiation d’un organogel formé
d’un dérivé 1,8-diaryl-1,3,5,7-octatétrayne a mené à l’obtention de nanoparticules de carbone graphitique amorphe. Des fonctions amides sur le précurseur riche en alcynes ont pour rôle de pré-organiser les unités et ainsi diriger les réactions d’addition entre les 1,3-5-7-octatétraynes. L’organogel formé de ces unités organisées a une structure en fibres, mais la polymérisation par irradiation UV modifie sa morphologie afin d’obtenir des particules de 130 à 350 nm caractérisées par une fluorescence jaune. Bien que le mécanisme exact de ce changement de morphologie soit inconnu, cette voie de synthèse effectuée à température ambiante est une percée intéressante vers la synthèse de nanoparticules de carbone. L’obstacle principal pour son utilisation réside dans le manque de contrôle durant la synthèse, où la taille des particules obtenues est polydisperse.
Schéma 1.3. Synthèse de CNP par l’irradiation d'un organogel composé de 1,8-diaryl-1,3,5,7-octatétraynes.42 2% PVA H2O, 80°C, 48h Pyrolyse 800°C, 24h Sphères de poly(DBO) ( =15 μm) Sphères de carbone ( =12 μm) 1,8-dibutyl-1,3,5,7-octatétrayne (DBO)
21
Figure 1.13. Images SEM de l'organogel du 1,8-diaryl-1,3,5,7-octatétrayne (a) avant et (b) après irradiation UV. Résultats obtenus des travaux de Nabeo et al.42
1.4. Les nanoparticules de polymère
Il existe plusieurs techniques de polymérisation en milieu dispersé afin de faire la synthèse de polymères sous leur forme nanoparticulaire. Parmi ces techniques, comptons les polymérisations en émulsion, en miniémulsion, en microémulsion, en dispersion et en suspension. Le tableau 1.1 ci-dessous résume les propriétés particulières de chacune des techniques.
Tableau 1.1. Particularités des procédés de polymérisation en milieu dispersé. Tableau adapté de Shboul et al.43
Polymérisation Microémulsion Emulsion, Miniemulsion Dispersion Suspension
Phase continue Eau Eau mélange alcool/eau Solvant organique, Eau
Monomère En micelles Gouttelettes préformées Phase continue En goulettes Dispersant Surfactant Surfactant Polymère soluble hydrosoluble Polymère
Produit 10 – 20 nm 50 – 500 nm 0,1 – 20 μm > 5 μm
Ces méthodes en milieu dispersé sont généralement rapportées pour des polymérisations radicalaires. Cependant, des procédés adaptés à des polycondensations par réaction de couplage
22
ont été publiés récemment afin de générer des nanoparticules de polymères conjugués. La miniémulsion, par exemple, est applicable à des conditions de couplage de Glaser et de Suzuki-Miyaura.44,45 Le désavantage majeur des nanoparticules formées par cette méthode est la haute
polydispersité résultante. Dernièrement, la polymérisation en dispersion a aussi été appliquée aux couplages de Sonogashira, de Suzuki-Miyaura et de Heck.46-48 Contrairement aux méthodes en
miniémulsion, ces méthodes en dispersion ont été prouvées comme étant efficaces pour la synthèse de nanoparticules de polymère sphériques aux tailles modulables avec une faible polydispersité.
1.4.1. Polymérisation en dispersion par couplage de Sonogashira
Un exemple de polymérisation en dispersion faisant intervenir la réactivité des alcynes est celui par couplage de Sonogashira. Ce couplage fut appliqué en milieu dispersé pour polymériser le 1,3-diéthynylbenzène et le 9,9’-dioctyl-2,7-diiodofluorène.47 La synthèse nécessite des catalyseurs et
une base tout comme un couplage de Sonogashira traditionnellement effectué en solution. Or, afin d’induire la formation de particules, des stabilisants et un alcool en guise de solvant doivent être utilisés. Anwar et al. ont utilisé le 1-propanol (1-PrOH) comme solvant et le poly(1-vinylpyrrolidone-co-vinyl acétate) (PVPVA) combiné au Triton X-45 (TX-45) comme stabilisants dans leur synthèse.
Schéma 1.4. Synthèse de nanoparticules de polymère par couplage de Songoshira selon les conditions rapportées par Anwar et al.47
1.4.1.1. Mécanisme de polymérisation
Au départ, le milieu réactionnel est une solution homogène des monomères, des stabilisants et des catalyseurs dans le solvant. L’initiation de la réaction est induite par l’ajout de la base. Selon le mécanisme classique du couplage de Sonogashira, la base permet de déprotoner l’alcyne terminal du 1,3-diéthynylbenzène pour former un acétylénure de cuivre. Suite à cette initiation, le couplage avec le dérivé 2,7-diiodofluorène procède de façon à former des oligomères solubles. À une masse