Étude du rôle préactivateur de la
protéine S100A9 sur les neutrophiles dans la
goutte
Mémoire
Louis-Simon Rousseau
Maîtrise en microbiologie-immunologie
Maître ès sciences (M. Sc.)
Québec, Canada
© Louis-Simon Rousseau, 2018
Étude du rôle préactivateur de la
protéine S100A9 sur les neutrophiles dans la
goutte
Mémoire
Louis-Simon Rousseau
Sous la direction de :
Maria Fernandes, directrice de recherche
Martin Pelletier, codirecteur de recherche
iii
Résumé
La goutte est une arthrite particulièrement douloureuse due à une réponse immunitaire contre des cristaux d’urate monosodique (MSU). Le neutrophile est un leucocyte qui contribue grandement à la perpétuation de l’inflammation lors d’une crise de goutte. Avant d’être recrutés au site d’inflammation, les neutrophiles rencontrent plusieurs médiateurs pro-inflammatoires, dont la protéine S100A9. Nous montrons ici que S100A9 accentue plusieurs réponses effectrices des neutrophiles humains aux MSU, notamment la production de dérivés réactifs de l’oxygène (ROS), la sécrétion de CXCL8/IL-8 et d’IL-1β et la glycolyse. S100A9 augmente également la mobilisation intracellulaire de calcium du neutrophile en plus d’augmenter la phosphorylation des tyrosines, la phosphorylation des sérines des substrats de la PKC, d’AKT et de la p38. Nous avons identifié un des mécanismes par lesquels S100A9 contribue à la pathogenèse de la goutte ainsi que les voies de signalisation impliquées dans ce phénomène qui sont des cibles thérapeutiques potentielles pour cette maladie.
iv
Abstract
Gout is the common and painful type of inflammatory arthritis. It is caused by an immune response against monosodium urate crystals (MSU) that form in the affected joint. Neutrophils are the most abundant leukocytes in the gout joint and play a key role in perpetuating inflammation during a gout flare. During their recruitment to the site of inflammation, neutrophils are exposed to several pro-inflammatory mediators such as S100A9. Although blocking S100A9 dampens MSU-induced inflammation, the role of this protein in the pathogenesis of gout remains incompletely characterized. We identified a novel role for S100A9 in MSU-induced inflammation, the priming of neutrophils towards MSU activation. We provide evidence for the ability of S100A9 to enhance several effector functions of human neutrophils triggered by MSU including the production of reactive oxygen species (ROS), the secretion of CXCL8/IL-8 and IL-1β as well as glycolysis. As for intracellular signaling, S100A9 increases the mobilisation of calcium, induces tyrosine phosphorylation of intracellular proteins as well as serine phosphorylation of PKC, AKT and p38 kinase. In summary, we report for the first time that S100A9 acts as a priming agent during MSU-induced inflammation and identify the underlying signaling pathways that could be targeted to treat gout.
v
Table des matières
Résumé ... iii
Abstract ... iv
Liste des figures ... vii
Remerciements ... viii Avant-propos ... ix 1. Introduction ... 1 1.1. Le neutrophile ... 1 1.1.1. Origine et description ... 1 1.1.2. Fonctions effectrices ... 5 1.1.3. Métabolisme ... 12
1.2. Qu’est-ce que la goutte? ... 15
1.2.1. Histoire de la goutte ... 15
1.2.2. Manifestation clinique de la goutte ... 15
1.2.3. Épidémiologie de la goutte ... 16
1.2.4. Pathophysiologie de la goutte ... 16
1.2.5. Facteurs de risque de la goutte ... 22
1.3. S100A9 et les calgranulines ... 25
1.3.1. Structure ... 25 1.3.2. Expression ... 28 1.3.3. Récepteurs ... 28 1.3.4. Fonctions intracellulaires ... 29 1.3.5. Fonctions extracellulaires ... 31 1.3.6. La goutte et S100A9 ... 38 1.4. Hypothèse et objectifs ... 40
2. S100A9 potentialise l’activation des neutrophiles par l’agent étiologique de la goutte, les cristaux d’urate monosodique ... 41 2.1. Résumé ... 41 2.2. Abstract ... 43 2.3. Introduction ... 44 2.4. Methods ... 47 2.5. Results ... 51 2.6. Discussion ... 57 2.7. References ... 61
vi
3. Discussion ... 74
4. Conclusion et perspectives ... 79
5. Bibliographie ... 80
vii
Liste des figures
Figure 1 — Stades de différentiation du neutrophile humain ... 3
Figure 2 — Granules définies en fonction de la biosynthèse de leurs protéines caractéristiques ... 4
Figure 3 — Adhésion et transmigration des neutrophiles ... 10
Figure 4 — Mécanismes d’élimination des pathogènes du neutrophile ... 11
Figure 5 — Étapes de la glycolyse et de la voie des pentoses phosphates ... 14
Figure 6 — La goutte ... 19
Figure 7 — Métabolisme de l’acide urique ... 20
Figure 8 — Déclenchement de l’inflammation lors d’une crise de goutte ... 21
Figure 9 — Facteurs de risque de la goutte ... 24
Figure 10 — Structure de S100A9 ... 27
Figure 11 — Résumé des rôles critiques de S100A8 et de S100A9 dans l’inflammation ... 37
viii
Remerciements
J’aimerais d’abord remercier Maria Fernandes qui m’a permis de réaliser cette maîtrise dans son laboratoire. À travers toutes les difficultés rencontrées et mes nombreux découragements, Maria n’a jamais baissé les bras, m’a toujours soutenu et m’a appris à ne jamais me laisser abattre. C’est grâce à sa persévérance dans sa volonté de me superviser que ce mémoire existe. Merci. Je voudrais aussi remercier Martin Pelletier sans qui ce mémoire n’aurait pas pu aboutir. C’est d’abord pour son temps et son enthousiasme à discuter de science que je voudrais le remercier. Que ce soit pour n’importe quelle question, Martin était toujours ouvert à la discussion et il a fait naître de nombreuses réflexions en moi au cours de cette maîtrise. J’aimerais aussi le remercier pour son Seahorse qui a grandement facilité le projet. Je remercie aussi Philippe Tessier et Nathalie Pagé pour les précieuses protéines.
Merci aussi à Guillaume Paré qui, à son arrivé dans le laboratoire, a décuplé la vitesse à laquelle avançait mon projet avec son expertise technique. Merci aussi à Myriam Vaillancourt. J’ai vraiment été choyé de travailler à vos côtés.
Il y a aussi tous mes collègues et amis de l’étage que je voudrais remercier. Notamment Asmaa Lachhab pour m’avoir tout appris au Seahorse et avoir enduré tous les moments où je venais discuter de science ou de découragement. Merci aussi à Maude Gagné, Joan Defrêne, Maleck Kadiri, Weili Hui, Benjamin Brisebois et Nicolas Tessandier de m’avoir si bien entouré durant ces deux années.
Mes derniers remerciements vont aux membres de ma famille qui ont et vont toujours m’encourager et me soutenir durant mes interminables études universitaires. Merci aussi à Ariane, mon amoureuse, de m’avoir forcé à me mettre au travail et pour son aide précieuse en traduction.
ix
Avant-propos
Dans le cadre de ma maîtrise en microbiologie-immunologie, je me suis intéressé particulièrement à la goutte, une maladie rhumatismale auto-inflammatoire qui se trouve aussi à être la forme d’arthrite la plus douloureuse. Sa prévalence, de 1 à 6% selon les pays, est en constante augmentation due notamment au fort vieillissement de la population dans les pays développés et à l’attrait d’une diète occidentale dans les pays émergents. Les neutrophiles constituent la population leucocytaire la plus recrutée au site d’inflammation, d’où l’intérêt de chercher à mieux comprendre les multiples fonctions du neutrophile dans la pathophysiologie de la goutte et au-delà.
Pourtant, la recherche en immunologie s’est longuement consacrée exclusivement au système immunitaire acquis, délaissant ainsi le système immunitaire inné. Cet aspect du système immunitaire constitue pourtant la première défense de l’organisme contre les infections et joue un rôle primordial dans cette pathologie où l’organisme en vient à se défendre en déclenchant une inflammation stérile. Au niveau physiopathologique, les neutrophiles rencontrent plusieurs signaux inflammatoires, notamment la protéine S100A9, l’interleukine 8 (CXCL8/IL-8) et l’IL-1β, qui permettent leur recrutement au site inflammatoire où ils rencontreront l’agent infectieux. S100A9, particulièrement, se trouve en grande quantité dans les liquides synoviaux de patients goutteux. Je me suis donc intéressé principalement aux rôles que joue S100A9 sur les fonctions effectrices du neutrophile avant et pendant que celui-ci rencontre les cristaux d’urate de sodium (monosodium urate - MSU), l’agent étiologique de la goutte.
Principalement, la recherche effectuée durant cette maîtrise se base sur un modèle pathologique de la goutte où des neutrophiles de donneurs sains sont mis en contact in vitro avec des MSU afin de les activer et ce, en présence ou en absence de S100A9. Mon mémoire sera donc composé d’une introduction sur les rôles du neutrophile, sur la goutte et finalement sur les diverses fonctions connues de la protéine S100A9, d’un article établissant le rôle préactivateur de S100A9 sur les neutrophiles ultérieurement exposés aux MSU puis d’une discussion comprenant
x
les limites de ce mémoire et les perspectives qu’il offre pour la compréhension et le traitement de cette douloureuse pathologie.
L’article constituant le corps de ce mémoire a été accepté le 2 mai 2017 dans le Journal of Leukocyte Biology et a été publié dans cette même revue en septembre 2017. J’ai écrit la majeure partie de l’article et réalisé la plupart des figures qui y sont présentées. Guillaume Paré a effectué une grande partie des manipulations notamment concernant la mobilisation de calcium intracellulaire et les voies de signalisation et a participé à la révision du manuscrit. Asmaa Lachhab m’a formé à l’utilisation de l’analyseur de flux extracellulaire (Agilent/Seahorse Bioscience), nécessaire à toutes les figures impliquant la glycolyse et les ROS. Paul H. Naccache a contribué à la réflexion sur le projet et les manipulations à effectuer en plus de participer à la révision du manuscrit. François Marceau a apporté son aide pour les analyses statistiques. Philippe Tessier a fourni gracieusement les protéines S100A9 et a contribué à la conception du projet. Martin Pelletier a fourni l’analyseur de flux extracellulaire, en plus de contribuer à la conception des expériences reliées au métabolisme et à la révision du manuscrit. Maria Fernandes a grandement participé à la conception du projet, ainsi qu’à l’écriture et à la révision du manuscrit.
1
1. Introduction
Les neutrophiles sont les leucocytes les plus présents à l’articulation lors d’une crise de goutte. La présente section permettra de brièvement décrire cette cellule et de comprendre ses fonctions pour la défense de l’organisme.
1.1.
Le neutrophile
Les neutrophiles jouent un rôle clé dans la défense de l’organisme contre les infections, notamment grâce à leur capacité de passer rapidement de la circulation sanguine au site d’inflammation, d’y reconnaître les pathogènes et de les détruire. Il s’agit d’un type cellulaire hautement spécialisé dans la destruction de micro-organismes néfastes à l’organisme. Les mécanismes principaux par lesquels le neutrophile peut accomplir sa tâche efficacement sont la capacité de générer et de sécréter une grande variété d’enzymes cataboliques (protéases, hydrolases, nucléases), son efficacité à produire des dérivés réactifs de l’oxygène (reactive oxygen species - ROS) via le complexe NADPH oxydase (activé en combinaison avec la myéloperoxydase), la capacité de pouvoir phagocyter les pathogènes et autres débris cellulaires et à engluer et dégrader les pathogènes en décondensant son ADN lors d’un type de mort cellulaire spécialisée nommée NETose. [1]
1.1.1. Origine et description
Les neutrophiles sont des cellules de types myéloïdes. Leur maturation a lieu dans la moelle osseuse et est régulée par les niveaux de Granulocyte-Colony Stimulating Factor (G-CSF). [2] À partir du myéloblaste, ils traversent plusieurs stades successifs de maturation pour finalement devenir un neutrophile mature complètement segmenté qui sera libéré dans la circulation sanguine (Fig. 1). Une des caractéristiques permettant de distinguer les différents stades de différenciation du neutrophile est la formation en série des divers types de granules. [3] Les protéines granulaires qui sont formées à un moment seront stockées à l’intérieur de la même granule (Fig. 2). On peut constater les différences entre les types de granules par leur contenu. Les premières granules formées contiennent la myéloperoxydase et l’élastase. Ces dernières sont formées seulement à un stade
2
précoce de différenciation alors que d’autres, contenant la lactoferrine, sont formées plus tard lors de la maturation du neutrophile. Les granules gélatineuses, quant à elles, sont formées après que la biosynthèse de la lactoferrine soit bien entamée et continuent à être formées même après que la biosynthèse de lactoferrine ait cessé, soit en toute fin de maturation. [2] La production journalière chez un être humain en santé peut atteindre jusqu’à 1011 de ces neutrophiles. [4] Ces cellules ont une
demi-vie d’environ 1,5 jour dans la circulation sanguine chez l’humain bien que leur longévité puisse être de plusieurs jours en condition inflammatoire. Chez l’humain, 50 à 70 % des leucocytes en circulation sont des neutrophiles. [5, 6] Les neutrophiles matures possèdent un diamètre de 7 à 10 µm. Leur maturation peut être accélérée de même que leur libération dans la circulation sanguine principalement par le G-CSF, mais aussi par d’autres cytokines. [1]
3
Figure 1 — Stades de différentiation du neutrophile humain
Dans la moelle osseuse, le myéloblaste passe par différents stades de différenciation où généralement il perd en taille de cellule et de noyau, la morphologie du noyau change et les diverses granules sont produites séquentiellement jusqu’à la maturation complète en neutrophile segmenté.
4
Figure 2 — Granules définies en fonction de la biosynthèse de leurs protéines caractéristiques
Les granules formés à un stade donné de la maturation des précurseurs du neutrophile sont composés des protéines granulaires synthétisées à ce même stade. Les sous-ensembles de granules identifiés sont le résultat de différences dans les fenêtres de biosynthèse des protéines granulaires pendant la maturation. Lorsque la formation de granules cesse, les vésicules sécrétoires se forment. La biosynthèse des protéines granulaires est exercée par des facteurs de transcription qui contrôlent l’expression des gènes codant pour diverses protéines de granules. MB, myéloblaste; PMC, promyélocyte; MC, myélocyte; MMC, métamyélocyte; BC, neutrophile immature non segmenté; Segm., neutrophile mature segmenté.
5
1.1.2. Fonctions effectrices
Lors de leur parcours de la circulation au site d’inflammation, les neutrophiles rencontrent plusieurs signaux régulateurs ou chimiotactiques et doivent être en mesure de répondre à ceux-ci. Ces signaux permettent à la fois d’amorcer et de moduler le processus de recrutement du neutrophile vers le site d’inflammation en plus de le préparer à réagir aux pathogènes en facilitant son activation.
Le processus de migration est fortement régulé afin d’éviter l’activation inutile de neutrophiles qui pourrait être délétère à l’organisme. La figure 3 décrit les différentes molécules d’adhésion utilisées par la cellule à chacune des étapes requises afin de se rendre au site d’inflammation. Tout d’abord, le neutrophile rencontre un agent chimiotactique ce qui provoquera le roulement de celui-ci sur la paroi endothéliale. Il peut s’agir d’une cytokine comme l’IL-1, le CXCL8/IL-8 ou un médiateur lipidique comme le leucotriène B4 (LTB4). La rencontre de cet agent enclenche la migration
par le roulement du neutrophile à la surface de l’endothélium où les sélectines sont spécialement importantes. À mesure que le neutrophile s’approche du site d’inflammation, la concentration d’agent chimiotactique augmente, le roulement prend fin et le neutrophile adhère fermement à la barrière endothéliale grâce à l’activation des intégrines β2 à sa surface. Il commence ensuite un processus nommé diapédèse ou transmigration qui lui permet de traverser la barrière endothéliale et de migrer au site de l’inflammation. [1]
Pour éviter que les neutrophiles soient activés alors qu'ils se trouvent encore dans la circulation, ils subissent une étape de préactivation (priming) pendant leur recrutement au site inflammatoire. Cette étape de préactivation sert à préparer le neutrophile à réagir à un stimulus pro-inflammatoire sans pour autant déclencher ses fonctions effectrices. Ce stade lui permet d’acquérir une capacité cytotoxique plus grande, une durée de vie plus longue et des fonctions effectrices plus efficaces lors de son contact éventuel avec le stimulus, permettant ainsi de déclencher une réponse immunitaire puissante et appropriée. Ce processus est enclenché via la phosphorylation de diverses protéines, dont des kinases, qui modifient par la suite la membrane cytoplasmique en modulant le contenu protéique à la surface
6
notamment par la dégranulation qui permet de transférer le contenu des granules à la membrane plasmique. Elles peuvent aussi moduler l’expression génique par la phosphorylation de facteurs de transcription. Ces trois mécanismes participent à la préactivation du neutrophile. Lors de cette étape, le neutrophile est en mesure de sécréter plusieurs cytokines, chimiokines et autres molécules immunorégulatrices qui promeuvent l’inflammation par le recrutement et l’activation d’autres cellules immunitaires, dont notamment d’autres neutrophiles. Ces molécules peuvent aussi permettre de moduler d’autres éléments du système immunitaire, notamment la maturation des leucocytes. [7]
La première étape de l’activation du neutrophile est la reconnaissance du pathogène grâce aux nombreux récepteurs qui reconnaissent des motifs pathogéniques à leur surface ou pattern recognition receptors (PRR), notamment les récepteurs de type Toll (toll-like receptor - TLR), les récepteurs de la famille des lectines et les récepteurs Fc (Fragment crystallisable). L’activation du neutrophile par ces récepteurs mène rapidement à un influx important de calcium intracellulaire qui sert à activer les diverses kinases et autres messagers nécessaires aux prochaines étapes. [8]
Au site inflammatoire, l’activation du neutrophile par le stimulus pro-inflammatoire (e.g. un pathogène) est fortement liée à la concentration cytoplasmique de calcium. Ceci est un des événements de signalisation le plus précoce suite au contact du neutrophile avec un agent pro-inflammatoire. Le calcium joue un rôle clé dans la signalisation intracellulaire. Il agit comme second messager en permettant l’activation de kinases. Les concentrations de calcium intracellulaire sont étroitement contrôlées par un mécanisme de transport actif. La mobilisation du calcium à l’intérieur du neutrophile, qu’il soit d’origine extracellulaire ou du réticulum endoplasmique, où la majorité du calcium intracellulaire est entreposée, amorce des signaux intracellulaires qui mènent à des réponses fonctionnelles. Les niveaux de calcium cytosolique sont maintenus à des niveaux relativement faibles dans la cellule au repos par plusieurs pompes à calcium. Plusieurs mécanismes permettent l’entrée de calcium dans le cytoplasme. Des canaux calciques couplés à un
7
récepteur permettent l’influx de calcium lorsque liés à un ligand et des canaux voltage-dépendants font la même chose lorsqu’un certain niveau d’activation est atteint. Chez les neutrophiles, le principal mécanisme permettant un influx d’ions calciques au cytosol permet au calcium contenu dans le réticulum endoplasmique de se retrouver au niveau du cytosol. Habituellement des récepteurs extracellulaires amorçent une cascade de signalisation menant à la phosphorylation de phospholipases. La phospholipase C (PLC) convertit alors le lipide membranaire phosphatidylinositol-4,5-bisphosphate (PIP2) en diacylglycérol (DAG)
et en inositol triphosphate (IP3). L’IP3 se lie alors sur son récepteur, InsP3R, dans le
réticulum endoplasmique et permet la libération rapide d’ions calciques. Ce premier influx de calcium est suivi d’un second influx plus soutenu en provenance de la membrane plasmique. Cette deuxième entrée de calcium active de nombreuses molécules de signalisation dépendantes du calcium et des facteurs de transcription qui modulent les fonctions immunitaires comme la dégranulation, la production de cytokines et la polarisation cellulaire. [9]
Le neutrophile reconnaît alors le pathogène, s’y lie fortement et externalise plusieurs récepteurs se liant au pathogène recouvert d’immunoglobuline G (IgG) et des protéines C3b et C3bi afin d’amorcer la phagocytose. Par la suite, la membrane plasmique du neutrophile englobe complètement le pathogène et celui-ci se retrouve à l’intérieur d’un phagosome. Le processus de phagocytose mène à la sécrétion intraphagosomale de peptides antibactériens, de protéases, de myéloperoxydase et d’anion superoxyde (O2-) qui est produit par l’activation de la NADPH oxydase. La
production de ROS est l’un des mécanismes principaux par lequel le neutrophile peut venir à bout des divers microbes qui peuvent attaquer l’organisme. Les neutrophiles produisent d’abord des anions superoxydes, qui vont par la suite générer d’autres ROS comme le peroxyde d’hydrogène (H2O2) des radicaux
d’hydroxyle (OH•) et de l’acide hypochlorique (HOCl). Ces ROS générés à la membrane du phagosome peuvent dégrader des particules phagocytées et ainsi être utilisés à l’intérieur de la cellule ou être sécrétés dans l’environnement extracellulaire par dégranulation. [10] En plus de ses capacités oxydatives qui permettent de tuer les pathogènes, le neutrophile peut sécréter des protéines
8
antimicrobiennes comme les défensines, des enzymes ainsi que d’autres cytokines permettant de perpétuer la réaction inflammatoire. [10] Ces produits antimicrobiens, en plus des ROS, peuvent être expulsés du neutrophile en même temps que son ADN décondensé lors de la NETose (Fig. 4).
En plus de leur rôle direct dans l’amorce des dommages tissulaires dans les maladies inflammatoires, les ROS, les cytokines, chimiokines et les autres molécules immunorégulatrices sécrétées par les neutrophiles peuvent aussi communiquer avec les autres cellules immunitaires en condition inflammatoire. [11] Loin d’être de simples cellules observatrices qui ne peuvent répondre qu’aux signaux inflammatoires en générant une réponse cytotoxique, il est maintenant reconnu que les neutrophiles jouent un rôle important dans la régulation de pratiquement tous les éléments du système immunitaire, du contrôle de l’hématopoïèse à la modulation des fonctions des lymphocytes T et B. [12]
En plus de ce mécanisme de migration, de préactivation et d’activation, le neutrophile est aussi reconnu pour contribuer aux dommages tissulaires associés à l’inflammation et aux maladies inflammatoires. Ces maladies sont caractérisées par une réaction excessive du système immunitaire inné à l’encontre de substances endogènes ou exogènes. Les maladies rhumatismales, notamment, portent la marque des dommages tissulaires infligés à l’articulation par les neutrophiles. Dans ces maladies, les produits d’activation des neutrophiles (protéases et ROS) sont présents au site d’inflammation et contribuent aux dommages tissulaires. Les neutrophiles peuvent aussi infiltrer les tissus et s’activer de façon inappropriée. Par exemple, en réponse à une infection ou à des complexes immuns, les neutrophiles vont sécréter des molécules qui sont normalement contenues dans les phagosomes tels les lysozymes. Ces molécules, une fois sécrétées, peuvent attaquer les tissus de l’hôte et donner lieu à une maladie inflammatoire si elles se retrouvent en plus grande quantité que les niveaux de protéase et d’antioxydants endogènes dans les tissus. [13, 14] Lors de la résolution de l’inflammation, le neutrophile se dirige spontanément en apoptose et exprimera des molécules qui seront reconnues par les macrophages dans le but de phagocyter et d’éliminer la cellule apoptotique via
9
l'efferocytose, bien que des études pointent vers une migration inverse dans certains cas lors de laquelle le neutrophile reviendrait dans la circulation sanguine. [15, 16]
10
Figure 3 — Adhésion et transmigration des neutrophiles
Le passage du neutrophile de la circulation sanguine au site de l'inflammation se déroule en quatre étapes. L’étape du roulement sur la paroi endothéliale nécessite certaines molécules d’adhésion dont les sélectines alors que l’adhésion ferme et la migration à cette même paroi font intervenir d’autres molécules comme les intégrines. Une fois au site d’inflammation, le neutrophile phagocyte, libère le contenu de ses granules et produit des ROS pour finalement entrer en apoptose et être phagocyté par les macrophages.
11
Figure 4 — Mécanismes d’élimination des pathogènes du neutrophile
Le neutrophile peut éliminer les pathogènes de l’organisme de trois différentes façons : la phagocytose, la dégranulation et la NETose.
12
1.1.3. Métabolisme
Les cellules immunitaires sont fortement adaptées aux environnements dans lesquels elles circulent et s’établissent lors des réactions inflammatoires. Elles diffèrent dans leurs états métaboliques de base et dans leurs réactions à un stimulus activateur. Les cellules myéloïdes comme les neutrophiles et les macrophages dépendent beaucoup de la glycolyse pour produire de l’ATP, ce qui leur permet d’accomplir leurs fonctions dans l’environnement hypoxique d’un tissu inflammé et œdémateux. [18-20] Les neutrophiles sont préadaptées aux environnements hypoxiques, puisqu’elles ont très peu de mitochondries. [21, 22] Le neutrophile utilise principalement l’oxygène non pas afin de se fournir en énergie, mais de façon à produire des ROS via la NADPH oxydase. [23]
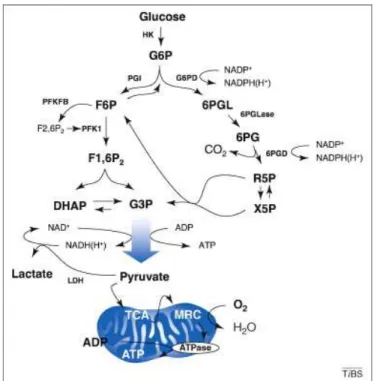
Le métabolisme énergétique assure le bon fonctionnement du système immunitaire, puisque les cellules immunitaires ont besoin d’énergie non seulement pour les fonctions de base, mais aussi pour engendrer des réponses immunitaires spécifiques. [24] Si le métabolisme échoue à répondre aux besoins de la cellule, ses fonctions sont limitées et cela peut mener à l'apoptose. Au contraire, un métabolisme excessif peut prévenir l’apoptose, stimuler l’hyperréactivité et exacerber les fonctions cellulaires, ce qui peut mener à l’auto-immunité et aux maladies inflammatoires. [25, 26] L’adénosine triphosphate (ATP), la principale source d’énergie d’une cellule, est principalement générée par la glycolyse et la phosphorylation oxydative (respiration mitochondriale). Les cellules transforment le glucose en pyruvate au moyen de la glycolyse (Fig.5) et oxydent le pyruvate par le cycle de Krebs et la chaîne de transport des électrons des mitochondries. Les acides gras et les acides aminés peuvent aussi être dégradés en pyruvate, en acétyl-coenzyme A et en d’autres intermédiaires pour maintenir la production d’ATP. [27] La voie du pentose phosphate, une alternative à la glycolyse, est également utilisée chez les neutrophiles et les monocytes afin de fournir du NADPH pour les fonctions microbicides régulées par la NADPH oxydase. [28]
13
L’étude du métabolisme cellulaire et de sa régulation dans les cellules immunitaires est maintenant un domaine de recherche en immunologie de base, et les voies métaboliques reçoivent un intérêt renouvelé en tant que cibles pour l’immunothérapie. Le lien entre l’activation des cellules immunitaires et le métabolisme n’est pas encore bien compris et plusieurs études dans les dernières années ont révélées les adaptations métaboliques qui rendent l’immunité possible. L’utilisation de l’analyseur de flux extracellulaire (XF Extracellular Flux Analyzer), un instrument de Agilent/Seahorse Bioscience qui mesure les paramètres bioénergétiques en temps réel sur microplaque avec l’avantage de fournir de l’information à la fois sur la consommation d’oxygène (respiration mitochondriale) et sur l’acidification extracellulaire (glycolyse) des cellules vivantes, est devenu un moyen de comprendre efficacement la biologie et la bioénergie des cellules immunitaires dans le contexte de vaccins, de maladies et d’inflammation. [29-32] Cet instrument peut révéler si les cellules utilisent à la fois la glycolyse et la phosphorylation oxydative ou si elles utilisent préférentiellement une des deux voies métaboliques. [29]
14
Figure 5 — Étapes de la glycolyse et de la voie des pentoses phosphates Par la glycolyse, le glucose est utilisé pour générer principalement de l’ATP à partir de l’ADP. Il s’agit de la principale voie par laquelle les neutrophiles vont générer de l’énergie sous forme d’ATP. La voie des pentoses phosphates permet de
regenérer le NADPH à partir du NAD+.
15
1.2.
Qu’est-ce que la goutte?
La goutte est caractérisée par de l’inflammation localisée aux articulations. Le facteur étiologique de la goutte est les MSU. Le leucocyte retrouvé en quantité la plus abondante au site de l’inflammation lors d’une crise de goutte est le neutrophile d’où son importance dans la maladie.
1.2.1. Histoire de la goutte
La goutte a été identifiée dès 2640 av. J.-C. par les Égyptiens et les premières mentions écrites de la maladie remontent à environ 400 av. J.-C. par le grec Hippocrate, grand médecin et philosophe. La première description exacte de la maladie est écrite en 1683 par Thomas Sydenham, un médecin anglais décrivant sa propre crise de goutte. L’accumulation de cristaux dans les tophi goutteux (dépôt sous-cutané de cristaux d’acide urique entouré de cellules inflammatoires) a été décrite vers le milieu du XIXe siècle par A. B. Garrod, offrant par le fait même la
première indication sur la pathophysiologie de la maladie. Malgré cette découverte, il a fallu attendre 1961 pour que McCarty et Hollander démontrent la présence de ses cristaux dans les liquides synoviaux et fassent de leur présence un critère diagnostique. Les premières indications de la goutte parlent de la « maladie des rois ou des hommes riches » puisque le style de vie, dont notamment une alimentation riche en viande, est un facteur de risque important. [34]
1.2.2. Manifestation clinique de la goutte
La goutte aiguë commence habituellement dans une articulation des membres inférieurs (85-90 % des cas), souvent la première articulation métatarsophalangière, classiquement appelée podagre. D’autres endroits fréquents pour une première crise de goutte incluent l’articulation médiotarsienne, la cheville, les genoux ou même les bras. La goutte est habituellement composée de trois phases : une hyperucémie asymptomatique, des épisodes de crises de goutte aiguë avec des intervalles asymptomatiques et une phase de résolution. Dans certains cas, une arthrite goutteuse chronique peut se développer. La première attaque n’est habituellement pas polyarticulaire (3-14 % des cas sont polyarticulaires) et les
16
attaques affectent rarement les épaules ou les hanches. L’attaque est très rapide et l’articulation affectée devient érythémateuse, chaude, enflée et très douloureuse. [35] Plusieurs patients ne souffriront que d’une crise au cours de leur vie, mais certains peuvent être victimes d’une seconde attaque dans un délai de 6 mois à 2 ans. Un type de goutte chronique se développe habituellement à l’intérieur de 5 ans depuis la première crise de goutte chez 30 % des patients non traités. Les attaques secondaires durent fréquemment plus longtemps que l’attaque initiale, attaquent habituellement plusieurs articulations et se propagent dans les articulations des membres supérieurs, notamment les bras et les mains. Si aucun traitement n’est offert, ces attaques récurrentes de goutte peuvent mener au développement d’une forme chronique de goutte qui est caractérisée par une arthrite polyarticulaire menant à de l’inflammation et à la destruction du tissu articulaire. [35]
1.2.3. Épidémiologie de la goutte
La goutte est la forme d'arthrite la plus répandue dans les pays développés, notamment chez les hommes plus âgés. Sa prévalence est d'environ 3% de la population du Canada et des États-Unis et en augmentation ailleurs dans le monde comme en Chine, en Polynésie, en Nouvelle-Zélande et dans les zones urbaines de l’Afrique subsaharienne. Cette augmentation générale de la prévalence de la maladie s’explique en partie par l’augmentation de l’espérance de vie, par le vieillissement de la population et par la généralisation du style de vie occidental, surtout au niveau de la diète. [36]
1.2.4. Pathophysiologie de la goutte
La goutte est un type d’arthrite aiguë causée par l’accumulation de cristaux d’urate dans les articulations et qui implique principalement les macrophages et les neutrophiles (Fig. 6). Cette accumulation est due à une augmentation des concentrations d’acide urique normalement présente dans la circulation, une condition nommée hyperuricémie. L’acide urique est le produit final de la dégradation des purines (Fig. 7). Le corps élimine l’acide urique principalement par le foie, mais aussi par l’intestin. L’hyperuricémie peut être déclenchée à la suite d’une augmentation de l’apport en purine, notamment par l’alimentation, ou par une
17
diminution de l’excrétion d’acide urique, notamment à cause de problèmes rénaux. Cette augmentation de concentration de l’acide urique en circulation peut mener notamment à la cristallisation de celle-ci. Ces cristaux vont par la suite s’accumuler dans les articulations où ils seront la source d’une réaction inflammatoire. [37]
Cette réaction inflammatoire débute habituellement par l’activation des macrophages résidents par les MSU. Le macrophage phagocyte ces cristaux tout en libérant une variété de médiateurs pro-inflammatoires, dont l’IL-1β. Cette cytokine joue un rôle crucial dans l’initiation et la perpétuation d’une crise de goutte puisque c'est elle qui active les cellules endothéliales, menant à la production de CXCL8/IL-8 et l'augmentation de l'expression de molécules d'adhésion. Le CXCLCXCL8/IL-8/IL-CXCL8/IL-8 et les molécules d’adhésion vont permettre à leur tour de recruter les neutrophiles qui caractérisent la crise de goutte. Ces neutrophiles, dans le liquide synovial, vont sécréter une variété de cytokines pro-inflammatoires dont le S100A9 et IL-1β, ce qui même à la perpétuation de l’inflammation (Fig. 8). [38]
Deux paires de récepteurs membranaires ont, jusqu’à présent, été impliqués dans les réponses des leucocytes aux cristaux de MSU. Chez les neutrophiles humains, il a été démontré que la paire CD16b-CD11b joue un rôle dans les réponses aux cristaux de MSU. [37] La preuve du rôle des récepteurs MyD88 (myeloid differentiation primary response gene 88 )-dépendants (TLR et IL-1R) a également été montrée, mais la plupart du temps dans des modèles murins et dans d’autres cellules que les neutrophiles, comme des cellules péritonéales murines ou des cellules de la lignée HEK. [39] La stimulation des voies de phosphorylation de tyrosine dans les neutrophiles humains exposés aux cristaux de MSU est manifeste. Plusieurs preuves pointent vers une implication biphasique des tyrosines kinases non réceptrices de la famille Src : dans un premier temps, une activation rapide dépendante des microtubules qui mène, entre autres, à la stimulation de la voie phospholipase Cγ (PLCγ) comprenant la mobilisation du calcium intracellulaire, l’activation des protéines kinases C (PKC) classiques et dans un deuxième temps le recrutement et l’activation de Syk, qui à son tour agit comme un interrupteur pour stimuler les kinases et les Tec PI3 p85-dépendante. [40] L’activation complète de
18
Syk et Tec est elle-même modulée par des kinases Src. La réponse inflammatoire qui suit ces événements de signalisation est très probablement dépendante de la dégranulation des neutrophiles, ainsi que de la synthèse et de la sécrétion de médiateurs pro-inflammatoires tels que la chimiokine CXCL8/IL-8 et de la production de l’IL-1β. [37]
19
Figure 6 — La goutte
Illustration représentant un homme atteint de la goutte. Les neutrophiles rament alors que le macrophage dirige la traversée puisque c’est lui qui amorce la réaction inflammatoire, alors que ce sont les neutrophiles qui en sont les principaux
contributeurs.
20
Figure 7 — Métabolisme de l’acide urique
Les purines que nous consommons ou qui se retrouvent dans notre ADN passent par les stades d’inosine, d’hypoxanthine, de xanthine pour finalement être
métabolisées en acide urique et être excrétées.
21
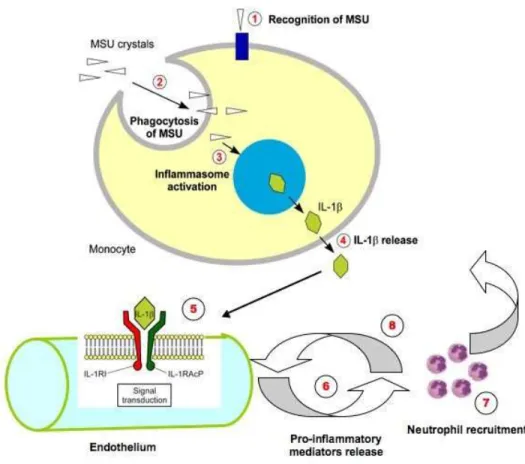
Figure 8 — Déclenchement de l’inflammation lors d’une crise de goutte
Différentes étapes mènent à l’inflammation lors d’une crise de goutte : (1) la reconnaissance des MSU par les monocytes/macrophages; (2) la phagocytose des MSU par les monocytes/macrophages; (3) l’activation de l’inflammasome par les MSU; (4) la libération d’IL-1β; (5) l’activation des récepteurs IL-1R chez les cellules endothéliales; (6) la libération de médiateurs pro-inflammatoires, comprenant le CXCL8/IL-8, induit le recrutement des neutrophiles; (7) le recrutement de neutrophiles au site d’inflammation; (8) la libération de composés pro-inflammatoires par les neutrophiles, y compris IL-1β.
22
1.2.5. Facteurs de risque de la goutte
L’hyperuricémie chronique est le facteur de risque le plus important de la goutte. Les risques augmentent en corrélation avec la concentration d’urate dans le sang. L’incidence annuelle de la goutte est de 0,5 % chez les personnes dont la concentration d’urate est entre 420 et 530 µmol/L et de 4,5 % pour les gens dont la concentration est supérieure à 540 µmol/L. Cependant, beaucoup de gens possédant des niveaux d’urate sanguin élevés ne développeront jamais la goutte. La consommation de viande, de fruits de mer, le jeûne, les traumatismes et la chirurgie peuvent agir comme éléments déclencheurs d’une crise de goutte, de par leur capacité à perturber le métabolisme de l’acide urique. [44]
L’héritabilité des niveaux d’acides uriques explique 60 % de la variabilité associée à la maladie. Des études de séquençage haut débit ont identifié des associations substantielles avec des polymorphismes dans le transporteur principal d’acide urique SLC2A9/GLUT9 et avec SLC22A12/URAT1, un transporteur spécifique de l’anion urate, chez les hommes chinois avec la goutte. Les loci ABCG2 et SLC17A3/NPT4 ont aussi été associés à la concentration d’acide urique et à la goutte (Fig. 9). Les transporteurs de l’acide urique ayant ces polymorphismes sont moins efficaces pour l’excrétion de l’acide urique, ce qui mène à un hyperuricémie chronique qui peut évoluer vers la goutte. [45]
Chez les femmes, l’arrivée de la ménopause est un facteur de risque lié aux crises de goutte puisque la perte des concentrations d’œstrogène entraîne une hausse des niveaux d’acide urique dans le sang. Le style de vie est depuis longtemps associé à la goutte et l’alcool et les excès alimentaires en sont les facteurs de risque principaux. La prévalence chez les hommes augmente avec la consommation de viande, de fruits de mer, de fructose, de bières et de spiritueux alors que la consommation de légumes à haute teneur en purine et la consommation de vin modérée n’ont pas d’effets. La prévalence de la goutte est augmentée avec la hausse de l’indice de masse corporelle et la perte de poids est corrélée avec une baisse de prévalence. La consommation de produits laitiers, de vitamine C et de
23
café est associée à une baisse des niveaux d’acide urique et à une diminution de la prévalence de la goutte. [46]
24
Figure 9 — Facteurs de risque de la goutte
Plusieurs facteurs environnementaux et génétiques mènent à une cristallisation de l’acide urique. Certains contribuent à une surproduction d’acide urique comme la consommation de viande alors que d’autres mènent à une déficience de son excrétion telle l’insuffisance rénale.
25
1.3.
S100A9 et les calgranulines
De tous les facteurs impliqués dans la goutte, la protéine S100A9 sera abordé parce qu’elle affecte grandement les neutrophiles lors de la crise. S100A9 est une protéine qui a été isolée, de concert avec S100A8, pour la première fois en 1987 par Karel Odink et ses collègues. Elles ont d’abord été nommées MIF Related Proteins (MRP) de par leur homologie présumée avec la protéine Macrophage Migration Inhibitory Factor (MIF). Leurs poids moléculaires respectifs permettent de les distinguer : S100A9 ayant une masse de 14 kDa se nomme MRP-14 et S100A8, de la même manière, se nomme MRP-8 à cause de son poids moléculaire de 8 kDa. Elles possèdent respectivement 114 et 93 acides aminés, contiennent toutes deux un seul résidu cystéine, ne possèdent pas de séquence d’attachement à la membrane et contiennent chacune deux domaines de liaisons au Ca2+ (Fig. 10). [48]
1.3.1. Structure
S100A9 fait partie de la famille des protéines S100, 24 protéines cytosoliques liant le calcium exprimées chez l’humain dont 19, incluant S100A9, sont localisées sur le chromosome 1q21. [49] Une caractéristique des membres de cette famille est que les protéines S100 possèdent chacune deux domaines de liaisons au calcium, soit une structure de type EF classique de 12 acides aminés et une non-classique de 14 acides aminés. S100A9 existe sous forme d’homodimère et d’hétérodimère avec S100A8 (nommé calprotectine) et représente jusqu’à 40 % des protéines cytosoliques totales chez les neutrophiles. [50] S100A9 fait partie d’un groupe de trois protéines humaines (S100A8, S100A9 et S100A12) nommées calgranulines parce qu’elles lient le calcium et sont exprimées par les granulocytes. Ce sont des protéines hydrophobes exprimées principalement par les cellules issues de lignées myéloïdes qui ne contiennent pas de sites consensus pour la N-glycosylation. S100A9 possède un domaine C-terminal qui consiste principalement en des acides aminés hydrophiles qui est très homologue au facteur d’immobilisation du neutrophile (Neutrophil Immobilization Factor - NIF). [51] Elle possède aussi plusieurs sites sujets à des modifications post-traductionnelles comprenant la phosphorylation, la méthylation, l’acétylation, l’oxydation, la palmitoylation, la
26
sumoylation et l’ubiquitination. Sans calcium, S100A8 et S100A9 ont tendance à former des hétérodimères alors qu’en présence de calcium, l’hétérotétramère serait favorisé. [52]
27
Figure 10 — Structure de S100A9
La protéine S100A9, d’une longueur de 114 acides aminés est composée de l’exon 2 et 3 du gène S100A9.
28
1.3.2. Expression
S100A9, tout comme S100A8, est exprimée principalement par les cellules issues d’une lignée myélomonocytaire. S100A9 est exprimée constitutivement chez les granulocytes et différentiellement chez les monocytes en fonction de leur stade de différenciation. Exprimée par les monocytes, son expression décline graduellement pour finalement devenir pratiquement nulle lors de l’atteinte du stade de macrophage. S100A8 et S100A9 sont exprimées par les monocytes et les précurseurs des cellules dendritiques, mais elles cessent de l’être à la fois chez les macrophages tissulaires et chez les cellules dendritiques matures. [53] Les macrophages peuvent néanmoins l’exprimer lors d’inflammation chronique ou aiguë p. ex. la gingivite et la polyarthrite rhumatoïde. [54] Elle est aussi exprimée dans les cellules leucémiques myéloïdes, chroniques ou aigües. [55]
1.3.3. Récepteurs
L’homodimère de S100A9 est un ligand important du Receptor for Advanced Glycation End products (RAGE). [56] CD36 est aussi proposé comme récepteur de l’hétérodimère S100A8/S100A9. [57] S100A9 peut se lier au TLR-4 chez les monocytes et CD14 pourrait être son corécepteur en jouant un rôle direct dans l’endocytose de S100A9. [56, 58] Chez les neutrophiles, la liaison de S100A9 au TLR-4 permet l’activation des intégrines β2, permettant ainsi le roulement et l’adhésion des neutrophiles à l’endothélium vasculaire activé. [59] Le récepteur basigine (CD147) joue un rôle important dans la migration des cellules de mélanome induite par S100A9, et ce, indépendamment de RAGE. CD147 se lie spécifiquement à S100A9, mais pas à S100A8. [60] S100A9 possède une grande affinité pour l’héparine et se lie au sulfate d’héparine sur les cellules endothéliales de microvasculature qui ne possèdent ni CD36 ni RAGE. [61] Il a aussi été démontré dans les macrophages péritonéaux de rats que le récepteur CD68 pouvait se lier à S100A8 et à S100A9 et qu’il était impliqué dans la régulation des fonctions immunitaires de cette cellule. [62]
29
1.3.4. Fonctions intracellulaires
S100A9 possèderait des fonctions intracellulaires. Au niveau des leucocytes, ces rôles peuvent être différents dépendamment si la protéine forme un homodimère ou un hétérodimère avec S100A8. S100A9, sous forme d’homodimère, inhibe la réduction de l’activité des télomérases induite par S100A8. [63] S100A9 est aussi impliquée dans la différenciation des cellules myéloïdes. Les cellules de la moelle osseuse, lorsqu’elles sont déficientes en S100A9, répondent de façon plus importante au G-CSF et au Granulocyte-Macrophage-Colony Stimulating Factor (GM-CSF) que lorsqu’elles expriment cette protéine, ce qui indique que les précurseurs myéloïdes sont favorisés par rapport aux précurseurs lymphoïdes en absence de S100A9. [64] S100A9 inhibe la différenciation des cellules myéloïdes et l’accumulation des cellules myéloïdes suppressives (Myeloid-Derived Suppressor Cell - MDSC) en contexte pathologique via la génération de ROS intracellulaires, ce qui contribue à la croissance des tumeurs. [53] S100A9 pourrait aussi modifier le phénotype des cellules myéloïdes. Les neutrophiles déficients en S100A9 produisent moins de cytokines en réponse à la stimulation de TLR-4 alors que les cellules dendritiques déficientes en S100A9 en produisent plus. [65] La suppression du gène de S100A9 affecte la réponse des neutrophiles aux chimioattractants et perturbe aussi le cytosquelette, ce qui diminue la migration transendothéliale. [66] S100A9 est nécessaire à la formation et la stabilisation des microtubules chez le neutrophile en modulant la mobilisation de calcium induite par des agonistes inflammatoires dont la réponse est liée à l’IP3. [67] Chez les monocytes et les
neutrophiles, l’augmentation des concentrations de calcium intracellulaire, de concert avec l’activation de la mitogen-activated protein kinase (MAPK) p38, induit un changement de conformation de l’hétérodimère, ce qui mène à la phosphorylation de S100A9 [68, 69]. S100A9 réduit la polymérisation des microtubules et la réticulation (cross-linking) de l’actin-F par l’hétérodimère S100A8/A9. [68] La phosphorylation de S100A9 mène à la dissociation de l’hétérodimère des microtubules et à la dépolymérisation de ceux-ci. Les neutrophiles de souris déficientes en S100A9 montrent une migration transendothéliale déficiente et une migration compromise en réponse à une blessure ouverte. [68] S100A9 promeut la
30
signalisation calcique associée à des signaux inflammatoires médiés par l’IP3 chez
les neutrophiles. [70]
La première fonction rapportée de l'hétérodimère S100A8/S100A9 est de pouvoir inhiber les caséines I et II [71], ce qui suggère un rôle dans la différenciation des cellules myéloïdes par l’interaction avec des protéines du noyau. L’hétérodimère transporte des acides gras insaturés ainsi que l’acide arachidonique [72] et promeut l’activation de la NADPH oxydase dans les phagocytes en interagissant avec p67 phox et la petite protéine G Rac-2. [73] S100A8/A9, mais pas les homodimères, se lie à Rac-2 et p67phox et ce complexe interagit directement avec le cytochrome b558 de façon calcium-dépendante. [74-76] Cet ancrage stabilise le complexe, augmente son activité et induit un changement de conformation du cytochrome permettant l’activité de la NADPH oxydase. [73, 77, 78] La phosphorylation de la thréonine 113 de S100A9, qui est nécessaire pour la translocation de l’hétérodimère à la membrane, pourrait être requise. [79] S100A8/A9 a été décrit très tôt comme un transporteur majeur d’acides gras insaturés et d’acide arachidonique (AA) dans les neutrophiles. Il est aussi impliqué dans le transport intracellulaire d’AA et de ses précurseurs dans les kératinocytes. [52, 72, 80] S100A8/A9 joue également un rôle dans le transport de l’AA à l’endothélium. [81] Cette fonction de transporteur lui permet de jouer un rôle important dans l’activation de la NADPH oxydase, complexe très abondant dans les phagocytes, particulièrement dans les neutrophiles, ce qui contribue grandement à leur activité antimicrobienne. La phosphorylation de S100A9 est médiée par la MAP kinase p38 et est dépendante de la phospholipase indépendante du calcium A2 (calcium-independent phospholipase A2 - iPLA2). [82] S100A8/A9 est important pour la phagocytose sous contrôle du récepteur FcγRI/CD64 qui requiert une déplétion des réservoirs de calcium intracellulaire pour l’internalisation. [83] Suivant la phagocytose de zymosan opsonisé, l’hétérodimère fait office de senseur de calcium cytoplasmique qui lie l’influx de calcium à la production de ROS par les phagosomes. [83] À la suite de l’internalisation de zymosan opsonisé, S100A8/A9 agit comme un senseur cytoplasmique de calcium qui peut lier l’influx de celui-ci à la production de ROS par la NADPH oxydase. La migration du complexe de la
31
NADPH oxydase à la membrane phagosomale est dépendante du calcium et à lieu en réponse au zymosan opsonisé, ce qui confirme les observations selon lesquelles S100A9 est séquestré près des phagosomes durant ce processus. [84] Une colocalisation entre S100A9 et le glutathion autour des membranes phagosomales qui contiennent du zymosan opsonisé a aussi été observée. Puisque S100A9 est déjà S-glutathionylée, cela pourrait représenter une forme de protection contre les dommages du complexe intracellulaire, et possiblement de l’assemblage de la NADPH oxydase, durant une flambée respiratoire médiée par le récepteur Fcγ. De la même manière, S100A9 réduit la production de peroxyde induite par le phorbol 12-myristate 13-acetate (PMA) chez les macrophages activés par la protéine du vaccin bilié de Calmette et Guérin (BCG). [85]
L’hétérodimère se retrouve à la membrane à la suite de l’activation du phagocyte et pourrait promouvoir la formation et la stabilisation des microtubules ainsi que l’augmentation de la polymérisation de la tubuline chez les neutrophiles. [68] Ces interactions avec les composantes du cytosquelette sont calcium-dépendantes et sont importantes pour la migration, la dégranulation, la phagocytose des monocytes activés ainsi que des neutrophiles. Le tétramère promeut la polymérisation des microtubules et la réticulation de l’actine de type F. [68]
1.3.5. Fonctions extracellulaires
Dans un contexte extracellulaire, les calgranulines sont considérées comme faisant partie d’un groupe de protéines endogènes nommées les motifs moléculaires associés aux dégâts cellulaires (Damage-Associated Molecular Patterns) (DAMP) qui active le système immunitaire inné et acquis en cas de danger. [86] Des concentrations importantes de calgranulines peuvent se retrouver dans divers liquides biologiques humains lors d’une pathologie, notamment la goutte (Tableau 1). La structure des protéines S100 et leur partenaire putatif de liaison peuvent déterminer leurs fonctions. Par exemple, S100A8 et S100A9 ont des fonctions qui sont dépendantes de la formation de l’hétérodimère. Plus les protéines S100 sont oligomérisées plus elles sont fonctionnellement efficaces; pour certaines fonctions, des concentrations élevées sont nécessaires pour l’activation,
32
alors que d’autres dépendent de faibles concentrations, ce qui indique des affinités différentes aux récepteurs. [87] De plus, les protéines S100 peuvent être structurellement altérées par leur micro-environnement menant à des modifications transcriptionnelles pouvant affecter les fonctions. Selon les cas, l’endocytose contrôlée par récepteurs ou non est impliquée dans la fonction extracellulaire des S100. [88]
33
Tableau 1 : Concentration de S100A8/A9 dans différentes pathologies rhumatismales
Pathologie Localisation Concentration (µg/ml) Polyarthrite rhumatoïde Liquide synovial 23,645 ± 11,737 Sérum 1,64 ± 0,89 Arthrose Liquide synovial 1,033 ± 0,348 Sérum 0,455 ± 0,122 Goutte Liquide synovial 63,907 ± 11,41 Sérum 1,984 ± 0,484 Chondrocalcinose Liquide synovial 60,166 ± 24,846 Sérum 1,803 ± 0,633 Spondylarthrite Liquide synovial 28,486 ± 12,818 Sérum 1402 ± 678 Arthrite psoriasique Liquide synovial 13,463 ± 6,96 Sérum 1,266 ± 0,605
34
S100A9 est un important activateur de l’adhésion des neutrophiles au fibrinogène, à la fibronectine et aux cellules endothéliales. [90-92] Cette adhésion est consécutive à l’activation de l’intégrine β2 des neutrophiles et peut être empêchée par le chélateur de calcium BAPTA. [82] S100A9 est aussi un régulateur positif de la migration des neutrophiles entre les cellules endothéliales. S100A9 augmente la migration spontanée et dépendante de CXCL8/IL-8 des neutrophiles. [64, 92] On trouve S100A9 dans les lavages bronchoalvéolaires des patients atteints de fibrose pulmonaire idiopathique et de sarcoïdose et les concentrations corrèlent avec la quantité de neutrophiles. [93] S100A9 est un mitogène pour les fibroblastes, stimule la sécrétion de CXCL8/IL-8 par les cellules épithéliales dérivées des poumons et pourrait contribuer au recrutement des neutrophiles et à la fibrose dans certains désordres pulmonaires. [94] S100A9 bloque l’activation des macrophages à la suite de la phagocytose de neutrophiles apoptotiques. [95]
Plusieurs protéines S100 possèdent des propriétés chimiotactiques. S100A8 et S100A9 murins sont chimiotactiques pour les macrophages alvéolaires et péritonéaux. [96] L’activité de ces protéines chez l’humain est moins claire sur les neutrophiles et les monocytes et pourrait dépendre de l’état de l’oxydation de la protéine. [92] Elles peuvent inhiber la migration des neutrophiles. [97, 98] La liaison de S100A8/A9 aux N-glycans carboxylés sur le récepteur RAGE et d’autres récepteurs glycosylés promeut la migration des MDSC grâce à un mécanisme dépendant de la voie de signalisation NF-B. [99] Le fait de bloquer la liaison de S100A8/A9 avec un anticorps contre le glycan réduit le niveau de MDSC dans le sang et dans les organes lymphoïdes secondaires dans un modèle murin de cancer métastatique. [99] Chez des souris injectées avec des S100A8 et/ou anti-S100A9, la migration des neutrophiles et des monocytes/macrophages est diminuée aux sites d’infection en réponse aux MSU et à une infection au Streptococcal pneumonia (Fig. 11). [92, 100]
Il a été suggéré que les activités chimiotactiques des calgranulines n’étaient pas biologiquement importantes lors des maladies inflammatoires puisque la surexpression de S100A8 et S100A9 dans des kératinocytes murins ne mène pas
35
au recrutement de leucocytes [86], malgré le fait qu’il ait été démontré que les kératinocytes exprimant S100A8 ne la sécrètent pas. [101] Un autre argument est que les concentrations de calgranulines sont beaucoup plus importantes dans la circulation sanguine d’individus avec des maladies inflammatoires que leurs concentrations optimales durant les expériences in vitro. [101] Une injection intraveineuse de CXCL8/IL-8 ou de N-formylmethionyl-leucyl-phenylalanine (fMLP) à une concentration relativement élevée permet de réduire l’extravasation des neutrophiles en inhibant des fonctions nécessaires à la transmigration. [102] De la même façon, des concentrations circulantes élevées de calgranulines pourraient tempérer l’infiltration des neutrophiles et des monocytes. [103]
Différents effets ont pu être observés au niveau de l’activation cellulaire. L’hétérodimère n’induit pas la sécrétion de cytokines par lui-même dans des cellules murines de la moelle osseuse, mais permet de potentialiser l’effet du LPS sur la sécrétion de cytokines. [66] S100A9 et S100A8/A9 induisent l’expression de TNF, IL-1β, IL-6 et CXCL8/IL-8 chez les macrophages via une activation de NF-B. [104] S100A9, et, dans une moindre mesure, S100A8 induisent la production de cytokines comme TNF, IL-1β, IL-6, G-CSF, CCL5/RANTES et CCL3/MIP-1β chez les monocytes après une activation de NF-B. [104, 105] Pouliot et collaborateurs ont suggéré l’importance du TLR-4 pour la production d’oxyde nitrique (NO) induite par les calprotectines dans une lignée cellulaire murine de macrophages. [106] Pourtant, Hsu et Geczy n’ont observé aucune induction de cytokines ou production de NO par des monocytes/macrophages primaires murins ou humains activés avec différentes concentrations de calgranulines ou de S100A8/A9. [107] La stimulation de S100A8/A9 par des lymphocytes T cytotoxiques d’individus atteints de lupus érythémateux augmente la production d’IL-17, ce qui suggère un rôle de S100A8/A9 dans le développement de lymphocytes T autoréactifs. [108] D’un autre côté, S100A8/A9 inhibe la synthèse d’immunoglobulines par les lymphocytes B. [109] S100A8/A9 promeut aussi l’activité transcriptionnelle du VIH de type 1 et la réplication virale dans les lymphocytes T auxiliaires infectés [110] et sa régulation positive dans les monocytes pourrait potentialiser cet effet. [111] S100A8/A9, mais pas les homodimères, stimule les propriétés proinflammatoires et adhésives des
36
cellules endothéliales [68] malgré que Lim et collaborateurs n’ont pu répliquer ce résultat [112]. Cet hétérodimère pourrait potentialiser l’activation des cellules endothéliales par les produits avancés de glycation, incluant CD54/ICAM-1, CD106/VCAM-1, IL-6 et CCL2/MCP-1 par l’activité de ERK1/2 et de p38 MAPK. [113] S100A8 et S100A9 transportent l’acide arachidonique à l’endothélium par un système modulé par CD36 [81] et stabilise et protège la leucotriène A4 (LTA4) de l’hydrolyse non enzymatique, ce qui augmente possiblement la disponibilité des leukotriènes bioactives. [114] S100A8/A9 cause la perte de contact dans les cellules endothéliales de la microvasculature in vitro, menant à l’apoptose via des voies caspase-dépendantes et caspase-indépendantes et est suggéré comme cause des dommages aux cellules endothéliales dans les cas de vasculites et de maladies inflammatoires. [115]
S100A8 et S100A9 sont deux protéines qui contribuent fortement aux défenses antimicrobiennes des neutrophiles. Elles sont toutes deux sécrétées aux sites d’infections [116] et se retrouvent en abondance dans les abcès bactériens. [117, 118] Les niveaux peuvent atteindre 20 µg/ml [119] dans les abcès et les niveaux circulants de S100A8/A9 sont aussi augmentés dans les cas de choc septique autant chez les souris que les humains. [116] La calprotectine possède de nombreuses propriétés bactéricides en réponse à plusieurs organismes, particulièrement les champignons, par sa capacité à chélater le zinc et le magnésium. [117, 120] La calprotectine est la protéine majoritaire qui compose les NET et son activité y est zinc-dépendante, confirmé dans des souris KO pour S100A9 qui sont susceptibles à une infection à l’Aspergillus. [121] Par contre, S100A8/A9 augmente la croissance de Mycobacterium tuberculosis in vitro. [122]
37
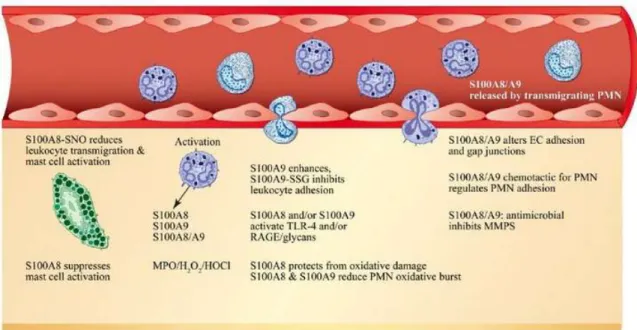
Figure 11 — Résumé des rôles critiques de S100A8 et de S100A9 dans l’inflammation
Cette figure présente les événements menant au recrutement des leucocytes ainsi qu’à leur activation. Ces protéines ont à la fois des propriétés chimiotactiques et antimicrobiennes.
38
S100A8/A9 et S100A8 augmentent les niveaux d’ARN messagers de la métalloprotéinase 3 (MMP3), de la MMP9 et de la MMP13 dans des macrophages murins dérivés de la moelle osseuse. [124] Les ARN messagers de MMP3, MMP13 et ADAMTS-4 ont été retrouvés dans le synovium de souris atteinte d’arthrite rhumatoïde induite par l’albumine de sérum bovin. [124] La destruction du cartilage était absente chez les souris déficientes en S100A9 et les niveaux d’ARN messagers étaient beaucoup plus bas dans les synoviaux arthritiques de ces souris. [124] S100A8 et S100A9 sont exprimés chez les chondrocytes hypertrophiques dans les os normaux et ces protéines se retrouvent autour et dans les chondrocytes dans un modèle d’arthrite expérimentale. [125]
Les concentrations extracellulaires de calprotectine ont un effet cytotoxique ou apoptotique. Des concentrations relativement élevées inhibent la croissance d’une variété de cellules tumorales ou non (macrophages, cellules de la moelle osseuse, lymphocytes, fibroblastes). [126] S100A8/A9 pourrait aussi promouvoir l’autophagie. [127] Ces deux mécanismes pourraient impliquer une communication entre les lysosomes et la mitochondrie menant à la génération de ROS. [127]
1.3.6. La goutte et S100A9
L’implication de S100A9 et de S100A8/A9 dans de nombreuses maladies inflammatoires fait de ces protéines des cibles de choix pour la recherche en immunologie. La goutte, quant à elle, est une pathologie de choix pour y étudier le rôle de S100A9 puisque la majorité des cellules immunitaires y sont des neutrophiles. De plus, dans un tophus goutteux, la majorité des cellules mononucléaires sont positives pour S100A8 et S100A9. [128] S100A8/A9 se retrouve dans les tophi, les liquides synoviaux et les sérums et sa concentration corrèle avec la sévérité de la maladie. [89] Les niveaux circulants de S100A8/A9 chez les patients goutteux corrèlent avec les niveaux de CXCL8/IL-8. [129]
L’équipe du Dr Philippe Tessier a montré que, dans un modèle murin de poche d’air injecté avec des cristaux de MSU, 1) S100A8, S100A9 et S100A8/A9 se retrouvent à de fortes concentrations dans l’exsudat de la poche d’air, 2) l’injection de S100A8,
39
S100A9 ou S100A8/A9 menait à l’accumulation de neutrophiles dans la poche d’air et 3) l’utilisation d’anticorps bloquants contre S100A8 ou S100A9 inhibait complètement l’accumulation de neutrophiles dans la poche d’air. [130] La même équipe a aussi démontré que les neutrophiles stimulés avec des MSU libéraient S100A8/A9 et que cette sécrétion pouvait être liée à l’activation de CD11b, de CD16, des Src kinases, de Syk et de la polymérisation de la tubuline. [100] Une autre équipe a démontré que S100A8/A9 était effectivement sécrété par les phagocytes activés par le MSU et que la calprotectine permettait d’augmenter la sécrétion d’IL-1β induite par le MSU de façon TLR-4 dépendante. [39] Une délétion ciblée de S100A9 dans ces souris permettait de réduire modérément l’inflammation due aux MSU in vivo. [89] Il a été démontré que la sécrétion de S100A8/A9 par les neutrophiles en réponse au MSU dépendait de la production de ROS et nécessitait des échanges de potassium grâce à des canaux à potassium sensibles à l’ATP. [131]
40
1.4.
Hypothèse et objectifs
Plusieurs rôles sont attribués à la protéine S100A9 lors d’une crise de goutte [89, 130], mais son implication dans l’activation des neutrophiles reste à définir. Plus précisément, il serait important, pour mieux comprendre la goutte, de détailler les effets combinés de la protéine S100A9 et des MSU sur des neutrophiles primaires humains. Comme il semble évident que ces deux composantes agissent de concert lors de la crise de goutte, cette étude in vitro permet d’éclaircir la synergie entre S100A9 et les MSU chez les neutrophiles humains au niveau métabolique, signalétique et fonctionnel.
Notre hypothèse est que la protéine S100A9 amplifie la réponse des neutrophiles humains aux MSU puisqu’ils sont exposés à la protéine S100A9 au niveau des capillaires sanguins, c’est-à-dire à une étape très précoce de leur recrutement à l’articulation inflammée. La préactivation du neutrophile à ce stade remplirait alors la double mission de ne pas activer les fonctions effectrices du neutrophile afin de ne pas créer de dommage tissulaire tout en préparant le neutrophile à s’activer rapidement et efficacement dès son arrivée au site de l’inflammation.
Nos objectifs étaient de caractériser les effets individuels ou en combinaison de S100A9 et des MSU sur le métabolisme énergétique (glycolyse), l’activation (mobilisation du calcium, phosphorylation des tyrosines et phosphorylation des sérines des substrats de PKC, Akt et p38) et les fonctions effectrices (production de ROS et production des cytokines IL-1 et CXCL8/IL-8) des neutrophiles. Ces fonctions effectrices et voies de signalisation sont déjà connues pour leurs rôles dans la réponse du neutrophile aux MSU seul et le métabolisme permet de fournir l’énergie nécessaire à ces réponses. [37]
Cette étude permettra de mettre en lumière le rôle de S100A9 sur les neutrophiles lors d’une crise de goutte. Éclaircir ce rôle ainsi que les voies de signalisation déclenchées par cette protéine permettra d’identifier de nouvelles cibles thérapeutiques.