HAL Id: hal-02821612
https://hal.inrae.fr/hal-02821612
Submitted on 6 Jun 2020HAL is a multi-disciplinary open access
archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Impact de l’ozone troposphérique sur le métabolisme
antioxydant du peuplier (Populus sp.) : pools
d’antioxydants, activités enzymatiques et expression des
gènes correspondants
Marien Havé
To cite this version:
Marien Havé. Impact de l’ozone troposphérique sur le métabolisme antioxydant du peuplier (Populus sp.) : pools d’antioxydants, activités enzymatiques et expression des gènes correspondants. [Stage] Université Paris Est Créteil Val de Marne (Paris 12) (UPEC UP12), Créteil, FRA. 2009, 57 p. �hal-02821612�
Université Paris Est Créteil
Master BIO-RESSOURCES « Ingénierie Biologique de l’Environnement »
Mémoire de stage.
Impact de l’ozone troposphérique sur le métabolisme
antioxydant du peuplier (Populus sp.) : pools d’antioxydants,
activités enzymatiques et expression des gènes
correspondants.
Marien Havé
Année Universitaire 2008-2009
Encadrants : Dr. Anne Repellin, groupe Écophysiologie Moléculaire de l’université Paris EST.
Dr. Yves Jolivet, équipe Ecophysiologie Cellulaire et Moléculaire de l’Université Nancy 1.
Université Paris Est Créteil
Master BIO-RESSOURCES « Ingénierie Biologique de l’Environnement »
Mémoire de stage.
Impact de l’ozone troposphérique sur le métabolisme
antioxydant du peuplier (Populus sp.): pools d’antioxydants,
activités enzymatiques et expression des gènes
correspondants.
Marien Havé
Année Universitaire 2008-2009
Encadrants : Dr. Anne Repellin, groupe Écophysiologie Moléculaire de l’université Paris EST.
Dr. Yves Jolivet, équipe Ecophysiologie Cellulaire et Moléculaire de l’Université Nancy 1.
Remerciements
Je tiens à remercier mes maîtres de stage Mme Anne Repellin, Mr Yves Jolivet et Mr Didier Le Thiec pour leur soutient, leur aide et leurs conseils.
Je remercie les équipes des laboratoires de Nancy et Créteil pour leur aimable accueil.
Je remercie Mme Zarly, Mme Zuilly et Mr Dizengremel de m’avoir accueilli dans leur laboratoire et équipe.
Et enfin je voudrais remercier Ruben et Nassim, pour leur bonne humeur pendant ce stage, François et Fabien, et surtout Aurélie pour ses conseils et son soutient pendant ce stage et tout au long de
Sommaire
Liste des Figures ... I
1.
Introduction... 1
2.
Synthèse bibliographique ... 4
2.1. L’ozone dans l’atmosphère terrestre ...4
2.1.1. L’ozone stratosphérique...4
2.1.2. La formation de l’ozone troposphérique ...4
2.1.3. Répartition de l’ozone troposphérique ...6
2.1.4. Evolution de la concentration en ozone troposphérique ...6
2.2. Impact de l’ozone troposphérique sur la végétation ...7
2.2.1. Impact sur les plantes ...7
2.2.2. Impact sur les agrosytèmes et les écosystèmes forestiers ...8
2.2.3. Indices d’exposition à l’ozone ...9
2.3. Mécanismes d’action de l’ozone à l’échelle cellulaire ...11
2.3.1. Diffusion dans les tissus foliaires ...11
2.3.2. Formations d’espèces activées de l’oxygène (ROS) dans l’apoplasme et contrainte oxydative ...11
2.4. Mécanismes de résistance à une contrainte oxydative par détoxication des espèces activées de l’oxygène ...12
2.4.1. La voie de détoxication des espèces activées de l’oxygène d’Halliwell-Asada-Foyer ...12
2.4.2. Importance de l’ascorbate et du glutathion et stimulation des voies de biosynthèse ...13
2.4.3. Les enzymes impliquées dans le cycle d’ Halliwell-Asada-Foyer ...14
2.4.3.1. L’Ascorbate Peroxydase ...14
2.4.3.2. La Glutathion Réductase ...15
3.
Matériels et méthodes ... 17
3.1. Matériel végétal et traitement à l’ozone ...17
3.2. Etude de l’activité d’Ascorbate Peroxydases, Glutathion Réductases chez le peuplier en réponse à l’ozone ...17
3.2.1. Extraction des protéines totales de feuilles de peuplier ...17
3.2.2. Quantification des protéines totales de feuilles de peuplier ...18
3.2.3. Activités enzymatiques spécifiques ...19
3.2.3.1. Dosage de l’activité Ascorbate peroxydase ...19
3.2.3.2. Dosage de l’activité Glutathion réductase ...19
3.2.3.3. Calcul des activités spécifiques ...20
3.3. Analyse des pools d’ascorbate et de glutathion chez le peuplier en réponse à l’ozone ...20
3.3.1. Extraction des formes réduites et oxydées de l’ascorbate et du glutathion...20
3.3.2. Quantification des formes réduites et oxydées d’ascorbate ...21
3.3.2.1. Principe des mesures ...21
3.3.2.2. Protocoles de mesure...21
3.3.3. Quantification des formes oxydées et réduites du Glutathion ...22
3.3.3.1. Principe des mesures ...22
3.3.3.2. Protocole de mesure ...22
3.4. Etude de l’expression de gènes codant des Ascorbate Peroxydases, des Glutathion Réductases et une enzyme impliquée dans la synthèse de l’ascorbate ...22
3.4.2. Extraction d’ARNs totaux (ARNt) de feuilles de peuplier ...23
3.4.3. Elimination de l’ADN génomique dans les extraits d’ARNs totaux ...24
3.4.4. Rétrotranscription d’ARNs totaux de feuilles de peuplier en ADN complémentaire (ADNc) ...24
3.4.5. Réactions de PCR sur les ADNc obtenus à partir de feuilles de peuplier ...24
3.4.6. Clonage de produits de réaction PCR ...25
3.4.6.1. Ligation des amplicons dans le vecteur de clonage plasmidique pGEM-T easy ...25
3.4.6.2. Préparation de bactéries compétentes pour la transformation bactérienne par choc thermique ...26
3.4.6.3. Transformation des bactéries compétentes et sélection ‘blanc/bleu’ de colonies bacteriennes ...26
3.4.7. Isolement d’ADN plasmidique (mini-préparation) ...27
4.
Résultats ... 29
4.2. Exposition à l’ozone ...29
4.3. Evolution des activités enzymatiques spécifiques ...30
4.3.1. Activités Ascorbate Peroxydase ...30
4.4. Evolution des pools d’antioxydants ...32
4.4.1. Evolution du pool d’ascorbate ...32
4.4.2. Evolution du pool de glutathion ...34
5.
Discussion ... 37
6.
Conclusion et Perspective ... 41
I
Liste des Figures
Figure 1: Cycle de l'ozone dans la troposphère. D’après Jenkin et Clemitshaw (2000). ... 5 Figure 2: Evolution de la concentration en ozone troposphérique depuis 1840 et prévision en 2100. D'après Vingarzan (2004). 6 Figure 3: Relation entre réduction de la biomasse relative au témoin chez le bouleau (Betula pendula) et la dose d'ozone
cumulée déterminé par différents indices ... 10 Figure 4 : Schéma du cycle Halliwell-Asada-Foyer. D'après Castagna et Ranieri (2008). ... 13 Figure 5 : Evolution de la dose cumulée d’exposition à l’ozone pour chaque traitement au cours des 56 jours de traitement. 29 Figure 6 : Evolution de l’activité spécifique de l’Ascorbate Peroxydase et de la Glutathion Réductase au cours des 56 jours de
traitement. ... 30 Figure 7 : Evolution de l’activité spécifique relative par rapport aux témoins de l’Ascorbate Peroxydase et de la Glutathion
Réductase en réponse à la dose d’exposition à l’ozone. ... 31 Figure 8 : Evolution du pool d’ascorbate, de déshydroascorbate et d’ascorbate total au cours des 56 jours de traitement... 32 Figure 9 : Evolution du pool d’ascorbate, de déshydroascorbate et d’ascorbate total en fonction de la dose d’exposition à
l’ozone. ... 33 Figure 10 : Evolution de l’état redox de l’ascorbate au cours des 56 jours de traitement et évolution de l’état redox de
l’ascorbate relatif au témoins en fonction de la dose d’exposition à l’ozone. ... 33 Figure 11 : Evolution du pool de Glutathion réduit, de glutathion oxydé et de glutathion total au cours des 56 jours de
traitement. ... 34 Figure 12 : Evolution du pool glutathion oxydé, de glutathion réduit et de glutathion total en fonction de la dose d’exposition
à l’ozone ... 35 Figure 13 : Evolution de l’état redox du glutathion au cours des 56 jours de traitement. ... 35
1
1.
Introduction
Dans la troposphère (la partie de l’atmosphère terrestre qui s’étend de la surface du sol jusqu’ 8 à 16km d’altitude), l’ozone est un polluant d’origine anthropique dont la concentration a considérablement augmenté depuis le siècle dernier. Les teneurs actuelles sont désormais à l’origine de troubles de la santé tels que des réactions inflammatoires dans les voies respiratoires, des dommages tissulaires et une réduction de la capacité pulmonaire. Chez les plantes, l’ozone affecte un certain nombre de processus physiologiques et biochimiques essentiels ce qui se traduit par une baisse de croissance et une défoliation chez certaines espèces. Il est ainsi responsable de diminutions significatives du rendement des grandes cultures, de réductions de la capacité de séquestration du CO2 des écosystèmes forestiers et est susceptible d’affecter la biodiversité. De ce fait, l’ozone est
aujourd’hui considéré comme l’un des polluants gazeux les plus toxiques pour la végétation.
Selon certains modèles d’évolution des concentrations en ozone dans la troposphère, il est prévu que celles-ci continuent d’augmenter au cours des prochaines décennies. Afin de prédire les conséquences de cette augmentation sur la productivité et la survie des agro-écosystèmes, des modèles prédictifs d’impact ont été élaborés. Cependant, la valeur des modèles actuels est limitée car ceux-ci n’intègrent pas de paramètre physiologique comme le flux effectif d’ozone qui correspond au bilan entre le flux d’ozone entrant dans les tissus foliaires et l’ozone (ou les molécules délétères dérivées) qui sont neutralisées en terme de toxicité par les systèmes antioxydants des cellules. L’identification de paramètres cellulaires permettant d’évaluer la capacité de détoxication de l’ozone et de suivre l’évolution de cette capacité en fonction du type d’exposition à ce polluant est l’objectif du travail de recherche présenté ici. Ce travail est inscrit dans deux contrats de recherche, IFLOZ (Impacts et Flux d’Ozone sur les couverts végétaux) et VULNOZ (Vulnérabilité des agro-écosystèmes à l’ozone. Quels risques à l’horizon 2020-2030 ?), financés respectivement par l’INSU (l’Institut National des Sciences de l’Univers) et l’ANR (l’Agence Nationale de la Recherche). Ces deux contrats font collaborer le groupe Écophysiologie Moléculaire (EPM) de l’université Paris EST avec, ente autres, l’unité Environnement et Grandes Cultures (EGC) du centre INRA de Grignon-Thiverval et l’UMR 1137 INRA/UHP Ecologie et Ecophysiologie Forestières (EFF) de Nancy.
Ce travail a porté sur le clone de peuplier Soligo (Populus x canadensis Moench). En plus de son importance économique pour la fabrication de bois d’emballage et de pâte à papier, le peuplier est le modèle biologique ligneux car sa croissance est rapide, il peut être propagé végétativement, transformé génétiquement et la séquence du génome de Populus trichocarpa (peuplier baumier) a été publiée en 2006. De plus, de précédentes études ayant montré qu’il présentait une sensibilité
2 élevée à l’ozone, il constitue un matériel intéressant pour l’étude de l’évolution des capacités de détoxication de l’ozone chez les arbres forestiers et les écosystèmes forestiers.
La principale voie biochimique cellulaire de détoxication de l’ozone et des molécules qui en découlent est le cycle ascorbate-glutathion ou voie de Halliwell-Asada-Foyer. Dans ce travail, le cycle a été étudié à plusieurs niveaux afin d’identifier les paramètres permettant l’évaluation précise des capacités de détoxication en fonction de l’exposition à l’ozone. Ainsi, dans les feuilles de peupliers soumis à différentes doses d’ozone, nous avons quantifié certains intermédiaires du cycle : l’ascorbate et le glutathion, sous leurs formes réduites et oxydées. L’activité de deux enzymes a été mesurée. Ces enzymes sont les formes actives de l’Ascorbate Peroxydase impliquée dans la réduction d’espèces activées de l’oxygène dérivées de l’ozone et la Glutathion Réductase, impliquée dans la régénération du glutathion réduit. Ces études ont été complétées par l’étude des variations d’accumulation des transcrits ARN de l’Ascorbate Peroxydase, de la Glutathion Réductase et de VTC2, qui code pour une enzyme-clé de la voie de biosynthèse de l’ascorbate.
Ce travail a été réalisé sous la direction conjointe du docteur Anne Repellin, Yves Jolivet et Didier Le Thiec. Madame Repellin, coordinnatrice du projet IFLOZ, est Maître de Conférences à l’Université Paris EST-Créteil (groupe d’Ecophysiologie Moléculaire, équipe IBIOS, UMR 7618 BIOEMCO), Monsieur Jolivet est Maître de Conférence à l’Université Henri Poincaré Nancy 1 (UMR 1137 INRA/UHP Ecologie et Ecophysiologie Forestières) et Monsieur Le Thiec, est Chargé de Recherches et responsable de l’équipe Bioclimatologie et Ecophysiologie au centre INRA de Nancy (UMR 1137 INRA/UHP Ecologie et Ecophysiologie Forestières).
3
Synthèse Bibliographique
4
2.
Synthèse bibliographique
2.1. L’ozone dans l’atmosphère terrestre
L’ozone est une molécule d’oxygène triatomique, caractérisé par un puissant pouvoir oxydant (potentiel d’oxydation de 2,076V) et rentre dans la composition de l’atmosphère en tant qu’espèce trace (de 0 à 0,07ppm selon l’altitude). Selon la couche de l’atmosphère dans laquelle il se trouve, il peut tenir un rôle indispensable à la vie des êtres vivants ou être néfaste pour ceux-ci.
2.1.1.L’ozone stratosphérique
Dans la stratosphère (entre 12 et 50km d’altitude en moyenne), l’ozone est formé de façon naturelle par réaction d’une molécule de dioxygène avec un atome d’oxygène issu de la dissociation d’une molécule de dioxygène sous l’effet du rayonnement ultraviolet (UV). La couche d’ozone ainsi formée concentre 90% de l’ozone atmosphérique, elle filtre les rayons UV de courtes longueurs d’ondes (entre 200 et 320nm, UV-B) néfastes pour les organismes vivants jouant ainsi un rôle important dans la protection et le maintien de la vie sur terre (Jankowski & Cader, 1997 ; Hollosy, 2002). Depuis les années 80, on constate une destruction de cet ozone stratosphérique, notamment aux pôles (Farman et al., 1985). Ce phénomène est dû à l’accumulation de chlorofluorocarbones (CFC) contenu dans les mélanges réfrigérants : ces composés, très stables, parviennent jusqu’à la stratosphère, réagissent avec les molécules d’ozone et les détruisent après avoir été photolysés. Il a été rapporté que la diminution de l’ozone stratosphérique pourrait entraîner une chute importante des rendements agricoles (Reich et al., 1985). Une régénération de la couche d’ozone a cependant été observée depuis les réductions des émissions de CFC mises en place par la signature du protocole de Montréal en 1987.
2.1.2.La formation de l’ozone troposphérique
La troposphère est la partie de l’atmosphère terrestre qui s’étend de la surface du sol jusqu’à 8 à 16km d’altitude et constitue le siège de la plupart des phénomènes météorologiques et des flux atmosphériques et concentre la majeure partie de la masse totale d’air, la totalité de la vapeur d’eau et seulement 10% de l’ozone atmosphérique.
L’ozone troposphérique peut être formé de façon naturelle de la même manière que dans la stratosphère mais la faible intensité du rayonnement UV dans la troposphère limite cette réaction. L’ozone troposphérique est principalement d’origine anthropique : les activités humaines, telles que les transports routiers, produisent d’importantes quantités d’oxydes d’azotes (NOx). Parmi ceux-ci, le monoxyde d’azote (NO) réagit avec le dioxygène de l’air pour former du dioxyde d’azote (NO2 ;
5 réaction 1 ; figure 1). Sous l’effet du rayonnement UV, le dioxyde d’azote libère un atome d’oxygène (réaction 2) qui se combine au dioxygène de l’air pour former une molécule d’ozone (réaction 3).
2 NO + O2 2 NO2 (réaction 1)
NO2 + hν NO + O (réaction 2)
O + O2 O3 (réaction 3)
L’ozone ainsi formé peut réagir avec le monoxyde d’azote ce qui pourrait limiter son accumulation (réaction 4).
O3 + NO O2 + NO2 (réaction 4)
Cependant, certains composés organiques volatils (COV) émis par les couverts végétaux et de nombreuses activités humaines (industries, habitations et transports routiers) modifient ce cycle de formation de l’ozone : après réaction avec le dioxygène de l’air (réaction 5), les COVs se combinent au monoxyde d’azote (réaction 6). Ces réactions favorisent donc l’accumulation d’ozone en déséquilibrant le système vers une production accrue d’ozone via la libération de NO2 (réactions 2 et
3).
RH + O2 RO2 (réaction 5)
(COV)
RO2 + NO RO + NO2 (réaction 6)
L’ozone troposphérique est qualifié de polluant secondaire et de polluant photochimique car il résulte de réactions entre les COVs et les NOx (dits polluants primaires) en présence de radiations solaires. D’autre part, l’ozone troposphérique absorbe le rayonnement infrarouge (IR) et constitue ainsi un gaz à effet de serre avec une contribution au réchauffement climatique correspondant au quart de celui du CO2.
2.1.3.
6
Figure 2: Evolution de la concentration en ozone troposphérique depuis 1840 et prévision en 2100. Les barres d'erreurs correspondent aux différents scénarios IPCC. D'après Vingarzan (2004).
2.1.3.Répartition de l’ozone troposphérique
La répartition de l’ozone entre zones urbaines et les zones suburbaines et rurales est inégale. En zones urbaines, les quantités importantes de NO générées par les activités humaines permettent d’éliminer l’ozone formé (Sillman, 1999). La nuit, l’absence de rayonnement UV empêche la formation d’ozone et l’ozone accumulé au cours de la journée est alors éliminé par le monoxyde d’azote. Le jour, l’ozone est éliminé en début de matinée lorsque la température de l’air est encore trop basse pour permettre la volatilisation des COVs et que des quantités élevées de monoxyde d’azote sont générées par le trafic routier important à cette période de la journée. Dans les zones suburbaines et rurales, les teneurs en NO sont trop faibles et ne permettent pas d’éliminer efficacement l’ozone. De plus, l’émission de COVs par les couverts végétaux s’ajoute aux COVs d’origine industriel apportés par les vents depuis les zones de production et il y’a ainsi accumulation d’ozone au dessus des couverts végétaux.
2.1.4.Evolution de la concentration en ozone troposphérique
Depuis le développement des activités humaines et des transports intercontinentaux, à l’origine de fortes émissions de NOx et de COVs précurseurs d’ozone, la concentration en ozone troposphérique est passée de 10ppb au début du XXème siècle à une valeur comprise entre 20 et 45ppb au tournant du XXIème siècle (Vingarzan, 2004). Après l’observation d’impacts du l’ozone sur les rendements des cultures et sur les forêts, des mesures de contrôle des émissions de NOx et de COVs ont été prises, dans les années 80, par les pays d’Amérique du Nord et de l’Europe de l’Ouest et ont permis de réduire la concentration des pics d’ozone dans ces régions. Cependant, les concentrations globales de fond, en
7 ozone troposphérique continuent d’augmenter (Ashmore, 2005) du fait de l’augmentation de l’émission de précurseurs en Asie, en Amérique du Sud et en Afrique. Selon différents scénarios de l’IPCC (Groupe d'experts intergouvernemental sur l'évolution du climat ; GIEC en français), la concentration moyenne en ozone troposphérique pourrait ainsi s’élever entre 35 et 48ppb en 2040 et entre 42 et 84ppb en 2100 (Fig. 2 ; Vingarzan, 2004). Ainsi, du fait de son fort pouvoir oxydant et de sa concentration croissante dans la troposphère, l’ozone est susceptible d’entraîner des dégâts sur la santé humaine et d’avoir un impact significatif sur les rendements des agrosystèmes et la survie des écosystèmes forestiers, il est donc considéré comme le plus problématique des polluants atmosphériques.
2.2. Impact de l’ozone troposphérique sur la végétation
2.2.1.Impact sur les plantes
Les réponses des plantes exposées à l’ozone dépendent à la fois du type d’exposition et de leur sensibilité à ce polluant (Fiscus et al., 2005, Castagna et Ranieri, 2008). Une exposition à des concentrations élevées en ozone pendant une courte période (exposition aiguë) provoque des lésions foliaires semblables à celles pouvant être observées lors de la réponse d’hypersensibilité induite par une interaction d’incompatibilité entre plantes et pathogènes (Diara et al., 2005). Une exposition à long terme à des concentrations en ozone relativement peu élevées provoque une diminution de la photosynthèse et de la croissance, et une sénescence foliaire prématurée sans nécessairement provoquer l’apparition de dommages visibles (Kangasjärvi et al., 2005 ; Gielen et al., 2007).
Une réduction significative de la photosynthèse a été observée chez les espèces végétales cultivées et arborées. Cette baisse d’assimilation du CO2 serait dû à une diminution de la quantité et
de l’activité de la rubisco (Lehnherr et al., 1987, Di Baccio et al., 2008) ainsi qu’à une diminution de la capacité de transport d’électrons photosynthétiques et des teneurs en pigments photosynthétiques : chlorophylles et caroténoïdes (Ranieri et al., 2001).
Une exposition à l’ozone entraîne très souvent une baisse de la conductance stomatique (gs) correspondant à la fermeture des stomates, aussi bien chez les espèces herbacées que chez les espèces arborées (Castagna et Ranieri, 2008). La fermeture des stomates en réponse à l’ozone est considérée comme un mécanisme de protection destiné à limiter l’entrée du polluant dans les tissus foliaires (Castagna et al., 2001). La façon dont l’ozone agit sur la fonction stomatique reste encore mal comprise. Plusieurs auteurs ont démontré que la réduction de la conductance stomatique était le résultat, et non la cause, d’une baisse de l’assimilation ; la fermeture des stomates serait alors déclenchée par l’augmentation de la concentration en CO2 interne résultant de la diminution de la
8 photosynthèse (Fiscus et al., 1997). Cependant, l’ozone pourrait affecter directement la fonction stomatique : la formation de peroxyde d’hydrogène dérivé de l’ozone dans les cellules de garde entraînerait une élévation de la concentration en Ca2+ dans le cytosol de ces cellules, déclenchant alors la fermeture des stomates (McAinsh et al., 2002, Kangasjärvi et al., 2005).
L’ozone réduit également l’allocation de carbone vers les organes puits, ce qui a pour conséquence de diminuer la croissance racinaire chez les espèces cultivées (Cooley et Manning, 1987) et arborées (Landolt et al., 1994). La diminution de l’allocation de carbone vers les racines peut être dûe à la diminution de l’activité photosynthétique qui réduit la quantité d’assimilats disponibles (Furher et Booker, 2003), à une inhibition de la fonction de charge du phloème (Grantz et Farrar, 2000), à une sénescence accélérées des feuilles basses, principales sources de photosynthétats pour les racines (Cooley et Manning, 1987) et à l’augmentation de l’allocation de carbone vers les feuilles pour la réparation des dégâts causés par l’ozone. Selon Furher et Booker (2003), la réduction de l’allocation de carbone vers les racines peut affecter négativement la formation de mycorhizes et limiter les symbioses entre légumineuses et rhizobium, ce qui pourrait réduire l’approvisionnement en nutriments.
Une méta-analyse de Black et al., (2000) étudiant les effets de l’ozone sur la reproduction chez un certain nombre d’espèces cultivées et arborées rapporte qu’une exposition à l’ozone entraîne un retard dans la floraison, une réduction du nombre de fleurs produites, une inhibition de la germination du pollen et de la croissance du tube pollinique, une perte de rendement en fruits et en grains, et affecte également la germination des graines. Tous ces effets peuvent résulter de la baisse de l’assimilation dans les organes végétatifs et de la réduction de l’allocation de carbone vers les organes reproducteurs et/ou peuvent être causés par une action directe de l’ozone sur les appareils reproducteurs. Une exposition à l’ozone entraîne ainsi une baisse des rendements en fruits et en grains et affecte la qualité de la production végétale.
2.2.2.Impact sur les agrosytèmes et les écosystèmes forestiers
L’ozone troposphérique est responsable d’une diminution de la croissance et du rendement chez des espèces de première importance agronomique comme le blé, le riz et le soja, en Europe (Peijel et al., 2007) et dans le monde (Ashmore, 2005). Ces baisses de rendements s’accompagnent de pertes économiques importantes (Ashmore, 2005 ; Fiscus et al., 2005). L’effet de l’ozone sur la photosynthèse des arbres forestiers affecte la productivité primaire nette des écosystèmes forestiers et donc leur capacité de séquestration du CO2 (Beedlow et al., 2004) dont la concentration est en
hausse dans l’atmosphère.L’ozone est susceptibled’affecter de façon importante la biodiversité et de modifier les relations de symbioses entre plantes et microorganismes dans la rhizosphère(Furher
9 et Booker, 2003). De plus, la diminution de la biomasse racinaire observée après une exposition à l’ozone pourrait réduire l’humidité du sol. Ceci entraînerait alors une fermeture des stomates qui conduirait à son tour à un changement des flux d’eau et d’ozone au niveau de la canopée.
Selon des modèles de simulation de l’évolution de la concentration et de la distribution de l’ozone dans la troposphère, la surface de forêts potentiellement exposées à une concentration en ozone capable d’induire des effets physiologiques significatifs sur les arbres forestiers pourrait passer de 24% en 1990 à près de 50% en 2100 (Fowler et al., 1999). Les surfaces agricoles exposées à une concentration en ozone susceptible d’entraîner des baisses de rendement de 10% pourraient passer de 9-35% en 1985 à 30-75% en 2020 (Chameides et al., 1994). L’Asie, mais également l’Amérique du Sud et l’Afrique pourraient être particulièrement concernées par ces changements. Dans ces deux dernières régions, où le maintien des stocks de nourriture est rendu difficile face aux changements climatiques, par les politiques agricoles, par la croissance démographique rapide et une diminution de la fertilité des sols, des baisses additionnelles (dûe à l’ozone) des rendement des cultures pourraient avoir de graves répercutions sociales et économiques (Emberson et al., 2003). Il est donc indispensable d’établir des seuils critiques d’exposition à l’ozone afin d’assurer la survie des écosystèmes et de réduire les pertes de rendements à un niveau économique acceptable.
2.2.3.Indices d’exposition à l’ozone
Dans le but de prédire l’impact de l’ozone sur la végétation, des indices ont été créés afin d’associer les pertes en productivité observées à l’exposition à l’ozone. En Europe, l’indice retenu par la Commission Economique pour l’Europe de l’ONU (UNECE) pour évaluer les risques liés à l’ozone pour la végétation est l’AOT40 (accumulated dose over a trehold of 40ppb). Il est calculé en faisant la somme des concentrations horaires en ozone supérieures à un seuil de 40ppb, en ne prenant en compte que les heures avec un éclairement de 50 W.m-2 et pendant la période de croissance (avril à septembre pour les forêts). Un AOT40 de 10 ppm.h est le seuil retenu pour un effet néfaste. Lorsque le seuil de l’AOT40 est dépassé, des mesures sont prises par les décideurs afin de diminuer les émissions de précurseurs de l’ozone : conduite alternée, limitation de l’utilisation de solvants.
10
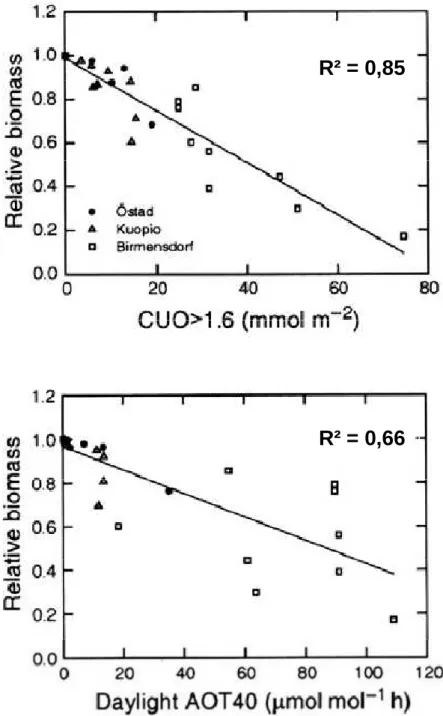
Figure 3: Relation entre réduction de la biomasse relative au témoin chez le bouleau (Betula pendula) et la dose d'ozone cumulée déterminée par différents indices : le CUO>1,6 ou la dose d'ozone cumulée dans les feuilles au dessus d’un seuil de 1,6nmol m-2 s-1 (en haut) et l’AOT 40 (en bas).
Des études ont souligné qu’un tel indice ne prenait pas en compte le fait que la phytotoxicité de l’ozone dépend plus étroitement du flux d’ozone entrant dans les tissus foliaires plutôt que de la dose d’exposition seule (Ashmore, 2005). Depuis, il existe un consensus dans la communauté scientifique, approuvé par la
‘’Convention on Long-Range Transboundary Air Pollution’’ (UNECE), sur le fait que les indices basés sur les flux stomatiques représentaient l’approche la plus appropriée pour établir de nouveaux indices et seuils critiques d’exposition à l’ozone . Deux nouveaux indices basés sur ce concept du flux d’ozone entrant dans les tissus foliaires ont alors été inventés. Le CUO (Cumulative uptake of ozone) qui correspond à la dose cumulée d’ozone par les feuilles et l’AFstX (accumulated
stomatal flux of ozone over a threshold of X nmol m-2 s-1), le flux d’ozone stomatique cumulé auquel on attribue un seuil de X nmol m-2 s-1 qui traduit la capacité de détoxication de l’ozone des plantes. Ce seuil est déterminé de façon empirique en privilégiant les valeurs qui fournissent la meilleure corrélation dose/effet pour les plantes considérées. Uddling et al. (2004) ont montré, chez le bouleau (Betula pendula), que l’utilisation
du CUO permettait d’obtenir une corrélation plus étroite entre les pertes de biomasse et l’exposition à l’ozone qu’avec l’indice AOT40 (Figure 3). Des conclusions similaires ont été déduites d’études sur plusieurs espèces ligneuses avec l’utilisation de L’AFstX.
R² = 0,85
11 Le CUO et L’AFstX présentent toutefois quelques limites. En effet, ils ne prennent pas en
compte l’évolution temporelle de la capacité antioxydante des cellules foliaires. Afin de rendre les indices d’exposition à l’ozone encore plus performant, Musselman et al. (2006), et d’autres, ont mis au point le concept de ‘’flux effectif’’ d’ozone qui est le bilan entre le flux d’ozone absorbé par voie stomatique et les capacités de détoxication des plantes. C’est de ce ‘’flux effectif’’ d’ozone que dépende les réponses des plantes à une exposition à l’ozone. Ainsi, des indices ou des modèles d’impacts prenant en compte ce ‘’flux effectif’’ d’ozone constitueraient de bon outils pour prévoir le plus précisément possible l’impact de l’ozone sur la production et la survie des agro-écosystèmes dans les années à venir.
2.3. Mécanismes d’action de l’ozone à l’échelle cellulaire
2.3.1.Diffusion dans les tissus foliaires
La diffusion de l’ozone à travers la cuticule des feuilles est négligeable, celle-ci forme en effet une barrière quasi-absolue à la diffusion des gaz (Kerstiens et Lendzian, 1989). Le flux d’ozone diffusant à travers les tissus foliaires est donc presque entièrement contrôlé par les échanges gazeux stomatiques et dépend ainsi du nombre de stomates sur les feuilles, de leur dimension et de leur degré d’ouverture (Castagna et Ranieri, 2008).
2.3.2.Formations d’espèces activées de l’oxygène (ROS) dans l’apoplasme et contrainte oxydative
Dans l’apoplasme, l’ozone est virtuellement indétectable : immédiatement après son entrée dans la cavité sous-stomatique, il se décompose spontanément en espèces activées de l’oxygène et/ou réagit avec de nombreux composés de la paroi cellulaire et de la membrane plasmique pour former des espèces activée de l’oxygène (Laisk et al, 1989). Des radicaux libres, comme l’ion superoxyde (O2
–.
), le radical hydroxyle (OH–) ainsi que du peroxyde d’hydrogène (H2O2) sont, entre
autre, formés.
Cette décomposition de l’ozone dans l’apoplasme constitue la première phase de la cinétique de formation des ROS (Fiscus et al., 2005) Ceux-ci déclenchent des peroxydations des lipides membranaires conduisant à une déstructuration de la membrane plasmique qui permet la progression de la contrainte oxydative à l’intérieur de la cellule. De plus, l’ion superoxyde et le peroxyde d’hydrogène sont capables de traverser les membranes plasmiques et de diffuser à l’intérieur des compartiments subcellulaires. Il faut également noter que le peroxyde d’hydrogène est un inhibiteur de la plupart des enzymes du cycle de Calvin.
12 Si la quantité de ROS formées au cours de cette première phase excède la capacité antioxydante de l’apoplasme, l’excès de ROS déclanche un mécanisme de génération endogène active de ROS qui s’autopropage (Kangasjärvi et al., 2005 ; Castagna et Ranieri, 2008). La seconde phase de formation d’espèces activées de l’oxygène est d’abord limitée à l’apoplasme puis se propage à travers le cytoplasme, vers les peroxysomes et les mitochondries et les chloroplastes (Pellinen et al., 1999). Ces processus pourraient déclencher plusieurs réponses : la mort de la cellule, une réaction d’hypersensibilité conduisant à la mort cellulaire programmée et une sénescence accélérée (Pell et al., 1997). Elles peuvent toutefois être modulées par les taux d’éthylène, d’acide jasmonique et d’acide salicylique (Kangasjärvi et al., 2005, Fiscus et al., 2005).
La phytotoxicité de l’ozone est donc à la fois dûe à la toxicité directe des espèces activées de l’oxygène et indirectement aux réponses cellulaires déclenchées par les voies de signalisation faisant intervenir ces ROS. Les plantes doivent donc maintenir la concentration en ROS en dessous du seuil de toxicité, par l’intermédiaire de systèmes antioxydants enzymatiques ou non enzymatiques, afin d’induire un ajustement approprié au niveau de l’expression de gènes et aux niveaux métaboliques et physiologiques sans déclencher la mort cellulaire (Castagna et Ranieri, 2008).
2.4. Mécanismes de résistance à une contrainte oxydative par détoxication des espèces activées de l’oxygène
Comme les réactions associées à la photosynthèse, la photorespiration et le fonctionnement mitochondrial constituent des sources majeures de ROS dans les cellules (Foyer et Noctor, 2005), les plantes ont mis en place des systèmes antioxydants enzymatiques et non enzymatiques très efficaces capables de détoxiquer des quantités importantes d’espèces activées de l’oxygène (Castagna et Ranieri, 2008).
2.4.1.La voie de détoxication des espèces activées de l’oxygène d’Halliwell-Asada-Foyer
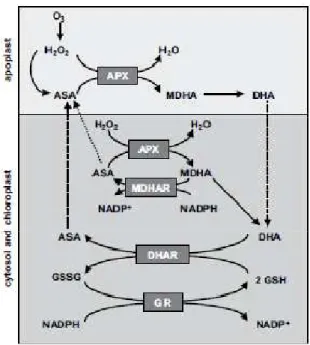
Le cycle d’Halliwell-Asada-Foyer (Figure 4) constitue la composante majeure du système antioxydant chez les plantes (Noctor et Foyer, 1998). Dans l’apoplasme et dans le cytosol, l’ascorbate (AsA) réagit avec les ROS dérivées de l’ozone et est oxydé en déhydroascorbate (DHA).Si l’ascorbate apoplastique permet d’éliminer une quantité significative de ROS dérivées de l’ozone (Castagna et Ranieri, 2008), Van Hove et al. (2001) ont démontré, chez le peuplier, que les concentrations en ascorbate dans l’apoplasme étaient insuffisantes pour protéger les feuilles contre les dommages causés par des concentrations ambiantes en ozone (environ 50ppb ) et qu’il était rapidement reconstitué avec de l’ascorbate provenant du cytosol où les concentrations en antioxydants sont 10 à 30 fois supérieures. Seule la forme réduite de l’ascorbate possède des propriétés antioxydantes, le
13 DHA doit donc être réduit en ascorbate dans le cytosol par la Déhydroascorbate réductase (DHAR) au prix de l’oxydation d’une molécule de glutathion réduit (GSH). Le glutathion est particulièrement important pour les cellules puisqu’en plus de contribuer à la régénération de l’ascorbate réduit, il est capable, par réaction directe, de réduire et éliminer les ROS et peut également se conjuguer aux protéines pour éviter leur oxydation. Tout comme l’ascorbate, seule la forme réduite possède ces propriétés. Le glutathion oxydé (GSSG) peut à son tour être réduit par la Glutathion Réductase (GR) qui utilise le NADPH, issue de la photosynthèse, de la glycolyse ou de la voie des pentoses phosphates, comme accepteur d’électron.
En plus de réagir directement avec les ROS, l’ascorbate peut également servir de substrat à l’Ascorbate Peroxydase (APX). Celle-ci réduit le peroxyde d’hydrogène en eau et produit du monodéhydroascorbate (MDHA) qui peut être réduit en ascorbate par la Monodéhydroascorbate Réductase (MDHAR) par oxydation d’une molécule de NADPH en NADP+. L’Ascorbate Peroxydase est considérée comme une enzyme clé du système antioxydant chez les plantes du fait de sa forte affinité pour le peroxyde d’hydrogène et de sa présence dans l’apoplasme et dans les différents compartiments cellulaires : le cytosol, les chloroplastes, les peroxysomes et les mitochondries (Miyake et Asada, 1992 ; Ranieri et al., 1998).
Figure 4 : Schéma du cycle Halliwell-Asada-Foyer. D'après Castagna et Ranieri (2008).
2.4.2.Importance de l’ascorbate et du glutathion et stimulation des voies de biosynthèse
Comme on vient de le voir, l’ascorbate et le glutathion réduit sont des composants majeurs du système antioxydant de par leur interaction directe avec les ROS et leur fonction de substrat d’enzymes du cycle d’Halliwell-Asada-Foyer. Le rôle antioxydant joué par l’ascorbate et le glutathion
14 est cependant strictement dépendant de la capacité de la cellule à les maintenir à l’état réduit. Les plantes doivent donc être capables de les régénérer sous forme réduite efficacement et de les synthétiser de manière accrue.
Les facteurs majeurs contrôlant la synthèse du glutathion réduit sont d’une part la disponibilité en cystéine et d’autre part l’activité de la g-glutamylcysteine synthase (g-ECS) (Noctor, 2006). Chez le peuplier, Di Baccio et al. (2008) ont observé qu’une forte accumulation de transcrits ARN de la g-glutamylcysteine synthase était associée à un pool de glutathion réduit (GSH) élevé. Chez le peuplier, l’expression de ce gène ne semble pas être affectée par une exposition chronique à l’ozone (Di Baccio et al., 2008).
La voie majeure de biosynthèse de l’ascorbate est la voie de Smirnoff-Wheeler. La vitesse de biosynthèse semble être associée à l’activité de la GDP-L-Galactose Phosphorylase codée par le gène
VTC2 (Linster et al., 2007). Encore aucune étude n’a été réalisée sur la variation de l’expression de ce
gène en réponse à l’ozone.
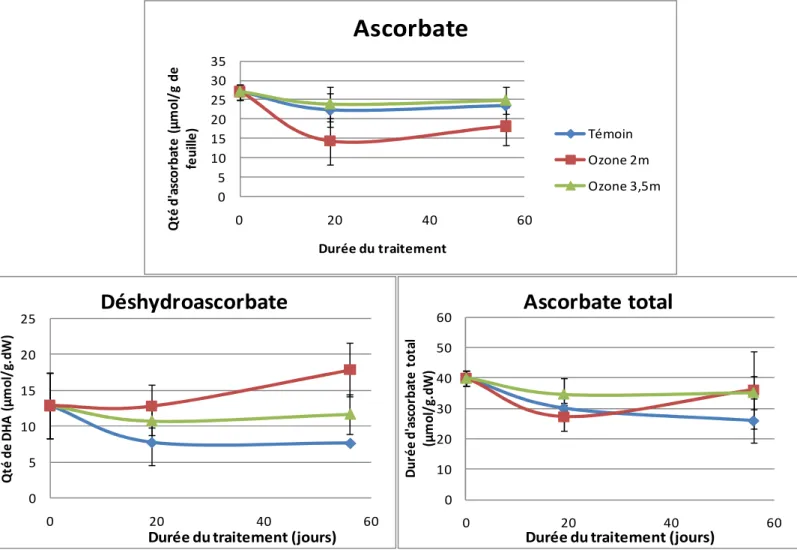
L’évolution des pools d’ascorbate et de glutathion en réponse à l’ozone varie en fonction de l’espèce et de la sensibilité de la plante. Toutefois, il apparaît que les espèces tolérantes parviennent à maintenir leur pool d’ascorbate et de glutathion dans un état redox (paramètre qui reflète l’équilibre entre les formes réduites et formes oxydées) plus réduit que les espèces sensibles.
2.4.3.Les enzymes impliquées dans le cycle d’ Halliwell-Asada-Foyer 2.4.3.1. L’Ascorbate Peroxydase
L’Ascorbate Peroxydase catalyse la réaction de réduction du peroxyde d’hydrogène en eau au prix de l’oxydation d’une molécule d’ascorbate en monodéhydroascorbate. L’existence d’Ascorbate Peroxydases a été mise en évidence chez de nombreuses espèces végétales (Shigeoka et al., 2002). Plusieurs isoformes ont été mises en évidence : dans le cytosol (cAPX), dans le stroma (sAPX), liée aux membranes des thylakoides (tAPX) et dans les peroxysomes (pAPX). Elles présentent une masse moléculaire d’environ 30kDa (Shigeoka et al., 2002) et sont très spécifiques de leurs substrats, en particulier les isoformes chloroplastiques, et sont inhibées par de faibles concentration en ascorbate et par des réactifs contenant un groupement thiol.
Les variations de l’activité des différentes isoformes de d’Ascorbate Peroxydase ainsi que la régulation de ces activités en réponse à une contrainte environnementale rapportées dans la littérature sont parfois contradictoires. Les réponses des plantes sembleraient dépendre de la sensibilité de la plante, du type de contrainte et de la façon dont cette contrainte est appliquée. Toutefois, en réponse à une exposition chronique à l’ozone, une stimulation de l’activité Ascorbate
15 Peroxydase globale est généralement observée chez plusieurs espèces (Ranieri et al., 1996 ; 2003) dont le peuplier (Ranieri et al., 1998). Cette stimulation est supérieure chez les clones présentant une tolérance à l’ozone par rapport aux clones sensibles. Au contraire, une exposition aiguë à l’ozone entraîne une diminution significative de l’activité APX globale chez deux espèces de trèfle différemment sensibles à l’ozone. L’expression du gène codant la cAPX est stimulée en réponse à une exposition à l’ozone chez Arabidopsis thaliana (Conklin et Last, 1995) et le peuplier (Rizzo et al., 2007). Peu d’analyses de l’évolution de l’activité cAPX et de l’expression du gène cAPX ont été réalisées en réponse à une contrainte à l’ozone empêchant de connaitre le mode de régulation de cette activité en réponse à cette contrainte.
2.4.3.2. La Glutathion Réductase
La Glutathion Réductase permet de régénérer le glutathion réduit au prix de l’oxydation d’une molécule de NADPH. La Glutathion Réductase est largement répandue dans le règne végétal et plusieurs isoformes ont été mises en évidence : l’isoforme cytosolique (GR-cyt) et chloroplastique (GR-chl) qui est responsable de 80% de l’activité totale dans les feuilles (Edwards et al., 1990).
Comme pour l’Ascorbate Peroxydase, Les informations concernant les variations de l’activité des différentes isoformes de la Glutathion Réductase ainsi que la régulation de ces activités en réponse à une contrainte environnementale rapportées dans la littérature sont parfois contradictoires. Chez le trèfle et le peuplier, il a été observé que l’activité Glutathion Réductase globale diminuait chez les clones sensibles en réponse à une exposition à l’ozone (Scebba et al., 2003 ; Di Baccio et al., 2008). Une accumulation de transcit GR-cyt et GR-chl plus importante chez un clone tolérant de peuplier par rapport à un sensible correspondait à une activité Glutathion Réductase plus élevée chez le clone tolérant. Cependant, une augmentation de l’accumulation de transcrit GR-cyt chez le clone tolérant, en réponse à une exposition chronique à l’ozone, ne s’est pas traduit par une augmentation de l’activité Glutathion Réductase (Di Baccio et al., 2008).
16
Matériels et Méthodes
17
3.
Matériels et méthodes
3.1. Matériel végétal et traitement à l’ozone
L’étude a été menée sur de jeunes plants de peuplier Soligo (Populus x canadensis Moench), hybride issu du croisement entre le peuplier deltoïde (Populus deltoides Bartr. Ex March.) et le peuplier noir (Populus nigra L.).
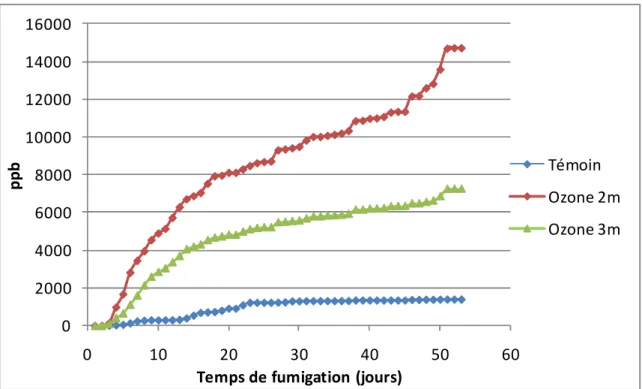
Les jeunes plants de peuplier sont issus de boutures provenant de la pépinière nationale de Guéméné Penfao. Les boutures ont été mises en pôts de 6L (mélange tourbe sable 50/50). Après un mois, les plants sont transplantés en champ sur la parcelle NitroEurope-IP du centre INRA de Grignon-Thiverval : 32 peupliers sont plantés à 15m de la rampe de fumigation et constituent les témoins, 16 peupliers sont plantés à 2m et à 3,5m de la rampe de fumigation. Quand les plants sont âgés de deux mois, la feuille 9, en partant du haut, est identifiée à l’aide d’un morceau de ficelle nouée autour du pétiole et les feuilles 8 et 10 sont prélevées sur 6 plants témoins, 4 plants à 2m et 4 plants à 3,5m et immédiatement congelées dans de l’azote liquide puis conservées dans un congélateur à -80°C. Ce premier prélèvement constitue l’échantillon témoin.Des prélèvements sont effectués 19, 35, 49 et 56 jours après le premier prélèvement selon le même mode opératoire que celui décrit précédemment.
Le traitement à l’ozone commence 7 jours après la date du premier prélèvement. Il est assuré, en plein, champ, par un générateur d’ozone relié à une rampe de fumigation qui diffuse une dose d’ozone constante. Le vent de Nord-Est, dominant dans la région, est utilisé comme agent disperseur et permet de créer un gradient d’ozone à 2m et 3,5m de la rampe. Un dispositif est présent pour que la rampe ne soit active que lorsque le vent a une composante Nord-Est. Des capteurs sont installés à 2m et 3,5m et 15m de la rampe afin d’enregistrer les concentrations en ozone atteintes à ces trois distances.
3.2. Etude de l’activité d’Ascorbate Peroxydases, Glutathion Réductases chez le peuplier en réponse à l’ozone
Ces analyses ont été réalisées au laboratoire d’Ecologie Cellulaire et Moléculaire (ECM) de l’UMR 1137 INRA/UHP Ecologie et Ecophysiologie Forestières à l’université Nancy 1 Henri Poincaré.
3.2.1.Extraction des protéines totales de feuilles de peuplier
Environ 150mg de matière fraîche sont broyés dans l’azote liquide en présence de PVPP (10%, m/m) et 3,5mL de tampon d’extraction de composition suivante :
18 - HEPES-KOH pH 7,8 (50mM).
- EGTA (5mM).
- MgCl2 (5mM).
- Triton X-100 (0,4%, m/v), un détergent de synthèse permettant de déstructurer les membranes cellulaires et de solubiliser les protéines membranaires.
- PVP 25000 (0,06%, m/v) et PEG 20000 (0,07%, m/v) qui, comme le PVPP, sont des protecteurs qui précipitent les tanins et les polyphénols libérés au cours du broyage et qui pourraient dénaturer et inactiver les protéines enzymatiques.
- Ascorbate (5mM) afin d’éviter que l’Ascorbate péroxydase ne soit inactivée.
- Pepstatine (1µM), un inhibiteur de protéase à acide aspartique et Leupeptine (1µM), un inhibiteur de protéase à sérine.
Les extraits sont centrifugés à 36000xg pendant 20 minutes à 4°C (centrifugeuse Avanti 30 Beckman) afin de culotter les débris cellulaires. 2,5mL de surnageant sont prélevés et dessalés par passage sur une colonne Sephadex G25 (Pharmacia PD-10, Orsay, France). Les protéines solubles sont récupérées par élution dans 3,5mL d’un tampon de composition suivante :
Tampon de solubilisation = HEPES-KOH pH 7,8 (50mM), EGTA (5mM), MgCl2 (5mM), Ascorbate
(5mM).
L’éluat ou extrait protéique soluble total est divisé en trois : une fraction est conservée dans la glace en vue du dosage de l’activité Glutathion réductase immédiatement après dessalage, une deuxième fraction est conservée à -80°C en vue de quantifier les protéines solubles totales et une troisième fraction est conservée à -80°C après ajout de glycérol (10%, v/v) en vue du dosage de l’activité Ascorbate peroxydase.
3.2.2.Quantification des protéines totales de feuilles de peuplier
La teneur en protéines solubles totales de chaque échantillon est déterminée selon la méthode de Bradford (1976) basée sur le changement d’absorbance du bleu de Coomassie de 465nm à 595nm lorsque celui-ci se lie, par interactions non-covalentes, aux acides aminés basiques (arginine, lysine et histidine) et aromatiques (phénylalanine, tyrosine et tryptophane) des protéines. Les mélanges réactionnels sont composés de 20µL d’extrait protéique soluble total dilué cinq fois, 780µL d’eau ultra pure et de 200µL de bleu de Coomassie (réactif Biorad). Le témoin est composé de
19 800µL d’eau ultra pure et de 200µL de bleu de Coomassie. Après homogénéisation et incubation pendant 10 minutes à température ambiante, l’absorbance est lu à 595nm à l’aide d’un spectrophotomètre Beckman DU 640 (Beckman Coulter France, Villepinte, France). Deux répétitions sont réalisées par échantillon. Une gamme étalon d’Albumine Sérique Bovine (SAB), allant de 2,5µg à 10µg, est réalisée dans les mêmes conditions.
3.2.3.Activités enzymatiques spécifiques
3.2.3.1. Dosage de l’activité Ascorbate peroxydase 3.2.3.1.1. Principe des mesures
Les ascorbate peroxydases (AscPOD) catalysent l’oxydation de l’ascorbate (AsA) en Monodéhydroascorbate (MDHA) en présence de peroxyde d’hydrogène (H2O2) :
AsA MDHA
H2O2 2 H2O
Le dosage est effectué selon une méthode dérivée de celle mise au point par Nakano et Asada (1981) basée sur la diminution de l’absorbance de l’ascorbate qui peut être suivie spectrophotométriquement à 298nm (ε=0,000758) après ajout de peroxyde d’hydrogène.
3.2.3.1.2. Protocoles de mesure
Le mélange réactionnel a la composition suivante : Tampon HEPES-KOH pH7 (50mM), EDTA (0,1mM), Ascorbate (2mM) et un volume variable de l’extrait protéique total dans un volume total de 200µL. La réaction est déclenchée par l’addition d’H2O2 (5mM). La diminution d’absorbance est suivie
pendant cinq minutes, 15 secondes après l’ajout d’H2O2, sur un spectrophotomètre Beckman DU 640
(Beckman Coulter France, Villepinte, France) et les activités sont calculées sur les deux premières minutes (décrit dans le paragraphe 3.2.3.4). Pour chaque extrait, deux dosages essais (avec H2O2) et
deux témoins (sans H2O2) sont effectués.
3.2.3.2. Dosage de l’activité Glutathion réductase 3.2.3.2.1. Principe des mesures
Les glutathion réductases (GR) catalysent la réduction du glutathion oxydé (GSSG) en glutathion réduit (GSH) avec consommation d’une molécule de NADPH. Le dosage est effectué selon la méthode de Smith et al. (1988) basée sur la réaction spontanée du GSH avec l’acide 5,5’-Dithiobis(2-nitrobenzoic) (DTNB) qui produit l’acide 2-Nitro-5-thiobenzoic (TNB), un composé coloré qui absorbe à 412nm (ε=14150) : AscPOD 2 TNB DTNB GR NADPH NADP+ GSSG 2 GSH AscPOD
20 3.2.3.2.2. Protocoles de mesure
L’activité Glutathion réductase est mesurée indirectement par quantification du TNB formé par après réaction du GSH réduit par l’enzyme. Le mélange réactionnel a la composition suivante : HEPES-KOH pH 7,8 (50mM), EDTA (1mM), DTNB (0,75mM), GSSG (1mM) et un volume variable de l’extrait protéique total dans un volume total de 200µL. La réaction est déclenchée par l’ajout de NADPH (0,2mM). L’augmentation de l’absorbance est suivie à 412nm sur un spectrophotomètre Beckman DU 640 (Beckman Coulter France, Villepinte, France) 15 secondes après le début de la réaction et les activités sont calculées sur les trois premières minutes (décrit dans le paragraphe 3.2.3.4.). Pour chaque extrait, deux dosages essais (avec NADPH) et deux témoins (sans NADPH) sont effectués.
3.2.3.3. Calcul des activités spécifiques
Les activités spécifiques (AS) sont exprimées en micromoles de substrat transformés par minute et par milligramme de protéines solubles (µmol.min-1.mg-1). Elle est calculée selon la formule suivante :
ܣܵ =ሺ∆DO. min − 1ሻ ∗ 200 ε ∗ 5 ∗ Cprot
Où ε est le coefficient d’extinction molaire, qui correspond à la variation d’absorbance mesurée à une longueur d’onde donnée, pour un trajet optique de 1cm, provoqué par la transformation d’une nanomole de ce composé par mL. Cprot est la concentration en protéines solubles de l’extrait. Le facteur 200/5 est une simplification du facteur permettant de prendre en compte le volume d’extrait.
3.3. Analyse des pools d’ascorbate et de glutathion chez le peuplier en réponse à l’ozone
Ces analyses ont été réalisées au laboratoire d’Ecophysiologie Cellulaire et Moléculaire (ECM) de l’UMR 1137 INRA/UHP Ecologie et Ecophysiologie Forestières à l’Université Nancy 1 Henri Pointcaré.
3.3.1. Extraction des formes réduites et oxydées de l’ascorbate et du glutathion
Le protocole d’extraction employé est celui décrit par Queval et Noctor (1986) : environ 150mg de matières fraîches sont broyés dans l’azote liquide puis passés deux fois au broyeur à bille pendant une minute dans 1,5mL d’HCl (0,2N). L’acidité du milieu permet de digérer les membranes
21 cellulaires et d’inactiver les enzymes responsables de l’oxydation ou de la réduction de l’ascorbate et du glutathion qui pourraient fausser les dosages. Les extraits sont centrifugés à 16000xg pendant dix minutes à 4°C (centrifugeuse Avanti 30 Beckman) afin de culotter les débris cellulaires. 500µL de surnageant sont neutralisés par l’ajout progressif d’environ 400µL de NaOH (0,2M) en présence de 50µL NaH2PO4 pH 5,6 (0,2M) jusqu’à atteindre un pH compris entre 5 et 6. Les extraits neutralisés
sont conservés dans la glace pour la quantification des formes oxydées et réduites de l’ascorbate et du glutathion.
3.3.2. Quantification des formes réduites et oxydées d’ascorbate 3.3.2.1. Principe des mesures
Le dosage de la forme réduite de l’ascorbate (AsA) est effectué selon la méthode décrite par Queval et Noctor (2006) basée sur la diminution de l’absorbance à 265nm de l’AsA après oxydation en molécule non absorbante (MDHA et DHA) après ajout d’Ascorbate Oxydase (AO) (voir Annexe). L’ascorbate total (AsA, MDHA et DHA) est dosé après traitement au Dithiothreitol (DTT) qui permet de réduire le MDHA et le DHA en AsA. Les quantités d’ascorbate oxydé sont déduites des mesures qui précèdent.
3.3.2.2. Protocoles de mesure
Le mélange réactionnel pour le dosage de l’ascorbate réduit est composé de tampon NaH2PO4 pH 5,6 (0,1M) et d’un volume variable d’extrait cellulaire neutralisé dans un volume total de
200µL. La réaction est déclenchée par l’ajout d’AO (1U/mL) et la diminution d’absorbance est suivie à 265nm sur un spectrophotomètre Beckman DU 640 (Beckman Coulter France, Villepinte, France) jusqu’à obtention d’une valeur d’absorbance stable. Pour chaque extrait, deux dosages essais (avec AO) et deux témoins (sans AO) sont effectués. La soustraction de la valeur des absorbances des dosages essais à celles des témoins permet de déterminer la teneur en Ascorbate de chaque extrait à partir d’une gamme étalon d’Ascorbate, allant de 2,5 à 20nmol, réalisée dans les mêmes conditions.
Pour convertir le MDHA et le DHA en AsA, un aliquote d’extrait neutralisé est incubé en présence de tampon NaH2PO4 pH 7,5 (67,2mM) et de DTT (1mM) pendant 30 minutes à température ambiante
22 3.3.3.Quantification des formes oxydées et réduites du Glutathion
3.3.3.1. Principe des mesures
Le dosage des formes oxydée (GSSG) et réduite (GSH) du glutathion est effectué selon la méthode décrite par Queval et Noctor (2006) basée la réduction du GSSG en GSH par la Glutathion Réductase (GR) et sur la réaction spontanée du GSH avec l’acide 5,5’-Dithiobis(2-nitrobenzoic) (DTNB) qui produit l’acide 2-Nitro-5-thiobenzoic (TNB), un composé coloré qui absorbe à 412nm (voir shéma en 2.2.3.3.1.). Le glutathion total (GSH et GSSG) est dosé selon cette méthode tandis que le Glutathion oxydé est dosé spécifiquement après traitement au 2-vinylpyrimidine (VPD) qui se complexe au GSH et l’empêche de réagir avec le DTNB.
3.3.3.2. Protocole de mesure
Pour doser le glutathion total, le mélange réactionnel suivant est utilisé : tampon NaH2PO4
pH 7,5 (0 ,1M), EDTA (5mM), DTNB (0 ,6mM), NADPH (0,5mM) et un volume variable d’extrait cellulaire neutralisé dans un volume total de 200µL. La réaction est déclenchée par l’ajout de GR (1U/mL). L’augmentation de l’absorbance est suivie à 412nm sur un spectrophotomètre Beckman DU 640 (Beckman Coulter France, Villepinte, France) et les valeurs d’absorbance obtenues pendant les 90 premières secondes de réaction sont retenues pour le calcul des concentrations. Pour chaque extrait, deux dosages essais (avec GR) et deux témoins (sans GR) sont effectués. La quantité de TNB formé est déterminée à partir d’une gamme étalon de GSH, allant de 0 à 1nmol, réalisée dans les mêmes conditions.
Afin de doser le glutathion oxydé, 200µL d’extrait neutralisé sont incubés en présence d’1µL de VPD dilué 10 fois pendant 30 minutes à température ambiante pour complexer le glutathion réduit. Après deux centrifugation à 20000g pendant 10 minutes à 4°C (centrifugeuse Avanti 30 Beckman) afin d’éliminer le VPD, une aliquote de cette solution est dosé comme décrit ci-dessus. La quantité de TNB formé est déterminée à partir d’une gamme étalon de GSSG, allant de 0 à 80pmol, réalisée dans les mêmes conditions et après un traitement au VPD.
3.4. Etude de l’expression de gènes codant des Ascorbate Peroxydases, des Glutathion Réductases et une enzyme impliquée dans la synthèse de l’ascorbate
Ces analyses ont été effectuées au sein du groupe d’Ecophysiologie Moléculaire (EPM), équipe IBIOS, UMR 7618 BIOEMCO à l’Université Paris Est-Créteil.
23 3.4.1.Recherche et mise au point d’amorces
Des séquences nucléotidiques correspondant aux gènes d’intérêt sont identifiées chez l’espèce Populus trichocarpa dans la banque de données du ‘‘National Center for Biothechnology Information’’ (NCBI ; http://www.ncbi.nlm.nih.gov/). Les séquences nucléotidiques sont alignées grâce au programme ‘’clustalw’’ (http://bioinfo.hku.hk/services/analyseq/cgi-bin/clustalw_in.pl) afin de mettre en évidence des régions consensus et des couples d’amorces sens et anti-sens sont
dessinés dans ces régions. Le logiciel ‘’Net Primer‘’
(http://www.premierbiosoft.com/netprimer/netprlaunch/netprlaunch.html#) est utilisé pour vérifier
que les amorces dessinées ne présentent pas de séquences palindromiques, qu’elles ne forment pas de boucles en épingles à cheveux et qu’elles ne s’hybrident pas entre elles. Les amorces ont été commandées auprès d’Eurofins MWG Operon (Ebersberg, Allemagne).
3.4.2.Extraction d’ARNs totaux (ARNt) de feuilles de peuplier
Les extractions sont effectuées en utilisant le ‘’RNeasy minikit’’ (Quiagen, France) et en suivant les instructions du fabriquant. Environ 60mg de feuilles sont broyés dans l’azote liquide. Les membranes cellulaires sont déstructurées et les protéines sont dénaturées (dont les RNases) par addition d’un tampon de lyse RLT additionné de β-mercaptoéthanol (1% v/v) et en incubant trois minutes à 60°C. Le tampon RLT contient du thyocyanate de guanidine, un agent chaotropique qui disloque les membranes et dénature les protéines. Le β-mercaptoéthanol empêche la reformation des ponts disulfure et maintient ainsi les protéines à l’état dénaturé. Les débris cellulaires sont éliminés par deux centrifugations à 14500 rpm pendant 6 minutes, les débris cellulaires résiduels sont retenus par centrifugation sur une colonne ‘QIA shredder’. L’éluat contenant les acides nucléiques, dont les ARNs totaux, est déposé sur une colonne de silice qui retient les acides nucléiques. Après lavage avec le tampon RPE les acides nucléiques sont élués par diminution de la force ionique.
La quantité d’ARN totaux extraits des diverses échantillons est déterminée par mesure de leur absorbance à 260 nm au spectrophotomètre (Nanodrop ND 1000, Noryx, USA). Le rapport des absorbance à 260 et 280nm (longueur d’onde d’absorption des protéines) permet également de mettre en évidence une éventuelle contamination par des protéines.
L’intégrité et la qualité des ARNs totaux extraits sont analysées par électrophorèse sur gel d’agarose à 1% contenant du bromure d’éthidium ; un agent intercalant qui fluoresce lorsqu’il est excité par les rayons UV.
24 3.4.3.Elimination de l’ADN génomique dans les extraits d’ARNs totaux
Afin de ne pas fausser les analyses PCR, l’ADN génomique éventuellement co-extrait avec les ARNs totaux sont éliminés par traitement à la Turbo DNase (TURBO DNA-free™ Kit, Ambion, France) en suivant les instructions du fabriquant. Toutes les réactions sont effectuées dans un volume réactionnel de 40µl contenant : le tampon de la TurboDNase concentré 10x, 0,8µl (1,6U) de TurboDNase, de l’eau distillée sans RNase et 3µg d’ARNs totaux. Après 30 minutes d’incubation à 37°C, 0,8µl de TurboDNase sont ajouté au mélange réactionnel qui est à nouveau incubé à 37°C pendant 30 minutes. Le mélange réactionnel est incubé pendant cinq minutes à température ambiante après l’ajout de 5µl de réactif d’inactivation de la TurboDNase afin que celle-ci n’interfère pas avec les réactions de PCR. Les échantillons sont centrifugés à 10000xg pendant 2 minutes afin de culotter le réactif d’inactivation de la TurboDNase. Le surnageant, constitué des ARNs totaux traités à la TurboDNase, est prélevé et transféré dans un nouveau tube.
L’efficacité du traitement à la TurboDNase est vérifiée par un test comparatif comprenant des réactions de PCR (comme décrit dans le paragraphe 3.4.4.) en utilisant, comme matrice, des extraits d’ARN totaux traités et non traités à la TurboDNase.
3.4.4.Rétrotranscription d’ARNs totaux de feuilles de peuplier en ADN complémentaire (ADNc)
Les ARN messagers (ARNm) de feuilles de peupliers sont rétrotranscrits en ADN complémentaires (ADNc) qui sont moins sensibles aux dégradations et qui pourront être amplifiés par PCR. Les réactions sont effectuées en utilisant le kit ‘’Omniscript Reverse Transcription’’ (QUIAGEN) et en suivant les instructions du fabriquant. Toutes les réactions sont effectuées dans un mélange réactionnel de 40µL contenant : 0,5mM de chaque dNTP, 1µM d’amorce oligodT pour rétrotranscrire les ARNm uniquement, un inhibiteur de RNase (10 U/µL), l’enzyme Reverse
Transcriptase Omniscript (4 U/µL) dérivée d’un rétrovirus, de l’eau distillée sans RNase et 1,5µg
d’ARNs totaux préalablement chauffés pendant cinq minutes à 65° afin de les linéariser. Les mélanges réactionnels sont incubés pendant une heure à 37°C, température optimale d’activité de la Reverse Transcriptase.
3.4.5.Réactions de PCR sur les ADNc obtenus à partir de feuilles de peuplier
La réaction de PCR permet d’amplifier un fragment spécifique de chaque gène cible présent en faible quantité et de le rendre détectable. Les réactions de PCR sont réalisées dans un mélange réactionnel de 25 µL contenant :
25 - 10 pmol de chaque amorce sens et anti-sens spécifiques de chaque gène étudié.
- 12,5 µL d’un ‘master mix’ concentré 2x contenant les dNTPs, l’enzyme ADN polymérase thermorésistante issue de la bactérie Thermus aquaticus et le tampon de l’enzyme.
- de l’eau distillée sans RNase.
- 50 ng d’ADNc de feuilles de peuplier.
La PCR s’effectue dans un thermocycler Mastercycler Gradient (Eppendorf) selon le programme suivant :
- dénaturation à 95°C pendant cinq minutes.
- 35 cycles, constitués de trois étapes : dénaturation des doubles brins d’ADNc matrices à 95°C pendant 40 secondes, hybridation des amorces sur les brins d’ADNc matrices pendant 40 secondes à la températures d’hybridation des couples d’amorces utilisées et élongation des nouveaux brins par la Taq polymérase à 72°C (température optimale d’activité de la Taq polymérase) pendant 50 secondes
- élongation terminale et ajout d’une adénosine triphosphate en 3’OH de chaque nouveau brin par la Taq polymérase : 72°C pendant 5 minutes.
Les produits de PCR sont analysés par électrophorèse sur gel d’agarose à 1% (m/v) contenant du bromure d’éthidium et en présence d’un marqueur de taille.
3.4.6.Clonage de produits de réaction PCR
3.4.6.1. Ligation des amplicons dans le vecteur de clonage plasmidique pGEM-T easy
Les amplicons obtenus à partir des amorces spécifiques de gènes cibles sont liés dans des vecteurs de clonage plasmidiques pour conservation en vue d’un séquençage. Le plasmide utilisé est le plasmide pGEM-T Easy (Promega).
La réaction de ligation est effectuée en suivant les instructions du fournisseur dans un mélange réactionnel de 10µl contenant :
- 5µL du tampon de ligation 2x.
- 50ng de vecteur pGEM-T Easy.
- 3 unités d’enzymes T4 DNA ligase, issue du phage T4.
26 quantité d’insert ሺngሻ =quantité de vecteur ሺngሻx taille de l
ᇱinsertሺkbሻ
ݐ݈݈ܽ݅݁ ݀ݑ ݒ݁ܿݐ݁ݑݎ ሺܾ݇ሻ
Le mélange est incubé pendant une heure à température ambiante.
3.4.6.2. Préparation de bactéries compétentes pour la transformation bactérienne par choc thermique
Les bactéries sont rendues compétentes par un traitement au CaCl2 qui permet d’augmenter
la perméabilité de leur membrane. 1mL de culture bactérienne Escherichia coli GT 869 est ajouté à 120mL de milieu Luria-Betani (LB) et incubé à 37°C avec agitation à 150 tour/min jusqu’à une turbidité à λ=600nm de A=0,6. Le mélange est conservé 10 minutes dans la glace (4°C) afin de bloquer la croissance bactérienne. Après centrifugation à 4000 rpm pendant 10 minutes à 4°C, le surnageant est éliminé et le culot bactérien est resuspendu dans 60mL de CaCl2 (50mM) afin de
perméabiliser les membranes bactériennes. Le mélange est maintenu pendant 10 minutes dans la glace avant d’être centrifugé à 4000 rpm pendant 10 minutes à 4°C. Le culot bactérien est resuspendu dans 6mL de CaCl2 (50mM) et laissé toute la nuit dans la glace à 4°C. La suspension
bactérienne est diluée deux fois dans du glycérol 30% (v/v), aliquotée et conservée à -80°C.
3.4.6.3. Transformation des bactéries compétentes et sélection ‘blanc/bleu’ de colonies bacteriennes
80µL d’une suspension de bactéries compétentes d’Escherichia coli GT 869 sont transformées par choc thermique avec la totalité de la réaction de ligation selon le protocole suivant :
- 5 minutes dans la glace (4°C) - 5 minutes à 37°C
- 1 minute dans la glace (4°C)
Les bactéries sont ensuite mises en culture dans 400µL de milieu LB et incubées sous agitation douce (100 rpm) pendant 20 minutes à 37°C. Après centrifugation et élimination de 300µL de surnageant, les 100µL de bactéries restantes sont étalés sur un milieu LB solide contenant de la carbénicilline (1µL/mL), de l’Isopropyl β-D-1-ThioGalactopyranoside (IPTG ;0,25µL/mL) et du 5-bromo-4-chloro-3-indolyl-beta-D-galactopyranoside (X-Gal ; 1µL/mL).
Après 16 heures d’incubation à 37°C, trois clones bactériens blancs sont prélevés et suspendus dans 20µL d’eau distillée. Cinq microlitres sont utilisés pour effectuer une réaction de PCR sur clone afin de vérifier la présence de l’insert. Deux clones bactériens positif sur les trois testés sont