Exploiter la diversité génétique des cultivars de tomates
pour mieux comprendre les voies métaboliques des
composés volatils
Mémoire
Sébastien Isabelle
Maîtrise en biologie végétale - avec mémoire
Maître ès sciences (M. Sc.)
Exploiter la diversité génétique des cultivars de tomates
pour mieux comprendre les voies métaboliques des
composés volatils
Mémoire
Sébastien Isabelle
Sous la direction de :
Résumé
La tomate (Solanum lycopersicum) est largement appréciée par les consommateurs. La flaveur distinctive des tomates provient des interactions entre les acides, les sucres et un mélange complexe de composés volatils. Ces substances volatiles sont principalement dérivées de nutriments tels que les caroténoïdes, les acides gras et les acides aminés. Bien que la tomate soit considérée comme un modèle pour le développement des fruits, la plupart des voies métaboliques menant à la synthèse de volatils ne sont pas encore bien comprises. Afin de mieux interpréter les sentiers métaboliques, nous avons quantifié une centaine de composés volatils dans 254 accessions de tomates ancestrales, modernes et sauvages. Nous avons sélectionné 64 de ces cultivars en fonction de leur profil aromatique et réalisé une étude transcriptomique. Nous avons utilisé un modèle de régression linéaire et une étude d’association pangénomique pour évaluer la relation entre les composés volatils et l’expression génique afin de mieux comprendre la régulation génétique des diverses voies métaboliques.
L’analyse de la population a démontré que le profil en composés volatils varie considérablement entre les divers cultivars de tomates. Les composés volatils à l’intérieur d’un même sentier métabolique sont par contre fortement corrélés entre eux. La force de ces corrélations diffère considérablement, indiquant la présence d’étapes limitantes. De fortes corrélations entre des composés volatils non apparentés indiquent également des liens possibles entre différentes voies de biosynthèse. L’émission différentielle de plusieurs volatils dans la population de cultivars de tomates corrèle fortement avec l’expression des gènes caractérisés et d’autres gènes candidats. L’étude d’association pangénomique a permis de cibler de courtes régions chromosomiques associées à l’émission de certains groupes de composés volatils dans le fruit. Nos résultats démontrent le potentiel de ces différentes approches pour mieux comprendre les voies métaboliques de biosynthèse des composés volatils et découvrir de nouveaux gènes candidats.
Abstract
Tomato (Solanum lycopersicum) is widely appreciated by consumers. The distinctive flavor of tomatoes comes from the interactions between acids, sugars and a complex mixture of volatile compounds. These volatiles are mainly derived from nutrients such as carotenoids, fatty acids and amino acids. Although tomato is considered a model for fruit development, most of the metabolic pathways leading to volatiles synthesis are not yet fully understood. In order to better understand these metabolic pathways, we quantified about 100 volatile compounds in 254 accessions of heirloom, modern and wild tomatoes. We selected 64 tomatoes cultivars based on their aroma profile and performed a transcriptomic analysis. We used a linear regression model and a genome-wide association study to evaluate the relationship between volatile compounds and gene expression, in an effort to better understand the genetic regulation of the various metabolic pathways.
The volatiles profile varied considerably among tomatoes cultivars. Volatile compounds within the same metabolic pathway were strongly correlated with each other. On the other hand, the strength of these correlations differed considerably, indicating the presence of limiting steps. Strong correlations between unrelated volatile compounds also indicate possible links between different biosynthetic pathways. The differential emission of several volatiles in the tomato cultivar population strongly correlates with the expression of characterized genes and other candidate genes. A genome-wide association study was used to target short chromosomal regions associated with the emission of certain groups of volatiles in the fruits. Our results demonstrate the potential of these different approaches to better understand the metabolic pathways leading to the biosynthesis of volatile compounds and to uncover new candidate genes.
Table des matières
Résumé ... ii
Abstract ... iii
Table des matières ... iv
Liste des figures ... vi
Liste des tableaux ... ix
Liste des abréviations et de sigles ... xii
Remerciements ... xiv
Introduction ... 1
Chapitre 1: Revue littéraire ... 2
1.1 Les effets de la domestication sur la tomate ... 2
1.2 Le développement de nouveaux cultivars ... 4
1.3 La flaveur ... 6
1.4 Les composés volatils ... 9
1.4.1 Le sentier métabolique des caroténoïdes ... 11
1.4.2 Le sentier métabolique des acides gras ... 16
1.4.3 Le sentier métabolique des acides aminés ... 18
1.4.4 La biosynthèse des esters volatils ... 22
1.5 Une nouvelle vision ... 24
Chapitre 2: Matériels et méthodes ... 27
2.1 Quantification et identification des composés volatils ... 27
2.2 Préparation des librairies d’ARN ... 27
2.3 RNA-Seq data ... 28
2.4 Analyse pondérée des réseaux de corrélation ... 30
2.5 Étude d’association pangénomique ... 31
Chapitre 3: Résultats ... 33
3.1 Profil aromatique d’une population de cultivars de tomate ... 33
3.1.1 Les composés volatils dérivés d’acides gras ... 33
3.1.2 Les composés volatils dérivés des acides aminés ... 35
3.1.3 Les composés volatils dérivés des caroténoïdes ... 40
3.1.4 Les composés volatils dérivés des esters ... 42
3.2.1 Les composés volatils dérivés des acides gras ... 45
3.2.2 Les composés volatils dérivés des caroténoïdes ... 49
3.2.3 Le sentier des acides gras influence le contenu en apocaroténoïdes ... 50
3.2.4 Les composés volatils dérivés des acides aminés ... 51
3.2.5 Les esters ... 55
3.3 Corrélation de l’expression génique et émission de volatils ... 57
3.3.1 Les voies métaboliques des acides gras ... 58
3.3.2 Les voies métaboliques des caroténoïdes ... 62
3.3.3 Les voies métaboliques des acides aminés ... 67
3.3.4 Les esters ... 73
3.4 Identification de gènes candidats ... 76
3.4.1 Découverte de nouveaux gènes candidats à l’aide de corrélations ... 77
3.4.2 Étude d’association pangénomique ... 97
Chapitre 4: Discussion ... 114
4.1 La voie métabolique des acides gras ... 115
4.2 La voie métabolique des apocaroténoïdes ... 119
4.3 Les voies métaboliques des acides aminés ... 123
4.4 Les esters ... 128
Conclusion ... 130
Bibliographie ... 132
Annexe A - Cultivars de tomates séquencés dans le cadre de l’étude ... 143
Annexe B – Codes scripts pour les alignements de séquences ... 145
Annexe C – Codes scripts pour l’analyse GWAS ... 146
Annexe D – Corrélations de Pearson / Résultats supplémentaires ... 149
Liste des figures
Figure 1. Catégories de formes et tailles de tomate. Tiré de Rodriguez et al. (2011) ... 3
Figure 2. Modèle d’évolution de la variation des formes de la tomate. Tiré de Rodriguez et al. (2011) ... 4
Figure 3. Variations moyennes des produits chimiques associés à la flaveur dans les variétés de tomates modernes. ... 9
Figure 4. Les diverses fonctions de protection des composés volatils contre les stress biotiques et abiotiques et leurs chemins de signalisation dans la plante et le milieu environnant. ... 10
Figure 5. Le sentier métabolique des caroténoïdes et l’effet des mutations r, t, et og sur la couleur du fruit. ... 12
Figure 6. Effet de la mutation Psy-1 sur la pigmentation des fruits. ... 12
Figure 7. Effet d’une mutation ‘CRTISO’ sur la pigmentation des fruits. ... 14
Figure 8. Une partie des caroténoïdes potentiellement clivés par les enzymes CCD1s pour former des apocaroténoïdes. ... 15
Figure 9. Effet de l’allèle B sur la pigmentation des fruits. ... 16
Figure 10. Voie métabolique de composés volatils dérivés de l’acide linoléique dans le fruit de tomate. ... 17
Figure 11. Voies de synthèse des produits de dégradation de l’acide linolénique dans le fruit de tomate. ... 18
Figure 12. Sentier métabolique des volatils dérivés d’acides aminés à chaîne courte dans la tomate. ... 20
Figure 13. Les diverses étapes du sentier métabolique proposée pour la biosynthèse de l’eugénol et de l’isoeugénol. ... 20
Figure 14. Voies métaboliques proposées pour la production de volatils dérivés des acides aminés à chaîne ramifiée. ... 21
Figure 15. Catabolisme des esters d’acétate en alcool et en acide acétique dans la tomate par l’action de l’enzyme CXE1. ... 23
Figure 16. Balance d’esters et d’alcools chez S. pennellii et S. lycopersicum. ... 24
Figure 17. Programme de sélection génétique assistée par le consommateur. ... 25
Figure 18. Logiciels utilisés pour notre protocole d’analyse génomique. ... 30
Figure 19. Répartition des composés volatils dérivés des acides gras en fonction du nombre de carbones de la molécule. ... 33
Figure 20. Proportion de l'émission différentielle de composés volatils dérivés des acides aminés dans la population. ... 36
Figure 21. Émission différentielle de 1-nitro-3-methyl butane pour chaque lignée de tomate dans la population des 254 cultivars considérés. ... 39
Figure 22. Émission différentielle d’eugenol pour chaque lignée de tomate dans la population des 254 cultivars considérés.. ... 40
Figure 23. Émission différentielle de géranylacétone pour chaque lignée de tomate dans la population des 254 cultivars considérés. ... 42
Figure 24. Émission différentielle de 2-methylbutyl acétate pour chaque lignée de tomate dans la population de 254 cultivars considérés... 43
Figure 25. Proportion de l'émission différentielle de composés volatils dérivés des acides aminés dans la population ... 44 Figure 26. Sommaire de la voie métabolique des acides gras conduisant à la biosynthèse de volatils associés aux arômes. ... 46 Figure 27. Sommaire de la voie métabolique des caroténoïdes conduisant à la biosynthèse de volatils associés aux arômes. ... 50 Figure 28. Sommaire de la voie des phénylpropanoïdes conduisant à la biosynthèse de volatils associés aux arômes. ... 52 Figure 29. Voie de biosynthèse proposée pour les composés volatils dérivés de l’isoleucine. 54 Figure 30. Voie de biosynthèse proposée pour les composés volatils dérivés de la leucine. 55 Figure 31. Sommaire des voies métaboliques réversibles des esters et alcools volatils aromatiques. ... 56 Figure 32. Expression différentielle de l’enzyme ADH2 pour chaque lignée de tomate séquencée. 59 Figure 33. Émission différentielle de composés volatils dérivés des acides gras dans des lignées de tomates transgéniques montrant une perte de fonction pour l’enzyme LoxC. ... 60 Figure 34. Influence de l’expression de LoxC sur l’émission relative en (Z)-3-hexenal dans deux sous-groupes de cultivars de tomates séquencées. ... 62 Figure 35. Émission relative différentielle d’apocaroténoïdes dans deux sous-groupes de cultivars de tomates séquencées. ... 65 Figure 36. Émission relative différentielle d’apocaroténoïdes dans les sous-groupes de cultivars de tomates séquencées. ... 66 Figure 37. Effet des mutations r et ry sur le contenu en volatils de trois sous-groupes de cultivars de tomates. ... 67 Figure 38. Expression différentielle d’AADC1b pour chaque lignée de tomate séquencée. ... 69 Figure 39. Émission différentielle de composés volatils dérivés des acides gras chez des lignées de tomates mutantes possédant une perte de fonction de l’enzyme CTOMT1. ... 70 Figure 40. Niveaux d’émission relatifs d’esters volatils en fonction de l’expression de CXE1 dans deux sous-groupes de cultivars de tomates. ... 75 Figure 41. Expression différentielle d’AAT1 dans deux sous-groupes de cultivars de tomates séquencés. ... 75 Figure 42. Ratios différentiels de la CXE1 sur l’AAT1 dans deux sous-groupes de cultivars de tomates séquencés. ... 76 Figure 43. Manhattan plot des chromosomes 1-12 dans l’étude d’association pangénomique du penten-3-ol. ... 97 Figure 44. Manhattan plot des chromosomes 1-12 dans l’étude d’association pangénomique du penten-3-one. ... 98 Figure 45. Manhattan plot des chromosomes 1-12 dans l’étude d’association pangénomique du pentanal. ... 98 Figure 46. Manhattan plot des chromosomes 1-12 dans l’étude d’association pangénomique du pentanol. ... 99 Figure 47. Manhattan plot des chromosomes 1-12 dans l’étude d’association pangénomique du (E)-2-pentenal. ... 99 Figure 48. Manhattan plot des chromosomes 1-12 dans l’étude d’association pangénomique du (Z)-3-hexenal. ... 100
Figure 49. Manhattan plot des chromosomes 1-12 dans l’étude d’association pangénomique de l’heptanal. ... 101 Figure 50. Manhattan plot des chromosomes 1-12 dans l’étude d’association pangénomique du (E)-2-octenal. ... 101 Figure 51. Manhattan plot des chromosomes 1-12 dans l’étude d’association pangénomique de l’octanal. ... 102 Figure 52. Manhattan plot des chromosomes 1-12 dans l’étude d’association pangénomique du 6-methyl-5-hepten-2-one. ... 102 Figure 53. Manhattan plot des chromosomes 1-12 dans l’étude d’association pangénomique du géranylacétone. ... 103 Figure 54. Manhattan plot des chromosomes 1-12 dans l’étude d’association pangénomique de β-ionone. ... 103 Figure 55. Manhattan plot des chromosomes 1-12 dans l’étude d’association pangénomique de β-cyclocitral. ... 104 Figure 56. Manhattan plot des chromosomes 1-12 dans l’étude d’association pangénomique du α-citral. ... 104 Figure 57. Manhattan plot des chromosomes 12 dans l’étude d’association pangénomique du 1-nitro-2-phenylethane. ... 105 Figure 58. Manhattan plot des chromosomes 1-12 dans l’étude d’association pangénomique du phenylacetaldehyde. ... 106 Figure 59. Manhattan plot des chromosomes 1-12 dans l’étude d’association pangénomique du benzyl cyanide. ... 106 Figure 60. Manhattan plot des chromosomes 1-12 dans l’étude d’association pangénomique du 2-methylbuteraldehyde. ... 107 Figure 61. Manhattan plot des chromosomes 1-12 dans l’étude d’association pangénomique du 2-methyl-1-butanol. ... 107 Figure 62. Manhattan plot des chromosomes 1-12 dans l’étude d’association pangénomique du 2-methyl-2-butenal. ... 108 Figure 63. Manhattan plot des chromosomes 1-12 dans l’étude d’association pangénomique de l’isovaleraldehyde. ... 108 Figure 64. Manhattan plot des chromosomes 1-12 dans l’étude d’association pangénomique du 3-methyl-1-butanol. ... 109 Figure 65. Manhattan plot des chromosomes 1-12 dans l’étude d’association pangénomique du 3-methylbutanal oxime. ... 109 Figure 66. Manhattan plot des chromosomes 12 dans l’étude d’association pangénomique du 1-nitro-3-methyl butane. ... 110 Figure 67. Manhattan plot des chromosomes 1-12 dans l’étude d’association pangénomique de l’isovaleronitrile. ... 110 Figure 68. Manhattan plot des chromosomes 1-12 dans l’étude d’association pangénomique du 2-isobutylthiazole. ... 111 Figure 69. Manhattan plot des chromosomes 1-12 dans l’étude d’association pangénomique du n-propylacetate. ... 111 Figure 70. Manhattan plot des chromosomes 1-12 dans l’étude d’association pangénomique du (Z)-3-hexenyl acetate. ... 112
Liste des tableaux
Tableau 1. Comparaison des différentes espèces du clade Lycopersicon. ... 2 Tableau 2. Composés volatils présents dans la tomate fraîche à plus de 1nL/L, leur seuil odorant dans l’eau et leur ordre concentration... 8 Tableau 3. Composés volatils générés par le clivage positionnel des doubles liens de caroténoïdes par les enzymes CCD1s dans le fruit. ... 13 Tableau 4. Acides aminés précurseurs de composés volatils dans les diverses voies métaboliques des acides aminés. ... 19 Tableau 5. Contenu en acides aminés au cours des divers stades de développement de la tomate. . 22 Tableau 6. Liste des différentes enzymes caractérisées dans les sentiers métaboliques menant à la biosynthèse des composés volatils dans la tomate, et leur positionnement sur le génome de
référence de la tomate. ... 26 Tableau 7. Taux de variation des volatils dérivés d’acides gras dans la population des cultivars de tomate considérés. ... 34 Tableau 8. Taux de variation des volatils dérivés d’acides aminés dans la population des cultivars de tomate considérés.. ... 37 Tableau 9. Taux de variation des apocaroténoïdes dans la population des cultivars de tomate considérés. ... 41 Tableau 10. Taux de variation des esters volatils dans la population ded cultivars de tomate
considérés. ... 43 Tableau 11. Coefficients de corrélation de Pearson entre les divers acides gras volatils détectés ... 48 Tableau 12. Coefficients de corrélation entre certains composés volatils dérivés des acides gras et les apocaroténoïdes ... 51 Tableau 13. Coefficients de corrélation de Pearson entre divers volatils dérivés des acides aminés53 Tableau 14. Coefficients de corrélation de Pearson entre divers esters volatils ... 57 Tableau 15. Expression différentielle des gènes caractérisés du sentier métaboliques des volatils dérivés des acides gras chez les cultivars de tomates séquencés ... 58 Tableau 16. Coefficients de corrélation de Pearson entre l’émission relative de volatils dérivés des acides gras et de l’expression des gènes caractérisés (TPM) dans le sentier métabolique
correspondant. ... 61 Tableau 17. Expression différentielle des gènes caractérisés du sentier métabolique des
apocaroténoïdes volatils chez les cultivars de tomates séquencés... 63 Tableau 18. Coefficients de corrélation de Pearson entre l’émission relative d’apocaroténoïdes volatils et de l’expression des gènes potentiellement impliqués (TPM) dans le sentier métabolique considéré. ... 64 Tableau 19. Expression différentielle des gènes caractérisés du sentier métaboliques de la
phénylalanine chez les cultivars de tomates séquencés. ... 68 Tableau 20. Coefficients de corrélation de Pearson entre l’émission relative des composés volatils et de l’expression des gènes caractérisés (TPM) dans le sentier métabolique ... 69
Tableau 21. Coefficients de corrélation de Pearson entre l’émission relative d’acides aminés volatils et de l’expression des gènes caractérisés (TPM) dans le sentier métabolique correspondant. ... 70 Tableau 22. Émission différentielle de methylsalicylate chez des lignées de tomates possédant une enzyme SAMT non fonctionnelle et des lignées témoins (ng/g*pf/h) ... 71 Tableau 23. Expression différentielle des gènes potentiellement impliqués dans la synthèse de l’isoleucine et de la leucine dans le sentier métabolique des acides aminés volatils chez les cultivars de tomates séquencés ... 71 Tableau 24. Coefficients de corrélation de Pearson entre l’émission relative d’acides aminés volatils et l’expression des gènes caractérisés (TPM) dans le sentier métabolique correspondant. .. 72 Tableau 25. Coefficients de corrélation de Pearson entre l’émission relative d’acides aminés volatils et l’expression des gènes potentiels (TPM) dans le sentier métabolique correspondant... 73 Tableau 26. Expression différentielle des gènes caractérisés du sentier métaboliques des esters volatils chez les cultivars de tomates séquencés ... 73 Tableau 27. Coefficients de corrélation de Pearson entre l’émission relative d’alcools et d’esters volatils et de l’expression des gènes caractérisés (TPM) dans le sentier métabolique considéré. ... 74 Tableau 28. Coefficients de corrélation de Pearson entre l’émission relative du penten-3-ol et l’expression moyenne des gènes candidats dans la population. ... 80 Tableau 29. Coefficients de corrélation de Pearson entre l’émission relative du penten-3-one et l’expression moyenne des gènes candidats dans la population. ... 80 Tableau 30. Coefficients de corrélation de Pearson entre l’émission relative du pentanal et
l’expression moyenne des gènes candidats dans la population. ... 81 Tableau 31. Coefficients de corrélation de Pearson entre l’émission relative du pentanol et
l’expression moyenne des gènes candidats dans la population. ... 81 Tableau 32. Coefficients de corrélation de Pearson entre l’émission relative du (E)-2-pentenal et l’expression moyenne des gènes candidats dans la population. ... 82 Tableau 33. Coefficients de corrélation de Pearson entre l’émission relative du (Z)-3-hexenal et l’expression moyenne des gènes candidats dans la population. ... 82 Tableau 34. Coefficients de corrélation de Pearson entre l’émission relative de l’heptanal et
l’expression moyenne des gènes candidats dans la population. ... 83 Tableau 35. Coefficients de corrélation de Pearson entre l’émission relative du (E)-2-octenal et l’expression moyenne des gènes candidats dans la population. ... 83 Tableau 36. Coefficients de corrélation de Pearson entre l’émission relative de l’octanal et
l’expression moyenne des gènes candidats dans la population. ... 84 Tableau 37. Coefficients de corrélation de Pearson entre l’émission relative du 6-methyl-5-hepten-2-one et l’expression moyenne des gènes candidats dans la population. ... 85 Tableau 38. Coefficients de corrélation de Pearson entre l’émission relative du géranylacétone et l’expression moyenne des gènes candidats dans la population. ... 85 Tableau 39. Coefficients de corrélation de Pearson entre l’émission relative du β-ionone et
l’expression moyenne des gènes candidats dans la population. ... 86 Tableau 40. Coefficients de corrélation de Pearson entre l’émission relative du β-cyclocitral et l’expression moyenne des gènes candidats dans la population. ... 86 Tableau 41. Coefficients de corrélation de Pearson entre l’émission relative du α-citral et
Tableau 42. Coefficient de corrélation de Pearson entre l’émission relative du
1-nitro-2-phenylethane et l’expression moyenne des gènes candidats dans la population ... 89 Tableau 43. Coefficients de corrélation de Pearson entre l’émission relative du phenylacetaldehyde et l’expression moyenne des gènes candidats dans la population. ... 90 Tableau 44. Coefficients de corrélation de Pearson entre l’émission relative du benzyl cyanide et l’expression moyenne des gènes candidats dans la population. ... 90 Tableau 45. Coefficients de corrélation de Pearson entre l’émission relative du
2-methylbuteraldehyde et l’expression moyenne des gènes candidats dans la population. ... 91 Tableau 46. Coefficients de corrélation de Pearson entre l’émission relative du 2-methyl-1-butanol et l’expression moyenne des gènes candidats dans la population. ... 91 Tableau 47. Coefficients de corrélation de Pearson entre l’émission relative du 2-methyl-2-butenal et l’expression moyenne des gènes candidats dans la population. ... 92 Tableau 48. Coefficients de corrélation de Pearson entre l’émission relative de l’isovaleraldehyde et l’expression moyenne des gènes candidats dans la population. ... 92 Tableau 49. Coefficients de corrélation de Pearson entre l’émission relative du 3-methyl-1-butanol et l’expression moyenne des gènes candidats dans la population. ... 93 Tableau 50. Coefficients de corrélation de Pearson entre l’émission relative du 3-methylbutanal oxime et l’expression moyenne des gènes candidats dans la population. ... 93 Tableau 51. Coefficients de corrélation de Pearson entre l’émission relative du 1-nitro-3-methyl butane et l’expression moyenne des gènes candidats dans la population. ... 94 Tableau 52. Coefficients de corrélation de Pearson entre l’émission relative de l’isovaleronitrile et l’expression moyenne des gènes candidats dans la population. ... 94 Tableau 53. Coefficients de corrélation de Pearson entre l’émission relative du 2-isobutyllthiazole et l’expression moyenne des gènes candidats dans la population. ... 95 Tableau 54. Coefficients de corrélation de Pearson entre l’émission relative du n-propylacetate et l’expression moyenne des gènes candidats dans la population. ... 96 Tableau 55. Coefficients de corrélation de Pearson entre l’émission relative du (Z)-3-hexenyl acetate et l’expression moyenne des gènes candidats dans la population. ... 96 Tableau 56. Probabilité d’obtenir la même valeur ou une valeur encore plus extrême que celle observée pour le SNP associé à l’émission de composés volatils dérivés de la phénylalanine dans la tomate ... 105
Liste des abréviations et de sigles
AADC1a Acide aminé décarboxylase 1a AADC1a Acide aminé décarboxylase 1b AATr Amino acid transporter AAT1 Alcool acyltranférase 1 Acyl-CoA Acyle-coenzyme A ADH2 Alcool déshydrogénase 2 AlDH Aldehyde dehydrogenase ARF10b Auxin response factor 10B
AtAAP6 Arabidopsis thaliana Amino acid permease 6 AtARF6 Arabidopsis thaliana Auxin response factor 6
Bam Alignement de séquence sur carte en fichier binarisé BCAA Acide aminé à chaîne ramifiée
BCAT Aminotransférase à chaîne ramifiée BCAT1 Aminotransférase à chaîne ramifiée 1 BCAT3 Aminotransférase à chaîne ramifiée 3 BCKA Cétoacide à chaîne ramifiée
βLYC Lycopène cyclase
CCD1a Carotenoid cleavage dioxygenase 1a CCD1b Carotenoid cleavage dioxygenase 1b CRTISO Caroténoïde isomérase
CTOMT1 Catéchol O-méthyltransférase CXE1 Carboxylestérase 1
Del Delta
DHAD Dihydroxyacid dehydratase DMAPP Diméthylallyl diphosphate EGS1 Eugénol synthase 1
ErTF Ethylene-responsive transcription factor εLYC Lycopène ε-cyclase
FAD7 Fatty acid desaturase 7
FAS Fasciated
FDR Taux de découverte erronée
FPKM Fragments par kilobase par million de reads GC Chromatographe en phase gazeuse
GC/MS Chromatographe en phase gazeuse couplée à un spectromètre de masse GDSLel GDSL esterase/lipase
GGPP Géranylgéranyl diphosphate
GWAS Études d’associations pangénomiques HPL Hydroperoxyde lyase
IαTIH Inter-alpha-trypsin inhibitor heavy chain-like protein IGS1 Isoeugénol synthase 1
IGV Intégrateur de génome visuel IL Lignée d’introgression IPMD Isopropylmalate déshydratase
IPP Isopentényle
KARI Ketolacid reductoisomerase
LC Locule number
LOX Lypoxygénase
LoxC Lypoxygénase C MeSA Méthyle salicylate MHO 6-methyl-5-hepten-2-one NIL Lignée quasi isogénique
OsCCD1 Oryza sativa Carotenoid cleavage dioxygenase 1 OsCCD4a Oryza sativa Carotenoid cleavage dioxygenase 4a OsCCD4b Oryza sativa Carotenoid cleavage dioxygenase 4b PAR1 Phénylacétaldehyde réductase 1
PAR2 Phénylacétaldehyde réductase 2 PAT Préphénate aminotransferase
Pb Paires de bases
PDE1α Pyruvate dehydrogenase E1 component subunit alpha PDS Phytoène désaturase
PE Paired end
PEPC Phosphoenolpyruvate carboxylase PP2c Protein phosphatase 2c
Psy-1 Phytoène synthase 1
QTL Locus de caractère quantitatif Rin Ripening-inhibitor
S-ACP-DES Acyl-acyl-carrier-protein desaturase Sam Alignement de séquence sur carte SAMT Salicylate O-méthyltransférase SlLIP1 Lipase 1
SNP Polymorphisme nucléotidique TPM Transcrits par million
WGCNA Analyse pondérée des réseaux de corrélation WRF Wound-responsive family protein
ZDS ζ-carotène desaturase 13-HPO Acide hydroperoxylinoléique 13-HPOT Acide hydroperoxylinolénique
Remerciements
Je remercie Charles Goulet, mon directeur de recherche, pour sa pensée rigoureuse, ses conseils judicieux et ses mots d’encouragement tout au long de ce projet. Je tiens aussi à remercier toutes les personnes qui ont contribué à la réalisation de ce projet.
Un merci particulier à Louis-Félix Nadeau et Isabelle Clermont, tous deux professionnels de recherche, pour avoir récolté les divers cultivars de tomates au fil des années. Merci à Blandine Bulot, étudiante à la maîtrise dans le laboratoire, pour son aide et ses conseils lors de la réalisation des librairies d’ARN et des analyses bio-informatiques subséquentes. Je tiens également à remercier les autres étudiants gradués du laboratoire, Roberto Carlos Montoya, Jérémie Chironzi et Sylvain Villot pour leur camaraderie et leur aide.
Un remerciement spécial à Gilbert Éthier et Steeve Pépin pour m’avoir offert ma première occasion de travail en biologie végétale et pour les précieux conseils au fil des années.
Introduction
Au Canada, la production de légumes frais totalisait près de 2,5 milliards de dollars en 2016. En excluant la pomme de terre, la tomate est le légume canadien ayant la plus grande valeur commerciale. Elle occupe le premier rang dans le secteur des légumes de serre, avec 40% des ventes, et le deuxième rang dans le secteur des légumes de champ, avec 10% des ventes. À elle seule, la production de tomate canadienne a généré des revenus de près de 650 millions de dollars en 2016 (Mukenzangango, 2017). Les tomates sont principalement cultivées pour la consommation fraîche et la transformation. La consommation de tomates sur une base régulière est associée à de saines habitudes de vie et réduit les risques de plusieurs types de cancer et maladies cardiovasculaires (Causse et al., 2003; Viuda-Martos et al., 2014). Les tomates produisent plusieurs métabolites secondaires bénéfiques pour la santé humaine. Elles sont une source importante de vitamines, de fibres, de minéraux et d’antioxydants (Bauchet et al., 2017b). La tomate est produite massivement à l’échelle mondiale et le fruit est très populaire auprès des consommateurs. La flaveur unique du fruit, un élément central de son succès, dérive d’un mélange complexe de métabolites secondaires, les composés volatils (Goulet et al., 2015). Bien que la tomate soit considérée comme un organisme modèle pour le développement des fruits, on connait encore très peu les gènes impliqués dans la biosynthèse des composés volatils (Klee, 2010; Goulet et al., 2012; Wang et al., 2016; Klee et Tieman, 2018). La découverte d’enzymes clés dans les différentes voies métaboliques favoriserait l’amélioration génétique des tomates afin de répondre adéquatement aux demandes grandissantes des consommateurs (Tieman et al., 2017).
Chapitre 1: Revue littéraire
1.1 Les effets de la domestication sur la tomate
La tomate (Solanum lycopersicum) fait partie de la famille des Solanacées, qui comprend plus de 3000 espèces incluant de nombreuses plantes ayant une grande importance économique comme les pommes de terre, les aubergines et les poivrons (Bergougnoux, 2013). Le clade de la tomate (Solanum section Lycopersicon) compte une dizaine d’espèces (Bauchet et al., 2017a) originaires de l’Amérique du Sud. Plus précisément, elles sont retrouvées le long de la côte ouest, dans les hautes Andes depuis le centre de l’Équateur, en passant par le Pérou jusqu’au nord du Chili et sur les îles Galápagos (Bergougnoux, 2013). L’hétérogénéité des climats dans lesquels ces espèces croissent est à l’origine de leurs différents caractères adaptatifs. À titre d’exemple, S. cheesmaniae qui pousse sur les rivages rocheux des îles Galapagos a développé une tolérance aux sels tandis que S. habrochaites, qui pousse en altitude, est tolérante aux températures froides (Tableau 1). La tomate est plus étroitement apparentée à S. galapagense, S. cheesmaniae et S. pimpinellifolium qui produisent des fruits colorés, à l’inverse des autres espèces du clade.
Tableau 1. Comparaison des différentes espèces du clade Lycopersicon, adapté de Paralta et al. (2005), Spooner et al. (2005) et Bergougnoux (2013).
Espèces Distribution et habitat Couleur Caractères intéressants
S. cheesmaniae Endémique des Îles Galápagos, Équateur; grande variété d’habitats; niveau de la mer à 500 m
Jaune, orange
Tolérance aux sels, résistance aux virus
S. galapagense Endémique des Îles Galápagos; lave côtières à moins de 1 m ligne de marée, parfois dans les terres, niveau de la mer à 50 m
Jaune, orange S. lycopersicum Échelle mondiale dans une variété d’habitats; niveau de la mer à 4000
m
Rouge Tolérance à l’humidité et
résistance aux moisissures S. pimpinellifolium Centre de l’Équateur au centre du Chili; habitats côtiers secs;
0-500 m et exceptionnellement 1400 m
Rouge Résistance aux insectes, nématodes
et maladies S. chilense Sud du Pérou au nord du Chili; plaines rocheuses très arides et
côtières, les déserts; niveau de la mer à 3250 m
Vert, mauve strié
Tolérance à la sécheresse S. chmielewskii Sud du Pérou au nord de la Bolivie; hautes vallées andines sèches;
1600-3200 m
Vert Haut contenu en sucre
S. habrochaites Centre de l’Équateur du centre du Pérou; versants ouest des Andes et divers types de forêts; 40-3300 m
Vert Tolérance au froid et au gel et
résistance aux insectes S. pennellii Nord du Pérou au nord du Chili; côtes rocheuses sèches et zones
sablonneuses; niveau de la mer à 2300 m
Vert Tolérance à la sécheresse et aux
insectes S. neorickii Sud de l’Équateur au sud du Pérou; vallées inter-andines sèches; rives
et rives rocheuses; 920-2600 m
Vert pâle S. peruvianum
var. hirsutum
Nord du Pérou; vallées côtières et intérieures des Andes; Iomas, vallées et pentes sèches; 100-2800 m
Vert Résistance aux virus, bactéries,
La domestication de la tomate a débuté il y a environ 10 000 ans, au Pérou ou au Mexique (Bergougnoux, 2013). La grande abondance de tomates cerises sauvages en Amérique centrale suggère que S. lycopersicum var. cerasiforme est l’ancêtre le plus probable des tomates cultivées. La tomate a été importée en Europe au début du 16e siècle par les conquistadors. Sa domestication a
engendré des changements majeurs dans les caractères morphologiques et les caractéristiques agronomiques du fruit (Lin et al., 2014; Bai et Lindhout, 2007; Bauchet et al., 2017a).
Au fil des temps, divers cultivars de tomates ont été sélectionnés, entre autres, en fonction de la morphologie de leur fruit. La grande hétérogénéité de formes entre les cultivars résulte principalement d’un contrôle effectué par quatre gènes (Rodriguez et al., 2011). Les gènes SUN et OVATE sont responsables de la forme allongée des fruits alors que les gènes FASCIATED (FAS) et LOCULE NUMBER (LC) ont un impact sur le nombre de locules et la forme aplatie des fruits (Figure 1).
Figure 1. Catégories de formes et tailles de tomate. Tiré de Rodriguez et al. (2011)
Des mutations ou variations structurales dans ces gènes sont à l’origine de l’importante variation observée chez les cultivars de tomate. Les mutations FAS, OVATE et LC sont possiblement apparues lors de la domestication effectuée par les populations latino-américaines (Figure 2). La mutation SUN serait plus récente et daterait de la sélection en Europe survenue dans les derniers siècles (Rodriguez et al., 2011). La domestication de la culture réalisée par les cultivateurs locaux
américains et européens a créé un goulot d’étranglement qui a progressivement réduit la diversité génétique des plantes cultivées relativement à leurs ancêtres sauvages (Bauchet et al., 2017a).
Figure 2. Modèle d’évolution de la variation des formes de la tomate. Tiré de Rodriguez et al. (2011)
1.2 Le développement de nouveaux cultivars
Au début du 20e siècle, plusieurs établissements publics, principalement aux États-Unis, ont affiché
un intérêt accru pour le développement de nouveaux cultivars de tomate alors qu’au même moment, de nouvelles compagnies privées axées sur le développement de cultivars commerciaux voyaient le jour (Bai et Lindhout, 2007). Ce mouvement s’est accéléré au milieu du siècle et se poursuit encore à ce jour (Bai et Lindhout, 2007). Les sélectionneurs ont cherché, par exemple, à développer de nouvelles lignées de tomates possédant des gènes de résistances aux maladies. Une des sources de résistance utilisée a été celle des espèces de tomates sauvages (Tableau 1), dont plusieurs possèdent des gènes de résistance aux maladies (Bauchet et al., 2017). L’introduction de ces gènes dans les nouveaux cultivars de tomates a été réalisée, en partie, à l’aide de collections de lignées d’introgression (ILs). Les ILs ont été produites en introduisant de courts segments chromosomiques d’une espèce sauvage comme S. lycopersicoides ou S. pimpinellifolium en les croisant avec la tomate (Canady et Chetelat, 2005). Après quelques générations de rétrocroisements pour limiter la
présence du matériel génétique des espèces sauvages, les lignées pouvaient servir à introduire des caractères avantageux dans les nouveaux cultivars. Les chercheurs sont ainsi parvenus à introduire une dizaine de gènes de résistance aux maladies dans les cultivars de tomates modernes (Bauchet et al., 2017a). Cette méthode bien que fonctionnelle, et repose en partie sur la chance et prend toutefois du temps.
Au cours des dernières décennies, la forte diminution des coûts de séquençage de l’ADN et de l’ARN a permis le développement de nouveaux outils qui facilitent grandement la localisation de gènes d’intérêt tels que les gènes de résistance aux maladies (Klee et Tieman, 2018). L’application des outils de la génomique facilite ainsi le développement de nouveaux cultivars répondant mieux aux contraintes du marché. Pour la tomate, la tâche est grandement facilitée par le fait que le génome, avec ses quelques 35 000 gènes, est bien annoté (The Tomato Genome Consortium, 2012). Il est donc possible d’utiliser à leur plein potentiel les nouvelles technologies de séquençage à haut débit. Par exemple, les études de transcriptomiques sont très utiles pour faire l’analyse de la transcription de l’ADN en ARNm à un moment donné (Shinozaki et al., 2018). Un autre type d’étude commune faisant appel aux outils de séquençage est l’étude d’associations pangénomiques (GWAS). Dans ce cas, la recherche de gènes d’intérêt est réalisée en corrélant un caractère qualitatif ou quantitatif à des variations génétiques observées dans une population donnée, par exemple des cultivars de tomate. Les variations génétiques principalement observées sont des polymorphismes nucléotidiques (SNP), des insertions/délétions ou des réarrangements chromosomiques. Les altérations de séquence génétique identifiées permettent alors d’établir des liens entre des locations chromosomales et un caractère déterminé (Korte et Farlow, 2013).
L’utilisation de ces nouvelles technologies a grandement favorisé les percées réalisées durant les dernières décennies. L’exploration de la diversité génétique a rendu possible le développement de nouveaux cultivars de tomates qui possèdent maintenant un large éventail de caractéristiques agronomiques intéressantes. Parmi celles-ci, notons l’adaptation aux stress biotiques et abiotiques, l’adaptation aux conditions de culture en serre, l’augmentation de la quantité de fruits produits, la facilité des récoltes et l’apparence des fruits (Causse et al., 2003; Tieman et al., 2017; Klee et Tieman, 2018). Les cultivars de tomates doivent aussi être suffisamment fermes pour supporter les manipulations qui surviennent lors de la récolte, du transport et de l’entreposage (Klee, 2010).
La sélection d’allèles favorables pour certains caractères peut parfois avoir des conséquences inattendues et négatives sur d’autres caractères. Les contrecoups sont souvent observés
subséquemment alors engendrant de nouveaux défis. Par exemple, les cultivars de tomates sauvages mûrissent de l’extrémité de la fleur vers l’extrémité de la tige et possèdent une épaule verte (Powell et al., 2012). Le tissu entourant le pédicelle est vert foncé et a tendance à mûrir très lentement. Puisque l’apparence visuelle des tomates est un facteur déterminant pour les consommateurs (Oltman et al, 2014), les sélectionneurs ont misé, il y a plusieurs décennies, sur une mutation qui inactive le facteur de transcription uniform (U). Cette mutation récessive réduit de manière significative la taille de l’épaule verte, ce qui permet un mûrissement plus uniforme des fruits (Powell et al., 2012). Ce choix d’allèle est donc avantageux pour les producteurs de tomates qui doivent répondre aux attentes des consommateurs avec de belles tomates parfaites.Compte tenu de cet avantage, tous les cultivars de tomates modernes possèdent la mutation uniform. Cependant, la mutation du facteur de transcription U a aussi un effet négatif dans le fruit. En particulier, le facteur de transcription golden 2-like (U) favorise normalement l’accumulation de la chlorophylle et des chloroplastes dans le fruit. Les chloroplastes convertissent le dioxyde de carbone, à l’aide de l’énergie lumineuse, en sucres. Conséquemment, la perte de fonction du facteur de transcription golden-2-like va causer une réduction de la teneur en sucre chez les tomates mutantes. Bien que la mutation rende les cultivars de tomate moderne beaucoup plus attrayants visuellement, elle a un effet négatif sur leur flaveur (Klee et Tieman, 2018).
1.3 La flaveur
La flaveur est l’ensemble des sensations gustatives, tactiles et olfactives perçues par le cerveau lors de la consommation d’aliments. Il chez l’humain existe cinq classes de récepteurs au niveau des papilles gustatives, qui évaluent la proportion de salé, de sucré, d’acidité, d’amertume et d’umami dans la nourriture (Goff et Klee, 2006). Les sensations tactiles, telles que la texture ou la sensation que laisse un aliment dans la bouche, sont perçues par les cellules épithéliales. Elles influencent de manière subjective l’évaluation de la flaveur (Klee, 2010). Enfin, les récepteurs olfactifs permettent de distinguer environ un trillion d’odeurs différentes (Klee et Tieman, 2018). Pour arriver à détecter autant d’odeurs, plus de 400 gènes codant pour des récepteurs olfactifs s’expriment au niveau de votre bulbe olfactif dans la cavité nasale. L’humain perçoit les odeurs par deux mécanismes distincts, soit l’ortho-olfaction et la rétro-olfaction. L’ortho-olfaction implique l’inspiration nasale des composés volatils contenus dans l’air ambiant tandis que la rétro-olfaction se manifeste lorsque les composés volatils, emprisonnés dans les aliments, sont libérés dans la bouche et dirigés vers la cavité nasale et l’épithélium olfactif (Shepherd, 2006). Le cortex cérébral assimile les sensations perçues par ces deux systèmes de manière différentielle. La rétro-olfaction est le facteur déterminant dans le discernement dans la flaveur (Shepherd, 2006). De plus, l’impact d’un produit
chimique sur la perception de la flaveur dépend à la fois de sa concentration et de son seuil de détection (Goff et Klee, 2006). Le discernement de la flaveur fait donc appel à plusieurs sens et dépend des caractéristiques biochimiques des aliments.
Chez la tomate, la flaveur résulte de la détection des acides organiques, des sucres et des composés volatils. Les deux acides les plus abondants dans le fruit sont l’acide malique et l’acide citrique et leur présence confère à la tomate un pH acide (~pH 4) (Klee et Giovannoni, 2011). Du côté des sucres, ce sont le fructose et le glucose qui sont les plus abondants. Les niveaux de sucres et d’acides peuvent par ailleurs fluctuer entre les cultivars de tomates avec une grande incidence sur la flaveur (Baldwin et al, 1991). Ce sont par contre les composés volatils qui donnent sa spécificité à la flaveur des tomates. L’accumulation de composés volatils débute avec le mûrissement du fruit et culmine, la plupart du temps, lorsque la tomate est mûre. La concentration en composés volatils diffère de manière considérable entre les divers cultivars de tomate (Baldwin et al., 2000; Goff et Klee, 2006). Ce sont plus de 400 composés volatils qui ont été identifiés dans le fruit (Ling et Buttery, 1993) mais seulement quelques dizaines d’entre eux influenceraient la perception globale de l’arôme (Klee, 2010; Wang et al., 2016). L’abondance d’un composé n’est pas le seul aspect qui influence la perception puisque le seuil de détection des divers volatils par l’humain varie grandement (Tableau 2). Un composé présent à très faible concentration peut ainsi être davantage détecté que le composé le plus abondant. Les composés volatils qui ont un impact sur la flaveur des tomates sont souvent reliés à des arômes singuliers. Par exemple, la β-ionone est associé à un arôme floral alors que le cis-3-hexenal est lié à un arôme de gazon Ainsi, certains ont un effet positif sur l’arôme du fruit alors que d’autres ont un effet négatif (Tieman et al., 2012). L’appréciation du fruit par les consommateurs dépend donc d’un mélange complexe de métabolites.
Tableau 2. Composés volatils présents dans la tomate fraîche à plus de 1nL/L, leur seuil odorant dans l’eau et leur ordre concentration. Adapté de Ling et Buttery, 1993 et Baldwin et al, 2000.
Composés volatils Concentration (nL x L-1)
Seuil de détection
(nL x L-1) Arôme caractéristique
(Z)-3-hexenal 12 000 0.25 Herbacé, gazon
β-ionone 4 0.007 Baie, floral
hexanal 3 100 4.5 Boisé, herbacé, gazon
penten-3-one 520 1 Végétal, gazon
3-methylbutanal 27 0.2 Cacao
(E)-2-hexenal 270 17 Boisé, feuillu, herbacé, gazon
2-isobutylthiazole 36 3.5 Cerise, végétal
1-nitro-2-phenylethane 17 2 Épicé, floral
(E)-2-heptenal 60 13 Gazon, pelure de pomme
phenylacetaldehyde 15 4 Cacao, miel, floral
6-methyl-5-hepten-2-one 130 50 Banane, pomme
(Z)-3-hexenol 150 70 Gazon, âcre
2-phenylethanol 1 900 1 000 Floral, miel, pain, rose
3-methylbutanol 380 250 Cognac, huile de fusel
methylsalicylate 48 40 Balsamique
géranylacétone 57 60 Floral, rose
1-nitro-3-methyl butane 59 150 Épicé
α-citral 12 32 Citron, lime
penten-3-ol 110 400 Végétal, gazon
(E)-2-pentenal 140 1 500 Gazon
hexanol 7 500 Boisé, gazon, herbacé
Souvent, les consommateurs sont insatisfaits de la flaveur des tomates modernes (Tieman et al., 2018). Pendant plusieurs décennies, la flaveur de la tomate a en effet été vue comme une caractéristique accessoire dans le développement d’un cultivar. Ce manque d’intérêt a découlé, d’une part, de la complexité technique d’une sélection axée sur l’arôme et, d’autre part, de l’importance des caractères agronomiques qui assurent le succès d’un cultivar auprès de producteurs agricoles rémunérés sur une base de quantité plutôt que sur une base de qualité (Goff et Klee, 2006). Ce processus de sélection a graduellement changé le profil aromatique des cultivars de tomate (Figure 3). Ainsi, certains composés volatils comme l’isovaleronitrile ont diminué de près de 60% alors que les composés gustatifs faciles à mesurer comme le sucre et les acides sont demeurés beaucoup plus stables.
Figure 3. Variations moyennes des produits chimiques associés à la flaveur dans les variétés de tomates modernes. Tiré de Tieman et al. (2018)
1.4 Les composés volatils
Les volatils sont des composés organiques importants produits par les plantes. Les propriétés physiochimiques de ces métabolites secondaires leurs permettent de traverser librement la membrane cellulaire afin d’être libérés dans l’environnement (Pichersky et al., 2006). Les composés volatils sont des liquides lipophiles possédant un faible poids moléculaire et une pression de vapeur élevée à température ambiante (Dudareva et al., 2012). Les volatils sont synthétisés de novo dans les tissus de la plante où l’émission a lieu. À chaque jour, c’est près du cinquième de tout le dioxyde de carbone fixé par les plantes terrestres qui est réémis sous forme de composés volatils dans l’air (Baldwin, 2010).
Les plantes produisent une vaste gamme de composés volatils afin d’interagir avec leur environnement ou en réponse à leur environnement. L’émission de composés volatils permet, entre autres, d’attirer des espèces bénéfiques de nématodes, de champignons, de bactéries sous-terraines et de pollinisateurs (Figure 4). Lorsque les plantes sont endommagées par une attaque microbienne ou un agent pathogène, elles émettent une grande quantité de composés volatils dans l’air ambiant. Les volatils produits peuvent avoir différentes fonctions. Certains ont des propriétés
antimicrobiennes alors que d’autres servent à guider les prédateurs ou parasites naturels des espèces envahissantes (Figure 4). La synthèse de composés volatils offre donc à la plante une protection contre les stress biotiques. Les plantes peuvent aussi émettre des composés volatils en réponse à des stress abiotiques. Ainsi, les isoprènes, des composés à cinq carbones, protègent les plantes contre la chaleur et le stress oxydatif (Baldwin, 2010). Les plantes produisent également un mélange complexe de composés volatils dans leurs fruits afin d’attirer les espèces frugivores et assurer la dispersion de leurs graines dans l’environnement.
Figure 4. Les diverses fonctions de protection des composés volatils contre les stress biotiques et abiotiques et leurs chemins de signalisation dans la plante et le milieu environnant. Tiré de Baldwin (2010)
Les composés volatils sont produits en grande quantité dans les fleurs, où l’émission est régulée par une horloge circadienne qui suivrait des modèles rythmiques (Paré, 1999; Pichersky et al., 2006). Les plantes produisent aussi un large éventail de composés volatils dans les cellules des tiges, des feuilles, des racines et des fruits. Là encore, la production de ces molécules est finement régulée tout comme le relâchement dans l’air ambiant. Dans la plante, les composés volatils peuvent être entreposés pour être relâchés ultérieurement (Pichersky et al., 2006). L’emmagasinement à long terme des composés volatils dans la vacuole a par contre lieu uniquement lorsque ceux-ci sont glycosylés par l’action de glycosyltransférases. L’UDP-glycosyltransférase 5 qui, par exemple, est capable de glycosyler le guaiacol, l’eugenol et le methyl salicylate dans le fruit (Louveau et al., 2011).
Parmi tous les organes de la plante, ce sont les fruits mûrs qui produisent la plus grande quantité et la plus grande variété de composés volatils (Dudareva et al., 2004). Cette accumulation débute généralement lors du murissement du fruit, qui signale la maturité des semences. Chez la tomate, le mûrissement s’accompagne d’une conversion des chloroplastes en chromoplastes. La chlorophylle et les structures photosynthétiques de la membrane du fruit sont dégradées et débute alors l’accumulation de caroténoïdes qui donnent leur couleur aux tomates (Klee et Giovannoni, 2011). Les caroténoïdes sont aussi précurseurs de bon nombre de composés volatils chez le fruit. Outre les caroténoïdes, les composés volatils de la tomate sont produits principalement à partir des acides gras et des acides aminés qui s’accumulent eux aussi durant le murissement du fruit. Les tomates mûres produisent donc davantage de composés volatils que les tomates qui débutent leur processus de murissement. L’accumulation des composés volatils est aussi corrélée avec le niveau de transcription des enzymes de synthèse, qui augmente généralement durant le murissement sous le contrôle de l’éthylène (Pichersky et al., 2006).
1.4.1 Le sentier métabolique des caroténoïdes
Chez la tomate, plusieurs enzymes sont impliquées dans les voies métaboliques qui mènent à la synthèse d’apocaroténoïdes. Les apocaroténoïdes sont des composés organiques dérivés du clivage oxydatif des caroténoïdes. La biosynthèse des caroténoïdes a lieu dans les plastides de la plante (Fraser et al., 1994) et tous les caroténoïdes ont comme précurseur l’isopentenyle diphosphate (IPP) (Bramley et al., 2002). L’isomérisation de l’IPP en son isomère allélique, le dimethylallyl diphosphate (DMAPP), mène à la production du geranylgeranyl diphosphate (C20) (GGPP) suite à
une réaction métabolique réalisée par le GGPP synthase, qui utilise comme substrat les deux isomères (Bramley et al., 2002). Par la suite, une réaction enzymatique réalisée par la phytoene synthase 1 (Psy-1) permet la condensation de deux molécules de GGPP pour former le 15-cis-phytoène (C40) (Fraser et al., 1999). Il existe deux mutations connues du gène Psy-1 qui affectent la
couleur du fruit mûr (Figure 5). La mutation chair jaune r occasionne une perte de fonction de la protéine Psy-1. Une insertion dans le premier exon de Psy-1 est à l’origine de la mutation non fonctionnelle de la protéine (Fray et Grierson, 1993). Les tomates mutantes n’accumulent donc pas de caroténoïdes et sont de couleur jaune. La mutation à chair jaune ry cause une perte de fonction de
la protéine Psy-1. C’est une variation structurale de séquence dans l’exon six du gène de la protéine qui explique le dysfonctionnement de Psy-1 (Bulot, 2019). Bien que les tomates mutantes ry
accumulent une faible quantité de caroténoïdes dans leurs tissus, cette différence est minime et elles ont une pigmentation jaune (Figure 6).
Figure 5. Le sentier métabolique des caroténoïdes et l’effet des mutations r, t, et og sur la couleur du fruit. Adapté de Vogel (2010)
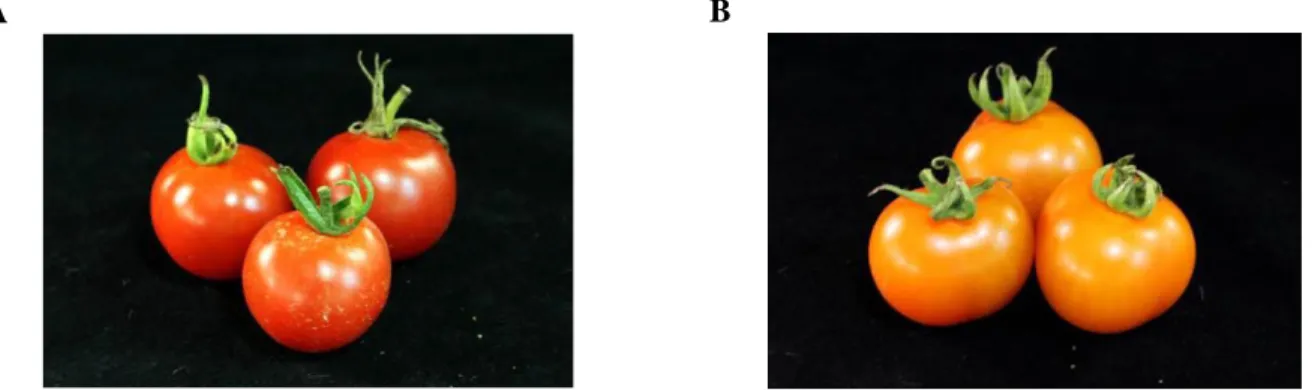
Figure 6. Effet de la mutation Psy-1 sur la pigmentation des fruits. (A) Cultivar de tomate Livingston Stone possédant une protéine Psy-1 fonctionnelle. (B) Cultivar de tomate Fantome du Laos montrant une mutation (r).
Le produit de la réaction chimique assurée par PSY-1, le 15-cis-phytoène, est converti en phytofluène sous l’action de la phytoene desaturase (PDS) (Pecker et al., 1996). Par la suite, c’est la même enzyme, soit PDS qui transforme le phytofluène en di-cis-ζ-carotène. Ce dernier composé peut, tout comme ses précurseurs (GGPP et phytoène), potentiellement être clivé aux positions du double lien 5,6 ou 5’,6’ ou le double lien 9,10 ou 9’,10’ par des carotenoid cleavage dioxygenase 1 (CCD1a et CCD1b) pour former deux apocaroténoïdes, le 6-methyl-5-hepten-2-one (MHO) et le géranylacétone, respectivement (Tableau 3).
Tableau 3. Composés volatils générés par le clivage positionnel des doubles liens de caroténoïdes par les enzymes CCD1s dans le fruit. Adapté de Vogel et al. (2008)
Caroténoïdes Position du double lien
5,6 ou 5’ ,6’ 7,8 ou 7’ ,8’ 9,10 ou 9’ ,10’
GGPP 6-methyl-5-hepten-2-one géranylacétone
Phytoène 6-methyl-5-hepten-2-one géranylacétone
ζ-carotène 6-methyl-5-hepten-2-one géranylacétone
Lycopène 6-methyl-5-hepten-2-one α-citral, β-citral
δ-carotène 6-methyl-5-hepten-2-one α-citral
β-carotène β-ionone
Seule une petite fraction des caroténoïdes présents lors de la maturation des fruits sont métabolisés en apocaroténoïdes, un constat qui suggère que le changement structurel associé à la différentiation des chromoplastes limite l’accès au bassin de caroténoïdes (Auldridge et al., 2006). De plus, les protéines CCD1s n’ont pas d’affinité pour la membrane du plastide et ne sont pas importés dans les chloroplastes (Simkin et al., 2004). Les CCD1s ont la capacité de cliver plusieurs caroténoïdes (Tableau 3). Dans la tomate, CCD1b semble être l’enzyme la plus active, i.e. celle qui a le plus d’affinité avec les caroténoïdes, et elle est davantage exprimée dans le fruit mûr (Ilg et al., 2014). Toutefois, l’expression des enzymes CCD1s dans les fruits mûrs ne corrèle pas avec l’émission d’apocaroténoïdes (Auldridge et al., 2006), des résultats qui remettent en question le rôle réel de ces protéines dans la tomate. Le développement de plantes transgéniques portant des mutations entraînant une perte de fonction des enzymes CCD1a et CCD1b semble suggérer qu’elles ont un impact limité sur l’accumulation d’apocaroténoïdes dans les tomates (Bulot, 2019).
L’enzyme ζ-carotene desaturase (ZDS) assure pour sa part la prochaine réaction enzymatique du sentier métabolique des caroténoïdes en catalysant la conversion du di-cis-ζ-carotène en neurosporène (Bramley et al., 2002). Tout comme la PDS, la ZDS catalyse deux réactions du sentier
métabolique des caroténoïdes en transformant le neurosporène en tetra-cis-lycopène (prolycopène). L’étape suivante du sentier est l’isomérisation du tetra-cis-lycopène, effectuée par l’enzyme caroténoïde isomérase (CRTISO), menant à la production du lycopène. Les enzymes CCD1s semblent pouvoir cliver le lycopène aux positions 5,6 ou 5’6’ pour former du MHO. De plus, les isoformes CCD1a et CCD1b ont aussi la capacité de cliver les positions 7,8 ou 7’8’ du double lien du lycopène pour potentiellement former deux apocaroténoïdes, l’α-citral et le β-citral (Ilg et al., 2014).
L’activité de CRTISO est grandement altérée chez les tomates possédant la mutation tangerine (t) (Figure 7). Deux mutations causant des pertes de fonction ont été caractérisées pour CRTISO (Isaacson et al., 2002). Le mutant tangerinemic a une délétion dans la séquence codante causant un dysfonctionnement de la protéine. Dans les fruits du mutant tangerinemic, l’essentiel du contenu en
caroténoïdes est retrouvé sous la forme de prolycopène et, en moindre quantité, de son précurseur le di-cis-ζ-carotène (Isaacson et al., 2002). Le mutant tangerine3183 possède quant à lui une délétion de
342 paires de bases (pb) dans le promoteur de l’enzyme CRTISO, une délétion qui altère négativement son expression. Dans les fruits du mutant tangerine3183, le di-cis-ζ-carotène est le
caroténoïde le plus abondant, suivi du prolycopène (Isaacson et al., 2002). C’est l’accumulation d’une grande quantité de prolycopène, un pigment jaune-orangé, dans les fruits qui à est l’origine de la couleur orange caractéristique des deux types de tomates mutantes (Figure 7).
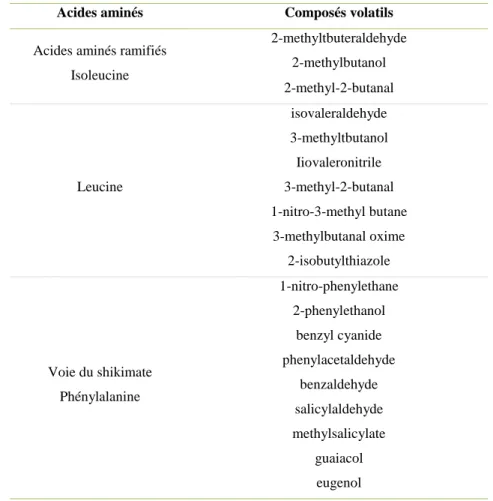
Figure 7. Effet d’une mutation ‘CRTISO’ sur la pigmentation des fruits. (A) Cultivar de tomate Ethel Watkin’s Best possédant une protéine CRTISO fonctionnelle. (B) Cultivar de tomate Orange Strawberry possédant une mutation (t).
La cyclisation du lycopène constitue une étape centrale dans la synthèse des caroténoïdes à anneaux comme la lutéine, la zéaxanthine ou le beta-carotène (Liu et al., 2015). Deux types de cyclases peuvent utiliser le lycopène comme substrat (Figure 7). La lycopène ε-cyclase (εLCY) transforme le pigment rouge δ-carotène qui a une couleur orangée (Cunningham et al., 1996). Les cultivars de
tomates qui portent la mutation Delta (Del) accumulent davantage le δ-carotène en raison d’une augmentation de l’expression de la εLCY dans le fruit mûr (Ronen et al., 1999). Cette hausse marquée de δ-carotène dans les mutants Del se fait au détriment du lycopène et résulte en des fruits de couleur orangée. Cette mutation sur le chromosome 12 provient de l’espèce de tomate sauvage S. habrochaites (Tomes, 1969). Sous l’action des CCD1s, le δ-carotène peut être clivé à la position 5,6 ou 5’6’ ou à la position 7,8 ou 7’8’ du double lien pour hypothétiquement former deux apocaroténoïdes, le β-citral et l’α-citral respectivement (Figure 8). Une coupure de la δ-carotène en position 9’,10’ résulte par ailleurs en α-ionone, un composé volatil à l’arôme floral.
Figure 8. Une partie des caroténoïdes potentiellement clivés par les enzymes CCD1s pour former des apocaroténoïdes. Adapté de Lewinsohn (2005)
Dans le second embranchement, la lycopène β-cyclase (βLYC) génère le γ-carotène, premier produit d’une réaction enzymatique en deux étapes qui se termine par la production de β-carotène (Ronen et al., 2000). Ce dernier composé peut être clivé aux positions 9, 10 ou 9’,10’ par les enzymes CCD1s pour produire l’apocaroténoïde β-ionone (Vogel et al., 2010). Deux mutations de perte de fonction ont été caractérisées dans le gène de la βLYC. Chez le mutant old-gold (og), la délétion d’une adénine à la position 103 du βLYC cause un changement de cadre de lecture dans la séquence codante et rend la protéine non fonctionnelle (Ronen et al., 2000). Chez le mutant old-gold-crimson (ogc), une insertion de trois bases à la position 403 est à l’origine d’un changement de cadre de lecture qui occasionne le dysfonctionnement de l’enzyme βLYC (Ronen et al., 2000). Ainsi les cultivars de tomates qui possèdent les mutations og et ogc accumulent davantage de lycopène et très peu de β-carotène. Une autre variation de βLYC, Beta (B), dérive de croisements avec d’autres espèces du clade des tomates. Les cultivars qui possèdent l’allèle sauvage accumulent davantage de β-carotène, au détriment du lycopène, puisque le gène B est surexprimé dans les fruits mûrs. Ces cultivars de tomates sont donc de couleur orangée (Figure 9).
Figure 9. Effet de l’allèle B sur la pigmentation des fruits. (A) Allèle de la βLYC du cultivar Mexico Midget (B) Allèle sauvage (B) de la βLYC du cultivar Jaune Flamme.
1.4.2 Le sentier métabolique des acides gras
La voie métabolique menant à la biosynthèse de composés volatils dérivés des acides gras est partiellement caractérisée. Au cours de la maturation du fruit, la dégradation de la membrane du thylakoïde accompagne la transition des chloroplastes en chromoplastes (Griffiths et al., 1999). Le processus libère des lipides membranaires comme les acylglycérols, qui sont les précurseurs de plusieurs composés volatils dérivés des acides gras (Li et al., 2018). Suite à une réaction enzymatique réalisée par des lipases, les glycérides sont transformés en acides gras polyinsaturés de 18 carbones (C18), soit l’acide linoléique (C18:2) et l’acide linolénique (C18:3). Chez S. pennellii,
l’enzyme fatty acid desaturase 7 (FAD7) a la capacité d’ajouter un double lien à l’acide linoléique pour générer davantage d’acide linolénique (Li et al., 2018). Cette enzyme n’est toutefois pas fonctionnelle chez S. lycopersicum et il est probable que l’acide linolénique provienne uniquement de l’hydrolyse des glycérides par les lipases. La peroxydation des C18 est catalysée par des
lipoxygénases (LOXs) (Griffiths et al., 1999). Les enzymes LOXs ont la capacité d’oxyder les C18
au neuvième carbone (9-LOXs) ou au treizième carbone (13-LOXs) (Griffiths et al., 1999). Les deux types d’enzymes se distinguent largement par leurs rôles et leur localisation intracellulaire. Par exemple, les 9-LOXs jouent un rôle important lors de la réaction de défense de la plante contre des attaques fongiques (Bai et al., 2010) alors que les 13-LOXs, et plus particulièrement LoxC, mènent à la biosynthèse de composés volatils dérivés des acides gras associés à la flaveur (Porta et Rocha-Sosa, 2002; Chen et al., 2004).
La peroxydation de l’acide linoléique par la LoxC occasionne la formation de l’acide hydroperoxylinoléique (13-HPO) (Figure 10). L’hydroperoxyde lyase (HPL) catalyse ensuite un clivage oxydatif sur le 13-HPO pour former un aldéhyde volatil à six carbones (C6) (Froehlich et al.,
2000). Une enzyme située dans la membrane externe de l’enveloppe chloroplastique chez la tomate
(Porta et Rocha-Sosa, 2002). Cet aldéhyde peut, par la suite, être transformé en alcool (hexanol) par l’enzyme alcool déshydrogénase 2 (ADH2), qui est fortement exprimée dans les fruits mûrs (Speirs et al., 1998). Le groupement hydroperoxyle 13-HPO pourrait aussi être transformé en groupement alcoxyle par la lipoxygénase pour former des composés à 5 carbones et possiblement des composés à 7, 8, 9 et 10 carbones. L’utilisation de l’acide linolénique plutôt que l’acide linoléique, par LoxC résulte en la formation de l’acide hydroperoxylinolénique (13-HPOT) qui montre une désaturation supplémentaire. Ce composé sert ensuite de point de départ pour la formation du penten-3-ol, penten-3-one, (Z)-3-hexenal et (Z)-3-hexenol par la même série d’enzyme (Figure 11).
Figure 10. Voie métabolique de composés volatils dérivés de l’acide linoléique dans le fruit de tomate. Adapté de Klee et al. (2018)
Figure 11. Voies de synthèse des produits de dégradation de l’acide linolénique dans le fruit de tomate. Tiré de Shen et al. (2014)
1.4.3 Le sentier métabolique des acides aminés
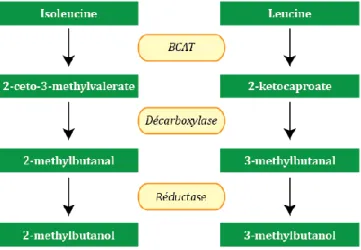
Les composés volatils dérivés des acides aminés peuvent être divisés en deux groupes (Rambla et al., 2014) (Tableau 4). Le premier groupe inclut les composés associés aux acides aminés à chaîne simple synthétisés via la voie du shikimate (Tzin et al., 2010). Le second dérive du sentier de synthèse des acides aminés ramifiés, qui inclut la leucine, la valine et l’isoleucine (Klee, 2010).
Tableau 4. Acides aminés précurseurs de composés volatils dans les diverses voies métaboliques des acides aminés. Adapté de Buttery et Ling. (1993) et de Baldwin et al. (2000).
Acides aminés Composés volatils
Acides aminés ramifiés Isoleucine 2-methyltbuteraldehyde 2-methylbutanol 2-methyl-2-butanal Leucine isovaleraldehyde 3-methyltbutanol Iiovaleronitrile 3-methyl-2-butanal 1-nitro-3-methyl butane 3-methylbutanal oxime 2-isobutylthiazole Voie du shikimate Phénylalanine 1-nitro-phenylethane 2-phenylethanol benzyl cyanide phenylacetaldehyde benzaldehyde salicylaldehyde methylsalicylate guaiacol eugenol 1.4.3.1 La voie du shikimate
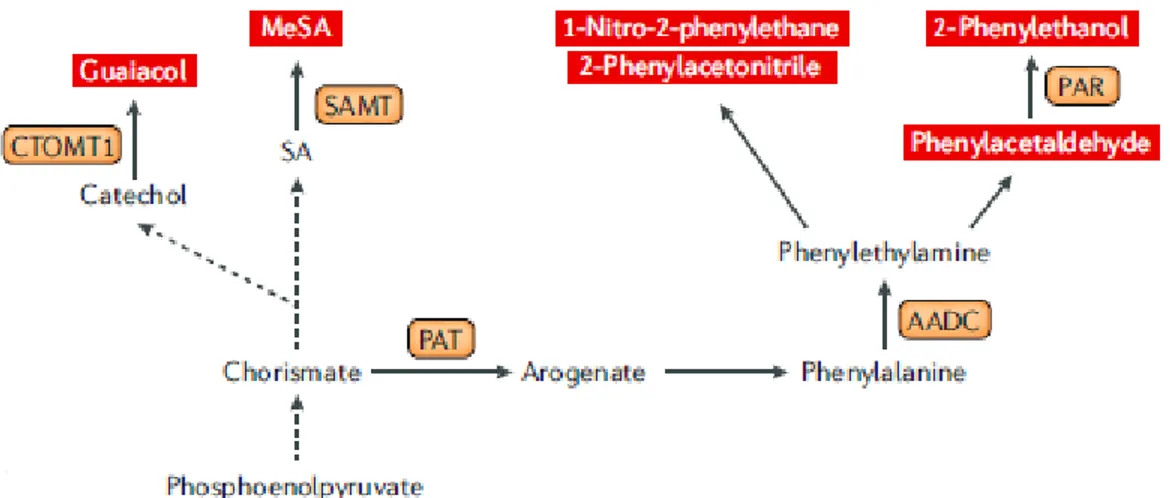
Dans la voie du shikimate, le phosphoénolpyruvate est converti, par l’entremise de plusieurs réactions enzymatiques, en chorismate. Le chorismate est un intermédiaire important dans plusieurs sentiers métaboliques menant à la synthèse de volatils dans la tomate (Figure 12). Il peut servir de point de départ pour la formation d’arogénate par l’action de plusieurs enzymes dont la préphénate aminotransférase (PAT) (Tzin et al., 2010). L’arogénate est ensuite transformé en phénylalanine à l’aide d’une enzyme qui n’a pas encore été caractérisée chez la tomate. La phénylalanine est le précurseur de plusieurs composés volatils chez la tomate, ainsi que de plusieurs autres métabolites secondaires comme les phénylpropanoïdes, les flavonoïdes et les anthocyanes. Pour produire des composés volatils, l’acide aminé est converti en phényléthylamine par l’entremise d’une petite famille de décarboxylases (AADC1a et AADC1b) (Tieman et al., 2006a). Le phényléthylamine sert ensuite d’intermédiaire dans la synthèse de composés volatils azotés et non-azotés comme le phénylacetaldehyde (Figure 12). Ce dernier composé peut être converti en 2-phényléthanol grâce à