© Claude Dufour, 2019
Les carences nutritionnelles des abeilles (Apis mellifera
L.) en condition de pollinisation du bleuet à feuilles
étroites (Vaccinium angustifolium Ait.) et de la
canneberge (Vaccinium macrocarpon Ait.)
Mémoire
Claude Dufour
Maîtrise en biologie - avec mémoire
Maître ès sciences (M. Sc.)
Les carences nutritionnelles des abeilles (Apis
mellifera L.) en condition de pollinisation du bleuet
à feuilles étroites (Vaccinium angustifolium Ait.) et
de la canneberge (Vaccinium macrocarpon Ait.)
Mémoire
Claude Dufour, ing.f.
Sous la direction de :
Pierre Giovenazzo, Ph. D., directeur de recherche
Valérie Fournier, Ph. D., codirectrice de recherche
ii
Résumé
L’abeille domestique (Apis mellifera L.) participe à la pollinisation commerciale des cultures de bleuets à feuilles étroites (Vaccinium angustifolium Ait.) et de canneberges (Vaccinium
macrocarpon Ait.). Ce service de pollinisation représente 27% des revenus associés aux activités des
apiculteurs au Québec (Canada). En participant à la pollinisation commerciale, les abeilles domestiques sont ainsi souvent exposées à des sources de pollen moins diversifiées qui pourraient alors contribuer à engendrer des carences nutritionnelles. Dans cette étude, nous avons élaboré quatre stratégies d’aménagement apicole (SA) avec pollinisation commerciale et mesuré leur impact sur le développement et la santé des colonies d’abeilles domestiques. Les groupes expérimentaux utilisés étaient : A) SA avec production de miel seulement (témoin); B) SA avec pollinisation commerciale du bleuet à feuilles étroites; C) SA avec pollinisation commerciale de la canneberge et D) SA avec double pollinisation, bleuet suivi de la canneberge. Nos objectifs étaient de 1) réaliser le suivi de colonies pendant une saison apicole complète dans différentes situations selon les SA, 2) identifier et comparer la diversité florale et son attrait pour les abeilles domestiques entre les ruchers expérimentaux en utilisant un système d’information géographique et le pollen récolté, 3) mesurer périodiquement le contenu en protéines et acides aminés du pollen récolté par les butineuses, par le biais des pelotes de pollen et du pain d'abeilles dans différentes situations selon les SA, et 4) comparer le développement et la santé des colonies d’abeilles domestiques entre les différentes SA tout au long d’une saison apicole complète. Nos résultats démontrent que l’abondance florale et son attrait pour les abeilles domestiques sont significativement plus faibles lors des services de pollinisation de la canneberge comparé aux autres SA. D’autre part, la concentration de protéines dans le pollen et le pain d’abeilles était significativement plus faible lors des services de pollinisation du bleuet, ce qui a engendré une plus faible surface de couvain. Dans ces deux cas, plusieurs acides aminés étaient en déficits mais ceux-ci n’étaient pas toujours en lien avec les SA. De façon générale, plusieurs déficits d’acides aminés essentiels (pollen et pain d’abeilles) ont été trouvés dans les trois ruchers et les quatre stratégies d’aménagement. La SA avec double pollinisation (bleuet et canneberge) a eu pour impact de réduire significativement le gain de poids des colonies, la récolte de pollen et la surface de couvain, et a également causé une mortalité hivernale plus importante. Nous avons de plus mesuré une quantité plus significative du virus de la cellule royale noire, du virus du couvain sacciforme et de Nosema
iii
Abstract
Commercial pollination in lowbush blueberry (Vaccinium angustifolium Ait.) and cranberry (Vaccinium macrocarpon Ait.) crops benefit the presence of honey bee (Apis mellifera L.) for pollination and this pollination service represents 27% of the revenues from all seasonal beekeeping activities in Quebec (Canada). While providing such services, honey bees are often exposed to undiversified pollen sources that may contribute to nutritional deficiencies. In this study, we investigated four beekeeping management strategies (MS) and measured their impact on honey bee colony health and development. Experimental groups were: A) Control farmland honey producing MS (control MS); B) Blueberry pollination MS (blueberry MS); C) Cranberry pollination MS (cranberry MS) and D) Double pollination MS, blueberry followed by cranberry (double MS). Our objectives were to 1) monitor honey bee colonies during one year in different situations (according to the MS) 2) compare floral abundance and attractiveness of foraging areas to honey bees between apiaries using a Geographic Information System and harvested pollen, 3) analyze the protein and essential amino acid content of collected and stored pollen (bee bread) and measure the nutritional impact of pollination services on honey bee colonies and 4) compare honey bee colony health status and population development between MS during a complete beekeeping season. Our study reveals that honey bees providing blueberry and/or cranberry pollination services are exposed to a less diversified pollen diet than colonies located in a rich farmland environment. This was especially true for the cranberry crop environment. There was a significantly lower proportion of crude protein content in the pollen collected and stored by honey bees during provision of blueberry pollination services, which led to a smaller brood population. Regarding essential amino acids, many deficiencies were measured, however these were not always related to the management strategy. Globally, various essential amino acid deficiencies (harvested pollen or bee bread) were present at all three apiaries and four management strategies. The double MS significantly reduced colony weight gain, pollen harvest and brood population, and induced a significantly higher winter mortality rate. We also found significantly higher levels of Black queen cell virus, Sacbrood virus and Nosema ceranae in the double MS.
iv
Table des matières
Résumé ... ii
Abstract ... iii
Table des matières ... iv
Liste des figures ... vii
Liste des tableaux ... xi
Remerciements ... xiii
Avant-propos ... xv
Introduction ... 1
L’abeille domestique ... 1 Biologie ... 1 Besoins nutritionnels ... 4Ennemis biologiques de l’abeille domestique ... 13
Stress d’origine anthropique ... 19
Situation de l’abeille domestique au Canada et au Québec ... 21
Pollinisation commerciale ... 25
Biologie de la pollinisation entomophile ... 25
Enjeux agricoles liés à la pollinisation par l’abeille domestique ... 26
Situation de la pollinisation commerciale au Canada et au Québec ... 27
Pollinisation commerciale du bleuet et de la canneberge au Québec par l’abeille domestique ... 31
Hypothèses de recherche ... 34
Objectifs de cette étude ... 35
Chapitre 1 : The impact of lowbush blueberry (Vaccinium angustifolium Ait.) and
cranberry (Vaccinium macrocarpon Ait.) pollination on honey bee (Apis mellifera L.)
colony health status ... 36
1.1 Résumé ... 37
v
1.3 Introduction ... 39
1.4 Material and methods ... 41
1.4.1 Experimental treatments and colony management ... 41
1.4.2 Landscape analysis ... 42
1.4.3 Colony health status ... 42
1.4.4 Statistical analysis ... 45
1.5 Results ... 46
1.5.1 Landscape analysis ... 46
1.5.2 Colony health status ... 47
1.6 Discussion ... 49
1.6.1 Landscape foraging potential for honey bees ... 50
1.6.2 Colony performance ... 50
1.6.3 Pathogens, parasites and viruses ... 51
Acknowledgements ... 54
References ... 54
Chapitre 2 : Diversity and nutritional value of pollen harvested by honey bee (Apis
mellifera) colonies during lowbush blueberry (Vaccinium angustifolium) and cranberry
(Vaccinium macrocarpon) pollination ... 60
2.1 Résumé ... 61
2.2 Abstract ... 62
2.3 Introduction ... 63
2.4 Material and methods ... 65
2.4.1 Experimental treatments and colony management ... 65
2.4.2 Statistical analysis ... 68
2.5 Results ... 69
2.5.1 Diversity of harvested pollen ... 69
2.5.2 Protein in harvested pollen and bee bread ... 70
2.5.3 Essential amino acids in harvested pollen and bee bread ... 71
2.5.4 Honey bee brood population ... 72
vi
2.6.1 Protein in pollen and bee bread ... 74
2.6.2 Amino acids in pollen and bee bread ... 75
2.6.3 Bee bread vs bee pollen composition ... 76
2.6.4 Conclusion ... 76 Acknowledgments ... 77 Author contributions ... 77 Conflict of interest ... 78 References ... 78
Discussion générale ... 85
Diversité florale ... 85Protéines et acides aminés dans le pollen et le pain d’abeilles ... 88
Protéine dans le pollen et le pain d’abeilles ... 88
Acides aminés dans le pollen et le pain d’abeilles ... 89
La composition du pain d’abeilles vs le pollen récolté par les abeilles ... 91
La performance des colonies ... 92
Quantité de pollen récolté ... 92
Gain de poids des colonies ... 93
Surface de couvain ... 94
Pertes de reines ... 94
Pathogènes, parasites et maladies virales ... 95
Conclusion générale ... 97
Bibliographie ... 101
Annexe A: Figures et tableaux du chapitre 1 ... 118
vii
Liste des figures
Liste des figures de l’introduction
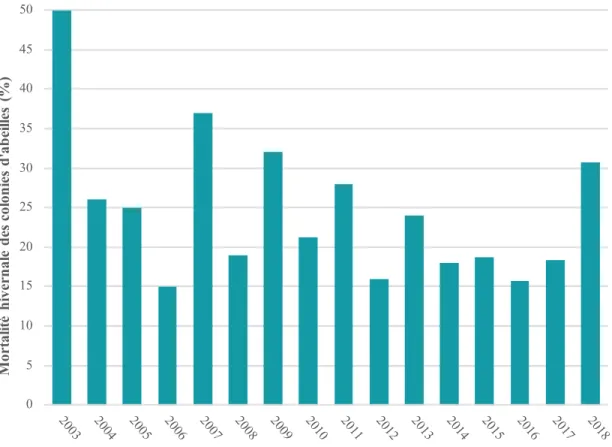
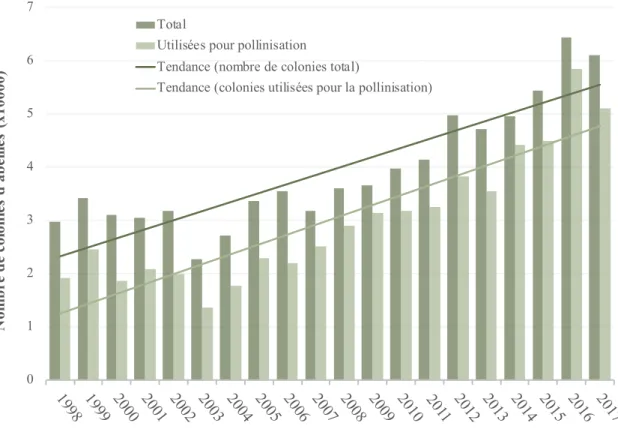
Figure 1. Nombre de colonies d'abeilles domestiques et d’apiculteurs au Québec entre 1998 et 2017 (Institut de la statistique du Québec 2018). ... 22 Figure 2. Mortalité hivernale (%) des colonies d’abeilles domestiques au Québec de 2003 à 2018
(CAPA 2008, 2009, 2010, 2011, 2012, 2013, 2014, 2015, 2016, 2017, MAPAQ 2017b, CAPA 2018). ... 23 Figure 3. Valeur monétaire attribuable aux abeilles domestiques de la pollinisation commerciale des
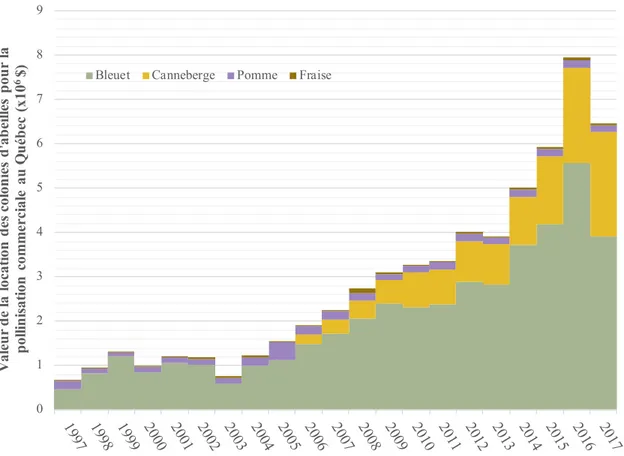
grandes cultures canadiennes en 2016 (en millions $) (Mukezangango et Page 2017). ... 28 Figure 4. Valeur monétaire de la location des colonies d’abeilles pour la pollinisation commerciale
du bleuet, de la canneberge, de la pomme et de la fraise au Québec entre 1997 et 2017 (Institut de la statistique du Québec 2018). ... 29 Figure 5. Nombre total de colonies d’abeilles domestiques au Québec ainsi que celles utilisées pour
la pollinisation commerciale au Québec de 1998 à 2017 (Institut de la statistique du Québec 2018). ... 30 Figure 6. Valeur, pour les apiculteurs du Québec, de la vente de miel et de la location des colonies
d’abeilles domestiques pour la pollinisation commerciale de 1998 à 2017 (Institut de la statistique du Québec 2018). ... 31
Liste des figures du chapitre 1
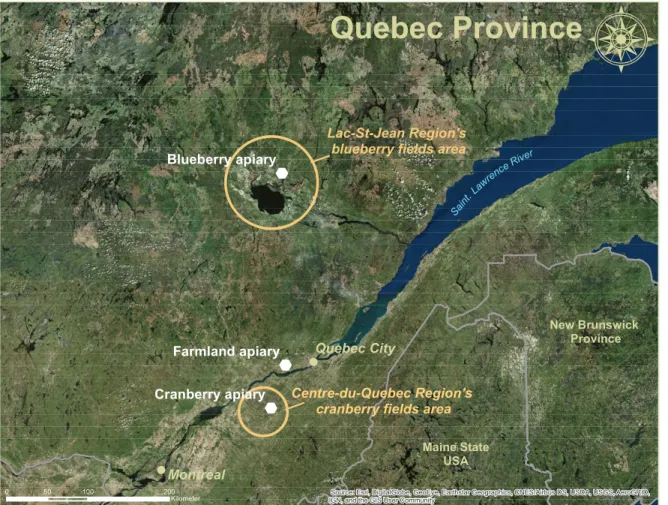
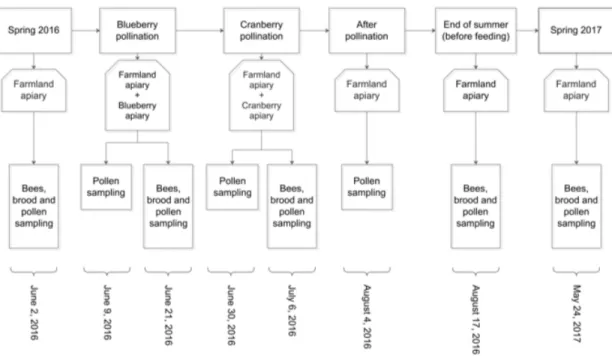
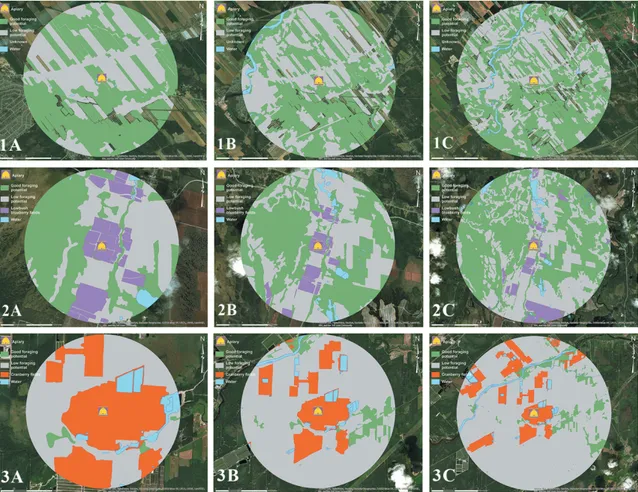
Fig 1. Location of the study apiaries. Location of the farmland, blueberry field and cranberry field apiaries, against the location of the most important regions for blueberry and cranberry production in the province of Quebec, Canada. Sources: Esri, DigitalGlobe, GeoEye, i-cubed, USDA FSA, USGS, AEX, Getmapping, Aerogrid, IGN, IGP, swisstopo, and the GIS User Community. Maps were created using ArcGIS® software by Esri. ArcGIS® and ArcMap™ are the intellectual property of Esri and are used herein under license. Copyright © Esri. All rights reserved. For more information about Esri® software, please visit www.esri.com. ... 119 Fig 2. Data sampling schedule. Data sampling schedule from spring 2016 to spring 2017. ... 120 Fig 3. Landscape structure. Landscape structure (forestlands and farmlands) surrounding the
various apiaries: 1) farmland apiary, 2) blueberry apiary and 3) cranberry apiary in a proximal 1.5-km radius (A), medial 3-km radius (B) and distal 5-km radius (C). Areas in green are those with good foraging potential for honey bees, while areas in grey are those with low foraging potential. Lowbush blueberry fields are in purple and cranberry fields are in red. Data were
viii
extracted from the Ministère de l’Énergie et des Ressources naturelles du Québec database (Provincial 4th 10-year program) and the Financière Agricole du Québec database
(Info-Sols 2016). Sources: Esri, DigitalGlobe, GeoEye, i-cubed, USDA FSA, USGS, AEX, Getmapping, Aerogrid, IGN, IGP, swisstopo, and the GIS User Community. Maps were created using ArcGIS® software by Esri. ArcGIS® and ArcMap™ are the intellectual property of Esri and are used herein under license. Copyright © Esri. All rights reserved. For more information about Esri® software, please visit www.esri.com. ... 121 Fig 4. Hive weight gain. Hive weight gain (mean weight in kilograms ± SE) per treatment (N = 5
colonies per treatment) over a season (from June 1, 2016 to September 6, 2016), including surveys before pollination, during blueberry pollination and cranberry pollination and after pollination. Significant differences among treatments (P < 0.01 based on post hoc Tukey’s test - HSD) are shown with different letters. ... 122 Fig 5. Surface of capped brood. Evolution of the surface of a honey bee colony capped brood (mean
number of sealed brood cells ± SE) for each management strategy (N = 5 colonies per treatment) over a one-year period (from May 2016 to May 2017), including surveys before pollination, during blueberry pollination and cranberry pollination, after pollination and after wintering. Significant differences among treatments (P < 0.01 based on post hoc Tukey’s test - HSD) are shown with different letters. ... 123 Fig 6. Black queen cell virus (BQCV) virulence. BQCV copies (mean number of copies ± SE)
diagnosed in honey bee larvae within the four management strategies (MS) (N = 5 colonies per MS), including surveys before pollination, during blueberry pollination and cranberry pollination, after pollination and after wintering. Significant differences among MS (P < 0.01 based on post hoc Tukey’s test - HSD) are shown with different letters. ... 124 Fig 7. Sacbrood virus (SBV) virulence. SBV copies (mean number of copies ± SE) diagnosed in
honey bee larvae within the four management strategies (MS) (N = 5 colonies per MS), including surveys before pollination, during blueberry pollination and cranberry pollination, after pollination and after wintering. Significant differences among MS (P < 0.01 based on post hoc Tukey’s test - HSD) are shown with different letters. ... 125 Fig 8. Nosema ceranae spores. Number of Nosema ceranae spores in honey bee gut (mean number
of spores per bee ± SE) for each treatment (N = 5 colonies per treatment) over a one-year period (from May 2016 to May 2017), including surveys before pollination, during blueberry pollination and cranberry pollination, after pollination and after wintering. Significant differences among treatments (P < 0.01 based on post hoc Tukey’s test - HSD) are shown with different letters. ... 126
ix
Liste des figures du chapitre 2
Fig. 1. Location of the study apiaries. Location of the farmland, blueberry field and cranberry field apiaries, located in the most important regions for blueberry and cranberry production in the province of Quebec, Canada. Sources: Esri, DigitalGlobe, GeoEye, i-cubed, USDA FSA, USGS, AEX, Getmapping, Aerogrid, IGN, IGP, swisstopo, and the GIS User Community. Maps were created using ArcGIS® software by Esri. ArcGIS® and ArcMap™ are the intellectual property of Esri and are used herein under license. Copyright © Esri. All rights reserved. For more information about Esri® software, please visit www.esri.com. ... 139 Fig. 2. Sampling schedule. Data sampling schedule from May 2016 to May 2017. ... 140 Fig. 3. Floral pollen sources per apiary. Floral pollen sources (palynology analysis results) and
relative abundance (%) per apiary (farmland, blueberry and cranberry) over the one-year study period (May 2016 to May 2017). Five pollen sampling periods are presented: Spring 2016, Blueberry pollination, Cranberry pollination, Late summer 2016 and Spring 2017. Pollen diversity harvested from colonies in the control farmland apiary are showed for each period (green bars) and compared to pollen diversity harvested from colonies during blueberry pollination (blue bars) and cranberry pollination (red bars). ... 141 Fig. 4. Diversity index. Shannon diversity index (mean index ± SE) for each management strategy
(MS) (N = 5 colonies per MS) before pollination, during blueberry and cranberry pollination, after pollination and after wintering (from June 2, 2016 to May 24, 2017). Significant differences between treatments are shown with different letters (P < 0.01 based on post hoc Tukey’s test (HSD)) (F21,98 = 5.01, P < 0.001). *Cell colour indicates the apiary where the
colonies are located (Green = farmland apiary; Blue = blueberry apiary; Red = cranberry apiary). ... 142 Fig. 5. Protein concentration in pollen. Protein concentration (% of dry matter) in pollen harvested
by honey bees (mean concentration in % ± SE) for each management strategy (MS) (N = 5 colonies per MS) before pollination, during blueberry and cranberry pollination, after pollination and after wintering (from May 2016 to May 2017). Significant differences between treatments are shown with different letters (P < 0.01 based on post hoc Tukey’s test (HSD)) (F21, 103 = 19.08, P < 0.0001). *Minimum threshold of 20% protein of dry matter (Kleinschmidt
et al. 1974). ... 143 Fig. 6. Protein concentration in bee bread. Protein concentration (% of dry matter) in bee bread
x
before pollination, during blueberry and cranberry pollination, after pollination and after wintering (from May 2016 to May 2017). Significant differences between treatments are shown with different letters (P < 0.01 based on post hoc Tukey’s test (HSD)) (F12,56 = 4.99, P < 0.001).
*Minimum threshold of 20% protein of dry matter (Kleinschmidt et al. 1974) ... 144 Fig. 7. Essential amino acid (AA) concentrations in pollen. Essential AA concentrations in pollen
harvested by honey bees (mean g/100 g of protein ± SE) for each management strategy (MS) (N = 5 colonies per MS) before pollination, during blueberry and cranberry pollination, after pollination and after wintering (from May 2016 to May 2017). Significant differences between treatments are shown with different letters (P < 0.01 based on post hoc Tukey’s test (HSD)). 1A
minimum threshold for each essential AA is in relation to tryptophan = 1.0 (De Groot 1953); the AA with concentrations below the minimum relative thresholds, based on tryptophan = 1.0, are in grey; colors indicate the apiary (green = farmland apiary, blue = blueberry apiary, red = cranberry apiary) ... 146 Fig. 8. Essential amino acid (AA) concentrations in bee bread. Essential AA concentrations in bee
bread (mean g/100 g of protein ± SE) for each management strategy (MS) (N = 5 colonies per MS) before pollination services, during blueberry and cranberry pollination and after, until May 2017. Significant differences between treatments are shown with different letters (P < 0.01 based on post hoc Tukey’s test (HSD)). 1Minimum relative threshold for each essential AA is
in relation to tryptophan = 1.0 (De Groot 1953); the AA with concentrations below the minimum relative thresholds, based on tryptophan = 1.0, are in grey; colors indicate the apiary (green = farmland apiary, blue = blueberry apiary, red = cranberry apiary) ... 148 Fig. 9. Brood population. Evolution of the sealed brood population of honey bee colonies (mean
number of brood cells ± SE) for each management strategy (N = 5 colonies per MS), including surveys before pollination services, during blueberry and cranberry pollination and after until May 2017. Significant differences between treatments are shown with different letters (P < 0.01 based on post hoc Tukey’s test (HSD)) ... 149
xi
Liste des tableaux
Tableau de l’introduction
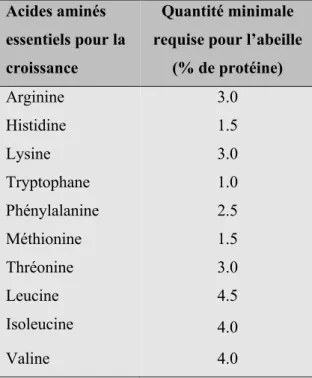
Tableau 1. Les 10 acides aminés essentiels au développement de l’abeille domestique et leur contenu relatif minimum en % de la protéine brute (avec tryptophane = 1.0 comme base) (De Groot 1953) ... 8
Liste des tableaux du chapitre 1
Table 1. Colony management strategy schedule ... 127 Table 2. Foraging potential ... 127
S1 Table. List of the different land types within the three honey bee foraging radii (1.5K, 3K and 5K) for each apiary (farmland, blueberry and cranberry apiaries). ... 128 S2 Table. Virus prevalence (presence or absence) per honey bee colony for the 7 viruses analyzed
within three castes (larvae, nurse and forager bees) of each management strategy throughout the study. ... 129 S3 Table. Virus virulence (mean virus copies per bee) per honey bee colony for the 7 viruses analyzed
within larvae of each management strategy throughout the study. ... 131 S4 Table. Virus virulence (mean virus copies per bee) per honey bee colony for the 7 viruses analyzed
within nurse bees of each management strategy throughout the study. ... 133 S5 Table. Virus virulence (mean virus copies per bee) per honey bee colony for the 7 viruses analyzed
within forager bees of each management strategy throughout the study. ... 135 S6 Table. Varroa mite population monitoring. ... 137
Tableau du chapitre 2
xii
À mon merveilleux compagnon de vie, Alain, et à mes enfants
xiii
Remerciements
Je tiens d’abord à remercier mon directeur de recherche, M. Pierre Giovenazzo, Ph. D., gentilhomme, passionné d’apiculture et professionnel remarquable sans qui ce travail colossal ne se serait jamais concrétisé, et ce sans autant d’enthousiasme. Il a facilité toutes les étapes du cheminement et je lui en suis fort reconnaissante. Il a su dire les mots d’encouragement qu’il fallait quand il le fallait. Non seulement il n’a jamais douté de mes capacités à accomplir la tâche, mais il a souvent manifesté son enchantement pour mon travail, à sa façon qui lui est propre et pour laquelle il est reconnu au sein des étudiants et collègues. Son positivisme reconnu a illuminé mon cheminement. Mes remerciements vont aussi à Mme Valérie Fournier, Ph. D., ma codirectrice de recherche qui a participé aux étapes importantes de cette recherche et de la correction de la rédaction qui a suivi avec un professionnalisme réconfortant. Sa connaissance du domaine apicole est sans borne et son support a été grandement apprécié, de sorte que je n’aurais pu avoir meilleure codirectrice.
Je tiens également à remercier M. Émile Houle, technicien apicole au Centre de recherches en sciences animales de Deschambault (CRSAD), grand connaisseur du domaine apicole et homme de cœur qui par ses connaissances de la régie apicole a permis de travailler avec les colonies d’abeilles expérimentales de façon professionnelle, sécuritaire et même amusante. Sa joie de vivre, sa volubilité, son sens pratique et ses anecdotes vécues au fil de ses longues années d’expérience ont rendu le travail sur le terrain des plus intéressants et formateurs. J’apprécie maintenant le transfert de ses connaissances au-delà de cette recherche, plus particulièrement pour mon travail d’apicultrice. Je m’incline bien bas devant cette encyclopédie vivante de l’apiculture.
Je suis aussi reconnaissante envers d’autres membres du personnel du CRSAD et collègues étudiants :
M. Michaël Benoît et M. Georges Martin (CRSAD), ainsi que Mme Ségolène Maucourt et Mme Sabrina Rondeau (étudiantes) qui ont participé sporadiquement aux travaux sur le terrain. De plus,
l’équipe du CRSAD a assuré la prise en charge des colonies d’abeilles expérimentales de façon complémentaire à notre récolte des données de recherche.
Le hasardeux et laborieux travail d’analyses statistiques n’aurait jamais abouti sans le précieux support de M. Gaétan Daigle, statisticien et consultant en statistiques, Université Laval. Sa façon de vulgariser cette science m’a déstabilisée… et grandement aidée !
xiv
Merci à Mme Karen Grislis qui a corrigé mes articles anglophones pour les soulever à un niveau de langue supérieur, prêts à être soumis aux journaux scientifiques.
Merci aussi à Intermiel (au nom du producteur de bleuets) et Les Atocas de l’Érable pour avoir fourni les sites expérimentaux pour nos colonies d’abeilles permettant ainsi d’appliquer nos différentes stratégies d’aménagement.
Merci à Bayer Corp Science qui a financé en entier cette étude, et plus particulièrement à M. Luc
Bourgeois, Technical Issues Manager, pour son intérêt envers ce projet. Merci également au CRSAD
pour sa contribution en nature et l’opportunité d’utiliser ses infrastructures tout au long du travail technique avec les colonies d’abeilles.
Je termine avec mes remerciements plus personnels, d’abord envers Mme Mélissa Girard. Cette merveilleuse amie, mentor, professeure (cours collégial en apiculture), partenaire d’aventures apicoles sans frontières et créatrice d’étincelles est l’instigatrice de tout ce beau projet. C’est Mélissa qui a semé en moi la graine de la maîtrise en sciences apicoles, qui a rapidement germé et qui est maintenant concrétisée dans cet ouvrage, telle une magnifique fleur tous pétales ouverts ! Mélissa a également participé à cette étude par le biais de ses compétences en palynologie en analysant mes nombreux échantillons de pollen pour en déterminer l’espèce florale. Grazie mille Mélissa pour tout ton apport à cette réussite et à mon déploiement dans le merveilleux monde de l’apiculture.
Enfin, mes remerciements les plus tendres vont à mon conjoint, M. Alain Roy, et à mes enfants qui m’ont accompagnée passivement et significativement, dans les moindres soubresauts, obligations, contraintes, compromis et embûches qu’a imposé ce projet dans notre vie familiale tout au long de ces trois années académiques. Vous avez été des plus compréhensifs. Je vous adore mes amours ! Et merci Alain pour ton soutien financier sans lequel il m’aurait été absolument impossible de poursuivre des études graduées après 20 ans sur le marché du travail dans ma profession d’ingénieure forestière. Tu savais que la soif d’apprendre m’habite et que cette idée farfelue de retour aux études ne devait restée inachevée. Ma passion pour les abeilles est réelle et ma volonté d’entreprendre un défi de cette envergure était plus grande que jamais. Tu l’as compris, accepté et supporté. Sans toi, rien de cela n’aurait jamais vu le jour. Le mot « merci » ne représente en rien ma gratitude à ton égard, alors je te demande d’accepter ma plus profonde et sincère reconnaissance.
xv
Avant-propos
Ce manuscrit a été rédigé sous la forme de mémoire par insertion d’articles, c’est-à-dire que les deux chapitres qui forment le cœur de ce manuscrit consistent en deux articles scientifiques rédigés en anglais et soumis à un journal scientifique. Le corps du mémoire comporte également une introduction consistant en une revue de littérature rédigée en français ainsi qu’une discussion et conclusion générale, également en français, revenant sur l’ensemble des résultats et des observations qui découlent des chapitres 1 et 2.
Le chapitre 1 intitulé « The impact of lowbush blueberry (Vaccinium angustifolium Ait.) and cranberry (Vaccinium macrocarpon Ait.) pollination on honey bee (Apis mellifera L.) colony health status » a été accepté par le journal scientifique PLoS ONE pour publication, puis resoumis après révisions le 9 octobre 2019 (Identifiant PONE-D-19-18647R1). Il est en seconde révision au moment d’écrire ces lignes.
Le chapitre 2 intitulé « Diversity and nutritional value of pollen harvested by honey bee (Apis
mellifera) colonies during lowbush blueberry (Vaccinium angustifolium) and cranberry (Vaccinium macrocarpon) pollination » a été soumis au journal scientifique Journal of Pollination Ecology le
14 novembre 2019 (identifiant #592). Il est en révision au moment d’écrire ces lignes.
L’auteure principale a fait l’ébauche originale de ce manuscrit, de même que la récolte et l’analyse des données. La conceptualisation, la méthodologie et l’administration du projet ont été réalisées par l’auteure principale avec la collaboration de Pierre Giovenazzo, Ph. D., professeur-chercheur au département de biologie et titulaire de la Chaire de leadership en enseignement en sciences apicoles, Université Laval. La validation, la révision et l’édition du manuscrit ont été réalisées par l’auteure principale avec la collaboration Pierre Giovenazzo et de Valérie Fournier, Ph. D., professeure-chercheuse du Centre de recherche et innovation sur les végétaux, Université Laval. Le projet a entièrement été supervisé par Valérie Fournier et Pierre Giovenazzo et ce dernier a assuré l’acquisition du financement.
1
Introduction
L’abeille domestique
Biologie
Historique
L’abeille domestique (Apis mellifera L.) (Hymenoptera: Apidae) descend d’un ancêtre commun avec la guêpe de la superfamille des Vespoïdes dans l’ordre des Hyménoptères. Il y a plus de 100 millions d’années, lorsque les Angiospermes1 sont apparues sur Terre, la guêpe carnivore a évolué
en différentes espèces omnivores et végétariennes. Parmi celles-ci, on retrouve les espèces de la famille des Apidés (les « abeilles ») comprenant aujourd’hui plus de 20 000 espèces dont fait partie l’abeille domestique (genre Apis) (Wilson-Rich 2014). Au cours de l’évolution, les plantes à fleurs et les abeilles ont développé des caractéristiques favorisant la coévolution et la symbiose entre ces deux organismes. Les premières se sont adaptées pour leur reproduction et les deuxièmes pour leur alimentation, dans une activité hautement spécialisée d’une extrême importance pour ces dernières, la pollinisation (Waser et al. 1996).
L’abeille domestique fut importée sur le continent nord-américain (en Virginie, aux États-Unis) à l’époque de la colonisation au début du 17e siècle (Crane 1992). Il s’agissait de la sous-espèce Apis
mellifera mellifera. Elle est parente avec toutes les autres sous-espèces d’Apis mellifera dispersées
en Afrique, au Moyen-Orient et en Europe (plus de deux douzaines de sous-espèces au total) (Schneider 2015). Cette dispersion génétique reste encore à étudier, mais on avance présentement qu’elles possèdent toutes leur souche commune (A. mellifera) en Asie du Sud-Est, incluant les Philippines (Garnery et al. 1992, Gupta 2014).
La sous-espèce Apis mellifera mellifera a régné en Amérique du Nord pendant plus de deux siècles. Entre 1859 et 1922, sept autres sous-espèces d’Apis mellifera furent introduites, dont Apis mellifera
ligustica, l’abeille italienne, la plus connue et la plus appréciée des apiculteurs. Depuis 1922, une
loi américaine visant le contrôle bio sanitaire des colonies d’abeilles sur notre continent impose des restrictions sur l’importation d’abeilles d’Europe. Ces restrictions ont eu comme effet d’augmenter la consanguinité des abeilles domestiques que l’on retrouve aujourd’hui sur le continent nord-américain (Schneider 2015).
2
Castes
L’abeille domestique est un insecte eusocial, ce qui implique que les individus de différentes générations vivent en colonie et que l’organisation sociale des différentes castes comprend une spécialisation des tâches, par exemple celle de s’occuper collectivement des « jeunes ». De plus, l’eusocialité implique un niveau d’organisation à l’échelle de la colonie, au-delà de l’individu seul (Beshers et Fewell 2001).
Les abeilles sont divisées en trois castes d’individus reproducteurs et non reproducteurs : la reine (femelle fertile), les ouvrières (femelles stériles) et les faux-bourdons (mâles fertiles). La détermination du genre résulte de la diploïdie et de l’haploïdie : les œufs fécondés deviennent des femelles tandis que les mâles proviennent d’œufs non fécondés (Schneider 2015). Puis, la différenciation entre une reine et une ouvrière est environnementale. Seul un changement de nourriture offerte aux larves femelles dans les premiers jours après l’éclosion de l’œuf permet le développement de celles-ci en reine ou en ouvrières. Les abeilles nourricières offriront presque exclusivement de la gelée royale à la future reine, ce qui lui permettra de développer des organes reproducteurs fonctionnels. À l’opposé, les autres femelles, les ouvrières, ne recevront de la gelée royale que durant les trois premiers jours suivant l’éclosion de l’œuf (Wilson-Rich 2014). Orchestrées par les phéromones qui assurent l’homéostasie, soit l’équilibre des tâches à accomplir par chaque individu au sein de la colonie pour le maintien de la cohésion, lesquelles découlent de la spécialisation morphologique, physiologique et comportementale de chacune des castes (Le Conte et Hefetz 2008). Ainsi, la reine pond les œufs, les mâles fécondent la reine et les ouvrières assurent toutes les autres tâches pour le bon fonctionnement de la colonie (Le Conte 2011). Seeley (1982) définit six castes chez les abeilles domestiques : une caste mâle, une caste femelle reproductive (la reine) et quatre sous-castes d’ouvrières, divisées en fonction de leurs tâches accomplies dans la colonie. On y retrouve la sous-caste qui 1) nettoie les cellules, 2) nourrit le couvain, 3) entrepose la nourriture dans les alvéoles et 4) butine pour rapporter nectar, pollen, propolis et eau à la colonie.
Indépendamment de la caste, tous les individus se développent en quatre stades : œuf, larve, nymphe et adulte. L’œuf éclot après la troisième journée suivant la ponte et la larve qui en émerge est nourrie par les abeilles nourricières avant d’être operculée à la fin du stade larvaire pour opérer sa transformation finale en adulte (le stade nymphal). La durée des stades larvaire et nymphale est fonction de la caste : huit jours en larve et quatre jours en nymphe chez la reine, 10 jours en larve
3
et 11 jours en nymphe chez le faux-bourdon, 10 jours en larve et huit jours en nymphe chez l’ouvrière (Le Conte 2011).
Organisation d’une colonie
Une caractéristique importante d’un insecte eusocial tel l’abeille domestique, se retrouve dans l’organisation sociale de la colonie. Le polyéthisme d’âge des ouvrières, c’est-à-dire les tâches réalisées en fonction de leur âge, régule cette organisation complexe et minutieuse. La configuration du nid serait à l’origine du polyéthisme afin d’optimiser l’efficacité des tâches (Seeley 1982). En effet, les ouvrières débutent leur travail dans la colonie dès leur naissance, à l’endroit même où elles naissent. Dès l’émergence de l’alvéole, l’abeille s’affaire à nettoyer sa cellule et les cellules voisines récemment vidées, en prévision d’une autre ponte. Sa tâche ne lui demande donc aucun déplacement inefficace. Lors de cette première journée, elle poursuit son développement, et particulièrement celui de ses glandes hypopharyngiennes responsables de l’excrétion de la gelée royale qui lui permettront de nourrir les larves à proximité (Seeley 1982, Omar et al. 2017). La progression du travail par les ouvrières en fonction de l’âge va comme suit (Winston 1987) :
1) Nettoyage et operculation des alvéoles (deux premiers jours) 2) Soins du couvain et de la reine (deux à 11 jours)
3) Construction et nettoyage des alvéoles, et manutention de la nourriture (réception du nectar, nettoyage des débris, formation du pain d’abeilles (avec le pollen)) (12 à 20 jours) 4) Tâches extérieures (ventilation, surveillance, butinage) (à partir de 19-21 jours et ce jusqu’à
4
Besoins nutritionnels
À l’instar de la plupart des animaux, l’abeille domestique requiert des protéines, des glucides, des lipides, des vitamines, des minéraux et de l’eau pour son bon développement. Le nectar récolté sur les nectaires2 des fleurs procure les glucides nécessaires alors que le pollen récolté sur les anthères3
des fleurs comble les besoins pour tous les autres éléments (protéines, lipides, vitamines et minéraux). Les besoins de l’abeille au stade larvaire ainsi que la jeune abeille diffèrent de ceux de l’abeille adulte. Les larves de même que les jeunes abeilles doivent consommer une grande quantité de pollen (stocké dans les alvéoles sous forme de pain d’abeilles, consistant en du pollen fermenté par les enzymes ajoutées par les sécrétions des abeilles). Cette nutrition assure le développement des tissus, muscles et glandes (Winston 1992), notamment les glandes hypopharyngiennes et mandibulaires qui produisent la gelée royale et la gelée nourricière et dont le développement atteint un sommet au jour 5 (Omar et al. 2017). La consommation de pollen durant les jours 1 à 8 de la vie adulte des abeilles est intensive, avec une culminance au jour 3. Il s’ensuit une baisse nette dès le jour 9 (Omar et al. 2017). À partir de 10 à 14 jours de vie adulte, lorsque les tâches de soin sont terminées, l’abeille consomme majoritairement des glucides du nectar et du miel (Herbert et Hill 2015).
Durant le stade larvaire, les nourricières sécrètent une gelée nutritive appelée « gelée nourricière » qu’elles déposent dans les alvéoles contenant une larve d’ouvrière. Pour les deux premiers jours du stade larvaire, cette sécrétion mixte se compose de 20 à 40% de sécrétion blanchâtre, principalement des lipides, provenant des glandes mandibulaires alors que le reste de la diète provient de sécrétions claires des glandes hypopharyngiennes, principalement composées de protéines. Dès la troisième journée du stade larvaire, la sécrétion blanchâtre cesse et seulement la sécrétion claire est déposée dans l’alvéole, combinée avec du miel et du pollen. Les larves de faux-bourdons reçoivent aussi cette diète, mais en plus grande quantité que celles des ouvrières (Haydack 1970). Comme il a été dit auparavant, les larves de reine sont presque exclusivement nourries avec de la gelée royale qui consiste en une quantité égale de sécrétions blanchâtres des glandes mandibulaires et de sécrétions claires des glandes hypopharyngiennes des nourricières (Haydack 1970). La gelée royale comprend 11,9% de protéines, 67,1% d’humidité et 4,3% de lipides (Herbert et Hill 2015).
2 Glandes des fleurs qui excrètent le nectar
5
La nutrition spécialisée des larves par les abeilles nourricières démontre qu’elles ont la capacité de reconnaître la caste et l’âge de développement de la larve (Haydack 1970).
Glucides
Le miel est sans équivoque le produit le plus connu des abeilles. Il consiste en la source d’énergie de la colonie, représentant la nourriture la plus importante pour l’abeille adulte de plus de 10 jours de vie (Haydack 1970). Le miel se retrouve aussi en petite quantité dans la nourriture offerte aux larves (Herbert et Hill 2015). Le miel provient du nectar butiné sur les fleurs qui, lors du vol de retour, séjourne dans le jabot de l’abeille (partie de son système digestif servant de sac de transport) lui ajoutant ainsi certaines sécrétions et enzymes. Une fois arrivé à la ruche, ce nectar en partie transformé est échangé par trophallaxie entre plusieurs abeilles pour être enfin déposé dans les alvéoles et déshumidifié par ventilation par les abeilles.
Les butineuses ont un sens accru pour détecter les valeurs nutritionnelles du nectar (sucres, minéraux, etc.) et choisissent les fleurs en conséquence (von Frisch 2011, Hendriksma et al. 2014). Le nectar des fleurs contient de 4% à 60% de glucides, mais celui prisé par les abeilles lors du butinage en possède une concentration de 30-50% et contient, par ordre de préférence : du sucrose, du fructose et du glucose (Waller 1972). Le miel est constitué de sucres, d’eau et d’autres constituants mineurs propres à chaque fleur visitée (arômes, pigments, acides et minéraux). Ces derniers sont principalement responsables à eux seuls des différences entre les miels (White et Doner 1980).
Après quelques jours d’entreposage dans les alvéoles, le nectar a entamé son processus de transformation des sucres grâce aux actions enzymatiques. Puis par l’action de ventilation des abeilles pour déshumidifier ce nectar, il atteint une teneur en sucre d’environ 80% : il est devenu du miel. Une étude de White et Doner (1980) sur 490 échantillons de miel américain a permis de caractériser son contenu en sucres : fructose (38%), glucose (31%), sucrose (1-2%), maltose (7%) et autres sucres complexes (1,5%).
Le besoin en glucides d’une abeille adulte pour sa survie est minimalement de 4 mg par jour (Barker et Lehner 1974).
6
Protéines
La source de protéines nécessaires à la colonie provient du pollen récolté sur les fleurs par les butineuses (Winston 1987, von Frisch 2011). Ce pollen est rapporté à la ruche sous forme de pelote entreposée sur une structure des pattes postérieures de l’abeille appelée « corbeille » (Snodgrass et al. 2015). Arrivée à la ruche, la butineuse détermine l’endroit où seront déposées ses deux pelotes dans une alvéole près du couvain. Les ouvrières affectées à l’entreposage du pollen viendront compacter les pelotes avec un mélange de miel et de sécrétions ce qui produira du pain d’abeilles, un pollen fermenté par l’action enzymatique (Herbert et Shimanuki 1978, Brodschneider et Crailsheim 2010). La valeur nutritive du pain d’abeilles est directement liée au pollen et à sa composition (Donkersley et al. 2017).
- La qualité du pollen nécessaire pour un développement optimal
Un facteur d’importance à considérer dans la qualité du pollen est son taux de protéines. Un pollen composé d’une grande proportion de protéines contribue à une meilleure croissance de la colonie et une meilleure espérance de vie de l’abeille (Schmidt et al. 1987), un développement optimal des glandes hypopharyngiennes dans les premiers jours de vie de l’abeille (Standifer 1967, Di Pasquale et al. 2013) et un meilleur élevage du couvain (Herbert et al. 1970). Schmidt et al. (1987) précisent que c’est non seulement la quantité de pollen ingéré qui affecte l’espérance de vie, mais aussi la concentration en protéines du pollen, et plus important encore, la quantité totale de protéines consommées. La composition en acides aminés définirait plus précisément la valeur nutritive du pollen (Cook et al. 2003).
Le taux de protéines brutes4 du pollen floral varie de 2 à 60% de matière sèche (pollen récolté à la
main) (Roulston et al. 2000).
Les abeilles peuvent survivre en consommant un pollen constitué d’un faible taux de protéine (moins de 20%), mais leur longévité augmente lorsqu’elles consomment du pollen avec un taux de protéine brute élevé (25 à 30%) comparativement à un taux de protéine brute plus faible (Somerville 2005). Kleinschmidt et al. (1974) dans Somerville (2005) classent les qualités nutritives de diverses
4Le taux de protéines brutes du pollen est une mesure de sa concentration en azote multipliée par un facteur
de 6.25
7
sources florales en 3 catégories : le pollen avec plus de 25% de protéines brutes est d’excellente qualité, le pollen contenant entre 20 et 25% de protéines brutes est de qualité moyenne et le pollen contenant moins de 20% de protéines brutes est de faible qualité.
Les protéines contenues dans le pollen sont formées d’acides aminés essentiels et non essentiels dont la proportion et la composition varient selon l’espèce de plante butinée (Roulston et Cane 2000). Un acide aminé essentiel est un acide aminé qui ne peut être synthétisé par l’organisme, ce qui implique qu’il doit être ingéré par l’alimentation. Les besoins en acides aminés essentiels des abeilles ont été déterminés par De Groot (1953) dans une étude exclusive jamais répétée depuis en raison de sa complexité. Les 10 acides aminés suivants sont essentiels pour la croissance des abeilles et le développement de la colonie : arginine, histidine, lysine, tryptophane, phénylalanine, méthionine, thréonine, leucine, isoleucine et valine (tableau 1). Les acides aminés faisant partie du groupe « non essentiels » (donc qui peuvent être synthétisés par l’organisme) utile au développement de l’abeille sont : tyrosine, cystine, acide glutamique, acide aspartique, glycine, alanine, proline et sérine. De plus, la glycine, la sérine et la proline sont prouvées comme apportant une influence stimulante sur la croissance (De Groot 1953).
La quantité minimale requise pour l’abeille de chaque acide aminé essentiel (en pourcentage de la protéine ingérée) (tableau 1) doit être considérée non pas comme un chiffre absolu, mais une quantité dépendante des autres, avec le tryptophane comme unité de base (1.0). Ainsi, lorsqu’un acide aminé est déficient, l’utilisation des autres acides aminés devient tout autant diminuée. La valeur nutritionnelle du pollen se définit plus adéquatement en fonction de sa composition en acides aminés que sa proportion en protéines puisque sa valeur est directement réduite par une déficience en un ou plusieurs acides aminés (Cook et al. 2003). Par exemple, si un type de pollen contient 1% de phénylalanine, ce qui serait plus de la moitié de la proportion estimée nécessaire selon De Groot (1953) (tableau 1), les abeilles ne pourront utiliser que 40% de la protéine totale parce que la phénylalanine est le facteur limitant l’absorption. Ce faisant, l’abeille sera tenue à ingérer 2,5 fois plus de pollen pour obtenir le taux de phénylalanine requis (2,5%), et ce en gaspillant plus de la moitié de la protéine. En conclusion, le pollen présentant un faible taux de protéines brutes et un déficit d’un ou plusieurs acides aminés représente une plus grande inquiétude que le pollen en déficit d’un ou plusieurs acides aminés, mais ayant un taux élevé de protéines.
8
Tableau 1. Les 10 acides aminés essentiels au développement de l’abeille domestique et leur contenu relatif minimum en % de la protéine brute (avec tryptophane = 1.0 comme base) (De Groot 1953)
Acides aminés essentiels pour la croissance
Quantité minimale requise pour l’abeille
(% de protéine) Arginine 3.0 Histidine 1.5 Lysine 3.0 Tryptophane 1.0 Phénylalanine 2.5 Méthionine 1.5 Thréonine 3.0 Leucine 4.5 Isoleucine 4.0 Valine 4.0
Comme pour le nectar, les abeilles ne butinent pas le pollen aléatoirement, leur recherche étant plutôt dirigée par l’apprentissage des plantes possédant une valeur nutritionnelle optimale (Cook et al. 2003). Les facteurs qui dictent les dynamiques de butinage du pollen sont cependant complexes. Ils peuvent inclure la disponibilité de la ressource florale, la diversité du paysage, le climat régional et les facteurs météorologiques locaux (Kaluza et al. 2016). En ce qui a trait à la ressource florale et la diversité du paysage, Donkersley et al. (2017) concluent qu’un paysage complexe et biodiversifié se répercute dans la qualité du pain d’abeilles en favorisant une plus grande variété d’espèces entreposées dans les alvéoles. La composition de l’environnement autour des ruchers engendre donc un impact important sur la valeur nutritionnelle du pain d’abeilles (Donkersley et al. 2014).
- La quantité de pollen requise par une colonie pour une saison apicole
La quantité de pollen requise par une colonie est difficile à déterminer et dépend de plusieurs facteurs telles les conditions climatiques, la disponibilité en nectar, la quantité de couvain et la qualité du pollen récolté (Somerville 2005). Une abeille ouvrière consomme en moyenne 3,4 à 4,3 mg de pollen par jour (Crailsheim et al. 1992) et aura besoin entre 160 et 180 mg de pollen durant sa vie adulte (à un taux moyen de protéine de 20%) (Keller et al. 2015b). Au total, entre 13 kg et
9
55 kg de pollen de bonne qualité doit être consommée par année par une colonie mature pour un développement optimal (Crailsheim et al. 1992, Kleinschmidt and Kondos (1976) dans Somerville 2001, Keller et al. 2015b)
La recherche de Somerville (2005) a démontré que pour chaque 10 grammes de protéines que la colonie a besoin pour son bon développement, elle doit consommer 48 grammes de pollen contenant 30% de protéines brutes. Mais si le pollen contient seulement 20% de protéines brutes, la colonie devra consommer 72 grammes de ce pollen pour obtenir les mêmes valeurs nutritionnelles. Une colonie devra donc fournir un effort de butinage beaucoup plus important si le pollen récolté contient moins de protéines brutes.
Contrairement au miel, il y a peu de pollen entreposé dans la ruche puisqu’il est pratiquement consommé au fur et à mesure (Brodschneider et Crailsheim 2010, Keller et al. 2015b). La quantité de pollen récolté par une colonie dicte la quantité de couvain qui sera élevée par celle-ci (Mattila et Otis 2006).
Lipides, minéraux et vitamines
L’abeille comble ses besoins en lipides (acides gras, stérols et phospholipides) par la consommation de pollen. Ceux-ci lui servent de source d’énergie, à synthétiser ses réserves de gras et de glycogène et comme composantes structurelles essentielles de nombreuses membranes cellulaires (Herbert et Hill 2015). Les lipides composent entre 1 et 20% du contenu du pollen selon l’espèce florale (Herbert et Shimanuki 1978, Roulston et Cane 2000, Villanueva et al. 2002). Parmi tous les stérols, le cholestérol est réputé essentiel pour les abeilles : elles ne peuvent le synthétiser elles-mêmes et doivent l’obtenir par l’alimentation. Peu d’études approfondies ont démontré la nécessité du cholestérol pour leur développement normal, mais l’addition de ce lipide dans l’alimentation d’abeilles à l’étude a prouvé ses effets bénéfiques (Herbert et Hill 2015).
Les minéraux que consomment les abeilles sont des composés inorganiques présents sous forme de « cendres » dans le pollen. Il y a peu de connaissance sur les besoins des abeilles en minéraux, mais on sait qu’ils sont essentiels à leur système enzymatique. Ils composent entre 2,5% et 6,5% du contenu du pollen. Les minéraux présents dans le pollen sont communément le potassium, le phosphore, le calcium, le magnésium et le fer (Herbert et Hill 2015).
10
Les vitamines jouent un rôle jusqu’à maintenant peu connu dans le développement de l’abeille. Elles sont présentes dans le pollen, qui est riche en vitamines hydrosolubles (thiamine, riboflavine, pyridoxine, acide pantothénique, niacine, acide folique, biotine, inositol et acide ascorbique) et pauvre en vitamines liposolubles (vitamines A, D, E et K) (Herbert et Hill 2015). Un déficit en acide ascorbique (vitamine C) porte une atteinte à l’exosquelette de l’abeille (Kramer et Seib 1982). Une étude a démontré qu’un supplément d’acide ascorbique apporte des effets positifs sur le métabolisme de l’insecte (Farjan et al. 2015). De façon générale, si le pollen disponible est varié, nutritif et abondant, l’abeille y retrouvera toutes les vitamines dont elle a besoin pour son développement (Herbert et Hill 2015).
Eau
L’eau est nécessaire aux abeilles à plusieurs égards : permet le transport de la nourriture dissoute dans toutes les parties de leur corps, permet la digestion, le métabolisme et l’élimination des déchets, rend possible l’utilisation du miel par dilution, assure le maintien d’une température adéquate dans la ruche par le biais de la ventilation lors des journées chaudes puis assure le maintien d’une bonne humidité relative au sein de la colonie pour l’éclosion des œufs et la prévention de l’assèchement des larves. Les besoins annuels d’une colonie en eau sont estimés à environ 44 livres (env. 20 kg) (Herbert et Hill 2015).
Conséquences d’un stress nutritionnel
Un stress nutritionnel apparaît lorsque le seuil minimal de l’un ou l’autre des besoins nutritionnels décrits plus haut n’est pas rencontré dans l’alimentation de l’abeille. Les répercussions peuvent apparaître à court terme sur l’individu, mais elles peuvent aussi se manifester à long terme sur la colonie ; c’est l’effet de retardement, ou « carry over ». Harrison et al. (2011) décrivent l’effet de retardement comme étant des événements et des processus survenant lors d’une saison et qui se répercutent sur l’individu pendant la transition vers la saison suivante, ce qui conséquemment affecte la performance de l’individu à la période subséquente. L’exemple le plus probant de cet effet se rencontre lorsque les ressources florales sont limitées durant la saison apicole et que la colonie est entraînée à sa perte durant l’hiver qui suit (mortalité hivernale). Une cascade complexe de comportements de l’insecte comme réponse à un stress nutritionnel et d’effet synergique de stress environnementaux autrement latents engendrent un effet catastrophique sur la survie de la colonie.
11
Avant de développer davantage sur les effets d’un stress nutritionnel chez l’abeille, il faut comprendre la dynamique de butinage au sein de la colonie. Sachant que la quantité de pollen disponible dicte la ponte et l’élevage du couvain, le printemps est une période critique où la récolte de pollen doit être assez intense pour envoyer le signal à la colonie d’accroître sa population. Fewell et Winston (1992) montrent qu’il existe un impact important autant au niveau du comportement des butineuses que de la colonie dans son ensemble en réponse à des variations dans la quantité de pollen disponible. Les butineuses ajustent leur effort de butinage de même que le type de fleurs visitées selon le niveau de pollen entreposé dans la ruche. La colonie répond à un niveau faible de pollen entreposé dans les alvéoles en augmentant la quantité de butineuses. Si toutefois la quantité de pollen demeure limitée, la colonie s’ajuste d’abord en diminuant la ponte de la reine, puis en cannibalisant les larves par les nourricières et ultimement en arrêtant complètement la ponte d’œufs (Schmickl et Crailsheim 2001). Comme la quantité de couvain au sein d’une colonie correspond à la quantité d’ouvrières 21 jours plus tard puis subséquemment à l’effort de butinage environ un mois plus tard, l’effet de retardement d’une disette de pollen au printemps se répercute en une diminution du butinage en été et conséquemment de la réserve alimentaire pour l’hiver (Requier et al. 2017).
- Manque de miel
Lorsque la colonie se voit en pénurie de miel entreposé et que le nectar disponible dans l’environnement est en baisse, elle réagit de différentes façons : la colonie diminue son développement, devient plus agressive dans la défense de la ruche, diminue son comportement hygiénique et envoie moins de butineuses à la récolte de pollen (Somerville 2005).
- Manque de pollen en qualité et en quantité
Un manque de pollen dans l’élevage des larves et des jeunes abeilles engendre un stress chez la colonie d’abeilles qui se concrétise par :
• une diminution de la longévité des abeilles (Schmidt et al. 1987, Roulston et al. 2000, Hendriksma et Shafir 2016) ;
• une diminution de la ponte de la reine et de la quantité de couvain (Vanderplanck et al. 2014) (Schmidt et al. 1987) ;
12
• une activité de butinage réduite (Scofield et Mattila 2015). Cette dernière serait causée par une diminution de l’habileté à éviter la prédation, une vigueur insuffisante, une incapacité à danser correctement pour transmettre l’information sur la localisation d’une source florale aux autres butineuses, une capacité affaiblie de retrouver la colonie au retour du butinage.
Une préoccupation majeure de l’impact de la malnutrition chez les colonies d’abeilles mellifères est qu’elle interagit avec les autres facteurs de stress décrits plus haut pour ébranler toutes les fonctions de la colonie.
Les résultats d’une étude de Höcherl et al. (2012) montrent qu’une réponse adaptative des abeilles suite à une nutrition déficiente en nutriments autre que les protéines et acides aminés (probablement des vitamines) a été de récolter significativement plus de pollen que les colonies d’abeilles dont la nutrition est adéquate. De plus, bien que les ressources florales soient abondantes, elles ne peuvent offrir une alimentation saine et complète pour les abeilles que si elles contiennent tous les macronutriments (protéines, glucides, lipides) et micronutriments (acides aminés, vitamines, minéraux, etc.) (Donkersley et al. 2017).
Une diète diversifiée est nécessaire pour limiter le stress nutritionnel (Schmidt et al. 1995). Dans une étude menée par Hendriksma et Shafir (2016), les résultats concluent à une préférence des abeilles butineuses à rapporter à la ruche un pollen de plusieurs sources plutôt qu’à favoriser le butinage sur les mêmes espèces de fleurs puisque la probabilité de déficit en éléments nutritifs se voit diminuée par une alimentation de provenance diverse. Le butinage sur une grande diversité de fleurs est une stratégie adaptative qui assure un équilibre nutritionnel.
13
Ennemis biologiques de l’abeille domestique
Les ennemis biologiques de l’abeille domestique proviennent de maladies de source bactérienne, fongique et virale, de parasites, de prédateurs et d’insectes nuisibles. Selon le cas, l’ennemi peut s’attaquer soit à la larve, la nymphe ou l’adulte (Pettis et al. 2015). Le parasite Varroa destructor (Anderson et Trueman), ayant récemment élu A. mellifera comme hôte de prédilection, se veut l’ennemi contemporain le plus redoutable de l’abeille domestique (Watson et Stallins 2016).
Parasites
§ Varroase
Parmi les parasites ayant l’abeille domestique comme hôte, et même parmi tous ses ennemis biologiques, V. destructor arrive au premier rang des plus dommageables pour la colonie.
Varroa destructor est un acarien parasite de l’abeille domestique depuis peu (environ 50 ans),
identifié à l’année 2000 (Anderson et Trueman 2000). À l’origine, Apis ceranae était son seul hôte avant d’être mis en contact avec A. mellifera lors de son introduction en Asie au cours de ce siècle. Comme cette dernière est beaucoup moins résistante qu’A. ceranae, le varroa a depuis connu une propagation cosmopolite (sauf en Australie pour le moment) (de Guzman et Rinderer 1999, Rosenkranz et al. 2010, Mondet et al. 2014).
On associe souvent les mortalités hivernales massives de colonies d’abeilles domestiques à une infestation ou à l’héritage d’une infestation de varroas (Le Conte et al. 2010). Varroa destructor se nourrit de l’hémolymphe et des corps gras des larves, nymphes et adultes. Il est rare qu’une abeille adulte meure lorsque parasitée, mais son espérance de vie diminue. Il en est autrement pour l’abeille immature : si la quantité de femelles-fondatrices de varroas à parasiter une larve ou une nymphe à l’intérieur de l’alvéole est grande, l’abeille pourrait mourir avant même d’émerger. L’impact le plus important de la présence de varroas dans une colonie se trouve dans la transmission de virus qui causent des dommages irréversibles aux abeilles et à la colonie (Martin et al. 2012).
La transmission de la maladie peut se faire horizontalement et verticalement : les varroas peuvent être transportés à l’intérieur de la colonie en passant d’une abeille à l’autre lorsqu’à proximité et ils peuvent être transportés d’une colonie à l’autre par la dérive (abeille qui entre dans la mauvaise
14
colonie) (Pettis et al. 2015). La varroase peut être prévenue et traitée par une gestion apicole adéquate (Giovenazzo et Dubreuil 2011). Le calendrier de contrôle de la varroase du ministère de l’Agriculture, des Pêcheries et de l’Alimentation (MAPAQ) suggère des seuils d’interventions et une série de traitements à effectuer dans chaque colonie afin de prévenir ou contrôler une infestation de varroas.
§ Petit coléoptère de la ruche (Aethina tumida)
Le petit coléoptère de la ruche (PCR) est un insecte ravageur originaire de l’Afrique qui a été répertorié pour la première fois aux États-Unis (Floride) en 1998 (Thomas 1998) et plus récemment au Canada (Giovenazzo et Boucher 2010). L’insecte adulte pénètre dans la ruche pour y pondre ses œufs dont les larves se nourrissent du couvain, du pollen et du miel qu’elles contaminent ensuite par ses excréments ou par les levures qui lui sont associées qui fermenteront le miel. Ce dernier devient alors impropre à la consommation. Lorsque la population du petit coléoptère de la ruche devient trop importante dans la colonie, les abeilles peuvent abandonner la ruche (Pettis et al. 2015). Les mesures de contrôle proposées incluent l’utilisation de trappes à PCR à l’intérieur de la ruche et la conservation de colonies fortes (Bernier et al. 2015).
Maladies bactériennes
La maladie la plus importante de l’abeille causée par une bactérie est la loque américaine (Paenibacillus larvae). Elle a longtemps été la maladie la plus dommageable des colonies d’abeilles avant l’arrivée de la varroase. La loque américaine se répand grâce aux spores de P. larvae, qui peuvent demeurer viables durant des décennies dans l’attente d’un hôte. Cette bactérie infecte la phase larvaire de toutes les castes : la larve qui se nourrit de gelée nourricière contaminée au fond de l’alvéole ingère les spores (à peine dix peuvent suffire) qui vont germer et se reproduire dans le système digestif de la larve qui meurt ensuite de septicémie (Genersch 2010). La maladie se répand autant horizontalement (sans reproduction de l’hôte) que verticalement (avec reproduction de l’hôte). L’occurrence de la maladie dépend de la présence de spores ou non. Il n’existe pas de moyen de lutte efficace et durable contre la loque américaine, à part la destruction par le feu des colonies contaminées et de la décontamination des instruments apicoles (Pettis et al. 2015).
La loque européenne est moins virulente que la loque américaine, mais peut causer des dommages importants et engendrer des diminutions de production de miel considérables. Elle est causée par
15
la bactérie infectieuse Melissococcus plutonis. La loque européenne affecte la phase larvaire de toutes les castes. Comme pour la loque américaine, la larve devient infectée lorsqu’elle ingère de la gelée nourricière contaminée. M. plutonis se développe dans le système digestif de la larve. Comme la demande en gelée nourricière par la larve infestée augmente considérablement, les abeilles nourricières les éliminent, ce qui limite la propagation de la maladie. Si la colonie est forte et que les nourricières sont nombreuses, il est fort probable que la maladie ne se développera pas à un niveau alarmant (Pettis et al. 2015). Par contre, dans une colonie faible il y aura dépérissement pouvant aboutir à sa mort.
Il existe plusieurs autres maladies bactériennes de moindre importance dont il ne sera pas question ici.
Maladies fongiques
La nosémose constitue la maladie fongique la plus importante pour l’abeille adulte. Elle est causée par un parasite unicellulaire intracellulaire, Nosema spp. Il existe deux espèces, soit Nosema apis, connue depuis des décennies comme une maladie parasitaire d’Apis mellifera en Europe, et Nosema
ceranae, récemment devenue un parasite d’A. mellifera (Higes et al. 2006) (son hôte de prédilection
était Apis ceranae). La transmission s’effectue horizontalement lorsque l’abeille ingère de la nourriture infectée par les spores ou nettoie les fèces infectées à l’intérieur de la ruche. Les spores pénètrent la paroi cellulaire du système digestif, se développent au stade végétatif rapidement et ces nouveaux champignons produisent de nouvelles spores en quantité si importante que la paroi cellulaire éclate et libère ces spores dans le système digestif de l’abeille pour aller infecter d’autres cellules et ainsi de suite. Éventuellement, des spores sont libérées dans les fèces des abeilles, ce qui devient une source de contamination (Pettis et al. 2015).
Nosema apis est mieux connue que la récente N. ceranae, qui est réputée être plus virulente que la
première. Elle est associée avec des pertes substantielles de colonies en Europe (Higes et al. 2006). Les effets de N. Apis sur une colonie d’abeilles sont :
1) La diminution de la population en fin d’hiver et au début du printemps 2) La perte de reines
3) La contamination de l’intérieur de la ruche par les abeilles infectées dans l’incapacité d’effectuer un vol de propreté à la fin de l’automne et au début du printemps crée un pic d’infection au printemps
16
4) La perte d’abeilles devenant plus grande que leur taux de naissance, ce qui diminue la population et réduit par conséquent la récolte de nectar et le rendement en miel.
Les effets de N. ceranae ne sont pas encore bien connus (Pettis et al. 2015), mais comme les deux espèces affectent les mêmes tissus, il est probable que les effets de N. ceranae soient les mêmes que N. apis. Aussi, les incidences semblent différentes selon la localisation géographique des colonies (Fries 2010). Les abeilles adultes ne sont pas toutes infectées au même niveau par la nosémose, l’infection augmentant avec leur âge (Li et al. 2017b). La présence de Nosema spp. augmente la susceptibilité à d’autres pathogènes (Fries 2010). Le MAPAQ suggère différents moyens de prévention, qui sont efficaces sur N. apis et probablement aussi sur N. ceranae.
Une deuxième maladie fongique importante chez l’abeille domestique est le couvain plâtré, causée par le champignon Ascosphaera apis. La présence seule des spores de A. apis ne peut contribuer au développement de la maladie : elles doivent être accompagnées de conditions externes favorables à leur germination tels le refroidissement du couvain et l’humidité (Flores et al. 1996). La maladie se développe par le biais de la larve tout juste operculée ou quelques heures avant. Sous l’opercule, elle finit par mourir suite à la prolifération du champignon dans son système digestif puis la larve devient dure, blanche et sèche (d’où le terme « couvain plâtré »). Il n’y a pas de moyen de combattre cette maladie, mais en prévention il est conseillé de conserver des populations fortes et utiliser une lignée génétique résistante (Pettis et al. 2015).
Maladies virales
Il existe plusieurs dizaines de virus pouvant affecter l’abeille domestique partout à travers le monde (McMenamin et Flenniken 2018), mais la plupart ne causent pas d’infections apparentes (Pettis et al. 2015). Les virus les plus communs sont le virus des ailes déformées (Deformed Wing Virus – DWV), le virus de la cellule royale noire (Black Queen Cell Virus – BQCV), le virus du couvain sacciforme (Sacbrood Virus – SBV), le virus du Cachemire (Kashmir Bee Virus – KBV), le virus de la paralysie chronique (Chronic Bee Paralysis Virus – CBPV), le virus de la paralysie aiguë (Acute Bee Paralysis Virus – ABPV) et le virus israélien de la paralysie aiguë (Israelis Acute
Paralysis Virus – IAPV). Les virus affectent toutes les castes et tous les stades de développement
de l’abeille (Chen et Siede 2007). Dans la plupart des cas, les virus ne causent pas de pathologies sur les individus ni de dommages aux colonies d’abeilles à moins d’une interaction avec un autre pathogène ou en conjonction avec des conditions spécifiques (Döke et al. 2015).