Pour l'obtention du grade de
DOCTEUR DE L'UNIVERSITÉ DE POITIERS UFR des sciences fondamentales et appliquées
Institut de chimie des milieux et matériaux de Poitiers - IC2MP (Diplôme National - Arrêté du 7 août 2006)
École doctorale : Sciences pour l'environnement - Gay Lussac (La Rochelle) Secteur de recherche : Chimie organique, minérale, industrielle
Présentée par :
Amir Astafan
Synthèses, caractérisations et performances catalytiques des zéolithes nanoéponge de type structurale *BEA
Directeur(s) de Thèse : Ludovic Pinard, Jean Daou Soutenue le 30 mai 2016 devant le jury Jury :
Président Joël Patarin Directeur de recherche CNRS, Université de Haute-Alsace Rapporteur Johan Martens Professeur, Université de Leuven, Belgique
Rapporteur Anne Galarneau Directeur de recherche CNRS, ENSCM de Montpellier Membre Ludovic Pinard Maître de conférences, Université de Poitiers
Membre Jean Daou Maître de conférences, Université de Haute Alsace Membre Jean-Pierre Gilson Professeur des Universités, ENSI de Caen
Membre Yannick Pouilloux Professeur des Universités, Université de Poitiers Membre Benoît Louis Chargé de recherche, Université de Strasbourg
Pour citer cette thèse :
Amir Astafan. Synthèses, caractérisations et performances catalytiques des zéolithes nanoéponge de type
structurale *BEA [En ligne]. Thèse Chimie organique, minérale, industrielle. Poitiers : Université de Poitiers, 2016.
Pour l’obtention du grade de
DOCTEUR DE L’UNIVERSITE DE POITIERS
Faculté des Sciences Fondamentales et Appliquées(Diplôme National - Arrêté du 7 août 2006)
Ecole Doctorale : Gay Lussac, Sciences pour l’environement Secteur de Recherche : Chimie Organique, Minérale, Industrielle
Présentée par :
Amir ASTAFAN
************************
Synthèses, Caractérisations et performances catalytiques des zéolithes nanoéponge de type structurale *BEA
************************
Directeur de Thèse:
Ludovic PINARD, Maître de Conférence – HDR, Université de Poitiers Co-directeur de Thèse:
Jean DAOU, Maître de Conférence – HDR, Université de Haute Alsace ************************
Soutenance prévue le γ0 mai β016 devant la commission d’examen
************************
JURY
Rapporteurs : Johan Martens (Professeur de l’Université de Leuven)
Anne Galarneau (Directeur de Recherche de l’Université de Montpelliers) Examinateurs : Jean-Pierre Gilson (Professeur de l’Université de Caen)
Benoît Louis (Chargé de Recherche -HDR de l’Université de Strasbourg) Joël Patarin (Directeur de Recherche de l’Université de Haute Alsace) Yannick Pouilloux (Professeur de l’Université de Poitiers)
Jean Daou (Maître de Conférence – HDR de Université de Haute Alsace) Ludovic Pinard (Maître de Conférence – HDR, Université de Poitiers)
i
Liste des figures……….………...vi
Liste des tableaux……….………...x
Introduction générale……….1
I. Généralités sur les solides microporeux cristallisés ... 3
I.1. Structure, propriétés et composition chimique des zéolithes ... 3
I.2. Exemples de structure zéolithique ... 5
I.2.1. La zéolithe Bêta de type structural *BEA ... 5
I.2.2. La zéolithe ZSM-48 de type structural *MRE ... 7
I.2.3. La zéolithe ZSM-5 de type structural MFI ... 9
II. La synthèse de zéolithe ... 11
II.1. Principes et mécanismes de synthèse ... 11
II.2 Le rôle particulier des agents structurants ... 15
III. Les zéolithes en catalyse ... 19
IV. Synthèse de nanocristaux zéolithiques ... 24
IV.1 Méthodes usuelles de synthèse ... 25
IV.1.1 Synthèse à partir de solutions claires ... 25
IV.1.2 Synthèse à partir de gels fortement alcalins ... 26
IV.1.3 Synthèse en espaces confinés ou nanoréacteurs ... 27
IV.1.4. Synthèse à partir de précurseurs lamellaires ... 29
IV.2. Les composés organiques inhibiteurs de croissance ... 31
IV.2.1. Les polycations ... 31
IV.2.2. Les tensioactifs de type organosilane... 32
IV.2.3. Les composés inhibiteurs de croissance ... 33
IV.2.4. Cas particulier : les composés bifonctionnels ... 35
V. Les performances catalytiques des zéolithes hiérarchisées ... 38
Conclusions et objectifs ... 43
Références bibliographiques... 45
Introduction ... 49
I. Techniques de caractérisation physico-chimiques des catalyseurs zéolithiques ... 50
I.1. Etude de la structure zéolithique par diffraction de rayons X (DRX) ... 50
I.2. Composition chimique ... 51
I.2.1. Spectrométrie de fluorescence X ... 51
Chapitre I
ii
I.3. Composition superficielle mesurée par Spectroscopie des photoélectronX (XPS) ... 52
I.4. Composition de la charpente ... 52
I.4.1. Détermination du rapport Si/Al de la charpente zéolithique ... 53
I.4.2. Détermination de la formule de la maille élémentaire ... 55
I.5. Etude de la morphologie ... 56
I.5.1. Microscopie électronique à balayage... 56
I.5.2. Microscopie électronique en transmission ... 56
I.6. Etude de la Porosité par adsorption-désorption de diazote ... 57
I.7. Etude de l’acidité ... 62
I.7.1. La désorption en température programmée d’ammoniac (TPD-NH3) ... 62
I.7.2. Thermodésorption de pyridine suivie par spectroscopie infrarouge ... 62
I.8. Dispersion des Métaux par Thermodésorption de CO suivie par spectroscopie infrarouge ... 64
II. Description des réactions modèles utilisées ... 66
II.1. Etude de stabilité des catalyseurs : transformation de l’éthanol en hydrocarbures et l’analyse des catalyseurs cokés ... 66
II.1.1. Préparation des catalyseurs sous forme protonique ... 66
II.1.2. Mise en forme des catalyseurs ... 66
II.1.3. Conditions standard ... 67
II.1.4. Analyse des catalyseurs cokés ... 71
II.2. Hydroisomérisation du n-hexadécane ... 74
II.2.1. Préparation des catalyseurs bifonctionnels ... 74
II.2.2. Réactifs chimiques utilisés ... 75
II.2.3 Montage expérimental ... 75
II.2.4. Analyse chromatographique ... 76
II.2.5. Identification des produits de réaction ... 76
II.3. Exploitation des résultats obtenues par chromatographie ... 78
Références bibliographiques... 79
Introduction ... 81
I. Protocoles de synthèse des zéolithes bêta ... 81
I1. Synthèse des microcristaux de bêta (MC-1 et MC-2) ... 81
I.2. Synthèse des petits cristaux de zéolithe bêta (PC-1 et PC-2) ... 82
I.3. Synthèse des nanocristaux de zéolithe bêta (NC) ... 83
iii
I.4.2. Synthèse des nanoéponges de zéolithe bêta... 87
I.5. Résumé des protocoles de synthèse ... 88
I.6. Calcul du nombre d’agent bifonctionnel par maille de zéolithe ... 88
II. Caractérisations structurale et texturale des zéolithes bêta ... 90
II.1. Structure ... 90
II.2. Morphologie et taille des cristaux ... 92
II.3. Impact de la diminution de la taille des cristaux sur les propriétés texturales ... 95
III. Composition chimique ... 97
IV. Synthèse des nanoéponges : influence des conditions opératoires ... 101
Conclusions ... 111
Références bibliographiques... 112
Introduction ... 113
I. Relationship between the acidic properties and the crystal size of *BEA zeolites ... 114
II. Catalytic performances in ETH reaction ... 117
III. Relationship between the coke composition and its location with the textural properties of *BEA zeolites ... 120
IV. Effect of the textural properties on coke removal ... 124
Conclusions ... 126
Références bibliographiques... 127
Introduction ... 129
I. Catalyst characterisations ... 131
I.1. Acidic properties of the *BEA zeolites ... 131
I.2. Properties of the bifunctional catalysts ... 138
II. n-C16 hydroisomerization over Pt/*BEA zeolites ... 142
II.1. Activities ... 142
II.2. Selectivity’s and reaction schemes ... 143
Conclusions ... 149
Références bibliographiques... 150
Synthèse et Perspectives ... 151
Chapitre IV
iv
*BEA Bêta
2-D Bidimensionnel 3-D Tridimensionnel
B Multi-branched
BAS Brønsted Acid Sites BET Bruner Emmet Teller
BTA Butylamine
BTX Benzène Toluène Xylène
C Cracking
C16 Héxadecane C2H4 Ethylène
CA Concentrations of acid sites CBU Composite Building Unit CD Chemin Diffusion CH2Cl2 Dichlorométhane CHA Chabasite
CPt Concentrations of platinum
D Dispersion
DEE Diethyl Ether DPA Dipropylamine
DPL Diffusion Path Length EA Elementary Analyse EC External Coke
EFAL Extra Framework Aluminium
ETOH Ethanol
FAU Faujasite
FD Framework Density
FTIR Fourrier Transform InfraRed GC Gaz Chromatography
GPC Gel permeation chromatography HF Acide fluorhydrique
HRTEM High Resolution Transmission Electron Microscopy
IC Internal Coke
ICP Inductively Coupled Plasma IZA International Zeolite Association
v MC Micron-Size Crystal MOR Mordenite MS Mass Spectrometry MTG Methanol-To-Gazoline MTH Methanol-To-Hydrocarbons N2 Diazote
NAR Number of aromatic ring nas Number of acid steps NC Nanometre-Size Crystal
NH3 Ammoniac
NMR Nuclear Magnetic Resonance NS Nano-sponge zeolite
PBU Primary Building Unit
PyH+ Pyridine adsorbed on Brønsted PyL Pyridine adsorbed on Lewis Rdt Rendement massique SBU Secondary Building Unit SC Small-Size Crystal
SEM Scanning Electron Microscopy
SOD Sodalite
TEABr Tetraethylammonium Bromide
TEAOH Tetraethylammonium Hydroxide
TEM Transmission Electron Microscopy TEOS Tetraethyl orthosilicate
TOF Turn Over Frequency
TOT Bande de structure
TPAOH Tetraeropyl ammonium Hydroxide
TPD Temperature Programmed Desorption XPS X-ray Photoelecron Spectroscopy XRD X-Ray Diffraction
vi
Figure I.1 : Combinaison polymérique d'unités de construction primaires (PBU) Figure I.2 : Les 23 unités de construction secondaires (SBU) répertoriées
Figure I.3 : Formation des zéolithes de type structural FAU, LTA et SOD à partir d'une même unité de construction composite "sod" (CBU), passant par la combinaison d'unités primaires de construction (PBU) en unités secondaires de construction (SBU) Figure I.4 : Structure de la zéolithe bêta (*BEA)
Figure I.5 : Les défauts de structure dans la zéolithe de type *BEA Figure I.6 : Vue de la de la zéolithe ZSM-48 (*MRE) selon [100] Figure I.7 : Structure de la zéolithe MFI
Figure I.8 : Mécanisme de formation des zéolithes à partir d'espèces dissoutes issues de la phase amorphe ou par le réarrangement de cette phase amorphe
Figure I.9 : Entités silicates présentes dans le système TPAOH-TEOS
Figure I.10 : Mécanisme général pour la synthèse de zéolithe, proposé par Cundy et Cox. En présence de monomères et oligomères en solution
Figure I.11 : Tendances observées entre les agents structurants utilisés et les zéolithes obtenues Figure I.12 : Mécanisme de synthèse de la zéolithe Silicalite-1 (MFI) en présence du cation
tétrapropylammonium, tel que proposé par Burkett et Davis
Figure I.13 : Représentation schématique de la croissance des dépôts carbonés polyaromatiques
formés à l’intérieur de la zéolithe H-*BEA Figure I.14 : Désalumination des zéolithes
Figure I.15 : Rendement en hydrocarbures C3+ en fonction du temps de réaction (h) sur les
micro- et nano) zéolithes HZSM-5
Figure I.16 : Mécanisme de synthèse de nanocristaux agglomérés en microémulsion inverse Figure I.17 : La MCM-22P, précurseur à de nombreux matériaux, selon le traitement
post-synthèse suivi
Figure I.18 : Images de MEB des cristaux de zéolithe X (FAU) à faible grossissement et de la surface d'un cristal à fort grossissement
Figure I.19 : Représentation schématique de la génération de la mésoporosité intracristalline en présence d'un organosilane et images de MEB de cristaux de zéolithe NaA synthétisés sans composé organique et en présence de l'organosilane TPHAC Figure I.20 : Représentation du di (tripropylammonium) comportant un espaceur à 6 atomes de
carbone L'espaceur permet aux fonctions structurantes d'occuper les sites de structuration au sein de la zéolithe de type structural MFI
Figure I.21 : Vue d'un nanofeuillet de zéolithe ZSM-5 (MFI) structuré par le composé C22
-N+(C1)2-C6-N+(C1)2-C6 (rouge:azote) selon le plan (a,b)et clichés obtenus par MEB
de la morphologie rose des sable du matériau et par MET de l'alternance de nanofeuillets et de couches micellaires
vii
Figure II.1 : Les bandes de structure de *BEA zéolithe
Figure II.2 : Représentation de l'allure des six isothermes d'adsorption et de désorption telles qu'elles sont répertoriées dans la classification de l'IUPAC
Figure II.3 : Exemple de profil TPD-NH3d’une zéolithe HZSM-5 conventionnelle et
hiérarchisée
Figure II.4 : Vue en coupe du réacteur chargé
Figure II.5 : Dispositif expérimental utilisé pour la transformation d’éthanol
Figure II.6 : Programmation de la température de chauffage du four du chromatographe Figure II.7 : Exemple d’un chromatogramme d’une analyse en ligne
Figure II.8 : Méthodes de caractérisation du catalyseur frais, du catalyseur coké et du « coke », et informations obtenues
Figure II.9 : Schéma simplifié d’extraction automatique du coke externe sur catalyseurs désactivés après réaction
Figure II.10 : Programme de température de chauffage de la colonne
Figure II.11 : Programme de température de régénération des catalyseurs « cokés »: Analyse thermogravimétrique (ATG)
Figure II.12 : Protocole de calcination des catalyseurs bifonctionnels
Figure II.13 : Programmation de la température de chauffage du four du chromatographe Figure II.14 : Exemple d’un chromatogramme des produits de conversion du n-C16
Chapitre III
Figure III.1 : Représentation de l’agent structurant N-1utilisé pour la synthèse des nanoéponges bêta (NE-1)
Figure III.2 : Représentation de l’agent structurant N-2utilisé pour la synthèse des nanoéponges bêta (NE-2)
Figure III.3 : Représentation de l’agent structurant N-3utilisé pour la synthèse des nanoéponges bêta (NE-3)
Figure III.4 : Courbes ATG des zéolithes NE brutes de synthèse
Figure III.5 : Diffractogrammes de rayons X aux grandes angles des zéolithes bêta calcinées Figure III.6 : Modèles calculés de l’inter-croissance du polymorphe A (*BEA) et du polymorphe
B dans la zéolithe bêta, en utilisant le logiciel DIFFaX
Figure III.7 : Diffractogrammes de rayons X aux bas angles des zéolithes NE calcinées Figure III.8 : Clichés MEB des zéolithes bêta calcinées
Figure III.9 : Clichés MET des zéolithes bêta calcinées Figure III.10 : Image d’éponge de mer
Figure III.11 : Isothermes d’adsorption et de désorption du diazote de la série bêta.
Figure III.12 : Distributions en taille de pores calculées par la méthode DFT pour les zéolithes bêta calcinées
viii NE-3)
Figure III.15 : Figure XPS de la série de zéolithes bêta calcinées
Figure III.16 : Diffractogrammes de rayons X aux grandes angles des échantillons obtenus après 4 et 7 jours de cristallisation
Figure III.17 : Détermination des polytypes dans les zéolithes *MRE synthétisées Figure III.18 : Hexaméthonium
Figure III.19 : Isothermes d’adsorption et de désorption de diazote à – 196 °C des echnatillons calcinés après 4 et 7 jours de cristallisation
Figure III.20 : Isothermes d’adsorption et de désorption de diazote à – 196 °C obtenus par Choi et
Figure III.21 : Clichés MET des zéolithes calcinées obtenus après 4 et 7 jours de cristallisation
Chapitre IV
Figure IV.1 : IR spectra of degassed micron-sized crystal (MC), nanometer-sized crystal (NC) and nano-sponge (NS) *BEA-type zeolites., and OH acid bands interacting with pyridine at 150 °C
Figure IV.2 : Weight yields of C2H4, DEE and C3+ hydrocarbons as a function of conversion
for micro-crystal, nano-crystal and nano-sponge *BEA-type zeolites
Figure IV.3 : Ethanol transformation at 350 °C and 3.0 MPa: Ethanol conversion, weight yields of C2H4 ,DEE and C3+ hydrocarbons as a function of time-on-stream, for
micron-sized crystal, nanometer-micron-sized crystal and nano-sponge *BEA-type zeolites
Figure IV.4 : Influence of pyridine adsorption at 150 C on the intensity of bands of coke (1700-1300 cm-1) over the NC and NS samples coked for 24 h. Difference spectra before and after pyridine adsorption
Figure IV.5 : Light-off curves and their derived for micron-sized crystal, nanometer-sized crystal (and nano-sponge spent *BEA-type catalysts during a temperature programmed oxidation (10 % O2/He) of coke
Chapitre V
Figure V.1 : Alkane hydroisomerization scheme: 2, 4, 6 chemical steps and 1, 3, 5, 7 diffusion steps
Figure V.2 : OH acid bands of degassed *BEA series
Figure V.3 : IR Spectra of BEA series interacting with ammonia at 50 °C FigureV.4 : IR Spectra of BEA series interacting with pyridine at 150 °C Figure V.5 : Ammonia TPD of BEA series
Figure V.6 : IR Spectra of BEA series interacting with CO at -196 °C
Figure V.7 The localisation of the actives sites in the micron and nanosponge *BEA zeolite Figure V.8 : IR Spectra of Pt/BEA series interacting with CO at 25 °C
Figure V.9 : Representative transmission electron microscopy images of 2.2Pt/MC(23), 1.8Pt/NC(23) and 1.4Pt/NS(22) catalysts
ix
as a function of conversion on the 1.4Pt/NS(22) catalyst Figure V.12 : Yields into: isomers cracking products , monobranched , and multibranched
isomers as a function of conversion on a series of bifunctional catalysts. Catalytic tests carried out by changing temperature (220-250 °C) and WHSV (2-100 h-1)
Synthèse et Perspectives
Figure VI.1 : Représentation de l’agent structurant N-1utilisé pour la synthèse des nanoéponges bêta (NE-1)
Figure VI.2 : Impact de la diminution de la taille des cristaux de zéolithe bêta sur : les volumes microporeux et mésoporeux calculés à partir des isothermes d’adsorption et
désorption d’azote à -196 °C, les proportions de sites théoriques neutralisés par la pyridine et l’ammoniac, les proportions en sites forts et faibles déterminées par l’adsorption de CO à -196 °C,la fréquence de rotation en hydroisomérisation du
n-C16 calculée à partir des sites acides déterminés par la pyridine), et du calcul du
nombre de site acide fort , le nombre de site acide efficace rencontré lors de
l’hydrosiomérisation du n-C16 et la masse molaire du coke formé lors de la réaction de transformation de l’éthanol
x
Chapitre I
Tableau I.1 : Polymorphes de la zéolithe bêtaTableau I.2 : Zéolithes nanométriques synthétisées à partir de solutions claires Tableau I.3 : Zéolithes nanométriques synthétisées à partir de gels fortement alcalins Tableau I.4 : Zéolithes nanométriques synthétisées par l’utilisation de matrices poreuses Tableau I.5 : Zéolithes nanométriques synthétisées par microémulsion inverse
Tableau I.6 : Matériaux zéolithiques synthétisés à partir de précurseurs lamellaires
Tableau I.7 : Zéolithes synthétisées en présence de composés organiques inhibiteurs de croissance
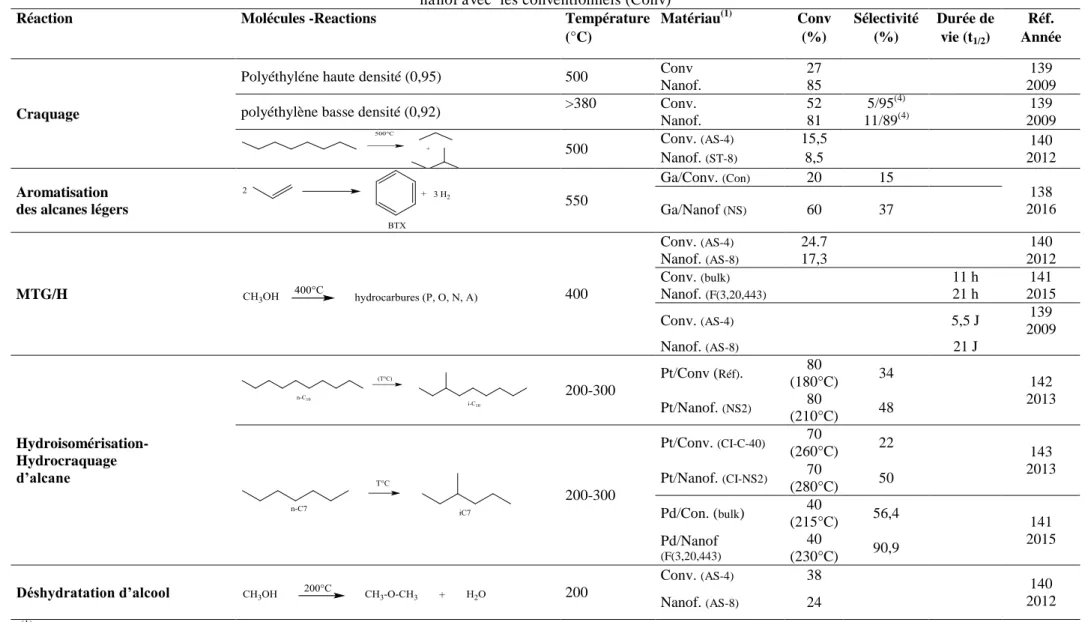
Tableau I.8 : Comparaion des performances catalytiques dans les réactions de pétrochimie des catalyseurs à base de nanofeuillets de zéolithe ZSM-5 (MFI)-nanof avec les conventionnels (Conv)
Tableau I.9 : Performances catalytiques de catalyseur à base de nanofeuillets de zéolithe ZSM-5 (MFI)-nanof dans les réactions de chimie fine
Tableau I.10 : Performances catalytiques de catalyseur à base de nanoéponges de zéolithe BEA (MFI)-nanof dans diverses réactions
Chapitre II
Tableau II.1 : Caractérisation physico-chimique des catalyseurs zéolithiques. Techniques, et informations obtenues
Tableau II.2 : Récapitulatifs des conditions d’enregistrement des spectres RMN Tableau II.3 : Conditions opératoires standard
Tableau II.4 : Caractéristiques des colonnes Tableau II.5 : Conditions d’analyse
Tableau II.6 : Conditions d’analyse du « coke » en GC-MS Tableau II.7 : Conditions opératoires standard
Tableau II.8 : Conditions d’analyse
Chapitre III
Tableau III.1 : Quantités de réactifs utilisés pour la synthèse des microcristaux Tableau III.2 : Réactions impliquées dans la synthèse des agents bifonctionnels
Tableau III.3 : Récapitulatif des conditions opératoires pour la synthèse des zéolithes bêta Tableau III.4 : Morphologie et taille des cristaux de zéolithe bêta
xi
Tableau III.8 : Liste des différents protocoles de synthèse
Tableau III.9 : Récapitulatif des conditions opératoires pour différents synthèses des nanoéponges de bêta avec différents rapports Si/Al
Tableau III.10 : Composition chimique et structure et propriétés texturales des zéolithes synthétisées
Chapitre IV
Tableau IV.1 : Selected characteristics of micron-sized-crystal (MC), nanometer-sized crystal (NC) and nano-sponge (NS) *BEA-type zeolites
Tableau IV.2 : Distribution of internal and external coke on spent micron-sized crystal (MC), nanometer-sized crystal (NC) and nano-sponge (NS) *BEA-type zeolites drawn from residual pore volumes and acidities as well as from composition and content of coke
Tableau IV.3 : Molecular soluble coke composition determined by GC-MS after digestion of the coked *BEA zeolites
Chapitre V
Tableau V.1 : Acidic properties of micron-sized (MC), sub-micron-sized (SC), nanometer-sized (NC) crystals and nanosponge (NS) *BEA-type zeolites
Tableau V.2 : Values of OH group’s frequency down shift (Δ ) due to the interaction with CO and proton affinities (PA) calculated according to PA =2254.8-44β.5 log (Δ ) Tableau V.3 : Physicochemical characteristics of the bifunctional catalysts: Pt dispersion
(D) estimated by CO chemisorption, concentration of accessible Pt atoms (CPt), average diameter of platinum particles (dPt) and balance between
hydrogenating and acid functions (CPt/[PyH+)
Tableau V.4 : Activities values measured at 220 °C per gram of catalyst and per acid sites (TOF, and of the initial ratios between cracking and isomerization products (C/I)0
and between multibranched and monobranched isomers (B/M)0. nas, number of
i
1
Les zéolithes sont des matériaux à la fois fascinants et utiles mais pour l’homme de la rue ce sont des vedettes méconnues. Les propriétés remarquables de ces solides microporeux sont mises à profit au quotidien dans des domaines nombreux et variés que sont l’énergie, la remédiation et les commodités. Elles procurent à nos sociétés combustibles, carburants de qualité, et de nombreux précurseurs de polymères et médicaments, etc. Les applications sont nombreuses allant de la détergence (composant des lessives pour l’adoucissement de l’eau par échange des cations calcium et magnésium), au séchage du gaz naturel de l’air (double-vitrages), à la purification-séparation d’isomères (tamisage moléculaire), de l’oxygène de l’air par adsorption en passant aussi par la catalyse. Si le domaine de la détergence représente plus de 70 % de la consommation totale de zéolithe, la catalyse est le secteur pour lequel le chiffre
d’affaire est le plus important. En effet les zéolithes sont devenues en 60 ans les catalyseurs les plus employés en raffinage du pétrole. C’est ainsi qu’il existe une multitude de procédés
utilisant des catalyseurs zéolithiques spécifiques à chacune des coupes pétrolières. Les zéolithes sont également très employées en pétrochimie permettant la production de
molécules plateformes comme les aromatiques essentielles pour l’industrie chimique. Qui
plus est, elles prennent peu à peu une place de choix dans les domaines de la remédiation
(dépollution automobile, de l’air, de l’eau et du sol), de la chimie fine voire maintenant de la chimie verte, et participe à l’essor du mix énergétique.
Un tel succès vient à coup sûr de leur structure poreuse dans laquelle sont situés la plupart des sites catalytiques et où se produisent les réactions. Ce matériau constitué de cages et de canaux dont les tailles sont très proches des molécules organiques usuelles, peut être considéré comme un nanoréacteur. La vitesse, la stabilité et la sélectivité des transformations catalytiques sont non seulement déterminées par les caractéristiques des centres actifs, par la taille et la forme de ses nanoréacteurs et de leurs ouvertures. La deuxième raison du succès des zéolithes tient en la possibilité de modifier aisément leur morphologie, leur composition, leur porosité, mais également de leur associer dans la localisation souhaitée et sous la forme voulue des espèces actives. La structure microporeuse des zéolithes siège de la réaction catalytique apporte alors une sélectivité de forme, un tamisage moléculaire et un effet de confinement favorable à la réaction catalytique à la condition sine qua none que la diffusion des réactifs et des produits ne soient pas limitant.
La présence de limitations diffusionnelles de matière au sein des zéolithes peut provoquer une diminution de la vitesse si la réaction est endothermique, et une augmentation si elle est exothermique. Elles peuvent impacter aussi la stabilité. En effet si le poison est
2
transport ou transformation dans les pores des molécules précurseurs. Si la formation du poison est cinétiquement limitée par les étapes chimiques, le poison est uniformément distribué dans le grain, si elle est limitée par le transport intragranulaire, le poison est localisé préférentiellement sur la couronne externe du grain. Ces limitations diffusionnelles peuvent être évitées en optimisant les conditions réactionnelles, et si cela n’est pas possible en adaptant les propriétés texturales du matériau via la création de mésopores interconnectés aux micropores afin de faciliter le transport de matière des réactifs et des produits. Deux écoles existent pour la conception de zéolithe hiérarchisée, directement par la synthèse ou par modification post-synthèse. La synthèse directe de zéolithe hiérachisée micro-et mesoporeuses (mesostructurée) est une voie à explorer et à privilégier car elle peut permettre
d’atteindre des tailles de cristaux de seulement quelques nanomètres.
Le but de ce travail est d'évaluer l'impact de la forte réduction de cristaux de la zéolithe *BEA sur les propriétés catalytiques (activité, sélectivité et stabilité). Pour cela, des zéolithes de différentes tailles (4nm à 10 µm) ont été synthétisées et caractérisées (Chapitre III) par de nombreuses techniques physicochimiques (RMN du solide, XPS, TEM, MEB, Adsorption-Désorption N2, NH3 et de pyridine, etc.). Le principe et les conditions opératoires
utilisées pour chacune des techniques sont détaillés dans le chapitre II. L’impact de la forte
réduction de l’épaisseur des cristaux de la zéolithe *BEA sur les propriétés catalytiques a été
étudiée sur deux réactions modèles et font l’objet chacun d’un chapitre (chapitre IV et V).
La première concerne la transformation de l’éthanol en hydrocarbures. Cette réaction qui nécessite un catalyseur acide, a pour objectif d’évaluer la stabilité ou plutôt la résistance
au coke, poison formé lors de la réaction. Le but final étant de déterminer si la toxicité du coke change avec les propriétés texturales des divers matériaux synthétisés. Pour cela il est nécessaire de caractériser les catalyseurs cokés et les espèces désactivantes à savoir le coke.
La deuxième réaction, l’hydrosiomérisation du n-hexadécane, nécessite quant à elle
une fonction déhydro-hydrogénant, supplémentaire via l’ajout de platine. Cette réaction sous
pression d’hydrogène permet de caractériser l’activité des sites protoniques. L’avantage d’utiliser cette réaction modèle contrairement aux réactions modèles faisant intervenir une
catalyse purement acide comme le craquage du n-hexane, est avant tout l’absence de désactivation par le coke. Ce chapitre confrontera les caractérisations des sites acides en termes de nombre, nature, force et localisation obtenue via l’utilisation de nombreuses techniques physicochimiques et par celle obtenue via la réaction modèle.
1
Ce chapitre est consacré à l'étude de la bibliographie portant sur le domaine des zéolithes et de leurs applications en catalyse. Après une première partie générale sur les principes et mécanismes de synthèse des zéolithes, nous démontrerons que les limitations diffusionnelles induites par la microporosité de ces matériaux impacte négativement,
l’activité, la sélectivité et la stabilité de ces catalyseurs acides. Les différents outils
développés pour limiter les contraintes diffusionnelles seront discutés. Parmi eux, la diminution de la taille des cristaux à l’échelle nanométrique s’avère être la voie à privilégier. Les moyens et méthodes utilisés pour la synthèse de nanocristaux zéolithiques seront par la suite détaillés et une attention sera portée sur l’utilisation de composés organiques inhibiteurs de croissance, et plus particulièrement sur les composés bifonctionnels. Ces derniers conduisent à la formation de zéolithes hiérachisées, le chemin diffusionnel se limite alors à quelques nanomètres. Un état de l’art sur les performances des zéolithes hiérachisées (nanofeuillets et nanoéponges) catalyseurs acides potentiellement exempts de contraintes diffusionnelles, permettra d’identifier d’un part quelles sont leurs limites et d’autre part quelles sont les réactions modèles les plus adéquates pour les caractériser.
Chapitre I
3
I. Généralités sur les solides microporeux cristallisés
I.1. Structure, propriétés et composition chimique des zéolithes
Les zéolithes, également appelées tamis moléculaires, sont définies comme étant des solides microporeux et cristallisés appartenant à la famille des tectosilicates. Leur structure particulière est liée à la combinaison polymérique régulière d'unités de construction primaire (Primary Building Unit, PBU), de géométrie tétraédrique. Chaque atome d'oxygène, formant les sommets de ces tétraèdres, est relié à deux atomes d'éléments T trivalents ou tétravalents situés au centre du tétraèdre (enchaînement O-T-O-T-O, illustré sur la Figure I.1) : ainsi, le rapport O/T est rigoureusement égal à 2.
Figure I.1 : Combinaison polymérique d'unités de construction primaires (PBU)
Historiquement, les zéolithes sont des aluminosilicates hydratés, de formule chimique générale :
|My/q(H2O)z| [SixAlyO2(x+y)] ; avec q = 1 ou 2 et x/y ≥ 1 (eq.1)
- M représentant les cations alcalins (Na+, K+), alcalino-terreux (Ca2+, Mg2+), voire les protons compensant les charges induites par la présence de tétraèdres trivalents AlO4- au sein
de la charpente zéolithique ;
- q étant la charge électronique de M ; - z étant la quantité d'eau physisorbée.
Les tétraèdres tétravalents SiO4 possèdent, quant à eux, une charge électronique nulle
et ne contribuent donc pas à la charge globale de la charpente. Le rapport atomique Si/Al, définissant l'acidité intrinsèque de la zéolithe, est dans tous les cas supérieur à 1. Ceci s'explique par un différentiel d'énergie évalué à 60 kJ/mol lorsque deux tétraèdres AlO4- sont
adjacents, comparativement à une alternance de tétraèdres AlO4- et SiO4.1 Ce cas est donc peu
4
Aujourd'hui, cette définition a été élargie à tout solide microporeux cristallisé à base d'oxyde de silicium et dont une partie des atomes de silicium a été remplacée par des atomes d'éléments trivalents (Al, Fe, B, Ga...), tétravalents (Ge, Ti, Zr...) voire pentavalents (P, As) : ces matériaux sont alors appelés "zéotypes".3-5 La combinaison de ces différentes SBU, aux longueurs et angles de liaison T-O-T variées (145° pour Si-O-Si contre 130° pour Ge-O-Ge), permet la formation de nombreuses unités de construction secondaires différentes (Secondary Building Unit, SBU). Ainsi, en 2007, 23 SBU différentes ont été répertoriées (Figure I.2), dont certaines mises en évidence en solution par la spectroscopie RMN 29Si.6
Figure I.2: Les 23 unités de construction secondaires (SBU) répertoriées.7 Chaque arête correspond à une liaison T-O. Leur fréquence d'apparition est indiquée entre parenthèses
Ces SBU peuvent se recombiner entre elles en formant une des 47 unités de construction composites (Composite Building Unit, CBU), précurseurs des zéotypes. Au final, l'assemblage périodique de ces CBU avec d'autres SBU et/ou CBU conduit à la formation de structures, caractérisées par un réseau poreux unique constitué de canaux et de cavités aux morphologies et tailles calibrées (de 0,3 à 1,5 nm, jusqu'à 2,0 nm dans le cas de germanosilicates ou métallophosphates).8-10 La Figure I.3 illustre ces différentes étapes.
À l'heure actuelle 231 types structuraux zéolithiques, naturels ou synthétiques, ont été découverts.12 À chacune de ces structures est attribué un code mnémonique composé de trois lettres et proposé par la Commission des Structures de l'International Zeolite Association (IZA). Un astérisque est ajouté devant le code mnémonique dans le cas où il s'agit d'une structure zéolithique comportant des défauts structuraux, et un tiret est placé à la suite de ce code afin d'indiquer que la structure de la zéolithe est interrompue.
5
Figure I.3: Formation des zéolithes de type structural FAU, LTA et SOD à partir d'une même unité de construction composite "sod" (CBU), passant par la combinaison d'unités primaires de construction
(PBU) en unités secondaires de construction (SBU)
Ces matériaux sont reconnus pour avoir des surfaces spécifiques allant jusqu'à 900 m²/g et un volume microporeux pouvant atteindre 0,3 cm3/g. De plus, ils possèdent en général une bonne stabilité thermique, pouvant atteindre des températures supérieures à 700 °C. Dans le cas des zéolithes, le rapport Si/Al dirige non seulement l'acidité intrinsèque du matériau, mais également sa polarité. Une dernière propriété différencie les zéotypes des autres matériaux : il s'agit de leur densité de squelette (Framework Density, FD), définie comme le nombre d'atomes T contenus dans 1000 Å.11 Contrairement aux phases denses qui possèdent une FD supérieure à 21, la valeur de la FD d'une zéolithe varie entre 12,1 et 20,6 pour les structures les plus ouvertes. Cette valeur dépend du volume poreux du matériau, mais n'est pas nécessairement proportionnelle à la taille des ouvertures de pores.
I.2. Exemples de structure zéolithique
Trois exemples de zéolithe, une à larges pores (Bêta de type structural *BEA) et deux à tailles de pores intermédiaires la ZSM-5 de type structural MFI et la ZSM-48 de type structural *MRE sont présentés dans cette partie.
I.2.1. La zéolithe Bêta de type structural *BEA
La zéolithe de type *BEA est un composé alumino-silicaté qui a été synthétisé pour la
première fois en 1λ67 par Wadlinger, Kerr et Rosinski à partir d’un gel aluminosilicaté en
milieu basique (NaOH) et en présence de cation tétraéthylammonium. Le rapport silice/alumine de la charpente de cette zéolithe est compris entre 10 et 200.13 La structure de la
zéolithe bêta, en raison de sa complexité, n’a été élucidée que β1 ans après sa découverte,
simultanément par deux équipes : Newsam et al. (1988), et Higgins et al. (1988).14-15 La détermination de la structure est le fruit des informations procurées par la microscopie électronique haute résolution, la diffraction de rayons X et de la modélisation assistée par
6
ordinateur. La zéolithe bêta résulte de l’intercroissance de deux structures voisines
(polymorphes), chacune pourvue d’un système tridimentionnelle de pores formés de cycle à
1β tétraèdres. L’une des structures est de symétrie tétragonale, (polytype A), et l’autre est de
la symétrie monoclinique (polytype B).16-17 Les différents polymorphes proposés sont donnés dans le tableau I.1.
Tableau I.1: Polymorphes de la zéolithe bêta.18-19
Polymorphe Groupe d’espace Paramètres de la maille cristalline Type de canaux à 12 MR A (BEA) P4122 ou P4322 a=b=1,26 nm c=2,64 nm 2 linéaires 1 sinusoïdal B C2/c a=b=1,79 nm c=1,43 nm =114,8° 2 linéaires 1 sinusoïdal CN (BEC) P42/mmc a=b=1,28 nm c=1,30 nm 3 linéaires CH P2/c a=b=1,79 nm c=1,43 nm =114,8° 2 linéaires 1 sinusoïdal DN P2/m a=b=1,28 nm c=1,38 nm =108,4° 3 linéaires a. Structure vue [010]
b. Taille des ouvertures des canaux à 12 atomes T. Vue < 100>
c. Taille des ouvertures des canaux à 12 atomes T. Vue [001] Figure I.4: Structure de la zéolithe bêta (*BEA).21
7
La zéolithe *BEA possède un système tridimensionnel de canaux avec une ouverture de canaux à douze atomes T. 16-17 (Figure I.4.a). Deux types de canaux sont interconnectés. Le premier type est constitué par deux systèmes de canaux linéaires parallèles à l’axe <100> de la maille quadratique, les ouvertures sont ellipsoïdales et de taille 0,64 nm x 0,76 nm (Figure I.4.b). Le deuxième type correspondant à un système de canaux et parallèles à l’axe
[001], d’ouverture 0,55 nm x 0,55 nm (Figure I.4.c).16-17,20
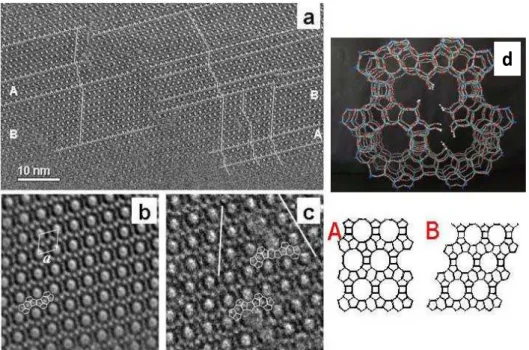
La figure I.5 présente les deux polymorphes A et B de la zéolithe *BEA et illustre la formation de défauts de structure. Les images HRTEM, enregistrées le long de la direction [100] de la zéolithe bêta, montrent la présence de pore à 12 MR (gros points blancs) entourée de pores à 4, 5, et 6 MR (petits points blancs) figure I.5.b. Il a été constaté que les deux polymorphes A et B inter-croient ensemble et forment de nombreux défauts disposés d’une façon désordonnée.22 La figure I.5.c montre l’existence de nombreux doubles pores d’une taille équivalente environ à celle d’un pore à 17 MR ou 15 MR.
Figure I.5: Les défauts de structure dans la zéolithe de type *BEA.22
I.2.2. La zéolithe ZSM-48 de type structural *MRE
La zéolithe ZSM-48 a été découverte comme impureté pendant la synthèse de la zéolithe ZSM-39. 23 En effet, des bâtonnets fibreux de 1 µm de diamètre et 4 à 5 µm de longueur ont été observés en train de croître épitaxialement sur la face octaédrique des cristaux de ZSM-39. La forme pure de la zéolithe ZSM-48 a été obtenue plus tard par Chu 24 par voie hydrothermale en utilisant un mélange réactionnel contenant de la silice, un peu
d’alumine, du chlrorure de tétraméthylammonium, du n-propylamine ainsi qu’une source
d
8
d’ions OH
-. Trois jours de synthèse hydrothermale à 100-200 °C ont été nécessaires pour obtenir le produit cristallisé. Cette zéolithe est décrite comme riche en silicium avec une symétrie orthorhombique ou pseudo-orthorhombique.25 En 1985, Schlenker et al. ont décrit la zéolithe ZSM-48 comme une structure désordonnée résultante de l’association de plusieurs feuillets de zéolithe de type FER reliées entre eux par des ponts entre les oxygènes situés dans les plans miroirs.25 La figure I.6 présente une vue de la structure poreuse de cette zéolithe selon la direction [100]. Cette dernière est constituée d’un réseau monodimensionnel
composé de canaux cylindriques interconnectés, dont l’ouverture est comprise entre 0,5γ et
0,56 nm. La charpente de la zéolithe ZSM-48 est moins ouverte que celle de la zéolithe bêta.
Figure I.6: Vue de la de la zéolithe ZSM-48 (*MRE) selon [100]
Une nouvelle description du désordre dans la zéolithe ZSM-48 a été donnée par Lobo et al. 26 En 2002ils ont montré que la zéolithe ZSM-48 correspondait à une famille de matériaux
constituée de pores tubulaires. Les pores sont formés de feuillets roulés en nid d’abeille.
L'ouverture de ces pores est constituée de 10 atomes T. Les pores voisins sont reliés par un décalage du zéro le long de la direction des pores ou par un décalage de la moitié de la distance de répétition le long de la direction de pores (~ 0,05 nm x 0,84 nm). D'autres dimères T-T remplissent les espaces entre les tubes. L’utilisation des différents degrés de désordre, les diffractogrammes de rayons X d'une variété d'échantillons de ZSM-48 peuvent être simulés (9 polymorphes sont possibles). Contrairement aux publications précédentes sur ZSM-48, il est constaté que certains matériaux peuvent être très ordonnés, d'autres présentent des défauts essentiellement dans le plan, et d'autres sont mieux décrits par un empilement 2D (désordre) des pores tubulaires.67 La topologie locale des pores est la même dans tous les modèles (désordonnés), et le désordre ne bloque pas les pores. Les différences dans les propriétés
9
catalytiques sont probablement dues à des différences dans la morphologie et la taille des cristaux et ainsi que la répartition de l'aluminium dans la charpente.
I.2.3. La zéolithe ZSM-5 de type structural MFI
Les zéolithes de type structural MFI, dans leur forme brute de synthèse (contenant le
structurant organique), cristallisent dans le système orthorhombique (groupe d’espace Pnma).
La maille élémentaire de cette structure contient 96 tétraèdres TO4 répartis sur 12 sites
cristallographiques non équivalents, chaque site ayant une multiplicité de 8. La structure
cristalline d’une zéolithe de type structural MFI est présentée en figure I.7. La structure de la MFI est basée sur une unité structurale appelée unité pentasil. L’association de ces unités pentasil conduit à la formation de chaînes, qui sont disposées symétriquement par rapport à un
plan et génèrent des feuillets. Si l’opération qui relie ces différents feuillets entre eux est un centre d’inversion, la structure de type MFI est alors obtenue. L’arrangement spatial de ces
réseaux de couches génère au sein du matériau une microporosité. Elle est composée de
canaux droits parallèles à l’axe [010] interconnectés entre eux par des canaux sinusoïdaux
orientés selon l’axe [100]. Dans le cas de la zéolithe ZSM-5, les canaux droits et sinusoïdaux
ont une ouverture elliptique respectivement de l’ordre de 0,5γ nm x 0,56 nm et 0,51 nm x 0,55
nm. En revanche pour la silicalite-1, les canaux sinusoïdaux deviennent quasiment
cylindriques avec un diamètre d’ouverture de l’ordre de 0,5γ nm. Les longueurs des canaux
droits et sinusoïdaux, estimées à partir des données de Flanigen, sont respectivement de
l’ordre de γ,λ6 et β,66 nm. L’intersection entre ces deux types de canaux donne naissance à
une cavité quasi-sphérique dont le diamètre est de l’ordre de 0,8 à 0,λ nm. Il y a quatre cavités de ce type par maille élémentaire.
10
a. Structure vue [010]
b. Ouverture 10 atomes T, vue [100]
c. Ouverture 10 atomes T, vue [010] Figure I.7: Structure de la zéolithe MFI
11
II. La synthèse de zéolithe
II.1. Principes et mécanismes de synthèse
Les zéolithes synthétiques sont principalement obtenues par chauffage sous pression autogène d'un système réactionnel binaire, appelé hydrogel, comportant une phase solide et une phase liquide. Cet hydrogel comprend systématiquement un solvant, une ou plusieurs sources d'éléments T réactives, à savoir habituellement des oxydes ou hydroxydes amorphes nécessaires à l'édification de la charpente zéolithique et un agent minéralisateur. Le solvant est généralement l'eau : la synthèse est alors réalisée dans des conditions dites hydrothermales. L'agent minéralisateur est majoritairement l'anion hydroxyde, ou l'anion fluorure. Il est également possible d'inclure un ou plusieurs cations alcalins ou alcalino-terreux ainsi que différents agents structurants. Chaque zéolithe possède un domaine de composition d'hydrogel défini, parfois très étroit. En outre le pH du milieu réactionnel, la température ainsi que la durée de synthèse apparaissent comme des facteurs prépondérants.
Deux mécanismes de synthèse, longtemps admis, ont été proposés au cours des années 1960. Le premier, par Barrer, implique que la nucléation ainsi que la croissance des nucléi prennent place en solution, par la combinaison de monomères et oligomères siliciques, aluminiques et aluminosiliciques issus de la dissolution progressive de la phase amorphe du gel.36 Selon ce mécanisme, cette phase amorphe sert de réservoir à éléments réactifs, et le minéralisateur permet de contrôler sa dissolution et donc la continuité de l'alimentation de la solution en éléments. Ce mécanisme est représenté figure I.8.a.
Le deuxième mécanisme, avancé par Flanigen et Breck, propose que la formation du réseau cristallin résulte du réarrangement in situ des éléments composant la phase amorphe. La nucléation s'initie au sein de cette phase et les cristaux se forment suivant une transformation dite solide-solide.37 Ce deuxième mécanisme est représenté sur la figure I.8.b.
12
Figure I.8: Mécanisme de formation des zéolithes à partir d'espèces dissoutes issues de la phase amorphe (a) ou par le réarrangement de cette phase amorphe (b)38
Des travaux ultérieurs de Kerr, Ciric puis Zhdanov, semblent corroborer le mécanisme proposé par Barrer. En séparant la phase amorphe des nucléi formés au cours de la cristallisation de la zéolithe A (LTA), puis en faisant circuler le solvant contenant l'agent minéralisateur d'une phase solide à l'autre, Kerr a souligné le rôle majeur de la solution dans le transport des éléments dissouts.39 Ciric s'est, quant à lui, attaché à étudier la cinétique de cristallisation de la zéolithe A (LTA), confortant l'hypothèse selon laquelle des unités anioniques TO4 seraient présentes dans le milieu de synthèse.40 Zhdanov avance, à la manière
de Barrer, que la phase amorphe a un rôle de réservoir en équilibre avec la phase liquide. Selon lui, la phase solide est dissoute sous l'action de la chaleur et de l'agent minéralisateur et libère ainsi des espèces solubles, consommées lors de la formation des nucléi et leur croissance.41
Figure I.9: Entités silicates présentes dans le système TPAOH-TEOS, a) pentamère bicyclique, b) octamère pentacyclique, c) undécamère tétracyclique, d) "trimère", et e) "nanoslab" (gauche). Présentation schématique de la formation puis de la croissance des "nanoslabs" à partir des unités
13
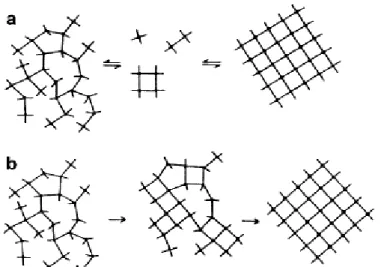
Plus récemment, les travaux de Kirschhock et al. ont mis en évidence la formation d'entités minérales à 33 atomes de silicium appelées "trimères", précurseurs de la structure MFI, dans un système TPAOH-TEOS et par la combinaison des techniques de chromatographie d'exclusion stérique (GPC), de diffractométrie de rayons X (DRX), de résonance magnétique nucléaire du silicium en milieu liquide (RMN29Si) et de spectrométrie infrarouge in situ.42-44 Ces unités trimères s'organisent en "nanoslabs", qui vont à leur tour s'organiser pour former les cristaux de zéolithe. Une représentation schématique est proposée sur la Figure I.9. Il convient de noter que ces travaux ont été réalisés dans le cadre de systèmes réactionnels relativement simples (solutions claires, systèmes purement siliciques, cations structurants tétrapropylammonium hautement sélectifs envers le type structural MFI), et ne permettent pas d'expliquer le passage des espèces inorganiques de l'état liquide à l'état cristallisé.
À la suite de ces travaux, de nouvelles hypothèses mécanistiques émergent, dont l'existence d'une phase intermédiaire : la "phase amorphe secondaire". Appuyés par plusieurs techniques de caractérisation (analyses chimiques, diffraction de rayons X, spectroscopie Raman, détection de tailles des particules), Angell et Flank ont démontré que l'obtention de zéolithes passe par une phase amorphe secondaire, formée à partir de la phase amorphe initiale par l'intermédiaire de la solution. Cette phase secondaire se dissout à son tour, libérant en solution les éléments précurseurs à la nucléation.46 Cette hypothèse sera confortée par Nicolle et al. Lors de leurs travaux sur la synthèse d'aluminosilicates en présence de cations tétraéthylammonium et sodium. En modifiant les durées de synthèse hydrothermale, ils ont mis en évidence la formation d'une phase amorphe secondaire après dissolution puis reprécipitation de la phase amorphe initiale.47 Forts de ces observations Cundy et Cox proposent, dans une revue sortie en 2005, un mécanisme général et applicable à toute synthèse hydrothermale de zéolithe est présenté sur la figure I.10.
14
Figure I.10: Mécanisme général pour la synthèse de zéolithe, proposé par Cundy et Cox. En présence de monomères et oligomères en solution, un fragment de phase amorphe initiale (a) va se réorganiser et développer un ordre local, laissant place à une phase amorphe secondaire (b). Cet ordre local va
s'étendre, initiant les étapes de nucléation et de croissance (c). Enfin, à l'issue de cycles de dissolution/recristallisation, la matière amorphe disparait totalement pour laisser place aux cristaux
zéolithiques (d)45
Une phase amorphe initiale est obtenue immédiatement après ajout des sources d'éléments T. Ce solide, à la constitution hétérogène, subit une réorganisation par le biais d'échanges de monomères et d'oligomères (PBU, SBU et CBU) avec la phase liquide : cette première étape, appelée communément mûrissement et souvent réalisée à température ambiante, mène à l'obtention de la phase amorphe secondaire. Les cations et agents structurants présents dans le milieu réactionnel influencent l'organisation de cette nouvelle phase. De fait, sa formation s'accompagne d'une distribution statistique de zones possédant un ordre local, sans qu'il n'y ait création de réseau périodique. Leur concentration va augmenter jusqu'à atteindre une valeur critique, initiant les étapes de nucléation et de croissance.
Lors de la nucléation, la structure définie localement va se propager. Sa cinétique est dépendante du degré de conversion du solide amorphe en structure périodique et de la
15
température du milieu de synthèse (phénomène activé). Cette étape est orientée préférentiellement par la présence d'agents structurants. Les nucléi formés, ou germes cristallins, sont sensibles au phénomène de croissance prenant place à l'interface cristal/solution. De nombreux auteurs s'accordent pour dire que les mécanismes de croissance mettent en jeu des petites unités en solution venant se condenser à la surface des nucléi, telles que des monomères et oligomères, plutôt que de larges unités déjà préfabriquées. Le transport de ces unités se fait généralement par le biais de la solution. Dans le cas où la nucléation prend place au sein de la phase amorphe, des réarrangements locaux sont aussi envisagés. Dans les deux cas, le rôle des agents structurants reste prépondérant.
Selon les conditions réactionnelles utilisées et les énergies interfaciales des cristaux, une seconde étape de croissance peut avoir lieu : le mûrissement d'Ostwald, consistant en la dissolution des cristaux les plus petits au profit des plus gros en vue d'atteindre l'état thermodynamique de plus grande stabilité. Enfin, la réversibilité du système réactionnel permet aux fautes structurelles naissant lors de la croissance cristalline de se résorber, afin que la structure puisse se propager. Le contrôle des mécanismes de nucléation et de croissance permet ainsi de définir la taille finale des cristaux de zéolithe obtenue, ainsi que leur degré de cristallisation.
Ces mécanismes de synthèse mettent en avant le rôle de certains constituants du système réactionnel sans que leur influence précise n'ait été décrite en détail. De plus, le rôle des nombreux paramètres réactionnels n'a pas été considéré. Tout ceci fait l'objet des paragraphes suivants.
II.2 Le rôle particulier des agents structurants
Historiquement, les premiers agents structurants utilisés ont été des cations alcalins ou alcalino-terreux, conduisant à des zéolithes à faible rapport molaire Si/Al (1≤Si/Al≤5). Ces cations minéraux possèdent un double rôle : d'une part, ils favorisent de manière plus ou moins spécifique la formation des unités de construction secondaires et composites. Par exemple, les cations sodium hydratés dirigent préférentiellement la formation des cages sodalite et gmelinite mais aussi les unités d6R, alors que les cations baryum et potassium stabilisent les cages cancrinite.48-49 D'autre part ils permettent de compenser les charges négatives de la charpente zéolithique induite par la présence d'éléments de charpente trivalents (Al, Fe, B, Ga...). Les agents structurants organiques ont été introduits par Barrer dans les années 1960, et depuis leur utilisation s'est banalisée.
16
Ces agents structurants doivent préserver leur intégrité au cours de la synthèse : il est donc nécessaire qu'ils bénéficient d'une bonne stabilité chimique et thermique. Dans certains cas, il est cependant avantageux de générer in situ l'agent structurant à la suite de la dégradation d'un précurseur, permettant d'obtenir de nouveaux matériaux.50 Leur rôle est multiple : tout comme les cations minéraux, ils permettent de compenser les charges négatives de la charpente zéolithique, mais surtout de diriger la formation des SBU et CBU ainsi que leur assemblage au cours des étapes de nucléation et de croissance par le biais d'interactions de type Van der Waals, Coulombienne ou des liaisons hydrogène. Les agents structurants peuvent avoir un impact sur les propriétés du mélange réactionnel, en augmentant par exemple son pH lorsqu'il possède un contre-ion hydroxyde ou en modifiant la balance hydrophile/hydrophobe. Enfin, un effet dit "bloquant" peut survenir, comme illustré par Casci
et al. : par l'ajout d'une petite quantité du dication hexaméthonium dans un gel de synthèse favorable à l'obtention de la zéolithe ZSM-5 (MFI), ils ont observé la formation de mordénite et de quartz.51 La raison proviendrait de la longueur de la molécule, trop faible pour faire le lien entre deux sites interconnectés selon les canaux sinusoïdaux et résultant ainsi en une pénalité énergétique importante. Cet effet n'est pas observé lorsque le dication décaméthonium, d'une longueur similaire à la distance entre deux sites interconnectés, est utilisé.
Les agents structurants ont été classés en trois catégories par Davis et Lobo : les gabarits (templates, en anglais), les agents structurants "vrai" (structure-directing agents) et les espèces remplissant la porosité (space-fillers).52 Le cas des espèces remplissant la porosité est le plus général : ces espèces permettent de stabiliser énergétiquement une structure zéolithique formée au cours du temps (action thermodynamique).53 C'est le cas, par exemple, des 22 composés organiques différents permettant d'obtenir de la zéolithe ZSM-5 (MFI) selon les conditions réactionnelles utilisées.71 La différence entre gabarit et agent structurant "vrai" est plus subtile à appréhender. Un agent structurant "vrai" possède une grande spécificité vis-à-vis d'une structure zéolithique unique. C'est le cas, par exemple, du complexe 18-éther-couronne-6/cation sodium permettant d'obtenir la zéolithe EMC-2 (EMT)32-35 ainsi que du dérivé N,N,N-triméthylammonium de la 1-adamantine permettant d'obtenir la zéolithe SSZ-24 (AFI).55 Le gabarit, quant à lui, possède en plus une adéquation géométrique et électronique forte avec la structure formée : ce cas, très rare, peut être illustré avec la synthèse de la zéolithe ZSM-18 (MEI) en présence d'un triammonium quaternaire complexe (appelé
17
tri-quat).56-58 Par la suite, le terme d'agent structurant sera utilisé indifféremment pour ces 3 catégories de composés organiques.
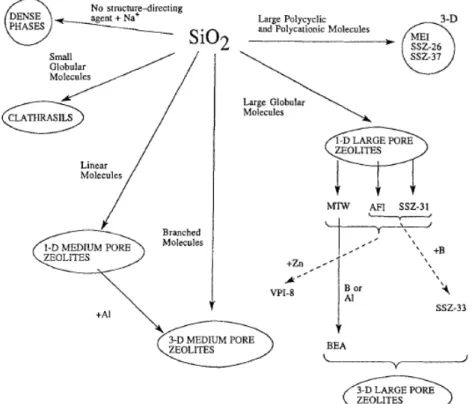
Les interactions agent structurant-zéolithe ne sont pas uniquement dépendantes de critères morphologiques. Cependant, des travaux initiés par Gies et Marler sur les clathrasils et zeosils,60 repris par Davis et al.,59 tendent à montrer qu'il est possible de prédire le type de structure obtenue en fonction de l'agent structurant utilisé dans des systèmes simples. Un résumé schématique est proposé sur la figure I.11.
Figure I.11: Tendances observées entre les agents structurants utilisés et les zéolithes obtenues59
Ainsi, les molécules linéaires favorisent l'obtention de structures zéolithiques unidimensionnelles, possédant un système poreux non connecté, contrairement aux molécules ramifiées promouvant la création d'une porosité bi- voire tridimensionnelle et interconnectée. Les molécules encombrées permettent quant à elles l'obtention de larges canaux ou cages.
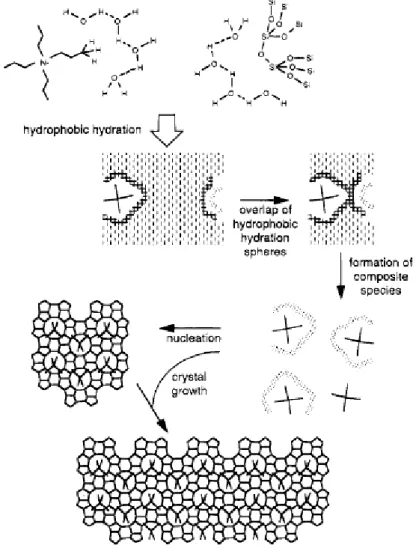
Une dernière notion, qui est celle de balance hydrophile/hydrophobe, est illustrée par les travaux de Burkett et Davis sur la synthèse de la zéolithe Silicalite-1 (MFI) en présence de cation tétrapropylammonium (TPA+) comme agent structurant. Selon les auteurs, l'espèce organique ne doit pas être trop hydrophile pour être capable de présenter des propriétés structurantes : ils introduisent ainsi le concept "d'hydratation hydrophobe".61-63 De manière schématique l'agent structurant s'entoure dans un premier temps d'une sphère d'hydratation par le biais de liaisons hydrogène. Si les molécules d'eau possèdent une affinité trop forte envers
18
l'agent structurant, elles ne peuvent pas être remplacées au cours de la synthèse par les monomères et oligomères présents dans le milieu réactionnel, inhibant le pouvoir structurant de l'espèce organique. Mais si l'hydrophilie de l'agent structurant est moindre, cette substitution peut avoir lieu et servir de point de départ à la formation de germes zéolitiques, précurseurs aux cristaux. Ce mécanisme est schématisé sur la figure I.12. Il convient de noter que les espèces composites formées à la suite de l'échange eau-silice autour du cation tétrapropylammonium peuvent s'apparenter aux unités "trimères" dont la formation a été rapportée par Kirschhock et al.42-44
Figure I.12: Mécanisme de synthèse de la zéolithe Silicalite-1 (MFI) en présence du cation tétrapropylammonium, tel que proposé par Burkett et Davis61
De manière pratique, il est possible d'évaluer cette balance hydrophile/hydrophobe grâce au rapport C/N de l'agent structurant (nombre d'atomes de carbone divisé par le nombre d'atomes d'azote contenus dans l'espèce organique).64 Cependant, il ne prend pas en compte l'influence des liaisons, des groupements cycliques ou des autres atomes, tels que l'oxygène.
19
C'est pourquoi le descripteur Log P, où P correspond au coefficient de partage d'une espèce dans un mélange octanol/eau, est préféré.65 De manière empirique, la valeur du descripteur Log P d'espèces organiques à potentiel structurant est comprise entre -1 et 6, correspondant à une des espèces les plus hydrophiles capable de présenter un effet structurant en synthèse de zéolithe (cation tétraméthylammonium, Log P = - 1,03) et à celle parmi les plus hydrophobes (cation tétrapentylammonium, Log P = 6,10).66 Ce raisonnement ne semble pas s'appliquer pas aux espèces organiques de type "composé bifonctionnel" telles que celles utilisées par l'équipe de Ryoo67 et qui ont permis de synthétiser des nanofeuillets de zéolithe ZSM-5 (dication C22-N+(Me)2-C6-N+(Me)2-C6, Log P = 10,8).
Contrairement à d'autres minéraux, la synthèse d'une zéolithe résulte d'une alchimie complexe où tous les paramètres ont leur importance. Outre l'agent structurant, possédant un rôle décisif dans la définition de la structure finale obtenue, d'autres facteurs de première importance entrent en jeu :
1) la nature des réactifs et la composition du milieu de synthèse 2) l'agent minéralisateur
3) les éléments de charpente présents en solution 4) l'étape de mûrissement
5) la température et la durée de synthèse 6) l'agitation du milieu réactionnel
7) l'ensemencement par des germes cristallins
III. Les zéolithes en catalyse
Les zéolithes protoniques sont parmi les catalyseurs solides les plus utilisées en raffinage du pétrol et en pétrochimie, 29principalement en raison d’une porosité en adéquation avec la taille des molécules de réactifs, des états de transitions et des produits recherchés.29 Cependant, cette taille de pore réduite a des effets contradictoires sur l’activité. Dans certains cas, elle peut agir de manière très favorable en évitant la formation des molécules les plus volumineuses, diminuant ainsi le risque de désactivation.30 Dans d’autres cas, comme celui de la conversion des alcools 31 et du craquage des hydrocarbures,27-31 les restrictions diffusionnelles associées à la faible taille des pores conduisent à une désactivation très rapide par cokage. Le problème essentiel de l’utilisation des zéolithes en catalyse est avant tout la désactivation par des dépôts carbonés.30 D’un point de vue économique, il devient nécessaire de régénérer régulièrement par combustion le catalyseur afin de tenter d’accroitre sa durée de
20
vie. Ces successions de régénération entrainent des coûts énergétiques importants et la perte inévitable des propriétés originales.
La composition du coke est, à haute température (350-500°C) reliée non pas à la nature du réactif mais à la structure de la zéolithe.128-131 La croissance des dépôts carbonés est évidemment limitée par la géométrie du pore. 128-131 Ainsi en transformation de paraffines, d’oléfines ou d’aromatiques sur une zéolithe à larges pores : HFAU et une autre à taille de pores intermédiaires : HMFI, les molécules de coke formées à 450 °C sont des méthylcoronènes pour la première et des méthylpyrènes pour la seconde. La formation de coke, qui se produit suivant un processus de sélectivité de forme, fait intervenir deux grands
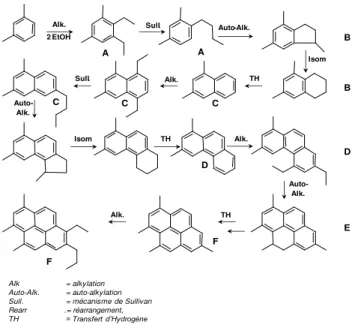
types d’étapes réactionnellesμ condensation-réarrangement (oligomérisation et cyclisation d’oléfines, alkylation inter ou intramoléculaire d’aromatiques par des oléfines, isomérisation) et transfert d’hydrogène ; ces étapes se répètent de multiples fois (Figure I.13).132
Par
exemple lors de la transformation de l’éthanol à γ50 °C sur la zeolithe *BEA, six grandes
familles de coke se forment successivement dans ses canaux:
Figure I.13: Représentation schématique de la croissance des dépôts carbonés polyaromatiques formés à l’intérieur de la zéolithe H-*BEA 132
Il est alors facile d’imaginer que la formation du coke est étroitement liée au temps de
séjour des intermédiaires réactionnels (TS) au sein du réseau poreux.133 Diminuer TS permet de limiter la formation autocatalytique de molécules polyaromatiques très toxiques. Unes des voies envisagées pour limiter le cokage est de hiérarchiser la porosité des zéolithes. Cela consiste à créer un réseau secondaire de pores connecté au réseau poreux inhérent à la
Alk. 2 EtOH Sull. A A Auto-Alk. C TH Alk. Sull. C C Auto-Alk. Isom TH D Auto-Alk. TH F F Alk. Isom B B D E Alk. Alk = alkylation Auto-Alk. = auto-alkylation Sull. = mécanisme de Sullivan Rearr .= réarrangement, TH = Transfert d’Hydrogène