HAL Id: dumas-01912960
https://dumas.ccsd.cnrs.fr/dumas-01912960 Submitted on 5 Nov 2018
HAL is a multi-disciplinary open access
archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Nathalie Cavillon
To cite this version:
Nathalie Cavillon. Mise au point d’une technique de dosage des folates alimentaires par CLHP. Sciences pharmaceutiques. 1994. �dumas-01912960�
AVERTISSEMENT
Ce document est le fruit d'un long travail approuvé par le
jury de soutenance et mis à disposition de l'ensemble de la
communauté universitaire élargie.
Il n’a pas été réévalué depuis la date de soutenance.
Il est soumis à la propriété intellectuelle de l'auteur. Ceci
implique une obligation de citation et de référencement
lors de l’utilisation de ce document.
D’autre part, toute contrefaçon, plagiat, reproduction illicite
encourt une poursuite pénale.
Contact au SID de Grenoble :
bump-theses@univ-grenoble-alpes.fr
LIENS
LIENS
Code de la Propriété Intellectuelle. articles L 122. 4
Code de la Propriété Intellectuelle. articles L 335.2- L 335.10
http://www.cfcopies.com/juridique/droit-auteur
Sciences Technologie Médecine
\
U.F.R.de PHARMACIE Domaine de laMerci -La Tronche
Année: 1994 N° d'Ordre:
J1o
l;_s-/ TITRE DE LA THESEMISE AU POINT D'UNE TECHNIQUE DE DOSAGE DES FOLA TES ALIMENTAIRES PAR C.L.H.P.
THE SE
Présentée àl'UniversitéJoseph FOURIER-GRENOBLE I . pour obtenir le grade de: DOCTEUR EN PHARMACIE
Par
Nathalie CA VILLON
Cette thèse sera soutenue publiquement le 3 novembre 1994 Devant: Madame leProfesseurJ. ALARY
Monsieur M. FAW AZ Madame N. DE MAULEON
Président du Jury
[Données à caractère personnel]
U.F.R. de PHARMACIE Domaine de laMerci -La Tronche
Année: 1994 N° d'Ordre:
TITRE DE LA THESE
MISE AU POINT D'UNE TECHNIQUE DE DOSAGE DES FOLATES ALIMENTAIRES PAR C.L.H.P.
THE SE
Présentéeàl'UniversitéJoseph FOURIER-GRENOBLE I pour obtenir le grade de: DOCTEUR EN PHARMACIE -Par
Nathalie CA VILLON
Cette thèsesera soutenue publiquement le 3 novembre 1994 Devant: Madame leProfesseur J. ALARY
Monsieur M. FAWAZ Madame N. DE MAULEON
Président du Jury
1
[Données à caractère personnel]
No
tre
Préd
iden
t
de
Thèse
,
Madame
le
Pro
fesseur
J.A
lary
,
Pro
fesseur
de
Ch
im
ie
Ana
ly
t
ique
e
t
de
Broma
to
log
ie
àl
'U
.F
.R
.
de
Pharmac
ie
de
Grenob
le
,
pour
son
accue
i
l
cha
leureux
au
se
in
de
son
labora
to
ire
,
sa
très
grande
compé
tence
e
t
sa
d
ispon
ib
i
l
i
té
,
qu
i
nous
a
perm
is
de
mener
à
b
ien
ce
trava
i
l
.
Mons
ieur
M
.
Fawaz
,
Ma
î
tre
de
Conférences
à
l
'U
.F
.R
.
de
Pharmac
ie
de
Grenob
le
,
pour
sa
pa
t
ience
e
t
ses
nombreux
conse
i
ls
,
sans
qu
i
ce
trava
i
l
n
'aura
i
t
pu
vo
ir
le
jour
.
Madame
N
.
De
Mau
léon
,
Responsab
le
Qua
l
i
té
s
i
te
de
Reve
l
de
"Nu
tr
i
t
ion
&S '~pour
sa
présence
dans
ce
jury
qu
i
témo
igne
d
'un
grand
in
térê
t
pour
no
tre
trava
i
l
.
Nous
la
pr
ions
de
cro
ire
àno
tre
pro
fonde
gra
t
i
tude
.
E
t
tou
t
le
personne
l
du
labora
to
ire
de
Ch
im
ie
Ana
ly
t
ique
qu
i
nous
a
sou
tenu
e
t
encouragé
tou
t
au
long
de
ces
que
lques
années
.
BSA: sérumalbumine bovine.
CBP A: competitive binding protein assay. CSP: Phase stationnaire chirale.
DHF: acide dihydrofolique. DTT: dithiothréitol.
ELISA: enzyme linked immuno-sorbent assay. ELLSA: enzyme linked ligand sorbent assay. F ou FA: acide folique.
FBP: folate binding protein.
FBP A: folate binding protein assay. FBP-Bi: FBP liée à la biotine.
FBP-pteglu.: FBP liée à l'acide ptéroylglutamique (ou acide folique). N5CH3THF: acide N5 méthyl tétrahydrofolique.
N5CHOTHF: acide N5 formyl tétrahydrofolique. NlOCHOTHF: acide NI 0 formyl tétrahydrofolique. pABG: acide para amino benzoylglutamique.
TBA: Tétrabutylammonium.
TBAP: Phosphate de Tétrabutylammonium. TEA: Triéthylamine.
INTRODUCTION
PREMIERE PARTIE
I. CARACTERISTIQUES GENERALES DES FOLATES: I.1. Propriétés physico-chimiques:
1.1.1. Structure chimique de base:
1.1.2. Propriétés physiques de l'acide folique: I.2. Etudes de stabilité:
1.2 .1. Effet de l'oxygène de l'air: 1.2.2. Effet du pH:
1.2.3. Effet de la température: 1.2.4. Effet de la lumière:
1.2 .5. Effet des ions métalliques:
II. ASPECTS METABOLIQUES ET PHYSIOLOGIQUES : II.l. Rôle des folates:
II.2. Absorption des folates:
II.3. Répartition dans l'organisme et stockage: II.4. Mobilisation et métabolisme:
II.5. Elimination:
II.6. Apports en folates:
II. 7. Biodisponibilité des folates:
II.8. Evaluation des besoins en acide folique:
7 9 9 9 12 13 13 16 17 18 18 20 20 20 21 21 22 22 24 24
II.9. Différentes étiologies des carences: 25
II.9 .1. Carences d'apport: 25
II.9.2. Carences par augmentation des besoins: 26 II.9.3. Carences par malabsorpion: 26
II.9.4. Carences iatrogènes: 26
II.10. Incidences des carences en folates: 26 ID. INCIDENCE DE TRAITEMENTS TRAUMATISANTS
SUR LA TENEUR EN FOLATES DES ALIMENTS: 27
III.1. Effets de différents modes de cuisson: 27 III.2. Comparaison entre la cuisson traditionnelle et celle aux
micro-ondes: 28
III.3. Conservation: 29
III.3.1. Traitement UHT (Cas particulier du lait): 29
III.3.2. Les sulfites: 29
III.3.3. Autres agents de conservation: 30
ID.3.4. Problème du stockage: 30
IV. TECHNIQUES D'EXTRACTION A PARTIR D'ALIMENTS: 31
IV.1. Purifications préalables: 31
IV .1.1. Tampons d'extraction: 31
IV.l.2. La précipitation des protéines: 32
IV.l.3. Conclusion: 33
IV.2. Traitements enzymatiques: 33
IV.2.1. Les conjugases de pancréas de poulet et de rein
de porc: 33
IV.2.2. La conjugase plasmatique: 34
IV.2.3. Action tri-enzymatique: 35
IV.2.4. hlhibiteurs de la déconjugaison: 36 IV.2.5. Autres types d'enzymes utilisées: 36
IV.3. Purification des échantillons après traitement enzymatique: 37
IV.3.1. La centrifugation: 37
IV.3.2. Les colonnes de chromatographie d'affinité: 37 IV.3.3. Résines échangeuses de cations: 38 IV.3.4. Résines échangeuses d'anions: 38
IV.3.5. Colonnes polaires: 39
IV.3.6. Colonnes apolaires: 39
V. TECHNIQUES D'ANALYSE: 40
V.l. Méthode microbiologique: 40
V.l.l. Principe: 40
V.1.2. Inconvénients: 41
V.1.3. Intérêt de l'utilisation d'une conjugase dans la
méthode microbiologique: 42
V.1.4. Technique particulière: 42
V.1.5. Conclusion: 42
V.2. Techniques enzymatiques: 43
V.2.1. Technique "Folate Binding Protein Assay" (FBPA): 43 V.2.2. Technique "Enzyme Linked Ligand Sorbent Assay"
(ELLSA): 44
V.2.3. Les techniques "Enzyme Linked Immuno-Sorbent Assay" (ELISA) et "Competitive Binding Protein Assay"
(CBPA): 45
V.3. Techniques Chromatographiques: 47
V.3.1. Le phénomène d'échange d'ions: 47
V.3.2. Le phénomène de partage: 48
V.3.3. Performances des techniques de détection: 56 V.3.3.1. Détection électrochimique: 56 V.3.3.2. Détection par absorption dans l'ultra-violet: 59 V.3.3.3. Détection fluorimétrique: 59 V.3.3.4. Détection de la radioactivité: 61
DEUXIEME PARTIE
INTRODUCTION 63
PREMIER CHAPITRE: MISE AU POINT D'UNE TECHNIQUE DE DOSAGE DES FOLATES PAR CLHP AVEC DETECTION DANS
L'ULTRA-VIOLET 65
1. ANALYSE: 65
1.1. Appareillage: 65
1.2. Préparation des solutions témoins: 67
1.3. Conditions d'analyse: 67
1.4. Résultats: 68
II. MISE AU POINT DE LA PURIFICATION ET DE LA
CONCENTRATION SUR CARTOUCHES SEP-PAK: 69
11.1. Propriétés générales des cartouches Sep-Pak: 69
11.2. Etude de la fixation: 70 11.2.1. Principe: 70 11.2.2. Matériel et méthode: 71 11.2.3.Résultats-Discussion: 72 11.3. Etude de la concentration: 73 11.3.1. Méthode: 73 11.3.2. Résultats: 75
ill. DOSAGE DES FOLATES DANS DES REPAS LYOPHILISES: 75
ill.l. Protocole: 76
III.2. Résultâts: 80
DEUXIEME CHAPITRE: MISE AU POINT D'UNE TECHNIQUE DE DOSAGE DES FOLATES PAR CLHP AVEC DETECTION
FLUORIMETRIQUE: 82
1 ANALYSE CHROMATOGRAPHIQUE: 83
I.l. Appareillage: 83
I.2. Conditions d'analyse: 83
I.3. Préparation des solutions témoins: 84
II. V ALIDA TI ON DE LA METHODE: 85
Ill. Etude de la linéarité: 85
II.2. Etude de la répétabilité et de la reproductibilité: 86 II.3. Etude de la limite de détection: 87
II.4. Conclusion: 87
III. ETUDE DE LA DEGRADATION DU TI-IF: 88
lill. Principe: 88
II12. Résultats: 88
II13. Conclusion: 88
IV. PURIFICATION ET CONCENTRATION SUR CARTOUCHES
SEP-PAK: 89
IV.l. Généralités: 89
IV.2. Recherche du solvant éluant: 89
IV.2.1. Méthode: 89
IV.2.2. Résultats: 91
IV.3. Détermination de la capacité de rétention de la cartouche: 91
IV.3.1. Méthode: 91
IV.3.2. Résultats: 92
IV.3.3. Conclusion: 92
V. PURIFICATION DE LA CONJUGASE DE REIN DE PORC: 93
V.l. Réactifs: 93
V.2. Matériel et méthode: 93
VI. ETUDE DE LA CONJUGASE: 94
VI.l. Protocole d'extraction: 94
VI.2. Résultats: 96
VII. TENEURS EN FOLATES DES EPINARDS HACHES
SURGELES: 96 VII.1. Méthode: 96 VII.2. Résultats: 97 VII.3. Conclusion: 97 CONCLUSION 99 ANNEXES 101 BffiLIOGRAPHIE 119
En 1994, les habitants des pays industrialisés vivent dans l'abondance et ont oublié ces affections mystérieuses qui frappaient les marins de Christophe Colomb. Scorbut et Béri-béri sont des maladies qui appartiennent au passé. Elles ne nous concernent plus, mais il faut savoir qu'elles restent le lot des pays en voie de développement.
L'abondance que nous connaissons aujourd'hui cache pourtant des déficiences qui, pour être marginales, n'en sont pas moins susceptibles de retentir sur la santé. Un apport insuffisant en vitamines ou en sels minéraux (fer, magnésium, zinc ... ) peut perturber des fonctions biochimiques et nombre de systèmes enzymatiques, entrainant par exemple une moindre résistance aux infections, des troubles de la croissance chez l'enfant, une baisse des performances physiques ou encore une anémie chez la femme enceinte.
n
est donc important de s'en préoccuper, même dans les pays développés comme la France et les autres pays industrialisés car les habitudes alimentaires y ont beaucoup évolué sur le plan qualitatif et quantitatif.La vitamine B9 ou acide folique, ainsi que ses dérivés, reste parmi les vitamines du groupe B celle qui est encore source de carences, même dans les pays industrialisés.
En effet, sa très faible stabilité et le développement de technologies alimentaires souvent traumatisantes, auxquels on peut ajouter une modification des habitudes alimentaires, peuvent entrainer des troubles variés dont les plus graves sont neurologiques.
ll devient donc nécessaire de mettre au point une méthode d'analyse sensible, spécifique et rapide permettant d'estimer, en routine, les teneurs en folates des aliments.
Après avoir présenté les caractéristiques générales des folates, nous développerons plus particulièrement leur stabilité en fonction des différents paramètres physico-chimiques. La fragilité de ses dérivés constitue en effet la difficulté majeure dont dépend l'analyse appliquée aux études alimentaires et métaboliques.
Nous aborderons ensuite les aspects métaboliques et physiologiques de cette vitamine.
Dans un troisième chapitre, nous évaluerons l'incidence des différents traitements sur la teneur en folates alimentaires.
Puis, nous passerons en revue, tout en les comparant, les nombreuses techniques de dosage répertoriées dans la littérature au cours des dix dernières années: nous distinguerons d'une part l'extraction et d'autre part, l'analyse proprement dite.
La deuxième partie de ce mémoire sera axée sur notre travail personnel, qui a eu comme objectif d'évaluer la teneur en folates de produits alimentaires par chromatographie liquide haute performance (C.L.H.P.):
-avec détection dans l'ultra-violet et application à des repas lyophilisés.
- avec détection fluorimétrique et application aux épinards bâchés surgelés.
PREMIERE
PARTIE
l. CARACTERISTIQUES GENERALES DES FOLATES: 1.1. Propriétés physico-chimigues:
1.1.1. Structure chimique de base:
L'acide folique ou acide ptéroylglutamique est constitué d'une molécule d'acide ptéroïque liéepar une liaisonamide àl'acide glutamique.
L'acide ptéroïque est formé lui-même d'une ptérine liée à l'acide para amino benzoïque. La molécule de base peut être ensuite substituée sur l'azote 5, et le deuxième cycle de la ptérine peut être saturé partiellement ou totalement pmu: donner lesdifférents dérivés.
Figure 1: formules développées des différents dérivés:
a) Acide folique; b) DHF; c)THF; d) NsCH3THF; e) NsCHOTHF; f)NtoCHOTHF; g) NsNtométhylèneTHF; h) polyglutamates. a) b) OH s O OH
3NY.4
.·r6
~
'
Cq1_
1 1 , C-0 · ~ H - ,~
NH2 N N H Y t s B C==O / OH . H OH si OH~ ~
t=o
~~T ~
J
~
·
NH2 1N N 8 · H·' ·. ··y . (3 C-O / OHc) OH H 0 1 OH si 9
~
'
~
C=O:Jc
NrN~
3N 1 - N y~
N 7 H H'~
C=O NH, 1 81 / - H OH d) OH · CH3~
1Y
OH.
. si .9~
~ '
C=Or
N'~
3N 1 - N y~
N H H'~
C=O NH2 t'J .
6H
e) CHO 0 OH j:Jc
OH sNI 9~
'
~
C=Or
N'
)
-z
3N 1 - N y~
N H H'I
l
C=O NH,., 1 s1 / - H OH f)g) OH 5/CH2 O OH
3Nx4
~ ~
'
//
1 1 N C, C=O,1
-
N)_z
~
N 7 H.. Y NH2 1 si H (3 C=O / OH h) OH 5 03N:J:4
Nr6
9
~
~
,
I
l
~-A
/..
7 H OH NH, N~ 1 N 8 .~
~
o
\ y H (3 l;c 0 H \ 1 C=ON4
y n~
1
c=o
On parle de monoglutamates d'acide folique lorsque le groupement Garboxylique en gamma du reste glutamique de la vitamine est ~ et de polyglutamates, quand cette fonction est liéeàW1 ou plusieurs autres restes
glutamiques.
Les groupements carboxyliques, ainsi que lafonction amine primaire aromatique, sont d'une importance primordiale car ils conditionnent la solubilité
de
la
mo
lécu
le
e
t
son
compo
r
temen
t
ch
roma
tog
raph
ique
.
I
ls
penne
t
ten
t
éga
]emen
t
d'envisager des réactions de couplage qui faciliteraient alors la détection de lav
i
trun
ine
.
I.1.2. Propriétés physiques de l'acidefolique:
Les propriétés physiques de l'acide folique sont énoncées dans le tableauci-dessous:
Tableau 1: Propriétés physiques de l'acidefolique:(51) PROPRIETES
Aspect Couleur
Poids moléculaire Formule brute
Température de combustion Pouvoir rotatoire
Maximums d'absorption dans l'UVàpH 13
pH (suspension 1% dans l'eau) Solubilités (mg/ml)
*eau (25°C)
*
eau(1 00°C) *méthanol* éthanol, butanol * acétone, chloroforme, éther, benzène
* acide acétique, phénol,
pyridine, solutions d'hydroxydes ou carbonates alcalins
CARACTERISTIQUES poudre cristalline jauneorangée 441,40 C19H19N706 calcinationà250°C +23° (0,5% dans la soude 0,1N) 256,283,368nm 4,0-4,8 très légèrementsoluble (0,0016) ~ légèrementsoluble un peu moins soluble insoluble
1.2. Etudes de stabilité:
Selon Rizzolo et Polesello (66), le problème majeur durant l'extraction est la sensibilité des folates à la fois vis à vis de l'oxydation et des traitements thermiques et le nombre de résidus glutamiques. Une difficulté supplémentaire est due au taux extrèmement bas présent dans beaucoup d'aliments (moins de lOOng/g).
I.2.1. Effet de l'oxygène de l'air:
Les folates ont des niveaux d'oxydation différents, plusieurs substituants sur l'azote N 5 sont possibles et la chaine polyglutamique est de longueur variable, d'où un certain nombre de problèmes analytiques.
Dans les aliments, on retrouve essentiellement l'acide tétrahydrofolique (THF) et les dérivés méthylés et formylés sur l'azote N 5 du THF (NsCH3THF et NsCHOTHF). Ces dérivés réduits sont les plus sensibles à l'oxydation.
Selon Barret et Lund (8), 75% de destruction sur le dérivé méthylé, dans un tampon phosphate à pH 7, saturé en oxygène, apparait pendant chaque traitement par la chaleur (à différentes températures).
*Le THF:
Le THF, dans certaines conditions de stockage permettant l'oxydation, se transforme en divers composés (cf. schéma 2).
Selon Lucock et coll. ( 6), le THF est reconnu comme l'un des dérivés actifs le moins stable (la moitié du THF a disparu après 29 minutes, dans l'eau et entre deux injections chromatographiques).
*L'acide dihydrofolique (DHF):
Le DHF en faible quantité peur ëtre détecté comme produit mineur d'oxydation du THF, mais lui aussi, se transforme rapidement en acide folique (F) (cf. schéma 3).
* L'acide folique:
Généralement, l'acide folique est une forme ajoutée dans les aliments supplémentés du fait de sa plus grande stabilité.
Schéma 2: Oxydation du THF: (22) THF
l\
pH7A
pABG ptérine pABG CH06 pABG pt érine
Schéma 3: Oxydation du DHF: (22)
pH9 pH 5,6
acide folique pABG dihydro- HCHO xantho-ptérine *Agents antioxydants: pH 10 CH06 DHF ptérine pH 5,6 à 7 CH06 dihydro ptérine
Du fait de l'extrême sensibilité de ces composés à l'oxydation, lors de l'analyse, il faut utiliser des agents anti oxydants comme l'acide ascorbique, les thiols (2-mercaptoéthanol ou dithiothréitol) ou un mélange des deux. Mais l'efficacité de ces produits apparait comme étant dépendante du pH et de la température (Gregory (30)).
a) l'acide ascorbique:
L'acide ascorbique joue le rôle d'antioxydant vis à vis des folates. Quand cet acide est détruit, des pertes en folates apparaissent en fonction du temps et de la température (Anders son et Oeste (3 )( 4)).
L'acide ascorbique endogène contribue à protéger les folates lors des traitements et peut expliquer la stabilité plus élevée de ces composés dans certains types d'aliments (Aramouni et Godber (7)).
Mais selon Holt et coll. (38), l'instabilité des folates due à l'oxydation demande de grandes quantités d'agents réducteurs qui peuvent provoquer des interférences lors de l'analyse par CLHP (Lucock et coll (49)). Une concentration en acide ascorbique supérieure à 0,5% provoque ainsi une précipitation de l'acide folique.
De plus, l'utilisation de certains composés antioxydants nécessite de connaître les traitements ultérieurs que vont subir les échantillons. En effet, l'addition d'acide ascorbique avant la déprotéinisation par l'acide perchlorique est nécessaire car sinon, les pourcentages de récupération des dérivés N sCH 3 THF et NsCHOTHF sont faibles et variables (Van Tellingen et coll. (74)).
b) Les thiols:
Lucock et coll. ( 49), ont utilisé le dithiothréitol (DTT) comme antioxydant pour protéger le NsCH3THF.
Il s'agit d'un solide très soluble dans l'eau, pratiquement inodore et ayant une faible tendance à être oxydé par l'air (contrairement à l'acide ascorbique). Son faible potentiel Rédox (-0,33V à pH 7) fait de lui un composé idéal pour déplacer l'équilibre vers la forme réduite de plusieurs composés dont l'acide ascorbique et les molécules à groupement sulfydryl.
Plus classiquement, d'autres auteurs proposent le 2-mercaptoéthanol, mais son odeur est plus désagréable.
c) Mélange d'antioxydants:
Certains auteurs, comme Payet et coll. (60), ou Varela-Moreiras et coll. (75), proposent un mélange d'ascorbate de sodium et de 2-mercaptoéthanol. Remarque: Le plus souvent, on associe au composé antioxydant, un barbotage par de l'azote pour chasser l'oxygène.
d) Conclusion:
Une étude de Barret et Lund (8),montre que la dégradation thermique du N5CH3THF dans un tampon phosphate O,lM, se fait à lafois par des mécanismes oxydatifs et non oxydatifs qui peuvent être significatifs
1.2.2. Effet du pH:
Selon Gregory et coll.(31),lors de l'extraction des folates, le chauffage en présence d'acide ascorbique à pH 4,9 n'induit pas d'interconversions indésirables, contrairement à un milieu neutre. Sous courant d'azote, dans les mêmes conditions, touslesfolates ont une bonne stabilité(> 90% de rétention).
Le milieu acide de l'extraction augmente la stabilité de l'acide ascorbique donc augmente celle des folates.
Ces mêmes auteurs ont cependant modifié le pH de l'extraction au cours d'études ultérieures (1990)(32). Ils montrent, en effet, que la stabilité des folates est meilleure à pH 7,85 avec l'acide ascorbique et le 2-mercaptoéthanol qu'à pH7 ne contenant que l'acide ascorbique. De lamême façon, Finglas et coll. (27),El-Gizawy et coll. (19), utilisent un milieu neutre lors de l'extraction.
Les folates ont un comportement ionique complexe: certains sites ionisables sont sujets à des variations de charge. Des variations de pH dans la zone de 4,9-7,85 pourraient donc entraîner des différences nettes d'ionisation. Cet effet est plus prononcé pour les polyglutamates qui sont plus facilement ionisables du fait des groupements alpha carboxyliques (Gregory et coll.(31)).
Ni et coll.(55),proposent un diagramme de répartition des différentes formes d'acide folique en fonction du pH:
H3A+ H2A+- HA- A2
---~---~---~---
4,65 6,75 9,00 pH
'--
~ /Zwitterion
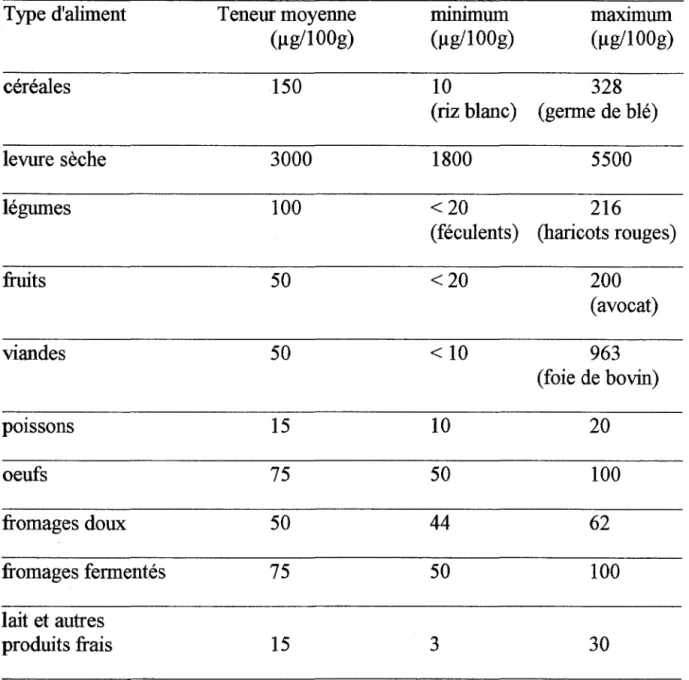
Une étude récente de Lucock et coll. (49),montre que la température, aussi bien que la lumière sont des facteurs prédominants qui influencentles pertes en NsCH3THF. Cette perte est dépendante du pH.
En effet, à pH 9,0, en absence d'antioxydant, à 25°C, le N5CH3THF est instable.
A pH 7,3 et 3,5, la stabilité est meilleure.
En présence de DTT, à 25°C, le N5CH3THF est stable à pH 7,3 et 9,0, alors qu'aucun effet protecteur n'est observé à pH 3,5 (cf. Tableau II).
-·
Tableau II: Temps de 1/2 vie (heures) du N5CH3THF en présence de DTT en fonction du pH et de l'éclairement.( 49)
pH Obscurité Lumière
9 5,25 5,92
7,3 16,22 20,68
3,5 19,82 23,32
La stabilité relative des 4 dérivés monoglutamiques est dans l'ordre décroissant
N5CHOTHF > DHF > N5CH3THF > THF
Peu de pertes en N5CH3THF ont été détectées pour une solution à 500ng/ml dans un tampon à pH 3,5, stockée à 4°C, avec du DTT, à l'obscurité, pendant 2 jours (temps de 1/2 vie de 259 heures).
1.2.3. Effet de la température:
Selon Hahn et coll. (34)(35), le dérivé le plus labile est le DHF. Il est détruit par la chaleur à raison de 90o/o après 10 minutes. Il devient indétectable après 20 minutes. En conséquence, il est rarement retrouvé dans les milieux naturels.
Lors de l'extraction, il vaut mieux utiliser le chauffage sous reflux à une température supérieure à 90°C pendant 5 minutes plutôt que l'autoclave à
121
oc
pendant 15 minutes (Finglas et coll. (27)).Selon Lucock et coll. (49), un stockage au froid (même sans anti oxydant) ne provoque pas de pertes. Par contre, l'alternance congélation-décongélation a un effet néfaste (à partir de plus de 2 cycles).
Tous les auteurs s'accordent pour dire qu'il faut conserver les échantillons au froid à -20°C pour certains, à -80°C pour d'autres, afin de limiter les pertes.
Néanmoins, à température ambiante, la dégradation du N sCH 3 THF intervient très rapidement (112 vie de 1 heure) (Payet et coll. (60)).
Enfin, le N 1 oCHOTHF est instable et même dans des conditions de protection extrêmes, une interconversion en N sCHOTHF intervient rapidement (Gounelle et coll. (29)).
1.2.4. Effet de la lumière:
Tous les auteurs protègent leurs échantillons de la lumière (conservation dans le noir ou utilisation de papier d'aluminium).
Engelhart et Gregory (20), ont réalisé leurs expériences dans un
laboratoire muni de lampes fluorescentes jaunes pour éviter la dégradation photochimique.
Cependant, quel que soit le pH, la lumière n'a pas d'effet néfaste sur le NsCH3THF à 25°C, avec ou sans DTT (Lucock et coll. (49)).
I.2.5. Effet des ions métalliques:
L'acide folique, grâce à ses groupements à caractère acide, pourrait former des complexes métalliques.
Or, selon Nayan et Dey (54), le comportement de l'acide folique comme acide est dû à la présence d'un groupement "phénolique" sur le cycle ptéridinique et à deux groupements carboxyliques. Ils attribuent le pka de 9,00 à ce groupement "phénolique" ce qui est contesté par Ni et coll. (55) qui attribuent ce pka au groupement aminé de la ptérine. En effet, l'hydroxyle est porté par un cycle hétéroatomique et non benzénique donc il ne peut s'agir d'un groupement phénolique.
Bien que les groupements -COOH soient en mesure de former des chélates à des pH bas, ceci ne peut pas être étudié pour l'acide folique car il n'est pas complètement soluble en milieu aqueux et acide. C'est pourquoi, les chélates observables aux pH biologiques, nécessitent la contribution du groupement -OH fixé sur le noyau ptérine.
Nayan et Dey (54), ont montré l'affinité de l'acide folique vis à vis des ions métalliques carcinogènes qui sont des métaux de transition souvent associés aux vitamines, protéines, enzymes et acides nucléïques, impliqués dans l'apparition de cancers.
Nishikawa et Kondou (56), remarquent un faible pourcentage de récupération de l'acide folique à partir de mélanges polyvitaminiques, probablement dû aux minéraux. En effet, le sulfate de cuivre (substance interférente témoin) décompose l'acide ascorbique d'où un effet néfaste sur la stabilité de l'acide folique (cf. tableaux III et IV).
Tableau III: Pourcentage résiduel en acide folique en présence d'acide ascorbique et/ou de sulfate de cuivre:(56)
0/o résiduel essai 1 essai 2 moyenne
FA 100 100 100
FA+VC 100.9 100.1 100.5
FA+ CuS04 96.4 96.4 94.4
FA +
vc
+ 76.1 72.5 74.3CuS04
Tableau IV: Pourcentage résiduel en acide folique à différentes concentrations en présence d'acide ascorbique et de sulfate de cuivre:( 56)
concentration en FA (Jtg/ml) 0/o de récupération
5 72.5
10 84.1
20 77.7
25 75.7
FA: acide folique; VC: vitamine C; CuS04: sulfate de cuivre.
La dégradation oxydative de l'acide ascorbique donne naissance à des composés tels que l'acide oxalique, puissant réducteur , pouvant transformer l'acide folique en ses dérivés réduits moins stables (Faure (21)).
Pour éliminer les pics interférants et améliorer l'intensité du pic de l'acide folique, Iwase (41), rajoute dans sa phase mobile de l'édétate de sodium afin de complexer les métaux.
De la même façon, Faure (21), utilise de l'EDTA (1 mole d'édétate de sodium pour 1 mole d'ion métallique) et élimine le fer réduit à l'aide d'une baguette aimantée.
II. ASPECTS METABOLIQUES ET PHYSIOLOGIQUES: II.l. Rôle des folates:
Les folates sont utilisés comme co-facteurs dans le transfert enzymatique des unités monocarbonées. Par exemple, ils permettent le transfert des groupements méthyl dans la synthèse de la méthionine, et des groupements formyl dans la biosynthèse des purines.
Les folates agissent aussi sur les bases pyrimidiques avec méthylation de l'uracile conduisant à la thymine. Ils interviennent dans le métabolisme de la sérotonine, noradrénaline, adrénaline et dopamine en participant à la synthèse de la tétrahydrobioptérine (BI4) (Faure (21)).
II.2. Absorption des folates:
Seule la forme monoglutamique de l'acide folique est absorbée. Les polyglutamates doivent être hydrolysés par une enzyme ( conjugase) avant leur absorption.
Cette absorption a lieu au niveau du duodénum et du jéjunum et nécessite un transport actif au niveau de la muqueuse, stimulé par le glucose. Elle est maximale à pH 6. Ce mécanisme fait intervenir une Folate Binding Protein (FBP) au niveau de la barrière en brosse de l'intestin.
Mais l'acide folique est aussi absorbé de façon passive, probablement par diffusion (20-30% de l'absorption totale).
L'efficacité de l'absorption est d'environ 50%, ce qui montre l'importance de l'intégrité de la muqueuse pour éviter les carences par malabsorption.
II.3. Répartition dans l'organismeet stockage:
Les folates, dans le sang, se présentent sous 3 formes: -folates libres.
-folates faiblement liés aux protéines du sérum.
-folates trèsfortement liés à des protéines de haute affinité (5% du transporttotal).
Ces protéines de haute affinité sont aussi présentes dans lelaitce qui faciliterait l'absorptionintestinaledes folates.
Le foie représente l'organe majoritaire de stockage (50%). Avec d'autres tissus, il va convertir les folates circulants, principalement le NsCH3THF, en forme polyglutamique, aptes au stockage, avec l'aide d'une polyglutamate synthétase.
Selon Brody et coll. (10), qui ont étudié les groupements monocarbonés présents dans les folates de foie de rat, il y aurait des différences dans le métabolisme engendré par les penta-et hexa-glutamates. En effet, le N5CH3THF est la forme majoritaire du groupe des penta-glutamates ~ des
folates totaux) avec un faible taux de THF. Au niveau des hexa-glutamates, le NsCH3THF et le THF représentent les formes majoritaires (~ 17et22o/o
respectivement). Dans legroupe des hepta-glutamates, le THF prédomine.
Mais dans tous les cas, la forme monoglutamique est la forme de transportidéale.
Coppell et coll. (15), affirment que le THF, le NsCH3THF, le N 1oCHOTHF et leurs dérivés polyglutamiques sont les composés majoritaires du pool métabolique des folates normaux chez l'homme. L'acide folique et son dérivé N1oCHO,ainsi que le N sCHOTHF ne sont pas les constituants naturels du métabolisme normal des folates.
De lamême façon, Lucock et coll. (49), montrent que les principales formes dans leplasma sont leN sCH 3THF et ses dérivés polyglutamiques.
II.4. Mobilisation et métabolisme:
Bonomi et coll. (9), montrent que quelle que soit la voie d'introduction duNsCHOTHFdans' ~ il est intensément et rapidement
converti en N sCH 3THF et il est maintenant établi que seul l'isomère(1) de ce dérivé participe à cette conversion.
Le métabolisme cellulaire des folates est constitué de nombreuses réactions incluant la synthèse et l'hydrolyse des dérivés polyglutamiques, la synthèse des tétrahydrofolates avec ou sans substitution d'un carbone à des niveaux d'oxydation variés, et le transfert de ces unités carbonées pour la synthèse de la méthionine, thymidilate, purines et l'interconversion sérine/glycine.
Ces réactions résultent en une variété de composés foliques intra-cellulaires qui diffèrent selon la structure du cycle ptéridinique et la longueur ·de la chaine glutamique.
Les modifications dans les taux de ces réactions vont entrainer des changements dans la distribution des folates. En déterminant leur répartition dans les tissus, on pourra avoir plus d'informations sur leur métabolisme cellulaire (Varela-Moreiras et coll. (75)).
II.5. Elimination:
Une circulation entéro-hépatique existe (sécrétion dans la bile) permettant de prévenir les carences. L'alcool inhibe ce cycle. Il y a aussi une élimination urinaire des formes actives et inactives.
II. 6. Apports en folates:
Selon Finglas et K wiatkowska (25), les folates existent essentiellement dans les légumes, principalement sous forme de longues chaînes polyglutamiques (5 à 7 résidus glutamiques reliés en gamma). On les trouve aussi dans les fruits, les levures et le foie.
Selon Finglas et coll. (26), la majorité des formes actives naturelles de folates que l'on rencontre dans les aliments sont les dérivés 5-6-7-8 THF avec des résidus glutamiques > 8. La majorité des dérivés possède un azote substitué par un méthyl ou un formyl en position 5.
En effet, selon White (77) et (78), les principales formes dans le citron sont le N5CH3THF et ses dérivés polyglutamiques.
Holt et coll. (38), trouvent la même chose dans le lait et Müller (53), montre qu'il existe 70% de N5CH3THF, 20% de NsCHOTHF et 10% de THF dans les produits laitiers.
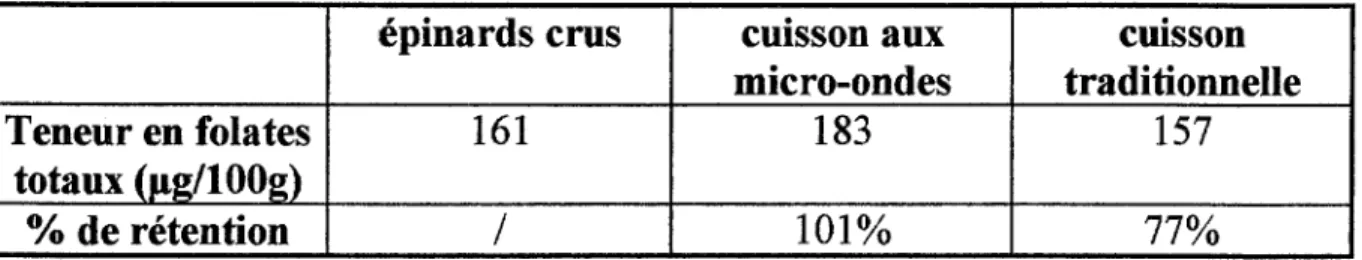
Dans tous les cas, en ce qui concerne les fruits et légmnes, il existe des variations de la teneur en folates totaux suivant l'année de production, la variété, l'acidité, la conservation ménagère et les traitements subits (cf. Tableau V).
Tableau V: Sources de folates totaux:
Type d'aliment Teneur moyenne nnrumum maxnnum (Jlg/100g) (Jlg/100g) (Jlg/lOOg)
céréales 150 10 328
(riz blanc) (germe de blé)
levure sèche 3000 1800 5500
légumes 100 <20 216
(féculents) (haricots rouges)
fruits 50 <20 200 (avocat) viandes 50 < 10 963 (foie de bovin) pmssons 15 10 20 oeufs 75 50 100 fromages doux 50
44
62 fromages fermentés 75 50 100 lait et autres produits frais 15 3 30 Références: (21)(53)(52)(62)(64)(45)ll.7. Biodisponibilité des folates:
La biodisponibilité des folates est variable selon les aliments et ils sont généralement moins bien utilisésà partir d'aliments d'origine végétale plutôt qu'animale.
Les facteurs affectant la biodisponibilité des folates alimentaires ne sont pas encore très bien déterminés mais semblent inclure les statuts en fer et en vitamine C. Des déficiences en ces deux nutriments chez l'homme, sont associées à une mauvaise utilisation des folates.
L'utilisation des folates est réduiteàpH bas, par inhibition de la conjugase. Cette enzyme est aussi inhibéepar certains composés alimentaires, par une carence en zinc et une exposition chronique à l'alcool.
Selon Selhub et coll. (69), l'importance de la "polyglutamation" est un facteur important contribuant à labiodisponibilité des folates alimentaires età l'utilisationdes co-enzymes foliques par lacellule.
Ainsi, labiodisponibilité dépend:
-de laforme d'existence de lavitamine (libre, liée,réduite, oxydée...).
-delanature et de lacomposition des aliments (fibres, protéines...).
-du pH du tractus digestif. -desfacteurs iatrogènes:
*contraceptifs oraux, anti-convulsivants, Salazopyrine qui inhibentlaconjugase.
* anti-mitotiques, diurétiques, anesthésiques, ant i-parasitaires, qui inhibentlaréductase.
ll.8. Evaluation des besoins en acide folique:
Les apports quotidiens varient de 30à 800~ suivant les
différentes périodes de lavie (cf. Tableau VI).
La dose journalière recommandée (DJR) est de ~ de poids
corporel et par jour. Cette valeur est basée sur le minimum requis de 1~ et
par jour en considérant 85% de l'efficacité de l'absorption, 50% de biodisponibilité et un coefficient de variation de 30%.
TableauVI:Apports quotidiens en folates selon lespériodes de lavie:
ENFANTS HOMMES FEMMES Réf.
-
-
-
-
-
--
-
-
-
-
-
r
-
-
-
-
--
-
-
-
--
-
-
-
-
-
-
---
---·
------------------~------0-0'
5
0,5-1 1-3 4-6 7-10 11-14 15-+
11-14 15-+
enceintes allaitantes(ans) 0-6(mois)1. 6-9
---· ---
:---
-
-
-
-
-
-
-
-
-
-
---
---2535
50
75 100 150 200 150 180 400 280 260 DJR 200 200 200 400 400 400 400 400 400 800 800 800us
DJR50
50
~ 200 300 400 400 400 400 800 600 600 (62) 3050
00 300 300 400 400 400 400 800500
500
(21) Selon Ni et coll. (55), les besoins quotidiens se situent entre0
,5
et 1mg pour un adulte, ce qui est largement supérieuràce que proposent les auteurs précédents.Du point de vue biologique, les folates sériques doivent être compris entre 9 et 41 nmoVl (soit 4à18Jlg/1)et les folates intra-erythrocytaires entre 340 et 1600 nmoVl (soit 150à700Jlg/1).On considère que les folates in tra-erythrocytaires sont assez représentatifs du pool tissulaire. Cependant, la détermination du seuil à partir duquel une carence en acide folique sera diagnostiquée est encore assez floue puisqu'il varie entre 3 et5Jlg/1 en folates sériques et de 140à250Jlg/1 pour lesfolates intra-erythrocytaires(Faure (21)).
II.9. Différentes étiologies des carences: TI. 9.1. Carences d'apport:
-par lestraitementstraumatisantssubis par l'aliment,
-biodisponibilité différente selon l'étatde l'aliment, son association avec d'autres produits, lafonne de folate présente,
-habitudes alimentaires.
Ce type de carence touche3 catégories de personnes: -lespersonnes âgées,
-les alcooliques,
II.9.2. Carences par augmentation des besoins: - grossesse,
- allaitement.
II. 9.3. Carences par malabsorption: -cancers et syndrômes hématologiques, - pathologies intestinales,
- maladies héréditaires du métabolisme B9 dépendant, - atteintes par le
vœ.
11.9.4. Carences iatrogènes: - anti-épileptiques, - antibiotiques ou anti-parasitaires, - anti-inflammatoires coliques, - anti-mitotiques, - contraceptifs oraux.II.l 0. Incidences des carences en folates:
importants: Les carences en acide folique provoquent des désordres biologiques - Troubles dans la synthèse des acides nucléiques conduisant à une anémie macrocytaire,
- Altération des muqueuses (buccale, intestinale, vaginale) avec troubles intestinaux,
- Affections des systèmes nerveux et immunitaire,
- Dysplasies cervicales et anomalies de la formation du tube neural (Spina bifida).
Les études du déficit en folates chez les femmes enceintes et allaitantes, les enfants, les malades hospitalisés, les femmes sous contraceptifs oraux et les alcooliques, ont montré la nécessité d'avoir plus d'informations sur la teneur alimentaire en folates.
Selon Lacey ( 45), des carences en acide folique provoquent des troubles dans le développement de l'embryon, particulièrement pendant les premières semaines de grossesse, lorsque la femme ignore encore qu'elle est enceinte. Une supplémentation entraîne une réduction de 72% des atteintes de la moelle épinière chez l'embryon.
Cependant, une supplémentation de 4mg/jour en acide folique ne préviendrait pas tous les défauts du tube neural. D'où la possibilité d'une étiologie multiple pour ce type de désordre. Après étude, il y aurait une réduction des défauts de 17 à 28o/o.(5)
Enfin, O'Connor (57), propose une supplémentation en folates pendant la jeune enfance, essentielle pour faciliter la croissance.
ill. INCIDENCE DE TRAITEMENTS TRAUMATISANTS SUR LES TENEURS EN FOLATES DES ALIMENTS:
TI est généralement reconnu que pendant les procédés de préparation, les aliments sont sujets aux pertes en vitamines, à cause de la lumière, de la chaleur, des variations de pH, etc ...
Par ailleurs, ces traitements peuvent aussi causer une inactivation enzymatique, une destruction des micro-organismes, une élimination de l'oxygène, ce qui résulte en une meilleure stabilité des vitamines.
Ainsi, le taux résiduel de vitamines correspond à un équilibre entre un effet direct négatif et un effet indirect positif.
liLI. Effets de différents modes de cuisson:
Selon Aramouni et Godber (7), les grillades provoquent tme perte de 41% en folates alors que la friture cause une perte de 50%. Ainsi, une température élevée pendant un temps relativement court lors de la cuisson, a un effet plus destructeur. Un temps de cuisson plus long associé à une chaleur sèche sont préférables.
Perloff et Butrum (62), montrent une perte en folates libres plus élevée que celle en folates totaux, lors de la cuisson (cf. Tableau VII).
Tableau VII: Pourcentages de récupération en folates libres et totaux après chauffage à l'ébullition:(62)
temps d'ébullition folates libres folates totaux (min.)
5 10-50% 20-90%
15 5-10o/o 20-40%
/
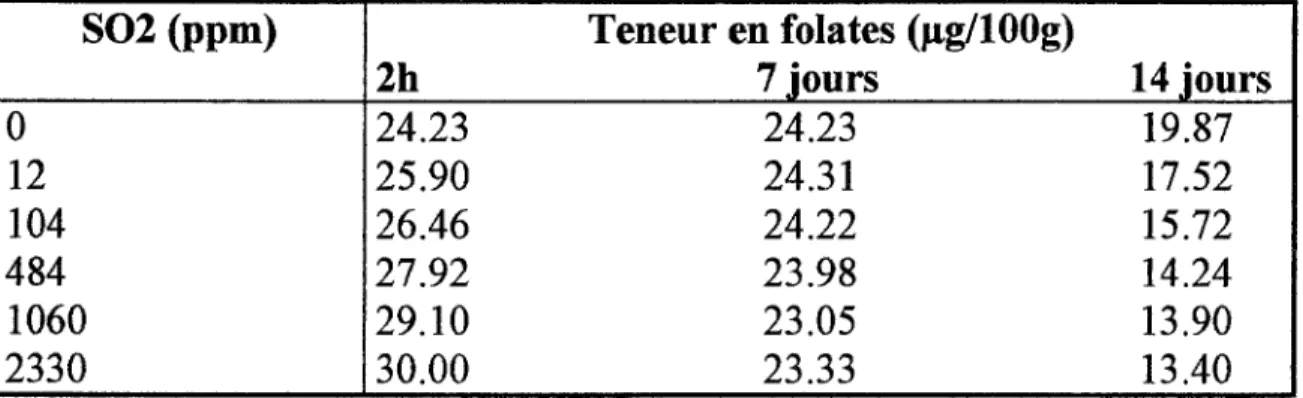
lli.2. Comparaison entre la cuisson traditionnelle et celle aux micro-ondes: Klein et coll. ( 44), comparent les cuissons traditionnelle et aux micro-ondes des épinards. Les résultats sont présentés dans le tableau VIII.
Tableau VIII: Effet du type de cuisson sur la teneur en folates totaux des épinards:( 44)
épinards crus cuisson aux cuisson micro-ondes traditionnelle
Teneur en folates
161
183
157
totaux (Jlg/1 OOg)
% de rétention 1
101%
77%
Selon ces mêmes auteurs, la teneur en folates des épinards ne serait pas significativement affectée par la chaleur ou le mode de cuisson, ce qui serait contradictoire avec les valeurs que ces auteurs annonçent dans le tableau VIII. Cependant, la quantité d'eau utilisée dans le procédé de chauffage et le temps de cuisson sont des facteurs importants afin d'optimiser la rétention des folates.
Ainsi, la qualité de la cuisson aux micro-ondes semble meilleure que celle de la cuisson traditionnelle.
Selon Klein et coll. ( 43), les folates sont assez bien retenus dans les légumes congelés, cuits pendant un temps très court, avec un minimum d'eau (exception faite pour le brocoli qui contient une grande quantité de fonnes thennolabiles ).
Selon Chevance et Adrian (13), la cuisson aux micro-ondes n'entraine pas de pertes en nutriments supérieures à celles observées au cours des cuissons traditionnelles. Avec les micro-ondes, il y a une plus grande montée en température mais une absence de fonnation de croûte (la protection est plus faible).
Les micro-ondes n'engendrent pas de conséquences spécifiques sur le plan chimique mais elles entrainent une déshydratation plus importante: les éléments hydrosolubles auront tendance à migrer dans l'eau.
Cependant, dans la pratique, la cuisson traditionnelle entraine, indirectement des pertes plus élevées du fait d'un volume d'eau souvent supérieur.
De plus, il existe une variation de comportement des folates lors de la cuisson en fonction de leur structure: l'acide folique se révèle très stable aux micro-ondes alors que les fonnes réduites seraient plus sensibles aux micro-ondes qu'à la cuisson traditionnelle.
III.3. Conservation:
III.3.1. Effets du traitement UHT (cas particulier du lait):
Andersson et Oeste (3)(4) , étudient les pertes en acide ascorbique, en folates et en vitamine B12 ainsi que les changements dans les taux d'oxygène du laitUHT.
Pendant le chauffage et la conservation du lait UHT, des changements majeurs dans le goût et la valeur nutritionnelle peuvent apparaitre en présence d'oxygène, ce dernier provenant de 3 sources différentes:
- oxygène dissous dans le lait, -adsorption à partir de l'extérieur,
- présence d'oxygène dans l'espace de tête.
*
Conditions idéales pour une bonne rétention des folates: - dégazage maximum avant traitement UHT. - [02] < 3,3ppm dans l'espace de tête.*
Lors du traitement UHT:- [02] < 0,6ppm ---> pas de dégradation. -dégazage maximum----> pertes d'environ 30%
dues à l'oxygène dissous.
III.3.2. Les sulfites:
Pizzoferrato (63), propose des exemples d'effets directs et indirects de traitements technologiques sur l'acide ascorbique, les folates et la thiamine. Il étudie les effets des sulfites sur les teneurs en thiamine et en acide folique dans les pommes de terre traitées. Les sulfites ont des propriétés anti-microbienne, anti-enzymatique et anti oxydante. Mais les folates réagissent réversiblement avec le S02 pour former un composé d'addition relativement instable.
Ainsi, l'acide folique est sujet à la fois à un dommage direct et à une protection indirecte contre ses antagonistes naturels (micro-organismes, enzymes et oxygène) (cf. Tableau IX).
Tableau IX: Teneurs en folates dans des pommes de terre traitées aux sulfites (moyenne sur 3 déterminations)(63)
S02 (ppm) Teneur en folates (Jtg/100g) 2h 7 .iours 14 .iours 0 24.23 24.23 19.87 12 25.90 24.31 17.52 104 26.46 24.22 15.72 484 27.92 23.98 14.24 1060 29.10 23.05 13.90 2330 30.00 23.33 13.40
III.3 .3. Autres agents de conservation:
Taher et Lakshmaiah (71 ), étudient la stabilité de l'acide folique dans du lait traité par du peroxyde d'hydrogène et du thiocyanate de potassium. Ces deux produits sont utilisés comme système anti-microbien.
Le peroxyde d'hydrogène seul ou combiné au thiocyanate de potassium inactive l'acide folique du lait (libre ou total) de façon significative.
Le thiocyanate seul n'entrairerai pas de pertes en folates mais ce sont alors les lactoperoxydases du lait qui l'inactiveraient. L'addition d'une quantité suffisante de peroxyde d'hydrogène empêche cette dégradation des lactoperoxydases par inactivation, alors qu'une concentration trop faible n'a pas d'effet.
III.3 .4. Problème du stockage:
Selon Lacey ( 45), alors que les pois congelés contiennent encore un taux élevé de folates, les légumes, sujets à un stockage frigorifié n'en contiennent généralement plus que très peu d'où l'intérêt de manger des légumes frais.
IV. TECHNIQUES D'EXTRACTION A PARTIR DES ALIMENTS:
Les folates étant liés dans la matrice alimentaire, il faudra faire une extraction préalable. Nous étudierons en premier lieu, quels sont les tampons d'extraction choisis, en précisant s'il y a utilisation concomitante de chauffage ou de solvants.
Cette étape est suivie de l'action d'une conjugase permettant de libérer les monoglutamates à partir des polyglutamates, puis d'une purification avant analyse par des méthodes diverses et variées.
IV.l. Purifications préalables:
IV.1.1. Tampons d'extraction:
Gregory et coll. (32), ont cherché à optimiser les différentes techniques d'extraction.
Ils montrent que les tampons d'extraction sont choisis en principe dans des zones de pH proche du pH d'activité maximale de la conjugase (de rein de porc en milieu acide; et de pancréas de poulet en milieu neutre).
Deux extractions sont efficaces à pH 7,85 (une troisième extraction n'apporte aucun gain). Ils proposent un rapport échantillon/tampon extractif de 1/9.
En fait, une extraction incomplète peut être due à la rétention des folates dans la matrice alimentaire par des intéractions avec des composés insolubles.
De la même façon, O'Connor et coll. (57), utilisent un volume de lait pour 9 volumes de tampon à pH 7.
Varela-Moreiras et coll. (75), utilisent 10 volumes de tampon à pH 7,85 par gramme d'échantillon.
Engelhart et Gregory (20), proposent des rapports de 114 à 1/9 selon le type d'échantillon.
IV .1.2. La précipitation des protéines:
La précipitation des protéines peut être effectuée par différents procédés:
* Le chauffage:
Plusieurs auteurs proposent un chauffage afin de précipiter les protéines alimentaires et de libérer les folates (Klein et coll. (44); O'Connor et coll. (57); Varela-Moreiras et coll. (75); Engelhart et Gregory (20); Gregory et coll. (32)).
La précipitation des protéines évite la saturation de la colonne analytique.
Mais Selhub (68), montre que l'extraction à haute température empêche l'hydrolyse enzymatique des chaines glutamiques.
De plus, pendant l'extraction, il peut y avoir:
- Libération d'acide formique provenant du N 5-10 méthylène THF qui provoque l'interconversion du N 1 oCHOTHF en NsCHOTHF.
-Hydrolyse enzymatique de l'acide glutamique.
Enfin, l'étude récente de Finglas et coll. (27), montre que l'utilisation de l'autoclave donne des taux de folates plus bas (10-20%) par rapport au chauffage sous reflux.
* L'acétone:
Halm et coll. (34)(35), utilisent plutôt l'acétone, inerte, volatil, induisant moins de pertes que le chauffage. Malheureusement, ce solvant ne peut pas être combiné à une éventuelle hydrolyse enzymatique car il détruit l'enzyme de déconjugaison. L'efficacité de l'extraction est à peu près constante entre 300 et 2000 pmol/1.
*L'acide perchlorique:
Van Tellingen et coll. (74), ainsi que Leeming et coll. (47),
proposent une déprotéinisation par l'acide perchlorique. Cet acide produit une rapide interconversion du N 1 oCHOTHF en N sCHOTHF et une incubation prolongée diminue le pourcentage de récupération du N sCHOTHF.
*L'acide trichloracétique:
Selon Gregory et coll. (32), il peut entrainer une perte en folates par instabilité en milieu acide.
IV .1.3. Conclusion:
Ainsi, une évaluation systématique des différents paramètres jouant un rôle sur l'extraction (pH, force ionique, rapport échantillon/tampon extractif, type d'agent réducteur, temps de chauffage, température ... ) est nécessaire pour chaque type d'échantillon.
IV.2. Traitements enzymatiques:
L'absorption intestinale des folates nécessite l'hydrolyse des polyglutamates en monoglutamates. Chez les mammifères, l'enzyme hydrolytique carboxypeptidase folylpoly-gamma-glutamate, communément appelée "conjugase", coupe les liaisons peptidiques gamma-glutamyl des polyglutamates.
La concentration en enzyme et le temps d'incubation doivent être déterminés pour chaque type d'échantillon. Certains extraits peuvent, en outre, inhiber l'enzyme.
Selon White (77)(78), le traitement par la conjugase augmente le taux de folates de 30 à 70%.
Il existe principalement 3 types de conjugases: - la conjugase de pancréas de poulet, - la conjugase de rein de porc,
- la conjugase de plasma humain.
IV.2.1. Les conjugases de pancréas de poulet et de rein de porc: Selon Gregory et coll. (31), l'enzyme de pancréas de poulet n'est pas souhaitable en vue d'une analyse chromatographique car elle donne des formes diglutamiques contrairement à celle de rein de porc qui fournit des formes monoglutamiques (Engelhart et Gregory (20)).
D'après ces auteurs, malgré une inhibition de la conjugase de rein de porc par certains composés naturels, elle est utilisée avec succès dans l'analyse d'une large gamme d'échantillons.
Malgré tout, la conjugase extraite de pancréas de poulet serait plus active car elle renfermerait des amylases qui faciliteraient l'extraction (Pedersen
(61)).
De même, pour De Souza et Eitenmiller (17), elle possèderait une activité protéolytique résiduelle et une certaine activité amylolytique.
Chaque enzyme possède un pH maximum d'activité: - conjugase de rein de porc à pH 4,5.
(entre 3,6 et 4,9 pour Engelhart et Gregory (20))
- conjugase de pancréas de poulet à pH 7. IV.2.2. La conjugase plasmatique:
La déconjugaison utilisant un faible excès de plasma humain est optimale entre pH 6 et 7 (Goli et Vanderslice (28)).
Finglas et coll. (27), évaluent l'activité de deux types de conjugases avant un dosage microbiologique:
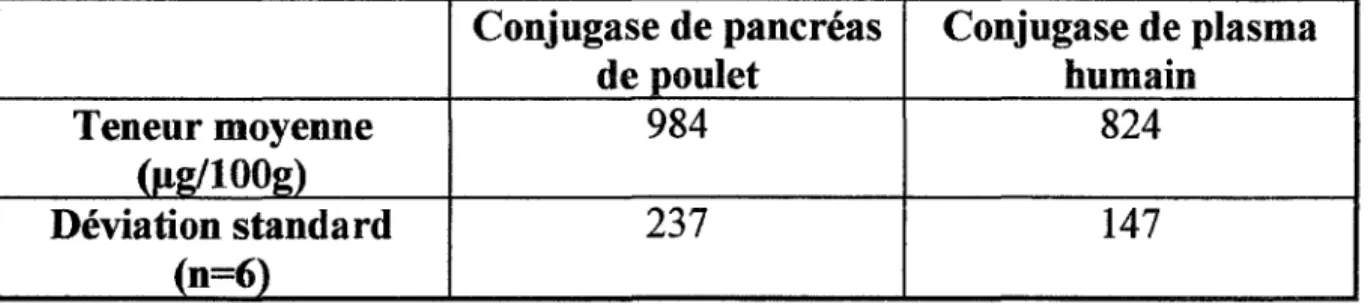
- la conjugase de plasma humain, - la conjugase de pancréas de poulet. Les résultats sont répertoriés dans le tableau X.
Tableau X: Teneurs moyennes en folates après traitement par deux types de conjugases (en Jlg/lOOg de matière sèche):(27)
Conjugase de pancréas Conjugase de plasma
de poulet humain
Teneur moyenne 984 824
(Jtg/100g)
Déviation standard 237 147
La conjugase de plasma humain est plus facile à utiliser et a une plus grande activité enzymatique que la conjugase de rein de porc car:
- temps d'incubation plus faible qui limite la dégradation des folates. Ce paramètre est toujours délicat à fixer car il doit être un compromis entre une déconjugaison totale et un minimum de pertes en folates.
- utilisation à pH 6 (la stabilité des folates est plus élevée au voisinage de la neutralité).
De plus, ces mêmes auteurs montrent que pour le choux de Bruxelles, la conjugase de rein de porc n'est pas aussi efficace que celle de pancréas de poulet ou de plasma humain. Ceci est probablement dû à des inhibiteurs de l'enzyme dans ce type d'aliment.
Ainsi, le choix entre les différents types d'enzymes doit tenir compte de la nature de l'échantillon à traiter et de la méthode de dosage utilisée.
IV.2.3. Action tri-enzymatique:
Les protéines et les hydrates de carbones dans les aliments peuvent lier et adsorber les folates. Beaucoup d'auteurs se sont basés sur cette hypothèse pour étudier une extraction avec plusieurs types d'enzymes.
Martin et coll. (50), utilisent une conjugase de pancréas de poulet couplée à une alpha amylase et à une pronase (protéase). Ce traitement entraîne une augmentation de 19% de la teneur en folates.
Pedersen (61), montre que le traitement par les amylases augmente le taux en folates de 9%.
De Souza et Eitenmiller (17), évaluent 4 types de traitements enzymatiques:
- conjugase seule,
- conjugase et alpha amylase, - conjugase et pronase,
Ce dernier traitement s'avère être le plus efficace. En effet, des aliments riches en protéines fournissent des valeurs élevées en folates totaux après traitement par la pronase; alors que des aliments riches en amidon donnent des valeurs élevées en folates totaux après traitement par une alpha amylase.
D'une manière générale, la déconjugaison des folates est influençée par la température, le temps d'incubation, le pH et la purification de l'enzyme utilisée.
IV.2.4. Inhibiteurs de la déconjugaison:
Gregory (30), montre qu'il existe une inhibition potentielle de la conjugase dans certains extraits alimentaires.
Pour Go li et V anderslice (28), le citrate inhibe la transformation en mono glutamates. Il donne surtout des formes di glutamiques (ce qui est néfaste pour l'analyse par microbiologie car les germes utilisés (tels que Lactobacillus casei) ne reconnaissent que les formes monoglutamiques, d'où l'obtention de résultats par défaut. Mais il existe aussi d'autres inhibiteurs d'effet moindre comme l'oxalate, le tartrate, l'acétate et les chlorures.
De la même façon, Engelhart et Gregory (20), affinnent que la, conjugase de rein de porc est inhibée par des composés présents dans les extraits alimentaires (citrates mais aussi, acides nucléiques et polysaccharides anioniques). La conjugase de pancréas de poulet semble moins sensible à ces inhibiteurs.
IV.2.5. Autres types d'enzymes utilisées:
Otles et Hisil (59), utilisent un mélange (Takadiastase et Papaïne), à pH 4,5 et une incubation toute la nuit à 37°C.
Jacoby et Henry (42), proposent un mélange de Papaïne (5% p/v) et de protéase bactérienne (5% p/v) avec de l'eau, à pH 8,4. La protéase permet d'éviter, dans certains cas, la présence de pics interférants en CLHP. Elle augmente aussi le pourcentage de récupération de l'acide folique.
D'autres auteurs utilisent des conjugases de foie de rat (Gounelle et coll. (29); Gregory (30)), ou de pancréas de rat (Andersson et Oeste (3)(4)).
Plus simplement, Aramouni et Godber (7), ont mis en oeuvre deux méthodes de déconjugaison, après homogénéisation dans un tampon acétate à pH 4,5, l'une utilisant une conjugase de rein de porc; l'autre, une conjugase endogène.
Cette dernière technique a été choisie car elle ne demande pas d'apport exogène d'enzyme (Varela-Moreiras et coll. (75)).
D'ooe façon générale, la déconjugaison est plus élevée quand on augmente le taux de conjugase (Pedersen (61)).
IV.3. Purification des échantillons après traitement enzymatique:
La préparation des échantillons fait intervenir ooe purification en vue d'analyses chromatographiques.
La plus classique consiste en ooe centrifugation. Mais on peut aussi utiliser des résines échangeuses d'anions ou de cations, des colonnes de chromatographie d'affinité ou des colonnes polaires ou apolaires.
IV.3.1. La centrifugation:
Elle est pratiquée par de nombreux auteurs (Day et Gregory (16); Andersson et Oeste (3)(4); Aramouni et Godber (7); De Souza et Eitenmiller
(17); Leeming et coll. (47); Holt et coll. (38); White (77); Klein et coll. (44)),
mais elle parait insuffisante et est souvent suivie d'ooe extraction en phase solide. IV.3.2. Les colonnes de chromatographie d'affinité:
Selhub et coll. (69), utilisent ooe telle colonne constituée de Folate Binding Protein (FBP) liée à des grains de Sépharose, afin de purifier les extraits tissulaires.
Un excès de FBP pourrait quantitativement lier les folates de l'échantillon malgré les différentes affinités des diverses formes (% de récupération de 90 à 95%).
Varela-Moreiras et coll. (75), Selhub (68), utilisent la même technique. Le principe est simple:
1 °) Une FBP du lait est isolée et purifiée par chromatographie d'affinité.
2°) Cette FBP est immobilisée sur du Sépharose (Sépharose 4B activé au CNBr).
3 °) L'ensemble est utilisé comme matrice d'affinité pour la purification des folates issus d'extraits tissulaires.
Après fixation, l'élution est réalisée par de l'acide trifluoro acétique 0,02M contenant un agent antioxydant.
IV.3.3. Résines échangeuses de cations:
Il s'agit de silices échangeuses de cations (sulfoniques) de type SCX (Ni et coll. (55)).
La rétention des folates sur ce type de colonne augmente quand le pH diminue avec passage à la forme moléculaire puis cationique.
En effet, l'acide folique possède 3 constantes acide/base: pk 1 = 9 '00
<--->
NH2 (2)pk2 = 6,75
<--->
COOH en alpha pk3 = 4,65<--->
COOH en gamma(cf. structures en 1.1.1.)
Il y a neutralisation interne et formation d'un zwitterion entre pH 4,65 et 6,75 (cf. schéma page 16).
A pH 7 ,5, l'élution de l'acide folique de la colonne est très rapide (sous forme anionique).
IV.3.4. Résines échangeuses d'anions:
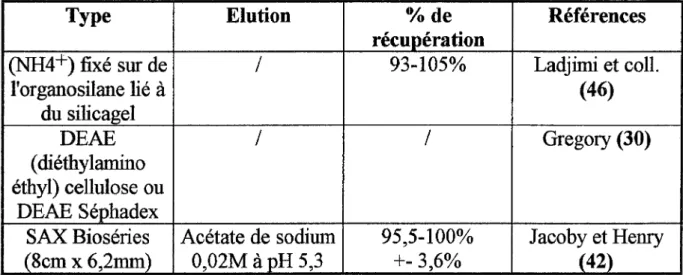
Elles sont répertoriées dans le tableau ci-après:
Tableau XI: Résines échangeuses d'anions:
Type Elution 0/o de Références
récupération
(NH4+) fixé sur de 1 93-105% Ladjimi et coll. l'organosilane lié à (46) du silicagel DEAE 1 1 Gregory (30) ( diéthylamino éthyl) cellulose ou DEAE Séphadex
SAX Bioséries Acétate de sodium 95,5-100% Jacoby et Henry . (8cm x 6,2mm) 0,02M à pH 5,3 +- 3,6o/o (42)
IV.3.5. Colonnes polaires:
Lucock et coll. ( 48), White (78), utilisent des cartouches de silice Bond Elut greffées avec des restes phényles. L'élution peut se faire par du méthanol pur ou par un tampon contenant 30% de méthanol.
Les pourcentages de récupération sont de 89,9% +/- 6,7% (White (78)).
L'extraction par cette technique est plus sélective qu'une extraction par des colonnes en Cg ou C18 ou par échange d'ions (Lucock et coll. (48)).
IV.3.6. Colonnes apolaires:
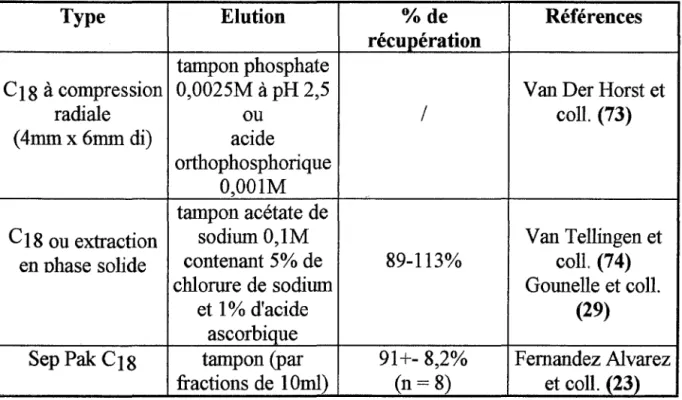
Il existe plusieurs types de colonnes apolaires (cf. tableau ci-après). Tableau XII: Colonnes apolaires:
Type Elution o/o de Références
récupération tampon phosphate
C18 à compression 0,0025M à pH 2,5 V an Der Horst et
radiale ou 1 coll. (73)
( 4mm x 6mm di) acide
orthophosphorique 0,001M tampon acétate de
C 18 ou extraction sodium 0,1M V an Tellingen et en ohase solide contenant 5% de 89-113% coll. (74)
chlorure de sodium Gonnelle et coll.
et 1% d'acide (29)
ascorbique
Sep Pak C18 tampon (par 91+- 8,2% F ernandez Alvarez fractions de 10ml) (n= 8) et coll. (23) Remarque: Un lavage après fixation sur la cartouche est recommandé de manière à éliminer les substances faiblement fixées qui pourraient interférer.
V. TECHNIQUES D'ANALYSE:
Un certain nombre de méthodes de dosage des folates ont été développées. Du fait des difficultés qu'elles posent en analyse de routine, les techniques microbiologiques ont laissé place aux méthodes immuno-enzymatiques ou immuno-enzymatiques, ainsi qu'aux techniques chromatographiques. Dans ce chapitre, nous passerons en revue tous les procédés actuellement mis en oeuvre, en soulignant les avantages et les inconvénients de chacun.
V.l. Méthode microbiologique:
Cette méthode reste encore la méthode officielle pour le dosage des folates, mais il semble maintenant que sa fiabilité soit contestée.
V.l.l. Principe:
Le dosage microbiologique consiste à étudier la croissance d'un micro-organisme qui ne peut se développer qu'en présence de folates et ceci, proportionnellement à la concentration en vitamines du milieu.
On utilise généralement 3 types de micro-organismes:
*
Lactobacillus casei (L. c.),*
Streptococcus faecalis (S. f),*
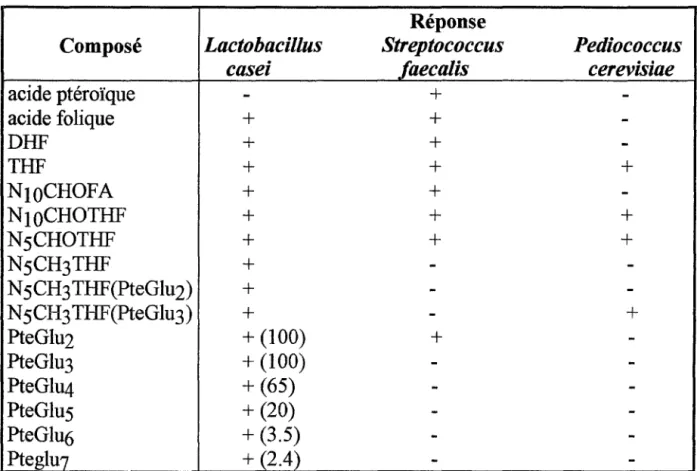
Pediococcus cerevisiae (P.c.).Cependant, seul L.
c.
semble répondre à un maximum de formes de cette vitamine (Klein et coll. (44); Selhub (68)) (cf. tableau XIII)Tableau XIII: Réponse des micro-organismes aux différentes formes de folates:(68)
Réponse
Composé
Lactobacillus
Streptococcus
Pediococcus
casei
faecalis
cerevisiae
acide ptéroïque
-
+
-acide folique+
+
-DHF+
+
-THF+
+
+
N1oCHOFA+
+
-N1oCHOTHF+
+
+
N5CHOTHF+
+
+
N5CH3THF+
-
-N5CH3THF(PteGlu2)+
-
-N5CH3THF(PteGlu3)+
-
+
PteGlu2+
(100)+
-PteGlu3+
(100)-
-PteGlu4+
(65)-
-PteGlu5
+
(20)-
-PteGlu6+
(3.5)-
-Pteglu7+
(2.4)-
-Les valeurs entre parenthèses sont des pourcentages. V.1.2. Inconvénients:
Malheureusement cette technique est longue (plusieurs heures) et fastidieuse. L'exactitude des résultats implique une maîtrise parfaite de divers paramètres (pH du milieu, température, mutations ... ) dont peut dépendre le développement bactérien.
Jacoby et Henry (42), trouvent la méthode peu reproductible: la réponse de L.
c.
peut varier par inhibition ou stimulation par des composés présents dans l'alimentation.Néanmoins, certains auteurs l'utilisent encore (Goli et Vanderslice (28); Ni et coll. (55); Klein et coll. (44); Andersson et Oeste (3)(4)).
Ainsi, lors d'une intercomparaison de différentes méthodes pour la détermination des folates, Finglas et coll. (27), montrent qu'en général, il y a une bonne corrélation des résultats.