HAL Id: tel-03246761
https://tel.archives-ouvertes.fr/tel-03246761
Submitted on 2 Jun 2021
HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Aurélie Gourgeon
To cite this version:
Aurélie Gourgeon. Régionalisation fonctionnelle du cortex cérébelleux postérieur chez le rat. Neuro-sciences [q-bio.NC]. Sorbonne Université, 2019. Français. �NNT : 2019SORUS568�. �tel-03246761�
Sorbonne Université
Ecole doctorale Cerveau, Cognition et Comportement
Institut de Biologie de l’Ecole Normale Supérieure Equipe Neurophysiologie des Circuits Cérébraux
ENS -CNRS UMR 8197- INSERM U1024
Régionalisation fonctionnelle du cortex cérébelleux
postérieur chez le rat
Par Aurélie GOURGEON
Thèse de doctorat de Biologie – Mention Neurosciences
Dirigée par Clément LENA
Présentée et soutenue publiquement le 17 décembre 2019 Devant un jury composé de :
Jean MARIANI Professeur des Universités – Praticien Hospitalier Président
Francesca SARGOLINI Maître de Conférence Rapportrice
Philippe ISOPE Directeur de Recherche Rapporteur
Mathieu BERANECK Chargé de Recherche Examinateur
Christelle ROCHEFORT Maître de Conférence Examinatrice
Julie KOENIG Maître de Conférence Examinatrice
Remerciements
Je tiens tout d’abord à remercier les membres de mon jury qui liront ce manuscrit et notamment les rapporteurs, Philippe Isope et Francesca Sargolini. J’espère qu’ils prendront autant de plaisir à le lire que j’en ai eu à travailler et partager sur ce sujet passionnant durant ces quatre années.
Mes pensées vont également à ma famille, mes parents et mon frère pour le soutien indéfectible qu’ils m’ont apporté durant toutes ces années. Cela fait onze ans maintenant qu’ils soutiennent ma soif de connaissance et de curiosité. Tout le monde n’a malheureusement pas cette chance ! Je tiens tout spécialement à remercier ma mère, relectrice officielle et assidue de ce manuscrit, sans qui, les dernières semaines auraient sûrement été insurmontables.
Certaines rencontres ont cette particularité de rendre l’impossible envisageable ; ma rencontre avec Madame Serradas est de celles-ci. Je n’écrirais pas ces lignes sans la confiance qu’elle m’a accordée pour intégrer le master 1 de neurosciences de Sorbonne Université il y a six ans maintenant. Jamais je n’aurais pu poursuivre mes études dans cette voie après mon diplôme d’ergothérapie et encore moins envisager un doctorat, sans l’ouverture d’esprit dont elle a fait preuve. Je n’oublierai jamais la phrase qu’elle m’a lancée à la sortie de l’entretien « on peut très bien avoir échouer au concours de médecine, se tromper d’orientation et très bien réussir après ! ». Si j’étais déjà déterminée, elle n’a fait que renforcer ma conviction.
Cependant rien n’aurait pu se concrétiser, sans l’opportunité que Clément m’a accordée en m’intégrant à son équipe pour mon stage de M2 puis en doctorat ; heureusement pour moi, il apprécie les parcours atypiques ! Merci de m’avoir laissé ma chance dans un domaine de recherche que je n’avais jamais approché et pour lequel mon ignorance expérimentale aurait pu être rédhibitoire. Merci pour ta patience, tes conseils, tes remarques, mais aussi pour nos désaccords qui ont enrichi nos discussions et sans lesquels ce travail n’aurait pu voir le jour. Comme il se plaît à le répéter, la thèse est un chemin long initiatique qui nous éclaire tant
Je souhaite également souligner le soutien indéfectible de Daniela dans les situations de crise ainsi que ses nombreux encouragements et conseils délivrés sans modération au cours de cette thèse.
Matthieu, tu as guidé mes premiers pas dans la recherche en neurosciences, tu m’as fait découvrir le vestibulo-cervelet, tu me l’as fait aimer (et un peu détester aussi !) et j’ai eu l’honneur de poursuivre tes travaux de thèse. Sache, que finalement tu avais vu juste, certaines cellules de Purkinje « prédisent » bien le mouvement !
Comment travailler sur le système vestibulaire et ne pas parler de Guillaume. Tu m’as à peu près tout appris, de la précision chirurgicale à l’analyse des données. Merci pour le temps que tu m’as consacré, les urgences que tu as gérées (j’ai en tête le concours de l’ED3C), tes conseils toujours avisés et pour les 5000 lignes de code que tu m’as transmises. Je dois toutefois avouer que la première fois que je les ai ouvertes, un sentiment de solitude m’a submergé ; surtout lorsque j’ai désespérément recherché une fonction basique R du nom de « meow » !
Il m’est impossible d’évoquer cette thèse ou l’équipe Neurophysiologie des Circuits Cérébraux, sans évoquer ses membres les plus « enthousiastes » (terminologie proposée par la communauté neuroscientifique française) ! J’ai eu la chance de côtoyer tous les jours, non pas des collègues mais des amis. Avec vous j’ai vécu toutes les émotions, et j’ai toujours pu compter sur votre soutien moral, vos conseils et sur votre aide. Je n’oublierai jamais le bouddhisme d’Hind, l’« AVC juste là » ou le « wait and see » de Thibault ou encore les septantes de Bérénice. Je n’oublie bien évidement pas Idriss et sa bonne humeur, qui prend la relève dans l’étude du système vestibulaire et Romain « le petit nouveau » qui nous met largement déjà tous au tapis dans l’analyse et le code.
Un grand merci à vous tous et ne changez rien !
Je pense également aux membres des Cérébelliqueux et tout particulièrement à Alan et Victor pour leurs apports scientifiques et les très bons moments passés en leur compagnie.
Gérard, qu’aurait été ma thèse sans toi ? Un champ de complications. Tu m’as enseigné les bases de l’électronique, de la mécanique et l’art, ô combien inconsidéré, du bidouillage ! Combien de fois suis-je venue avec des requêtes plus ou moins loufoques auxquelles tu as toujours accepté de contribuer, même lorsqu’il s’agissait à 19h de fabriquer une « guitare libellule décorée de paillettes vertes ».
Je tiens également à remercier Bilel, pour toutes les fois où j’ai eu des problèmes de disque dur, d’éthernet, de serveur. Avec moi il ne risquait pas de s’ennuyer ! Je pense que toutes les personnes qui me côtoient s’accorderont sur le fait que j’ai la « chkoumoune » de ce côté-là.
Il me serait impossible d’oublier Anna, Yasmine, Josquin et Anne-Claire, mes acolytes de master. Merci à vous pour les soirées à raconter nos misères réciproques de manip’ et les discussions dans lesquelles on refait le monde. Si tout se passe bien, je vous retrouve bientôt au club des docteurs !
Sommaire
Partie I : Introduction ________________________________________________________ 1
1. Le système vestibulaire ______________________________________________________ 3 1.1. De la détection de la gravité à un système vestibulaire complexe _________________________ 3
1.1.1. Le premier sens : la graviception ________________________________________________ 3 1.1.2. De l’oreille primitive à un système vestibulaire complet ______________________________ 4 1.2. Anatomie du système vestibulaire__________________________________________________ 5 1.2.1. Les cellules ciliées : cellules mécano-électriques ____________________________________ 5 1.2.2. Les senseurs vestibulaires ______________________________________________________ 7 1.2.2.1. Les canaux semi-circulaires ________________________________________________ 7 1.2.2.2. Les organes otolithiques __________________________________________________ 8 1.3. Le nerf vestibulaire : de l’oreille interne au cerveau ____________________________________ 9 1.3.1. Description générale __________________________________________________________ 9 1.3.2. Un nerf, trois types d’afférences _________________________________________________ 9 1.3.3. Une innervation efférente des organes vestibulaires ________________________________ 11 1.4. Implication fonctionnelle du système vestibulaire ____________________________________ 11 1.4.1. Du système autonome à la navigation ___________________________________________ 11 1.4.2. Les ambiguïtés de l’information inertielle ________________________________________ 12 2. Cervelet et cortex cérébelleux ________________________________________________ 14
2.1. Description anatomique générale du cervelet _______________________________________ 14 2.1.1. Premières descriptions et phylogénie ____________________________________________ 14 2.1.2. Régionalisation antéro-postérieure : lobes et lobules cérébelleux _____________________ 16 2.1.3. Organisation parasagittale globale du cervelet ____________________________________ 17 2.2. Le cortex cérébelleux : une organisation laminaire ____________________________________ 18 2.2.1. Description générale et phylogénie _____________________________________________ 18 2.2.2. La cellule granulaire __________________________________________________________ 19 2.2.3. La cellule de Purkinje _________________________________________________________ 20 2.2.4. Les interneurones de la couche moléculaire ______________________________________ 21 2.2.5. Les interneurones de la couche granulaire ________________________________________ 22 2.2.5.1. Les cellules de Golgi _____________________________________________________ 22 2.2.5.2. Les cellules de Lugaro ___________________________________________________ 23 2.2.5.3. Les cellules unipolaires en brosse __________________________________________ 23 2.3. Cortex cérébelleux et filtre adaptatif _______________________________________________ 25 2.3.1. Le modèle interne : théorisation du fonctionnement sensori-moteur __________________ 25 2.3.2. Cytoarchitecture du cortex-cérébelleux et filtre adaptatif ____________________________ 27
3. Le circuit vestibulo-cérébelleux _______________________________________________ 30 3.1. Phylogénie et anatomie _________________________________________________________ 30
3.1.1. Le cortex vestibulo-cérébelleux ________________________________________________ 30 3.1.2. Les noyaux vestibulaires : intégrateurs multisensoriels ______________________________ 31 3.1.2.1. Description générale ____________________________________________________ 31 3.1.2.2. Convergence des afférences vestibulaires ___________________________________ 32 3.1.2.3. Afférences non-vestibulaires des noyaux vestibulaires _________________________ 33 3.2. Organisation parasagittale du cortex du vestibulo-cervelet _____________________________ 34 3.2.1. Régionalisation des cellules unipolaires en brosse __________________________________ 34 3.2.2. Marquage moléculaire du cortex cérébelleux caudal________________________________ 36 3.3. Les boucles cortico-nucléo-olivaires du vestibulo-cervelet ______________________________ 37 3.4. Régionalisation des fibres moussues vestibulo-cérébelleuses ___________________________ 38 3.4.1. Les afférences vestibulaires ___________________________________________________ 38 3.4.2. Les afférences spécifiques de l’uvula ____________________________________________ 39 4. Projet de thèse et objectifs __________________________________________________ 40
Partie II : Matériel et méthodes _______________________________________________ 41
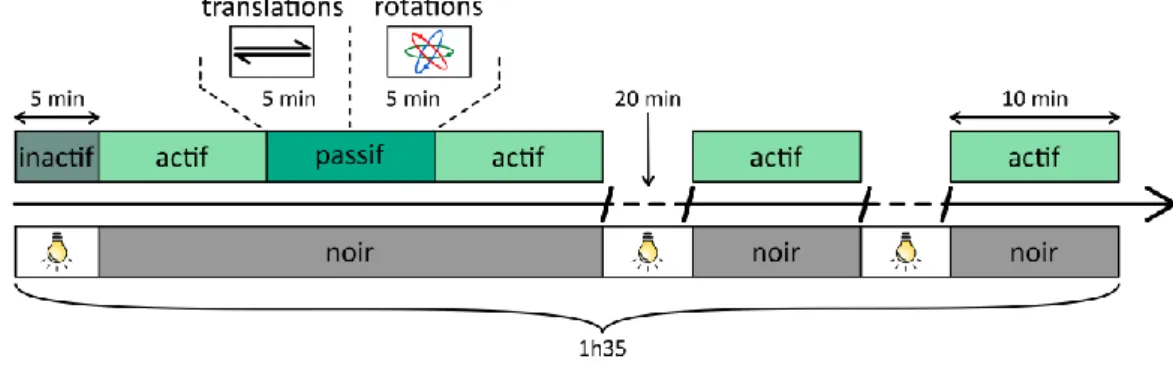
1. Animaux _________________________________________________________________ 43 2. Mesures inertielles des mouvements de la tête __________________________________ 43 3. Conception du micro-descendeur _____________________________________________ 45 4. Électrode d’enregistrement __________________________________________________ 46 5. Assemblage de l’implant ____________________________________________________ 47 6. Implantation et techniques opératoires ________________________________________ 48 6.1. Anesthésie et analgésie _________________________________________________________ 48 6.2. Implantation __________________________________________________________________ 48 6.3. Suivi post-opératoire des animaux ________________________________________________ 50 7. Enregistrements électrophysiologiques et inertiels _______________________________ 50 8. Protocole expérimental _____________________________________________________ 51 8.1. Habituation et descente de l’électrode _____________________________________________ 51 8.2. Conditions d’enregistrement _____________________________________________________ 51 8.3. Enregistrement en condition passive_______________________________________________ 52
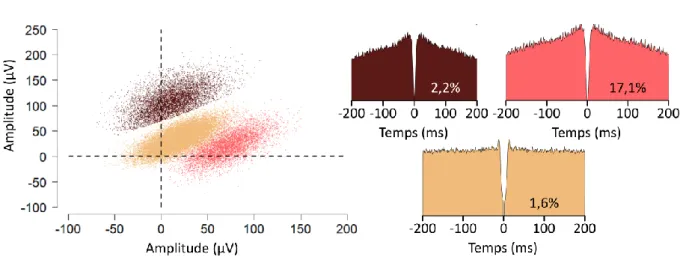
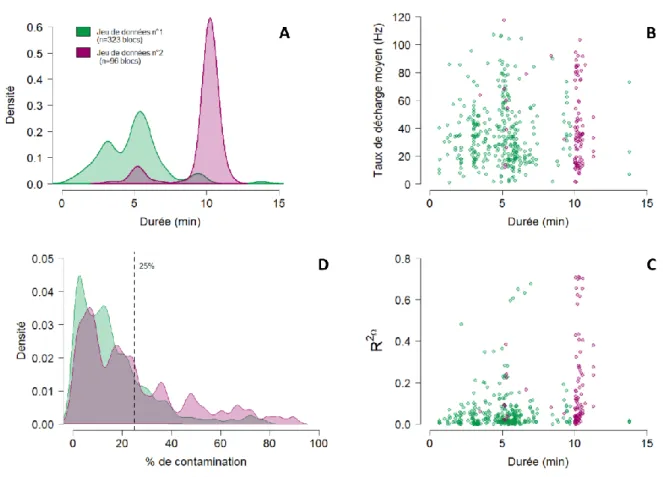
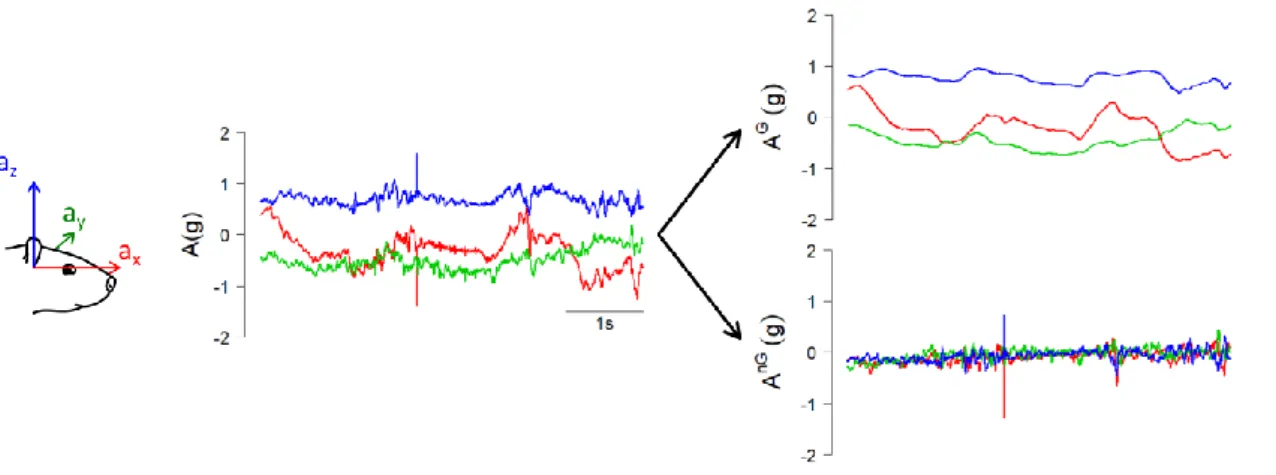
9. Analyse des données électrophysiologiques et inertielles __________________________ 53 9.1. Isolement des unités cellulaires ___________________________________________________ 53 9.2. Association de deux jeux de données ______________________________________________ 54 9.3. Classification des unités cellulaires enregistrées ______________________________________ 57 9.4. Répartition spatiale des cellules de Purkinje enregistrées ______________________________ 58 9.5. Analyses _____________________________________________________________________ 61 9.5.1. Calcul des taux de décharges et des coefficient de variations ________________________ 61 9.5.2. Analyse du signal accélérométrique : estimation de l’accélération gravitationnelle et de l’orientation _______________________________________________________________________ 62 9.5.3. Construction des champs récepteurs ____________________________________________ 63 9.5.4. Estimation du taux de décharge imputable aux paramètres inertiels ___________________ 65 9.6. Tests statistiques ______________________________________________________________ 67
Partie III : Résultats _________________________________________________________ 69
1. Régionalisation de l’intégration vestibulaire dans le cervelet postérieur chez le rat _____ 71 1.1. Les cellules de Purkinje du cervelet postérieur affichent des propriétés électrophysiologiques hétérogènes _________________________________________________________________________ 71 1.2. Le cervelet caudal présente des sous-populations cellulaires spécifiques pour certains
paramètres du mouvement _____________________________________________________________ 75 1.3. La partie latérale du cervelet postérieur contient plus de cellules « inertielles » ____________ 78 1.4. Une sous-population de cellules « prédictives » apparait selon un gradient médio-latéral dans le cervelet caudal _______________________________________________________________________ 81 1.5. L’activité des cellules de Purkinje du cortex cérébelleux caudal ne semble pas modulée par des mouvements passifs ___________________________________________________________________ 86 2. Article : Mesure inertielle sans-fil de la cinématique de la tête chez le rat libre de ses mouvements __________________________________________________________________ 89
Partie IV : Discussion ______________________________________________________ 103 Partie V : Bibliographie _____________________________________________________ 111 Partie VI : Annexes ________________________________________________________ 127
Liste des figures
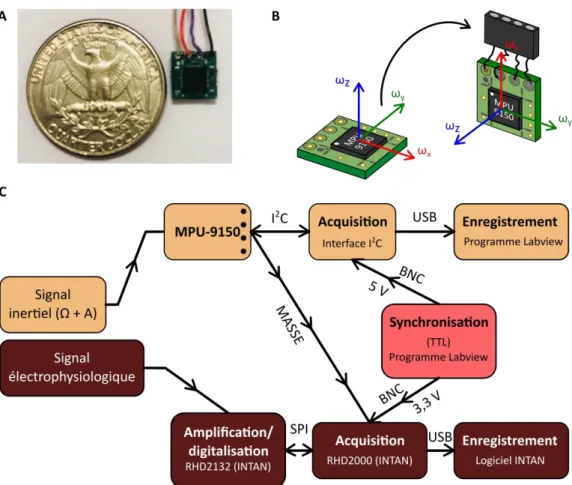
Figure 1: Acquisition et enregistrement des données inertielles. _____________________________________ 45 Figure 2: Microdescendeur de précision. _______________________________________________________ 46 Figure 3: Paradigme expérimental et conditions d'enregistrement. __________________________________ 52 Figure 4: Isolement des unités cellulaires. _______________________________________________________ 54 Figure 5: Comparaison des deux jeux de données analysés. ________________________________________ 56 Figure 6: Classification des cellules enregistrées. _________________________________________________ 58 Figure 7: Segmentation théorique médio-latérale et dorso-ventrale du cervelet postérieur. _______________ 59 Figure 8: Justification de la segmentation médio-latérale théorique du cortex cérébelleux postérieur. ______ 60 Figure 9: Estimation de l'accélération gravitationnelle. ____________________________________________ 64 Figure 11: Estimation du taux de décharge des cellules de Purkinje du cervelet postérieur dépendant des
paramètres du mouvement. _________________________________________________________________ 66
Figure 12: Propriétés électrophysiologiques des cellules de Purkinje chez le rat libre de ses mouvements dans
les différents lobules du cervelet postérieur. ____________________________________________________ 72
Figure 13: Propriétés électrophysiologiques des cellules de Purkinje des lobules cérébelleux selon leur
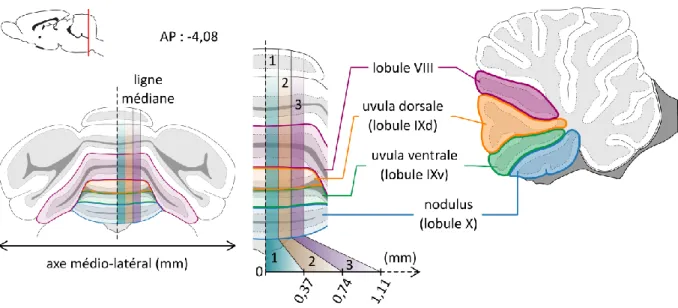
localisation parasagittale. ___________________________________________________________________ 74
Figure 14: Sensibilité des cellules de Purkinje du cervelet postérieur aux paramètres inertiels. ____________ 76 Figure 15: Répartition des cellules « inertielles » dans les différents lobules du cervelet caudal et selon l’axe
médio-latéral. _____________________________________________________________________________ 79
Figure 16: Répartition des sous-populations de cellules Ω, AG et mixtes dans les lobules VIII, IX et X et selon l'axe
médio-latéral. _____________________________________________________________________________ 80
Figure 17: Caractérisation de cellules de Purkinje "prédictives" dans le cervelet postérieur. _______________ 82 Figure 18: Sensibilité des cellules de Purkinje du cervelet postérieur aux paramètres angulaires. ___________ 84 Figure 19: Répartition des cellules "prédictives" du cervelet postérieur selon les axes dorso-ventral et
médio-latéral. __________________________________________________________________________________ 85
Figure 20: Comparaison des latences des cellules de Purkinje enregistrées en condition active et passive. ___ 86 Figure 21: Comparaison de la sensibilité au mouvement des cellules de Purkinje enregistrées en condition
passive et active. __________________________________________________________________________ 87
Figure 22: Corrélation cumulative entre les taux de décharge instantanés des cellules de Purkinje et leurs
prédictions selon différents paramètres ou combinaisons de paramètres inertiels. _____________________ 130
Figure 23: Champs récepteurs de cellules sensibles à la rotation, à l'accélération gravitationnelle ou à leurs
combinaisons. ____________________________________________________________________________ 130
Figure 24: Comparaison des sensibilités des cellules « rotationnelles » et « gravitationnelles » avec la
Liste des abréviations et symboles
Acronymes et sigles
:- ISI : Inter Spike Interval - CV : Coefficient de Variation - LTP : Potentiation à Long Terme - LTD : Dépression à Long Terme
- ZII+/- : Zébrine II (cellules positives au marquage de l’aldolase C)
Symboles :
- Ω + AG : vitesse angulaire + accélération gravitationnelle
- Ω + A : vitesse angulaire + accélération totale
- α + AG : accélération angulaire + accélération gravitationnelle
- α + A : accélération angulaire + accélération totale - A : accélération totale
- J : jerk (dérivée de l’accélération gravitationnelle) - AG : l’accélération gravitationnelle
- Ω + AnG : vitesse angulaire + accélération non gravitationnelle
- Ω : vitesse angulaire
- α + AnG : accélération angulaire + accélération non gravitationnelle
- α : accélération angulaire
1. Le système vestibulaire
1.1. De la détection de la gravité à un système vestibulaire
complexe
1.1.1.
Le premier sens : la graviception
L’équilibre n’existe pas, un corps inerte ne tient pas debout. Le maintien de la posture résulte d’un processus actif, d’une lutte constante contre la chute qui, dans le règne animal, nécessite une mesure précise de la gravité afin de maintenir l’orientation du corps. Toutefois, bien que constant dans l’espace, le vecteur de direction de la gravité dans le référentiel de l’animal varie en fonction des mouvements de celui-ci et notamment pendant la locomotion, qu’il s’agisse de marche, de nage ou de vol.
Ainsi, il est nécessaire aux animaux de détecter leur position par rapport à la verticale. Pour les espèces douées d’une vision suffisante, ce sens pourrait suffire pour estimer leur position et leur orientation dans l’environnement. Néanmoins, cette appréciation visuelle ne saurait être exclusive. Sans une autre sensorialité impliquée dans la détection de la verticale, tout déplacement dans le noir serait extrêmement malaisé.
Ainsi la détection de la gravité est le premier sens développé dans le règne animal bien avant que soit complétée la liste de ceux qui nous semblent constituer aujourd’hui notre sensorialité et que l’on nomme communément les « cinq sens » (le goût, l’odorat, le toucher, la vue et l’ouïe).
Il existe alors deux stratégies pour détecter la gravité : la première consiste à intégrer des forces mesurées sur l’ensemble du corps, la seconde à évaluer la direction de la force gravitationelle en un seul point, à l’aide de senseurs dédiés. Ces solutions ne sont bien évidemment pas exclusives et peuvent fonctionner simultanément. Ainsi les mollusques, les crustacés ou les insectes utilisent un système de graviception localisé (statocystes) auquel peut s’ajouter des systèmes de détection de la charge articulaire ou tendineuse (Bender and Frye, 2009).
1.1.2.
De l’oreille primitive à un système vestibulaire complet
Toutefois, cette estimation de la gravité, bien qu’indispensable, ne permet ni de détecter les mouvements de la tête par rapport au corps ni d’intégrer cette information avec une autre sensorialité : la vision. Ainsi, ces deux systèmes sensoriels gérés respectivement par l’oreille interne primitive et le globe oculaire, apparaissent avec les vertébrés. Ce lien phylogénétique trouve sa source dans la nécessité de stabiliser l’image sur la rétine lors des mouvements de la tête grâce au réflexe vestibulo-oculaire (Straka et al., 2014). En effet, les myxinoïdes (crâniates invertébrés) ne possèdent pas d’yeux fonctionnels, leur « oreille interne » se résume alors à un organe sensible à l’accélération linéaire et à un unique canal-semi circulaire qui, contrairement à ceux des vertébrés, ne détecte pas la rotation mais une direction. La lamproie (vertébré agnathe) apparait, quant à elle, comme dotée du système le plus archaïque d’oreille interne primitive avec la présence de deux canaux semi-circulaires (antérieur et postérieur), sensibles à la rotation, et d’une macula dite « commune », sensible à l’accélération linéaire incluant donc la gravité ; ces senseurs étant indispensables et associés à la présence d’yeux fonctionnels et donc au réflexe vestibulo-oculaire (Straka and Baker, 2013).
On ne peut cependant parler d’oreille interne véritable qu’avec l’apparition du troisième canal semi-circulaire (horizontal), présent chez tous les gnathostomes, qui ouvre la possibilité de détecter les rotations de la tête dans l’ensemble des directions. Les senseurs inertiels, quant à eux, peuvent voir leur nombre varier ; l’utricule et le saccule sont présents chez tous alors que la lagena fait défaut aux mammifères. Hormis les canaux semi-circulaires et l’utricule fortement conservés parmi les vertébrés, le saccule et d’autres structures morphologiquement différentes appelées papilles présentent une variabilité tant par leur présence que par leur sensorialité. Ainsi, alors que chez les mammifères le saccule n’a qu’une fonction inertielle, il a un rôle purement acoustique chez certains poissons et une sensibilité mixte chez les amphibiens et les reptiles (Carey and Amin, 2006). La lagena quant à elle, présente une sensibilité acoustique chez certains poissons, qui disparaît chez les oiseaux et les amphibiens pour lesquels elle reprend une fonction inertielle avec le développement de deux papilles dévolues au signaux acoustiques, respectivement la papille basilaire et la papille amphibienne (Mahmoud et al., 2013), la cochlée n’étant présente que chez certains animaux
terrestres dont les mammifères. Par ailleurs, la lagena pourrait être également impliquée dans la magnétoréception chez les oiseaux, bien que cette fonction reste un sujet de débat, notamment concernant les projections centrales de cette structure qui diffèrent selon les espèces (Mahmoud et al., 2013; Wu and Dickman, 2011) et la présence de magnetorécepteurs dans la lagena qui n’a pu être mise en évidence (Malkemper et al., 2019). Enfin, une dernière structure présente chez certains vertébrés, la papille dite « ignorée » (neglecta) a une fonction variable selon les espèces. Elle permet la détection des rotations chez les tortues (Brichta and Goldberg, 1998) alors qu’elle est dévolue au système auditif et vibratoire de certains poissons.
1.2. Anatomie du système vestibulaire
Chez les vertébrés supérieurs, l’oreille interne ou labyrinthe présente en paire, est constituée de deux structures enchâssées ; la partie membranaire qui contient un fluide, l’endolymphe riche en potassium est protégée par une structure osseuse renfermant la périlymphe, riche en sodium (Köppl et al., 2018). Toutefois, en dépit de cette homogénéité anatomique, ce labyrinthe compte deux systèmes sensoriels distincts : la cochlée, associée à l’audition, et le système vestibulaire permettant d’encoder les mouvements de la tête. Contrairement au système auditif des vertébrés supérieurs qui ne requiert qu’un seul organe afin d’encoder l’information acoustique, la complexité et la diversité des mouvements de la tête nécessite le développement de différents senseurs vestibulaires. Ainsi la détection des différents mouvements est permise grâce aux canaux semi-circulaires sensibles aux rotations et aux organes otolithiques permettant la détection des accélérations linéaires. Bien que ségrégés dans des structures différentes, leur transduction est assurée par le même mécanisme, et par une cellule sensorielle ciliée mécano-électrique identique à celles retrouvées dans la cochlée et similaire aux cellules sensorielles de la ligne latérale des poissons électriques (Chagnaud et al., 2017).
1.2.1.
Les cellules ciliées : cellules mécano-électriques
Les cellules ciliées, accompagnées de deux autres types cellulaires, les cellules de soutien et les cellules dites « sombres », constituent un neuroépithélium. Les cellules de soutien sont
impliquées dans la migration des stéréocils, la phagocytose des débris cellulaires, l’homéostasie ionique (Burns and Stone, 2017; Wan et al., 2013) mais également dans la régénération de certaines afférences vestibulaires (Bucks et al., 2017; Hicks et al., 2020). Les cellules « sombres », quant à elles, sont engagées dans la production et la sécrétion de l’endolymphe (Casale and Agarwal, 2019; Wangemann, 1995). Le nombre de cellules ciliées est variable selon les animaux mais représente environ 100 000 unités chez la souris avec une répartition relativement équitable entre la crista des ampoules canalaires et les macula otolithiques (Eatock and Songer, 2011).
Ces cellules ciliées sont constituées à leur surface apicale de plusieurs dizaines de rangées de cils enchâssés dans une substance gélatineuse appelée cupule ou membrane otoconiale respectivement dans les canaux semi-circulaires et les organes otolithiques. Dans chaque cellule, on distingue les stéréocils dont la longueur augmente progressivement à mesure que l’on s’excentre de la cellule et le kinocil qui constitue le cil principal. Ce dernier, souvent bien plus long que le stéréocil le plus proche (Kelley et al., 2006) joue un rôle dans le développement de la polarisation des cellules ciliées de l’oreille interne (Jones et al., 2008) et définit, dans le cas du système vestibulaire, le vecteur de polarisation déterminant la sensibilité directionnelle de la cellule ciliée. Toutefois, bien qu’indispensable dans la formation du labyrinthe, il ne semble pas impliqué dans la maturation des cellules ciliées et ne participe que de façon indirecte à la mécano-transduction. En effet, les kinocils cochléaires dégénèrent après la naissance (Steyger et al., 1989) et ceux encore présents dans le système vestibulaire, ne possèdent pas à leur surface les canaux cationiques nécessaires.
En revanche, les stéréocils sont reliés entre eux et avec le kinocil par des filaments composés de cadhérines (Müller, 2008) à la base desquels on retrouve des canaux cationiques dont l’ouverture est conditionnée par la tension générée par ces filaments. Au repos, 10 à 20% des canaux cationiques sont ouverts, entraînant une décharge basale de glutamate à la synapse avec l’afférence vestibulaire (Hudspeth, 2005) qui varie selon les espèces et le type de senseur vestibulaire (Goldberg et al., 2012). Lorsqu’un mouvement correspondant à la sensibilité de la cellule ciliée intervient, les stéréocils se fléchissent en direction du kinocil et entraînent, grâce aux filaments, l’ouverture de canaux cationiques. L’endolymphe riche en potassium permet la dépolarisation de la cellule ciliée et induit à sa partie basale l’entrée de calcium nécessaire à
l’augmentation du relargage de glutamate. S’en suit alors une augmentation du taux de décharge de l’afférence vestibulaire sous-jacente (Hudspeth, 1989). A l’opposé, un mouvement réalisé contrairement au vecteur de polarisation de la cellule ciliée entraîne une fermeture des canaux cationiques à la partie apicale de la cellule et conduit ainsi à la diminution de la libération de neurotransmetteurs vers l’afférence primaire. Cette réduction a pour effet d’abaisser le niveau de décharge de la fibre vestibulaire. Ainsi, une même cellule ciliée favorise une modulation bidirectionnelle des afférences et permet de couvrir à elle seule une variabilité de mouvements.
1.2.2.
Les senseurs vestibulaires
Ainsi, les vertébrés supérieurs dont les mammifères, possèdent cinq senseurs vestibulaires bilatéraux ; trois canaux semi-circulaires (antérieur, postérieur et horizontal) et deux organes otolithiques, le saccule et l’utricule. Ces types de structures présentent des morphologies différentes.
1.2.2.1.
Les canaux semi-circulaires
Les canaux semi-circulaires, au nombre de trois permettent de détecter les rotations de la tête selon trois axes perpendiculaires entre eux et coplanaires avec les canaux opposés, assurant ainsi une sensibilité de tous les mouvements de la tête en trois dimensions. Toutefois, il est intéressant de noter que l’orientation de ces canaux ne dépend ni de la verticale ni de l’horizontale mais semble plutôt correspondre à l’alignement avec le regard et varie donc selon les espèces (voir section 1.1.2). Ainsi, chez le rat, le canal horizontal est incliné de 35° par rapport au plan horizontal (Blanks and Torigoe, 1989) alors qu’il l’est d’environ 23° chez le chat (Blanks et al., 1972) , 20° chez le singe (Blanks et al., 1985), et de 25° chez l’Homme (Blanks et al., 1975; Highstein et al., 2005).
À son extrémité, près de l’utricule, chaque canal présente un renflement, l’ampoule, contenant l’organe sensoriel, la crista. Cette dernière renferme la cupule, une structure gélatineuse dans laquelle sont enchâssés les cils des cellules ciliées. Celles-ci sont toutes orientées dans le même sens au sein d’une ampoule. Lors d’une rotation, le déplacement
relatif de l’endolymphe par rapport au canal induit une déflection de la cupule et des stéréocils qu’elle contient. Bien que les canaux semi-circulaires soient sensibles à l’accélération angulaire, la géométrie du canal, les propriétés physiques de l’endolymphe (sa densité et sa viscosité) ainsi que l’élasticité de la cupule ne permettent d’encoder ce paramètre que dans les basses fréquences (Goldberg et al., 2012). Les cellules ciliées transduisent alors la vitesse angulaire dans la gamme physiologique de fréquences des mouvements de la tête (0,025 et 25 Hz) et la position au-delà (Highstein et al., 2005). Ainsi, un mouvement prolongé de rotation à vitesse constante (supérieure à 10 à 20 secondes), n’entraîne plus de déflection de la cupule et les cellules ciliées deviennent insensibles au mouvement (Meeks and Bell, 2019). La disposition homogène des cellules ciliées des crista canalaires n’empêche pas une organisation plus complexe de cette structure liée aux afférences du nerf vestibulaire. On distingue ainsi trois zones concentriques d’aires plutôt égales : centrale, intermédiaire et périphérique (Fernández et al., 1988, 1995).
1.2.2.2.
Les organes otolithiques
Les organes otolithiques sont au nombre de deux, l’utricule et le saccule. Ils permettent d’encoder les accélérations linéaires dans les trois axes du mouvement grâce à leur forme de « haricot » (Angelaki et al., 1999; Engström et al., 1972; Fernandez and Goldberg, 1976). Structurellement, leur sensibilité au mouvement est différente de celle des canaux. En effet, les cils sont englués dans une membrane gélatineuse, la membrane otolithique également appelée membrane otoconiale, sur laquelle reposent des agrégats de carbonate de calcium nommés otoconies. Le poids de cette structure permet ainsi la sensibilité des organes otolithiques aux accélérations linéaires par effet de cisaillement des cils.
De plus, contrairement à celles présentes dans les canaux, ces cellules ciliées ont des orientations variables même si leur vecteur directionnel (localisation du kinocil par rapport au stéréocil) est toujours opposé de part et d’autre d’une ligne médiane imaginaire qui divise le saccule et l’utricule en deux parties (Li et al., 2008). Toutefois, ce vecteur directionnel n’est pas identique pour les deux structures : dans le saccule, les kinocils sont orientés vers l’extérieur alors que dans l’utricule, ils pointent vers l’intérieur. Toujours le long de cette ligne
médiane, une zone se distingue par ses afférences et son apparence histologique, la striole qui représente jusqu’à 10 à 20% de la surface des macula chez les rongeurs (Desai et al., 2005).
1.3. Le nerf vestibulaire : de l’oreille interne au cerveau
1.3.1.
Description générale
Le nerf vestibulaire transporte l’information entre l’oreille interne et le cerveau. Il s’associe avec le nerf cochléaire pour former le nerf vestibulo-cochléaire (nerf VIII) pour entrer tout comme le nerf facial (nerf crânial VII), dans le système nerveux via le méat auditif interne.
Le nerf vestibulaire est formé de cellules bipolaires myélinisées dont le soma se trouve dans le ganglion de Scarpa. Elles forment, au niveau périphérique, des synapses directement avec les cellules ciliées vestibulaires et, au niveau central, dans le cortex cérébelleux postérieur et dans les noyaux vestibulaires du tronc cérébral. Elles sont cependant ségrégées en deux subdivisions au sein du nerf vestibulaire en fonction des organes qu’elles innervent. Ainsi, la partie supérieure du nerf est constituée d’afférences provenant de la crista des ampoules des canaux antérieur et horizontal, de l’utricule ainsi que de la partie postérieure du saccule. La partie inférieure se compose, quant à elle, de fibres innervant la partie postérieure du saccule ainsi que la crista de l’ampoule du canal postérieur (Fernandez and Goldberg, 1976).
Le nombre de fibres que contient le nerf vestibulaire varie selon les espèces avec une augmentation de leur nombre avec les espèces les plus évoluées. En effet, on trouve environ 8200 fibres chez le cochon d’Inde, 12400 chez le chat, 15400 chez le singe (Gacek and Rasmussen, 1961) et environ 22000 chez l’Homme (Park et al., 2001).
1.3.2.
Un nerf, trois types d’afférences
On distingue trois types d’afférences primaires vestibulaires, caractérisés par leur terminaison synaptique avec la cellule ciliée, leur zone de projection et leur propriété fonctionnelle : les fibres de type II qui innervent les cellules ciliées du même type, phylogénétiquement les plus anciennes, les fibres de type I qui contactent les cellules ciliées
du même nom, apparues avec les amniotes en même temps que la cochlée (Eatock and Songer, 2011) et celles qui forment des synapses avec les deux types de cellules ciliées (Fernández et al., 1988).
Bien que différentes sur bien d’autres aspects les crista des canaux semi-circulaires et les macula des organes otolithiques sont similaires quant aux caractéristiques de leurs afférences vestibulaires (Fernández et al., 1988, 1990; Goldberg et al., 2012).
Ainsi, les afférences de type I sont caractérisées par un diamètre important et par une terminaison synaptique en forme de calice autour des cellules ciliées. Elles innervent la partie centrale des crista canalaires et la striole des macula otolothiques et sont caractérisées par une activité électrophysiologique plutôt irrégulière. Les afférences de types II, quant à elles, présentent un petit diamètre axonal et forment des terminaisons synaptiques en bouton avec les cellules ciliées. Elles projettent dans la zone périphérique des crista et extrastriolaire des macula et leur activité est considérée comme régulière. Enfin, les afférences dimorphiques possèdent un diamètre moyen et innervent tant les cellules ciliées de type I que celles de type II, tout en respectant leurs spécificités synaptiques. On les trouve principalement dans la partie périphérique des crista et extrastriolaire des macula mais elles affichent toutefois un gradient entre les zones périphériques et centrales des deux types de neuroépithéliums. Leur activité électrophysiologique présente elle aussi un gradient, les cellules de la zone périphérique des crista et extrastriolaire des macula affichent une régularité qui laisse place à une irrégularité dans leur partie centrale.
Sur l’ensemble des 10 000 à 20 000 fibres afférentes qui innervent les organes vestibulaires (Gacek and Rasmussen, 1961), 20% correspondrait aux fibres de type I, 20% aux fibres de type II, le reste du contingent constituant les fibres dites dimorphiques (Kevetter and Leonard, 2002). Outre leur régularité qui semble différer selon leur type ou leur localisation, les afférences présentent une activité basale de décharge due au relargage de glutamate par les cellules ciliées au repos, dépendante du type de senseurs vestibulaires (voir section 1.2.1). Ainsi, l’activité basale des organes otolithiques est estimée à 60 Hz (Fernandez and Goldberg, 1976) et celle des canaux semi-circulaires à 90 Hz avec une sensibilité au mouvement de l’ordre de 0,5°/s (Miles and Braitman, 1980) chez le singe. Dans le cas des canaux semi-circulaires, l’intérêt d’un tel mécanisme réside dans le fait qu’une afférence peut être modulée
par augmentation de son taux de décharge ou par sa diminution en fonction du sens de la rotation effectuée. Ainsi, l’inhibition des afférences canalaires est en général limitée à l’encodage de rotations jusqu’à 180°/s, or il n’est pas rare que la vitesse angulaire des rotations atteigne 300 °/s chez l’homme. Toutefois, il a été montré que cette incohérence est surmontée par les propriétés des cellules ciliées, la réponse à l’excitation étant plus forte que celle de l’inhibition dans les afférences vestibulaires (Baloh et al., 1977).
1.3.3.
Une innervation efférente des organes vestibulaires
Les neuroépithéliums des senseurs vestibulaires présentent la particularité d’être innervés par des efférence provenant du tronc cérébral, qui réalisent des projections bilatérales sur les deux systèmes vestibulaires.
Succinctement, le nombre de fibres efférentes, estimé entre 500 et 1000, est faible comparé aux afférences vestibulaires bien que leurs terminaisons synaptiques semblent nombreuses et éparses, puisqu’il existe un ratio de 3:1 entre le nombre de synapses réalisées par les afférences et celles établies par les efférences (Goldberg et al., 2012). Ce système cholinergique pourrait jouer un rôle dans la modulation de l’activité des afférences par d’autres modalités sensorielles dans la plasticité vestibulaire, ou bien être la cible d’une décharge corollaire en provenance de moelle (Mathews et al., 2017).
1.4. Implication fonctionnelle du système vestibulaire
1.4.1.
Du système autonome à la navigation
Le système vestibulaire est impliqué dans de nombreuses fonctions biologiques aussi variées que complexes.
Tout d’abord, il participe à plusieurs arcs réflexes associés tant au système autonome qu’aux systèmes de stabilisation. Ainsi, il favorise les adaptations rapides que doivent effectuer les systèmes respiratoire et cardiaque lors de changement de posture (Yates, 1996). Chez les quadrupèdes par exemple, le passage à une position redressée imprévue entraîne une hypotension, qui est habituellement compensée par l’information otolithique vestibulaire. En effet, chez des rats dont le système vestibulaire a été lésé ou qui ont été élevés en
hypergravité, une diminution de la pression artérielle est observée (Abe et al., 2008). Le système vestibulaire est également impliqué dans plusieurs arcs réflexes permettant de maintenir la posture et l’équilibre tels que le réflexe vestibulo-spinal (compensation des mouvements) ou le réflexe vestibulo-colique (stabilisation de la tête). Il participe également au réflexe vestibulo-oculaire qui assure une vision stable lors de mouvements de rotation ou de translation de la tête.
Ensuite, le système vestibulaire semble jouer un rôle prépondérant dans la navigation et la représentation spatiale. Les patients souffrant de pathologies vestibulaires présentent des troubles de la navigation lors de déplacements complexes dès lors qu’ils n’ont plus accès à des indices visuels (St George and Fitzpatrick, 2011), notamment lorsque des rotations sont nécessaires (Glasauer et al., 2002). En effet, il a été montré chez le rat, que les propriétés de décharge des cellules de direction de la tête sont abolies après lésion du système vestibulaire et que l’influence de la vitesse angulaire sur le taux de décharge des cellules du noyau thalamique antérieur est également modifiée (Stackman and Taube, 1997). Il semble que des organes otolithiques sains soient indispensables à la conservation des propriétés des cellules de direction de la tête (Yoder and Taube, 2009). Toutefois, le système vestibulaire participe à des représentations spatiales nécessaires à la navigation plus élaborée encore. Ainsi, l’inactivation à la TTX du système vestibulaires chez le rat dégrade la corrélation du taux de décharge des cellules de lieu hippocampiques à leur localisation préférentielle (Stackman et al., 2002) et abolit également les oscillations théta du cortex enthorinal, entraînant alors une désorganisation des cellules de grille (Jacob et al., 2014).
Enfin, le système vestibulaire pourrait exercer une influence sur le système limbique et notamment dans l’anxiété et la dépression (Rajagopalan et al., 2017) bien que cette question reste sujette à débat (Best et al., 2006, 2007).
1.4.2.
Les ambiguïtés de l’information inertielle
Bien qu’impliqué dans de nombreuses fonctions, le système vestibulaire relaie une information inertielle brute qui contient plusieurs ambiguïtés.
Tout d’abord, les mouvements encodés par les senseurs vestibulaires ne renseignent pas sur les conditions de leurs réalisations. En effet, qu’ils soient auto-générés ou subis, les mouvements de la tête sont détectés de façon similaire par les organes otolithiques et les canaux semi-circulaires. Cependant, leur distinction est nécessaire puisque, dans un cas ils doivent être compensés par l’activation d’arcs réflexes (par exemple pour rétablir la posture lors d’une perte d’équilibre accidentelle), qui requièrent d’être inhibés dans l’autre (par exemple lorsque l’on se penche volontairement). L’innervation efférente du système vestibulaire fut évoquée en premier lieu comme moyen de modifier la sortie vestibulaire en fonction du contexte (Brichta and Goldberg, 2000; Goldberg and Fernández, 1980), mais des enregistrements extracellulaires chez le singe vigile n’ont pas montré de différence du taux de décharge des afférences vestibulaires lors de mouvements de rotation actifs ou passifs de la tête et des yeux (Cullen and Minor, 2002), ni après labyrinthectomie (Sadeghi et al., 2007). De plus, des résultats identiques ont également été montrés lors de mouvements linéaires actifs et passifs (Jamali et al., 2009).
Ensuite, les propriétés des senseurs vestibulaires eux-mêmes ne permettent pas de faire la distinction entre certains types de mouvements et peuvent entraîner, dans les cas les plus extrêmes, à des illusions vestibulaires. C’est le cas notamment lors d’une rotation prolongée. Après quelques secondes à vitesse constante, la cupule des canaux semi-circulaires retourne à sa position basale et la rotation n’est plus détectée. En l’absence d’indices visuels, cette illusion dite « somatogyrale » ne peut pas être compensée et entraîne la sensation d’une rotation en sens opposé lorsque l’inclinaison s’arrête (Correia Grácio et al., 2013). Bien que dommageable en aviation, cette illusion n’est que peu expérimentée en condition naturelle. Cependant, de façon bien plus courante, les canaux semi-circulaires qui encodent les rotations de la tête dans son référentiel, ne renseignent pas sur son mouvement par rapport à l’environnement extérieur. En effet, une rotation de la tête sur le côté en position verticale ou en position allongée génèrent une stimulation similaire des afférences canalaires. Il en est de même pour les organes otolithiques qui encodent de façon semblable deux mouvements très différents : une translation de la tête vers l’avant est ressentie de façon identique à son inclinaison vers l’arrière ; ils ne distinguent donc pas la gravité. Il est donc essentiel de discriminer ces deux types de signaux (voir section 1.1).
Enfin, le dernier défit que doit surmonter le système de traitement de l’information vestibulaire résulte de l’utilisation de son utilisation dans la navigation et la représentation spatiale. Encodés par les senseurs inertiels localisés dans l’oreille interne, les mouvements de la tête sont alors perçus dans un référentiel égocentré (ou interne). Toutefois, l’orientation et les déplacements nécessitent une représentation spatiale du corps dans l’environnement et donc une réinterprétation des entrées sensorielles dans le référentiel géocentré (ou externe).
En résumé, le système vestibulaire composé des canaux semi-circulaires et des organes otolithiques assure l’encodage respectivement des rotations et des accélérations linéaires. Bien qu’ils possèdent des spécificités propres, ces deux types de senseur assurent la transduction du signal inertiel via une cellule commune, la cellule ciliée (présente également dans la cochlée) qui permet un encodage bidirectionnel de l’information vestibulaire par l’excitation ou l’inhibition des fibres vestibulaires. Ces dernières forment le nerf vestibulaire qui projette de façon spécifique sur le vestibulo-cervelet et sur les noyaux vestibulaires du tronc cérébral. Il propage alors une information inertielle contenant des ambiguïtés qu’il est indispensable de résoudre pour le fonctionnement d’arcs réflexes ou la navigation et la représentation spatiale.
2. Cervelet et cortex cérébelleux
2.1. Description anatomique générale du cervelet
2.1.1.
Premières descriptions et phylogénie
Les premières descriptions du cervelet comme une subdivision du cerveau datent de l’Antiquité avec les études anatomiques de Galien. Cependant il faut attendre le XVIème siècle et les travaux d’André Vésale pour que la position de cette structure par rapport au cerveau soit plus largement étudiée (due notamment à l’abord de la dissection) ; il conclut notamment que les folia et fissures du cervelet sont moins variables que les circonvolutions cérébrales chez les vertébrés (Glickstein et al., 2009).
Le cervelet apparait dans la phylogénie avec les gnathostomes (Montgomery et al., 2012) et se développe à partir de la lèvre rhombique et plus particulièrement, de la partie dorsale du premier rhombomère (Butts et al., 2014). Parmi l’ensemble des gènes mis en jeu, PAX6 et Atoh1 sont largement impliqués dans le développement respectif des neurones glutamatergiques (cellules granulaires, neurones des noyaux cérébelleux profonds et cellules en brosse) (Yeung et al., 2016) et dans la prolifération des précurseurs de cellules granulaires (Flora et al., 2009). Toutefois l’expression de ces deux gènes se retrouve chez les agnates (Sugahara et al., 2016). Ainsi, bien que le cervelet soit une innovation liée à l’apparition des gnathostomes, des précurseurs développementaux semblent exister également chez les cyclostomes.
Quelles que soient les espèces, le cervelet est toujours localisé au-dessus du 4ème ventricule
mais présente une variabilité tant sur sa localisation que sur sa masse, sa structure, où le nombre de neurones qu’il contient (Yopak et al., 2017). En effet, alors que chez l’homme il se trouve à la base du cerveau, sous le lobe occipital en arrière du pont, il est localisé en arrière du cortex cérébral au-dessus du pont chez les rongeurs. De plus, si sa masse ne varie pas linéairement avec la masse totale du cerveau, elle augmente conjointement avec celle du cortex cérébral chez les mammifères (Clark et al., 2001) ; (Herculano-Houzel, 2010). Toutefois, malgré sa masse relative peu élevée, celui que l’on appelle le « petit cerveau » contient en réalité la majorité des neurones cérébraux et ce, chez l’ensemble des mammifères. Ainsi, si les neurones cérébelleux représentent 60% à 80% des neurones chez les rongeurs et les primates (Herculano-Houzel et al., 2006, Houzel et al., 2007)(Herculano-Houzel et al., 2007) et jusqu’à 80% des neurones chez l’homme, ils ne correspondent seulement qu’à 10% de la masse totale du cerveau (Töpperwien et al., 2018). Enfin, malgré sa présence avérée chez les gnathostomes, le cervelet présente des disparités structurelles selon les taxons. En effet, le cervelet peut être lisse, comme chez les amphibiens, ou hautement folié comme chez les poissons cartilagineux. Chez les mammifères, outre sa foliation relativement développée, il présente une caractéristique supplémentaire : le cervelet se compose d’une structure médiane, le vermis, flanquée de deux hémisphères cérébelleux (Yopak et al., 2017).
2.1.2.
Régionalisation antéro-postérieure : lobes et lobules
cérébelleux
Le cervelet peut présenter, tout comme le cortex cérébral, des circonvolutions, les folia, majoritairement continues entre le vermis et les hémisphères. Toutefois, des unités plus larges, les lobules, ont historiquement été décrites par Bolk « comme un changement soudain de direction dans la chaîne foliale hémisphérique » (Glickstein and Voogd, 1995). Ainsi, d’après sa description, le vermis peut être divisé en neuf lobules correspondant aux lobules hémisphériques sur l’axe antéro-postérieur : lingula, central, culmen, declive, folium, tuber, pyramis, uvula et nodulus. A contrario, Larsell considère les lobules hémisphériques comme des extensions latérales des lobules vermaux, ces derniers étant hautement conservés entre mammifères et également présents chez les oiseaux (Larsell, 1952). Ainsi, il décrit dix lobules sur l’axe antéro-postérieur du vermis, numérotés de I à X ayant leur équivalent hémisphérique numéroté avec le préfixe H. Néanmoins aucune de ces terminologies n’est totalement exhaustive. En effet, aucune ne satisfait réellement la relation entre les lobules vermaux et hémisphériques ou le rapprochement fonctionnel de certains d’entre eux (Voogd and Glickstein, 1998). De plus, cette nomenclature, majoritairement interchangeable, présente une ambivalence pour certains lobules (Apps and Hawkes, 2009).
Ces lobules sont à leur tour regroupés en structures plus vastes, les lobes cérébelleux toujours selon l’axe rostro-caudal. Au nombre de trois, ils sont séparés par deux sillons : la fissure primaire qui dissocie le lobe antérieur du lobe postérieur et la fissure postéro-latérale ou dorso-latérale qui sépare le lobe postérieur du vestibulo-cervelet.
Ces ségrégations structurelles se distinguent également par les afférences spécifiques que reçoivent les lobules vermaux et hémisphériques : les fibres moussues. Ces dernières peuvent être sensorielles ou motrices et proviennent de noyaux pré-moteurs localisés dans le tronc cérébral, ou de la moelle épinière, à l’exception du cortex cérébelleux du vestibulo-cervelet (uvula ventrale et nodulus) qui reçoit également des afférences primaires en provenance de l’oreille interne (Maklad and Fritzsch, 2002). Ces fibres se terminent de façon spécifique sur les lobules de façon discontinue entre la base et l’apex. Dans le vermis les entrées sont concentriques avec, à la base de tous les lobules des projections vestibulaires secondaires (Precht et al., 1977) originaires des noyaux vestibulaires localisés dans le tronc cérébral, à leur
apex des afférences pontiques (tronc cérébral) et en intermédiaire des fibres provenant de la moelle épinière (Voogd and Glickstein, 1998). Exceptés les flocculi qui ne reçoivent des afférences qu’en provenance des noyaux vestibulaires et de la formation réticulée, les hémisphères cérébelleux ainsi qu’une partie du vermis reçoivent des fibres pontiques qui forment par leurs projections une somatotopie fragmentée avec de multiples représentations d’un même champ récepteur.
2.1.3.
Organisation parasagittale globale du cervelet
Ainsi, outre une organisation antéro-postérieure, une structuration parasagittale du cortex cérébelleux apparait anatomiquement et structurellement. On distingue alors le vermis et les hémisphères, mais une structure intermédiaire supplémentaire, le paravermis apparait dès lors que l’on considère également les efférences du cortex cérébelleux. En effet, hormis pour l’uvula ventrale et le nodulus qui projettent également sur les noyaux vestibulaires, les noyaux profonds qui constituent l’unique sortie cérébelleuse, sont des structures bilatérales enchâssées dans le cervelet et dont le nombre varie conjointement avec l’évolution du cervelet des vertébrés. Ainsi les téléostes, bien qu’étant considérés comme détenteurs d’un cervelet ne possèdent pas de noyaux profonds (Han et al., 2006) et les poissons cartilagineux qui ont un cervelet primitif lisse ne possèdent bilatéralement qu’un seul noyau. En revanche, avec les reptiles apparaissent deux noyaux cérébelleux, le médial et le latéral, homologues chez les mammifères des noyaux fastigial et interposé (Yopak et al., 2017) ; les oiseaux, malgré l’absence d’hémisphères cérébelleux mais avec un vermis similaire aux mammifères, possèdent trois noyaux profonds, le fastigial, l’interposé et l’infra-cérébelleux homologue au denté ventral chez les mammifères (Wylie et al., 2003). Ainsi, chez les mammifères le vermis projette sur le fastigial, le paravermis sur l’interposé et les hémisphères sur le denté (Voogd and Glickstein, 1998).
2.2. Le cortex cérébelleux : une organisation laminaire
2.2.1.
Description générale et phylogénie
Quelle que soit l’espèce, la condition nécessaire et indispensable pour définir un « cervelet » est la présence d’une fibre grimpante projetant sur le cortex cérébelleux (Bell, 2002), même si une cytoarchitecture relativement homogène est constatée chez les gnathostomes. Ainsi, le cortex cérébelleux décrit pour la première fois en 1837 par Purkinje, est composé de trois couches superposées : la couche granulaire (la plus profonde) qui contraint avec la couche moléculaire (la plus superficielle) la couche des cellules de Purkinje (intermédiaire) (Glickstein et al., 2009).
Toutefois, une certaine variabilité sur l’organisation et la composition cellulaire du cortex cérébelleux persiste. Tout d’abord, bien que majoritairement localisées sous la couche des cellules de Purkinje, les cellules granulaires peuvent former des clusters séparés des cellules de Purkinje par un faisceau de substance blanche chez les poissons cartilagineux (Voogd and Glickstein, 1998). Chez d’autres espèces de poissons, les cellules de Purkinje ne forment pas une couche définie et se distribuent indépendamment dans la couche granulaire ou moléculaire (Yopak et al., 2017). De plus, la population d’interneurones dans ces deux dernières couches, bien qu’avérée chez tous les gnathostomes, présente des compositions différentes selon les espèces. En effet, si les cellules de Golgi (couche granulaire) et les cellules en étoile (couche moléculaire) sont présentes chez tous les gnathostomes, les cellules unipolaires en brosse (Mugnaini et al., 2011) et les cellules en panier (Voogd and Glickstein, 1998) ne se trouvent que chez les mammifères et certaines espèces aviaires ; les cellules de Lugaro, quant à elles, n’existent que chez les mammifères (Yopak et al., 2017).
Le cas particulier du cervelet des téléostes nécessite une attention particulière puisqu’il possède une cytoarchitecture singulière. Dans sa couche intermédiaire co-existent alors deux types cellulaires : les cellules de Purkinje ainsi que les cellules eurydendroïdes qui forment une population de neurones excitateurs. Contrairement au cortex cérébelleux « classique » dont l’unique sortie est médiée par l’axone de la cellule de Purkinje, ce sont les cellules eurydendroïdes recevant les projections inhibitrices des cellules de Purkinje qui constituent
l’efférence de ce cortex (Bell, 2002). Cette connexion entre deux types cellulaires, l’un inhibiteur et l’autre excitateur permettant l’efférence, n’est pas sans rappeler celle du lobe électrosensoriel des mormyrides (Bell et al., 2008).
2.2.2.
La cellule granulaire
Les cellules en grain sont les seuls neurones excitateurs glutamatergiques du cortex cérébelleux, à l’exception du cervelet postérieur dans lequel on trouve également les cellules unipolaires en brosse (Diño et al., 2001). Elles représentent la majeure partie des entrées du cortex cérébelleux et constituent sa plus grande population cellulaire (9,2 x 107 cellules). Ainsi,
pour une cellule de Purkinje, on trouve plusieurs centaines de cellules en grain (Fox and Barnard, 1957; Harvey and Napper, 1988).
Les cellules en grain reçoivent des afférences sensorielles de modalités diverses par l’intermédiaire des fibres moussues, d’origines proprioceptive, visuelle, auditive et vestibulaire (Chabrol et al., 2015; Huang et al., 2013; Ishikawa et al., 2015; Kotchabhakdi and Walberg, 1978). Elles possèdent typiquement entre quatre et cinq dendrites qui forment des synapses avec les fibres moussues, les cellules de Golgi et les cellules unipolaires en brosse (uniquement dans le vestibulo-cervelet), au sein des glomeruli : ceux-ci constituent le premier niveau d’intégration de l’information sensorielle. Chacun d’entre eux contient les dendrites de 50 à 60 cellules en grain (Ishikawa et al., 2015).
Localisées sous la couche des cellules de Purkinje, les cellules en grain émettent un axone ascendant qui traverse la couche moléculaire, longeant l’arborisation dendritique des cellules de Purkinje. À sa partie proximale, l’axone se sépare pour former une fibre parallèle non myélinisée qui s’étend, de part et d’autre, le long de l’axe médio-latéral. D’une longueur comprise entre 1,5 et 3 mm (Fox and Barnard, 1957) elles forment des synapses dites « en passant » avec les cellules de Purkinje (Napper and Harvey, 1988), les cellules de Golgi (Sultan and Bower, 1998) et les interneurones de la couche moléculaire (Schilling et al., 2008; Sotelo, 2015). Toutefois, leur longueur varie en fonction de leur localisation au sein de la couche moléculaire : les fibres parallèles les plus supérieures étant plus longues que celles positionnées aux abords de la couche des cellules de Purkinje (Pichitpornchai et al., 1994). Ce
sont avec les cellules de Purkinje qu’elle réalisent le plus de synapses, environ 150 000 (Hirano, 2018; Napper and Harvey, 1988; Pichitpornchai et al., 1994) même si la plupart d’entre elles sont silencieuses (Isope and Barbour, 2002).
2.2.3.
La cellule de Purkinje
En recevant des afférences excitatrices directes des fibres grimpantes en provenance de l’olive inférieure, et indirectes des fibres moussues, les cellules de Purkinje constituent les cellules principales du cortex cérébelleux. Elles forment une monocouche cellulaire flanquée des couches moléculaire au-dessus, granulaire en-dessous et présentent une morphologie relativement homogène entre les lobules vermaux (McKay and Turner, 2005). Cependant, on relève des différences entre la base et l’apex des lobules, entre le vermis et les hémisphères cérébelleux et entre les bandes parasagittales définies par des marqueurs moléculaires (Cerminara et al., 2015). Avec un taux de décharge basal d’environ 50 Hz (Häusser and Clark, 1997; Raman and Bean, 1999), elles constituent la seule sortie du cortex cérébelleux et envoient des projections inhibitrices GABAergiques vers les noyaux cérébelleux profonds et les noyaux vestibulaires.
Leur arborisation dendritique, particulièrement développée (220x250 µm chez le rat) est orientée dans le plan parasagittal et est constituée dans la majorité des cas d’une unique dendrite primaire qui se ramifie par la suite en de nombreuses dendrites secondaires et tertiaires au sein de la couche moléculaire (Berry and Bradley, 1976; McKay and Turner, 2005). Chaque cellule de Purkinje forme environ 150 000 synapses avec les fibres parallèles (Hirano, 2018; Napper and Harvey, 1988; Pichitpornchai et al., 1994) sur la partie distale de son arborisation dendritique, pour laisser place aux synapses avec la fibre grimpante dans sa partie proximale (Voogd and Glickstein, 1998). En plus de ces deux afférences principales, elle reçoit des projections de la part des interneurones de la couche moléculaire : les cellules en étoile et les cellules en panier.
Outre leurs projections vers les noyaux cérébelleux profonds et les noyaux vestibulaires, les cellules de Purkinje émettent des collatérales dans le plan parasagittal vers d’autres cellules
de Purkinje mais également vers les cellules de Lugaro et les interneurones de la couche moléculaire (Witter et al., 2016). Ces projections assureraient notamment la synchronisation locale des cellules de Purkinje entre elles (Orduz and Llano, 2007) ainsi qu’avec les interneurones inhibiteurs de la couche moléculaire (de Solages et al., 2008), permettant ainsi à la sortie cérébelleuse une modulation plus fine des noyaux de projection (Person and Raman, 2012). Toutefois, les cellules de Purkinje pourraient également émettre des collatérales, de façon hétérogène, entre les lobules vers les cellules en grain et ainsi, directement exercer un rétrocontrôle rapide sur l’intégration de l’information sensorielle dans la couche granulaire (Guo et al., 2016).
2.2.4.
Les interneurones de la couche moléculaire
Les interneurones de la couche moléculaire sont les seules cellules du cortex cérébelleux dont le soma est localisé dans cette couche et leur arborisation dendritique suit le plan parasagittal de celui des cellules de Purkinje. Ces neurones GABAergiques sont généralement classés en deux catégories, les cellules en étoile et les cellules en panier, en raison de leur localisation au sein de la couche moléculaire ; les premières sont présentes dans les 2/3 superficiels, les secondes dans la partie plus profonde (Llano and Gerschenfeld, 1993). Toutefois, cette dichotomie semble reconsidérée au profit d’un continuum entre ces deux types cellulaires (Schilling et al., 2008).
Les interneurones de la couche moléculaire réalisent des synapses inhibitrices entre elles (Llano and Gerschenfeld, 1993) mais forment également des jonctions gap afin d’assurer leur synchronisation (Alcami and Marty, 2013). Elles reçoivent également des entrées inhibitrices de la part des collatérales des cellules de Purkinje (Witter et al., 2016) et des cellules de Lugaro (Lainé and Axelrad, 1998) mais aussi des synapses excitatrices provenant des fibres parallèles (Lemkey‐Johnston and Larramendi, 1968). De plus, une excitation indirecte semble exister par un spillover de glutamate, libéré par les fibres grimpantes (Szapiro and Barbour, 2007).
Les synapses entre les interneurones de la couche moléculaire et les cellules de Purkinje sont inhibitrices, chacune d’entre elles pouvant être contactée par une dizaine d’interneurones (Häusser and Clark, 1997). Contrairement aux fibres parallèles et aux fibres grimpantes qui
contactent les dendrites secondaires et tertiaires, les cellules en étoile forment des synapses avec la dendrite primaire des cellules de Purkinje. Quant aux cellules en panier, elles réalisent des projections dites en « pinceaux » sur le segment initial de l’axone et recouvrent le soma de la cellule de Purkinje (Sotelo, 2015). Ce type de synapses particulier, permettrait une transmission dite éphaptique, entre les cellules en panier et les cellules de Purkinje. Ainsi, la décharge de l’interneurone induirait une augmentation de charges positives autour du soma de la cellule de Purkinje, cette modification du champ électrique local provoquant une inhibition rapide d’un potentiel d’action (Blot and Barbour, 2014).
2.2.5.
Les interneurones de la couche granulaire
La couche granulaire est plus riche en interneurones que la couche moléculaire. Ceux-ci sont de trois types : les cellules de Golgi, les cellules de Lugaro et les cellules unipolaires en brosse.
2.2.5.1.
Les cellules de Golgi
Les cellules de Golgi constituent la plus grande population d’interneurones de la couche granulaire dans la plupart des lobules cérébelleux. Leur soma est localisé dans la couche granulaire d’où émane une myriade de dendrites dont la surface peut atteindre celle de l’arborisation dendritique des cellules de Purkinje (Geurts et al., 2003). Elles sont cependant séparées en deux groupes distincts. Les dendrites apicales s’étendent dans la couche moléculaire et reçoivent des entrées excitatrices des fibres parallèles (Dieudonné, 1998) mais également des entrées inhibitrices grâce aux interneurones de la couche moléculaire (Dumoulin et al., 2001).
Les dendrites basales, quant à elles, restent dans la couche granulaire et forment des synapses avec les cellules unipolaires en brosse (Mugnaini et al., 1994), les fibres moussues et les cellules de Lugaro (Geurts et al., 2003). De plus, les cellules de Golgi sont couplées entre elles par des jonctions gap assurant leur synchronisation, et par la projection de leur axone, une inhibition rythmique sur les cellules en grain (Dugué et al., 2009).
Tout comme les interneurones de la couche moléculaire, les cellules de Golgi ne constituent pas une classe cellulaire bien définie mais plutôt plusieurs sous-populations d’interneurones