HAL Id: tel-01044734
https://tel.archives-ouvertes.fr/tel-01044734
Submitted on 24 Jul 2014HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
To cite this version:
Susana Hoette. Avaliação do ventrículo direito nos pacientes com hipertensão pulmonar. Pulmonology and respiratory tract. Université Paris Sud - Paris XI; Universidade de São Paulo (Brésil), 2012. Portuguese. �NNT : 2012PA114868�. �tel-01044734�
Doctoral thesis under joint supervision
Presented by
Susana HOETTE
in Sao Paulo, Brazil
20th August 2012
Corrélation entre les donnés de l`imagerie par résonance magnetique (IRM)
cardiaque et le cathétérisme droit dans l`hypertension artérielle pulmonaire
(HTAP).
Thesis advisors: M. Rogerio de SOUZA
M. Marc HUMBERT
JURY
M. le Pr Rogerio de SOUZA
President
M. le Pr Carlos Eduardo ROCHITTE
Examiner
M. le Pr. Mario TERRA-FILHO
Examiner
M. le Pr Denis CHEMLA
Examiner
Avaliação do ventrículo direito nos pacientes
com hipertensão pulmonar
Tese a ser apresentada à Faculdade de Medicina da Universidade de São Paulo para obtenção do título de Doutor em Ciências
Área de concentração: Pneumologia Orientador: Prof. Dr. Rogério de Souza Co-orientador: Prof. Dr. Marc Humbert
São Paulo 2012
Avaliação do ventrículo direito nos pacientes
com hipertensão pulmonar
Tese a ser apresentada à Faculdade de Medicina da Universidade de São Paulo para obtenção do título de Doutor em Ciências
Área de concentração: Pneumologia Orientador: Prof. Dr. Rogério de Souza Co-orientador: Prof. Dr. Marc Humbert
São Paulo 2012
Dados Internacionais de Catalogação na Publicação (CIP)
Preparada pela Biblioteca da
Faculdade de Medicina da Universidade de São Paulo ©reprodução autorizada pelo autor
Hoette, Susana
Avaliação do ventrículo direito em pacientes com hipertensão pulmonar / Susana Hoette. -- São Paulo, 2012.
Tese(doutorado)--Faculdade de Medicina da Universidade de São Paulo. Programa de Pneumologia.
Orientador: Rogério de Souza.
Descritores: 1.Disfunção ventricular direita 2.Hipertensão pulmonar 3.Ventrículos cardíacos 4.Hemodinâmica
Marcos e Anna, meus pais, vocês foram sempre exemplo de dedicação ao trabalho e aos estudos, exemplo de garra e de uma sede por conhecimento insaciável que me motivaram a vida toda. Esta tese é sem dúvida para vocês!
A todos da secretaria de Pneumologia da USP, sempre dedicados e dispostos a nos ajudar a resolver todos os tipos de pepinos. Em especial a Solange e Lucia, por fazerem possível o ambulatório de hipertensão pulmonar acontecer e pelo carinho com que me tratam sempre. A Luciana e a Alessandra por toda a dedicação à pós-graduação. Mesmo quando eu estava longe, vocês estiveram disponíveis e me ajudaram muito! Muito obrigada a todos, eu gosto muito de você todos.
Ao meu querido chefe (Prof. Dr. Rogério de Souza)! Não sei nem como agradecer tudo que você fez por mim. Apostou em mim me convidando pra trabalhar com você no grupo, me incentivou à ir para a França, me ensinou muita medicina e os encantos de fazer pesquisa. Você, além de orientador, se transformou num grande amigo, que esteve ao lado em momentos difíceis e com quem dividi muitas risadas. Chefe, não tenho palavras pra agradecer toda confiança depositada em mim e todo carinho que você teve comigo, amo você.
Aos meus queridos amigos do grupo de Hipertensão Pulmonar: André, Bruno, Caio e Lu. Vocês me ensinaram muito, de hipertensão pulmonar, de companheirismo e de parceria. Muito obrigada também pela companhia nas divertidas viagens e principalmente por almoços nos quais as risadas eram
Ao Dr. Mario (Prof. Dr. Mario Terra) por toda a dedicação à disciplina e à pós-graduação e em especial aos residentes. Você foi sempre muito acessível e disponível e ainda tornou nossa residência muito mais divertida. Você fez possível a co-tutela, sem palavras pra te agradecer essa conquista. Obrigada por tantos encontros tão divertidos, eu aprendi muito sobre viagens e cervejas, você é um exemplo de vida para todos nós, te admiro muito!
Ao Dr. Carlos (Prof. Dr. Carlos Carvalho) pela dedicação e comprometimento com a disciplina que me encantaram na UTI pneumo e me levaram a querer fazer pneumologia como especialidade. Obrigada também pelo exemplo profissional e de vida e mais uma vez pelas divertidas noites com cervejas!
Aos meus pais, Marcos e Anna, vocês são exemplos também de vida pessoal, vocês me encantam com o gosto pelas viagens, com essa curiosidade pelo novo e pelo diferente e com a forma como estão vivendo a vida. Obrigada por estarem sempre tão disponíveis e serem sempre tão carinhosos. Muito obrigada principalmente pelo apoio durante a minha estadia na França, sem o suporte de vocês eu não teria conseguido. Vocês são meus ídolos, meus dois pilares de sustentação. Amo vocês mais que tudo!
admiro e te amo muito irmã!
Aos meus tios queridos, Kike e Maura, pelo apoio incondicional, pelo exemplo de dedicação a profissão e aos estudos e pelo carinho, sempre. Amo vocês tios do coração. Primas queridas, Adriana, Karina e Milena, obrigada pelo carinho, apoio e amizade sempre! Primas-irmãs, vocês são muito importantes pra mim!
Aos meus queridos opapa, omama, vovô Braz e Neide, pelos exemplos de vida e por sempre me darem suporte e incentivarem!
As minhas amigas queridas: Mônica, Haydée, Adrienne, Juliana, Luciana e Ana. Mônica, você esteve comigo desde o primeiro pôster apresentado em congresso, sempre me dando força e me ajudando. Obrigada pelas viagens maravilhosas e por tantas noites divertidas tomando cerveja! Dede e Dri, amigas inseparáveis desde a residência, vocês estão sempre comigo apesar da distância. Ju, sua determinação e energia me encantaram desde o primeiro dia que te conheci, obrigada por estar ao meu lado sempre. Lu, você é um exemplo de coragem pra encarar as mais diversas situações, obrigada por estar sempre me apoiando. Ana, sem você a estadia na França não ia ser tão divertida e
À Camila, minha irmã do coração, seu amor à profissão e dedicação aos estudos sempre foram um grande estímulo pra mim. Obrigada pelos 20 anos de amizade incondicional: compreensão, colo sempre disponível e tantas lágrimas e gargalhadas divididas. Amo muito você amiga.
Aos meus queridos amigos de residência, André, Bruno e Daniel, que tornaram a residência muito mais prazerosa e divertida. André a sua parceria e amizade foram muito importantes, te admiro como pessoa e como médico, eu sinto muito a sua falta! Bruninho, você é e sempre foi meu xodó. Gosto de mais de você amigo. Dani, parceiro também de doutorado, você sabe que eu adoro você.
Ao meu amigo Pedro, por ter sido você que me fez começar a ter interesse em pesquisa e porque foi você quem me inscreveu na residência da USP, sem você eu não estaria nem em SP! E ao meu amigo Camilo, que esteve ao meu lado sempre e compartilhou a vida na Europa comigo. Saudades de você amigo.
final da tese. Quero você pra sempre do meu lado, amo você, de mais!
A todos do Hospital Antoine Béclère: Merci!
Merci a touts les patients français que ont été toujours disponible a faire les IRM et aussi sympa avec moi, merci beaucoup !
Denis, je n’ai pas les mots pour assez te remercier. Tu m’a accueilli, m’a apris à faire la recherche, m’a faire m’amuser et rigoler pendant les reunions de mardi après midi, tu etais a mon coté pour le Comité de Thèse et encore pour les articles. Tu es devenu un grand ami. Merci beaucoup pour tout. Deniiiiiis, tu me manques beaucoup !
Prof. Marc Humbert et Prof. Gerard Simoneau, merci de m’avoir acueilli avec amabilité et merci pour l’exemple qui vous étiez de dedication à l’HTAP et à la recherche. Merci pour le suport toujour et pour la amitié.
Nicolas, merci pour tout que tu m’a apris en IRM, pour la pacience avec mon français pourri, pour l’amitié et pour tout qui on a rigoler ensemble. Les après midi avec Denis et toi étaeint superb. Tu me manques beaucoup !
amies. On a beaucoup rigolé ensemble, les mercredi après midi e vendredi matin étaient adorables, merci! Merci aussi a les infirmières du cate, de l’aile et de la REA pour tout l’aide avec les patients pour l’IRM. Sans vous cette recherche n’existerai pas.
Merci a toute la equipe de pneumologie de l’Hôpital Antoine Béclère de m’avoir acueilli avec beaucoup d’affection et de m’avoir apris sur l’HTAP et sur la France. Florence, merci pour la amitié e pour partager le bureau avec moi. Larry, Xavier, Olivier, Gilles, David et Zizou vous êtes un example aussi a suivre, pour toute la dedication à les patients et à la recherche. Merci Phelipe Hervé de m’avoir apris a faire le cateterisme droit. Vous me manquez tous e beaucoup.
Dermot et Andrei, merci pour l’amitié et suport toujour a l’hôpital. Sven, merci pour partager les moments dificils avec moi, tu es un vrai ami ! Barbara, merci pour l’amitié et les exposition ensemble. Vous me manquez beaucoup mes amis! Christiane, je ne sais pas qu’est-ce que serai de moi sans toi a Paris. Tu m’a beaucoup aidé avec tout a l’hôpital des le premier jour. Merci pour les dînners ensemble et pour me faire rigoler quand j’etais triste. Tu est une grande amie. Merci !
Lista de unidades Lista de tabelas Lista de figuras Resumo Summary 1. INTRODUÇÃO 1
1.1 – Particularidades do ventrículo direito 3
1.2 – Resposta do ventrículo direito ao aumento da pós-carga 6
1.3 – O papel prognóstico da função ventricular direita na hipertensão pulmonar 9
1.4 – Avaliação não invasiva da função ventricular direita 11
2 . OBJETIVOS 19
2.1 – Objetivo principal 20
2.2 – Objetivo secundário 20
3. MÉTODOS 21
3.5 – Análise estatística 31
RESULTADOS 32
4.1 – População incluída na análise 33
4.2 – Dados clínicos e hemodinâmicos 35
4.3 – Dados da ressonância cardíaca 39
4.4 – Correlações da FEVD com as variáveis hemodinâmicas 41
4.5 – Correlações da FEVD com os volume do ventrículo direito 43
4.6 – Correlações entre as áreas e os volumes do ventrículo direito 44
4.7 – Correlações entre FEVD , RVFAC e TAPSE 45
4.8 – Dados da ressonância cardíaca nos grupos com menor e maior gravidade hemodinâmica 46
4.9 – Correlações entre a FEVD, RVFAC e TAPSE nos grupos com menor e maior gravidade hemodinâmica 48
4.10 – Medidas de interdependência ventricular nos grupos com menor e maior gravidade hemodinâmica 50
4.11 – Comparação entre as curvas ROC para a capacidade da RVFAC e do TAPSE em diagnosticar disfunção grave de ventrículo direito 51
kg...Quilogramas cm...Centímetros mg/dl...Miligrama por decilitro bpm...Batimentos por minuto mmHg...Milímetros de mercúrio L/min...Litros por minuto L/min/m2...Litros por minuto por metro quadrado UW...Unidades Wood mL...Mililitro mm...Milímetro mL/m2...Mililitro por metro quadrado cm/m2... Centímetro por metro quadrado
Tabela 2 – Características hemodinâmicas da população 38
Tabela 3 – Dados da ressonância magnética cardíaca 40
Tabela 4 – Comparação dos dados da ressonância magnética cardíaca entre o grupo com menor e maior gravidade hemodinâmica 47
Tabela 5 – Medidas de interdependência ventricular nos grupos com maior e menor gravidade hemodinâmica 50
Figura 2 – Áreas diastólicas finais dos ventrículos direito e esquerdo 28
Figura 3 – TAPSE 29
Figura 4 – Índice de excentricidade do ventrículo esquerdo 30
Figura 5 – Fluxograma da seleção da população incluída para análise 34
Figura 6 – Correlações da FEVD com as variáveis hemodinâmicas 42
Figura 7 – Correlações da FEVD com os volumes do ventrículo direito 43
Figura 8 – Correlações entre as áreas e os volumes do ventrículo direito 44
Figura 9 – Correlações entre FEVD, RVFAC e TAPSE 45
Figura 10 – Correlações entre FEVD, TAPSE e RVFAC nos grupos com menor e maior gravidade hemodinâmica 47
Hoette, S. Avaliação do ventrículo direito em pacientes com hipertensão pulmonar (tese). São Paulo: Faculdade de Medicina da Universidade de São Paulo (2012).
Introdução: A fração de ejeção do ventrículo direito (FEVD) é um importante fator prognóstico em pacientes com hipertensão pulmonar (HP), porém a sua medida é complicada e demorada devido à complexidade anatômica do ventrículo direito (VD). O TAPSE (Tricuspid Annular Plane Systolic Excursion) é um bom índice da FEVD, mas ele avalia apenas o componente longitudinal da contração ventricular direita. A RVFAC (Right Ventricular Fractional Area Change) parece ser um melhor índice da FEVD por incluir os componentes longitudinal e transversal da contração ventricular direita. O objetivo deste estudo foi avaliar a performance da RVFAC de acordo com a gravidade do acometimento hemodinâmico em dois grupos distintos de pacientes portadores de HP pré-capilar: hipertensão arterial pulmonar (HAP) e tromboembolismo pulmonar crônico hipertensivo (TEPCH).
Métodos: 62 pacientes realizaram cateterismo cardíaco direito e ressonância magnética cardíaca em ±72h. As áreas sistóica e diastólica finais do ventrículo direito (ASFVD, ADFVD), a área diastólica final do ventrículo esquerdo (ADFVE)
livre e septal (dL-S) e antero-posterior (dA-P) do ventículo esquerdo (VE) foram medidos nas imagens em eixo curto e o índice de excentricidade do VE (IE) foi calculado (=dA-P/dL-S). A FEVD foi calculada a partir de imagens consecutivas de 6mm no eixo curto.
.
Resultados: A população tinha 58 anos em média, a maioria era do sexo feminino e estava em classe funcional III, 23 tinham HAP e 39 TEPCH. A FEVD apresentou correlações fracas com as medidas hemodinâmicas de sobrecarga e de função do VD. A RVFAC apresentou melhor correlação (R2=0,65, p < 0,001) do que o TAPSE (R2=0,35, p<0,001) com a FEVD e melhor capacidade para estimar FEVD<35% do que o TAPSE (TAPSE: AUC 0,73 e RVFAC: AUC 0,93, p=0,0065). Dividimos a população pela mediana da resistência vascular pulmonar (RVP) e observamos que no grupo com maior gravidade hemodinâmica essa diferença se acentuou: no grupo com RVP<8,5UW (RVFAC: R2=0,66, p<0,001 e TAPSE: R2=0,30, e p=0,002) e no grupo com RVP>8,5UW (RVFAC: R2=0,51, p<0,001 e TAPSE: R2=0,14, e p=0,041). O grupo com RVP>8,5UW apresentou maior ADFVD/ADFVE e maior IE. As correlações da RVFAC e TAPSE com FEVD foram semelhantes entre os grupos HAP e TEPCH.
significativas, não havendo diferenças na performance da RVFAC entre os pacientes com HAP e TEPCH. A RVFAC foi um melhor índice da FEVD talvez por incluir o movimento transversal da contração ventricular.
Descritores: disfunção ventricular direita, hipertensão pulmonar, ventrículos cardíacos, hemodinâmica.
Paulo: Faculdade de Medicina da Universidade de São Paulo (2012).
Introduction: The right ventricular ejection fraction (RVEF) is a surrogate marker in pulmonary hypertension (PH), but its measurement is complicated and time consuming. The TAPSE (Tricuspid Annular Plane Systolic Excursion) is a good index of RVEF, though it measures only the longitudinal component of right ventricular contraction. The RVFAC (Right Ventricular Fractional Area Change) seems to be a better index of RVEF because it takes into account the longitudinal and the transversal components of right ventricular contraction. The aim of our study was to evaluate the RVFAC performance according to hemodynamic severity in two groups of patients with PH: pulmonary arterial hypertension (PAH) and chronic thromboembolic pulmonary hypertension (CTEPH).
Methos: Sixty-two patients with PAH and CTEPH underwent right heart catheterization and cardiac MR in a 72-hour delay. The right and left ventricle end diastolic areas (RVEDA, LVEDA), the right ventricle end systolic area (RVESA) and TAPSE were measured in the four chamber view. The RVFAC (= RVEDA – RVESA/RVEDA) and the RVEDA/LVEDA relationship were calculated. The diameter between the left ventricle (LV) free wall and the septum (dL-S) and
Results: The population had mean age of 58 years with female majority, most of the patients were in functional class III, 23 had pulmonary arterial hypertension (PAH) and 39 had chronic thromboembolic pulmonary hypertension (CTEPH). The RVEF was weakly correlated to the hemodynamic variables of RV afterload and function. The RVFAC was more strongly correlated to RVEF (R2=0.65, p<0.001) than TAPSE (R2=0.35, p<0.001). RVEF<35% was better predicted by RVFAC than TAPSE (TAPSE: AUC 0.73 and RVFAC: AUC 0.93, p=0.0065). We divided the population by the median of the pulmonary vascular resistance (PVR) and we observed that in the group with worse hemodynamic severity this
difference increased: in the group with PVR<8,5WU (RVFAC: R2=0.66, p<0.001 and TAPSE: R2=0.30, p=0.002) and in the group with PVR>8,5 WU (RVFAC: R2=0.51, p<0.001 and TAPSE: R2=0.14, p=0.041). The group with PVR>8,5WU had an increased RVEDA/LVEDA and an increased EI. There was no differences in the RVEF relationships between the groups of PAH and CETPH.
Conclusion: The RVFAC was better correlated to RVEF than TAPSE in the groups with less severe and more severe hemodynamics. In patients with increased hemodynamic severity, with no difference in the performance in the
Descriptors: right ventricular dysfunction, pulmonary hypertension, cardiac ventricles, hemodynamics.
A importância do ventrículo direito (VD) foi subestimada até recentemente. Trabalhos experimentais em modelo de cães com pericárdio aberto mostravam que não havia redução do débito cardíaco ou aumento da pressão venosa sistêmica quando VD era cauterizado e perdia sua função contrátil1. Assim, durante mais de quatro décadas, o VD foi considerado
como tendo uma função de condução passiva com insignificante relevância circulatória. Na década de 80, estudos em modelos de cães com tórax fechado mostraram comprometimento hemodinâmico significativo no infarto de VD2. Nesta época, estudos clínicos começaram a mostrar também o
maior risco de morte, arritmia e choque cardiogênico em pacientes com infarto de VD3.
O papel do VD passou a ser então reconsiderado, levantando a hipótese de que os modelos iniciais não encontravam alterações com a exclusão do VD porque não levavam em conta a interdependência ventricular, uma vez que esses eram baseados em modelos com pericárdio aberto1. A partir de então, a função do VD começou a ganhar importância e
em 2006 o Instituto Nacional de Coração, Pulmão e Sangue nos Estados Unidos identificou a fisiologia do ventrículo direito como prioridade na pesquisa cardiovascular1,4.
1.1. Particularidades do ventrículo direito
Em condições normais, o VD, ao contrario do ventrículo esquerdo (VE), está acostumado a um regime de baixa pressão porque a circulação pulmonar tem características bastante diferentes da circulação sistêmica. A principal característica da circulação pulmonar é a capacidade de acomodar grandes aumentos de volume sanguíneo sem elevação da pressão do circuito. Isso é possível pela distensibilidade dos vasos pulmonares e pelo recrutamento de capilares5. Essa elevada complacência da circulação
pulmonar associada a uma baixa resistência vascular pulmonar (RVP) (cerca de um sexto da resistência vascular sistêmica) faz com que o lado direito do coração trabalhe com pressões bastante inferiores do que o lado esquerdo6,7. As características anatômicas do VD diferem muito das do VE;
o VD tem paredes finas e bastante trabeculadas e possui formato semilunar ou em crescente. Já o VE tem formato concêntrico e paredes bem mais espessas (a massa miocárdica do VD é aproximadamente um quarto da massa do VE).
A perfusão sanguínea também se dá de forma diferente entre o VD e o VE. O fluxo na artéria coronária descendente anterior tem padrão bifásico, sendo praticamente nulo durante a sístole, e significativo apenas durante a diástole, estando assim a perfusão miocárdica do VE limitada à diástole. Já o fluxo da artéria coronária direita tem padrão monofásico permanecendo
praticamente inalterado durante a sístole e a diástole, garantindo perfusão miocárdica ao VD durante todo o ciclo cardíaco4.
Estas diferenças anatômicas proporcionam ao VD uma complacência muito maior do que a do VE e o levam a responder de forma diferente aos insultos. O VD responde de formas diferentes quando ocorre aumento de pressão ou de volume e também dependendo da rapidez com que o insulto se instala, seja de forma aguda ou crônica; tendendo a tolerar melhor sobrecarga de volume do que de pressão. Quando ocorre aumento súbito da pós-carga o VD dilata significativamente e o volume sistólico diminui quase que linearmente com o aumento da pós-carga. Assim, um VD normal é incapaz de gerar pressões de artéria pulmonar maiores que 40mmHg quando ocorre aumento abrupto na pós-carga. Em contrapartida, o VD consegue lidar bem com aumentos significativos de volume, mesmo que de forma abrupta. Aumentos súbitos em fluxo, como ocorre no exercício físico, não levam a aumentos significativos da pressão arterial pulmonar5.
Uma causa importante de sobrecarga ventricular direita é a hipertensão pulmonar (HP). A HP é definida pelo achado de elevação da pressão pulmonar média (PAPm ≥ 25 mmHg) no cateterismo cardíaco direito e a sua classificação diagnóstica engloba achados hemodinâmica e fisiopatológicos8. Quando a pressão da artéria pulmonar ocluída (PAPo) é >
15 mmHg a HP é pós-capilar e classificada no grupo 2 da classificação diagnóstica que consiste na HP causada por doença do coração esquerdo.
Os outros 4 grupos da classificação diagnóstica envolvem a HP com PAPo ≤ 15 mmHg, chamada HP pré-capilar. O grupo 1 é denominado hipertensão arterial pulmonar (HAP) e engloba HAP classificadas como: idiopática, hereditária, induzida por drogas ou toxinas, hipertensão persistente do recém-nascido, doença pulmonar veno-oclusiva e/ou hemangiomatose capilar pulmonar e HAP associadas a doença do tecido conjuntivo, infecção pelo vírus da imunodeficiência humana, hipertensão portal, cardiopatia congênita, esquistossomose e anemia hemolítica crônica. A HP causada por doença pulmonar e/ou hipoxemia pertence ao grupo 3 e o grupo 4 consiste no tromboembolismo pulmonar crônico hipertensivo (TEPCH). No grupo 5 são classificados os casos de HP com mecanismos multifatoriais não esclarecidos9.
1.2. Resposta do ventrículo direito ao aumento da pós-carga
Quando ocorre aumento da pós-carga o VD precisa se adaptar. Ocorre dilatação da cavidade ventricular, o que modifica sua forma inicial semilunar, deixando-o mais parecido com o VE, ou seja, mais concêntrico. O septo interventricular fica retificado podendo haver abaulamento e compressão da cavidade ventricular esquerda. A hipertrofia da parede muscular é outra importante alteração que ajuda o VD a vencer o aumento da RVP. Estudos experimentais mostram hipertrofia ventricular direita em apenas 96 horas de sobrecarga e aumento significativo da massa muscular do VD em 7 dias de hipóxia, sendo esse aumento progressivo, caso o estímulo seja mantido5,10.
A maior massa muscular do VD leva ao aumento da demanda de oxigênio; porém, a oferta de oxigênio está associada à perfusão coronária do VD e esta se encontra alterada conforme a massa muscular do VD aumenta. Em pacientes com HP e hipertrofia do VD, o fluxo na artéria coronária direita muda de padrão; passa do padrão monofásico para o padrão bifásico, como o apresentado pela artéria coronária descendente anterior. O VD passa então a ser perfundido somente durante a diástole, como o VE. Essa mudança no fluxo coronariano é diretamente proporcional aos aumentos da pressão sistólica do VD e de sua massa muscular4.
A resposta do VD ao incremento da pós-carga varia mesmo dentro de subgrupos da HP, podendo a disfunção ventricular direita estar presente de forma mais precoce em alguns grupos, mesmo que o padrão hemodinâmico seja similar2. Existe diferença na contratilidade cardíaca entre pacientes com
HAP idiopática e associada à esclerose sistêmica, apesar dessas duas patologias estarem classificadas no mesmo grupo na classificação diagnóstica da HP. Overbeek et al.11 mostraram que os pacientes com
esclerose sistêmica apresentavam menor contratilidade ventricular direita que os pacientes com HAP apesar da mecânica vascular semelhante nos dois grupos; não havia diferença significativa na RVP nem na complacência vascular pulmonar. Essa diferença na contratilidade ventricular estaria associada à variação do acometimento do miocárdio entre essas duas patologias, como a presença de fibrose miocárdica e o envolvimento de vasos coronários intramiocárdicos.
Desta forma, acredita-se que o aumento da pós-carga induz alterações na morfologia, na massa muscular e na perfusão do VD, sendo que a dilatação do VD pode ainda levar a alterações na complacência do VE, pelo abaulamento septal. Todos estes fatores associados contribuem para a redução do débito cardíaco, que leva à diminuição da pressão de perfusão coronária. O aumento da massa miocárdica associado às mudanças na perfusão coronária podem causar isquemia relativa, piorando ainda mais a performance do VD, gerando assim um ciclo vicioso, com auto-agravamento12.
Define-se, portanto, como disfunção do VD, o conjunto de alterações estruturais ou funcionais que levam ao comprometimento do enchimento ou da contração ventricular direita. Já a falência do VD se refere à síndrome clínica complexa que resulta destas alterações12. As principais
manifestações clínicas desta síndrome são: retenção hídrica, que pode levar a edema periférico, ascite e anasarca; redução da reserva sistólica e baixo débito cardíaco, que pode levar a intolerância ao exercício físico e fadiga; e arritmias atrial e ventricular.
A capacidade funcional do VD é o principal determinante do prognóstico na HP. Enquanto o VD consegue manter o débito cardíaco (DC), apesar de aumentos na pós-carga, o paciente permanece pouco sintomático2. A função ventricular direita é, portanto, fundamental nos
1.3. O papel prognóstico da função ventricular direita na hipertensão pulmonar
Estudos têm comprovado que a função do VD é um importante fator prognóstico na HP2. As medidas do índice cardíaco e do volume sistólico do
VD já foram estabelecidos como marcadores de sobrevida nesta doença13,14.
van de Veerdonk et al.15 mostraram que pacientes com HP e disfunção grave
de VD, definida por uma fração de ejeção (FEVD) menor do que 35%, tiveram sobrevida pior independente da RVP apresentada na avaliação inicial. No seguimento desses pacientes, a diminuição da FEVD foi marcador de pior prognóstico enquanto o aumento da RVP não teve papel prognóstico. Ou seja, independente do comprometimento hemodinâmico, o fator prognóstico mais importante foi a maneira como o VD conseguiu lidar com esse aumento de pós-carga.
Em um estudo mais recente também em pacientes com HP, o mesmo grupo comparou pacientes com sobrevida maior do que cinco anos (grupo dos sobreviventes) com pacientes que morreram entre 1 e cinco anos (grupo dos não sobreviventes) da avaliação inicial16. O grupo dos não sobreviventes
apresentava FEVD significativamente menor no momento da inclusão no estudo do que o grupo dos sobreviventes. A FEVD permaneceu estável entre a avaliação inicial e após um ano de tratamento no grupo dos sobreviventes, porém apresentou redução progressiva no grupo dos não
sobreviventes, reforçando a importância da FEVD como fator prognóstico nos pacientes com HP.
A sobrevida dos pacientes com HP varia não só entre os diferentes grupos, mas também dentro de cada um dos grupos existentes da classificação diagnóstica. A sobrevida dos pacientes com HAP associada à doença do colágeno é inferior a de pacientes com HAP idiopática que por sua vez é inferior a de pacientes com HAP associada à cardiopatia congênita13. Recentemente, Fernandes et al.17 mostraram que os pacientes
com HAP associada à esquistossomose apresentaram sobrevida maior do que pacientes com HAP idiopática. Se a função ventricular direita varia entre as patologias associadas a HP11, talvez o acometimento miocárdico distinto
1.4. Avaliação não invasiva da função ventricular direita
A fração de ejeção é considerada o método padrão para se avaliar a função ventricular de forma não invasiva. Para o cálculo da fração de ejeção é necessário que sejam medidos os volumes sistólico e diastólico finais. A medida dos volumes é realizada pelo contorno da borda endocárdica no final da sístole e da diástole em diversos cortes paralelos, da base ao ápice dos ventrículos. Este processo é trabalhoso e demorado18. A avaliação da FEVD
é ainda mais complicada do que do VE pela complexidade anatômica do VD. A parede mais trabeculada do VD dificulta a definição da borda endocárdica e o formato semilunar dificulta o desenvolvimento de modelos geométricos para o cálculo da sua função de forma automatizada19. A posição
retroesternal ainda atrapalha a aquisição de boas imagens do VD pela ecocardiografia, já que a janela acústica é prejudicada pela interposição do esterno20.
Pelas dificuldades técnicas que existem para a determinação da função do VD, formas para estimar a sua função que dispensam o cálculo da FEVD começaram a gerar interesse21. Para tal foi necessário compreender
melhor a forma como se dá a contração do mesmo.
Estudos da década de 50 já mostravam o interesse em entender como ocorria a contração cardíaca. Rushmer et al.22 fizeram um dos
cães. Eles suturaram pequenos pedaços de fio de metal na parede do VD e do VE e depois fizeram imagens com cinefluorografia. A análise das imagens permitiu identificar o principal eixo de aproximação desses pedaços de metal, definindo assim qual era o principal eixo de encurtamento das fibras musculares nas cavidades cardíacas. O VD se caracterizou principalmente pela aproximação das peças no sentido longitudinal, ou seja, o movimento da base em direção ao ápice do coração22.
Recentemente, o uso de uma técnica mais moderna com a inserção cristais microtransdutores ultrassônicos possibilitou uma análise mais detalhada da contração cardíaca. Leather et al.23 associaram essa técnica
com monitorização hemodinâmica e infudiram volume ou garrotearam a artéria pulmnar para avaliar a resposta a mudanças na pré e pós-carga do VD. O estudo mostrou que a variação no volume sistólico apresentou correlação forte com a variação dos microtransdutores no eixo longitudinal e fraca com a variação no eixo transversal. As variações na pré e pós-carga também se correlacionaram melhor com a variação no eixo longitudinal do que no eixo transversal. Os autores concluíram então que a contratilidade regional longitudinal refletia melhor a contratilidade global do VD do que a transversal.
Com base nesses achados, a avaliação da contratilidade longitudinal parecia ser a melhor forma de estimar a função global e assim a medida da movimentação do anel tricúspide foi estudada como forma de estimar a
FEVD já que refletia o movimento longitudinal, ou seja, o movimento da base em direção ao ápice cardíaco24.
Uma maneira de se aplicar esse conceito clinicamente é a avaliação do padrão de movimentação da válvula tricúspide. A medida do TAPSE (Tricuspid Annular Plane Systolic Excursion) é rápida e fácil de ser obtida, não requer o delineamento da borda interna do miocárdio e ainda é altamente reprodutível25. Ueti et al.26 compararam a medida do TAPSE
realizadas por ecocardiografia com a medida da fração de ejeção pela angiografia de radionuclídeos e encontraram forte correlação entre as duas medidas. A medida do TAPSE ainda apresentou boa capacidade em discriminar pacientes com boa função daqueles com disfunção de VD. Estudos com acompanhamento de longo prazo mostraram que o TAPSE é também um bom marcador prognóstico nas cardiopatias27.
Na HP, esse índice também se mostrou útil. Forfia et al.24 estudaram
o TAPSE em 63 pacientes com HP. O TAPSE apresentou alta sensibilidade e especificidade como indicador de volume sistólico reduzido. Pacientes com TAPSE menor que 1.8 cm apresentaram menor índice cardíaco e menor trabalho sistólico de VD, ou seja, disfunção ventricular direita mais avançada. A sobrevida foi significativamente menor nos pacientes com TAPSE menor que 1,8 cm do que nos paciente com mais de 1,8 cm. Quando o TAPSE inicial era menor que 1,5 cm os pacientes apresentaram
mortalidade ainda maior. Assim, a medida do TAPSE mostrou ser também marcador de prognóstico em HP.
Brown S et al.28 analisaram as áreas diastólica e sistólica finais do VD
para avaliar os componentes longitudinal e transversal da contração ventricular. Em relação à área total reduzida entre a diástole e a sístole, o maior percentual de redução de área aconteceu no eixo longitudinal (77%). Quando analisaram o grupo com HP o achado foi semelhante: o principal componente na contração do VD continuou sendo o encurtamento longitudinal. Mas o interessante foi que quando comparado ao grupo controle, a importância do componente transversal foi significativamente mais importante no grupo HP (componente transversal representou 37% da redução total da área no grupo HP contra 23% no grupo controle). Quando um subgrupo de pacientes com HP foi analisado antes e após tratamento, a melhora na função ventricular direita esteve associada a ganho principalmente no componente longitudinal. Os autores concluem que o principal componente da contração do VD é o longitudinal em sujeitos normais e nos pacientes com HP e que a resposta à redução na pós-carga se reflete também no componente longitudinal.
Entretanto, os dados desse estudo28 mostram que nos pacientes com
HP o componente transversal é proporcionalmente mais importante do que nos controles, levantando a hipótese que neste grupo de pacientes o componente transversal não deve ser desprezado. Essa hipótese é
reforçada por outros estudos que não encontraram relação tão significativa do TAPSE com a função ventricular direita. Anevkar et al.29 encontrou
correlação fraca entre a medida do TAPSE pelo ecocardiograma e a FEVD medida por ressonância nuclear magnética cardíaca (RMC). Em pacientes com HP, o TAPSE apresentou correlação também apenas fraca com a FEVD quando ambos foram medidos pela RMC30 e moderada quando
ambos foram medidos pelo ecocardiograma tri-dimensional31.
A RMC vem ganhando importância no estudo do VD e na HP. Os avanços nas técnicas de aquisição e processamento das imagens de RMC representaram um grande avanço na avaliação do VD, pois a RMC é um método não invasivo e com elevada resolução espacial que permite a avaliação do VD de forma tridimensional20. Este exame promove
visualização tomográfica detalhada da morfologia do VD além de oferecer definição nítida entre o miocárdio e o sangue intracavitário. Estudos já validaram as medidas dos volumes, massa muscular e FEVD por RMC. A RMC é considerada hoje o padrão ouro para a avaliação não invasiva do VD12,19.
Estudos utilizando RMC mostraram que pacientes com HP, quando comparados a grupo controle, apresentam aumento significativo dos volumes sistólico e diastólico finais e da massa muscular do VD, assim como redução significativa da FEVD32. Essas diferenças tiveram papel prognóstico
acompanhamento e um ano após, a redução no volume sistólico, o aumento do volume diastólico final do VD e a diminuição do volume diastólico final do VE foram fatores fortemente preditores de falência de tratamento e mortalidade14.
Kind T et al.30 usaram as imagens de RMC no corte de quatro
cavidades e estudaram a variação entre sístole e diástole dos componentes longitudinal e transversal. Para avaliar o componente transversal, eles traçaram segmentos entre a parede livre e septo e, para avaliar o componente longitudinal, segmentos do anel tricúspide ao ápice cardíaco. Esse estudo mostrou que o a redução no componente transversal teve melhor correlação com a FEVD do que a redução no sentido longitudinal em pacientes com HP. Eles ainda mostraram que quando comparados a um grupo controle, os pacientes com HP apresentam diferença no padrão de contração. A contração no eixo transversal apresenta maior redução nos segmentos apicais em indivíduos normais. Nos pacientes com HP essa diferença ocorre principalmente nos segmentos próximos a base do coração. O estudo conclui que o movimento transversal nos pacientes com HP se correlaciona melhor com a medida da função global do VD do que a medida do movimento longitudinal, pela RMC. Os autores acreditam que esse achado está associado ao fato do movimento transversal incluir o movimento septal. Quando a pós-carga aumenta e o VD dilata, o septo acaba sendo empurrado em direção ao VE e esse abaulamento septal não é levado em conta quando apenas o componente longitudinal é medido.
Assim outras formas de se estimar a FEVD continuaram a ser pesquisadas, entre elas a RVFAC (Right Ventricular Fractional Area Change). A RVFAC expressa o percentual de variação entre as áreas diastólica e sistólica finais do VD (ADFVD e ASFVD, respectivamente). As imagens são obtidas no corte de quatro-cavidades no eixo longitudinal e apenas duas imagens, a diastólica final e a sistólica final, são usadas. Para a determinação da RVFAC, ainda é necessário fazer o contorno da borda endocárdica, porém, como esse contorno é feito em apenas duas imagens, sua medida se torna muito mais rápida do que a da FEVD, que requer contorno em diversos cortes. O processo para o cálculo da RVFAC pode ser de 8 a 12 vezes mais rápido do que a determinação da FEVD16. A RVFAC,
por ser uma medida bidimensional, engloba os componentes longitudinal e transversal da contração ventricular, incluindo a movimentação septal. Os estudos mostraram que ela tem boa correlação com a função ventricular direita medida pela RMC e ainda se mostrou ser um fator prognóstico em cardiopatias29,33. Essa ferramenta começou então a ser estudada em
pacientes com HP.
O estudo já mencionado de Kind et al.30 mostrou forte correlação
deste índice com a FEVD (R2 = 0,76, p < 0,001) e o estudo de Mauritz et
al.16 mostrou o valor prognóstico da RVFAC em pacientes com HP. A
RVFAC parece ser melhor do que o TAPSE como índice da FEVD em pacientes com HP por incluir o movimento transversal enquanto que o
TAPSE avalia apenas o movimento longitudinal. No entanto, não se sabe qual o comportamento dessa medida em grupos com diferente comprometimento hemodinâmica e como ela se comporta nas diferentes etiologias de HP.
2.1. Objetivo principal
Avaliar a performance da RVFAC de acordo com a gravidade do acometimento hemodinâmico em dois grupos distintos de pacientes portadores de hipertensão pulmonar pré-capilar: HAP e TEPCH.
2.2. Objetivo secundário
Comparar a performance da RVFAC com a do TAPSE como índices da FEVD.
3.1. População do estudo
A população estudada consistiu nos pacientes encaminhados para avaliar possível doença vascular pulmonar no Centro de Referência Francês para HP, o Hospital Antoine Béclère, em Clamart, na França, vinculado à Universidade de Paris XI. Todos os pacientes que eram avaliados pela primeira vez neste centro e que tinham indicação de cateterismo cardíaco direito foram entrevistados para realização de RMC. Pacientes que concordavam em participar do estudo realizavam então a ressonância cardíaca.
Os critérios de inclusão foram: idade maior que 18 anos, HP pré-capilar ao cateterismo cardíaco direito (caracterizada pela presença de PAPm ≥ 25 mmHg e pressão da artéria pulmonar ocluída ≤ 15 mmHg), RMC realizada em até 72 horas da realização do cateterismo cardíaco.
Os critérios de exclusão foram: gravidez, as contra-indicações para realização de ressonância cardíaca (claustrofobia conhecida, marcapasso ou desfibrilador implantável, clip de aneurisma cerebral, fragmento metálico ocular e implante coclear, obesidade mórbida), presença de hipertensão pulmonar associada a doenças pulmonares crônicas ou com componente multifatorial ou incerto.
3.2. Avaliação hemodinâmica
Todos os pacientes incluídos na análise final foram submetidos a cateterismo cardíaco direito. O cateterismo era realizado no laboratório de hemodinâmica do próprio centro por pneumologistas especialistas em HP. Os pacientes ficavam em posição supina e o cateter da artéria pulmonar era inserido através de punção venosa do membro superior direito ou da veia jugular interna direita. A medida da PAPo era realizada com o balão insuflado na artéria pulmonar após confirmação por radioscopia de que o cateter estava adequadamente posicionado. O débito cardíaco foi medido pelo método de termodiluição e a média de três medidas foi considerada. Eram registradas as pressões de átrio direito, ventrículo direito e da artéria pulmonar (PAP), assim como a freqüência cardíaca. Amostra de sangue venoso misto, ou seja, da artéria pulmonar, foi coletado em 57 pacientes. A RVP foi calculada: RVP=(PAPm–PAPo)/DC. O volume sistólico foi calculado de acordo com a fórmula: VS=DC/FC. A complacência vascular pulmonar foi calculada pela divisão do volume sistólico pela pressão de pulso (PAP sistólica – PAP diastólica).
3.3. Ressonância magnética cardíaca
Os exames foram realizados em equipamento de 1,5 Tesla de campo principal (Magnetom Avanto, Siemens Medical Solutions, Germany) com sincronização eletrocardiográfica e em pausa inspiratória. As imagens cardíacas foram adquiridas no eixo curto e no eixo longo do VE através da técnica de SSFP (balanced steady-state free procession pulse sequence). Uma seqüência de imagens em eixo curto foi adquirida da base ao ápice do VE com intervalos de aproximadamente 5 mm, totalizando em média 10 cortes para cobrir todo o VE. Para análise do VD, outra seqüência de imagens cortes de 6 mm de espessura, contíguos, ou seja, sem intervalos, foi adquirida em paralelo ao plano da valva tricúspide, da base ao ápice do VD. As imagens em quatro cavidades foram adquiridas no eixo longo que foi realizado perpendicularmente ao eixo curto. Imagens de cine-ressonância da artéria pulmonar foram também adquiridas.
3.4. Análise das imagens da ressonância cardíaca
Todas as imagens foram analisadas por um radiologista que desconhecia os resultados do cateterismo cardíaco e os diagnósticos dos pacientes.
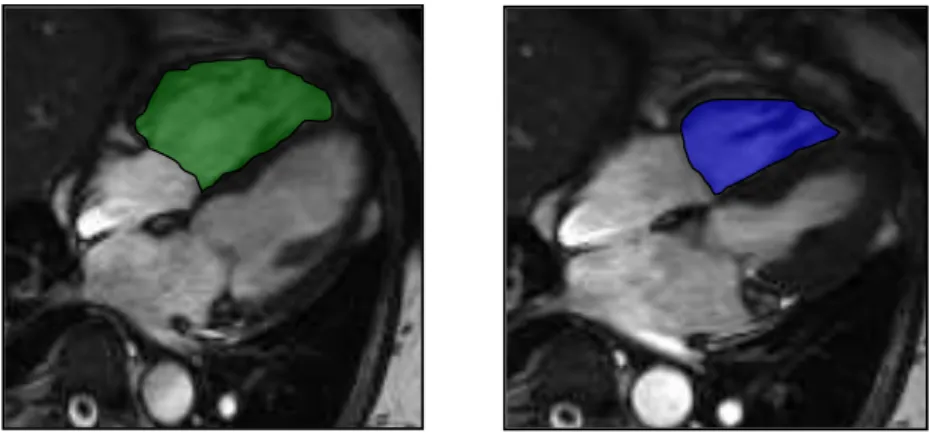
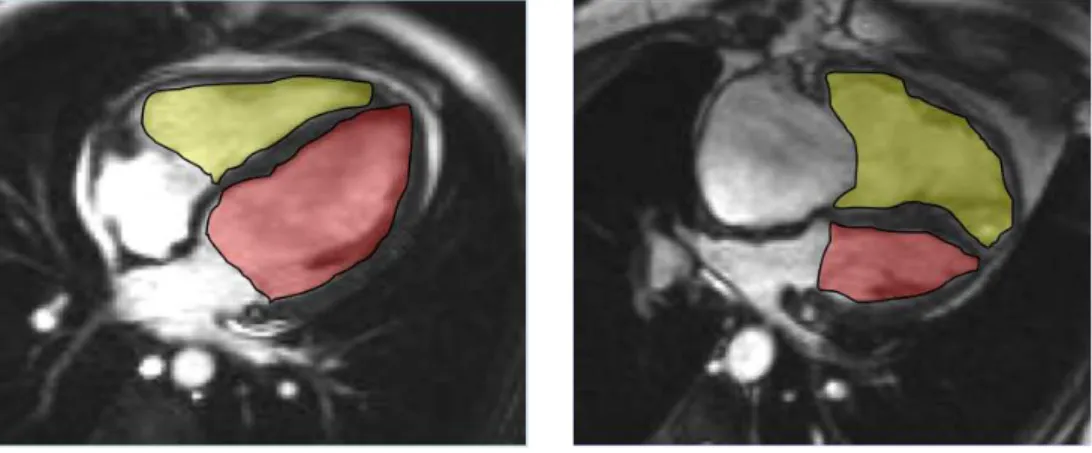
A ASFVD e a ADFVD foram determinadas através do delineamento manual da borda endocárdica do VD nas imagens em quatro-cavidades (Figura 1). A RVFAC foi calculada: RVFAC= 100x(ADFVD-ASFVD)/ADFVD. A área diastólica final do VE (ADFVE) também foi determinada pelo delineamento manual da borda endocárdica nas imagens em quatro cavidades e a relação ADFVD/ADFVE determinada (Figura 2). A medida do TAPSE foi realizada também no corte de quatro-cavidades e a distância percorrida pelo anel da válvula tricúspide foi medida entre a sístole e a diástole máximas do VD (Figura 3). O diâmetro entre as paredes anterior e posterior (dA-P) e entre as paredes livre e septal (dL-S) do VE foram medidos nas imagens em eixo curto na sístole máxima e na diástole máxima do VE. O índice de excentricidade (IE) do VE foi calculado: IE=dA-P/dL-S (Figura 4).
Para o cálculo da fração de ejeção, as áreas sistólicas e diastólicas finais do VE e VD foram delineadas nas imagens em eixo curto, possibilitando a determinação dos volumes sistólico e diastólicos finais dos
mesmos. O software ARGUS (versão VA 50C, Siemens Medical Solucions, Erlangen, Germany) foi utilizado para cálculo das frações de ejeção ventricular.
O diâmetro do tronco da artéria pulmonar foi medido e as áreas máximas e mínimas da artéria pulmonar (AmaxAP e AminAP, respectivamente) foram determinadas para o cálculo da pulsatilidade da artéria pulmonar (Pulsat AP=100 x (AmaxAP – AminAP) / AminAP).
Figura 1. Áreas diastólica e sistólica finais do ventrículo direito.
Imagem em corte de quatro cavidades: à esquerda, a área diastólica final (em verde) na diástole máxima e à direita, a área sistólica final (em azul) na sístole máxima do VD.
Figura 2. Áreas diastólica finais dos ventrículos direito e esquerdo.
Imagem em corte de quatro cavidades mostrando as áreas diastólica final do VD (em amarelo) e diastólica final do VE (em vermelho). À esquerda: ADFVD/ADFVE = 0,59 em paciente sem HP (PAPm = 10 mmHg). À direita: ADFVD/ADFVE = 2,28 em paciente com HP (PAPm = 51 mmHg).
Figura 3. TAPSE.
Imagem em corte de quatro cavidades: à esquerda na diástole máxima e à direita na sístole máxima do VD. A seta em vermelho indica a distância percorrida pelo anel da válvula tricúspide da base em direção ao ápice cardíaco.
Figura 4. Índice de excentricidade do ventrículo esquerdo.
Imagem no corte em eixo curto na diástole máxima do VE. Em verde o diâmetro entre as paredes anterior e posterior (dA-P) e em vermelho o diâmetro entre as paredes septal e livre (dL-S) do VE. À esquerda paciente com HP (índice de excentricidade = 2,4 e PAPm = 53 mmHg) e a à direita paciente sem HP (índice de excentricidade = 0,9 e PAPm = 10 mmHg).
3.5. Análise estatística
Os valores estão apresentados em média ± desvio padrão. Para comparação entre as médias utilizamos o Teste T de Student. As correlações foram testadas através de regressão linear, usando o método de média dos mínimos quadrados. Curvas ROC (Receiver Operating Characteristic) foram construídas para testar a capacidade da RVFAC e do TAPSE em detectar FEVD < 35%. O valor de p < 0,05 foi considerado estatisticamente significante. Para comparação das variáveis categóricas utilizou-se o teste do Chi-quadrado ou o teste exato de Fisher, conforme apropriado. As análises estatísticas foram realizadas no Software Medcalc®, versão 12.2.1.0 (Mariakerke, Belgium).
4.1. População do estudo
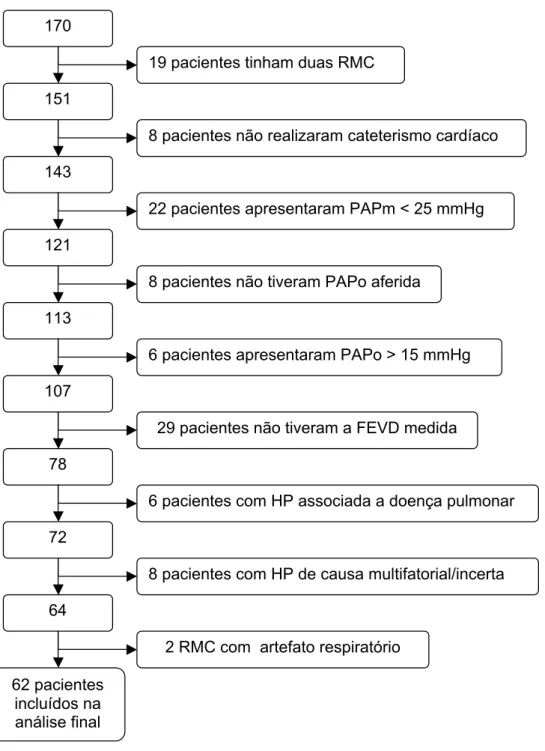
No período de Maio de 2009 a Fevereiro de 2011, 170 pacientes realizaram RMC. Foram incluídos para análise 62 pacientes com diagnóstico final de HAP e TEPCH (Figura 5).
Figura 5 – Fluxograma da seleção da população incluída para análise.
RMC: ressonância magnética cardíaca, PAPm: pressão da artéria pulmonar média, PAPo: pressão da artéria pulmonar ocluída, HP: hipertensão pulmonar, FEVD: fração de ejeção do ventrículo direito.
151
19 pacientes tinham duas RMC
143
8 pacientes não realizaram cateterismo cardíaco
121
22 pacientes apresentaram PAPm < 25 mmHg
113
8 pacientes não tiveram PAPo aferida
78
72 107
64 170
6 pacientes apresentaram PAPo > 15 mmHg
29 pacientes não tiveram a FEVD medida
6 pacientes com HP associada a doença pulmonar
8 pacientes com HP de causa multifatorial/incerta
2 RMC com artefato respiratório 62 pacientes
incluídos na análise final
4.2. Dados clínicos e hemodinâmicos
As características clínicas e hemodinâmicas da população estão expostas nas tabelas 1 e 2 respectivamente. Quando dividimos a população conforme a classificação diagnóstica, obtivemos 23 pacientes no grupo 1 (HAP) e 39 no grupo 4 (TEPCH).
A população apresentava em média 58 anos, com maioria do sexo feminino e em classe funcional III pela NYHA (New York Heart Association). No grupo de HAP, o principal diagnóstico foi HAP idiopática com 12 casos. Os demais diagnósticos foram HAP associadas: à doença veno-oclusiva (2 pacientes), ao uso de anorexígenos (1 paciente), à doença do tecido conectivo (2 pacientes), à comunicação interatrial (3 pacientes), à hipertensão portal (2 pacientes) e à anemia falciforme (1 paciente).
Quando comparamos os grupos HAP e TEPCH encontramos apenas diferença significativa na idade e peso. Em relação aos pacientes com HAP, os pacientes com TEPCH eram mais velhos e tinham peso discretamente maior, conseqüentemente um índice de massa corpórea também maior.
Tabela 1. Características clínicas da população.
SC: superfície corpórea; IMC: índice de massa corpórea; TC6M: teste de caminhada de seis minutos; SvO2: saturação venosa mista; Hb:
hemoglobina. População total n = 62 HAP n = 23 TEPCH n = 39 P valor Idade, anos 58,3 ± 17,2 47,5 ± 17,6 64,6 ± 13,5 < 0,001 SC, m2 1,75 ± 0,21 1,69 ± 0,19 1,79 ± 0,21 0,062 Peso, Kg 67,9 ± 14,6 62,7 ± 13,9 71,0 ± 14,3 0,029 Altura, cm 166,5 ± 9,1 166,1 ± 8,2 166,9 ± 9,7 0,735 IMC 24,3 ± 4,2 22,7 ± 4,6 25,3 ± 3,7 0,015 Sexo 34 F / 28 M 13 F / 10 M 21 F / 18 M 0,30 Classe funcional I e II / III e IV 11 / 51 6 / 17 5 / 34 1,0 TC6M, m (n=59) 379,4 ± 113,4 365,8 ± 114,3 387,5 ± 113,6 0,48 SvO2 , % (n=57) 62,0 ± 8,9 63,6 ± 9,6 61,2 ± 8,6 0,336 Hb, mg/dL 14,6 ± 1,7 14,4 ± 1,7 14,8 ± 1,7 0,352
Em relação às medidas hemodinâmicas houve diferença significativa entre os dois grupos diagnósticos. A pressão de pulso da artéria pulmonar foi maior e conseqüentemente a complacência vascular pulmonar foi menor no grupo TEPCH quando comparado com o grupo HAP (Tabela 2).
Tabela 2. Características hemodinâmicas da população. População Total n = 62 HAP n = 23 TEPCH n = 39 P valor FC, bpm 80,8 ± 12,6 83,7 ± 14,4 79,2 ± 11,3 0,191 PAD, mmHg 6,39 ± 4,6 6,17 ± 4,14 6,52 ± 4,91 0,775 PAPm, mmHg 46,7 ± 12,3 47,6 ± 15,3 46,2 ± 10,3 0,683 PAPo, mmHg 7,4 ± 3,1 7,1 ± 2,9 7,6 ± 3,2 0,565 DC, L/min 4,76 ± 1,48 4,89 ± 1,79 4,67 ± 1,22 0,575 IC, L/min/m2 2,70 ± 0,74 2,89 ± 0,95 2,59 ± 0,58 0,132 RVP, UW 9,2 ± 4,2 9,3 ± 4,6 9,1 ± 4,0 0,832 VS, mL 60,4 ± 19,9 60,1 ± 20,9 60,5 ± 19,5 0,939 PP, mmHg 52,2 ± 15,1 44,8 ± 12,7 56,6 ± 14,8 0,002 CVP, ml/mmHg 1,29 ± 0,63 1,56 ± 0,75 1,16 ± 0,51 0,016
FC: freqüência cardíaca; PAD: pressão de átrio direito; PAPm: pressão da artéria pulmonar média; PAPo: pressão da artéria pulmonar ocluída; DC: débito cardíaco; IC: índice cardíaco; RVP: resistência vascular pulmonar; VS: volume sistólico; PP: pressão de pulso; CVP: complacência vascular pulmonar.
4.3. Dados da ressonância cardíaca
Em relação às medidas realizadas pela RMC, houve diferença apenas na área diastólica final do VD; o grupo HAP apresentou VD mais dilatado do que o grupo de TEP crônico (Tabela 3).
A freqüência cardíaca medida durante a realização do cateterismo cardíaco direito e durante a RMC não apresentou variação significativa. (80,7 ± 12,7 e 81,5 ± 13,6 respectivamente, p = 0,722).
Tabela 3. Dados da ressonância magnética cardíaca.
FEVE: fração de ejeção do ventrículo esquerdo; Tronco AP: tronco da artéria pulmonar; Pulsat AP: pulsatilidade da artéria pulmonar; FEVD: fração de ejeção do ventrículo direito; VDFVDi: volume diastólico final indexado do ventrículo direito; VSFVDi: volume sistólico final indexado do ventrículo direito; VSVDi: volume sistólico indexado do ventrículo direito; ADFVDi: área diastólica final indexada do ventrículo direito; ASFVDi: área sistólica final indexada do ventrículo direito; ADFVEi: área diastólica final do ventrículo esquerdo; TAPSE: Tricuspid Annular Plane Systolic Excursion; RVFAC: Right Ventricular Fractional Area Change.
População total n = 62 HAP n = 23 TEPCH n = 39 P valor FEVE, % 61,6 ± 13,3 57,9 ± 16,9 63,6 ± 10,5 0,110 Tronco AP, mm 33,8 ± 4,8 34,6 ± 5,3 33,4 ± 4,5 0,375 Pulsat AP, % 17,5 ± 12,8 17,9 ± 12,8 17,3 ± 12,9 0,875 FEVD, % 30,6 ± 13,8 30,6 ± 15,5 30,6 ± 12,9 0,991 VDFVDi, mL/m2 109,8 ± 37,1 116,4 ± 38,7 105,9 ± 36,0 0,282 VSFVDi, mL/m2 78,7 ± 35,9 83,6 ± 39,8 75,8 ± 33,8 0,414 VSVDi, mL/m2 31,1 ± 14,4 32,8 ± 16,0 30,1 ± 13,4 0,466 ADFVDi, cm2/m2 18,8 ± 4,6 20,5 ± 5,1 17,8 ± 4,1 0,026 ASFVDi, cm2/m2 14,2 ± 4,8 15,4 ± 5,5 13,5 ± 4,2 0,133 ASFVEi, cm2/m2 15,0 ± 3,3 15,3 ± 3,4 14,9 ± 3,2 0,642 TAPSE, mm 13,7 ± 4,6 14,4 ± 5,2 13,2 ± 4,3 0,359 RVFAC, % 25,7 ± 11,4 26,3 ± 12,8 25,3 ± 10,7 0,749
4.4. Correlações da FEVD com as variáveis hemodinâmicas
A FEVD apresentou correlação fraca tanto com as medidas hemodinâmicas que refletem o aumento da pós-carga do VD (PAPm, RVP, pressão de átrio direito e complacência vascular pulmonar) como com as medidas de função do VD (DC e volume sistólico) (Figura 6).
Figura 6. Correlações da FEVD com as variáveis hemodinâmicas.
PAPm: pressão da artéria pulmonar média; RVP: resitência vascular pulmonar; PAD: pressão de átrio direito; CVP: complacência vascular pulmonar; DC: débito cardíaco; Vol Sistólico: volume sistólico; FEVD: fração de ejeção do ventrículo direito.
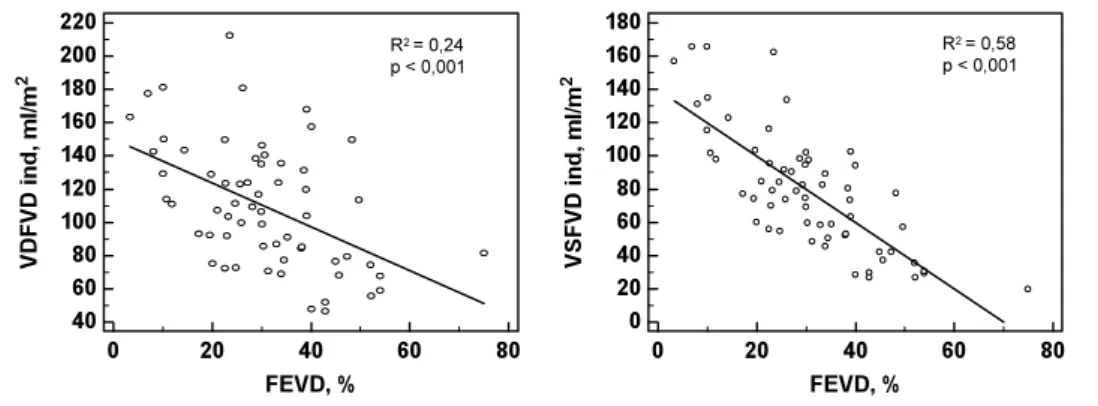
4.5. Correlações da FEVD com os volume do ventrículo direito
A FEVD apresentou correlação mais forte com a medida do volume sistólico final do que com a medida do volume diastólico final do VD (Figura 7).
Figura 7. Correlações da FEVD com os volumes do ventrículo direito.
VDFVD ind: volume diastólico final indexado do ventrículo direito; VSFVD ind: volume sistólico indexado final do ventrículo direito; FEVD: fração de ejeção do ventrículo direito.
4.6. Correlações entre as áreas e os volumes do ventrículo direito
Apesar das medidas das áreas diastólica e sistólica finais serem medidas bidimensionais, elas apresentaram uma forte correlação com as medidas dos volumes diastólico e sistólico finais do VD (Figura 8).
Figura 8. Correlações entre as áreas e os volumes do ventrículo direito.
ADFVD ind: área diastólica final indexada do ventrículo direito; VDFVD ind: volume diastólico final indexado do ventrículo direito; ASFVD ind: área sistólica final indexada do ventrículo direito; VSFVD ind: volume sistólico final indexado do ventrículo direito.
4.7. Correlações entre FEVD , RVFAC e TAPSE
Quando analisamos a população total, a FEVD apresentou associação mais forte com a RVFAC (R2 = 0,65, p < 0,001) do que com o
TAPSE (R2 = 0,35, p < 0,001) (Figura 9).
Figura 9. Correlações entre FEVD, RVFAC e TAPSE.
TAPSE: Tricuspid Annular Plane Systolic Excursion; RVFAC: Right Ventricular Fractional Area Change; FEVD: fração de ejeção do ventrículo direito.
4.8. Dados da ressonância cardíaca nos grupos com menor e maior gravidade hemodinâmica
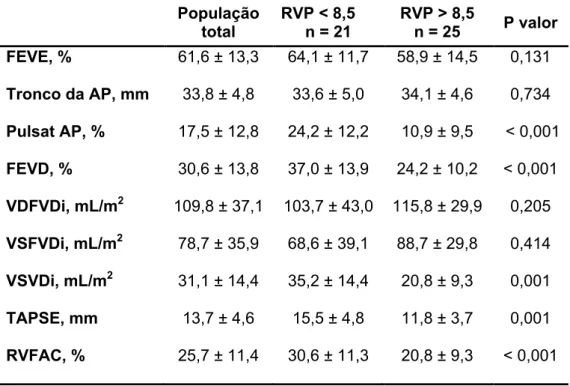
Para avaliar o comportamento da função ventricular direita em relação à gravidade hemodinâmica, dividimos a população pela mediana da resistência vascular pulmonar (8,5 UW) (Tabela 4).
Tabela 4. Comparação dos dados da ressonância magnética cardíaca entre o grupo com menor e maior gravidade hemodinâmica.
População total RVP < 8,5 n = 21 RVP > 8,5 n = 25 P valor FEVE, % 61,6 ± 13,3 64,1 ± 11,7 58,9 ± 14,5 0,131 Tronco da AP, mm 33,8 ± 4,8 33,6 ± 5,0 34,1 ± 4,6 0,734 Pulsat AP, % 17,5 ± 12,8 24,2 ± 12,2 10,9 ± 9,5 < 0,001 FEVD, % 30,6 ± 13,8 37,0 ± 13,9 24,2 ± 10,2 < 0,001 VDFVDi, mL/m2 109,8 ± 37,1 103,7 ± 43,0 115,8 ± 29,9 0,205 VSFVDi, mL/m2 78,7 ± 35,9 68,6 ± 39,1 88,7 ± 29,8 0,414 VSVDi, mL/m2 31,1 ± 14,4 35,2 ± 14,4 20,8 ± 9,3 0,001 TAPSE, mm 13,7 ± 4,6 15,5 ± 4,8 11,8 ± 3,7 0,001 RVFAC, % 25,7 ± 11,4 30,6 ± 11,3 20,8 ± 9,3 < 0,001
FEVE: fração de ejeção do ventrículo esquerdo; Tronco AP: tronco da artéria pulmonar; Pulsat AP: pulsatilidade da artéria pulmonar; FEVD: fração de ejeção do ventrículo direito; VDFVDi: volume diastólico final indexado do ventrículo direito; VSFVDi: volume sistólico final indexado do ventrículo direito; VSVDi: volume sistólico indexado do ventrículo direito; TAPSE: Tricuspid Annular Plane Systolic Excursion; RVFAC: Right Ventricular Fractional Area Change.
4.9. Correlações entre a FEVD, RVFAC e TAPSE nos grupos com menor e maior gravidade hemodinâmica
A RVFAC se relaciona melhor com a FEVD do que o TAPSE nos dois grupos (menor e maior gravidade hemodinâmica). No grupo com maior gravidade hemodinâmica essa diferença se acentuou, a RVFAC mostrou correlação mais de três vezes maior com a FEVD do que o TAPSE (Figura 10).
Figura 10. Correlações entre FEVD, TAPSE e RVFAC nos grupos com menor e maior gravidade hemodinâmica.
A e B: grupo com menor gravidade hemodinâmica (RVP < 8,5 UW); C e D: grupo com maior gravidade hemodinâmica (RVP > 8,5 UW). RVP: resistência vascular pulmonar, TAPSE: Tricuspid Annular Plane Systolic excursion; RVFAC: Right Ventricular Fractional Area Change; FEVD: fração de ejeção do ventrículo direito.
A B
4.10. Medidas de interdependênca ventricular nos grupos com menor e maior gravidade hemodinâmica
Em um subgrupo de 46 pacientes, medidas de interdependência ventricular foram analisadas. A relação entre as áreas diastólica finais do VD e VE (ADFVD/ADFVE) esteve significativamente aumentada no grupo com maior gravidade hemodinâmica. Os índices de excentricidade do VE na sístole e na diástole foram significativamente maiores também no grupo com maior gravidade hemodinâmica (Tabela 5).
Tabela 5. Medidas de interdependência ventricular nos grupos com maior e menor gravidade hemodinâmica.
n = 46 RVP < 8,5 n = 21 RVP > 8,5 n = 25 P valor ADFVD, mm2 32,2 ± 7,2 31,1 ± 7,4 33,1 ± 7,1 0,352 ADFVE, mm2 25,5 ± 5,9 29,1 ± 4,8 22,5 ± 5,1 0,001 ADFVD/ADFVE 1,32 ± 0,41 1,09 ± 0,32 1,52 ± 0,38 0,001 IE diástole 1,37 ± 0,25 1,23 ± 0,14 1,49 ± 0,26 < 0,001 IE sístole 1,39 ± 0,33 1,23 ± 0,19 1,54 ± 0,36 0,001
ADFVD: área diastólica final do ventrículo direito; ADFVE: área diastólica final do ventrículo esquerdo; IE: índice de excentricidade do VE.
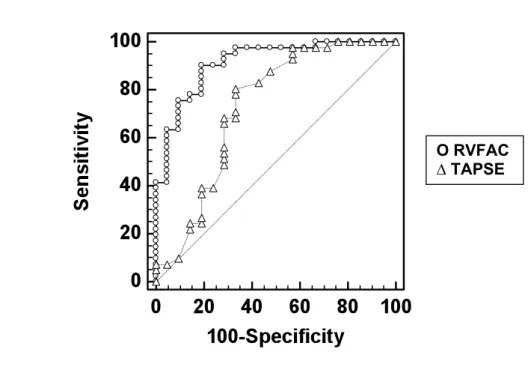
4.11. Comparação entre as curvas ROC para a capacidade da RVFAC e do TAPSE em diagnosticar disfunção grave de ventrículo direito
A comparação entre a capacidade desses dois índices em prever disfunção grave de VD (FEVD < 35%) através da comparação de curvas ROC mostrou que a RVFAC tem melhor performance. (TAPSE: AUC 0,73 e RVFAC: AUC 0,93, p = 0,0065) (Figura 11).
Figura 11. Comparação das curvas ROC para a capacidade da RVFAC e do TAPSE em diagnosticar disfunção grave do VD.
TAPSE: Tricuspid Annular Plane systolic excursion; RVFAC: Right Ventricular Fractional Area Change; FEVD: fração de ejeção do ventrículo direito.
Ο RVFAC ∆ TAPSE
4.12. Correlações entre FEVD, RVFAC e TAPSE em HAP e TEPCH
Analisamos as relações do TAPSE e RVFAC com a FEVD em cada um dos grupos diagnósticos (HAP e TEP crônico) separadamente.
No grupo com HAP, a correlação da FEVD com a RVFAC (R2 = 0,80,
p < 0,001) também foi melhores do que com o TAPSE (R2 = 0,37, p=0,002) e
no grupo com TEP crônico, os resultados se mantiveram semelhantes (TAPSE R2 = 0,34 e RVFAC R2 = 0,54, com p<0,001 para as duas medidas).
Nosso estudo mostrou que a RVFAC é um bom índice para estimar a FEVD em pacientes com HP. Nos pacientes com maior gravidade hemodinâmica, a RVFAC se correlacionou ainda melhor com a FEVD do que o TAPSE e esse achado parece ser relacionado à inclusão do componente transversal da contração ventricular na sua medida. A performance da RVFAC foi similar nos dois grupos de HP estudados: HAP e TEPCH.
Com o objetivo de entender melhor as determinantes da FEVD, analisamos as correlações da FEVD com as diferentes variáveis hemodinâmicas. Observamos que a FEVD apresentou associação apenas fraca, tanto com as determinantes de pós-carga (PAPm, RVP, pressão de átrio direito e complacência vascular pulmonar) como com as medidas de função (volume sistólico e débito cardíaco) do VD. Outro dado interessante foi que a FEVD apresentou associação mais forte com o volume sistólico final que com o volume diastólico final do VD. Esses achados mostram que não é apenas a sobrecarga do VD que determina a FEVD; o componente de contração miocárdica tem também papel importante na sua determinação34.
Em outro estudo preliminar, nosso grupo havia mostrado que esses índices clássicos da pós-carga ventricular direita explicavam menos de 40% da variabilidade da FEVD35. Desta forma, a FEVD reflete além da sobrecarga
ventricular, a forma como o VD responde à sobrecarga imposta pela HP, ou seja, a forma como ele remodela.
Dada a importância do componente miocárdico na determinação da FEVD, a melhor compreensão do remodelamento ventricular se faz necessária36. Além do estímulo pela sobrecarga volumétrica e de pressão,
substâncias como a noradrenalina, a endotelina e a angiotensina (que estão envolvidas na fisiopatologia da HP) estimulam a hipertrofia miocárdica e interferem na apoptose celular. Na hipertrofia, os miócitos apresentam alterações no aparato de contração ventricular (mudança no padrão das proteínas contráteis), na eficiência energética (redução na síntese de adenosina e na absorção de glicose) e aumento do colágeno extracelular37.
Existe assim, um comprometimento miocárdico independente do comprometimento vascular na HP. O fato de a FEVD incluir esse comprometimento miocárdico na sua determinação corrobora com o achado dela ser um fator prognóstico na HP independente do comprometimento hemodinâmico38. Os achados do nosso estudo reforçam o papel do
comprometimento miocárdico na determinação da FEVD e reforçam o achado da FEVD como fator independente do acometimento hemodinâmico, como demonstrado por van de Veerdonk M et al.15. O reconhecimento do
comprometimento miocárdico se torna importante na HP para que novas modalidades terapêuticas sejam testadas, já que os tratamentos específicos para HP visam apenas a ação nos vasos pulmonares39. Estudos com
beta-bloqueadores, espirinolactona e inibidores da enzima conversora de angiotensina vêm sendo realizados em pacientes com HP40-43 e talvez o
tratamento direcionado ao acometimento cardíaco possa trazer novas perspectivas, já que o remodelamento miocárdico pode ser reversível com o