1
ROYAUME DU MAROC
UNIVERSITE MOHAMED V - RABAT
FACULTE DE MEDECINE ET DE PHARMACIE - RABAT
Place de l’IRM dans le diagnostic de l’amylose cardiaque
Expérience du service de Cardiologie B
Mémoire de fin d’étude en vue de l’obtention du Diplôme National de Spécialité Médicale
En CARDIOLOGIE Présenté par Dr.ELOUARDIGHI KAOUTAR Sous la direction du : Pr.DOGHMI NAWAL Année 2020
2
REMERCIEMENTS :
Je tiens à remercier infiniment Mme le Professeur DOGHMI NAWAL d’avoir accepté d’encadrer ce travail.
Je remercie également tous mes professeurs de cardiologie pour le très beau parcours que nous avons passé ces 4 années, pour nous avoir appris le sens de la rigueur, du sérieux et de la persévérance. Vous nous
avez assistés avec patience pendant toutes ces années d’études, avec le souci de bien nous apprendre le savoir-faire de notre métier.
3
Sommaire :
I- Introduction :
A. propriétés communes aux différentes formes d’amylose : 1. Structure physique
2. Formation des fibrilles B. classification et terminologie II- Diagnostic de l’amylose cardiaque :
A. les manifestations cliniques B. les examens complémentaires
1. Electrocardiogramme (ECG) 2. Biomarqueurs cardiaques 3. Echocardiographie
C. Place de l’IRM dans le diagnostic de l’atteinte cardiaque de l’amylose :
1. Données morphologiques 2. Données fonctionnelles
3. Ti scouting et temps d’inversion du myocarde 4. Rehaussements tardifs
5. Cartographies T1, T2 D. Imagerie nucléaire
E. Autres examens biologiques extra-cardiaques F. Histologie
G. Grandes lignes thérapeutiques III- Matériel et méthodes
IV- Résultats V- Discussion VI- Conclusion VII- Références
4
I-Introduction :
Les amyloses sont un groupe hétérogène d’affections systémiques caractérisées par le dépôt extracellulaire de protéines fibrillaires insolubles. Elles peuvent être héréditaires ou acquises, localisées ou disséminées, asymptomatiques ou au contraire de pronostic
redoutable.
La plus fréquente est l’amylose AL. elle liée au dépôt de chaînes légères d’immunoglobulines. Elle peut être associée à un myélome ou une gammapathie monoclonale, et dans ce cas, son diagnostic est en
général facile. Un problème diagnostique existe lorsque le myélome ou la gammapathie ne sont pas connus, ou lorsque les manifestations évocatrices de l’amylose sont peu nombreuses.
Les symptômes liés aux propriétés physico-chimiques des protéines insolubles, se traduisent le plus souvent par des hypertrophies et des dysfonctions d’organes. Les tissus les plus fréquemment atteints sont les reins, le foie, le tube digestif, le système neveux et le cœur.
L’atteinte cardiaque est la plus grave. Elle est responsable de la moitié des décès. Le dépôt interstitiel de protéines amyloïdes dans le
myocarde va provoquer une atrophie des fibres myocardiques, et une fibrose endomyocardique, responsable d’une hypertrophie pariétale et d’une réduction de la compliance des parois ventriculaires. Il en résulte une cardiopathie restrictive sévère, souvent réfractaire au traitement. Un dépôt intra-mural coronarien peut de plus être responsable d’une insuffisance coronarienne.
Il existe donc un enjeu thérapeutique et pronostique majeur à poser précocement le diagnostic d’atteinte cardiaque, afin de prévenir l’évolution vers une altération incurable de la fonction cardiaque. Le diagnostic positif repose le plus souvent sur la confirmation d’une atteinte extracardiaque. Cependant, il faut savoir évoquer l’amylose lorsque seuls les symptômes cardiaques sont présents : dysfonction du ventricule gauche à coronaires saines, ou cardiopathie restrictive avec
5 hypertrophie myocardique. Le diagnostic de certitude reste la biopsie endomyocardique, mais son caractère invasif et peu accessible rend son application clinique parfois difficile. Le diagnostic peut alors être posé par l’association de plusieurs critères : cliniques,
échocardiographiques, isotopiques, et d’imagerie par résonance magnétique, associés à une biopsie extracardiaque positive.
6
A- Propriétés communes aux différentes formes d’amylose :
1- Structure physique :
Quel que soit le précurseur protéique responsable de leur
formation, les dépôts d’amylose ont en commun des propriétés tinctoriales et structurales caractéristiques résultant de la
structure des fibrilles. En microscope optique, les dépôts hyalins sont de siège extracellulaire et apparaissent homogènes et
amorphes. Ils se confondent avec les dépôts tissulaires d’autre origine, formés de protéines plasmatiques, de collagène ou de nécrose, d’où l’importance des colorations spécifiques. La plus sensible et la plus spécifique est le rouge Congo qui colore tous les dépôts d’amylose et qui donne, en lumière polarisée, une biréfringence jaune-vert caractéristique. En microscopie
électronique, les dépôts amyloïdes apparaissent constitués de fibrilles rigides, linéaires, non branchées, disposées en amas désordonnés de longueur indéfinie. Les fibrilles ont un diamètre compris entre 7,5 et 10mm, une structure dite bêta plissée
antiparallèle, responsable de la fixation du rouge Congo, dans laquelle les extrémités N- et C-terminales sont orientées dans des directions opposées. Les fibrilles sont formées de protofilaments (quatre à six) enroulés en hélice.
Elles sont associées à des composants non fibrillaires communs à tous les types d’amylose. Le plus important est une glycoprotéine, appelée composant amyloïde P, qui peut constituer jusqu’à 15% des dépôts. Ce composant P participe à la stabilité des dépôts, rendant compte de leur caractère pratiquement insoluble en milieu organique. Il provient d’une protéine sérique normale synthétisée par le foie, voisine de la protéine C réactive, la SAP. La SAP se lie facilement, en particulier à des polysaccharides linéaires de structure répétitive, les glycosaminoglycanes, dont certains participent à la constitution des différentes amyloses et pourraient jouer un rôle facilitateur dans la constitution des dépôts.
7
2- Formation des fibrilles :
La condition nécessaire pour la formation et le dépôt des fibrilles amyloïdes est la présence d’un précurseur protéique autologue, circulant ou produit localement. La conversion de la structure native de ce précurseur en une structure secondaire bêta plissée antiparallèle est un processus pathologique proche du repliement physiologique des protéines. Il se produit parce que la protéine peut avoir une propension naturelle à adopter une conformation anormale qui peut devenir apparente avec l’âge (par exemple la transthyrétine, protéine normale dont l’accumulation progressive entraîne l’amylose sénile) ou en raison d’une concentration
anormalement élevée (par exemple la bêta2-microglobuline [B2M] responsable de l’amylose des hémodialysés). Un autre mécanisme, habituel au cours des amyloses héréditaires, est le remplacement d’un seul acide aminé dans une protéine
normalement pas ou peu amyloïdogène. Enfin, le dérivé d’un précurseur, par clivage protéolytique ou autre, peut être à l’origine de l’amylose comme cela est le cas dans certaines amyloses immunoglobuliniques (AL) où la perte du domaine constant de certaines chaînes légères paraît favoriser leur polymérisation et la formation des fibrilles amyloïdes.
8
B- Classification et terminologie :
La classification actuelle des amyloses est basée sur la nature du précurseur protéique. A ce jour, 31 protéines différentes ont été reconnues comme agent causal d’une amylose.
9 Les différentes variétés d’amylose sont nommées suivant la
nature de la protéine impliquée qui elle-même sera désignée par le préfixe A (pour l’amylose) et un suffixe spécifique.
Ainsi, la protéine amyloïde dérivée des chaînes légères
d’immunoglobulines est désignée AL, et l’amylose constituée de ces chaînes « amylose AL », de même pour les protéines ATTR dérivées de la transthyrétine, l’amylose correspondante est nommée « amylose ATTR ».
Les formes cardiaques les plus fréquentes sont les amyloses AL (immunoglobuliniques) et les amyloses à transthyrétine (TTR) héréditaire (TTR-h) ou sénile (TTR sauvage ou TTR-WT).
• Les amyloses à chaînes légères AL :
Elles sont liées principalement aux gammapathies monoclonales ou au myèlome. Les gammapathies monoclonales sont très fréquentes et touchent environ 10% des patients âgés de 60ans et plus. Les gammapathies se compliquent rarement d’amylose mais représentent plus de 60% des CA (1) (2).
• Les amyloses à transthyrétine :
La transthyrétine (TTR) est une protéine synthétisée par le foie sous forme de monomères. Ces monomères s’assemblent en tétramères qui transportent des protéines dans le sang. Les amyloses TTR sont de deux types :
- les amyloses TTR-h : c’est une forme héréditaire secondaire à une mutation de la TTR, la transmission se fait selon un mode autosomique dominant, avec un âge de début qui peut être très tardif dans les formes cardiaques généralement après 60 ans, et jusqu’à plus de 80 ans (7).
- les amyloses TTR-wt : l’amylose TTR-wt, ou sénile, est
majoritairement diagnostiqué chez des sujets de sexe masculin (>90 pour cent), possiblement en raison d’un âge de début plus tardif et d’un dépistage moindre chez la femme. Sa prévalence augmente avec l’âge (jusqu’à 25 de dépôts amyloîdes cardiaques après 85ans dans certaines séries autopsiques (3).
10
II- Diagnostic de l’amylose cardiaque :
A- Les manifestations cliniques :
Les manifestations cardiaques dans l’amylose ne sont pas spécifiques : dyspnée, syncope, vertige, rarement une douleur thoracique (4) (5). Ce qui retarde souvent le diagnostic.
L’atteinte cardiaque au cours de l’amylose peut avoir des conséquences très graves :
- Insuffisance cardiaque congestive avec FEVG (initialement) préservée, due à la diminution de la compliance du VG occasionnée par les dépôts amyloîdes et la dysfonction diastolique.
- Altération de la fonction systolique suivant la dysfonction
diastolique aboutissant à une insuffisance cardiaque terminale. - L’élévation chronique des PRVG conduit à la dilatation de l’OG,
exposant ainsi au risque de FA et aux complications thrombo-emboliques.
- Troubles de rythme graves type TV (soutenue ou non soutenue). - Troubles de conduction, plus fréquents au cours des amyloses
ATTR.
- Hypotension orthostatique due à la dysautonomie vasculaire. - Plus rarement, la survenue d’une douleur thoracique par
atteinte de la microcirculation coronaire (en principe la macrocirculation reste indemne d’atteintes significatives). Les manifestations extra-cardiaques sont diverses et varient en fonction du type d’amylose.
11 L’atteinte dysautonomique peut être observée dans tous les types
d’amylose (moins fréquente dans les TTR-wt) : hypotension
orthostatique, syncope, insuffisance chronotrope, troubles digestifs, incontinence, dysfonction érectile, agueusie.
Les manifestations extra-cardiaques orientent également le diagnostic. A rechercher systématiquement :
- Echymose péri-orbitaire - Macroglossie
- Syndrome du canal carpien - Aspect pseudo-athlétique - Neuropathie périphérique - Canal lombaire étroit
12
B- Les examens complémentaires :
1- Electrocardiogramme (ECG) :
L’ECG est anormal dans 90% des cas. Un microvoltage des QRS, des pseudo-ondes Q dans le territoire antéro-septal, des QRS fragmentés et des troubles de la conduction type bloc auriculo-ventriculaire (BAV) sont classiquement décrit dans les amyloses (6) (7). Ces anomalies sont évocatrices surtout si elles sont associées à une hypertrophie importante à
l’échocardiographie
.
2- Biomarqueurs cardiaques
:
Les biomarqueurs cardiaques troponine et /ou peptides
natriurétiques (BNP) sont élevés dans les formes évoluées (8) (9). Cette élevation est le temoin de la souffrance myocytaire du fait de l’infiltration myocardique.
13
3- Echocardiographie :
L’atteinte cardiaque est caractérisée essentiellement soit par une cardiomyopathie infiltrative hypertrophique ou
restrictive (10).
Actuellement, les nouvelles techniques d’imagerie (speckle tracking ou 2D strain) ont aussi un rapport important dans le diagnostic (11).
Les principales anomalies détectées à l’échocardiographie transthoracique (ETT) sont :
- Une hypertrophie symétrique (>= 12mm), plus évocatrice
lorsqu’elle touche les deux ventricules avec un aspect granité et brillant du myocarde. Une hypertrophie >=15mm est associée à un mauvais pronostic (12).
- Un épaississement du septum inter-auriculaire.
- Un épaississement des valves mitrales et tricuspides. - Une cavité ventriculaire gauche (VG) petite ou normale. - Une fonction systolique globale du VG souvent préservée
(FEVG>50%) jusqu’à un stade tardif. Cependant en Doppler tissulaire, on note une diminution des vélocités des ondes Set E’ à l’anneau mitral latéral et septal témoin de l’altération de la fonction longitudinale et de la relaxation du VG.
- Une atteinte de la fonction diastolique qui commence par un trouble de la relaxation à la phase initiale puis une élévation des pressions de remplissage à un stade évolué avec un profil
restrictif et une dilatation bi-auricuaire.
- Un épanchement péricardique de faible abondance (13). - Des thrombi intra-auriculaires même en rythme sinusal (14). - Dilataion auriculaire.
La triade hypertrophique biventriculaire, profil restrictif et épanchement péricardique est très évocatrice d’amylose cardiaque, mais signe un stade avancé (15).
L’analyse des déformations du VG par le 2D-strain montre que malgré une fonction systolique préservée, le 2D-strain global du VG
14 est diminué avec une prédominance sur les segments basaux et
une préservation des segments apicaux ce qui aboutit à un gradient base-apex.
Figure1 : Aspect typique d’amylose cardiaque en incidence apicale des 4 cavités avec hypertrophie concentrique du VG, du SIA, et des valves auriculo ventriculaires et aspect scintillant du myocarde.
Figure2 : L’incidence sous costale permet de bien apprécier
l’hypertrophie ventriculaire droite
Figure3 : Coupe parasternale petit axe à un stade évolué avec présence d’épanchement péricardique et altération de la fonction radiale
15 Figure4 : L’outil le plus utile pour appréhender la fonction
longitudinale du VG dans l’amylose est le 2D Strain. L’étude du speckle tracking permet de mettre en évidence un élément important dans l’amylose cardiaque : le gradient apex-base
Figure5 : L’infiltration amyloide commence au niveau basal altérant les paramètres de déformation précocement à ce niveau puis progresse lentement en direction de l’apex. La figure suivante montre 4 patients différents avec des sévérité croissante de gauche à droite. L’apex reste longtemps préservé, il n’est atteint que dans les stades avancés de la maladie.
16
C- Place de l’IRM dans le diagnostic de l’atteinte cardiaque
de l’amylose
L’IRM cardiaque est la clé de voûte du diagnostic de l’atteinte cardiaque dans le cadre d’une amylose systémique. Non invasive, elle arrive en seconde intention après l’évaluation clinique, les dosages biologiques et l’échographie cardiaque transthoracique.
La suspicion d’atteinte cardiaque à l’échographie transthoracique est définie comme suit : épaisseur de la paroi ventriculaire gauche supérieure ou égale à 12mm en l’absence d’autre cause connue ; ou une paroi libre du ventricule droit épaissie coexistant avec un épaississement ventriculaire gauche en l’absence d’hypertension systémique ou pulmonaire (16).
D’autres signes évocateurs d’atteinte cardiaque à l’échographie cardiaque transthoracique sont un épaississement homogène des valves auriculoventriculaires, un épaississement du septum inter-auriculaire et un aspect hyperéchogène « brillant » ou « scintillant » du septum interventriculaire (17,18).
17 Ces signes échographiques présentent cependant quelques
limites :
- Ils sont caractéristiques de la maladie à un stade avancé mais peu présents à un stade plus précoce.
- Ils sont opérateurs dépendants, notamment pour le réglage du gain de l’échographe, pouvant modifier l’appréciation du caractère hyperéchogène scintillant du myocarde (17).
L’IRM cardiaque est, en ce sens, une méthode plus objective et moins opérateur dépendant que l’échographie transthoracique, permettant d’une part, une aussi bonne appréciation et quantification des anomalies diastoliques (19), ainsi qu’une caractérisation tissulaire d’autre part ; elle est utile au diagnostic positif d’amyloïdose cardiaque, en revanche, elle ne permet pas de préjuger de la nature des dépôts.
18 1. Données morphologiques
L’IRM révèle habituellement une hypertrophie myocardique concentrique associée à un épaississement du septum interventriculaire, des parois des oreillettes et de la paroi libre du ventricule droit. De récents travaux ont démontré que cette présentation d’hypertrophie concentrique est présente dans 60% des cas, cependant une hypertrophie excentrique, un remodelage concentrique ou une morphologie ventriculaire gauche normale peuvent également être retrouvés bien que plus rarement. (20). Il s’y associe une dilatation bi-auriculaire, avec une surface auriculaire mesurée à plus de 24 cm2 en télésystole (Figure 6).
Des thrombi muraux, notamment auriculaires, peuvent être retrouvés ; les thrombus intra-cavitaires ont été rapportés plus fréquemment dans l’amylose AL que dans les autres sous types d’amylose (21,22). Enfin, des épanchements péricardiques et pleuraux sont souvent objectivés (Figure 7).
19 L’étude de la contractilité intrinsèque par les séquences tagging (équivalent du strain à l’ETT) se fait en appliquant une grille au myocarde afin d’étudier la déformation qui peut se faire d’une manière quantitative et qualitative.
Figure 6 : Séquence ciné petit axe avec hypertrophie du septum interventriculaire à 19mm (A) ; séquence ciné 4 cavités avec dilatation bi auriculaire et épanchement pleural bilatéral (B).
Figure 7 : Séquence CINE 4 cavités (A) et petit axe (B) avec épanchement péricardique circonférentiel et épanchement pleural droit.
20 2. Données fonctionnelles
Les séquences CINE dans les différents plans du cœur retrouvent une hypokinésie globale. La fonction systolique ventriculaire gauche peut être préservée au début de la maladie mais est le plus souvent altérée au stade avancé d’insuffisance cardiaque. Une altération de la fonction systolique du ventricule gauche associée à la dysfonction diastolique permet de différencier les cardiomyopathies restrictives des cardiomyopathies hypertrophiques.
3. Ti scouting et temps d’inversion du myocarde
La séquence Ti scouting représente un élément primordial de l’imagerie par résonnance magnétique. Elle nous apporte un signe pathognomonique de l’atteinte cardiaque lors de l’amylose systémique : la difficulté ou l’impossibilité à déterminer le temps d’inversion myocardique.
En effet, en temps normal, sur une séquence de Ti scouting, le signal pool sanguin s’annule avant celui du myocarde ; en cas d’infiltration myocardique par des dépôts amyloïdes amorphes, on observe un virage myocardique c’est à dire une annulation du signal du myocarde avant celui du pool sanguin (Figure 8).
21 Si ce virage myocardique n’est pas présent, l’opérateur est confronté à une difficulté dans la détermination du temps d’inversion optimal du myocarde, liée à une perturbation de la cinétique du gadolinium, ce dernier restant capté au sein du myocarde par les dépôts amyloïdes alors qu’il est rapidement éliminé par la circulation au sein du pool sanguin.
Figure 8 : Séquence de Ti Scout : virage myocardique avec annulation du signal du myocarde (D) avant celui du pool sanguin (E
22 4. Rehaussements tardifs
Les séquences de rehaussements tardifs sont réalisées en pondération T1, dix minutes après injection de gadolinium, après inversion du signal du myocarde afin d’en améliorer le rapport contraste sur bruit. Un rehaussement sous endocardique diffus, non systématisé à un territoire artériel, est retrouvé dans la plupart des cas (23)(24) (Figure 9).
Il intéresse en majeure partie le ventricule gauche, mais peut également toucher les oreillettes, les muscles papillaires, le septum inter ventriculaire (25) et la paroi libre du ventricule droit.
Figure 9 : Séquence de rehaussement tardif en 4 cavités (A) et petit axe (B) : rehaussement tardif diffus intéressant le ventricule gauche et à moindre degrés le ventricule droit.
23 Bien que caractéristiques lorsque diffus, les rehaussements tardifs peuvent être d’interprétation délicate, surtout au début de la maladie où un pattern « patchy sous endocardique» peut être retrouvé, rendant la distinction difficile avec des séquelles d’infarctus du myocarde (26). Un rehaussement tardif transmural a été rapporté comme un facteur pronostique important, associé à une plus forte mortalité, tous types d’amylose confondus (27).
5. Cartographies T1, T2
Il s’agit de séquences paramétriques et quantitatives, étudiant les temps de relaxation des différents tissus. En IRM, la relaxation des protons H d’un tissu soumis à un champ magnétique statique constitue le principe fondamental de l’intensité du signal émis (28). Le principe de ces cartographies est de suivre la relaxation dans le temps des protons d'un tissu. Pour cela les séquences sont répétées en modifiant un seul paramètre, le temps d’écho ou l'angle de bascule (flip angle) pour obtenir une courbe de relaxation pour chaque pixel de l'image. La présence d’œdème, de graisse ou de fibrose modifie les temps de relaxation T1 et T2 des tissus, comme cela a été démontré dans la littérature (29).
24 Le cas le plus démonstratif reste celui de l’infarctus du myocarde, où la cicatrice ischémique est remplacée par du tissu fibreux avec un temps de relaxation T1 allongé au sein de cette zone, comparativement au reste du myocarde (29).
A l’inverse de la fibrose myocardique focale, soulignée par les rehaussements tardifs sur la base d’une différence de signal entre la zone cicatricielle et le myocarde sain adjacent, la fibrose diffuse, quant à elle, n’est pas mise en lumière par l’injection de gadolinium (29).
L’avènement récent de ces nouvelles séquences met donc à notre disposition des outils permettant une caractérisation tissulaire : quantification de la fibrose diffuse ou focale (Cartographie T1), de l’œdème myocardique (Cartographie T2), en nous affranchissant des limites connues des séquences morphologiques de rehaussements tardifs, classiquement rapportées dans les pathologies infiltratives diffuses du myocarde.
25
a. Cartographie T1
Elle est réalisée avec une synchronisation prospective à l’ECG ; on effectue une acquisition single-shot en une seule apnée de plusieurs images TrueFISP à différents temps d’inversion après un pulse d’inversion-récupération non sélectif de 180° (Figures 10 et 11).
L’ensemble des images est acquis au même moment du cycle cardiaque, permettant une quantification pixel par pixel du T1 myocardique.
Figure 10 : Protocole d’acquisition de la cartographie T1 dans notre centre. Après le pulse d’inversion-récupération, il est acquis plusieurs images à différents battements cardiaques jusqu’à repousse complète T1.
26
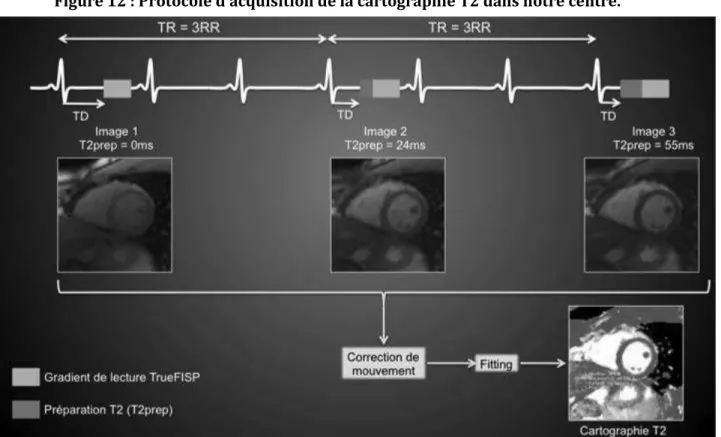
b. Cartographie T2
Elle est réalisée avec une synchronisation prospective à l’ECG ; une séquence mono apnée est acquise, en utilisant un gradient de lecture TrueFISP après une préparation T2 préalable. En pratique, trois images sont acquises en Single Shot, après trois préparations T2 (TE = 0, 24 et 55ms), en utilisant la même fenêtre d’acquisition pour chaque image en diastole (Figures 12 et 13).
Le temps d’acquisition total est égal à sept battements cardiaques et on applique une correction du mouvement entre les trois images par un algorithme dédié.
Au final, une cartographie T2 est générée à partir des trois images après fitting T2 pixel par pixel (30).
27 Figure 13 : Séquence T2 mapping petit axe médio ventriculaire.
c. Post traitement des cartographies T1 et T2
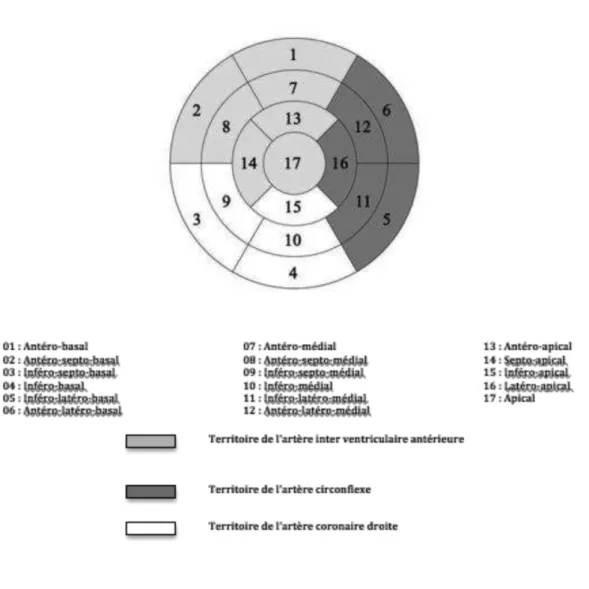
Les mesures du T1 et T2 sont effectuées à l’aide de régions d’intérêt (ROI), suivant la segmentation myocardique de l’AHA. (Figure 14). Ces ROI doivent être limitées à la région intra
myocardique, en excluant les cavités cardiaques avec le pool sanguin, et la graisse épicardique.
Pour bien établir la segmentation au niveau de la base et du segment moyen, l’axe horizontal est d’abord tracé, suivi de deux axes de 60 et 120 degré chacun (Figure 16). Pour l’apex, deux axes perpendiculaires sont tracés.
28 Figure 14 : Segmentation myocardique selon l’AHA
29
D- Imagerie nucléaire :
Les traceurs diphosphonates utilisés pour les scintigraphies osseuses marquent les dépôts d’amylose cardiaque. Elle semble plus spécifique des dépôts amyloides des composés de
transthyrétine. Une fixation myocardique diffuse et intense à la scintigraphie est en faveur d’une amylose à la transthyrétine (héréditaire ou sénile).
31
E- Autres examens biologiques extra-cardiaques :
La réalisation d’électrophorèse des protides, de l’immunofixation, du dosage des chaînes libres sériques et de la recherche de
protéinurie de Bence-jones sont nécessaires devant la suspicion du diagnostic de l’amylose AL. L’EPP et l’IEPP identifient le pic
monoclonale et permettent de quantifier les chaînes Kappa et Lambda.
F- Histologie :
La confirmation du diagnostic d’amylose en général, est
histologique. Elle implique donc la réalisation d’une biopsie et son étude après coloration spécifique par le rouge congo.
La biopsie endomyocardique est l’examen de référence pour le diagnostic de l’amylose cardiaque. Cependant, elle n’est pas pratiquée en routine et n’est pas facilement accessible. Même quand elle est disponible, les praticiens sont très hésitants vu les risques associés à savoir : perforation, tamponnade, pneumothorax et arythmies graves.
D’autres biopsies moins invasives sont possibles pour le diagnostic de l’amylose surtout si associées au contexte clinique et d’autres techniques d’imagerie.
Longtemps la biopsie rectale a été l’examen de référence mais elle est désagréable pour le patient et comporte un risque de
saignement. Deux autres techniques, moins invasives, semblent aussi performantes : la ponction de graisse sous-cutanée et la biopsie de glandes salivaires accessoires. La biopsie médullaire est aussi possible.
32 L’examen histologique demande un pathologiste averti de la
suspicion diagnostique et entraîné, notamment quand il s’agit de tout petits fragments obtenus par ponction de graisse
sous-cutanée. Une fois le diagnostic d’amylose établi, la nature des dépôts doit être précisée. Le diagnostic précis du type d’amylose repose essentiellement sur l’examen immunohistochimique des fragments congelés en utilisant différents anticorps, antichaînes légères pour l’amylose AL, anti-SAA pour l’amylose AA, et
antitransthyrétine pour l’amylose ATTR. D’autres anticorps sont également disponibles pour identifier les protéines précurseurs d’autres amyloses héréditaires.
33
G- Les grandes lignes thérapeutiques :
L’amylose est une maladie souvent grave. Le pronostic et l’évolution dépendent du type d’amylose, de l’extension des dépôts amyloîdes et de l’importance de l’atteinte cardiaque. L’impression que la formation des dépôts d’amylose est un processus irréversible est fausse. Il existe un équilibre entre la formation et l’élimination des dépôts,qui est très variable suivant les malades.
La suppression ou la diminution du taux de la protéine à l’origine des dépôts s’accompagne en général d’une réduction de
l’importance des dépôts et d’une amélioration clinique le plus souvent lente mais pouvant être relativement rapide, voire spectaculaire.
Le degré de réduction de la protéine nécessaire pour cela varie entre patients et dépend du turnover des dépôts d’amylose. Un traitement peut théoriquement agir de plusieurs façons : • Augmenter la vitesse d’élimination des dépôts constitués. • Réduire la production ou les taux sériques du précurseur
amyloîdogène et donc la formation de nouveaux dépôts en permettant à l’organisme d’éliminer les dépôts amyloîdes.
1- Mesures générales :
Le traitement des amyloses cardiaques se base essentiellement sur le traitement diurétique et la restriction sodée qui doivent être adaptés au niveau de congestion. Les bêtabloquants et les bradycardisants ne sont pas recommandés afin de maintenir un débit cardiaque correct.
Les médicaments dromotropes négatifs sont contre indiqués puisqu’ils peuvent aggraver les troubles de la conduction.
34 Les traitements classiques de l’insuffisance cardiaque,
notamment les IEC, sont à éviter en raison du risque d’hypotension et de la dysautonomie (31) (32).
Les troubles du rythme atriaux sont fréquents et le recours à des anti-arythmiques est souvent nécessaire.
Les anti-coagulants sont ) considérer même si rythme sinusal, en cas de dilatation de l’OG et profil restrictif même en l’absence de thrombi du massif auriculaire.
En cas d’insuffisance cardiaque terminale, la transplantation cardiaque peut être une option chez des patients jeunes avec atteinte cardiaque isolée (33).
2- Traitement spécifique :
Les traitements actuels de l’amylose AL visent à réduire la production des chaînes légères par chimiothérapies (34) (35). Le traitement médical des amyloses TTR est en plein
développement.
Un stabilisateur du tétramère de la transthyrétine (tafamidis) semble améliorer le pronostic des amyloses TTR avec atteinte cardiaque (36) (37).
35
II- Matériel et méthodes :
Il s’agit d’une étude rétrospective descriptive mono centrique, portant sur 40 patients, entre janvier 2017 et décembre 2019, menée au sein du CHU Ibn Sina de Rabat.
Le recrutement était réalisé par les services de cardiologie, hématologie clinique et médecine interne.
Le but de l’étude est de démontrer la place de l’IRM dans le diagnostic de l’amylose en l’absence de possibilité de réaliser une biopsie
endomyocardique chez nos patients.
Les critères d’inclusion étaient une symptomatologie clinique et échocardiographique suspecte d’amylose cardiaque.
Les dossiers des patients inclus étaient relus de manière rétrospective pour receuil des données diagnostiques : âge, FDRCV, signes cliniques (présence de signe d’IVG, dyspnée, syncope, angor, signes électriques). Le compte rendu de l’échocardiographie initiale était revu pour recueil de la présence (selon l’opérateur) d’une hypertrophie ventriculaire, d’une dilatation ventriculaire gauche, d’une dilatation de l’oreillette gauche.
L’épaisseur du septum inter ventriculaire télédiastolique en mm, de la FEVG en pourcentage étaient recueillies, de même que la présence d’une HTP définie par une pression artérielle pulmonaire systolique PAPs supérieure à 35mmhg, d’un épanchement péricardique et d’un aspect hyperechogène ou granité du myocarde.
Tous nos patients ont bénéficié d’une IRM cardiaque avec injection de gadolinium et évaluation des différents paramètres morphologiques et fonctionnels des cavités cardiaques (DTD VG, DTS VG, diamètre OG, épaisseur septum basal, moyen, et basal, FEVG), ainsi qu’une étude du tagging et du rehaussement tardif.
36
III- Résultats :
Parmi 40 patients initialement inclus sur la base de la clinique et
l’échocardiographie, 25 ont été retenus suite au diagnostic de l’atteinte cardiaque par l’IRM.
6 patients sur 40 étaient déjà pris en charge pour myélome multiple. Uniquement 2 d’entre eux ont révélé une atteinte cardiaque.
L’analyse descriptive a intéressé ces 25 patients retenus. L’âge moyen au diagnostic était de 65+/-12 ans.
Une prédominance masculine a été notée avec 68% pour les hommes contre 32% pour les femmes.
Ce qui rejoint les données de la littérature.
Sur le plan clinique, 100% des patients retenus ont présenté des signes d’insuffisance cardiaque congestive.
Sur le plan échocardiographie, l’hypertrophie ventriculaire gauche était présente chez 100% de nos patients. Le myocarde était considéré
M 68% F
32%
37 comme hyperéchogène ou avec un aspect « granité » dans 14 cas sur 25 soit 56%. La fonction diastolique était caractérisée par la présence d’un profil mitral restrictif dans 15 cas soit 60%.
Pour les 25 patients retenus, l’IRM cardiaque a démontré :
- Une altération de la FEVG dans 20 cas (80%) et une dilatation de l’OG dans 100% des cas avec une moyenne de 47mm.
- Une hypertrophie ventriculaire gauche chez tous les patients avec une moyenne de 15mm pour le septum basal, 14mm pour le
septum moyen et 12mm pour le septume apical.
- Une hypokinésie globale avec altération du tagging chez 22 patients soit 88%.
- Rehaussement tardif donnant un aspect en « zèbre » avec une couche sous endocardique et sous épicardique en hypersignal et couche en hyposignal médio-pariétal chez tous les patients.
0 5 10 15 20 25 30
38 0% 20% 40% 60% 80% 100% 120%
Altération FEVG HVG Altération Tagging Réhaussement tardif
39
IV- Discussion :
L’amylose systémique de type AL est caractérisée par une accumulation de dépôts amyloïdes dans de nombreux organes. (38) L’accumulation de cette protéine insoluble au sein de l’espace interstitiel entraine une expansion du volume extra-cellulaire.
L’atteinte cardiaque concerne plus de 90% des patients et est associée à un pronostic sombre avec des complications telles que l’insuffisance cardiaque ou des troubles de conduction. (39)
La mortalité rapportée à l’atteinte cardiaque concerne environ la moitié des patients atteints d’amylose systémique de type AL avec une médiane de survie de moins d’un an sans traitement. (40)
En pratique courante, le diagnostic d’atteinte cardiaque dans le cadre d’une amylose systémique de type AL est basé sur une approche multiparamétrique plutôt que sur la biopsie endomyocardique. En effet, si la biopsie endomyocardique est la méthode de référence pour démontrer l’atteinte cardiaque, elle n’est pas dénuée de risques et est limitée par la taille et le nombre d’échantillons prélevés. (41)
40 Cependant, cette approche multiparamétrique en pratique courante inclut souvent :
1/ une biopsie prouvant l’atteinte systémique (rein, glandes salivaires, rectum, moelle osseuse etc…)
2/ un faisceau d’arguments pour l’atteinte cardiaque comprenant une évaluation clinique cardiologique, l’électrocardiogramme, l’échographie cardiaque transthoracique et l’IRM cardiaque.
L’IRM cardiaque est considérée comme une des méthodes non invasives permettant d’établir le diagnostic de l’atteinte cardiaque d’une amylose systémique. (42)
Habituellement, les signes à l’IRM orientant vers une atteinte cardiaque sont une hypertrophie myocardique diffuse, une hypokinésie globale, un épanchement péricardique, et surtout des rehaussements tardifs évocateurs diffus ou sous-endocardiques non systématisés à un territoire artériel, associés à une difficulté à déterminer le temps d’inversion myocardique. Ce pattern a largement été validé et est associé à un pronostic sombre, mais sa précision n’est pas parfaite et requiert une injection de chélates de gadolinium, pouvant être délicate chez une population à risque souffrant d’insuffisance rénale. (43)
41 Les cartographies T1 et T2 mapping se sont récemment développées et permettent de déterminer les temps de relaxation du myocarde sans injection de chélates de gadolinium. (43,44)
Il existe des variations de ces temps de relaxation dans de nombreuses pathologies, telles que la fibrose myocardique (45), l’œdème myocardique(46), ou les pathologies infiltrantes. (47)
A ce jour, peu d’études ont évalué l’intérêt des cartographies natives T1 et T2 mapping dans le champ d’exploration de l’amylose systémique de type AL. (48)
Les principaux résultats de cette étude montrent une corrélation entre l’aspect typique de l’IRM avec forte suspicion clinique d’atteinte cardiaque.
La FEVG moyenne était altérée contrairement aux données de la littérature, ceci est justifié par le retard diagnostic. L’altération de la fonction diastolique et ses conséquences sur l’oreillette gauche et les pressions pulmonaires étaient fréquentes.
62.5% des IRM réalisées dans notre série retrouvaient des anomalies
fortement spécifiques d’atteinte amyloîde par le biais d’un
42 Cet examen nous a été d’une grande utilité dans notre contexte où la
biopsie endomyocardique n’est pas possible, améliorant ainsi la prise
43
V- Conclusion :
Le diagnostic d’amylose cardiaque pose souvent des difficultés, et pourtant, il se doit d’être précoce du fait d’un pronostic très
défavorable en l’absence de traitement adapté.
Le diagnostic d’une amylose cardiaque doit être évoqué devant toute cardiomyopathie hypertrophique et/ou insuffisance cardiaque à
FEVG préservée et doit mener à la recherche de signes cliniques extra-cardiaques.
La confirmation du diagnostic d’amylose est anatomopathologique. Les biopsies non invasives négatives ne permettent pas d’éliminer formellement le diagnostic.
Les signes évocateurs d’amylose cardiaque doivent être recherchés à l’ECG, aux dosages de biomarqueurs cardiaques et à l’ETT :
discordance hypertrophie échographie/ microvoltage ECG,
discordance FEVG préservée/ élévation majeure des biomarqueurs cardiaques, discordance FEVG préservée/ altération du strain global avec gradient base-apex.
Les anomalies à la scintigraphie osseuse sont évocatrices du diagnostic de l’amylose ATTR.
L’IRM cardiaque représente un examen clé dans l’arsenal
paraclinique des suspicions d’atteinte cardiaque amyloîde, du fait de son caractère non invasif, sa plus grande accessibilité et de sa grande spécificité. En particulier, certaines caractéristiques de rehaussement tardif qui sont suffisamment spécifiques pour porter le diagnostic d’amylose cardiaque, évitant possiblement à l’avenir le recours à la biopsie endomyocardique (49).
La prise en charge de l’insuffisance cardiaque est particulière et ne
44 bêtabloquants et bradycardisants, anticoagulation efficace à discuter systématiquement, prévention des fréquentes complications
rythmiques et conductives.
Le pronostic de l’amylose est amélioré par les nouvelles
thérapeutiques et la possibilité de greffe cardiaque pour des patients selectionnés.
45
RESUME :
Introduction –objectif :
le but de notre travail est de démontrer la place de l’IRM dans le diagnostic de l’amylose cardiaque en l’absence de possibilité de réaliser une biopsie endomyocardique.
Patients et méthodes :
Il s’agit d’une étude rétrospective descriptive mono centrique,
portant sur 40 patients, entre Janvier 2017 et décembre 2019, menée au sein du service de cardiologie B du CHU Ibn Sina de Rabat.
Ont été inclus dans notre étude tous les patients ayant bénéficié d’une IRM cardiaque devant une symptomatologie clinique et écho cardiographique suspecte d’amylose cardiaque.
Résultats :
L’âge moyen des patients était de 65+/-12 avec une prédominance masculine (68%).
L’atteinte cardiaque a été confirmée sur IRM chez 62.5% de nos malades, objectivant l’aspect typique en « zèbre » avec
rehaussement tardif.
Conclusion :
L’IRM cardiaque représente un examen clé dans l’arsenal para clinique du diagnostic de l’amylose cardiaque, du fait de son caractère non invasif et sa grande spécificité.
46
REFERENCES:
1. Vogelsberg H, Mahrholdt H, Deluigi CC, Yilmaz A, Kis pert EM, Greulich S, et al. Cardiovascular magnetic resonance in clinically suspected cardiac amyloidosis : non invasive imaging compared to endomyocardial biopsy. Jam Coll Cardiol 2008 ; 51 :1022-30.
2. Germans T, Van Rossum AC. The use of cardiac magnetic resonance imaging to determine the aetiology of left ventricular disease and cardiomyopathy. Heart 2008 ; 04 : 510-8.
3. A.Jaccard, J-P Fernnand. Service d’hématologie clinique et de thérapie cellulaire, centre hospitalier universitaire de Limoges, hôpital Dupuytren,2, avenue Martin-Luther-King, 87042 Limoges cedex, France.
4. Ng B, Connors LH, Davidoff R, Skinner M, Falk RH. Senile systemic amyloidosis presenting with heart failure : a comparison with light chain-associated amyloidosis. Arch Intern Med.2005 Jun 27 ;165 (12) : 1425-9.
5. Brenner DA, Jain M, Pimentel DR, Wang B, Connors LH, Skimer M, et al. Human amyloidogenic light chains directly impair
cardiomyocyte function through an increase in cellular oxidant stress. Circ Res. 2004 Apr 30 ;94(8) : 1008-10.
6. Maceira AM, Joshi J, Prasad SK, Moon Jc, Perugini E, Harding I, et al. Cardio-vascular magnetic resonance in cardiac amyloidosis. Circulation 2005 ; 111 :186-93.
7. Rapezzi C, Arbustini E, Caforio ALP, Charron P, Gimeno-Blanes J, Heliot, et al. Diagnostic work-up in cardiomyopathies : bringing the gap between clinical phenotypes and final diagnosis. A position
statement from the ESC working Group on myocardial and pericardial diseases. Eur Heart J. 2013 May ; 34 (19) : 1448-58.
8. Palladini G, Compana C, Klersy, Balduini A, Vadacca G, Perfetti V, et al. Serum N-terminal pro-brain natriuretic peptide is a senstive
47 marker of myocardial dysfunction in AL amyloidosis. Circulation 2003 May 20 ; 107 (19) :2440-5.
9. Babuin L, Jaffe AS. Troponin : the biomarker of choice for
detection of cardiac injury. CMAJ can Med Assoc J Assoc Medicale can. 2005 N ou8 ; 173 (10) : 1191-202.
10. Siqueira-Filho AG, Cunha CL, Tajik AJ, Seward JB, Schattenberg TT, Giuliani ER. M-mode and two-dimensional echocardiographic features in cardiac amyloidosis. Circulation. 1981 Jan ; 63(1) : 188-96. 11. Mohty D, damy T, Cosnay P, Echahidi N, Casset-senon D, Virot P, et al. Cardiac amyloidosis : updates in diagnosis and management. Arch Cardiovasc dis. 2013 Oct ; 106 (10) : 528-40.
12. Salma Charfeddine, Rania Hammami, Leila Abid, SouadMallek, Dorra Abid, Samir Kammoun. Cardiac amyloidosis : From diagnosis to management. Cardiologie tunisienne. Volume 14 N°03. 2018-153-159.
13. Bellavia D, Pellikka PA, Al-Zahrani GB, Abraham TP, Dispenzieri A, Miyazaki C, el al. Independent predictors of survival in primary
systemic (al) amyloidosis, including cardiac biomarkers and left ventricular strain imaging : an observational cohort study. J Am Soc Echocardiog off Publ Am Soc Echocardiogr.2010 Jun ; 23(6) : 643-52. 14. Feng D, Edwards WD, Oh JK, Chandrasekaran K, Grogan M,
Martinez MW, et al. Intracardiac thrombosis and embolism in patients with cardiac amyloidosis. Circulation. 2007 Nov 20 ; 116 (21) : 2420-6.
15. T.sanzalone, V.Thomson, R.Dauphin, C.Journe, Y.Berthezene. Diagnosis of cardiac amyloidosis using magnetic resonance imaging : A new reliable, non-invasive technique to be validated. SNFMI.
J.Revmed. 2011.04.004.
16. Gertz MA, Comenzo R, Falk RH, Fermand JP, Hazenberg BP, Hawkins PN, et al. Definition of organ involvement and treatment response in immunoglobulin light chain
48 International Symposium on Amyloid and Amyloidosis. Am J Hematol. août 2005;79(4):319 28.
17. Bodez D, Deux J-F, Rosso J, Tissot C-M, Guendouz S,
Benhaiem N, et al. L’amylose cardiaque, une maladie pas si rare ! Arch Mal Coeur Vaiss - Prat. avr 2014;2014(227):13 22.
18. Recueil d’IRM cardiaque, principes, sémiologie & collection d’observations cliniques [Internet]. Disponible sur:
http://irmcardiaque.com/index.php?title=Infiltrative
19. Rubinshtein R, Glockner JF, Feng D, Araoz PA, Kirsch J, Syed IS, et al. Comparison of Magnetic Resonance Imaging Versus Doppler Echocardiography for the Evaluation of Left Ventricular Diastolic Function in Patients With Cardiac
Amyloidosis. Am J Cardiol. 1 mars 2009;103(5):718 23. 20. Pozo E, Kanwar A, Deochand R, Castellano JM, Naib T,
Pazos-Lopez P, et al. Cardiac magnetic resonance
evaluation of left ventricular remodelling distribution in cardiac amyloidosis. Heart. 1 nov 2014;100(21):1688 95. 21. Feng D, Edwards WD, Oh JK, Chandrasekaran K, Grogan
M, Martinez MW, et al. Intracardiac Thrombosis and Embolism in Patients With Cardiac Amyloidosis. Circulation. 20 nov 2007;116(21):2420 6.
22. William C. Roberts, Bruce F. Waller. Cardiac amyloidosis causing cardiac dysfunction : Analysis of 54 necropsy patients. The American Journal of Cardiology. juill 1983;137 46.
23. Maceira AM, Joshi J, Prasad SK, Moon JC, Perugini E, Harding I, et al. Cardiovascular magnetic resonance in cardiac amyloidosis. Circulation. 18 janv
49 24. Fontana M, Chung R, Hawkins PN, Moon JC.
Cardiovascular magnetic resonance for amyloidosis. Heart Fail Rev. mars 2015;20(2):133 44.
25. Wang J, Kong X, Xu H, Zhou G, Chang D, Liu D, et al. Noninvasive diagnosis of cardiac amyloidosis by MRI and echochardiography. J Huazhong Univ Sci Technolog Med Sci. 2010;30:536 40.
26. Austin BA, Tang WHW, Rodriguez ER, Tan C, Flamm SD, Taylor DO, et al. Delayed Hyper-Enhancement Magnetic Resonance Imaging Provides Incremental Diagnostic and Prognostic Utility in Suspected Cardiac Amyloidosis. JACC Cardiovasc Imaging. déc 2009;2(12):1369 77.
27. Sloan KP, Bruce CJ, Oh JK, Rihal CS. Complications of echocardiography-guided endomyocardial biopsy. J Am Soc Echocardiogr Off Publ Am Soc Echocardiogr. mars 2009;22(3):324.e1 4.
28. Quarta CC, Kruger JL, Falk RH. Cardiac Amyloidosis. Circulation. 18 sept
2012;126(12):e178 82.
29. Dubrey SW. Amyloid heart disease: a brief review of treatment options. Postgrad Med J. 1 déc
2012;88(1046):700 5.
30. Fikrle M, Paleček T, Kuchynka P, Němeček E, Bauerová L, Straub J, et al. Cardiac amyloidosis: A comprehensive review. Cor Vasa. févr 2013;55(1):e60 75.
50 31. Rubinow A, Skimer M, Cohen AS. Digoxin Sensitivity in
alyloid cardiomyopathy. Circulation. 1981 Jun ;63 (6) : 1285-8.
32. Bouhour JB, Haddak M, Lefevre M. Risks of beta-blockers and calcium inhibitors in amyloid cardiopathy. Presse
Medicale Paris Fr 1983. 1986 May 24 ; 15 (21) : 981.
33. Sattianayagam PT, Gibbs SDJ, Pimey JH, Wechalekar AD, Lachman HJ, Whelan CJ, et al. Solid organ transplantation in AL amyloidosis. AMJ Transplant off J Am Soc Transplant surg. 2010 sep ; 10 (9) : 2124-31.
34. Sanchorawala V.High dose melphalan and autologous péripheral blood stem cell transplantation in AL amyloidosis. Hematol Oncol Clin North Am. 2014 Dec ;28 (6) : 1131-44. 35. Venner CP, Lane T, Foard D, Rannigan L, Gibbs SDJ, Pinney
J H, et al. Cyclophosphamide, bortezomib and
dexamethasone therapy in AL amyloidosis is associated with high clonal response rates and prolonged progression-free survival. Blood. 2012 May 10 ; 119 (19) : 4387.
36. Castano A, Drachman BM, Judge D, Maurer MS. Natural history and therapy of TTR-cardiac amyloidosis : emerging disease-modifying therapies from organ transplantation to stabilizer and silencer drugs. Heart Fail Rev. 2015 Mar ; 20 (2) : 163-78.
37. Maurer Ms, Schwartz JH, Grundapanemi B, Elliot PM,
Merlini G, Waddington-Cruz M et al. Tafamidis treatment for patients with transthyretin amyloid cardiomyopathy. N Engl J Med. 2018 13 ; 379 (11) : 1007-16.
38. Banypersad SM, Moon JC, Whelan C, Hawkins PN, Wechalekar AD. Updates in Cardiac Amyloidosis: A Review. J Am Heart Assoc. 23 avr
2012;1(2):e000364 e000364.
39. Selvanayagam JB, Hawkins PN, Paul B, Myerson SG, Neubauer S. Evaluation and Management of the
Cardiac Amyloidosis. J Am Coll Cardiol. nov 2007;50(22):2101 10.
40. Esplin BL, Gertz MA. Current Trends in Diagnosis and Management of Cardiac Amyloidosis. Curr Probl Cardiol. févr 2013;38(2):53 96.
51 41. Falk RH. Cardiac amyloidosis: a treatable disease, often
overlooked. Circulation. 30 août 2011;124(9):1079 85. 42. Austin BA, Tang WHW, Rodriguez ER, Tan C, Flamm SD,
Taylor DO, et al. Delayed Hyper-Enhancement Magnetic Resonance Imaging Provides Incremental Diagnostic and Prognostic Utility in Suspected Cardiac Amyloidosis. JACC Cardiovasc Imaging. déc 2009;2(12):1369 77.
43. Maceira AM, Prasad SK, Hawkins PN, Roughton M, Pennell DJ. Cardiovascular magnetic resonance and prognosis in cardiac amyloidosis. J Cardiovasc Magn Reson Off J Soc Cardiovasc Magn Reson. 2008;10:54. 44. Maceira AM, Joshi J, Prasad SK, Moon JC, Perugini E,
Harding I, et al. Cardiovascular magnetic resonance in cardiac amyloidosis. Circulation. 18 janv
2005;111(2):186 93.
45. Syed IS, Glockner JF, Feng D, Araoz PA, Martinez MW, Edwards WD, et al. Role of Cardiac Magnetic Resonance Imaging in the Detection of Cardiac Amyloidosis. JACC Cardiovasc Imaging. févr 2010;3(2):155 64.
46. Vogelsberg H, Mahrholdt H, Deluigi CC, Yilmaz A, Kispert EM, Greulich S, et al. Cardiovascular magnetic resonance in clinically suspected cardiac amyloidosis: noninvasive imaging compared to endomyocardial biopsy. J Am Coll Cardiol. 11 mars 2008;51(10):1022 30.
47. Dall’Armellina E, Piechnik SK, Ferreira VM, Si QL, Robson MD, Francis JM, et al. Cardiovascular magnetic resonance by non contrast T1-mapping allows
52 infarction. J Cardiovasc Magn Reson. 6 févr
2012;14(1):15.
48. Dass S, Suttie JJ, Piechnik SK, Ferreira VM, Holloway CJ, Banerjee R, et al. Myocardial tissue characterization using magnetic resonance noncontrast t1 mapping in
hypertrophic and dilated cardiomyopathy. Circ Cardiovasc Imaging. nov 2012;5(6):726 33. 49. Gertz MA, Comenzo R, Falk RH, Fermand JP,
Hazenberg BP, Hawkins PN, et al. Definition of organ involvement and treatment response in
immunoglobulin light chain amyloidosis (AL): a consensus opinion from the 10th International Symposium on Amyloid and Amyloidosis, Tours, France, 18-22 April 2004. Am J Hematol. août 2005;79(4):319 28.