HAL Id: inria-00404643
https://hal.inria.fr/inria-00404643
Submitted on 16 Jul 2009HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Analyse post-opératoire en stimulation cérébrale
profonde basée sur des images multimodales : mise en
place et validation des chaînes de recalage
Florent Lalys, Claire Haegelen, Alexandre Abadie, Omar El Ganaoui, Pierre
Jannin
To cite this version:
Florent Lalys, Claire Haegelen, Alexandre Abadie, Omar El Ganaoui, Pierre Jannin. Analyse post-opératoire en stimulation cérébrale profonde basée sur des images multimodales : mise en place et validation des chaînes de recalage. ORASIS’09 - Congrès des jeunes chercheurs en vision par ordina-teur, 2009, Trégastel, France, France. �inria-00404643�
Analyse post-opératoire en stimulation cérébrale profonde basée sur des images
multimodales : mise en place et validation des chaînes de recalage
Post-operative analysis in deep brain stimulation based on multimodal images:
preliminary steps and validation of the registration workflow
Florent Lalys1,2,3 , Claire Haegelen1,2,3,4 , Alexandre Abadie1,2,3 , Omar El Ganaoui1,2,3 , Pierre Jannin1,2,3
1 INSERM, U746, Faculty of Medicine CS 34317, F-35043 Rennes, France
2 INRIA, VisAGeS Unit/Project, F-35042 Rennes, France
3 University of Rennes I, CNRS, UMR 6074, IRISA, F-35042 Rennes, France
4 Department of Neurosurgery, Pontchaillou University Hospital, F-35043 Rennes, France
Résumé
La stimulation cérébrale profonde (SCP) est une technique neurochirurgicale utilisée pour traiter les troubles moteurs, dont la maladie de Parkinson. Le traitement consiste à implanter au cœur du cerveau, dans les noyaux gris centraux, des électrodes qui diminueront de façon spectaculaire les tremblements par l’intermédiaire d’une stimulation électrique haute-fréquence. Cette étude préliminaire décrit les différentes étapes de la construction d’un atlas numérique anatomo-clinique pour une évaluation post-opératoire de la SCP, dans un cadre d’outil d’aide à la compréhension. La première version inclut 25 patients, qui furent reliés à un code couleur représentant l'amélioration clinique globale du patient (score UPDRS (Unified Parkinson’s disease rating Scale) pour évaluer l'évolution de la maladie de Parkinson). La projection de tous les plots stimulés sur cet atlas a permis au neurochirurgien d’évaluer qualitativement les précédentes implantations.
Mots Clef
Stimulation cérébrale profonde, neurochirurgie, recalage, validation, contrôle post-opératoire.
Abstract
Movement disorders in Parkinson disease patients may require functional surgery, when medical therapy isn’t effective. In Deep Brain Stimulation electrodes are implanted within the brain to stimulate deep structures such as SubThalamic Nucleus. This paper describes successive steps for constructing a digital atlas gathering patient’s location of electrodes and contacts for post operative assessment. Visualisation software was developed for displaying into the atlas images the stimulated contacts represented as cylinders with a colour code related to the improvement of the UPDRS (Unified Parkinson’s disease rating Scale) score.
Keywords
Deep brain stimulation, neurosurgery, registration, Post-operative control, functional, targeting accuracy.
1 Introduction
La stimulation cérébrale profonde (SCP) est utilisée depuis plusieurs années pour traiter les troubles moteurs principalement, dont la maladie de Parkinson [1]. Le traitement neurochirurgical consiste à implanter au cœur du cerveau, dans les noyaux gris centraux, des électrodes qui seront stimulées électriquement et qui diminueront de façon spectaculaire les tremblements. La SCP est maintenant utilisée dans le monde entier, ainsi que dans une vingtaine de centres hospitaliers en France.
Contexte scientifique
Bien que la cause des pathologies liées aux troubles moteurs soit à priori bien identifiée, et que les structures cérébrales à l'origine des symptômes soient connues, au sein même des structures de multiples questions se posent. De nombreuses publications médicales [2, 3] ont montré qu'il existait des zones dont la stimulation augmentait la réussite de la chirurgie tout en diminuant les effets secondaires. Malheureusement, l'emplacement optimal de ces zones est encore assez mal connu et le fonctionnement interne de ces structures est toujours difficilement explicable.
Procédure d'implantation
L'intervention chirurgicale utilise la technique stéréotaxique. La stéréotaxie est une méthode de repérage radiologique qui permet de définir la position d'une structure cérébrale grâce à un système de coordonnées dans l'espace. Elle utilise un cadre, directement fixé sur le crâne avant les phases d'imagerie et qui reste positionné sur le patient pendant l'intervention. En phase pré-opératoire un scanner, une Imagerie par Résonance Magnétique (IRM) T1 complète du cerveau et 35 coupes d'IRM T2 sont obtenus. Ces trois modalités sont ensuite recalées entre elles, ps le neurochirurgien choisit la cible en s’appuyant sur toutes ces images (Noyau Sous Thalamique : NST, ou noyau Ventral Intermédiaire : VIM, ou Globus Palidus Intern : GPI selon la maladie), dont les coordonnées sont automatiquement mises dans le repère du cadre de stéréotaxie. Dans une phase chirurgicale, le praticien implante l'électrode à l'endroit
choisi, le patient étant alors sous anesthésie locale. Cela permet à un neurologue de tester les effets cliniques de l'implantation pendant l’opération, et donc éventuellement d'ajuster l'électrode pour obtenir les meilleurs effets cliniques avec le moins d'effets secondaires. Dans cette phase, le neurologue peut changer la fréquence de stimulation, le voltage et la position. Un neurostimulateur relié aux électrodes est ensuite installé sous la peau et permet de changer les paramètres de stimulation. Enfin, dans une phase post-opératoire (du lendemain à 3 mois après l'intervention), un scanner de contrôle est effectué pour vérifier d'éventuelles hémorragies ou lésions.
État de l'art
L'équipe de B. Dawant aux Etats-Unis a développé un logiciel de guidage intra-opératoire de placement des électrodes [4,5]. Elle s'est également intéressée aux paramètres optimaux de réglages (voltage, intensité, fréquence). L'équipe de T.Peters au Canada a également créée un logiciel utilisable en salle d'opération pour améliorer le placement [6,7], tout en enregistrant les données électrophysiologiques du patient pour créer une base de données. Ces deux équipes ne tiennent pas compte des données cliniques des patients en phase post-opératoire.
Plusieurs équipes se sont ensuite intéressées aux problèmes de la SCP, comme le recalage [8] des images, le rayonnement électromagnétique des plots sur le ciblage des électrodes [9,10] ou le type d'atlas à utiliser [11], qui introduisent tous un biais à corriger. La localisation post-opératoire des plots a aussi été source de publications [12-14], où des algorithmes de recherche automatique des plots ont été créés pour fournir des chaînes de traitement automatisées. De même, d'autres équipes [15,16] ont repris les concepts de base et introduit de nouvelles perspectives, notamment concernant les atlas probabilistes pour la SCP pour une analyse rétrospective des implantations. L'objectif de ce papier est de créer un atlas comprenant les coordonnées des plots de 25 patients recalées sur ce repère commun couplées avec des données cliniques de scores moteurs.
2 Matériels et méthodes
Données
Notre population d’étude est constituée de 25 patients (14 femmes, 11 hommes, moyenne d'âge : 56 +/- 6 ans) ayant tous subi une intervention chirurgicale dans le cadre de la SCP ces deux dernières années. Les images que nous possédons pour chaque patient sont le scanner post et pré-opératoire, et l'IRM pré-opératoire. Pour l'IRM, une séquence complète T1 est effectuée, de même que 35 coupes T2 incluant les structures profondes (pour une meilleure visualisation), acquises avec une IRM 3T de chez Philips Medical Systems (voxels : 1mm x 1mm x 1mm). Les scanners (0.4mm x 0.4mm x 0.7mm) sont eux réalisés avec une machine GE Healthcare VCT 64.
Pré-traitement
Les 3 images subissent tout d'abord une phase de débruitage. Dans les méthodes classiques (filtre sélectif, Median, de Wiener), la valeur débruitée est calculée grâce à la moyenne pondérée par la distance avec tous les
pixels d'un voisinage local
.
Pour ne pas dégrader lesfines structures, ce moyennage doit être adapté dans le but de garder les hautes fréquences. Nous utilisons ici l'algorithme NL-Means (Non-Local Means) [17] qui utilise comme fenêtre de voisinage l'image entière et qui se base sur les pixels de l'image qui ont une couleur proche.
Ensuite, l'IRM est soumise à une correction d'inhomogénéités de champs. Un système d'imagerie par résonance magnétique idéal devrait avoir un champ magnétique uniforme et des gradients orthogonaux parfaitement linéaires. En pratique, cela n'est pas le cas et les inhomogénéités de champs sont responsables de variations du signal en fonction des différentes coupes et des différentes régions. Elles engendrent des modifications de niveaux de gris (appelées aussi artefacts) qui faussent l'analyse qui sera faite derrière sur l'image, comme par exemple le recalage. Nous avons utilisé une méthode basée sur l'image seule [16], à comparer avec les méthodes basées imageur qui modélisent complètement le signal de l'IRM avant chaque acquisition de patient.
Détection des plots
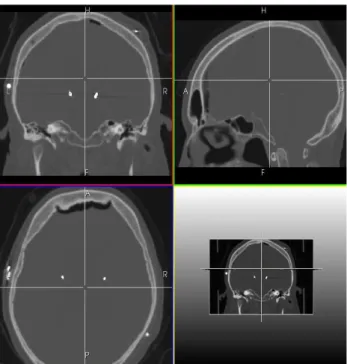
En post-opératoire, la phase primordiale est la localisation précise des électrodes sur l'imagerie (Scanner ou IRM). Certaines équipes [12] se basent sur un placement manuel du rayonnement des plots, et calculent ensuite automatiquement et précisément les coordonnées. D'autres [13] fournissent une méthode de localisation manuelle, basée sur l'utilisation d'un atlas histologique qui permet l'identification des structures. Après localisation du centre des plots, la plupart des équipes les modélisent par un point ou une sphère. La première équipe à avoir véritablement considérée la géométrie complète d'un plot, en le modélisant comme un cylindre, est [14] qui accorde des poids selon que celui-ci fasse partie partiellement ou complètement de la structure ciblée. Sur le scanner post-opératoire (donc après l'implantation) les électrodes sont bien visibles, et de petits artefacts apparaissent au centre de chaque plot (fig 1).
Fig 1 : Exemple de scanner post-opératoire d’un
patient.
Il a été prouvé dans des études [19] sur l'électromagnétisme que ces artefacts correspondent au milieu des plots. Pour les détecter un algorithme de recherche automatique a été développé. Cet algorithme commence par un seuillage du scanner, puis une recherche de maximum est lancée sur l'image avec des contraintes de voisinage. Tous les plots ne sont pas visibles car la résolution du scanner (donc le nombre de coupes) ne permet pas de tous les détecter. Il suffit alors de réaliser une extrapolation des plots trouvés (deux, trois, ou quatre) connaissant la géométrie des électrodes pour évaluer la position des plots restants. Avec la méthode développée les plots sont détectés selon un point. Connaissant la direction d'implantation de l'électrode (récupérée avec l'algorithme) et la géométrie il est possible de les représenter par des cylindres.
Recalage
La projection des coordonnées des plots sur ces atlas nécessite une phase de recalage, car les coordonnées des plots sont calculées sur le scanner post-opératoire. Nous avons développé une chaîne de recalage adaptée à la SCP [8], et conforme aux résultats publiés dans la littérature. Il est notamment préconisé d’utiliser une méthode de recalage dite “locale”, c'est-à-dire qu'une boite englobante est créée et appliquée à l'image pour s'intéresser seulement aux structures cérébrales profondes importantes. Voici notre chaîne : dans un premier temps, un recalage rigide (algorithme : Newuoa [20], fonction de coût : Information mutuelle, interpolation : Spline3) est réalisé entre le scanner post-opératoire et le scanner pré-opératoire puis entre le scanner pré-opératoire et l'IRM du patient. Ensuite, un recalage affine (algorithme : Newuoa, fonction de coût : Information
mutuelle normalisée, interpolation : Spline3) est fait entre l'IRM du patient et un atlas (Colin27 [21]). Sur le résultat on garde une boite qui englobe les structures cérébrales profondes. Ensuite, ce même recalage affine est réalisé au niveau local pour corriger la déformation. Enfin, un recalage non-linéaire (algorithme : Demons
(www.itk.org), type de Demons : SymmetricForces) permet de prendre en compte les différences d'anatomie entre les patients, et termine notre chaîne de recalage. Ces étapes sont présentées sur la figure 2.
Après le recalage, la dernière étape a consisté à mettre les coordonnées des plots dans le repère dit de Talairach, basé sur la définition des commissures antérieure et postérieure (CA-CP), pour les stocker dans la base de données. Un placement des deux commissures fut donc nécessaire, puis un changement de coordonnées 3D.
Fig 2 :chaîne de recalage
Validation du recalage
Pour pouvoir comparer efficacement les localisations des stimulations entre patient, il est nécessaire de valider la précision de la chaîne de recalage. De nombreuses études ont déjà démontrées la qualité des algorithmes de recalage linéaire. Par contre, cela n’est pas aussi clair dans le cas des algorithmes de recalage non-linéaire. Il est en effet difficile de juger la qualité d'un recalage non linéaire, du fait du manque de références fiables. Pour cette étude, nous avons choisi de nous appuyer sur deux grandes classes de validation : l’une basée sur le calcul de différences mathématiques, l’autre sur l'estimation de différences basée experts (calcul de distance euclidienne entre un point de l'atlas et son équivalent sur l'IRM patient tous deux définis par un expert anatomiste). Pour la première, il a été choisi de comparer deux images grâce à la corrélation et l'information mutuelle. Même si cette approche est purement mathématique, cela donne une première idée des paramètres à conserver.
La deuxième se base sur le positionnement de points d'intérêt par un expert neurochirurgien et anatomiste sur les deux images. En choisissant la même structure pour les deux images il est alors possible de calculer la distance euclidienne entre les deux points (car les deux images sont définies dans le même repère), et donc une approximation de l'erreur de recalage. Bien entendu, plus
il y aura de points définis plus le résultat se rapprochera de la réalité. L’expert a sélectionné 6 structures identifiables sur chaque IRM de patients.
En SCP, la source d'erreur majeure est le placement incorrect des noyaux gris centraux dans le processus de déformation. C'est pourquoi il est nécessaire de passer par une phase de recalage dite “locale” pour améliorer le recalage de ces structures. Une première étude de validation a montré l'apport de cette méthode.
De nombreux algorithmes existent dans le calcul d'un recalage non-linéaire. Nous avons choisi de tester deux des plus utilisés : l'algorithme des Démons difféomorphiques et l'algorithme des Démons de type SymmetricForces. De plus, il peut être intéressant de comparer l'apport d'un atlas dit de “super-résolution” par rapport à un atlas traditionnel. C'est pourquoi l'atlas original Colin27 (voxels : 1mm x 1mm x 1mm) et le super-résolution (0.5mm x 0.5mm x 0.5mm) ont tout les deux été testés, de même que les deux algorithmes de recalage non-linéaire dans une deuxième étude.
Comme évoqué auparavant le recalage non-linéaire peut être source de quelques interrogations. Il peut alors être judicieux de comparer l'apport de ce type de recalage dans le cadre d'une étude multi-patients avec un atlas. Le tableau 4.3 montre la moyenne sur dix patients de la distance euclidienne entre l'IRM et l'atlas, et cela pour 6 points d'intérêt définis par l’expert. Le recalage effectué est premièrement seulement linéaire, puis le non-linéaire est ensuite ajouté.
La dernière étude s'est tenue à comparer l'atlas utilisé, en comparant le Colin27 1.5 Tesla super-résolution avec un nouveau atlas IRM 3 Tesla que nous avons développé. Cet atlas est la somme de 15 IRM du même sujet qui ont été recalés et moyennés. La chaîne de recalage entière (Fig 3) est lancée pour 15 patients, et cela avec les deux atlas. La méthode basée expert est utilisée pour la validation, avec les mêmes points précédemment définis. Score clinique
Finalement, nous avons assigné à chaque patient un code couleur correspondant à l'amélioration clinique globale du patient après l'opération. Pour quantifier cette évolution nous avons pris les scores UPDRS III (Unified Parkinson’s Disease Rating Scale) [22] en phase pré-opératoire et en phase post-pré-opératoire. Les scores UPDRS III en pré-opératoire étaient de 29.3 +/- 3.1 et en post-opératoire, sans médicaments en période de stimulation de 13.1 +/- 4.1. Nous avons pris en compte le pourcentage d'amélioration, de 0% à 100%, puis nous avons séparé 5 clusters à partir de ces pourcentages. Tous les plots des patients stimulés furent enfin affichés sur l'atlas avec le code couleur correspondant.
3 Résultats
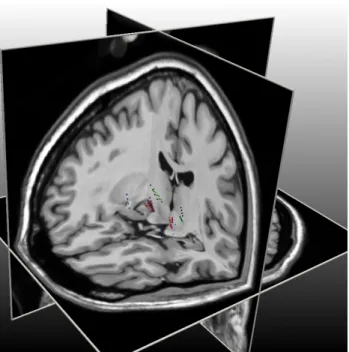
L'algorithme de détection des plots a été lancé sur les 25 scanners post-opératoires des patients. Tous les plots ont été détectés avec succès. Un exemple d'affichage des plots
(rouge), de l'électrode (vert) et du crâne pour un patient implanté bilatéralement est montré sur la fig 3 :
Fig 3 : Extraction du crâne, des électrodes et des plots
sur un patient implanté bilatéralement.
Tab 1 - Moyenne de l'information mutuelle et de la corrélation entre l'IRM d'un patient (10 cas) et l'atlas,
après recalage, pour deux méthodes (méthode n°1 : recalage local, méthode n°2 : recalage global). Il peut être tiré du tableau 1 que le recalage local donne de meilleurs résultats que le recalage global, avec un écart significatif dans le calcul de l'information mutuelle. La méthode “locale” est plus précise et sera gardée.
Tab 2 - Moyenne de l'information mutuelle et de la corrélation entre l'IRM d'un patient (10 cas) et l'atlas,
après recalage, pour 2 algorithmes de recalage non-linéaire différents.
D’après le tableau 2, l'algorithme SymmetricForces est légèrement meilleur que Diffeomorphic, nous garderons donc le premier dans la chaîne de recalage.
Tab 3 - Moyenne de la distance euclidienne entre l'IRM d'un patient et l'atlas (10 patients) pour six points d'intérêt, avec premièrement une méthode de recalage
linéaire, puis en rajoutant un recalage non-linéaire.
Point CA CP Average
Linear 1,26 +/-0.25 1,29 +/-0.29 1,51 +/-0.42 2,21 +/-0.36 1,6 +/-0.23 2,1 +/-0.35 1,66 +/-0.31
Linear+Non-linear 1,17 +/-0.26 0,71 +/-0.18 1,03 +/-0.25 1,96 +/-0.26 1,89 +/-0.22 1,9 +/-0.36 1,44 +/-0.25 Iter of
Sylvius Chiasma optique Mamillary bodies Tractus optici
Mutual information Correlation Difféomorphic SymetricForces Difféomorphic SymetricForces Average on 10 patients 0.96 +/- 0.13 1.084 +/- 0.08 88,43 +/- 0.12% 89,44 +/- 0.12%
Mutual information Correlation Average on 10 patients 0.811 +/- 0.11 0.68 +/- 0.16 82.19 +/- 0.08% 80.46 +/- 0.08%
Le tableau 3 nous renseigne sur l'erreur de recalage de l'IRM du patient sur l'atlas. Le recalage non-linéaire permet un affinement des déformations, ce qui parait logique car entre deux patients il existe une différence d'anatomie non négligeable, y compris dans ces structures. Avec une erreur moyenne de l'ordre de 1.45mm, cela permet d'obtenir une chaîne de recalage précise et robuste. Les résultats sont cohérents avec la littérature du domaine qui trouve des erreurs de l'ordre de 1 ou 2mm. De plus les trois structures (NST, GPI, VIM) qui nous intéressent se situent aux alentours de CA-CP, là où le recalage est le meilleur (de l’ordre de 0.9mm d’erreur). 1 2 0 0.5 1 1.5 2 G lo ba l r eg is tra tio n er ro r ( m m ) Registration workflow on Colin27 Template Registration workflow on our Template
Fig 4 – Erreur moyenne de recalage sur une étude sur
15 patients, avec le Colin27 (à gauche) et notre atlas (à droite).
D'après la figure 4 notre atlas donne de meilleurs résultats que le Colin27 (0.78 +/- 0.19mm d'erreur de placement pour le premier contre 1.54 +/- 0.33mm pour le second). En effet, les noyaux gris centraux du cerveau sont de très petites tailles, et un recalage robuste nécessite une très bonne définition des structures que nous n'avons pas réellement avec une IRM 1.5T. La différence de résultats du recalage sur le Colin27 avec le Tab 3 (1.54mm contre 1.44) vient du nombre et du choix des patients pour les deux études.
Grâce à la détection automatique des plots et à leurs projections sur un atlas, il est maintenant possible d'afficher les plots des patients dans un même repère. La figure 5 ci-dessous montre les plots recalés sur l'atlas de patients implantés dans différentes structures.
L'affichage des clusters de plots a montré que la région stimulée qui donnait les meilleurs résultats cliniques était la région dorsale du NST. Cela rejoint les autres papiers sur le sujet [4, 5, 6, 7]. Malgré tout, d'autres sites de plots aux alentours de la partie dorsale apparaissaient avec de bons scores cliniques.
Fig 5- Affichage 3D des plots de plusieurs patients sur
l'atlas Colin27 (teinte bleue : cible GPI, teinte rouge : cible NST, teinte verte : cible VIM). Les plots sont
représentés ici par des sphères.
4 Discussion
Détection des plots
Bien que cette étape ait débouché sur un système automatisé robuste, il subsiste quelques légers biais à prendre en considération. Tout d’abord, les artefacts apparaissant sur le scanner sont liés à la résolution spatiale du volume, qui engendre une légère perte d’information irrémédiable. Comme le point est calculé selon le centre des artefacts, la détection est alors soumise à la taille de chaque voxel. Plus les voxels seront petits, meilleure sera la localisation. Un plot ayant une hauteur théorique de 1.5mm, le scanner post-opératoire de résolution 0.4x0.4x0.7mm est suffisamment précis pour affirmer que la segmentation des plots est juste. De même, l’approximation qui considère que ces artefacts sont homogènes dans les trois dimensions rajoute un très léger biais. La validation de la méthode est en partie directement comprise dans la procédure, car l’algorithme lui-même trouve les plots en fonction de la position relative de l’électrode. La détection des plots visibles se base sur les artefacts, ce qui peut être validée directement visuellement. Ensuite, la phase d’extrapolation qui suit la détection rejette les points n’appartenant pas à l’électrode, ce qui rend la méthode sûr. Si jamais une recherche automatique ne renvoie pas de résultats, cela voudra dire que la détection des plots visibles n’est pas bonne et qu’une phase de placement manuelle est nécessaire. Cette hypothèse ne s’est pas encore produite.
Recalage
Nous avons présenté dans cette étude une chaîne de traitement qui a priori était la plus adaptée à nos besoins. De toutes les publications qui évoquent le recalage et les méthodes utilisées, aucune ne peut affirmer la supériorité d’une méthode, ni la précision exacte d’un recalage particulier qui permettrait une étude totalement juste des phénomènes. L’erreur moyenne de recalage, pour le cas du non-linéaire inter-sujet, varie dans toutes les publications entre 1mm et 2mm, mais ne descend jamais en dessous de 1mm. Dans le contexte de la SCP, la précision de cette étape est primordiale, c'est pourquoi nous avons consacré une partie importante de cette étude à la validation des méthodes et des algorithmes. En se basant sur l’état de l’art et en testant de multiples solutions nous avons finalement choisi une méthode semblant être la meilleure possible et donnant une précision inférieure au millimètre.
Les deux approches de validation utilisées dans cette étude (approche mathématique et approche basée expert) sont assez complémentaires mais loin d’être complètes. Pour le cas de la validation mathématique, l’information mutuelle est utilisée pour comparer les deux images. Or, le recalage entre ces deux volumes est basé sur l’information mutuelle, il est donc a priori logique de trouver de bons résultats avec cet outil statistique. La corrélation, deuxième outil utilisé, semble plus apte à répondre à la question de la validation et parait donner des conclusions plus rigoureuses. Cette approche doit donc fournir des idées mais ne doit pas être utilisée seule dans une validation de recalage.
Pour le cas de la validation basée expert, le biais se situe dans le placement correct des points d'intérêt. En effet, comme dans tout calcul statistique, l’approche nécessiterait de faire les calculs avec plusieurs experts pour prendre en compte une variabilité inter-observateur. Les études ont montré qu’il existait une forte variabilité inter-experts lorsqu’il s’agissait de placer des points particuliers sur une image. En revanche, les variabilités intra-experts dans un contexte mono-modal [23] sont assez faibles, ce qui justifie de ne demander à un neurochirurgien de ne définir qu’une seule fois les points. La cohérence de ses placements diminue fortement ce biais qui finalement devient quasiment nul. Cette validation est la vérité clinique, celle qui doit être la meilleure possible, c’est pourquoi nous avons attaché beaucoup d’importance aux résultats de cette approche. Néanmoins, plus de points apporteraient une puissance statistique supérieure aux résultats.
Nous avons vu que l'impact de l’atlas sur la qualité des résultats n'est pas du tout négligeable, ce qui montre l'importance d'avoir un atlas de référence optimal. L’atlas que nous avons construit n’a encore jamais été utilisé dans le cadre de la SCP mais montre son utilité et sa précision. Il ouvre des perspectives dans ce domaine puisque l'erreur moyenne de recalage descend en dessous de 1mm. Cette partie de notre procédure peut certainement être encore améliorée, avec l'aide de
nouvelles techniques d'imageries et de traitements d'images. Étant donné que le recalage est basé sur l'intensité des voxels : plus l'atlas sera précis, meilleur sera le recalage des structures.
Du fait des différents biais énoncés, les projections finales des plots sur l’atlas sont à prendre avec prudence. Cet outil de visualisation doit être un des renseignements, non exhaustif, de la phase d’analyse du neurochirurgien. Cela implique aussi que l’analyse statistique, puisqu’elle est source d’un biais significatif, doit être accomplie sur un maximum de données pour que les résultats réels tendent vers la réalité. Notre actuelle base de 25 patients permettra certes d’arriver aux premiers résultats mais ceux-ci devront être confirmés avec l'accumulation des données.
La localisation des plots stimulés au sein du NST sur l'atlas montre une répartition assez hétérogène. Des plots sont même en dehors du NST. Ceci peut être expliqué par le fait que les champs électro-magnétiques de la stimulation se répartissent autour du plot et peuvent atteindre des structures qui ne sont pas forcément en contact direct avec ce dernier.
5 Conclusion
Cette étude a permis de créer un premier outil complètement automatisé utilisable en phase post-opératoire pour la compréhension et l’évaluation des chirurgies passées. L’approche originale de la chaîne de recalage, l’utilisation d’un atlas jamais utilisé auparavant dans le cadre de la SCP et l'intégration dans la chaîne des données cliniques (UPDRS III) font de cette étude une première version d'un outil d'évaluation assisté par ordinateur. Il subsiste néanmoins des étapes dans cette chaîne de traitement qui pourront être progressivement optimisées, tel que le recalage non-linéaire, ou la localisation automatique des plots. Le point faible de notre analyse est d’ailleurs le recalage non-linéaire, qui même avec les nouvelles technologies et les nouveaux algorithmes, reste délicat. L’impact de notre atlas a en revanche montré l’amélioration du recalage des structures cérébrales profondes.
L’outil de visualisation créé pourra, par la suite, devenir un outil d’aide à la décision, en augmentant d’une part le nombre de patients pour se rapprocher d’une statistique réaliste, et d’autre part en corrélant des données cliniques variées (scores moteurs, neuro-psychologiques, cognitifs) avec les coordonnées anatomiques des plots. De nombreux outils de fouille de données pourront être utilisés dans ce but et cela permettra d’en apprendre davantage sur les effets secondaires et sur le placement optimal des plots au sein des structures.
Une version préliminaire de cette étude a été acceptée à la conférence SPIE Medical Imaging (Février 2009). Les auteurs voudraient aussi remercier la société Medtronic France pour leur soutien, ainsi que Nicolas Wiesst-Daesslé pour sa contribution.
Bibliographie
[1] Lang AE, Lozano AM, “Parkinson’s Disease”, The New England Journal of Medicine, 339(15), 1044-1053, 1998.
[2] The Deep-Brain Stimulation for Parkinson’s Disease Study Group, “Deep-Brain Stimulation of the Subthalamic Nucleus or the Pars Interna of the Globus Pallidus in Parkinson’s Disease, The New England Journal of Medicine, 345(13), 956-963, 2001.
[3] Vayssière N, Vander Gaag N, Cif L, Hemm S, Verdier R, Frerebeau P, Courbes P, “Deep brain stimulation for dystonia confirms a somatotopic organization in the Globus Pallidus Internus”, J Neurosurg, 101(2), 181-188, 2004.
[4] D’Haese PF, Cetinkaya E, Konrad PE, Kao C, Dawant BM, “Computer-aided placement of deep brain stimulators: From planning to intraoperative”, IEEE TMI, 24(11), 1469-1478, 2005.
[5] Dawant B, D’Haese P-F, Pallavaram S, Li R, Yu H, Spooner J, Davis T, Kao C, Konrad P, “The VU- DBS project : integrated and computer-assisted planning, intra-operative placement, and post-operative programming of deep-brain stimulators”, SPIE Medical Imaging, San Diego, CA, 2007.
[6] Guo T, Parrent AG, Peters TM, ‘Surgical targeting accuracy analysis of six methods for subthalamic nucleus deep brain stimulation”, Computer Aided Surgery, 12(6), 325-334, 2007.
[7] Guo T, Finnis KW, Parrent AG, Peters TM, “Development and Application of Functionnal Databases for Planning Deep-Brain Neurosurgical Procedures”, MICCAI, 3749, 835-842, 2005.
[8] Sanchez C Javier, “A Cross Validation Study of Deep Brain Stimulation Targeting : From Experts to atlas-Based, Segmentation-Based and Automatic Registration”, IEEE TMI, 25(11), 1440-1450, 2006. [9] Lemaire JJ, Coste J, Ouchchane L, Caire F, Nuti C,
Derost P, Cristini V, Gabrillargues J, Hemm S, Durif F, Chazal J, “Brain mapping in stereotactic surgery: A brief overview from the probabilistic targeting to the patient-based anatomic mapping”, NeuroImage, 37, S109-S115, 2007.
[10] Guo T, Finnis KW, Deoni SCL, Parrent AG, Peters TM, “Comparison of Different Targeting Methods for Subthalamic Nucleus Deep Brain Stimulation”, MICCAI, 4190, 768-775, 2006.
[11] Yelnik J, Bardinet E, Dormont D, Malandain G, Ourselin S, Tandé D, Karachi C, Ayache N, Cornu P, Agid Yves, “A three-dimensional, histological and deformabe atlas of the human basal ganglia. I. Atlas
construction based on immunohistochemical and MRI data”, NeuroImage, 37, 618-638, 2007.
[12] Pollo C, Vingerhoets F, Pralong E, Ghika J, Maeder P, Meuli R, Thiran J-P, Villemure J-G ,”Localization of electrodes in the subthalamic nucleus on magnetic resonance imaging, J Neurosurg”, 106, 36-44, 2007 [13] Videen TO, Campbell MC, Tabbal SD, Karimi M,
Hershey T, Perlmutter JS, “Validation of a fiducial-based atlas localization method for deep brain stimulation contacts in the area of the subthalamic nucleus”, J of Neuroscience methods, 168, 275-281, 2008.
[14] Hemm S, Caire F, Coste J, Vassal F, Nuti C, Derost P, Ouchchane L, Sarry L, Durif F, Lemaire JJ, “Post-operative control in deep brain stimulation of the subthalamic region, the contact membership concept”, International Journal of Computer Assisted Radiology and Surgery, 3(1-2), 69-77, 2008.
[15] Voges J, Volkmann J, Albert N, Lehrke R, Koulousakis A, Freund HJ, Sturm V, “Bilateral high-frequency stimulation in the subthalamic nucleus for the treatment of Parkinson disease: correlation of therapeutic effect with anatomical position”, J Neurosurg, 96(2), 269-279, 2002.
[16] Yelnik J, Damier P, Demeret S, Gervais D, Bardinet E, Bejjani BP, et al, “Localization of stimulating electrodes in patients with Parkinson disease by using a three-dimensional atlas-magnetic resonance imaging coregistration method”, J Neurosurg, 99, 89-99, 2003. [17] Coupe P, Yger P, Prima S, Hellier P, Kervrann C,
Barillot C, “An Optimized Blockwise Non Local Means Denoising Filter for 3D Magnetic Resonance Images”, IEEE TMI, 24(4), 425-441,2008.
[18] J Milles, YM Zhu, G Gimenez, CRG Guttman, “Correction des inhomogénéités d'intensité en IRM”, Conférences F. Lhermitte - 12e Rendez-Vous de l'ARSEP, Paris, France, 16-17, 2002.
[19] Pollo C, Villemure JG, Vingerhoets F, Ghika J, Maeder P, Meuli R, “Magnetic resonance artefact induced by the electrode activa 3389: an in vitro and in vivo study”, Acta Neurochirurgica, 146(2), 161-164, 2004.
[20] Wiest-Daesslé N, Yger P, Prima S, Barillot C, “ Evaluation of a new optimization algorithm for rigid registration of MRI data”, SPIE Medical Imaging, San Diego, CA, 2007.
[21] Aubert-Broche B, Evans AC, Collins L, “A new improved version of the realistic digital brain phantom”, NeuroImage, 32, 138-145, 2006.
[22] Fahn S et al, “Unified Parkinson’s Disease Rating Scale”, Recent developments in Parkinson’s Disease, 2, 153-163, 1987.
[23] Castro FJS, Pollo C, Maeder R, Cuadra MB, Cuisenaire O, Villemure JG, Thiran JP, “Cross validation of experts versus registration methods for target localization in Deep Brain Stimulation”, MICCAI, 3749, 417-424, 2005.