HAL Id: hal-02605061
https://hal.inrae.fr/hal-02605061
Submitted on 16 May 2020
HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Les microhabitats des arbres : lien avec la biodiversité
de trois groupes taxonomiques
Solène Du Puy
To cite this version:
Solène Du Puy. Les microhabitats des arbres : lien avec la biodiversité de trois groupes taxonomiques. Sciences de l’environnement. 2016. �hal-02605061�
Rapport de stage 2
ème
année – M2-IEGB
2 mars – 30 aout 2016
Du PUY Solène
Les microhabitats des arbres : lien avec la
biodiversité de trois groupes taxonomiques
IRSTEA
Domaine des Barres
45290 Nogent sur Vernisson
Paillet Yoan
Ingénieur de recherche
Association des étudiants du Master IEGB M a s t e r
B i o d i v e r s i t é É c o l o g i e É v o l u t i o n
Parcours Ingénierie en Ecologie et en Gestion de la Biodiversité
1 INTRODUCTION ... 1
1.1 CONTEXTE DE L’ETUDE ... 1
1.2 ETAT DE L’ART ... 2
1.2.1 Indicateurs écologiques : outil d’évaluation de la biodiversité ... 2
1.2.2 Validation scientifique d’un indicateur écologique ... 3
1.2.3 Cas des microhabitats des arbres ... 3
1.3 OBJECTIFS DE L’ETUDE, PROBLEMATIQUE ET HYPOTHESES ... 4
1.3.1 Objectifs ... 4
1.3.2 Problématique ... 5
1.3.3 Hypothèses générales ... 5
2 MATERIELS ET METHODES ... 6
2.1 ECHANTILLONNAGE ... 6
2.1.1 Sites d’étude et échantillonnage ... 6
2.1.2 Inventaire des variables abiotiques ... 7
2.1.3 Inventaires des trois groupes taxonomiques ... 7
2.2 METHODES D’ANALYSES STATISTIQUES... 8
2.2.1 Descripteurs de biodiversité ... 8
2.2.2 Indices des microhabitats et variables de contextualisation ... 9
2.2.3 Exploration des données ... 9
2.2.4 Choix et élaboration de la modélisation ... 10
2.2.5 Sélection des modèles ... 10
3 RESULTATS ... 11
3.1 STRUCTURE GENERALE DES DONNEES BIODIVERSITE ... 11
3.2 LES GROUPES TAXONOMIQUES ... 11
3.3 REPONSE DES ABONDANCES... 11
3.3.1 Les indices de communauté ... 11
3.3.2 Les groupes écologiques ou patrimoniaux ... 12
3.4 REPONSE DES RICHESSES SPECIFIQUES ... 12
3.4.1 Les indices de communauté ... 12
3.5 LES ESPECES ... 14
4 DISCUSSION ... 16 4.1 LES INDICES GENERAUX DE MICROHABITATS : MEILLEURS PREDICTEURS DE BIODIVERSITE DES OISEAUX ET DES CHIROPTERES ... 16
4.2 LES COLEOPTERES SAPROXYLIQUES REPONDENT PEU AUX MICROHABITATS ... 17
4.3 INFLUENCE DES VARIABLES DE CONTEXTUALISATION ... 18
4.4 LES INDICES INDIVIDUELS DE MICROHABITATS ONT PEU D’INFLUENCE AU NIVEAU DES ESPECES ET CELLE -LA EST SOUVENT NEGATIVE ... 19 5 CONCLUSION ... 19
1
Remerciements
Cette page me semble déjà trop courte pour remercier toutes les personnes qui ont, de près ou de loin, participé à la réussite de mon stage, mais je vais faire au mieux pour que tout le monde le soit.
Un grand merci à Christian Génisty pour son accueil au sein des locaux d’IRSTEA Nogent sur Vernisson où j’ai vraiment pris plaisir à travailler et dont le bénéfice est immense sur bien des points.
Une profonde reconnaissance envers mon maître de stage, Yoan Paillet, qui, dès les premiers contacts m’a accordé sa confiance, alors même que je débutais mon stage de master 1, en me proposant cette expérience à IRSTEA pour le master 2. Merci de son soutien tant moral, ami-cal que professionnel et de toutes ces pointes d’humour qui ont souvent permis de dédramati-ser la situation. Merci aussi simplement pour l’opportunité, qui maintenant, s’offre à moi pour mon insertion professionnelle.
Merci à Franck Richard et Olivier Thaler pour leurs conseils et guidance.
Merci à tous les stagiaires, Océane, Caroline, Mamadou, Julie, Marine, Mathilde, Anne-Gaëlle, Emily, Dominique et Kamel avec qui j’ai vécu sur le Domaine des Barres, à tous ces barbecues, apéritifs dinatoires, les discussions du pourquoi du comment des statistiques. Merci à l’équipe « Biodiversité », notre chef d’équipe Frédéric Archaux, mais encore, Chris-tophe Bouget, Marie Balzinger, Gwendoline Percel, Benoît Nusillard, Hilaire Martin, Richard Chevalier, Philippe Guillemard, Lisa Laurent, Fabien Laroche, Frédéric Gosselin et tous les autres, pour leur guidance et les relectures de mes livrables, mais aussi, bien des moments privilégiés avec eux lors des pauses cafés ou des repas.
Un grand merci aux personnes des autres équipes comme Rémy Gobin, Jordan Bello et Cécile Joyau, Agnès Rocquencourt, mais aussi des autres structures comme l’IGN, je pense notam-ment à Marine Dalmasso, ma future collègue. Merci beaucoup à Richard Chevalier pour les sorties botaniques, qui, j’espère, resteront au programme pour la suite.
Enfin, merci à toutes les personnes du Domaine des Barres de rendre ce lieu si accueillant et à celles rencontrées dans d’autres circonstances durant mon séjour ici.
1
1 I
NTRODUCTION
1.1
Contexte de l’étude
Soumise à une pression anthropique grandissante, la biodiversité de notre planète - remar-quable et ordinaire - connaît à l’heure actuelle un déclin sans précédent. Depuis le Sommet de la Terre de Rio de Janeiro en 1992, les problématiques liées à la conservation de la biodiversi-té ont pris les devants sur la scène politique internationale (Secretariat of the Convention on Biological Diversity 2006). Les pays signataires se sont engagés à respecter les principes de la Convention sur la diversité biologique. En réponse à ces engagements, la Seconde conférence interministérielle pour la protection des forêts en Europe (Helsinki, 1993) a introduit les prin-cipes de gestion durable des forêts européennes par la résolution H1 (FOREST EUROPE 2015).
Hébergeant une part significative de la biodiversité mondiale, les écosystèmes forestiers abri-tent certaines espèces dites « forestières », qui leur sont exclusivement associées. Elles dépen-dent entièrement d’attributs structurels ou compositionnels propres à ces milieux, comme les espèces saproxyliques qui vivent tout ou partie de leur cycle biologique dans le bois mort. Cependant, 20 à 50% de ces espèces saproxyliques sont menacées dans les forêts françaises métropolitaines, ainsi que 34% des mammifères et 11% des oiseaux forestiers (Gosselin & Paillet 2010), et ce, en dépit d’une augmentation de la surface forestière (Maaf & IGN 2016). L’intensification de l’exploitation forestière (cultures monospécifiques, enrésinements…) et la fragmentation des massifs sont autant de causes potentielles pour expliquer ce déclin
(Bengtsson et al. 2000; Paillet et al. 2010).
Afin de protéger cette biodiversité, il est crucial de comprendre le fonctionnement de ces éco-systèmes et l’impact que les activités humaines comme l’exploitation forestière induisent à la diversité biologique forestière (Kimmins 1990). Le projet Gestion Forestière, Naturalité et Biodiversité (GNB) a vu le jour en 2008. Né de la collaboration entre l’Institut national de Recherche en Sciences et Technologies pour l'Environnement et l'Agriculture (IRSTEA), l’Office National des Forêts (ONF) et Réserves Nationales de France (RNF), il vise à étudier l’effet de l’arrêt de l’exploitation forestière sur la structure des peuplements et la biodiversité en comparant des parcelles exploitées et non-exploitées depuis au moins 20 ans (Réserves Biologiques Intégrales - RBI - ou parties intégrales de Réserves Naturelles - RNN -). Sept groupes taxonomiques ont été échantillonnés : plantes vasculaires, mousses, champignons,
Photo 3 : Cavité de base de tronc en contact direct avec le sol forestier et
formée par les racines
Photo 5 : Carpophore de champignons lignicoles Photo 1 : Cavité de base de tronc avec une altération du bois déjà bien avancée
Photo 6 : Trous d’alimentation de pics en quête d’insectes
saproxyliques Photo 2 : Cavités remplies d’eau, aussi
dénommées « dendrotelme » dont le volume du contenu varie en fonction des
saisons
Photo 4 : Fourche cassée à son insertion exposant le bois de cœur, laissant présager
2 chauve-souris, oiseaux, coléoptères carabiques et saproxyliques ; différents paramètres den-drométriques et écologiques ont été relevés (Gosselin et al. 2014).
Dans le rapport final de ce projet, Gosselin et al. (2014) font état des difficultés de construire des indicateurs écologiques dont les liens avec la biodiversité ont été établis à partir d’une approche scientifique. En effet, Sutherland et al. (2004) soulignaient déjà cette tendance des orientations politiques ou de gestion se basant sur des éléments pas toujours construits scienti-fiquement. Par exemple, les indicateurs de gestion forestière durable actuellement appliqués par l’Institut Géographique National (IGN), font débat quant à leurs liens démontrés avec la biodiversité (Gosselin & Gosselin 2008; Lier et al. 2013), comme la corrélation entre volume de bois mort et richesse ou abondance des coléoptères ou champignons saproxyliques qui a été largement étudiée et demeure mal démontrée (Richard et al. 2005; Lassauce et al. 2011; Gao et al. 2015). De plus, ces indicateurs ne permettent pas à l’heure actuelle d’évaluer cer-taines composantes de la biodiversité telle que la diversité fonctionnelle ou phylogénétique
(Lier et al. 2013).
Dans cette perspective, une thèse est en cours à l’IRSTEA, au centre de Nogent sur Vernis-son, (45) menée par mon maître de stage, Yoan Paillet, au sein de l’équipe « Biodiversité » de l’Unité de recherche « Ecosystèmes Forestiers ». Ce travail intitulé « Les microhabitats des arbres : facteurs d’influence, lien avec la biodiversité et potentiel indicateur », s’intéresse aux microhabitats des arbres (Photos 1, 2, 3, 4, 5 et 6) considérés par plusieurs études scientifiques comme des spécificités structurales forestières plus à même d’être reconnues comme de po-tentiels indicateurs de biodiversité que le volume de bois mort (Michel & Winter 2009; Larrieu et al. 2014a; Winter et al. 2014). Mon stage consiste à mettre en relief de potentiels liens biodiversité/microhabitats et leurs variations dans des contextes variés à partir d’un trai-tement statistique des données acquises du projet GNB.
1.2
Etat de l’art
1.2.1 Indicateurs écologiques : outil d’évaluation de la biodiversité
Pour remplir leurs engagements internationaux, les acteurs de la forêt sont demandeurs d’indicateurs écologiques pertinents et représentatifs de la biodiversité (Basilico et al. 2014). Les indicateurs, définis selon Levrel et al. (2007), sont des outils de mesure indirecte d’un phénomène biologique ou physique qu’il est trop coûteux de mesurer directement. De ce fait, ils ne rendent compte que de compartiments partiels de la biodiversité, qui est par ailleurs bien trop vaste pour être évaluée dans son ensemble. Les indicateurs de biodiversité
3 s’appuient sur des données descriptives fiables et vérifiables mesurées régulièrement, facili-tant un suivi du statut, des changements et tendances liés à la biodiversité. Ils permettent de communiquer sur celle-là et de concevoir des outils d’aide à la décision et de suivi pour les politiques publiques. Ils doivent être compréhensibles pour de multiples acteurs (Gao et al. 2015) et dresser un diagnostic des effets des principales politiques et actions de protection ou de gestion de la nature afin de les réévaluer en cas d’objectifs non atteints (Gosselin et al. 2006). Ils soulignent aussi les pressions que la biodiversité subit et enrichissent les connais-sances scientifiques (Bonhême 2012). On distingue deux types d’indicateurs pour la biodiver-sité : les indicateurs directs qui sont appelés aussi indicateurs « taxonomiques » ou composi-tionnels, se centrent sur le suivi direct d’espèces ou de groupes d’espèces et les indicateurs indirects, construits à partir de la collecte de données écologiques autres que taxonomiques (structure paysagère, organisation spatiale…). Ils s’assimilent à des proxys de biodiversité et permettent d’estimer la présence ou l’abondance d’espèces ou groupes écologiques ciblés
(Dorioz et al. 2013).
1.2.2 Validation scientifique d’un indicateur écologique
Au-delà de l’exigence de mesurer les liens statistiques entre l’indicateur indirect et l’objet indiqué pour attester de sa qualité, de multiples étapes sont nécessaires pour valider un indica-teur (Gao et al. 2015). Tout d’abord, il convient de définir quelle composante de biodiversité l’indicateur caractérise : remarquable (rares et/ou menacées, protégées), ordinaire (de proxi-mité) ou fonctionnelle, quel niveau d’organisation (communautés, groupes écologiques, es-pèces) et à quelles échelles spatiale (locale, régionale, nationale, européenne ou internatio-nale) et temporelle (fréquence d’échantillonnage) (Bonhême 2012). Ensuite, on identifie la relation en sachant dans quel sens de variation (positif, négatif), à quelle magnitude (forte, faible) elle évolue et dans quels contextes écologiques (géographie, climat, gestion…) le do-maine de validité de l’indicateur s’exprime (Gosselin et al. 2008; Bubb et al. 2010). Parmi les éléments de structure forestière éligibles à la qualité d’indicateur de biodiversité, les microha-bitats suscitent depuis plusieurs années l’intérêt des scientifiques (Jonsson & Jonsell 1999; Vuidot et al. 2011; Larrieu & Cabanettes 2012; Paillet et al. 2015).
1.2.3 Cas des microhabitats des arbres
Dans ses travaux de thèse, Larrieu (2014) identifie les microhabitats des arbres comme un habitat d’espèces, de petites dimensions, portés par un arbre mort ou vivant et apparentés à des singularités morphologiques ou biologiques externes des arbres. Fréquemment le fruit de
4 l’activité biologique de champignons, de coléoptères saproxyliques et d’oiseaux, leur appari-tion peut être aussi provoquée par l’influence des condiappari-tions micro- et macro-climatiques ou mécaniques (ex : foudre) et les activités humaines (Regnery et al. 2013). Procurant abri, lieu de nourrissage, de reproduction et d’hibernation à de nombreux assemblages d’espèces
(Butler et al. 2013; Paillet et al. 2015), les microhabitats sont dynamiques et comportent sou-vent du bois en décomposition (Müller et al. 2014). Les communautés d’espèces qui leur sont
inféodées, le sont parfois de manière stricte, comme partiellement selon la nature et les be-soins de leur cycle biologique et peuvent évoluer en fonction du stade de maturité du micro-habitat (Kraus et al. 2016). Ils sont des attributs caractéristiques des processus naturels
(Bauhus et al. 2009; Larrieu & Cabanettes 2012), que l’on retrouve tout au long du cycle
sylvogénétique (Larrieu et al. 2014b), mais en particulier dans les phases avancées (Dorioz et
al. 2013; Kraus et al. 2016) et constituent d’ailleurs des descripteurs de naturalité biologique
(Gosselin et al. 2014).
Bien que les microhabitats aient donné matière à un certain nombre d’études, Gao et al. (2015) nous informent que dans plus de 50% des études menées sur des indicateurs structu-raux et temporels, aucun test de corrélation n’a été réalisé entre l’indicateur et l’indicandum. Les microhabitats des arbres sont des éléments dont les relations avec la biodiversité ont peu été étudiées (Winter & Möller 2008). Par ailleurs, la recherche les concernant s’est jusqu’ici
cantonnée à certaines guildes ou espèces, ou encore à un seul type de microhabitats (ex : cavi-tés), les données sont donc fragmentaires. Il apparaît alors circonstancié de mener une ap-proche pluri-taxonomique et multi-site pour la mise en évidence des relations entre microha-bitats et biodiversité. Les groupes taxonomiques sélectionnés pour notre étude sont les chirop-tères, les oiseaux et les coléoptères saproxyliques. En effet, la littérature scientifique abonde les concernant, eu égard à leurs liens supposés avec les microhabitats (Siitonen 2012) qui leur procurent refuge et alimentation. Ce choix permettra d’enrichir les données actuelles et de les comparer.
1.3
Objectifs de l’étude, problématique et hypothèses
1.3.1 ObjectifsLes objectifs de ce stage sont de :
- Mettre en évidence par une approche statistique des relations présumées entre indices de microhabitats et ceux de la biodiversité de trois groupes taxonomiques : chirop-tères, oiseaux et coléoptères saproxyliques. Ce travail s’attachera à examiner ces liens
5 aussi bien au niveau de la communauté des taxons, qu’au niveau de groupes écolo-giques (ex : les cavicoles) ou patrimoniaux et des espèces.
- Evaluer les variations potentielles de ces liens en fonction de différents contextes afin de mesurer le potentiel indicateur des indices décrivant les microhabitats.
1.3.2 Problématique
Existe-t-il des liens entre la diversité des microhabitats et l’abondance et richesse spécifique des trois groupes taxonomiques que sont les oiseaux, les chiroptères et les coléoptères sa-proxyliques ? Le pouvoir indicateur des microhabitats des arbres est-il similaire selon les groupes taxonomiques étudiés ?
1.3.3 Hypothèses générales
Il est relaté que les microhabitats ont des liens avec la biodiversité (Winter & Möller 2008), notamment les oiseaux (McClelland et al. 1979), les chauves-souris (Dietz et al. 2009b; Regnery et al. 2013; Przybilski et al. 2014) et les coléoptères saproxyliques (Bouget et al. 2013; Lier et al. 2013). Nous supposons que les indices de communauté et de groupes écolo-giques ou patrimoniaux de ces trois taxons répondent favorablement mais dans des mesures variables à la densité totale de microhabitats, à leur richesse, ainsi qu’à leur diversité
(Regnery et al. 2013).
Une forte densité de certains microhabitats est propice à l’abondance et/ou la richesse spéci-fique de différents groupes écologiques ou patrimoniaux, ainsi qu’à la présence/absence et à l’abondance des espèces étudiées. Nous émettons l’hypothèse que la densité en cavités est corrélée positivement avec les espèces strictement forestières (Vonhof & Gwilliam 2007), menacées ou rares (Lier et al. 2013; Müller et al. 2014), les espèces cavicoles (McClelland et
al. 1979; Gosselin & Laroussinie 2004; Dajoz 2007; Regnery et al. 2013; Bouget et al. 2014a)
des trois groupes taxonomiques et les oiseaux insectivores, dont le régime alimentaire inclut une forte proportion de coléoptères saproxylophages inféodés à ces microhabitats (Bouget et
al. 2014a). De même, les sporophores de champignons saproxyliques sont favorables aux co-léoptères saproxyliques en général (Økland et al. 1996) , et spécifiquement aux espèces fongi-coles (Johansson et al. 2006) et rares (Winter & Möller 2008; Bouget et al. 2013) car ils s’en nourrissent ou y chassent leurs proies (Dajoz 2007; Bouget et al. 2014a). Les épiphytes, en particulier la présence de lierre, augmentent la richesse spécifique des oiseaux insectivores
(Regnery et al. 2013) et des chiroptères (Coutadeur 2010), leur servant de nichoirs ou de garde-mangers d’insectes associés (Lier et al. 2013). Par ailleurs, puisque certains oiseaux et
6 de nombreuses espèces de chiroptères utilisent les écorces décollées et les fissures comme abri ou lieu d’alimentation (Psyllakis & Brigham 2006; Godineau & Pain 2007; Regnery et al. 2013), nous pensons que ces microhabitats sont positivement corrélés à leur richesse et abon-dance totales. De même, les branches mortes du houppier et les têtes cassées sont associées positivement aux chiroptères (Coutadeur 2010) et aux oiseaux, notamment les pics pour le « tambourinage » territorial, la chasse des larves qui se trouvent dans le bois mort, ou encore le forage de leur loge (McClelland et al. 1979).
Au-delà des liens supposés entre les différents niveaux des trois groupes taxonomiques et les microhabitats, nous supposons que ces relations sont dépendantes du contexte écologique et présentent des réponses différentes en fonction de variables environnementales et de gestion. Nous présumons donc qu’il existe des différences de variations de ces liens entre forêts exploitées et non exploitées (Winter & Möller 2008; Bouvet et al. 2016) qui peuvent aussi se rencontrer selon l’altitude (Müller et al. 2015). Par exemple, si on compare une cavité située en montagne à une autre en plaine, elle ne présente pas les mêmes conditions micro-climatiques (Bunnell et al. 1999) et cela change le lien entre taxons cavicoles et cavités
(Bouget et al. 2014a). On suppose que les cavités auront plus d’effet en montagne où les conditions de substitution sont plus durs à trouver (Com. Pers. Paillet Y.). Pour tester ces hypothèses, j’ai suivi une approche statistique fréquentiste à partir des données acquises du projet GNB.
2 M
ATÉRIELS ET MÉTHODES
2.1
Echantillonnage
2.1.1 Sites d’étude et échantillonnage
Cette étude repose sur un échantillonnage de placettes établi dans 15 massifs forestiers métro-politains (figure 1), dont neuf situés en plaine (altitude < 800m) et six en montagne (altitude ≥ 800m) (annexe 1). L’inventaire des oiseaux et des coléoptères saproxyliques s’appuie sur 14 forêts (pour le premiers, le massif d’Engins n’a pas été échantillonné et pour les seconds, celui de la Haute Chaîne du Jura), tandis que les chiroptères n’ont pas été dénombrés en montagne pour des raisons de sécurité, leur inventaire portant au final sur sept des neuf forêts de plaine. L’échantillonnage a consisté à choisir des massifs avec des parcelles non exploitées depuis 20 ans, qu’il s’agisse de Réserves Biologiques Intégrales (RBI) ou de parties intégrales en Ré-serves Naturelles Nationales (RNN), et à apparier des parcelles exploitées à proximité des parcelles non exploitées. Le plan d’échantillonnage a été créé à partir d’un quadrillage
régu-7 lier de 100x100m à partir duquel les placettes ont été pré-sélectionnées aléatoirement. Puis, elles ont été validées par une vérification de terrain sous la réserve de conditions stationnelles similaires (conditions édaphiques, topographie, exposition) pour l’appariement entre parcelles exploitées et non exploitées. Les parcelles exploitées ont été choisies dans un rayon de 5 km autour des limites des réserves et devaient être composées uniquement de peuplements au-tochtones (chênaies-hêtraies-charmaies en plaine, hêtraies-sapinières-peissières en montagne). Les placettes ont été géoréférencées et matérialisées durablement par des piquets métalliques, une borne de géomètre et d’autres éléments visibles permettant d’identifier leur centre. Seuls les arbres porteurs de microhabitats dont le diamètre à hauteur de poitrine (diamètre à 1m30 ou D1,30) ayant un diamètre > 30 cm ont été gardés dans le jeu de données pour les analyses afin d’homogénéiser le pool d’arbres entre les deux modalités altitudinales. L’échantillonnage comprend un total de 213 placettes, 68 en montagne et 145 en plaine (Annexe 1). Les données de terrain ont été collectées entre 2008 et 2013 par des agents de l’Irstea, de l’ONF ou issues de RNF. Je n’ai participé à aucun inventaire dans le cadre de mon stage pour alimenter mon jeu de données.
2.1.2 Inventaire des variables abiotiques
Le protocole utilisé pour le relevé des microhabitats s’insère dans la démarche du protocole SENP (Suivi des Espaces Naturels et Protégés), désormais appelé PSDRF (Protocole de Suivi Dendrométrique des Réserves Forestières). Il permet la caractérisation dendrométrique des placettes d’échantillonnage sous différents aspects bois mort et peuplement, analyse des flux de bois, suivi de la composition en essences, suivi du capital sur pied, régénération…(pour plus de détails, cf. Paillet et al. 2015a): L’inventaire des microhabitats a été réalisé à partir d’une liste comprenant 28 types avec des seuils de surface ou de recouvrement (annexe 2), par Y. Paillet, afin de limiter l’effet observateur potentiel (Paillet et al. 2015), à l’exception d’un
site (F. Gosselin).
2.1.3 Inventaires des trois groupes taxonomiques
Les inventaires des chiroptères, des oiseaux et coléoptères saproxyliques sont détaillés dans l’annexe 3. Cependant, il est important de mettre en lumière les principes de comptage utili-sés. C’est l’activité des chauves-souris, mesurée par le nombre de contacts par espèce et par minute qui fait office d’abondance. Les oiseaux sont relevés par la vue et l’ouïe et selon diffé-rents périmètres et les coléoptères par le nombre d’individus piégés.
8
2.2
Méthodes d’analyses statistiques
Le principe de la modélisation employée est de quantifier la part de variabilité d’une variable réponse Y (descripteurs de biodiversité) qui peut être expliquée par des variable(s) explica-tive(s) X (indices de microhabitats et variables de contextualisation éventuelles).
2.2.1 Descripteurs de biodiversité
Au préalable, un travail de sélection de l’ensemble des données biodiversité a été effectué : ont été exclues des analyses pour les trois groupes taxonomiques les individus déterminés seulement au niveau genre. Pour les oiseaux,ceux se trouvant à plus de 100 m et les rapaces ont été écartés (< 1% des données oiseaux) car la méthode d’inventaire n’était pas adaptée. Dans le but d’évaluer les relations biodiversité/ microhabitats à différentes échelles, les don-nées de biodiversité ont été considérées selon trois niveaux d’organisation : abondance et ri-chesse spécifique totales de la communauté entière, abondance et riri-chesse spécifique des groupes écologiques ou patrimoniaux, ainsi qu’abondance et présence/absence (occurrence) des espèces.
Les groupes écologiques ou patrimoniaux ont été choisis selon la bibliographie existante, étayant de liens présumés entre biodiversité/ microhabitats. Les espèces menacées, chiroptères et avifaune, proviennent des Listes rouges (IUCN France et al. 2009; IUCN France et al. 2011) et comprennent les espèces éteintes dans la nature, en danger critique, en danger et vul-nérable. Le statut de rareté et le caractère fongicole et cavicole des coléoptères saproxyliques sont issus de la base de données FRISBEE (Bouget et al. 2008), utilisées dans les articles de
Bouget et al. (2013) et Bouget et al. (2014a). J’ai utilisé cet indice de rareté qui fait référence
à des espèces non abondantes et distribuées seulement localement, car à ce jour, aucune Liste rouge n’est disponible pour ce taxon. Les deux derniers niveaux de l’indice (gradué de 1 – espèce abondante et distribuée largement - à 4 – espèce à distribution limitée et faibles abon-dances locales) définissent le groupe des espèces rares. Les espèces cavicoles, chiroptères et avifaune, découlent respectivement de Dietz et al. (2009a) et Bouvet et al. (2016). Les es-pèces forestières, au sens strict, dérivent des travaux de Landesbetrieb Mobilität Rheinland-Pfaz (2011) pour les chauves-souris et Gregory et al. (2007) pour les oiseaux. Il s’agit aussi d’indicateurs de gestion durable des forêts françaises métropolitaines (Maaf & IGN 2016). A nouveau, aucune liste exhaustive ne classe la spécialisation forestière des coléoptères sa-proxyliques. Enfin, le caractère insectivore des oiseaux est issue de l’étude de Gregory et al. (2007) utilisées par Bouvet et al. (2016). Au total, 26 variables de réponse ont été traitées, 12 variables explicatives et deux covariables à deux modalités (annexe 4).
Tableau 1 : Récapitulatif des moyennes, des moyennes + 50%, écarts-types, minimums et maximums des variables explicatives traitées dans les analyses par facteurs de variables de contextualisation. Mean : moyenne, Mean + 50% : moyenne + 50%, Sd : écart-type, Min : minimum, Max : maximum.
Gestion Altitude
Variables Global Exploité Non exploité Plaine Montagne
Mean Mean +
50% Sd Min Max Mean Sd Min Max Mean Sd Min Max Mean Sd Min Max Mean Sd Min Max N.mh 184,52 277,5 120,43 0 784,2 164,3 101,3 0 450,8 206 135,1 0 784,2 178,7 103,9 0 518,1 196 148,5 0 784,2 div.types 6,19 9 3,13 1 16 5,43 2,7 1 12 7 3,36 1 16 6,11 3,02 1 16 6,36 3,37 1 16 R.mh 4,46 7,5 2,24 0 11 3,82 2 0 8 5,13 2,28 0 11 4,46 2,21 0 11 4,45 2,3 0 10 N.crown.DW 12,37 18 21,83 0 129,2 10,47 23,04 0 129,2 14,37 20,4 0 72,34 16,68 24,35 0 129,2 3,68 11,53 0 60,92 N.bfork 2,37 3 6,56 0 44,38 1,54 6,11 0 44,38 3,24 6,93 0 31,83 3,14 7,35 0 44,38 0,81 4,22 0 27,98 N.conks 3,75 6 7,58 0 45,55 3,72 7,36 0 31,83 3,77 7,84 0 45,55 3,89 7,78 0 45,55 3,47 7,2 0 39,79 N.wcav 2,58 4,5 6,8 0 47,1 1,56 5,12 0 31,83 3,66 8,11 0 47,1 3,04 7,53 0 47,1 1,64 4,97 0 32,31 N.nwcav 8,64 13,5 14,65 0 92,43 7,11 14,32 0 92,43 10,26 14,91 0 77,15 8,12 14,11 0 92,43 9,67 15,75 0 77,15 N.bcav 1,94 3 5,54 0 34,08 1,25 4,67 0 29,81 2,67 6,29 0 34,08 0,87 3,59 0 29,81 4,09 7,77 0 34,08 N.cracks 14,29 21 21,17 0 151,6 11,59 15,58 0 65,72 17,16 25,59 0 151,6 11,59 14,54 0 51,47 19,7 29,84 0 151,6 N.bark 74,77 112,5 62,37 0 476,6 69,68 52,21 0 249 80,17 71,48 0 476,6 63,33 44,8 0 249 97,8 83,46 0 476,6 N.epip 51,68 78 51,45 0 203,4 46,33 45,22 0 166,9 57,36 57,02 0 203,4 57,82 51,68 0 203,4 39,3 49,06 0 190,3
9 Pour les occurrences, seules les espèces dont la fréquence est comprise entre 15 et 85% ont été incluses. En effet, a été considéré un intervalle supérieur à 20-80% (Verheyen et al. 2004)
afin d’ajouter six espèces de chiroptères et deux d’oiseaux dont les fréquences se situent légè-rement en dessous de 20% ou en dessus de 80%.
2.2.2 Indices des microhabitats et variables de contextualisation
A propos des 28 types de microhabitats relevés, nous avons procédé à quelques regroupe-ments de microhabitats rares avec ceux plus communs et assez similaires, soit 12 groupes décrits en annexe 2 (ex : absence d’écorce et écorces déhiscentes). Les indices de microhabi-tats ont été hiérarchisés en deux niveaux (annexe 4): les indices généraux et les indices indivi-duels. Parmi les premiers :
- la densité des microhabitats par ha correspond au nombre de microhabitats porté par chaque arbre extrapolés à un ha. Il convient cependant de noter que cette variable sous-estime légèrement la densité réelle en microhabitat car ils ont été notés sur chaque arbre en présence/absence mais pas en abondance (par exemple le nombre de cavités porté par chaque arbre n’est pas connu). Si un arbre portait plusieurs microha-bitats, l’arbre a été compté autant de fois que de microhabitats rencontrés. Si l’arbre portait le même microhabitat plusieurs fois, il n’a été compté qu’une fois.
- la diversité des types de microhabitats par placette, obtenue à partir des 28 types. Il s’agit de la somme des combinaisons différentes de types de microhabitats par arbre pour chaque placette.
- la richesse des microhabitats correspond au nombre des groupes différents de micro-habitats par placette.
Pour les indices individuels, ils correspondent à la densité par ha par groupe de microhabitats. Enfin, l’altitude (plaine vs. montagne) et la gestion (exploité vs. non exploité) ont fait office de facteurs de contextualisation pour les relations biodiversité/ microhabitats. Les moyennes, écarts-types, minimums et maximums des variables explicatives sont présentés en tableau 1.
2.2.3 Exploration des données
A l’aide du logiciel R version 3.2.4 (R Core Team 2015), l’exploration de données a été
me-née suivant la méthodologie décrite par (Zuur et al. 2010). Des vérifications ont permis d’établir l’absence de points aberrants et de vérifier l’homogénéité des variances, ainsi que d’identifier d’éventuelles collinéarités entre variables et détecter des interactions potentielles.
10 Au total, 17 variables explicatives ont été testées (annexe 4). Certains groupes de microhabi-tats ne faisant pas l’objet d’hypothèses (N.crownsq, N.outgrwth et N.runs), ont été exclus des analyses.
2.2.4 Choix et élaboration de la modélisation
Suivant les hypothèses et la distribution des données étudiées, il a été choisi d’utiliser le mo-dèle linéaire généralisé à effets mixtes (package lme4, fonction: glmer()) (Bates et al. 2013)
Les valeurs de comptage étant strictement positives, c’est une distribution d’erreur de Poisson qui a été utilisée pour les indices à l’échelle communauté et groupes écologiques ou patrimo-niaux. Un effet aléatoire « massif » a été intégré dans les modèles pour limiter l’auto-corrélation spatiale car deux placettes dans le même massif ont une plus grande probabilité d’être semblables que deux placettes dans deux massifs éloignés. Par ailleurs, comme les in-ventaires « biodiversité » ont été menés entre 2008 et 2013 par différents ornithologues, chi-roptérologues et entomologistes expérimentés, l’échantillonnage a été parcouru dans une même forêt la même année par la même personne. L’effet « massif » introduit a donc absorbé en parti l’effet observateur sous-jacent. De même, pour éviter des problèmes de potentielle sur-dispersion des données dans la modélisation, un effet aléatoire « observation » a été ajouté
(Harisson 2014). Pour les données d’occurrence des espèces, j’ai utilisé une distribution
d’erreur binomiale avec les mêmes effets aléatoires.
Les modèles construits se sont basés tout d’abord, sur les variables de biodiversité en variable de réponse, les indices de microhabitats en variables explicatives. Puis, les deux variables de contextualisation ont été ajoutées et enfin les interactions. Considérant l’absence de relevé pour les chiroptères en forêt de montagne, la covariable altitude a été exclue de leurs modèles. Pour les indices d’espèces, uniquement les densités de microhabitats individuels ont été trai-tées dans une approche orientée « indicateur » avec les effets aléatoires.
Les magnitudes ont été calculées à partir des moyennes des variables explicatives auxquelles une progression de 50% a été ajoutée (tableau 1).
2.2.5 Sélection des modèles
Dans l’objectif de sélectionner le meilleur modèle pour chaque variable réponse, j’ai utilisé le Critère d’information d’Akaike (AIC) (Akaike 1974), corrigé pour les petits échantillons (AICc) et recommandé par Burnham and Anderson (2002) lorsque le n est petit ou le nombre de paramètres important. Comme l’AIC, l’AICc pénalise les paramètres additionnels. Son principe est de défavoriser les modèles présentant le plus de paramètres pour répondre au
Figure 2 : Relation entre l’abondance totale des chiroptères et la richesse des arbres porteurs de microhabitats. La ligne continue représente le modèle et les
lignes en pointillés les intervalles de confiance à 95%.
Figure 3 : Relation entre l’abondance totale des oiseaux et la richesse des arbres porteurs de microhabitats. La ligne continue représente le modèle et les lignes en
11 mieux au principe de parcimonie. Le meilleur modèle est celui dont l’AICc est le plus faible, excepté si un modèle présente moins de paramètres et se situe dans une fourchette de moins de deux points.
3 R
ÉSULTATS
3.1
Structure générale des données biodiversité
Globalement, 19 espèces de chauves-souris, 57 d’oiseaux et 403 de coléoptères saproxyliques ont été inventoriées sur la totalité, ce qui correspond à un effectif total de 3 242 contacts de chauves-souris, 3 934 d’oiseaux et 32 331 individus de coléoptères saproxyliques. L’abondance totale moyenne par placette des chiroptères, de l’avifaune et des coléoptères saproxyliques représente, respectivement 26,79 (ET :±56,01), 19,57 (ET :±7,76) et 168,39 (ET :±245,36). La richesse spécifique totale moyenne par placette des chauves-souris, des oiseaux et des coléoptères saproxyliques est de 2,60 (ET :±2,18), 10,50 (ET :±3,26) et 28,56 (ET :± 12,64). Les moyennes et écarts-types des autres variables de réponse sont présentées dans l’annexe 5.
3.2
Les groupes taxonomiques
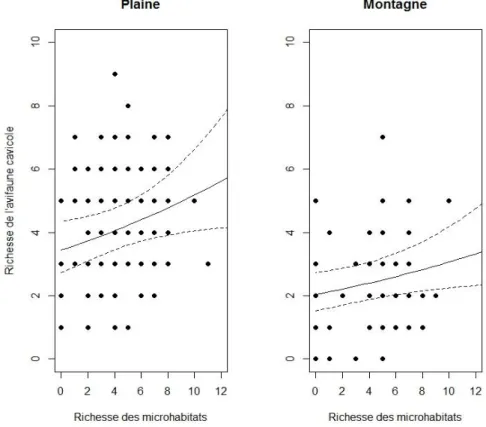
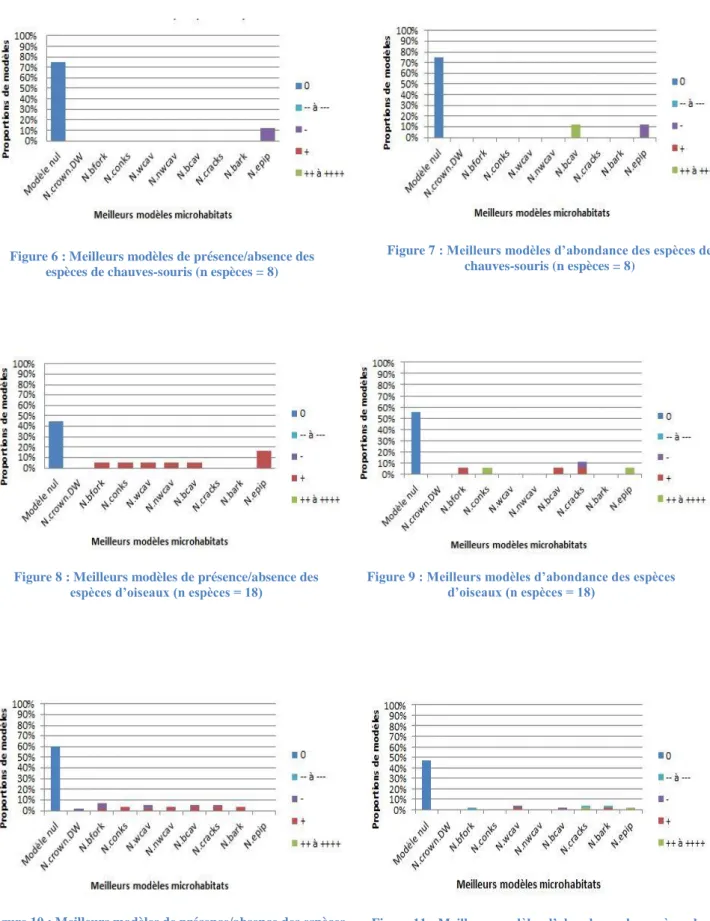
Les meilleurs modèles pour les indices (communauté et groupes écologiques ou patrimo-niaux) des chiroptères et des oiseaux sont ceux comprenant des indices généraux de microha-bitats, tandis que les coléoptères saproxyliques au contraire ont le modèle nul comme meilleur modèle. De plus, les variables les plus rencontrées dans les meilleurs modèles, quel que soit le taxon, sont des variables générales de microhabitats. Pour plus de détails, les résultats des meilleurs modèles sont présentés en annexe 6.
3.3
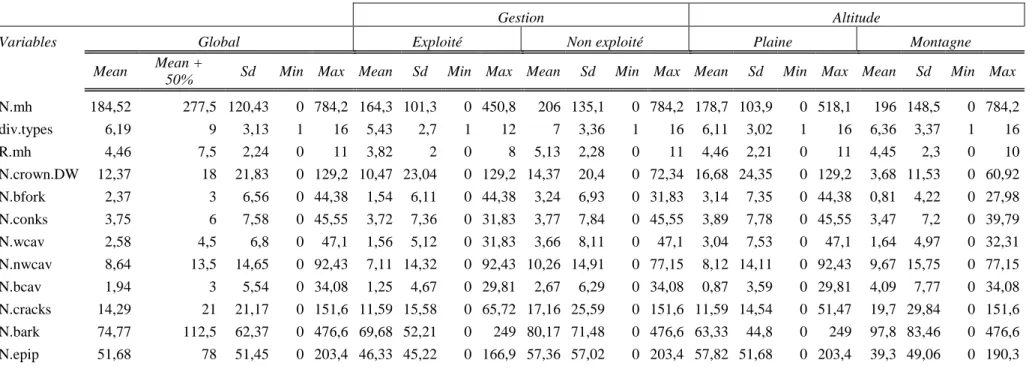
Réponse des abondances
3.3.1 Les indices de communauté
Les meilleurs modèles pour l’abondance totale des chiroptères (figure 2) et des oiseaux (fi-gure 3) sont ceux comprenant la richesse des microhabitats, combinée à un effet additionnel de la gestion. Ces relations sont significatives (resp. p = 0,002 et p = 0,003) et ont une magni-tude faible. Pour les chiroptères, une progression en richesse de microhabitats de 5 à 7,50 en forêts exploitées correspond à une augmentation de 0,19% d’abondance par placette au lieu de 0,11% en non exploitées; pour les oiseaux, de 0,09% d’individus par placette en exploitées à 0,10% en non exploitées. Le meilleur modèle pour l’abondance totale des coléoptères sa-proxyliques est celui avec la densité de microhabitats mais la relation n’est pas significative.
12
3.3.2 Les groupes écologiques ou patrimoniaux
Les espèces menacées ou rares
Le meilleur modèle pour l’abondance des chiroptères menacés est celui avec la densité de microhabitats avec un effet additionnel de la gestion. Cette relation est non significative. Le meilleur modèle pour l’abondance des oiseaux est celui avec la densité de cavités hors trous de pics, accompagné d’un additionnel de l’altitude. Cette relation est marginalement significa-tive (p = 0,085) et de faible magnitude. Le meilleur modèle pour l’abondance des coléoptères saproxyliques rares est le modèle nul.
Les espèces forestières
Le meilleur modèle pour l’abondance des chiroptères forestiers est celui avec la densité de cavités de pics, avec un effet additionnel de la gestion mais cette relation n’est pas significa-tive. Pour les oiseaux, le meilleur modèle est celui avec la richesse de microhabitats. Cette relation est significative (p = 0,004). Quand la moyenne de la richesse de microhabitats s’élève, l’abondance augmente de 0,05% d’individus. Sa magnitude est donc faible.
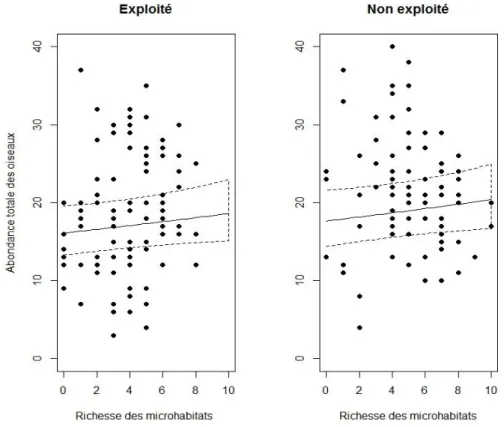
Les espèces cavicoles
Concernant les chauves-souris, le meilleur modèle pour l’abondance des cavicoles est celui avec la densité de microhabitats, combiné à un effet additionnel de la gestion. Ce résultat n’est pas significatif. Pour les oiseaux, leur meilleur modèle pour l’abondance est celui avec la ri-chesse de microhabitat. En élevant la riri-chesse de microhabitats de 5 à 7,5, l’abondance s’accroît significativement (p<0,001) de 0,10% d’individus, donc la magnitude est faible. Le meilleur modèle pour l’abondance des coléoptères saproxyliques cavicoles est le modèle nul.
Les espèces fongicoles
Le meilleur modèle pour l’abondance des coléoptères saproxyliques fongicoles est celui avec la densité de microhabitats, avec un effet additionnel de l’altitude. Cette relation est margina-lement significative (p = 0,066) et de faible magnitude.
Les espèces insectivores
Le meilleur modèle pour l’abondance des oiseaux insectivores est celui avec la richesse de microhabitats. Cette relation est significative (p = 0,035) et de faible magnitude : pour une élévation en richesse de microhabitats, l’abondance s’accroît de 0,03% d’individus.
3.4
Réponse des richesses spécifiques
3.4.1 Les indices de communauté
Le meilleur modèle pour la richesse spécifique totale des chiroptères est celui avec la diversité des microhabitats. Cette relation est significative (p = 0,007) et de magnitude plus forte que
Figure 4 : Relation entre la richesse des chiroptères cavicoles et la diversité des microhabitats. La ligne continue représente le modèle et les lignes en pointillés les
intervalles de confiance à 95%.
Figure 5 : Relation entre la richesse de l’avifaune cavicole et la richesse des arbres porteurs de microhabitats. La ligne continue représente le modèle et les lignes en
13 les autre relations : lorsque la diversité des microhabitats croît de 6 à 9, la richesse spécifique totale des chiroptères augmente de 2,15% d’espèces. Le meilleur modèle pour celle des oi-seaux comprend la richesse de microhabitats. Cette relation est significative (p = 0,014) et de magnitude plus forte que les autres relations. En effet, la richesse spécifique totale des oiseaux augmente de 1,17% d’espèces. Le meilleur modèle pour la richesse spécifique totale des co-léoptères saproxyliques est celui avec la densité de microhabitats, avec une double interaction de la gestion et de l’altitude mais ce résultat n’est pas significatif
3.4.2 Les groupes écologiques ou patrimoniaux
Les espèces menacées ou rares
Les richesses des espèces rares ou menacées des trois taxons ne répondent à aucun indice de microhabitats.
Les espèces forestières
Le meilleur modèle pour la richesse des chiroptères forestiers est celui avec la diversité des microhabitats. Cette relation est significative (p = 0,037) et de magnitude plus forte que les autres relations: lorsque l’on élève la diversité de microhabitats, la richesse croît de 1,84% d’espèces. Pour les oiseaux, le meilleur modèle pour la richesse spécifique est celui avec la richesse de microhabitats. Cette relation est significative (p = 0,038) et de magnitude faible : quand elle s’élève, la richesse spécifique augmente de 1,04% d’espèces.
Les espèces cavicoles
Le meilleur modèle pour la richesse spécifique des chiroptères cavicoles est celui avec la di-versité des microhabitats avec une interaction de la gestion (figure 4). Cette relation est signi-ficative (p<0,001) et de magnitude plus forte en forêts exploitées (2,64%) qu’en non exploi-tées (0,42%). Pour les oiseaux, le meilleur modèle pour la richesse spécifique est celui (p<0,001) avec la richesse de microhabitats accompagnée d’un effet additionnel de l’altitude (figure 5). En élevant la richesse de microhabitats, la richesse spécifique en plaine s’accroît de 3,69% d’espèces alors qu’en montagne de 2,25%. Sa magnitude est forte. L’indice des co-léoptères saproxyliques cavicoles ne répond à aucun descripteur de microhabitats.
Les espèces fongicoles
Le meilleur modèle pour la richesse est celui avec la densité des carpophores avec un effet additionnel de l’altitude, mais cette relation n’est pas significative.
Figure 6 : Meilleurs modèles de présence/absence des espèces de chauves-souris (n espèces = 8)
Figure 7 : Meilleurs modèles d’abondance des espèces de chauves-souris (n espèces = 8)
Figure 8 : Meilleurs modèles de présence/absence des espèces d’oiseaux (n espèces = 18)
Figure 9 : Meilleurs modèles d’abondance des espèces d’oiseaux (n espèces = 18)
Figure 10 : Meilleurs modèles de présence/absence des espèces de coléoptères saproxyliques (n espèces = 55)
Figure 11 : Meilleurs modèles d’abondance des espèces de coléoptères saproxyliques (n espèces = 55)
14 Le meilleur modèle pour la richesse spécifique des oiseaux insectivores est celui avec la di-versité des microhabitats. Cette relation est significative (p = 0,036) mais de faible magnitude (1,11%).
3.5
Les espèces
Résultats généraux
J’ai testé les espèces les plus fréquentes, soit 8 de chauves-souris, 18 d’oiseaux et 55 de co-léoptères saproxyliques. Au vu des résultats décrits de la figure 8 à la figure 11 (cf. annexe 7 à 10 pour plus de détails), le modèle nul est sélectionné dans près de 50% des cas pour l’ensemble des espèces des 3 taxons. 10 espèces présentent des relations négatives et 20 tives sur 81 pour la présence/absence. L’abondance affiche sept relations négatives et 10 posi-tives. Toutes les relations décrites ci-dessous sont significaposi-tives. Au niveau spécifique, les analyses ont démontrées que les espèces sont assez peu corrélées aux indices individuels de microhabitats (présence/absence et abondance).
Par groupes taxonomiques
Chiroptères
Entre présence/absence et abondance, la proportion d’espèces ne répondant pas aux modèles est identique (75%). Parmi huit espèces, en présence/absence comme en abondance, la
Pipis-trellus pipisPipis-trellus est influencée négativement par la densité de lierre tandis que Nyctalus leisleri est affectée positivement par les cavités de base de tronc avec une magnitude assez
forte.
Oiseaux
Il y a plus d’espèces qui répondent au modèle nul comme meilleur modèle en abondance qu’en présence/absence.
Globalement, la présence/absence manifeste plus de relations avec des magnitudes faibles. Trois espèces sont influencées positivement par la densité de lierre : Columba palumbus,
Pa-rus major et Turdus merula. Une espèce (Sitta europaea) augmente quand la densité de
cavi-tés de base de tronc s’élève, comme Erithacus rubecula avec les cavicavi-tés hors trous de pics. Deux espèces sont influencées positivement par la densité de cavités de pics (Poecile palustris et Turdus viscivorus). Enfin, une espèce (Phylloscopus sibilatrix) s’accroît avec la densité de champignons et une (Phylloscopus collybita) avec la densité de fourches cassées.
15 Les relations détenant une magnitude supérieure à 10% en abondance sont Columba
palum-bus avec la densité de lierre et Phylloscopus sibilatrix avec celle de champignons. L’espèce Phylloscopus collybita est influencée positivement par la densité de fourches cassées, pendant
que Sitta europaea l’est avec la densité de cavités de base de tronc. Deux espèces sont affec-tées par les fentes : Sylvia atricapilla négativement et Turdus philomelos positivement.
Coléoptères saproxyliques
Plus d’espèces répondent au modèle nul comme meilleur modèle en présence/absence qu’en abondance (60% vs .47,27%). En présence/absence, 22 relations sont significatives. Deux espèces sont influencées positivement par la densité d’écorces décollées (Eulagius filicornis et
Opilo mollis), deux par celle des champignons (Orchesia undulata et Xylosandrus germanus).
Une espèce est influencée négativement par la densité de tête de houppier (Cerylon
ferrugi-neum). Quatre espèces sont influencées par la densité de fourches cassées, trois négativement
(Cyclorhipidion bodoanum, Phymatodes testaceus et Scolytus intricatus) et une positivement (Platystomos albinus). Quatre espèces sont influencées par la densité de cavités de pics, trois négativement (Nemozoma elongatum, Rabocerus foveolatus et Taphrorychus bicolor) et une positivement (Melanotus villosus). La densité de cavités hors trous de pics affectent positi-vement deux espèces (Platycerus caraboides et Salpingus ruficollis) et négatipositi-vement une es-pèce (Rhizophagus bipustulatus). Les eses-pèces Salpingus planirostris et Microrhagus
pyg-maeus sont respectivement influencées positivement et négativement pas la densité de cavités
de base de tronc. Enfin, Gonodera luperus diminue avec l’augmentation de la densité de fentes, tandis que Litargus connexus et Rhagium mordax augmentent.
En abondance, il y a neuf relations significatives. Gonodera luperus est influencée positi-vement par la densité de fentes tandis que Rhagium mordax l’est négatipositi-vement. Ces deux rela-tions ont une magnitude forte. Trypodendron domesticum est affectée positivement à la densi-té de lierre avec une forte magnitude. Quand la densidensi-té d’écorces décollées augmente, l’espèce Opilo mollis augmente alors que Platystomos albinus diminue fortement.
Microrha-gus pygmaeus est influencée négativement par la densité de cavités de base de troncs, comme Taphrorychus bicolor l’est par la densité de cavités de pics, alors que Melanotus villosus est
influencée positivement. L’espèce Scolytus intricatus est enfin influencée négativement par la densité de fourches cassées.
16
4 D
ISCUSSION
Mon étude des relations entre la biodiversité de trois groupes taxonomiques et les microhabi-tats des arbres a mis en évidence que, globalement, les microhabimicrohabi-tats ont un effet significatif sur les chiroptères et les oiseaux, tant au niveau de la communauté que des groupes écolo-giques ou patrimoniaux, mais peu ou pas d’effet sur les coléoptères saproxyliques. D’autre part, ces relations sont en grande majorité positives mais avec des magnitude assez faibles. Au niveau spécifique, l’effet des microhabitats sur la biodiversité varie en fonction des taxons : en majorité, plus de 50% des espèces ne répondent pas aux microhabitats séparément.
4.1
Les indices généraux de microhabitats : meilleurs prédicteurs de
biodiversi-té des oiseaux et des chiroptères
Conformément à nos hypothèses, les indices généraux décrivant les microhabitats dans leur ensemble (densité de microhabitats par ha, leur diversité par placette et leur richesse par pla-cette) semblent être de meilleurs descripteurs que les indices individuels en particulier à l’échelle de la communauté. En revanche, nos présomptions à propos du rôle de chacun des groupes de microhabitats sur les descripteurs des groupes écologiques ou patrimoniaux sont majoritairement réfutées.
La diversité des microhabitats joue un rôle non négligeable pour la richesse spécifique totale des chiroptères et des espèces forestières, mais aussi des oiseaux insectivores. En effet, les microhabitats fournissent gite et couvert à bon nombre d’espèces (Stockland et al. 2012; Bouvet et al. 2016) car les chiroptères se nourrissent des insectes saproxylophages inféodés aux microhabitats (Dietz et al. 2009a), tout comme les oiseaux insectivores. De plus, les chi-roptères en général mais aussi forestiers les utilisent comme lieu de reproduction et de repos
(Tillon et al. 2016), à l’instar des oiseaux qui peuvent y nicher ou y chasser leurs proies (McClelland et al. 1979). De même, on peut lier diversité des microhabitats et diversité des ressources : plus il y a de microhabitats différents, plus les cortèges d’espèces qui leur sont inféodés, sont diversifiés (Regnery et al. 2013). Concernant les chauves-souris, le résultat de la richesse spécifique totale entre en contradiction avec celui de Regnery et al. (2013) : la ri-chesse spécifique totale des chauves-souris répond mieux à la densité des trous de Céramby-cidés, donc à un indice individuel. Cependant, ces auteurs démontrent que la richesse spéci-fique totale des chauves-souris est aussi sensible à la présence d’autres variables de microha-bitats comme la diversité. Le rôle des microhabitats fournissant le gite et le couvert et la théo-rie des niches écologiques pourraient aussi expliquer la relation positive et significative entre la richesse de microhabitats, très corrélée à leur diversité, et l’abondance totale des chiroptères
17 et des oiseaux, la richesse spécifique totale de l’avifaune, celle des oiseaux forestiers et cavi-coles, mais aussi l’abondance des oiseaux forestiers, insectivores et cavicoles. Par ailleurs, contrairement à Stockland et al. (2012), la richesse spécifique des espèces menacées de chi-roptères et de l’avifaune, ainsi que l’abondance des chichi-roptères ne répondent à aucun indice de microhabitats. Il y a néanmoins une exception : l’abondance de l’avifaune menacée est influencée par la densité de cavités hors trous de pics, mais la magnitude de cette relation est très faible et sa significativité marginale.
4.2
Les coléoptères saproxyliques répondent peu aux microhabitats
Parmi les dix variables de réponse testées, il n’y a qu’une seule réponse marginalement signi-ficative à un modèle contenant une variable de microhabitats. Il s’agit de la relation entre l’abondance des espèces fongicoles et la densité de microhabitats. Généralement, la densité de microhabitats est corrélée aux gros arbres, dépérissants ou matures (Winter & Möller 2008), qui ont une plus forte probabilité d’être le support de fructifications de champignons ligni-coles (Gosselin et al. 2014). Dans ce sens, il se peut que les indices des coléoptères saproxy-liques soient plus sensibles à d’autres facteurs que les microhabitats, comme la présence de bois mort (Winter & Möller 2008), et d’arbres de gros diamètres, qui sont des attributs struc-turels caractéristiques de peuplements matures (Vuidot et al. 2011; Larrieu & Cabanettes 2012), mais aussi l’ouverture du couvert forestier (Bouget et al. 2014a).
Pour l’abondance des coléoptères fongicoles, étant moins nombreux en montagne, il se peut que leur répartition inégale entre plaine et montagne ait de l’influence sur le résultat. Par ail-leurs, le taux de réponse si faible aux variables microhabitats peut être expliqué par les condi-tions d’échantillonnage des coléoptères saproxyliques et des microhabitats. En effet, Bouget
et al. (2013) soulignent que la méthode de relevé des microhabitats induit une sous-représentation de la densité car ils ont été recensés en présence/absence. Si un arbre portait deux cavités, elle n’a été comptée qu’une fois. D’un point de vue fonctionnel, cela n’a pas le même impact. L’effort d’échantillonnage des coléoptères saproxyliques, basé sur l’utilisation de deux pièges par placette uniquement durant une seule année, n’a peut-être pas été suffisant pour avoir une image représentative de la diversité locale de ce groupe taxonomique. On au-rait contacté plus d’espèces si le nombre de réplication ou d’année était augmenté (Parmain et
al. 2013). Par ailleurs, il est à noter que les coléoptères saproxyliques volants sont à peu près bien échantillonnés par les pièges-vitre mais plus rarement les spécialistes des microhabitats, à condition d’un élargissement de l’échantillon ou de dispositifs d’échantillonnage dédiés pour ces espèces (Com. Pers. Bouget C.). Dans cette même lignée, dans la relation de
18 l’abondance totale des chiroptères et la richesse en microhabitats, on assiste à un effet positif de l’exploitation forestière. L’inventaire des chiroptères nous montre que la métrique « abon-dance totale » soit pondérée par une espèce dont les contacts ont été deux fois plus fréquents en exploité (Pipistrellus pipistrellus).
4.3
Influence des variables de contextualisation
Parmi les résultats mis en évidence par nos analyses, le type de gestion (exploité vs. non ex-ploité) et l’altitude (plaine vs. montagne) semblent affectés différemment mais souvent fai-blement les relations entre indices de biodiversité et descripteurs de microhabitats. Par exemple, la relation entre la richesse spécifique des chiroptères cavicoles et la diversité des microhabitats est plus forte en forêts exploitées qu’en forêts non exploitées. Cela peut paraître étonnant, cependant la diversité des microhabitats est moindre en forêts exploitées et devient par ailleurs un facteur limitant. En effet, l’exploitation forestière entraîne une réduction des quantités et qualités de bois mort, de microhabitats et des arbres « habitats » (gros arbres, ca-vités) (Paillet et al. 2010). Donc, on peut supposer que les espèces dépendantes de ces élé-ments sont plus en compétition intra- et inter-spécifique pour l’accès à ces ressources pour maintenir leurs populations en forêts exploitées. De même, Bouvet et al. (2016) ont souligné que les habitats étaient plus favorables aux espèces, les ressources plus riches et les perturba-tions humaines moins fréquentes comme l’exploitation ou les activités de loisirs dérangeantes en forêts non exploitées et que cela pourrait concourir à une plus grande richesse des espèces. Donc, il se pourrait que l’exploitation forestière ait un rôle à jouer dans les relations biodiver-sité/microhabitats.
Concernant le rôle de l’altitude, le niveau de richesse en espèces des oiseaux cavicoles est moins fort en montagne qu’en plaine, pourtant le nombre moyen de microhabitats différents est le même entre les deux modalités (plaine : 4,46, montagne : 4,45) et la relation (pente) ne varie pas. Comme l’a démontré Scheffers et al. (2014), les microhabitats tels que les cavités ont un effet tampon par rapport aux températures et les populations d’espèces leur étant asso-ciées ont leur fonctionnement biologique mieux préservé. Il est possible aussi que d’autres paramètres aient une influence comme les conditions climatiques (Müller et al. 2015), la composition en essences des arbres (Holmes & Robinson 1981), la présence de chandelles de large diamètre (Spiering & Knight 2005; Czeszczewik et al. 2013) ou le traitement sylvicole
(Mahon et al. 2008). En effet, on peut faire l’hypothèse d’un effet abiotique sur la relation
biodiversité des oiseaux/ressource comme Bouget et al. (2014b) l’a souligné pour les coléop-tères saproxyliques.
19
4.4
Les indices individuels de microhabitats ont peu d’influence au niveau des
espèces et celle-là est souvent négative
Au vu des analyses traitant des relations des densités de microhabitats individuels et de la présence/absence ou abondance des espèces, on peut noter qu’une majorité des espèces ne répond pas aux variables de microhabitats, tandis que les indices de communautés et de groupes écologiques y répondent mieux. Dans son étude, Regnery et al. (2013) ont relevé des relations significatives principalement avec la diversité des microhabitats, donc un indice gé-néral de microhabitats et très peu de corrélations, par exemple, entre espèces cavicoles et ca-vités. Il est fort probable que les cortèges d’espèces de notre échantillonnage dépendent de plusieurs microhabitats, et non uniquement d’un seul (ex : la mésange noire est un cavicole secondaire qui utilise les trous de pics pour nicher et se nourrit d’insectes présents derrière les écorces et dans le bois mort du houppier). Les liens fonctionnels sont rarement évidents au moins pour les oiseaux (hormis par exemple les cavités de pic et la mésange nonnette). Si l’on prend l’exemple de la relation Trypodendron domesticum et la densité de lierre qui est posi-tive, ce coléoptère saproxylique est un xylophage secondaire. Il n’y a pas de relation écolo-gique directe avec les épiphytes. Il peut s’agir dans ce cas d’effet indirect par une covariable ou d’un artéfact analytique (Com. Pers. Bouget C.), du rôle indirect d’un phénomène plus large non pris en compte dans cette étude, comme l’ouverture du couvert forestier (Bouget et
al. 2014a). On peut par exemple penser que le lierre étant plus présent en plaine, l’espèce est peut-être inféodée à une classe d’altitude.
5 C
ONCLUSION
Il existe des liens entre les trois groupes taxonomiques et les microhabitats d’après nos ana-lyses mais dont l’amplitude varie selon le niveau d’organisation, la métrique et le contexte. Le pouvoir indicateur des microhabitats n’est donc pas le même entre les trois groupes étudiés. On constate qu’au niveau des communautés et des groupes écologiques les relations sont plus fortes en considérant l’ensemble des microhabitats plutôt que des microhabitats pris séparé-ment. Ce sont les oiseaux qui semblent être les mieux « indiqués » par ces indices de micro-habitats, suivis des chiroptères et tandis que les coléoptères saproxyliques révèlent en fait très peu de liens. D’autre part, les paramètres de contextualisation ont permis de mettre en relief que ces liens pouvaient fluctuer selon les conditions d’altitude et de gestion dans un même taxon mais de manière limitée. Par exemple les variables des chauves-souris répondaient de manière changeante à la gestion, comme celles des oiseaux à l’altitude. En outre, les relations qui ont été soulevées, sous-tendent rarement de manière explicite des relations mécanistes et
20 étaient de magnitude assez faible. Enfin, les indices de communautés et des groupes écolo-giques répondent mieux aux descripteurs des microhabitats que les espèces. On peut alors dire que la qualité des microhabitats des arbres en tant qu’indicateur de biodiversité reste mitigée. Il serait donc intéressant de poursuivre le processus de validation des microhabitats des arbres comme indicateur de biodiversité en testant les relations entre espèces et indices généraux de microhabitats avec des modèles linéaires généralisés à effets mixtes. D’un autre ordre, il pa-raît opportun de comparer le « pouvoir indicateur de biodiversité » des indices de microhabi-tats à celui d’autres indices, notamment dendrométriques liés au bois vivant et au bois mort. Afin de donner plus de puissance aux analyses, agrandir l’échantillonnage au niveau européen peut être aussi une opportunité pour introduire le relevé des microhabitats dans les inventaires nationaux, déjà mis en place en Allemagne et dans d’autres pays européens (Winter & Möller 2008).
Bibliographie
Akaike H. (1974). New look at the statistical model identification. IEEE Transactions on Automatic Control, AC-19, 716-723.
Barataud M. (2012). Ecologie acoustique des chiroptères d'Europe: Identification des espèces, étude de leurs habitats et comportements de chasse. Biotope.
Basilico L., Peyron J.-L., Soubelet H., Appora V. & Fournier M. (2014). Synthèse 2/3, Evaluation de la gestion durable des forêts, quels indicateurs pour la biodiversité forestière? In: Biodiversité, Gestion forestière et Politiques publiques. Conseil scientifique du programme BGF, p. 6.
Bates D., Maechler M. & Bolker B. (2013). lme4: Linear mixed-effects models using S4 classes. In.
Bauhus J., Puettmann K. & Messier C. (2009). Silviculture for old-growth attributes. Forest Ecology and Management, 258, 525-537.
Bengtsson J., Nilsson S.G., Franc A. & Menozzi P. (2000). Biodiversity, disturbances, ecosystem function and management of european forests. Forest Ecology and Management, 132, 39-50.
Bonhême I. (2012). Les indicateurs écologiques de biodiversité forestière : questions introductives. In: Les indicateurs de biodiversité forestière. Synthèse des réflexions issues du programme de recherche "Biodiversité, gestion forestière et politiques publiques" (eds. Nivet C, Bonhême I & Peyron J-L). Gip Ecofor, MEDDE Paris, p. 144.
Bouget C., Brustel H., Zagatti P. & Noblecourt T. (2008). Le Système d'Information sur l'Ecologie des Coléoptères Saproxyliques Français (French Information System on Saproxylic BEetle Ecology, FRISBEE): un outil écologique et taxonomiques pour l'évaluation de l'état de conservation des forêts. . In.
Bouget C., Larrieu L. & Brin A. (2014a). Key features for saproxylic beetle diversity derived from rapid habitat assessment in temperate forests. Ecological Indicators, 36, 656-664.
Bouget C., Larrieu L., Nusillard B. & Parmain G. (2013). In search of the best local habitat drivers for saproxylic beetle diversity in temperate deciduous forests. Biodiversity and Conservation, 22, 2111-2130.
Bouget C., Parmain G., Gilg O., Noblecourt T., Nusillard B., Paillet Y., Pernot C., Larrieu L. & Gosselin F. (2014b). Does a set-aside conservation strategy help the restoration of old-growth forest attributes and recolonization by saproxylic beetles? Animal Conservation, 17, 342-353.
Bouvet A., Paillet Y., Archaux F., Tillon L., Denis P., Gilg O. & Gosselin F. (2016). Effects of forest structure, management and landscape on bird and bat communities. Environmental Conservation, 1-13.
Bubb P., Almond R., Kapos V., Stanwell-Smith D. & Jenkins M. (2010). Guidance for national biodiversity indicator development and use. In: Cambridge, UK, p. 27.
Bunnell F.L., Kremsater L.L. & Wind E. (1999). Managing to sustain vertebrate richness in forests of the Pacific Northwest: Relationships within stands. Environmental Reviews, 7, 97-146.
Burnham K.P. & Anderson D.A. (2002). Model Selection and Multi-Model Inference: A Practical Information-Theoretic Approach. 2nd edition edn. Springer.
Butler R., Lachat T., Larrieu L. & Paillet Y. (2013). Arbres-habitats, éléments clés de la biodiversité forestière. In: Les approches intégratives en tant qu'opportunités de conservation de la biodiversité forestière (eds. Kraus D & Krumm F). Institut européen des forêts, p. 308.
Coutadeur P. (2010). Etude du potentiel indicateur des micro-habitats des arbres : lien avec la biodiversité forestière et test d'effet observateur. In, p. 30.
Czeszczewik D., Walankiewicz W., Mitrus C., Tumiel T., Stański T., Sahel M. & Bednarczyk G. (2013). Importance of dead wood resources for woodpeckers in coniferous stands of the Białowieża Forest. Bird Conservation International, 23, 414-425.
Dajoz R. (2007). Les insectes de la forêt. Rôle et diversité des insectes dans le milieu forestier. Editions TEC & DOC edn, Paris.