Vielerorts fehlen in Operationssälen, in denen Kinder versorgt werden, so-wohl die Erfahrung als auch die Aus-rüstung zum Anlegen einer intra-ossären Infusion. Im Folgenden sol-len die Grundkenntnisse zur intraos-sären Infusion vermittelt werden. Da-bei werden geeignetes Material und sichere Techniken beschrieben und mithilfe von Videos gezeigt. Die Indi-kationsstellung in der Kinderanästhe-sie wird – baKinderanästhe-sierend auf den Leitlinien aus der Notfallmedizin – diskutiert und anhand von Fallbeispielen illus-triert. Des Weiteren werden Implika-tionen für Anästhesieabteilungen mit Kinderversorgung aufgezeigt.
Grundlagen
Säuglinge und Kleinkinder können Venen verhältnisse aufweisen, die die Etablierung eines sicheren Gefäßzugangs selbst durch erfahrenes Personal nicht immer inner halb einer vertretbaren Frist erlauben [29, 42, 44]. Die intraossäre Infusionstechnik hat sich in der pädiatrischen Notfallmedi zin seit Jahren als schnelle, effiziente und sichere Alternativmethode zur Schaffung eines Gefäßzugangs erwiesen, um einem vitalgefährdeten Kind dringend benöti gte Medikamente und Flüssigkeiten zu ap plizieren [21, 51].
>
Nach maximal drei erfolglosen
venösen Versuchen
intraossär punktieren
In den aktuellen notfallmedizinischen Leitlinien für Kinder des European Resus citation Council (ERC) und der American Heart Association (AHA) sind die Indika tionen für den frühzeitigen Einsatz der in traossären Infusionstechnik beim Säugling und Kleinkind klar definiert: Nach maxi mal drei vergeblichen venösen Punktions versuchen sollte eine intraossäre Kanü le platziert werden [2, 6, 25]. Diese Emp fehlungen sind auf kritische Situationen in der Kinderanästhesie übertragbar.
Historisches
Im Jahr 1922 wurde erstmals die Kom munikation des Knochenmarks mit der systemischen Blutzirkulation und der Möglichkeit einer intraossären Verabrei chung von Flüssigkeiten beschrieben [9, 11]. In den 40er Jahren fand die intraos säre Infusionstechnik Eingang in die kli nische Praxis [9, 20, 54]. Rasch etablierte sie sich in der Pädiatrie zu einem Standard der Infusionstechnik [20], wurde dann je doch durch die aufkommenden Plastik verweilkatheter abgelöst und geriet wie der in Vergessenheit.
Erst 1983, anlässlich eines Anästhesie zwischenfalls mit fatalem Ausgang (inha lative Einleitung beim Kind mit Halothan bei Tonsillennachblutung und fehlendem Venenzugang), warf Henry Turkel die Frage auf, warum die intraossäre Infusi on als einfacher und ehemals bewährter Gefäßzugang in der Ausbildung ignoriert werde [57]. In der Folge erlebte die intra ossäre Infusionstechnik in der Notfallme dizin eine Renaissance [38], und heute ist
sie fester Bestandteil der notfallmedizi nischen pädiatrischen Leitlinien und Pra xis [2, 6, 25].
Prinzip
Die intraossäre Infusion ist eine Appli kation von Flüssigkeiten in einen knö chernen Gefäßraum. Dieser hat den Vor teil, auch bei Kälte, im Schock und beim Kreislaufstillstand nicht zu kollabieren. Dabei gelangen Medikamente und Flüs sigkeiten direkt in den intramedullären Blutgefäßraum des roten Knochenmarks und von dort über die venösen Marksi nusoide, die Zentralvenen des Knochen marks und die ableitenden Venen des Knochens in die Systemzirkulation. Rotes, zu Infusionszwecken punktierbares Kno chenmark findet sich beim Kind vor allem am Beckenkamm und in den Metaphysen der langen Röhrenknochen [14]. Die Infu sionsgeschwindigkeit ist abhängig von In fusionsdruck, Innendurchmesser der Na del, Art des Infusats und Ort der intraos sären Infusion. Flussraten von Kristallo iden erreichen je nach Nadelsystem un ter Schwerkraft 10–80 ml/min und unter Druckinfusion 40–150 ml/min [52].
Zusatzmaterial online
Zu diesem Beitrag stehen sieben Videos zur Verfügung. Bitte folgen Sie dem Pfad: www.deranaesthesist.de >Online-Version >Beitrag >Electronic Supplementary Mate-rial oder geben Sie folgende URL ein: dx.doi.org/10.1007/s00101-009-1605-1 Anaesthesist 2009 · 58:863–875
DOI 10.1007/s00101-009-1605-1 Online publiziert: 2. September 2009 © Springer Medizin Verlag 2009
M. Weiss1 · G. Henze1 · C. Eich2 · D. Neuhaus1
1 Anästhesieabteilung, Universitäts-Kinderkliniken Zürich 2 Zentrum Anaesthesiologie, Rettungs- und Intensivmedizin,
Universitätsmedizin Göttingen
Intraossäre Infusion
Eine wichtige Technik
auch für die Kinderanästhesie
Leitthema
Redaktion
B. Zwißler, München
863
Punktionsstellen
Die Punktionsstelle erster Wahl für ei ne intraossäre Infusion beim Kind un ter 6 Jahren ist die proximale anterome diale Tibia. Die Punktion wird dabei auf der flachen anteromedialen Vorderseite der proximalen Tibia, beim Kind ca. 1– 2 cm unterhalb der gut palpablen Tubero sitas tibiae durchgeführt (. Abb. 1A, B; [22, 52]). Ab dem Alter von etwa 6 Jah ren ist die Kortikalis der proximalen Ti bia relativ dick und mit manuellen Kanü len schwieriger zu durchbohren. Bei äl teren Kindern und bei Erwachsenen soll te daher auf die distale mediale Tibia aus gewichen werden, sofern nicht automa tische Kanülierungssysteme verwendet werden [26]. Die Punktionsstelle an der distalen Tibia liegt 2–3 cm kranial des me dialen Malleolus (. Abb. 1C, D). Dieser Punktionsort kann auch gewählt werden, wenn lokale Kontraindikationen für eine Punktion an der proximalen Tibia vor liegen. Die Punktionsrichtung ist immer senkrecht zur Knochenoberfläche. E Bei Kindern ist die Punktion
des Sternums verboten
Als weitere mögliche Punktionsstellen werden in der Notfallmedizin beim Er wachsenen der proximale Humerus, das distale Femur, die Spina iliaca anterior su perior und das Sternum erwähnt. Bei Kin dern ist die Punktion des Sternums we gen der Verletzungsgefahr mediastinaler Strukturen obsolet [55, 56].
Etablierte Indikationen
in der Notfallmedizin
Primäre Indikation
Gemäß den aktuellen Leitlinien des ERC und der AHA zur kardiopulmonalen Re animation gilt beim Kind unter 6 Jahren mit AtemKreislaufStillstand der primäre intraossäre Zugang als Methode der Wahl, falls nicht bereits ein venöser Gefäßzu gang vorhanden ist (Infobox 1; [2, 25]). Zudem kann bei Kindern mit aussichts los schwierigen Venenverhältnissen infol ge schwerer Hypovolämie, Hypothermie oder großflächigen Verbrennungen pri mär eine intraossäre Infusion angelegt werden [22, 24, 47].
Sekundäre Indikation
Beim vitalgefährdeten Säugling und Kind, das dringend eine Medikamenten oder Volumengabe zur Sicherung der Vitalfunktionen benötigt, muss nach drei erfolglosen venösen Punktionsversuchen oder spätestens nach 90–120 s die Indika tion für eine intraossäre Infusion gestellt bzw. diese angelegt werden [2, 25].
Kontraindikationen
Es muss zwischen relativen und absoluten Kontraindikationen gegen eine intraos säre Infusion unterschieden werden. Ab solute Kontraindikationen sind lokale Zu stände, die den Erfolg einer intraossären Infusion infrage stellen (Infobox 2). Nur solche sind in einer lebensbedrohlichen Situation zu berücksichtigen.
Als relative Kontraindikationen gelten Erkrankungen des Knochens oder des Blutbildungssystems sowie Bakteriämie, Sepsis, intrakardialer RechtslinksShunt und schwere pulmonale Insuffizienz (Ge fahr einer Knochenmark oder Fettembo lie). Diese sind nur von Bedeutung für Si tuationen, in denen keine unmittelbar le bensbedrohliche Situation vorliegt und in
denen ein Gefäßzugang mithilfe einer in traossären Infusion etabliert werden soll.
Medikamente und Flüssigkeiten
Alle für Reanimation und Anästhesieein leitung zur Verfügung stehenden intrave nösen Medikamente, Flüssigkeiten und Blutprodukte können auch intraossär ver abreicht werden [22]. Die Dosierungen und Volumina entsprechen denjenigen der intravenösen Applikation. Alle Medi kamente sollen mit 10 ml physiologischer Kochsalz oder RingerLaktatLösung nachgespült werden. Dies ist insbesonde re im Fall eines Kreislaufstillstands wich tig. Hypertone Lösungen wie Natriumbi karbonat oder hochprozentige Zuckerlö sungen sollen wegen der Gefahr von Ne krosen und Infektbildung verdünnt wer den [20, 34]. Pharmakokinetisch ist die intraossäre Infusion mit einer zentralve nösen Applikation vergleichbar und so mit einem periphervenösen Zugang so gar überlegen [36]. Da die Flussgeschwin digkeit von der Resorptionsfähigkeit des Markraums abhängig ist, benötigen ho he Volumengaben, wie sie bei der Thera pie der akuten Hypovolämie erforderlich sind, meist Druckbeutelsysteme oder In fusionspumpen.Komplikationen
In der Literatur sind verschiedene poten zielle Komplikationen einer intraossären Infusion beschrieben worden [3, 13, 15, 17, 32, 33, 50, 55]. Dazu gehören Fehllagen, Verbiegen der Punktionskanüle, Frak turen von Knochen, Verletzung der Epi physenfuge und ein Kompartmentsyn drom durch Perforation der gegenseitigen Kortikalis. Diese Komplikationen sind selten und vor allem auf eine unsachge mäße Handhabung manueller Knochen markkanülen zurückzuführen. Automa tische Systeme scheinen in dieser Hinsicht mehr Sicherheit zu bieten.
Fett und Knochenmarkembolien nach intraossärer Infusion sind laborex perimentell im Tierversuch nachgewie sen worden, haben jedoch bis heute kei ne klinische Bedeutung erlangt [19, 39, 41, 55]. Eine messbare Einschwemmung unreifer Knochenmarkzellen in die Blut strombahn konnte gezeigt werden [27, 43].
Abb. 1 8 Punktionsstellen für eine intraossäre Infusion beim Kind: A proximale anteromediale Tibia, B ca. 1–2 cm unterhalb der gut palpablen Tuberositas tibiae, C distale Tibia, D ca. 2–3 cm kranial des medialen Malleolus
Obwohl keine klinisch relevanten Fallbe richte mit Knochenmark oder Fettem bolisation durch intraossäre Infusionen existieren, ist bei Kindern mit intrakardi alem RechtslinksShunt und mit pulmo nalarterieller Hypertonie Vorsicht gebo ten. Die Medikamente und Infusionslö sungen sollten bei diesen Kindern nur langsam intraossär infundiert werden, und auf Druckinfusion ist zu verzichten, um die Mobilisation von Knochenmark oder Fettpartikeln zu vermeiden bzw. zu minimieren.
Die vermutlich relevanteste Kompli kation nach intraossärer Infusion ist ei ne Osteomyelitis. Diese ist jedoch bei ste riler Arbeitstechnik, aseptischem Um gang mit der intraossären Leitung und kurzer Verweildauer der Kanüle eine aus gesprochene Rarität. Am ehesten tritt sie bei septischen Schockzuständen mit Bak teriämie oder bei der Anwendung von hy peronkotischen Lösungen, die zu Nekro sen führen können, auf [20, 34].
In einer von Rosetti et al. [45] publi zierten Metaanalyse mit 4270 Fällen von intraossären Infusionen traten gerade 27 Fälle von Osteomyelitiden auf (0,6%). Eine skandinavische Studie mit 982 intra ossären Infusionen bei 495 Kindern (Al ter der Patienten: 2 bis 4 Jahre) zur Blut transfusion (n=686), zur Infusion von Se rum (n=174), Natriumbikarbonatlösung (n=78), 50%igen Glucoselösung (n=32) und anderen hochdosierten Medikamen ten (n=12) berichtet bei einer Liegedau er der Intraossärnadel von maximal 32 h über lediglich 5 Osteomyelitiden (0,5% der intraossären Infusionen; [20]). In der neuesten Literatur der vorwiegend not fallmedizinischen Anwendungen (1985– 2009) sind kaum mehr Fälle von Osteo myelitiden zu finden [53]. Gute Schu lung und Training sind nötig, damit mit zunehmender Einsatzfrequenz der intra ossären Infusion Komplikationen nicht häufiger auftreten bzw. berichtet wer den. Dennoch ist die Osteomyelitis eine ernst zu nehmende Komplikation der in traossären Infusion, sodass die Indikati on für eine intraossäre Infusion gegeben sein muss. Das geringe Komplikationsri siko einer intraossären Infusion steht al lerdings in keinem Verhältnis zum groß en zeitlichen und therapeutischen Ge winn beim vital bedrohten Kind.
Zusammenfassung · Abstract
Anaesthesist 2009 · 58:863–875 DOI 10.1007/s00101-009-1605-1 © Springer Medizin Verlag 2009
M. Weiss · G. Henze · C. Eich · D. Neuhaus
Intraossäre Infusion. Eine wichtige Technik auch für die
Kinderanästhesie
Zusammenfassung
Die zeitgerechte Etablierung eines venösen Zugangs kann insbesondere bei Säuglingen und Kleinkindern eine große Herausforde-rung sein. Hier hat sich die intraossäre Infusi-onstechnik seit den 1940er Jahren als schnel-le, effiziente und sichere Alternativmethode zur Schaffung eines Gefäßzugangs bewährt, um einem vitalgefährdeten Kind dringend benötigte Medikamente und Flüssigkeiten zu applizieren. Während in den internationa-len Leitlinien zur pädiatrischen Notfallmedi-zin der intraossären Infusion eine hohe Priori-tät eingeräumt wird, greifen die meisten An-ästhesisten nur sehr zögerlich auf diese lang-jährig bewährte Punktionstechnik zurück. Die vorliegende Arbeit beschreibt die intraos-säre Infusionstechnik, stellt zwei unterschied-liche Kanülierungssysteme vor und disku-tiert, basierend auf den aktuellen notfallme-dizinischen Leitlinien sowie anhand von ei-genen Fallbeispielen, potenzielle Indikati-onen für die Kinderanästhesie. Demnach soll-ten insbesondere akut vital-gefährdete
Kin-der mit Kreislaufstillstand, Laryngospasmus, akuter Atemwegsblutung, hypovolämischem Schock oder Hypothermie bei ausgedehnten Verbrennungen ohne liegenden bzw. rasch anzulegenden venösen Zugang mit einer in-traossären Kanüle versorgt werden. Inwie-weit die intraossäre Infusion auch beim nicht-akut vital-gefährdeten Kind mit schwierigem oder unmöglichem peripheren Venenzugang in der Anästhesie überbrückend und zeit-lich begrenzt eingesetzt werden sollte, wird die zukünftige Diskussion zeigen. Die erfolg-reiche Anwendung der intraossären Infusi-onstechnik in der Kinderanästhesie verlangt die unmittelbare Verfügbarkeit der entspre-chenden Ausrüstung, die umfassende Schu-lung und das regelmäßige Training sowie ei-ne klare Regelung für ihre Anwendung inei-ner- inner-halb der Anästhesieabteilung.
Schlüsselwörter
Infusion · Intraossär · Komplikationen · Anäs-thesie · Kinder
Intraosseous infusion. An important technique also for paediatric
anaesthesia
Abstract
Timely establishment of venous access in in-fants and toddlers can prove a particular-ly challenging task. Since the 1940s the tech-nique of intraosseous infusion has estab-lished itself as a valuable alternative means for rapid, efficient and safe delivery of drugs and fluids to critically ill children. Whereas in-ternational guidelines for paediatric emer-gency medical care have assigned intraosse-ous infusion a high priority, most anaesthe-tists utilize this well-proven technique with great reluctance. This article describes the technique of intraosseous infusion, introduc-es two different cannulation systems, and discusses its potential indications in paediat-ric anaesthesia, based on current emergen-cy medical care guidelines as well as some of our own case studies. In particular, children with acutely life-threatening conditions, such as circulatory arrest, laryngospasm, acute
air-way haemorrhage, hypovolaemic shock or hypothermia secondary to extensive burns, should receive an intraosseous cannula if in-travenous access cannot be rapidly estab-lished. Future discussion may reveal wheth-er a transiently inswheth-erted intraosseous infusion would also be indicated if the child with dif-ficult or impossible venous access presents without acute life-threatening conditions for anaesthesia. Successful application of the in-traosseous infusion technique requires im-mediate access to the necessary equipment, intensive education, continuous training and clear guidelines for its application in an an-aesthesia department.
Keywords
Infusion · Intraosseous · Complications · Anaesthesia · Children
865
Als weitere Komplikation soll noch der endostale Schmerz durch Aspiration (Sog) von Knochenmark und durch Injek tion von Flüssigkeiten (erhöhter intrame dullärer Druck) genannt werden [20, 58]. Der endostale Injektionsschmerz kann durch die intraossäre Gabe von 1–2 ml 1%igem Lidocain vermieden werden [35]. Langsam und kontinuierlich verabreichte Infusionen verursachen kaum Schmer zen [35].
Ausrüstung und Technik
Punktionsmaterial
Grundsätzlich lässt sich jede Stahlkanü le mit genügender Festigkeit, vorzugswei se eine mit Mandrin, für eine intraossäre Punktion verwenden. Von Medizinpro dukteherstellern werden speziell für die intraossäre Punktion konzipierte Kanü len angeboten; hierbei wird zwischen ma nuellen und automatischen Punktionssys temen unterschieden. Im Folgenden soll kurz auf die Cook®Intraossärkanüle und auf das EZIO®System eingegangen wer den (. Abb. 2; [7, 59]).
Cook®-Intraossärkanüle
Die Cook®Intraossärkanüle (Cook Criti cal Care, Bloomington, IN, USA) als ma nuelles Punktionssystem hat sich in der Praxis seit vielen Jahren bewährt. Sie ist in verschiedenen Größen und Modifika tionen sowie als Druck oder Schraubka nüle erhältlich. Die Autoren bevorzugen die 18GKanüle mit DieckmannModifi kation, weil sie sowohl bei Neugeborenen als auch bei Kleinkindern verwendet wer
den kann. Die Spitze dieser Cook®Kanü le weist zudem 2 Seitenöffnungen auf, die einen Flüssigkeitsdurchtritt über die Ka nüle sicherstellen, falls diese mit der Spit ze an der gegenseitigen inneren Korti kalis anliegt (Listenpreis: EUR 38/Stück; . Abb. 2a). Das Einbohren der Kanü le geschieht mit kontrollierter Kraft un ter rotierenden Bewegungen und erfor dert Übung. Beim Einbringen der Kanü le in den Knochen müssen sterile Hand schuhe getragen werden, da sie zwischen Daumen und Zeigefinger geführt wird. Der Zeitaufwand für die Punktion beträgt ca. 30–60 s (Video 1 und 2) Die Kanüle ist aus Chromstahl und daher auch im Ma gnetresonanztomographen (MRT) pro blemlos einsetzbar. Nachteilig kann sein, dass die Cook®Intraossärkanüle bei in korrekter Handhabung verbiegen oder gar abknicken kann, dass sie keine Einführ begrenzung hat und dass ihr Halt in der Kortikalis oft ungenügend ist [7, 59]. Wei terer Nachteil der manuellen Technik ist das trichterförmige Bohren mit einem ho hen lokalen Druck auf Knochen und Peri ost. Dies ist nicht nur schmerzhaft (Bohr zeit ca. 20–30 s), sondern kann auch Frak turen des Knochens nach sich ziehen. Au tomatische Techniken bieten diesbezüg lich klare Vorteile.
EZ-IO®-Intraossärinfusionssystem
Das EZIO®Infusionssystem (Vidaca re, San Antonio, TX, USA) wurde für Er wachsene und Kinder entwickelt und ist ein vielversprechendes automatisches Punktionssystem zur Etablierung eines intraossären Zugangs (. Abb. 2b ). Es besteht aus einer kleinen akkubetriebenen Handbohrmaschine (Akkukapazi tät für 1000 Einsätze oder 10JahreGaran tie; Listenpreis: EUR 245) und sterilen Ka nülenaufsätzen für den Einmalgebrauch, einschließlich abgewinkelter Infusionslei tung (Listenpreis: EUR 90). Diese haben einen Durchmesser von 15 G und sind zurzeit in 2 Längen erhältlich (15 mm für Kinder ab 3 kgKG bis 39 kgKG und 25 mm für Kinder und Erwachsene ab 39 kgKG).
Das EZIO®Infusionssystem erlaubt dem Anwender, sich auf das exakte Ein führen der Kanüle zu konzentrieren, wäh rend er vom gleichzeitigen Ausführen der Druck und Drehbewegungen entbun den ist. Eine tiefenlimitierende Eindreh begrenzung verhindert eine Penetration der gegenseitigen Kortikalis und stabili siert die Kanüle auf der Hautoberfläche. Eine speziell konfektionierte, gewinkelte Infusionsleitung ermöglicht eine sichere Konnektion ohne Gefährdung der Kanü lenstabilisation im Knochen. Das Einfüh ren der Kanüle in den Knochen dauert erfahrungsgemäß <5 s und ist technisch sehr einfach (Video 3 und 4). Der Druck auf den Knochen ist geringer und die Technik erfahrungsgemäß beim wachen Kind weniger schmerzhaft als bei den ma nuellen Nadelsystemen. In einer kürzlich publizierten Studie an erwachsenen Lei chen hat sich das EZIO®Infusionssystem gegenüber dem manuellen CookNadel system und im Tierversuch gegenüber der „bone injection gun“ (BIG) als das überle gene System erwiesen [7, 49].
Der Kanülenaufsatz besteht aus Chrom stahl und Kunststoff und ist somit MRT kompatibel. Die Bohrmaschine hinge gen ist magnetisch und darf daher nur im
Abb. 2 9 a 18-G-Cook®-Intraossärkanüle mit Dieck-mann-Modifikation (zwei gegenüberliegende Öff-nungen an der Kanülen-spitze). b EZ-IO®-Infusionssystem mit Handbohrmaschine und 15-G-Intraossärnadel für Kinder (3–39 kgKG, Nadellänge 15 mm)
MRT verwendet werden, wenn sie, wie andere magnetische Geräte und Gegen stände, mit einer Sicherungsleine für die Einhaltung des minimalen Sicherheits abstands zum Tomographen ausgestat tet ist.
Intraossäre Punktionstechnik
(Video 1–4)
Für die erfolgreiche, rasche und sichere Anlage einer intraossären Infusion emp fiehlt es sich, folgende Punkte zu berück sichtigen [59]:
F Korrekte Lagerung der Extremität (Unterpolsterung des Beines beim Neugeborenen und Säugling zur Ver hinderung eines Biegebruches; es wird abgeraten, die Hand dafür zu ge brauchen, da bei Perforation der hin teren Kortikalis bei manuellen Na delsystemen oder beim Abgleiten der Nadel die Hand des Anwenders ver letzt werden kann);
F Lokalisieren der richtigen anato mischen Landmarken (ggf. Anzeich nen der Punktionsstelle);
F Desinfektion der Punktionsstelle und Umgebung;
F Lokalanästhesie beim noch wachen Patienten mit 1%igem Lidocain bis zum Periost (Video 4);
F Aufsetzen der Kanüle im 90°Winkel zum Knochen mit Kompression der
Haut mit der Kanülenspitze auf die Knochenoberfläche;
F Einbringen der Intraossärkanüle un ter Druck durch die Knochenkortika lis, bis der Widerstand nachlässt:
1 Cook®Intraossärkanüle: Nadel bis zur 10mmTiefenmarkierung ein bringen. Daumen und Zeigefinger/ Mittelfinger stabilisieren die Na del oberhalb der Tiefenmarkierung und dienen damit als Tiefenbegren zung (Video 1 und 2).
1 EZIO®Intraossärkanüle: Nadel bis zur tiefenlimitierenden Eindrehbe grenzung einbringen (bei Kindern bis 3 Monaten nur gerade bis zum Widerstandsverlust; Video 3 und 4).
F Zeichen der korrekten intraossären Lage der Kanüle sind:
1 deutlicher Widerstandsverslust der Kanüle nach Durchdringen der Kortikalis;
1 die Kanüle steht fest im Knochen;
1 Aspiration von Knochenmark (nichtobligatorisch für das Funktio nieren einer intraossären Infusion, wird von einigen Autoren wegen des Verstopfungsrisikos der Kanüle sogar abgelehnt);
1 Injektion von 5–10 ml RingerLak tat oder physiologischer Kochsalz lösung ohne auftretende Schwel lung (Paravasat).
F Injektion und Anschließen der In fusion:
1 Initial ist der Widerstand bei der Injektion relativ hoch. Im Verlauf ist spontanes Tropfen der Infusion meist möglich. Für die Infusion von größeren Flüssigkeitsmengen ist ein Drucksystem oder eine Infusions pumpe empfehlenswert.
1 Bei forcierter Injektion von Medi kamenten und Flüssigkeiten kön nen wache oder somnolente Pa tienten Schmerzen äußern. Die se werden durch intramedullären Druck am Endost ausgelöst und können mit einer intraossären In jektion von 1–2 ml 1%igem Lidocain wirksam behandelt bzw. vermieden werden.
F Fixation der Infusionsleitung:
1 Auf eine Fixation der Nadel wird generell verzichtet. Verbände um die Einstichstelle sind nicht nötig. Von entscheidender Bedeutung ist die gute Fixation der Infusionslei tung auf der Haut, um ungewollten Zug auf die Intraossärkanüle abzu fangen. Wird die Intraossärinfusion bis in den Aufwachraum belassen, empfiehlt sich eine Schiene. Mecha nische Kräfte auf die Nadel durch Bettdecken und Seitenlagerung des Patienten müssen verhindert wer den.
Vier Videosequenzen zeigen die schritt weise Handhabung der Cook®Intraos särkanüle und des EZIO®Intraossärin fusionssystems:
F Video 1–3 wurden anlässlich diagnos tischer Knochenmarkentnahmen via Cook®Kanüle und EZIO®System in Allgemeinanästhesie aufgenommen und zeigen die intraossäre Punktion bei 3 Säuglingen.
F Video 4 zeigt die Anwendung des EZ IO®Systems unter Lokalanästhesie am wachen Säugling, der dringend ei ne Infusion benötigte.
Die Videos sind auch öffentlich unter http:// www.kindernarkose.ch abrufbar (Copy right UniversitätsKinderkliniken Zü rich).
Abb. 3 8 Notfallmäßige Anlage einer 18-G-Cook®-Intraossärkanüle bei einem 18 Monate jungen Knaben mit akuter Blutung aus der A. palatina am zehnten postoperativen Tag nach Verschluss des harten Gaumens
Vorsichtsmaßnahmen
Eine intraossäre Kanüle darf nur in si tu belassen werden, solange sie unab dingbar ist. Helm et al. [22] empfehlen sogar eine Höchstdauer von 2 h. Wur de die Kanüle bei einem Patienten mit möglicher Bakteriämie, z. B. im Rahmen eines septischen Schocks oder einer in fektbedingten Dehydratation, eingelegt, so ist sie zur Reduktion des Risikos einer Keimbesiedelung möglichst rasch nach Wiederherstellung der Vitalfunktionen durch intravenöse Gefäßzugänge zu er setzen bzw. zu entfernen. Oft gelingt die Anlage eines periphervenösen Venenzu gangs nach Volumensubstitution, oder es kann unter optimierten Bedingungen ei ne zentralvenöse Katheteranlage erfol gen. Ein streng aseptischer Umgang mit der intraossären Infusion analog dem Umgang mit zentralvenösen Kathetern ist zwingend. Eine prophylaktische anti biotische Abschirmung ist hingegen nicht indiziert. Die Extremität, an der die in traossäre Infusion angebracht wurde, ist regelmäßig auf Paravasate, Dislokation der Kanüle und Hinweise auf ein Kom partmentsyndrom zu kontrollieren. Eine leichte Leckage, insbesondere bei manuell eingebrachten Intraossärkanülen und bei Hochdruckinfusion sowie eine Weißver färbung der Haut bzw. der Extremität bei Katecholaminapplikation können vor kommen. Bei sichtbaren Schwellungen ist die Nadel zu entfernen.
Bei der Entfernung der Intraossär nadel wird die Punktionsstelle für 48 h steril verbunden. Gelegentlich können 15GEZIO®Intraossärkanülen beim älteren Kind sehr fest in der Kortika lis festsitzen. Es hat sich bewährt, die se mit einer 20ml oder 50mlSpritze mit LuerLockAufsatz herauszudrehen (Video 5).
Indikationen in der
Kinderanästhesie
Unter Berücksichtigung der Leitlinien zur notfallmedizinischen Versorgung von Kindern des ERC und der AHA [2, 25] sollen im Folgenden die potenziellen Indikationen für eine intraossäre Infu sion in der Kinderanästhesie abgeleitet und besprochen werden.
Kreislaufstillstand beim
anästhesierten Kind ohne
venösen Zugang
Tritt im Rahmen einer Anästhesie, insbe sondere während einer inhalativen Narkose einleitung, ein Kreislaufstillstand auf, und es konnte bis dahin kein sicherer Venenzugang angelegt werden, müssen in dieser Situation die Oxygenierung und Ventilation sicher gestellt und primär eine intraossäre Infusi on angelegt werden. Anästhesiezwischen fälle mit Kreislaufstillstand und anschlie ßend tödlichem Ausgang oder schwers ten zerebralen Schädigungen, wie sie im mer wieder auf kinderanästhesiologischen Konferenzen diskutiert werden, illustrieren eindrucksvoll den Bedarf nach einer früh zeitigen intraossären Infusion, um die be nötigten Notfallmedikamente und flüssig keiten umgehend applizieren zu können.
Akute Blutung in den
Atemwegen beim Kind ohne
venösen Zugang (.
Abb. 3)
Einer der wichtigsten Auslöser, die zur Re naissance der intraossären Infusionstechnik
in der pädiatrischen Notfallmedizin geführt haben, war der tragische Anästhesiezwi schenfall durch Hypoxie eines dreijährigen Kindes mit Tonsillennachblutung. Dieses war aufgrund erfolgloser venöser Kanü lierung inhalativ mit Halothan eingeleitet worden [57]. Ähnlich geartete Anästhesie zwischenfälle sind bis heute leider keine Sel tenheit. Blutungen im Pharynx treten nicht nur nach Tonsillektomien, sondern auch traumatisch bedingt oder nach Kiefer und Gaumenoperationen auf. Die inhalative Narkoseeinleitung ist beim Vorliegen ei ner Atemwegsblutung prinzipiell kontra indiziert. Gelingt es nicht, einen Venenzu gang zu etablieren, so muss präoperativ ei ne intraossäre Infusion in Lokalanästhe sie angelegt werden. Über den intraossären Weg kann dann sowohl eine in solchen Fäl len häufig indizierte Volumensubstitution als auch die Einleitung der Anästhesie er folgen. Beispielhaft zeigt . Abb. 3 den Fall eines 18 Monate jungen Knaben mit aku ter Blutung aus der A. palatina am zehn ten postoperativen Tag nach Verschluss des harten Gaumens. Bei schwerem Schockzu stand und Unmöglichkeit der peripheren Venenpunktion wurde eine 18GCook®
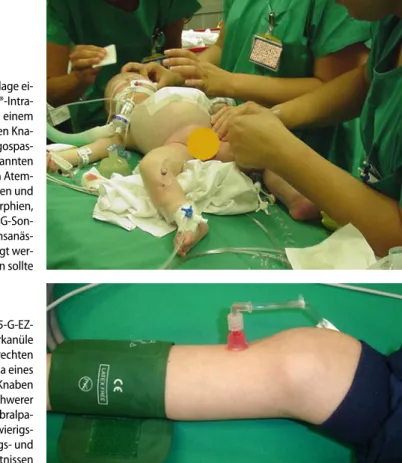
Abb. 4 7 Anlage ei-ner 18-G-Cook®-Intra-ossärkanüle bei einem 9 Monate jungen Kna-ben mit Laryngospas-mus bei bekannten funktionellen Atem-wegsproblemen und diversen Dysmorphien, bei dem eine
PEG-Son-de in Intubationsanäs-thesie eingelegt wer-den sollte
Abb. 5 7 15-G-EZ-IO®-Intraossärkanüle (15 mm) in der rechten proximalen Tibia eines 15-jährigen Knaben (15 kgKG) mit schwerer spastischer Zerebralpa-rese sowie schwierigs-ten Atemwegs- und Venenverhältnissen
869
Intraossärkanüle an der linken proximalen Tibia angelegt. Nach Volumensubstitution mit kristalloiden und kolloidalen Lösungen wurde die Anästhesie intraossär mit Keta min und Atracurium eingeleitet. Anschlie ßend erfolgte die Gabe von ungetestetem 200 ml Erythrozytenkonzentrat der Grup pe 0, Rhneg. durch die Intraossärkanüle. Nach erfolgter operativer Blutstillung wur de ein zentralvenöser Katheter in die V. ju gularis interna rechts eingelegt und die In traossärkanüle entfernt.
Laryngospasmus beim Kind
ohne venösen Zugang (.
Abb. 4)
Gemäß dem jüngsten „Perioperativecar diacarrest“ (POCA)Bericht ist in der Kinderanästhesie der Laryngospasmusdie häufigste Ursache für einen respira torisch bedingten Herzkreislaufstillstand (POCA Registry 1998–2004; [5]). Die Tat sache, dass große Anstrengungen unter nommen werden, nichtdepolarisieren de Muskelrelaxanzien auf die Schnellig keit ihres Anschlagens bei intramusku lärer Applikation zu testen, zeigt deutlich, dass das Problem des schwierigen Venen zugangs beim Kind mit Laryngospasmus von klinischer Bedeutung ist [8, 18]. Lei der wird dabei der Fokus nicht genügend darauf gelegt, einen Gefäßzugang in ad äquater Frist zu etablieren [10], obwohl hier der Status eines akuten vitalbedroh lichen Zustands erfüllt ist und eine intra ossäre Infusion nahe liegt [60]. Die Tat sache, dass beim Laryngospasmus wäh rend der Narkoseeinleitung die Anästhe
sie nicht mehr weiter inhalativ vertieft werden kann, macht bei sinkender Sauer stoffsättigung einen Kreislaufzugang zur Relaxierung unerlässlich und liefert damit die Indikation für eine intraossäre Kanü le. Alternativ zum intraossären Zugang wird von einigen Anästhesisten in dieser Situation noch Succinylcholin intramus kulär verabreicht [1]. Beispielhaft zeigt . Abb. 4 einen 9 Monate jungen Knaben, der mit bekannten funktionellen Atem wegsproblemen und diversen Dysmor phien zur Einlage einer perkutanen en doskopischen Gastrostomie (PEG)Son de in Intubationsanästhesie in die Kli nik eingeliefert worden war. Die Venen punktion erwies sich als äußerst schwie rig. Schließlich konnte eine Skalpvene er folgreich punktiert werden. Im Rahmen der geplanten Extubation kam es zum La ryngospasmus und durch die „Airway“ Manöver zur Dislokation der Venenka nüle am Kopf. Bei sinkender transkuta ner Sauerstoffsättigung und beginnender Bradykardie trotz Maskenüberdruckbe atmung mit 100%igem Sauerstoff wur de eine 18GCook®Intraossärkanüle in die rechte proximale Tibia eingebracht, Atracurium intraossär appliziert und das Kind wieder beatmet sowie reintubiert. Anschließend wurde unter stabilen, ruhi gen Bedingungen ein neuer Venenzugang angelegt.
Kind mit perioperativer
Kreislaufinstabilität ohne
oder mit ungenügendem
venösen Zugang (.
Abb. 5)
Primär zirkulatorische Ursachen für Herz KreislaufStillstände in der Kinderanäs thesie haben an Bedeutung gewonnen [5]. Kinder, die während der Anästhesieeinlei tung aus kardialen Gründen, wegen Hy povolämie oder aufgrund einer Medika mentenüberdosierung kreislaufinstabil werden und bei denen das Legen eines venösen Zugangs nicht rasch gelingt, soll ten die erforderlichen Medikamente und Flüssigkeiten über einen intraossären Zu gang erhalten. In . Abb. 5 wird die in die rechte proximale Tibia eines 15jährigen Knaben eingelegte15GEZIO®Intraos särkanüle gezeigt. Der Junge (Körperge wicht 15 kg) kam mit schwerer spastischer Zerebralparese sowie schwierigsten Atem
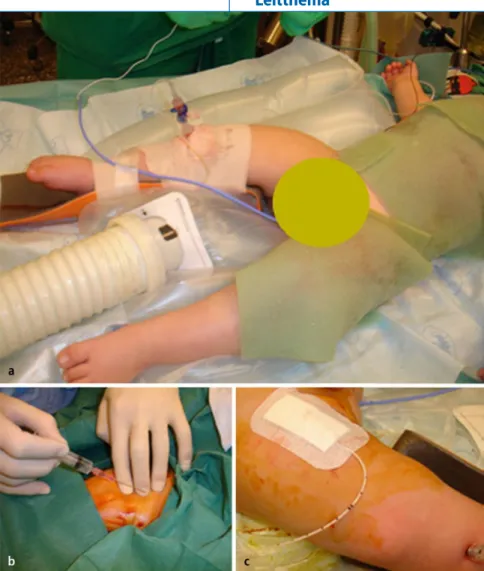
Abb. 6 8 Zweijähriger Knabe mit ausgedehnten Verbrühungen an Rumpf und Extremitäten zur Pri-märversorgung (Debridement und Verband). a 18-G-Cook®-Intraossärkanüle am rechten proximalen Unterschenkel zur präoperativen Schmerz- und Flüssigkeitstherapie. b, c Weitere Flüssigkeitssubstitu-tion und Analgosedierung mit Midazolam und Ketamin via Intraossärkanüle, bevor ein zentralvenöser Katheter in die rechte Femoralvene eingelegt werden konnte; anschließend umgehende Entfernung der Intraossärkanüle
wegs und Venenverhältnissen zur Anlage einer PEG. Bei bekannter schwieriger In tubation erfolgte die Anästhesieeinleitung inhalativ. Nach mehreren erfolglosen peri phervenösen Punktionsversuchen, zuneh mender arterieller Hypotonie und sinken der Herzfrequenz trotz Reduktion der in spiratorischen Sevoflurankonzentration wurde die 15GEZIO®Intraossärkanüle mit der Handbohrmaschine in die rechte proximale Tibia eingebracht, und Adrena lin, Atracurium sowie ein Flüssigkeitsbo lus wurden intraossär appliziert. Nach er folgter fiberoptischer Intubation und An lage der PEG sowie erfolgter Flüssigkeits substitution und Vasodilatation durch Se vofluran konnte auf dem linken, anterio ren Unterschenkel eine 24GVenenkanü le gelegt und die Intraossärkanüle vor Ex tubation wieder entfernt werden.
Ungenügende Venenzugänge und die damit verbundene Hypovolämie stellen eine klinisch relevante Ätiologie der pri mär zirkulatorisch bedingten Asystolie dar [5]. Wenn das Anlegen suffizienter venöser Zugänge nicht gelingt oder be stehende Zugänge durch Dislokation ver loren gehen, ist es auch in dieser Situati on indiziert, zügig einen intraossären Zu gang zu schaffen. Dabei sollten Kanülen der Größen 15 G oder 16 G gegenüber den kleinkalibrigeren bevorzugt werden.
Kind mit akuter Hypovolämie
und/oder Hypothermie ohne
venösen Zugang (.
Abb. 6)
Kinder mit akuten ausgedehnten Ver brennungen oder Verbrühungen können durch die Kombination aus Hypovolämie, Gewebsschwellung und die kühlungsbe dingte Hypothermie eine große Heraus forderung für das Anlegen eines peri phervenösen Gefäßzugangs zur Anästhe sieeinleitung darstellen. Obwohl intra muskulär verabreichtes Ketamin (oder S Ketamin) dem Geübten grundsätzlich die Einlage eines primären zentralen Venen katheters erlaubt, ist ein vorheriger Gefäß zugang aus Sicherheitsgründen und zur sofortigen Volumentherapie erstrebens wert. Auch in dieser Situation sollte bei Unmöglichkeit einer peripheren Venen kanülierung eine intraossäre Infusion an gelegt werden. Einige Autoren befürwor ten in solchen Fällen oder bei schwerer
Hypovolämie mit aussichtslosen Venen verhältnissen eine Intraossärinfusion be reits als Primärtechnik [22, 24, 47].
Potenzielle zukünftige Indikationen
Es besteht eine anhaltende Diskussion darüber, ob in nichtakut vitalbedroh lichen Situationen, wie z. B. beim Vorlie gen eines Ileus oder einer großen Fraktur, zur Einleitung der Anästhesie bei nicht möglichem Legen eines periphervenösen Zugangs überbrückend und zeitlich be grenzt eine intraossäre Infusion ange legt werden sollte [28, 48, 53]. Bei solchen Konstellationen müssen die Risiken einer Aspiration bzw. einer Kreislaufinstabili tät während einer Maskeneinleitung mit dem Risiko einer intraossären Kanülie rung abgewogen werden. Wird ein nicht nüchternes Kind oder ein Kind mit po tenzieller Kreislaufgefährdung durch ei nen kinderanästhesiologisch unerfah renen Arzt versorgt, so sollte die Narko seeinleitung stets über einen sicheren Ge fäßzugang erfolgen. Die Handlungsemp fehlungen des Wissenschaftlichen Ar beitskreises Kinderanästhesie der Deut schen Gesellschaft für Anästhesiologie und Intensivmedizin e.V. (DGAI) ziehen beim nichtnüchternen Kind generell eine intravenöse Einleitung vor [46]. Die intra venöse bzw. intravaskuläre Narkoseeinlei tung ist entscheidender Sicherheitsfaktor beim nichtnüchternen Patienten, und ei ne inhalative Einleitung mit Volatila wird von einigen Autoren als streng kontrain diziert beurteilt [4]. Die Maskeneinlei tung beim nichtnüchternen oder potenzi ell kreislaufgefährdeten Patienten ist dem erfahrenen Kinderanästhesisten, unter stützt durch in der Kinderanästhesie ge schultes Pflegepersonal, vorbehalten. Da bei ist auch für den Erfahrenen beim aus geprägten Ileus höchste Vorsicht bzw. Zu rückhaltung mit der inhalativen Einlei tung geboten. >Intravaskuläre
Narkoseeinleitung
ist entscheidender
Sicherheitsfaktor beim
nichtnüchternen Patienten
Gelegentlich wird intramuskulär verab reichtes Ketamin (oder SKetamin) zur
nachfolgenden zentralvenösen bzw. so nographisch assistierten Venenpunktion empfohlen, doch ist dieses Vorgehen nicht immer erfolgreich und zudem beim Kind mit vollem Magen ebenfalls mit einem Aspirationsrisiko verbunden. In solchen Situationen ist die intraossäre Infusion ei ne zuverlässige, einfache und sichere Al ternative – auch beim wachen Kind (Vi-deo 4). Sie erlaubt allfällige Volumendefi zite vor der Anästhesieeinleitung zu korri gieren und den Patienten sicher intravas kulär einzuleiten. Im Gegensatz zur in traossären Infusion liegt nach der inha lativen oder intramuskulären Einleitung beim nichtnüchternen Kind mit schwie rigen Venenverhältnissen nach wie vor kein Gefäßzugang, sodass der damit ver bundene Zeit und Erfolgsdruck weiter besteht.
Die intraossäre Punktion wird in sol chen semiselektiven Situationen vorbe reitet, kontrolliert sowie ohne Zeitdruck und unter streng aseptischen Kautelen an gelegt, anders als in einer hektischen Not fallsituation in der Notfallmedizin. Ent sprechend kann die niedrige Komplika
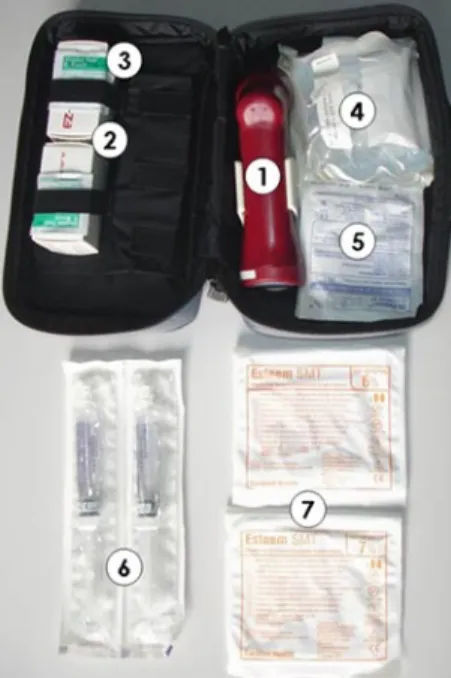
Abb. 7 8 Intraossäres Infusionsset, bestehend aus: 1 1-mal EZ-IO-Handbohrmaschine in Halte-rung, 2 2-mal EZ-IO-Intraossärkanüle für Kinder ab 3 kgKG (15 G, 15 mm), 3 4-mal Desinfektions-tupfer, 4 1-mal intraossäre Kanüle, Modell Cook 18 G mit Dieckmann-Modifikation für Kinder <3 kgKG, 5 2-mal Infusionsanschlussleitungen (gewinkelt), 6 2-mal 10-ml-Fertigspritzen mit 0,9%iger Kochsalzlösung, steril verpackt, 7 2-mal sterile latexfreie Handschuhe (Gr. 6,5/7,5)
871
tionsrate aus der Notfallmedizin noch niedriger erwartet werden. Damit ist die kontrollierte intraossäre Einleitung weni ger risikoreich als die inhalative oder in tramuskuläre Einleitung eines nichtnüch ternen, schreienden Kindes in den Hän den eines mit Kindern wenig vertrauten Anästhesisten.
Die Frage nach einer intraossären In fusion stellt sich auch bei Kindern, bei denen längere Zeit nach der Maskenein leitung immer noch kein peripherve nöser Venenzugang gelegt werden konn te, insbesondere in den Anästhesiebe reichen außerhalb des Operationstrakts (MRT, Ophthalmologie, Audiologie, Herzkatheter, Radiologie etc.; Video und ; [37]). Solche Situationen kommen nicht selten bei chronisch kranken oder herzchirurgischen Kindern vor [16, 30, 31]. Hier gilt es, die vor Ort vorhandenen Möglichkeiten, wie personelle Unter stützung, Sonographie, Transilluminati on, zentrale Venenpunktion etc. sorgfäl tig zu prüfen.
Bei elektiven Eingriffen mit unmög licher venöser Punktion unter Masken anästhesie sowie begründetem Bedarf für eine venöse Infusion, sind die Risiken einer kontrollierten und unter strikt ste rilen Kautelen angelegten intraossären Infusion gegen die Risiken einer prolon gierten Maskenbeatmung beim Säugling mit ihren potenziellen Folgen, wie Ate lektasen, Hyperkapnie, Mageninsuffla tion, Hypothermie etc. abzuwägen. Ge legentlich geraten inhalative Anästhe sieeinleitungen mit schwierigen Venen punktionsverhältnissen im Verlauf außer Kontrolle, insbesondere wenn der suffi zienten Beatmung in solchen Situationen
weniger Beachtung geschenkt wird als den ubiquitä ren intravenösen Punktions versuchen multip ler Helfer. Obwohl die Sonographie auch bei der Punktion der peripheren Venen hilfreich sein kann, ist diese apparativ und auch personell nicht immer überall und jederzeit verfügbar. Bevor in solchen Situa tionen vom we nig Geübten versucht wird, beim Säug ling einen zentralen Venenkatheter zu le gen, sollte er sich vor Augen halten, dass, im Gegensatz zur zentralvenösen, von der peripher angelegten intraossären Infusi on bisher keine punktionsbedingten To desfälle publiziert wurden. In die Über legungen müssen also die zur Verfügung stehende Assistenz, die Wartezeiten des im Operationssaal tätigen Personals und der anschließend geplanten Patienten so wie die personelle und materielle Infra struktur eines eventuell abseits des Ope rationstrakts gelegenen Narkosearbeits platzes einbezogen werden.
Die Indikation für eine semielektive in traossäre Infusion zur Anästhesieeinlei tung beim nichtnüchternen Kind mit Un möglichkeit eines periphervenösen Zu gangs oder beim Kind nach Maskenein leitung mit prolongierten erfolglosen peri phervenösen Punktionsversuchen unter liegt immer einer individuellen Risiko abwägung. Die entsprechende Diskussi on wird sich in Zukunft vermutlich aus weiten. Die Autoren, obwohl geübt in den Techniken der inhalativen Narkoseeinlei tung, der intramuskulären Ketaminanäs thesie sowie der zentralvenösen Punktion, favorisieren in den beschriebenen Situati onen die intraossäre Infusion – nicht zu letzt auch, um den in der Weiterbildung stehenden Assistenzärzten klare, verläss
liche und sichere Konzepte an die Hand zu geben.
Organisatorische Implikationen
In jeder Anästhesieabteilung, in der Säug linge und Kinder elektiv und/oder not fallmäßig anästhesiologisch betreut wer den, muss die entsprechende Ausrüstung zur intraossären Infusionstechnik vor handen und schnell verfügbar sein. Ärzte und Pflegepersonal müssen in der intraos sären Infusionstechnik und in der Hand habung der verfügbaren Systeme regelmä ßig geschult werden.Material
Neben dem intraossären Infusionssystem bedarf es zum Anlegen einer intraossären Infusion steriler Handschuhe, Desinfek tionsmittel, einer Infusionsverlängerung mit Dreiwegehahn, Klebeband zur Fi xierung der Infusionsleitung, Injektions spritzen und physiologischer Kochsalzlö sung. Es hat sich in der Praxis bewährt, gebrauchsfertige Sets zusammenzustel len [40]. Das intraossäre Infusionsmate rial sollte in der Operationsabteilung un mittelbar verfügbar sein. Insbesondere an den Kinderanästhesiearbeitsplätzen soll te es gut sichtbar und griffbereit positio niert werden. Ein Beispiel für ein intraos säres Infusionsset, wie es in der Anästhe sieabteilung der UniversitätsKinderkli niken Zürich an jedem Anästhesiearbeits platz und am mobilen Transportmonitor ständer vorhanden ist, zeigt . Abb. 7. Im MRTZentrum befindet es sich in einer Wandhalterung, an der die EZIO®Hand bohrmaschine mithilfe einer Sicherheits
Abb. 8 8 Intraossäre Infusionssets. a Angebracht an jedem Anästhesiearbeitsplatz, b einschließlich des MRT-Raums,
leine befestigt ist, damit diese nicht in den kritischen Magnetbereich des MRT gera ten kann (. Abb. 8).
Schulung
Ärzte und Pflegende müssen in den Grundlagen der intraossären Infusions technik geschult werden. Eine Beschrei bung der Handhabung und Anwendung des verfügbaren intraossären Infusions systems sowie die Leitlinien zum Einsatz der Intraossärinfusion sollten in der An ästhesieabteilung vorhanden sein.
Praktische Übung
Regelmäßiges Repetieren der Grundla gen der intraossären Infusion und ihrer praktischen Anwendung an geeigneten Übungsmodellen sind wichtig, um im Notfall Material und Technik schnell, si cher und erfolgreich anwenden zu kön nen. Die Hersteller der Systeme Cook®
und EZIO® verfügen über Übungsmate rial, wie Intraossärkanülen und Übungs knochen, die auch für abteilungsinter ne Workshops nützliche Hilfsmittel sind. Durch die Verwendung von Tierknochen (z. B. Pute oder Schaf) können noch realis tischere Kanülierungsbedingungen simu liert werden. Anwendungsbeobachtungen zeigen, dass durch vorherige Übung am Modell eine sehr hohe klinische Erfolgs rate bei der intraossären Kanülierung er zielt wird.
Eine weitere Möglichkeit der prakti schen Anwendung bietet der elektive Ein satz bei Kindern anlässlich der onkolo gischen Knochenmarkdiagnostik. Vieler orts wird bei Säuglingen hierzu die proxi male Tibia punktiert. In den Universitäts Kinderkliniken Zürich ist es daher üblich, dass die Knochenmarkpunktionen in All gemeinanästhesie im Beisein der Onkolo gen durch Mitarbeiter der Anästhesieab teilung durchgeführt werden. Dabei kön nen Cook® oder EZIO®Systeme ver wendet werden (Video 1–3).
Die zeitgerechte und sichere Anwen dung der intraossären Infusion schei tert gelegentlich im klinischen Alltag jedoch nicht nur am fehlenden Materi al oder an unzureichenden manuellen Fertigkeiten, sondern auch an der feh lenden Sicherheit mit den Einsatzindi kationen und an nichtgerechtfertigten übertriebenen Ängsten vor Komplikati onen der hilfreichen Kanülierungstech nik. Durch die Vermittlung klarer Emp fehlungen über den Einsatz der intraos sären Infusionstechnik und szenarienba siertes Training, unter Verwendung ge eigneter Kinderphantome oder simu latoren, können reale klinische Situati onen gezielt sowie authentisch simuliert und damit effektive sowie nachhaltige Trainingsmöglichkeiten geschaffen wer den [12, 40].
Fazit für die Praxis
Analog den internationalen Leitlinien zur pädiatrischen Notfallmedizin sind die In-dikationen für eine intraossäre Infusi-on auf die Kinderanästhesie übertrag-bar. Die intraossäre Infusionstechnik er-laubt es, einfach, schnell und sicher beim akut vital-gefährdeten Kind ohne mög-lichen Venenzugang einen verlässmög-lichen
Gefäßzugang für Medikamente und Flüs-sigkeit zu schaffen. Die Indikation für ei-ne semielektive intraossäre Infusion zur Anästhesieeinleitung beim nichtnüch-ternen Kind mit Unmöglichkeit eines pe-riphervenösen Zugangs oder beim Kind nach Maskeneinleitung mit prolongier-ten erfolglosen periphervenösen Punk-tionsversuchen unterliegt immer einer individuellen Risikoabwägung. Die ent-sprechende Diskussion wird sich in Zu-kunft vermutlich ausweiten. Unmittel-bare Verfügbarkeit des Materials, Schu-lung und regelmäßiges Training sowie klare Regelungen zur Anwendung inner-halb der Anästhesieabteilung sind Vor-aussetzung für einen sicheren und effizi-enten Einsatz.
Korrespondenzadresse
Prof. Dr. M. Weiss
Anästhesieabteilung, Universitäts-Kinder-kliniken Zürich
Steinwiesstrasse. 75, 8032 Zürich, Schweiz markus.weiss@kispi.uzh.ch
Interessenkonflikt. Der korrespondierende Autor gibt an, dass kein Interessenkonflikt besteht.
Literatur
1. Al-alami AA, Zestos MM, Baraka AS (2009) Pedia-tric laryngospasm: prevention and treatment. Curr Opin Anaesthesiol 22:388–395
2. American Heart Association (2005) Part 12. Pedia-tric Advanced Life Support. Circulation 112:167– 187; American Heart Association Guidelines for Cardiopulmonary Resuscitation and Emergency Cardiovascular Care (2005) Part 12. Pediatric Ad-vanced Life Support. Circulation 112:IV167–IV187 3. Arbeiter HI, Greengard J (1994) Tibial bone marrow
infusions in infancy. Pediatrics 25:1–12 4. Becke K, Schmidt J (2007) Das
aspirationsgefähr-dete Kind – Rapid Sequence Induction im Kin-desalter. Anasthesiol Intensivmed Notfallmed Schmerzther 42:624–631
5. Bhananker SM, Ramamoorthy C, Geiduschek JM et al (2007) Anesthesia-related cardiac arrest in children: update from the Pediatric Perioperative Cardiac Arrest Registry. Anesth Analg 105:344–350 6. Biarent D, Bingham R, Richmond S et al (2005)
European Resuscitation Council. European Resus-citation Council guidelines for resusResus-citation 2005. Section 6. Paediatric life support. Resuscitation 67 [Suppl 1]: 97–133
7. Brenner T, Bernhard M, Helm M et al (2008) Com-parison of two intraosseous infusion systems for adult emergency medical use. Resuscitation 78:314–319
Infobox 1
Indikationen
aF Kreislaufstillstand
F Vitalbedrohliche Situationen mit Bedarf für einen Gefäßzugang zur Medikamen-ten- oder Flüssigkeitsgabe
1 Akute Atemwegsblutung (Blutung nach Verschluss einer Lippen-Kiefer-Gaumenspalte oder Tonsillektomie)
1 Laryngospasmus
1 Hämodynamisch instabiles Kind zur/ unter Anästhesie
aNach dem European Resuscitation Council (ERC) und der American Heart Association (AHA), übertragen auf die Kinderanästhesie.
Infobox 2
Absolute bzw. lokale
Kontraindikation
F Fraktur im Punktionsgebieta
F Liegendes Osteosynthesematerial oder ehemalige Osteosynthese im Punktions-gebieta
F Vorausgegangene intraossäre Punktions-versuche (<48 h)a
F Gefäßverletzung proximal der Punktions-stelle
aBei Fraktur oder vorausgegangener Punk-tionen am einen Ende des Röhrenknochens darf am anderen Ende punktiert werden.
8. Denman WT, Kaplan RF, Goudsouzian NG et al (2001) Intramuscular rapacuronium in infants and children: a comparative multicenter study to con-firm the efficacy and safety of the age-related tra-cheal intubating doses of intramuscular rapacuro-nium (ORG 9487) in two groups of pediatric sub-jects. Anesthesiology 94:3–7
9. Doan CA (1922) The circulation of the bone mar-row. Contrib Embryol 67:27–47
10. Donati F, Guay J (2001) No substitute for the intra-venous route. Anesthesiology 94:1–2
11. Drinker CK, Drinker KR (1922) The circulation in the mammalian bone marrow. Am J Physiol 62:1–92 12. Eich C, Russo S, Timmermann A et al (2006) Neue
Perspektiven der simulatorunterstützten Ausbil-dung in Kinderanästhesie und Kindernotfallmedi-zin. Anaesthesist 55:179–184
13. Erb TO, Hampl KF, Frei FJ (1995) An unusual com-plication of intra-osseous infusion during paedia-tric resuscitation. Anesthesia 50:471
14. Fiser DH (1990) Intraosseous infusion. N Engl J Med 322:1579–1581
15. Galpin RD, Kronick JB, Willis RB (1991) Bilate-ral lower extremity compartment syndromes se-condary to intraosseous fluid resuscitation. J Pedi-atr Orthop 11:773–776
16. Gerber AC, Weiss M (2008) Intentional use of intra-arterial medications – the wrong message! Paedia-tr Anaesth 18:894–895
17. Glaeser PW, Hellmich TR, Szewczuga D et al (1993) Five-year experience in prehospital intraosseous infusion in children and adults. Ann Emerg Med 22:1119–1124
18. Goudsouzian N (2003) Do we need a new muscle relaxant in paediatrics? Paediatr Anaesth 13:1–2 19. Hasan MY, Kissoon N, Khan TM et al (2001)
Intraos-seous infusion and pulmonary fat embolism. Pedi-atr Crit Care Med 2:133–138
20. Heinild S, Sondergaard T, Tudvad F (1947) Bone marrow infusion in childhood. Experiences from a thousand infusions. J Pediatr 30:400–412 21. Helm M, Breschinski W, Lampl L (1996) Die
intra-ossäre Punktion in der präklinischen Notfallmedi-zin. Praktische Erfahrungen aus dem Luftrettungs-dienst. Anästhesist 45:1196–1202
22. Helm M, Gries A, Fischer S et al (2005) Invasive Techniken in der Notfallmedizin. Die intraossäre Punktion – Ein alternativer Gefäßzugang in pädia-trischen Notfallsituationen. Anaesthesist 54:49–56 23. Helm M, Hauke J, Bippus N, Lampl L (2007) Die
in-traossäre Punktion in der präklinischen Notfall-medizin. 10-jährige Erfahrungen im Luftrettungs-dienst. Anaesthesist 56:18–24
24. Holder M (1991) Intraossäre Injektion und Infusion im Kindesalter. Notfallmedizin 17:648–652 25. International Liaison Committee on Resuscitation
(ILCOR) (2005) Consensus science with treatment recommendations for pediatric and neonatal pa-tients: Pediatric Basic and Advanced Life Support. Pediatrics 117:e955–e977
26. Iserson KV (1989) Intraosseous infusions in adults. J Emerg Med 7:587–591
27. Joffe M (1990) Blasts in peripheral blood with in-traosseous infusion. Pediatr Emerg Care 6:106 28. Jöhr M, Can U (1993) Pediatric anesthesia without
vascular access: intramuscular administration of atracurium. Anesth Analg 76:1162–1163 29. Jordi Ritz EM, Erb TO, Frei FJ (2005) Vaskulärer
Zu-gang in der Kindernotfallanästhesie. Anästhesist 54:8–16
30. Joseph G, Tobias JD (2008) The use of intraosse-ous infusions in the operating room. J Clin Anesth 20:469–473
31. Joshi G, Tobias JD (2007) Intentional use of intra-arterial medications when venous access is not available. Paediatr Anaesth 17:1198–1202 32. LaFleche FR, Slepin MJ, Vargas J, Milzman DP
(1989) Iatrogenic bilateral tibial fractures after traosseous infusion attempts in a 3 month old in-fant. Ann Emerg Med 18:1099–1101
33. LaSpada J, Kissoon N (1995) Extravasation rates and complications of intraosseous needles du-ring gravity and pressure infusion. Crit Care Med 23:2023–2028
34. Lathers CM, Jim KF, High WB (1989) An investiga-tion of the pathological and physiological effects of intraosseous sodium bicarbonate in pigs. J Clin Pharmacol 29:354
35. Mofenson HC (1988) Guidelines for intraosseous infusions. J Emerg Med 6:143–146
36. Neufeld JD (1993) Comparison of intraosseous, central and peripheral routes of crystalloid infusi-on for resuscitatiinfusi-on of hemorrhagic shock in a swi-ne model. J Trauma 34:422–428
37. Neuhaus D, Engelhardt T, Henze G et al (2009) In-traosseous infusion in children with failed venous access after inhalational induction of anaesthesia. Swiss Med Weekly (in press)
38. Orlowski JP (1984) My kingdom for an intravenous line (editorial). Am J Dis Child 138:803
39. Orlowski JP, Julius CJ, Petras RE et al (1989) The safety of intraosseous infusions: risks of fat and bone marrow emboli to the lungs. Ann Emerg Med 18:1062–1067
40. Pfister CA, Egger L, Wirthmüller B et al (2008) Structured training in intraosseous infusion to improve potentially life saving skills in pediatric emergencies – Results of an open prospective national quality development project over 3 years. Paediatr Anaesth 18:223–229
41. Plewa MC, King RW, Fenn-Buderer N et al (1995) Hematologic safety of intraosseous blood transfu-sion in a swine model of pediatric hemorrhagic hy-povolemia. Acad Emerg Med 2:799–809 42. Rapp HJ, Luiz TH, Kuner S, Waschke KF (1997)
An-ästhesiologisches Management des kindlichen Po-lytraumas. Anaesthesiol Intensivmed 4:191–206 43. Ros SP (1991) Effect of intraosseous saline infusi-on infusi-on hematologic parameters. Ann Emerg Med 20:243
44. Rossetti V, Thompson BM, Aprahamian C (1984) Difficulty and delay in intravascular access in pedi-atric arrest. Ann Emerg Med 13:406
45. Rossetti V, Thompson BM, Miller J et al (1985) In-traosseous infusion: an alternative route of pedia-tric intravascular access. Ann Emerg Med 14:885– 888
46. Schmidt J, Strauß JM, Becke K et al (2007) Hand-lungsempfehlung zur Rapid-Sequence-Induction im Kindesalter. Vom Wissenschaftlichen Arbeits-kreis Kinderanästhesie der Deutschen Gesellschaft für Anästhesiologie und Intensivmedizin (DGAI). Anaesthesiol Intensivmed 48:S88–S93 47. Schoffstall JM, Spivey WH, Davidheiser S (1989)
Intraosseous crystalloid and blood infusion in a swine model. J Trauma 29:384–387
48. Schwartz RE, Pasquariello CA, Stayer SA (1993) Elective use in pediatric anesthesia of intraosse-ous infusion: proceed only with extreme caution. Anesth Analg 76:918–919
49. Shavit I, Hoffmann Y, Galbraith R, Waisman Y (2009) Comparison of two mechanical intraosse-ous infusion devices: a pilot, randomized crossover trial. Resuscitation 80:665–668
50. Simmons CM, Johnson NE, Perkin RM, van Stralen D (1994) Intraosseous extravasation complication reports. Ann Emerg Med 23:363–366
51. Smith R, Davis N, Bouamra O, Lecky F (2005) The utilisation of intraosseous infusion in the resusci-tation of paediatric major trauma patients. Injury 36:1034–1038
52. Spivey WH (1987) Intraosseous infusions. J Pediatr 111:639–643
53. Stewart FC (1992) Intraosseous infusion. Elective use in pediatric anesthesia. Anesth Analg 75:626– 629
54. Tocantins LM, O’Neill JF, Jones HW (1941) Infusi-ons of blood and other fluids via the bone marrow application in pediatrics. JAMA 117:1229–1234 55. Tocantins LM, O’Neill JF (1945) Complications of
intraosseous therapy. Ann Surg 122:266–277 56. Turkel H (1954) Deaths following sternal puncture.
JAMA 156:992
57. Turkel H (1983) Intraosseous infusion. Am J Dis Child 137:706
58. Waisman M (1995) Intraosseous regional anesthe-sia as an alternative to intravenous regional anes-thesia. J Trauma 39:1153–1156
59. Weiss M, Gächter-Angehrn J, Neuhaus D (2007) Intraossäre Infusionstechnik. Notfall Rettungsmed 10:99–116
60. Weiss M, Gerber A (2001) The substitute for the intravenous route. Anesthesiology 95:1040–1041