S w i s s - N O S O
I n f e c t i o n s n o s o c o m i a l e s e t h y g i è n e h o s p i t a l i è r e : a s p e c t s a c t u e l s
Volume 11 N°4, 2004
Editorial
Autres articles
βββββ-lactamases à spectre étendu : implications pour l’hygiène hospitalières ... 29
Efficacité et limites de l’approche
conservatrice de l’infection de
cathéter veineux implantable
Frank Bally, Sion, Christian Ruef, Zürich, Nicolas Troillet, Sion
Cet hiver 2004/05 a déjà connu une épidémie d'infections à Norovirus à l'échelle nationale dont les répercussions ont été très marquées dans de nombreux hôpitaux. L'annonce précoce des premiers cas a permis à quelques-uns de se prémunir à temps. L'un des prochains numéros du Bulletin résumera cette expérience et proposera différentes recommandations et stratégies. Il convient en effet de se préparer au prochain épisode, les infections et les épidémies de plus ou moins large envergure à Norovirus étant relativement habituelles.
Une nouvelle épidémie, provoquée cette fois par le virus de la rougeole, a sévi en Suisse occidentale ; elle ne s'est pas non plus stoppée aux portes des institutions, et certains membres du personnel de santé en ont été victimes. Des hôpitaux ont mis sur pied des campagnes de vérification de l'immunité ou de la vaccination du personnel soignant afin de limiter les risques de transmission aux patients hospitalisés les plus fragiles.
Une troisième épidémie annuelle a atteint la Suisse au cours de ces dernières semaines: la grippe, infection partagée également entre communauté et établissements de santé. Cet événement évoque aujourd'hui plus que jamais la possibilité d'une pandémie à souche de virus recombinant, grippe aviaire, devenue réalité partielle en Asie.
L'un des articles de ce numéro aborde le sujet des bétalactamases à spectre élargi (BLSE). Ce moyen de contre-attaque des bactéries contre les pénicillines et céphalosporines ne constitue pas encore une problématique à large échelle en Suisse.
Or, ces bactéries multirésistantes ont récemment fait leur apparition parmi les victimes rapatriées ou transférées du Tsunami, très souvent colonisées par des bâtonnets Gram négatif producteurs de BLSE. Bien que ce sujet manque d'évidences scientifiques, les auteurs ont néanmoins passé en revue la littérature existante et ont résumé leur propre expérience. Des recommandations sont proposées pour la prise en charge de cette problématique dans les hôpitaux suisses. Un prochain travail reprendra le sujet au plan purement microbiologique.
Tous ces thèmes ont un dénominateur commun: haute probabilité de survenue et potentiel réel de prévention. Il est souhaitable d'y réfléchir en période calme, afin d'établir des recommandations de prise en charge intelligentes et un système d'alerte bien conçu. Avant que la prochaine vague ne nous atteigne…
Introduction
D’excellentes recommandations générales, fondées sur l’évidence, existent pour la prévention et le traitement de l’infection de cathéter intravasculaire (Mermel, Clin Infect Dis 2001;32:1249; O’Grady, MMWR Recomm Rep 2002;51:1). En 1994, Swiss-NOSO a déjà publié une revue sur ce sujet (Widmer, Swiss-NOSO bull 1994;1:12). Celle-ci traitait des infections touchant les cathéters veineux centraux (CVC) standards, à courte durée d’utilisation. Le clinicien hésite généralement moins à sacrifier un tel cathéter, pour l’éventuelle confirmation d’une suspicion d’infection et comme traitement préemptif de celle-ci, qu’un cathéter implanté chirurgicalement, de type port-à-cath, Hickmann, Broviac ou Groshong. Or, une approche conservatrice, tant pour le diagnostic que pour le traitement d’une infection de CVC, est parfois possible. Cet article, focalisé sur les CVC implantables de longue durée d’utilisation, revoit les données de la littérature sur ce sujet et recense les attitudes cliniques possibles. Il est cependant tout à fait clair pour les auteurs que la prévention des infections, notamment par la formation pratique des soignants, reste primordiale (Mermel, Clin Infect Dis 2001;32:1249; O’Grady, MMWR Recomm Rep 2002;51:1).
Physio-pathologie et épidémiologie
La surface de plus de 80% des CVC est rapidement recouverte de fibrine après leur insertion. Ceci facilite l’adhérence de bactéries colonisatrices, capables de produire à leur tour un biofilm qui les protège du système immunitaire et des antibiotiques (Andris, Nutrition 1998;14:427; Costerton, Science 1999;284:1318; Darouiche, J Infect Dis 1994;170:720; Nickel, Antimicrob Agents Chemother 1985;27:619; Pascual, J Hosp Infect 1993;24:211; Passerini, Crit Care Med 1992;20:665). Après 100 jours, la lumière de plus de 90% des cathéters tunnelisés est colonisé (Tenney, Arch Intern Med 1986;146:1949). La survenue d’une infection clinique dépend de l’intensité de la colonisation (Rijnders, Clin Infect Dis 2002;35:1053). La colonisation du CVC peut avoir lieu par les trois voies représentées dans la figure 1. L’invasion intraluminale se fait par la pièce de connexion (hub) ou le perfusat, la contamination extraluminale peut survenir à partir du point de ponction, lors de l’insertion ou secondairement, et par voie hématogène, lors d’une bactériémie d'une autre origine.
La voie d’infection intraluminale est la plus fréquente en ce qui concerne les CVC implantables chirurgicalement, suivie de l’infection du point de ponction s’étendant ou non à la partie sous-cutanée du
Figure 1: Portes d’entrée possibles lors d’infection de cathéter veineux central
dispositif et de l’infection extraluminale intravasculaire, d’origine hématogène (Safdar, Intensive Care Med 2004;30:62). Toutes peuvent être à l’origine d’une bactériémie secondaire. Globalement l’incidence des bactériémies liées aux CVC implantables est de 0.04 à 0.15/100 jours chez l’adulte et peut atteindre 1.4/100 jours chez l’enfant (Mayhall, Curr Clin Top Infect Dis 1992;12:83). L’incidence des infections localisées de la partie sous-cutanée du dispositif varie de 0.03 à 0.14/100 jours pour les systèmes tunnelisés et de 0.02 à 0.09/100 jours pour les systèmes de type port-à-cath (Buchman, J Parenter Enteral Nutr 1994;18:297; Mayhall, Curr Clin Top Infect Dis 1992;12:83). La proportion d’infections intraluminales augmente avec la durée d’utilisation du cathéter (Raad, J Infect Dis 1993;168:400).
Méthodes de diagnostic
La méthode diagnostique de référence pour l’infection de CVC fut décrite par Maki (Maki, N Engl J Med 1977;296:1305). Elle consiste à retirer le cathéter suspect, à rouler ses 4 à 5 derniers centimètres sur une plaque de Pétri et à compter, après incubation, le nombre de colonies bactériennes présentes sur cette plaque. Le seuil diagnostique est fixé à 15 colonies.
Une méthode décrite plus récemment ne nécessite pas l’ablation du CVC. Elle consiste à comparer les délais de détection d’une croissance bactérienne entre l’hémoculture prélevée par le cathéter et celle prélevée au même moment par ponction veineuse. Une détection plus précoce de 2 heures ou davantage dans l’hémoculture provenant du cathéter établit le diagnostic d’infection de ce dernier. Cette précocité reflète la concentration bactérienne initiale plus élevée dans le sang qui provient du dispositif infecté que dans le sang prélevé à distance de celui-ci.
Blot et coll. trouvèrent une bonne corrélation entre cette méthode et la méthode classique de Maki lors de 28 épisodes de bactériémies (Blot, Lancet 1999;354:1071). Ces résultats furent confirmés récemment par Raad et coll. lors de 173 épisodes de bactériémies chez des patients qui n’étaient pas sous traitement d’antibiotique (Raad, Ann Intern Med 2004;140:18). En comparaison avec la méthode de Maki, la sensibilité et la spécificité de la méthode du délai de détection étaient respectivement de 89 et 88%. Cette spécificité était nettement plus basse chez les patients sous antibiotiques (29%), ceci étant attribuable à des résultats souvent négatifs dans ces cas pour la culture du cathéter retiré, alors que l’hémoculture prélevée par le même cathéter avant ablation était néanmoins positive plus de deux heures avant celle prélevée en périphérie. Cette différence pourrait en fait suggérer une sensibilité insuffisante de la méthode de référence.
Bien que Raad et coll. aient étudié une majorité (89%) de CVC standards, à courte durée d’utilisation, la méthode du délai de détection est utilisable également pour les cathéters implantés. Elle impose toutefois certaines limites résumées ci-dessous : 1) Nécessité de disposer d’un automate à
hémocultures détectant la croissance bactérienne en continu et dont tous les laboratoires de bactériologie ne sont peut-être pas pourvus.
2) Impossibilité d’évaluer une différence dans les délais nécessaires à la détection de la croissance bactérienne lorsque les hémocultures ont été pré-incubées et sont détectées positives à leur arrivée au laboratoire.
3) Détection uniquement des infections intra-luminales avec bactériémie.
4) Difficultés d’interprétation lorsque seule l’hémoculture prélevée par le cathéter est positive (contamination ou réelle infection de CVC?). La répétition des prélèvements peut être utile dans une telle situation.
Un groupe britannique de Leeds a étudié une autre alternative permettant de diagnostiquer une infection de CVC sans avoir à ôter celui-ci (Kite, Lancet 1999;354:1504; Bong, J Parenter Enteral Nutr 2003;27:146). Cette méthode consiste en un examen direct du sang aspiré par le cathéter après coloration de Gram ou à l’auramine. Leurs résultats, non confirmés par une étude dans un autre centre, ont montré une bonne corrélation entre cette méthode et celle de Maki.
Efficacité du traitement
conservateur
Le traitement standard de l’infection d’un cathéter intravasculaire consiste à retirer le dispositif et à administrer ensuite des antibiotiques par voie systémique pendant 7 à 14 jours, selon le micro-organisme responsable (Mermel, Clin Infect Dis 2001;32:1249).
Dix-sept études observationnelles ont évalué chez 401 cas (7 à 62 cas par étude, médiane=20 cas) l’efficacité d’un traitement conservateur de l’infection d’un cathéter implantable par application intraluminale d’antibiotiques à haute concentration (technique du verrou), associée ou non à un traitement systémique de durée variable. Ces études non comparatives ont inclu des enfants et des adultes recevant une nutrition parentérale, souffrant de pathologies onco-hématologiques, d’infection par le VIH, ou des dialysés. Globalement le taux de succès du traitement conservateur fut de 81% variant entre 42 et 100% selon les études. Outre les populations étudiées, ces travaux sont aussi hétérogènes en ce qui concerne les critères de diagnostic, les critères d’inclusion (notamment
quant aux risques de complications motivant la non-qualification pour un traitement conservateur), la définition du succès thérapeutique ou la durée du suivi. Ainsi par exemple, les rechutes tardives, dues au même micro-organisme, ne sont pas toujours considérées comme des échecs (Cuntz, J Parenter Enteral Nutr 2002;26:104; Kentos, Clin Infect Dis 1996;23:418). Trois études rapportent des durées moyennes d’utilisation des cathéters après traitement conservateur. Celles-ci sont respectivement de 188 jours (extrêmes : 51-249), 777 jours (210-1610) et 303 jours (104-570) (Krzywda, Infect Control Hosp Epidemiol 1995;16:596; Messing, Clin Nutr 1990;9:220; Rao, J Hosp Infect 1992;22:109). De tels gains semblent intéressants pour les patients.
Domingo et coll. ont trouvé, chez des patients positifs pour le VIH et souffrant d’infections de cathéters implantés, qu’un traitement antibiotique systémique seul, administré par le cathéter infecté mais sans verrou, était moins efficace que le verrou seul ou le verrou combiné au traitement systémique (Domingo, Clin Infect Dis 1999;29:346). En effet, le temps de contact de la perfusion avec le cathéter semble trop bref pour stériliser le biofilm et la rediffusion de l’antibiotique administré par voie systémique dans le dispositif est négligeable (Bastani, Nephrol Dial Transplant 2000;15:1035).
Les premières études démontrant l’efficacité du traitement conservateur visaient des patients bénéficiant d’une nutrition parentérale et ont évalué des durées moyennes de contact de 12 heures du verrou antibiotique avec la lumière du cathéter, de manière à pouvoir poursuivre malgré tout la nutrition durant les heures restantes. La durée totale de traitement par la technique du verrou est habituellement de 2 semaines, mais peut être plus longue (Carratala, Clin Microbiol Infect 2002;8:282; Mermel, Clin Infect Dis 2001;32:1249). Bien que cette technique puisse être suffisante en cas d’infection limitée à la lumière du cathéter, il est habituellement recommandé de la combiner à un traitement systémique de 7 à 14 jours, selon la nature du micro-organisme
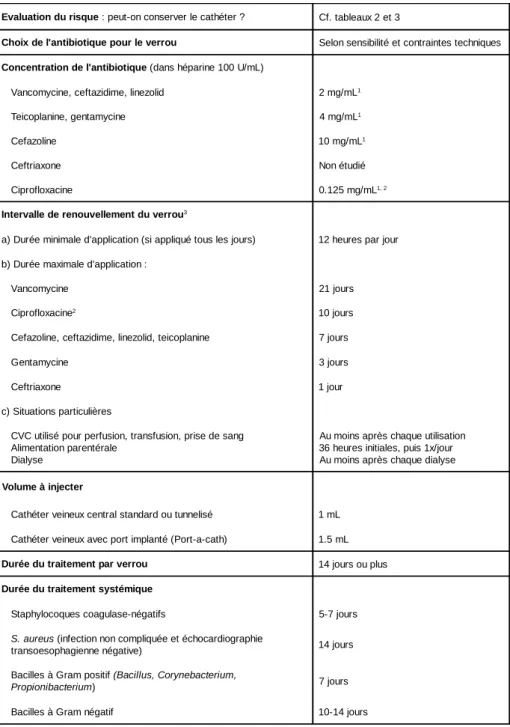
Evaluation du risque : peut-on conserver le cathéter ? Cf. tableaux 2 et 3
Choix de l'antibiotique pour le verrou Selon sensibilité et contraintes techniques
Concentration de l'antibiotique (dans héparine 100 U/mL)
Vancomycine, ceftazidime, linezolid 2 mg/mL1
Teicoplanine, gentamycine 4 mg/mL1
Cefazoline 10 mg/mL1
Ceftriaxone Non étudié Ciprofloxacine 0.125 mg/mL1, 2 Intervalle de renouvellement du verrou3
a) Durée minimale d'application (si appliqué tous les jours) 12 heures par jour b) Durée maximale d'application :
Vancomycine 21 jours Ciprofloxacine2 10 jours
Cefazoline, ceftazidime, linezolid, teicoplanine 7 jours Gentamycine 3 jours Ceftriaxone 1 jour c) Situations particulières
CVC utilisé pour perfusion, transfusion, prise de sang Alimentation parentérale
Dialyse
Au moins après chaque utilisation 36 heures initiales, puis 1x/jour Au moins après chaque dialyse
Volume à injecter
Cathéter veineux central standard ou tunnelisé 1 mL Cathéter veineux avec port implanté (Port-a-cath) 1.5 mL
Durée du traitement par verrou 14 jours ou plus
Durée du traitement systémique
Staphylocoques coagulase-négatifs 5-7 jours S. aureus (infection non compliquée et échocardiographie
transoesophagienne négative) 14 jours Bacilles à Gram positif (Bacillus, Corynebacterium,
Propionibacterium) 7 jours
Bacilles à Gram négatif 10-14 jours
Tableau 1: Aspects importants à considérer lors du traitement conservateur d’une infection de cathéter veineux implanté chirurgicalement.
1 Concentrations maximales compatibles avec l’héparine. Concentrations plus élevées utilisables sans
héparine, par exemple pour les cathéters de Groshong
2 Concentration probablement insuffisante pour être efficace.
3 L’imipénem, l’amphotéricine B liposomale, le cotrimoxazole et la quinupristine-dalfopristine ne restent
stables que quelques heures et sont inappropriés pour la confection d’un verrou
responsable, pour éviter le développement de foyers secondaires (Mermel, Clin Infect Dis 2001;32:1249).
Risques et limites du traitement
conservateur
Krishnasami et coll. ont trouvé des complications chez 11/62 patients hémodialysés (18%) souffrant d’une infection de cathéter traitée par verrou antibiotique (Krishnasami, Kidney Int 2002;61:1136). Il s’agissait de 5 chocs septiques, 3 infections ostéo-articulaires et 3 endocardites. Ce taux de complications correspondait à celui relevé au cours d’une période antérieure, durant laquelle les infections étaient traitées de façon standard, par l’ablation du cathéter. Buchman et coll. rapportent un taux de complications de 10% dans leur étude qui portait sur des patients recevant une nutrition parentérale (Buchman, J Parenter Enteral Nutr 1994;18:297). La plupart des études sur le traitement conservateur des infections de cathéters implantables ne rapportent pas de complications, mais omettent de préciser si celles-ci furent recherchées ou non, ce qui impose naturellement de la prudence dans l’interprétation de leurs résultats.
La présence d’une thrombose pourrait compliquer le traitement et nécessiter l’ablation du cathéter. Comme démontré par phlébographie ou échographie, la majorité des CVC sont recouverts, au niveau de leur portion intra-vasculaire, d’un matériel correspondant vraisemblablement à un thrombus (Mayhall, Curr Clin Top Infect Dis 1992;12:83). Ceci paraît moins fréquemment être le cas pour les cathéters en silicone. 29% des porteurs de CVC suivis prospectivement par van Rooden et coll. à l’aide d’écho-dopplers ont développé une thrombose (van Rooden, Br J Haematol 2003;123:507). Les thrombo-phlébites septiques sont vraisemblablement rares, mais non recherchées systématiquement en cas d’infection. Elles se manifestent comme une infection de CVC compliquée par la tuméfaction du membre supérieur ou du cou, la dilatation des veines collatérales superficielles, une fièvre persistante malgré une antibiothérapie adéquate et d’éventuelles embolies pulmonaires (Mayhall, Curr Clin Top Infect Dis 1992;12:83).
L’endocardite constitue une complication relativement fréquente de la bactériémie due à l’infection d’un CVC si un Staphylococcus aureus est en cause. Bien que les staphylocoques coagulase-négatifs soient typiquement responsables d’endocardites survenant sur des valves prothétiques, ces micro-organismes peuvent également infecter des valves natives et provoquer une endocardite dans 1.2 à 10% des épisodes de bactériémies dont ils sont responsables et faisant suite à l’infection d’un cathéter de
dialyse (Doulton, Kidney Int 2003;64:720). Les signes cliniques d’endocardite sont souvent discrets et l’échocardiographie est nécessaire pour exclure ce diagnostic. Le rapport coût-efficacité du recours systématique à l’échocardiographie transoesophagienne en cas de bactériémies à S. aureus sur infection de CVC a été montré favorable. Le risque d’endocardite suite à des infections de CVC dues à des bactéries à Gram négatif ou à des levures n’est pas connu précisément.
Hormis les risques précités, il est important de connaître les limites du traitement conservateur de l’infection de CVC
implantable. Tout d’abord, l’efficacité du traitement par la technique du verrou a été étudiée quasi exclusivement pour l’infection endoluminale du cathéter, avec ou sans bactériémie. En effet, toutes les études publiées, sauf celle de Buchman et coll. (Buchman, J Parenter Enteral Nutr 1994;18:297), ont exclu les infections du point de ponction et les experts sont unanimes pour recommander l’ablation du cathéter, lorsque la partie extraluminale sous-cutanée du dispositif est infectée (Mermel, Clin Infect Dis 2001;32:1249).
Risque Situation Attitude
A. Faible
Infection à staphylocoque coagulase-négatif, sans critère des classes B et C et en l'absence de valve cardiaque prosthétique Traitement conservateur possible1 B. Moyen ou indéterminé
- Infection du point de ponction
- Infection à bacilles Gram négatifs (entérobactéries) ou positifs (Proprionibacterium, Cornebacterium, Bacillus) - Bactériémie sur CVC standard, non implanté chirurgicalement
Ablation du cathéter en principe recommandée, mais traitement conservateur envisageable dans des situations particulières (cf. Tableau 3)
C. Elevé
- Cathéter qui n'est plus utilisé
- Infections à S. aureus (échocardiographie oesophagienne recommandée)
- Infections à Candida spp.
- Infection de la partie sous-cutanée du dispositif (tunnel ou port)
- Présence d'une valve cardiaque prosthétique (échocardiographie transoesophagienne recommandée) - Complication à distance (endocardite, embolies septiques) - Sepsis sévère ou choc septique
- Thrombose du vaisseau concerné
- Infection sans réponse au traitement conservateur dans les 72 heures (après exclusion d'un autre foyer) - Autres cas d'infection sortant des critères ci-dessus (A-C)
Ablation du cathéter
recommandée dans tous les cas
Tableau 2: Attitude pour le traitement d’une infection de cathéter veineux implanté chirurgicalement en fonction du risque d’échec ou de complications
1Ablation du cathéter si non-réponse clinique à 72 heures (après exclusion d’un autre foyer)
provenant des études publiées ne permet pas de calculer des taux de succès par micro-organisme. En effet, la majorité (52%) des infections recensées dans ces études était dues à des staphylocoques coagulase-négatifs. Bien qu’un traitement conservateur ait été efficace lors d’infections par d’autres micro-organismes tels que des bacilles à Gram négatif, S. aureus ou d’autres coques à Gram positif, l’expérience est limitée pour de tels cas. Messing et coll. rapportent 12 infections dues à des entérobactéries dans une série de 22 cas concernant des patients sous nutrition parentérale (Messing, Clin Nutr 1990;9:220). Toutes furent traitées avec succès par un verrou à l’amikacine, parfois associé à un traitement par voie systémique. Krishnasami et coll. trouvèrent des taux de succès comparables lors du traitement conservateur d’infections par des bactéries à Gram positif ou négatif (28/44 vs. 20/34 ; P=0.8) (Krishnasami, Kidney Int 2002;61:1136). Toutefois, la conservation du cathéter lors d’infections dues à S. aureus est associée à une plus longue persistance de la bactériémie (Cuntz, J Parenter Enteral Nutr 2002;26:104; Krishnasami, Kidney Int 2002;61:1136; Malanoski, Arch Intern Med 1995;155:1161). Quant à Candida spp., des guérisons obtenues sans l’ablation du cathéter ont bien été rapportées, mais restent anecdotiques (Benoit, Clin Infect Dis 1995;21:1286; Viale, Clin Infect Dis 2001;33:1947). En fait, l’échec est fréquent dans ces cas, parfois peut-être en raison de traitements trop courts (Bailey, J Antimicrob Chemother 2002;50:615; Benoit, Clin Infect Dis 1995;21:1286; Johnson, Pediatr Infect Dis J 1994;13:930; Messing, J Parenter Enteral Nutr 1988;12:185). De plus, la mortalité lors de fongémie à Candida sur infection de CVC traitée par amphotéricine B
est plus élevée si le cathéter est laissé en place (Nguyen, Arch Intern Med 1995;155:2429).
Aspects techniques du verrou
antibiotique
Pour être efficace, le verrou doit être appliqué au moyen d’antibiotiques chimiquement stables suffisamment longtemps pour garantir un effet durable dans la lumière infectée du cathéter. Ceci fut étudié in vivo et in vitro pour divers genres de cathéters et divers antibiotiques. Ainsi, la vancomycine reste stable au moins 25 jours in vivo (Haimi-Cohen, Antimicrob Agents Chemother 2001; 45:1565), tandis que les antibiotiques de la classe des béta-lactamines perdent plus rapidement de leur efficacité. Un verrou de ceftazidime doit par exemple être renouvelé tous les 7 à 10 jours et un verrou de ceftriaxone tous les jours. D’autres substances, devenant inactives en quelques heures, sont inappropriées pour la réalisation d’un verrou. Il s’agit par exemple de l’imipenem, du cotrimoxazole, de l’amphotéricine B sous forme liposomale et de la quinupristine-dalfopristine (Tice, Clin Infect Dis 2004;38:1651).
Autre contrainte, pour agir sur les bactéries en phase de croissance lente à l’intérieur d’un biofilm, la concentration de l’antibiotique doit être de 100 à 1000 fois supérieure à la concentration minimale inhibitrice (CMI) de bactéries libres (Krishnasami, Kidney Int 2002;61:1136 ; Pascual, Clin Microbiol Infect 2002;8:256). En règle générale, cette concentration devrait être maximale et au moins égale à 2mg/mL.
Enfin, l’antibiotique servant au verrou doit être compatible avec l’héparine utilisée dans la plupart des cathéters implantables pour
prévenir leur obstruction. Ainsi, une précipitation est observée en présence d’héparine lors de l’utilisation de ciprofloxacine à une concentration supérieure à 0.125 mg/ mL, rendant ainsi cette substance impropre à la confection d’un verrou. La vancomycine peut également être incompatible avec l’héparine, mais seulement à des concentrations supérieures à 2mg/mL (héparine 100 U/ml). Elle peut donc être utilisée à des concentrations efficaces (Anthony, Antimicrob Agents Chemother 1999;43:2074; Haimi-Cohen, Antimicrob Agents Chemother 2001;45:1565). L’héparine peut ne pas être nécessaire en cas de nutrition parentérale avec rinçage quotidien du cathéter ou si celui-ci est du type Groshong, peu utilisé en Suisse à notre connaissance.
Attitude pratique lors de
l’infection d’un cathéter
intraveineux implanté
chirurgicalement
La méthode consistant à comparer les délais de détection de la croissance bactérienne dans l’hémoculture prise par le cathéter par rapport à celle prélevée en périphérie peut confirmer une suspicion d’infection de CVC, sans avoir à retirer celui-ci, sous certaines réserves mentionnées ci-dessus et pour autant que la conservation du cathéter soit justifiée et n’augmente pas le risque de complications. En cas de croissance d’un possible contaminant (par exemple un staphylocoque coagulase-négatif) uniquement dans l’hémoculture du cathéter, un second prélèvement est recommandé pour confirmer le diagnostic.
Les divers aspects importants d’un traitement conservateur sont présentés dans le tableau 1. Le premier d’entre eux est essentiel et consiste à apprécier le risque d’un tel traitement afin de reconnaître les situations dans lesquelles l’ablation reste indiquée. Le tableau 2 fournit les principaux critères servant à cette appréciation. En cas de traitement conservateur, l’administration d’un antibiotique par voie systémique, en sus du verrou, est recommandée. Bien que les risques d’échec soient mal évaluées dans certaines infections, le recours à un traitement conservateur peut toutefois se justifier dans certaines situations, telles que celles présentées dans le tableau 3. La persistance de fièvre, de frissons ou d’hémocultures positives après 72 heures de traitement sont une des indications à l’ablation du cathéter. Des hémocultures prélevées par le cathéter plusieurs jours après la fin du traitement permettent de documenter son efficacité. Une rechute de l’infection après traitement, due au même micro-organisme, constitue une indication à l’ablation du cathéter.
Tableau 3: Situations pouvant justifier le traitement conservateur d’une infection de cathéter implanté chirurgicalement en cas de risque moyen ou indéterminé d’échec ou de complications
βββββ-lactamases à spectre étendu : implications pour l’hygiène
hospitalière
Andreas Tietz, Bâle, Patrick Francioli, Lausanne, Andreas F. Widmer, Bâle
Pour en savoir plus
- Carratala J. The antibiotic-lock technique for therapy of «highly needed» infected catheters. Clin Microbiol Infect 2002;8:282-289.
- O’Grady NP, Alexander M, Dellinger EP, et al. Guidelines for the prevention of intravascular catheter-related infections. Morbid Mortal Wkly Rep 2002;51(RR-10):1-29.
- Mermel LA, Farr BM, Sherertz RJ, et al. Guidelines for the management of intravascular catheter-related infections. Clin Infect Dis 2001;32:1249-1272.
Introduction
Les β-lactamases à spectre étendu (ESBL : Extended-spectrum β-lactamase : dans le texte cette abréviation sera utilisée à la fois pour les enzymes et pour les bactéries à Gram négatif qui produisent ces enzymes) ont une importance particulière en raison de la haute probabilité d’échec lors d’utilisation empirique d’antibiotiques en l’absence d’antibiogramme. Ceci est associé à une morbidité et une mortalité élevées, à une prolongation de la durée de l’hospitalisation et à une augmentation des coûts (Patterson, Chest 2001;119:426, Masterton, J Hosp Infect 2003;55:1).
Au plan de l’épidémiologie hospitalière, il existe beaucoup d’incertitude concernant les mesures de prévention et de contrôle optimales. Celles-ci se déclinent de la manière suivante :
- mesures d’hygiène hospitalière «classiques «
- modifications de l’utilisation des antibiotiques
- décolonisation
- mesures à prendre dans les établissements de long séjour.
Epidémiologie
Les ESBL sont observées avant tout dans les hôpitaux de soins aigus (par ex. dans les
services de soins intensifs ou dans les unités de transplantations) ou dans les établissements de long séjour. Les facteurs de risque pour l’acquisition des ESBL ont été recherchés dans de nombreuses études. Deux groupes de patients sont particulièrement touchés : 1. Patients sévèrement malades et séjournant
dans les hôpitaux de soins aigus. Dans ce cas, les principaux facteurs de risque sont l’utilisation d’antibiotiques, un score APACHE II ou SAPS élevé, un cathéter veineux central ou de multiples opérations. Tous ces facteurs sont des «surrogate markers» pour une charge en soins élevée et pour un risque accru de transmission. Les facteurs de risque pour une acquisition d’ESBL sont identiques à ceux qui prédisposent à l’acquisition d’autres germes multirésistants, tels que les staphylocoques dorés résistant à la méticilline (MRSA). Selon les études, la durée médiane de séjour au moment de l’acquisition varie de 10 à 17 jours (Eveillard, J Hosp Infect 2001;47:116). On relève cependant des cas où l’acquisition est survenue jusqu’à 70 jours après l’admission.
2. Patients débilités séjournant dans des établissements de long séjour. Les ESBL sont retrouvés le plus souvent dans l’urine. Quelques travaux, essentiellement en provenance des Etats-Unis, ont examiné
la prévalence d’ESBL dans les établissements de long séjour. C’est ainsi qu’une étude de prévalence a montré que 46% des résidents d’un établissement médico-social à Chicago étaient colonisés par des ESBL (Wiener, JAMA 1999;281:517). Il n’y a pas de données de prévalence européennes ou suisses pour ce groupe de patients. Dans une étude française datant de 1999, 33 parmi 39 patients porteurs d’ESBL provenaient d’établissements de long séjour (Arpin, Antimicrob Agents Chemother 2003;47:3506).
Une récente étude espagnole montre que les ESBL peuvent également être responsables de colonisation et d’infection communautaire (Rodriguez-Bano, J Clin Microbiol 2004;42:1089). C’est ainsi qu’au cours d’une période de 16 mois, des souches d’E. coli productrices d’ESBL ont été isolées de 49 patients ambulatoires qui remplissaient les critères pour une infection communautaire. Il s’agissait principalement de personnes âgées, avec des infections urinaires et des comorbidités mineures. 22% étaient porteuses d’une sonde à demeure et 57% présentaient une infection urinaire à répétition. 67% des patients avaient reçu un antibiotique dans les 2 mois précédant le diagnostic. 78% des isolats étaient résistants à la ciprofloxacine et 72% au co-trimoxazole. Les facteurs qui prédisaient Fin d’utilisation et/ou ablation proches
· Fin de traitement · Fin de vie
Cathéter indispensable et dont le remplacement est difficile · Pédiatrie
· Haut risque d’hémorragie (thrombopénie, troubles de la coagulation) · Haut risque de complications opératoires en raison de co-morbidités Problème anatomique (vaisseau thrombosé, invasion tumorale, etc.)
la présence de ces E. coli productrices d’ESBL étaient – comme pour les personnes hospitalisées – un âge avancé, un diabète, des infections urinaires à répétition, l’utilisation de quinolones et une hospitalisation au cours de l’année précédente (analyse multivariée).
Voies de transmission
Il existe plus de 50 études ayant utilisé la technique de l’électrophorèse à champs pulsés (pulse field gel electrophoresis : PFGE) ou d’autres méthodes moléculaires pour étudier l’épidémiologie des ESBL. Pratiquement tous ces travaux ont montré que les souches appartenaient à plusieurs clones. Ceci témoigne des modes de transmission suivants : dissémination clonale de plusieurs souches multirésistantes ou transmission d’un plasmide entre plusieurs souches avec sélection polyclonale, ou les deux. Les surfaces ainsi que les objets se trouvant dans l’environnement immédiat du patient ont été montrés comme pouvant être la source d’ESBL. Pourtant, la survie dans l’environnement de la plupart des ESBL n’est que de quelques heures, de telle sorte qu’ils n’y sont que rarement retrouvés. Voici quelques exemples de sources d’infections environnementales :
- gel pour ultrasons (Gaillot, J Clin Microbiol 1998;36:1357)
- bronchoscope (Branger, J Hosp Infect 1997;36:23)
- thermomètre axillaire (Rogues, J Hosp Infect 2000;45:76)
- cafards (Cotton, J Hosp Infect 2000;44:13) - ongles artificiels (Gupta, Infect Control Hosp
Epidemiol 2004;25:210)
- savon liquide (Szabó, J Clin Microbiol 1999;37:4167)
- lavabos (Hobson, J Hosp Infect 1996;33:249)
- baignoires pour bébés (Eisen, J Clin Microbiol 1995;33:713)
Le personnel hospitalier a été à l’origine d’épidémies par le biais d’une contamination des mains ou d’une colonisation du tractus gastro-intestinal (Hobson, J Hosp Infect 1996;33:249; French, J Clin Microbiol 1996;34:358). C’est ainsi que des infirmières porteuses de Salmonella productrices d’ESBL dans le tractus digestif ont été impliquées au cours de 2 épidémies dans des unités de pédiatrie (Mhand, J Clin Microbiol 1999;37:3769; Hammami, Eur J Clin Microbiol Infect Dis 1991;10:641). Selon la littérature, cette situation semble cependant rare et la plupart des épidémies ont pour source des patients colonisés, le personnel jouant plutôt le rôle de simple «transmetteur».
Le rapport entre colonisation et infection par des ESBL semble être au moins de 2:1 (Paterson DL, communication personnelle).
Lors d’épidémies dans des services de soins intensifs, on a observé que 30 à 70% des patients «contacts» pouvaient être colonisés. On a pu montrer que dans plus de 80% des cas une infection était précédée d’une colonisation intestinale (Peña, Antimicrob Agents Chemother 1998;42:53; Lucet, Clin Infect Dis 1999;29:1411). Certains auteurs indiquent que la durée de colonisation peut s’étendre jusqu’à 1 année. Lors d’une épidémie impliquant 6 patients de l’Hôpital de Bâle, la durée du portage d’un E. coli producteur d’ESBL a été de 68 à 365 jours (Witschi A. et al., ICAAC 2001).
Prise en charge
On peut distinguer 3 scénarios épidémiologiques qui impliquent des stratégies différentes :
Scénario 1 : Présence sporadique d’ESBL
En dehors d’une morbidité et d’une mortalité accrues, une telle situation peut conduire à une endémie durable et induire des changements dans les stratégies d’utilisation empirique d’antibiotiques. C’est ainsi que 80% des ESBL sont résistants aux quinolones. De plus, en raison de la nature plasmidique de certains ESBL, il existe un risque de transfert de l’enzyme à d’autres bacilles à Gram négatifs, tels que les Pseudomonas spp. et les Acinetobacter spp. avec les conséquences cliniques et épidémiologiques liées à ces micro-organismes. Cette situation peut être évitée par des mesures appropriées. C’est ainsi qu’une épidémie observée dans l’unité de néonatologie de l’Hôpital de Bâle a pu être contrôlée grâce à l’introduction de mesures de contrôle appropriées. Les principaux éléments de cette intervention sont analogues à ceux utilisés dans la lutte contre MRSA : - isolement de contact des patients colonisés
ou infectés, éventuellement cohortage - surveillance active : frottis rectal de contrôle
chez les patients contacts
- amélioration de l’hygiène des mains - information des institutions qui seraient
amenées à prendre le patient en charge ultérieurement
- recherche d’une source environnementale par des milieux appropriés (par ex. cultures de surface et recherche de portage au sein du personnel (frottis rectal)
- éviction du personnel colonisé
- mesures de décolonisation éventuelles (voir ci-dessous)
La typisation moléculaire est moins utile pour l’investigation d’épidémies à ESBL qu’elle ne l’est pour d’autres germes multirésistants. Les mutations de résistance peuvent se trouver parfois sur le chromosome et ne pas être détectées par PFGE. L’analyse des plasmides
n’est pas optimale en raison de leur instabilité. En cas de transmission à d’autres espèces, le monitoring de l’environnement peut s’avérer très difficile. C’est ainsi qu’il est pratiquement impossible de détecter les ESBL chez tous les bacilles à Gram négatifs d’une culture de selles. Les mesures d’isolement seront traitées plus bas.
Scénario 2 : Epidémie dans des hôpitaux
dans lesquels les ESBL sont endémiques Lucet a montré qu’il est possible de contrôler efficacement des situations dans lesquelles les ESBL sont épidémiques ou hyperendémiques (Lucet, Clin Infect Dis 1999;29:1411). Dans cette étude, les efforts pour améliorer la désinfection des mains n’ont pas suffi. Les pratiques de soins ont été analysées et les déficits des mesures de prévention ont été recherchés. Les patients ont été isolés ou cohortés, et tous les patients «contacts» ont été «screenés». Une attention particulière a été portée à la transmission de l’information aux unités ou hôpitaux dans lesquels le patient était transféré, ainsi qu’à la documentation de la situation dans le dossier.
Les habitudes de prescription des antibiotiques jouent un rôle important. L’association entre l’utilisation de certaines classes d’antibiotiques et la survenue d’ESBL se déduit déjà de la pathophysiologie du développement de la résistance. De nombreuses études épidémiologiques avec différents «designs» ont établi cette association (Dancer, J Antimicrob Chemother 2001;48:463; Paterson, Clin Infect Dis 2004;38:341). L’influence de l’utilisation des céphalosporines de 3ème génération sur la
fréquence des ESBL a été particulièrement étudiée. Cinq études au moins montrent qu’il existe une association significative. Trois autres travaux montrent également une tendance même si la puissance statistique de ces études n’est pas suffisante (Paterson, Clin Infect Dis 2004;38:341). Des études interventionnelles suggèrent également une association : une restriction dans la prescription des céphalosporines de 3ème génération, et même
de toutes les céphalosporines, a conduit à une diminution significative de la fréquence des ESBL (Rahal, JAMA 1998;280:1233; Patterson, Infect Control Hosp Epidemiol 2000;21:455).
Si l’on poursuit ce raisonnement, on peut se poser la question si l’utilisation d’une combinaison de β-lactamines avec des inhibiteurs des β-lactamases peut diminuer la fréquence d’ESBL. Des études cas-témoin ont montré des taux d’ESBL plus bas lors de l’introduction de combinaisons comprenant l’acide clavulanique. Une substitution des céphalosporines de 3ème génération par
piperacilline/tazobactam a également été accompagnée d’une diminution de la fréquence
des ESBL (Patterson, Chest 2001;119:426). Ceci a conduit certains hôpitaux, en particulier aux Etats-Unis et en Grande-Bretagne, à éviter d’utiliser des céphalosporines de 3ème
génération, telle la cefriaxone ou la ceftazidime.
Scénario 3 : Hôpitaux gériatriques et
établissements de long séjour
Des études rétrospectives montrent qu’environ 40% des patients dans les établissements de long séjour ont reçu des antibiotiques dans les mois précédant ces études (Nicolle, Infect Control Hosp Epidemiol 2000;21:537). Dans le contexte de ces établissements, les mesures de contrôle de l’infection sont souvent limitées, et la fréquence de patients atteints d’une polypathologie associée à une incontinence urinaire et des ulcères de décubitus est élevée (McNulty, J Hosp Infect 2003;55:119). Lors d’une épidémie à E. coli et K. pneumoniae productrices d‘ESBL, 31 des 55 patients impliqués provenaient d’établissements de long séjour (Wiener, JAMA 1999;281:517). Les facteurs de risque étaient la présence d’un ulcère de décubitus, une sonde de nutrition entérale percutanée, un mauvais status fonctionnel, ainsi que la prise préalable de ciprofloxacine ou de cotrimoxazole.
Même si les taux de colonisation en Suisse et en Europe sont certainement plus bas qu’ailleurs, les établissements de long séjour constituent un réservoir potentiel important de porteurs d’ESBL. Environ 10% de tous les résidents de ces établissements seront hospitalisés une fois au cours d’une année et peuvent ainsi constituer des sources d’épidémies. Par ailleurs, des patients hospitalisés et porteurs d’ESBL peuvent être source d’ESBL pour des résidents qui seront transférés dans des établissements de long séjour. Dans ce cas, le risque de transmission est toutefois moindre que dans le cadre hospitalier, car les occasions de transmission sont plus rares (Mody, Infect Control Hosp Epidemiol 2001;22:193; Bird, J Hosp Infect 1998;40:243). Une étude prospective réalisée en Ecosse a relevé que 38 porteurs d’ESBL ont quitté l’hôpital pour être pris en charge ambulatoirement. Aucun cas de transmission n’a été observé parmi 886 contacts potentiels (Bird, J Hosp Infect 1998;40:243). Ceci indique que la colonisation par des ESBL n’est pas une contre-indication pour une prise en charge ambulatoire et ne justifie pas la prolongation d’une hospitalisation.
Il n’existe pas de recommandation de prévention qui soit basée sur l’évidence (par des études bien conduites), ce qui explique pourquoi les mesures de prévention peuvent être très différentes au plan international.
C’est ainsi, par exemple, que le groupe de travail néerlandais pour la prévention ne recommande pas de mesures d’isolement dans les établissements de long séjour. En fait, les
ESBL ne sont même pas mentionnés (www.wip.nl).
Mesures d’isolement
La question de savoir si les mesures de contrôle et d’isolement doivent dépendre de la prévalence au niveau national est diversement appréciée. Au Canada où la prévalence des E. coli et de K. pneumoniae productrices d’ESBL se situe clairement en dessous de 5%, les patients ne sont souvent isolés que dans les unités de soins intensifs, et une décolonisation, ainsi qu’un screening des contacts et de l’environnement sont explicitement déconseillés (www.gov.mb.ca/ health/publichealth/cdc/fs/esbl.pdf).
La nature polyclonale des ESBL dans ces hôpitaux est avancée comme argument pour privilégier une politique de restriction de l’utilisation des antibiotiques plutôt que des mesures d’isolement pour contrôler les épidémies. Les ressources nécessaires pour une surveillance active, des mesures d’isolement et de décolonisation sont, selon les épidémiologistes canadiens, mieux investies dans l’implémentation des mesures de prévention de routine, telles que les précautions standard et l’hygiène des mains.
La plupart des cliniques universitaires allemandes recommandent l’isolement de contact lors de colonisation ou d’infection dans les hôpitaux de soins aigus. Les mesures de décolonisation, lorsqu’elles sont mentionnées, ne doivent être envisagées qu’après discussion avec le service d’hygiène hospitalière.
Pour des cas sporadiques, l’Institut Robert Koch recommande l’utilisation de blouses et de gants, de matériel de soins réservé aux patients, ainsi que l’inscription dans le dossier (Witte, Bundesgesundheitsblatt 2003; 46:881). Un isolement de contact n’est recommandé qu’en cas d’épidémie. L’Institut Robert Koch ne mentionne pas les mesures de décolonisation ni celles à prendre dans les établissements de long séjour. Dans les pays à prévalence élevée, tels que les Etats-Unis ou la Malaisie, un isolement de contact et une surveillance active sont recommandés dans pratiquement toutes les situations, quelle que soit le taux d’endémicité (Garner, Infect Control Hosp Epidemiol 1996;17:53). Une révision des recommandations est en cours. Selon les versions de cette révision, un isolement de contact est préconisé d’emblée ou alors seulement après mise en évidence d’une transmission, d’une situation à risque de transmission ou d’une colonisation de plaies ouvertes (Siegel J. Draft: Guideline for Isolation Precautions: Preventing Transmission of Infectious Agents in Healthcare Settings. www.hicpac.org). L’efficacité des mesures d’isolement pour réduire la colonisation et les infections est bien montrée dans un travail
français. Au cours d’une année, la mise en place de mesures d’isolement et d’hygiène des mains ont conduit à une réduction d’incidence de 54.9%, en l’absence de politique de restriction de l’utilisation des antibiotiques (Eveillard, J Hosp Infect 2001;47:116).
Pour les établissements de long séjour, une étude prospective non publiée a montré la valeur de l’utilisation ciblée de gants pour diminuer l’acquisition de germes multirésistants (Trick, 4th Decennial Conference on
Prevention of Healthcare-Associated Infections, 2000).
Bien que les mesures d’isolement et la surveillance active soient au centre des études rapportant un succès dans le contrôle d’épidémies, ces études souffrent de certaines limitations méthodologiques tels que l’absence de groupe contrôle, l’absence d’indépendance entre les diverses interventions et les résultats, ainsi que des suivis limités. Dans une publication de l’OMS, on ne trouve pas non plus de recommandations fermes pour ou contre l’introduction généralisée de mesures d’isolement en présence d’entérobactéries multirésistantes. L’utilité de telles mesures n’est mentionnée que pour les patients à haut risque (Nicolle: Infection control programmes to contain antimicrobial resistance, WHO 2001, www.who.int/emc/amrpdfs/Infection _ c o n t r o l _ p r o g r a m m e s _ t o _ c o n t a i n _antimicrobial_re.pdf).
Lorsque des mesures d’isolement sont décidées, se posent la question de leur durée et des critères pour les stopper. Contrairement aux MRSA, il n’existe pas de donnée concernant le nombre de frottis négatifs requis pour lever un isolement. Là aussi, on extrapole à partir des données collectées avec les MRSA. A Bâle, l’isolement est levé après 3 contrôles négatifs (frottis de gorge et du rectum, ainsi que de tout site dans lequel une colonisation a été détectée). Le problème est qu’il n’existe pas de protocole de screening validé. De plus, on sait que les patients colonisés perdent souvent leur ESBL spontanément en l’espace de quelques mois, même si là aussi des études contrôlées font défaut. C’est la raison pour laquelle les recommandations présentées ci-dessous sont basées sur l’état actuel des connaissances mais doivent être modulées par des experts.
Décolonisation
La décolonisation doit actuellement être encore considérée comme expérimentale, ce qui proscrit la recommandation d’un schéma fixe. La décolonisation intestinale ou pharyngée a été étudiée avec toute une série de substances. L’érythromycine s’est montrée inefficace (De Champs, Intensive Care Med 1993;19:191; Decré, Clin Infect Dis
Scénario Isolement de contact Surveillance active (=dépistage des patients contacts)* "Flagging" (=indications dans le dossier) Screening de l'environnement (=personnel, surface**) Restriction antibiotique dirigée ***
ESBL sporadiques Oui Non** Oui Non Non
ESBL endémiques Oui Oui Oui Non Oui
ESBL épidémiques Oui Oui Oui si contrôle insuffisant Oui
Etablissement de
long séjour Non lors d'épidémie Oui lors d'épidémie selon situation
Tableau 1: Mesures d’hygiène hospitalière recommandées en présence d’ESBL, en fonction de la situation épidémiologique
* frottis de gorge, frottis rectal, urine, plaies
** indiqué dans certaines situations en dehors d’épidémies : unité de néonatologie ou de soins intensifs ***dépendant des résistances spécifiques locales, mais incluant les céphalosporines C3
Swiss-NOSO est publié trimestriellement avec le soutien de l'Office Fédéral de la Santé Publique (OFSP), de la Société Suisse d'Hygiène Hospitalière (SSHH), et de la Société Suisse d'Infectiologie (SSI).
Rédaction Enos Bernasconi (Lugano), Karim Boubaker (OFSP), Patrick Francioli (Lausanne), Kathrin Mühlemann (Berne), Didier Pittet (Genève), Pierre-Alain Raeber (OFSP), Christian Ruef (Zürich), Hugo Sax (Genève), Nicolas Troillet (Sion), Andreas F. Widmer (Bâle)
Mise en page Zo0m Créations (Lutry)
Correspondance Dr Hugo Sax, SPCI, Hôpitaux Universitaires de Genève, Rue Micheli-du-Crest 24, 1211 Genève 14 Internet http://www.swiss-noso.ch
Swiss-NOSO contrôle rigoureusement le contenu du Bulletin afin d’assurer que le choix et le dosage des médicaments et des autres produits cités soient en accord avec les recommandations et la pratique en vigueur à l’heure de la publication. Cependant, en raison des progrès continus de la recherche et de l’état de la science, ainsi que des changements éventuels des réglementations, Swiss-NOSO décline toute responsabilité vis-à-vis d’éventuelles conséquences liées à des erreurs de dosage, d'application ou d' usage de médicaments ou autres produits.
1998;27:834). Des succès relatifs ont été obtenus avec une association de polymyxine, neomycine et acide nalidixique (Brun-Buisson, Ann Intern Med 1989;110:873).
La colistine, la tobramycine ainsi que la norfloxacine ont également été utilisées avec un certain succès (Taylor, J Hosp Infect 1991;17:271; Paterson, Clin Infect Dis 2001;33:126). Toutefois, lors d’une épidémie survenue dans une unité de transplantation hépatique, 3 patients sur 5 ont été à nouveau colonisés au niveau rectal 28 jours après l’administration de norfloxacine (Paterson, Clin Infect Dis 2000;30:473). Il faut mentionner que ces interventions, au cours d’une situation épidémique, peuvent entraîner une diminution de la charge intestinale en bactéries et réduire ainsi les risques de transmission.
La place de la fosfomycine dans cette indication n’a jusqu’ici pas été investiguée. La fosfomycine semble particulièrement appropriée pour une administration orale en dose unique dans le traitement de la cystite non compliquée à E. coli (Schito, Int J Antimicrob Agents 2003;22:79). La fosfomycine atteint des concentrations urinaires élevées. Les mutations de résistances situées sur le chromosome ne semblent pas transmissibles à d’autres micro-organismes (Reeves, J Antimicrob Chemother 1994;34:853). En dépit de l’utilisation de cet antibiotique depuis des décennies, les E. coli multirésistants à d’autres antibiotiques sont encore pratiquement tous sensibles à la fosfomycine (Alhambra, J Antimicrob Chemother 2004;53:1090; Ungheri, J Chemother 2002;14:237). Cependant, les études cliniques contrôlées font défaut. Pour l’instant, la fosfomycine est utilisée aux Etats-Unis pour des cas spéciaux comme thérapie de 2ème choix dans des infections urinaires non
compliquées (Hooton, Clin Infect Dis 2004;39:75).
A l’Université de Bâle, 2 patients porteurs d’infections urinaires à ESBL ont été traités avec succès par la fosfomycine, et de ce fait décolonisés. Par ailleurs, parmi 40 patients
évaluables, 21 ont perdu leur souche d’ESBL dont 14 (35%) par le traitement antibiotique prescrit uniquement, 3 (7.5%) par antibiotique et mesure de décolonisation et 4 (10%) sans aucune intervention (Tietz A, Widmer AF, données non publiées). Le schéma de décolonisation associait le plus souvent la ciprofloxacine et la neomycine, administrées oralement pendant 5 jours. La durée moyenne de colonisation a été de 93 jours (9 à 268 jours). Celle-ci était indépendante du traitement, de la localisation et de l’espèce bactérienne concernée. Il y avait cependant une tendance à une éradication plus facile dans les cas d’infections urinaires non compliquées causées par des E. coli encore sensibles aux quinolones. Le taux de succès chez les patients pour lesquels une décolonisation a été tentée a été d’environ 50% (3 patients sur 6). Parmi les 28 patients traités par des antibiotiques en fonction de l’antibiogramme, les ESBL n’ont plus été retrouvés dans 16 cas. Il apparaît donc qu’une antibiothérapie dirigée efficace est plus importante que des mesures de décolonisation non validées qu’il faut considérer comme expérimentales. Si les micro-organismes devaient persister après une antibiothérapie bien conduite, la consultation de spécialistes en hygiène hospitalière/maladies infectieuses est indiquée. L’usage non contrôlé des
fluoroquinolones est déconseillé en raison du risque de développement de résistances.
Conclusions
Des conclusions fermes ne peuvent pas être formulées en raison des données relativement éparses à disposition. Quelques recommandations sont résumées dans le tableau 1. Les principes suivants doivent être respectés :
- investigation microbiologique dans les «règles de l’art» de tout patient à risque - traitement par des antibiotiques auxquels le
germe est sensible, dans la règle les carbapénèmes
- isolement de contact des patients colonisés ou infectés (indépendamment du degré de continence, de la présence ou non de cathéter et de la situation épidémiologique) - réduction de l’utilisation des antibiotiques, principalement des céphalosporine de 3ème
génération, lorsque les ESBL sont endémiques
- la décolonisation doit pour l’instant être considérée comme une mesure expérimentale. Elle peut être justifiée dans certaines situations, après concertation avec des spécialistes en hygiène hospitalière.