HAL Id: dumas-01908104
https://dumas.ccsd.cnrs.fr/dumas-01908104
Submitted on 29 Oct 2018HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Rhumatisme articulaire aigu : focus immunologique en
zone endémique - cas particulier de la Polynésie française
Sarah El Battah
To cite this version:
Sarah El Battah. Rhumatisme articulaire aigu : focus immunologique en zone endémique - cas parti-culier de la Polynésie française. Sciences pharmaceutiques. 2018. �dumas-01908104�
HAL Id: dumas-01908104
https://dumas.ccsd.cnrs.fr/dumas-01908104
Submitted on 29 Oct 2018HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de
Rhumatisme articulaire aigu : focus immunologique en
zone endémique - cas particulier de la Polynésie française
Sarah El Battah
To cite this version:
Sarah El Battah. Rhumatisme articulaire aigu : focus immunologique en zone endémique - cas parti-culier de la Polynésie française. Sciences pharmaceutiques. 2018. <dumas-01908104>
Université de Bordeaux
U.F.R. DES SCIENCES PHARMACEUTIQUES
Année : 2018
N°82
Thèse pour l’obtention du DIPLOME d’ETAT de DOCTEUR EN
PHARMACIE
Présentée et soutenue publiquement Par EL BATTAH Sarah, Hinarere, Maïmouna
Née le 20/09/1995 à Montpellier Le 26 septembre 2018 à Bordeaux
Rhumatisme articulaire aigu : focus
immunologique en zone endémique – cas
particulier de la Polynésie française
Jury
Madame le Professeur Corinne ARPIN Président
Monsieur le Docteur Mostafa JEBBARI Examinateur
Madame Dorothée DULUC Examinateur
Au président du jury :
Corinne ARPIN, docteur en Pharmacie et professeur universitaire en microbiologie
Merci de l’honneur que vous me faites de présider ce jury. J’ai développé de mon mieux la partie « infectiologie » du rhumatisme articulaire aigu dans cette thèse, qui je l’espère vous
paraîtra suffisante, afin d’honorer votre présence.
Au directeur de cette thèse :
Maria MAMANI MATSUDA, docteur et maître de conférences en immunologie
Merci de m’avoir fait l’honneur d’accepter d’être mon directeur de thèse. Je vous remercie d’avoir toujours su me conseiller et de m’avoir aidée à aller « droit au but » lorsque je me dispersais. C’est avec beaucoup de respect que j’ai suivi tous ces conseils si précieux quant à
la réalisation de cette thèse.
Aux membres du jury :
Mostafa JEBBARI, docteur en Pharmacie et titulaire de la Pharmacie du Thouars
Un énorme merci d’avoir accepté d’être membre de ce jury. Je te remercie de ta gentillesse et d’avoir accepté d’être mon maître de stage lors de mon cursus.
Dorothée DULUC, docteur et maître de conférences en immunologie
Merci beaucoup d’avoir accepté de faire partie de ce jury. Vous trouverez dans ce travail l’expression de mon profond respect.
Aux personnes ayant contribué de près ou de loin à l’élaboration de cette thèse :
Abdellah EL BATTAH, docteur en pharmacie et titulaire de la Pharmacie de Tahaa
Les mots sont insuffisants pour t’exprimer toute ma gratitude et ma reconnaissance. Tes connaissances, ton expérience et ton aide au-delà de mes espérances et à la fois cruciales ont
été sans appels. Un roman de remerciements serait encore tellement marginal comparé à ta nécessité. C’est avec tout le respect du monde que j’espère te rendre fier.
Jean-Marc SEGALIN, médecin responsable du Bureau des Programmes de Pathologies
Infectieuses de la Direction de la Santé de Polynésie française.
Un grand merci pour votre aide précieuse concernant les données sur le RAA en Polynésie française. Je vous remercie également de m’avoir guidée sur les sites à consulter afin
d’enrichir mon manuscrit.
Jean-Michel LEGUEN, docteur en pharmacie et directeur de Médipac
Merci pour ton aide durant ces 6 mois de stage passés à Tahiti.
Marie-Hélène CHATEL, docteur en pharmacie et adjoint à la Pharmacie Maeva
Je te remercie énormément de ton aide dans la réalisation de ma thèse et notamment dans l’élaboration du questionnaire.
Raihau ATGER, professeur d’Anglais
Un énorme merci d’avoir pris le temps de relire ma thèse malgré les délais brefs. Une thèse parfaite pour moi aurait été rédigée avec ton vocabulaire !
Poerangi RICHARD, préparatrice en pharmacie de la Pharmacie Maeva
Merci pour la personne que tu es et pour tout ce que tu m’as appris durant mon stage.
Maeva GUERIN, docteur en pharmacie et titulaire de la Pharmacie Maeva
Merci pour tes précieux conseils et ta gentillesse.
Lucie DUBOST, docteur en pharmacie et titulaire de la Pharmacie Opuhi
A ma famille :
Maman, je n’y serais jamais arrivée sans toi ! Ton soutien sans failles et ton cœur énorme
comme le monde m’ont fait surmonter toutes les difficultés auxquelles j’ai pu faire face. Les mots ne sauraient traduire la chance que j’ai de t’avoir. Merci pour ta présence inconditionnelle et ton amour. Je t’aime infiniment.
Papa, à la fois papa et confrère, tu es mon exemple ! Ton amour est aussi grand que pudique et
c’est comme ça que je t’aime.
Tehei, mon mari, je ne te remercierai jamais assez de ton soutien inconditionnel durant ces 6
années d’études. Merci de m’avoir supportée et de toujours me traiter comme une princesse. Je ne pourrais citer toutes les causes pour lesquelles je devrais te remercier. Merci d’être toi, je t’aime ma vie.
Heimai, ma fille, ma princesse, comme je t’aime ! Maman a été beaucoup prise par ses études
et je suis tellement fière de toi ! Tout ce que je fais c’est pour toi, ma fille chérie.
Adam, mon frère d’amour et j’espère, futur confrère, je te remercie de ta contribution aussi
brève qu’efficace !
Tatie Heipua, merci pour ton efficacité à chaque fois que j’ai besoin de ton aide. Mes beaux-parents, merci de toujours croire en moi.
Il en manque beaucoup mais je remercie toute ma famille du côté de ma mère comme celle du côté de mon père.
A mes amis et collègues :
Randa, une vraie amie, merci pour ta folie et ton amour de sœur. Ces années d’études auraient
été bien plus ennuyeuses sans toi !
Sefika, Sarah et Imen, merci les filles pour votre gentillesse et votre grand cœur ! Hiro, merci pour tous tes conseils et toute ton aide chaque année !
Gaby, merci de m’avoir conseillée ma Gabinette !
Chloé et Mickaël, merci de m’avoir laissée travailler ma thèse quand j’étais à la distri ! Rémi, merci de m’avoir aidée dans le choix de mon sujet de thèse !
Table des figures
Figure 1. Vue au microscope électronique à transmission (X 6500) de streptocoques du groupe A groupés en chaînettes. Source : (25) ... 22 Figure 2. Représentation schématique de la structure morphologique d’un streptocoque
du groupe A. Source : (26). ... 23 Figure 3. Représentation schématique des divers composants antigéniques du
streptocoque ß-hémolytique du groupe A. Source : (28). ... 24 Figure 4. Schéma de la structure de la protéine M et de sa position dans la paroi
bactérienne. Source : (26). ... 25 Figure 5. Détail du positionnement des régions répétées contenues dans la protéine M
Source : (34). ... 26 Figure 6. Représentation schématique de la région chromosomique emm et des loci
contenus dans cette région. Source : (38). ... 27 Figure 7. Détail des régions chromosomiques emm et FCT selon les modèles de
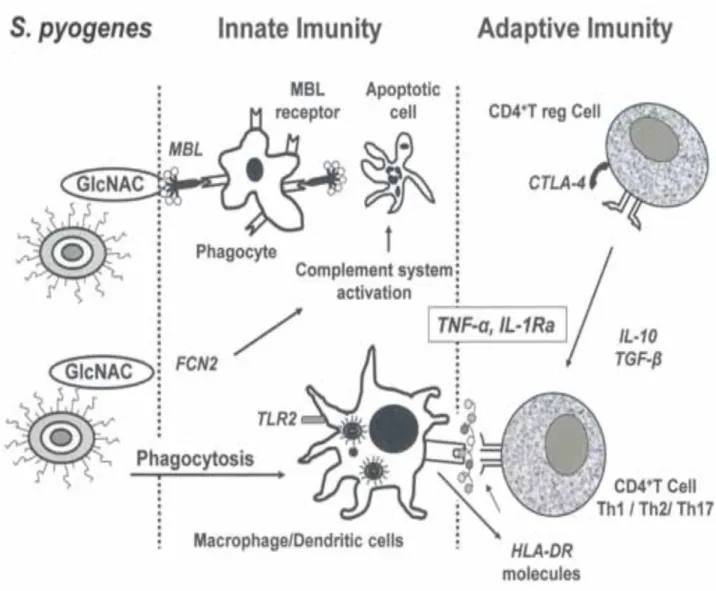
streptocoque bêta-hémolytique du groupe A. Source : (67) ... 36 Figure 8. Représentation schématique de la réponse immunitaire innée et adaptative
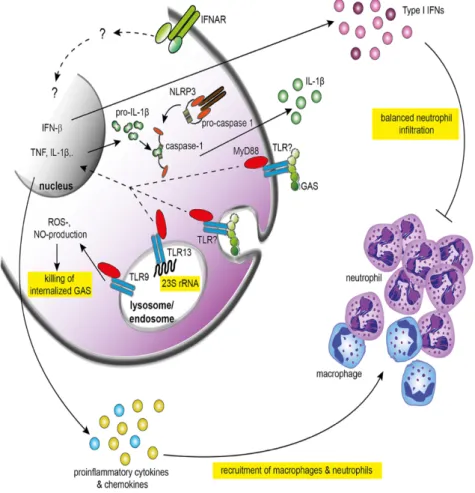
suite à une infection pharyngée à S.pyogenes. Source : (88). ... 44 Figure 9. Reconnaissance du SGA et activation des réponses immunitaires innées.
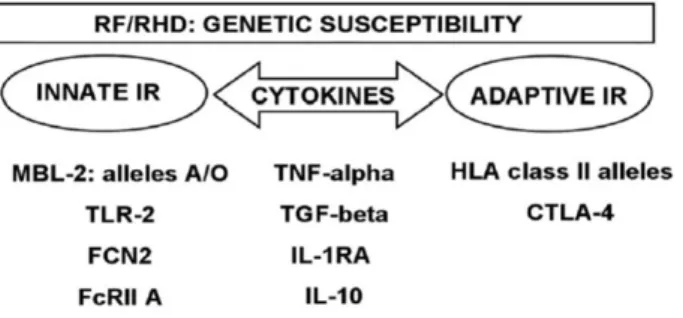
Source : (89) ... 45 Figure 10. Gènes impliqués dans le développement du RAA et de la cardiopathie
rhumatismale chronique. Source : (97). ... 49 Figure 11. L'arsenal des facteurs de virulence exprimés par le SGA pour contrecarrer la
réponse immunitaire innée de l'hôte. Source : (47) ... 51 Figure 12. Schéma représentant la physiopathologie du RAA. Source : (144) adapté de
(145) ... 56 Figure 13. Mécanisme immunopathogénique conduisant à une atteinte cardiaque lors
d’un RAA. Source : (146) adapté de (147) ... 57 Figure 14. Conduite à tenir en cas de rechute de RAA. Source :(183) ... 86 Figure 15. Les archipels de la Polynésie française. Source : (237) ... 96 Figure 16. Prévalence et taux de prévalence du rhumatisme articulaire aigu en Polynésie française de 1994 à 2015. Source : CPS (238) ... 99 Figure 17. Incidence annuelle et taux d'incidence annuels du rhumatisme articulaire en
Polynésie française de 1994 à 2015. Source : CPS (238) ... 99 Figure 18. Les pharmacies d'officine des Îles Sous-le-Vent dans l'archipel de la Société.
Source : (239) ... 100 Figure 19. Les pharmacies d'officine des Îles du Vent dans l'archipel de la Société.
Source : (239) ... 100 Figure 20. La pharmacie d'officine de l'archipel des Tuamotu. Source :(239) ... 101
Figure 22. La pharmacie d'officine de l'archipel des Australes. Source : (239) ... 101
Figure 23. Titres des pharmaciens répondants ... 106
Figure 24. Années d’expérience des pharmaciens d’officine ... 107
Figure 25. Ancienneté des pharmaciens d’officine en Polynésie française ... 107
Figure 26. Nombre de patients atteints de RAA rencontrés chaque année à l’officine . 108 Figure 27. Termes évoqués par les répondants concernant la physiopathologie du RAA ... 109
Figure 28. Principaux facteurs de risque de développer un RAA ... 110
Figure 29. Manifestations cliniques du RAA ... 111
Figure 30. Conseils à un patient ayant récemment été hospitalisé pour un RAA ... 113
Figure 31. Types de pénicillines utilisés dans le traitement d’un épisode de RAA selon les pharmaciens... 114
Figure 32. Anti-inflammatoires utilisés lors d’un épisode de RAA selon les pharmaciens d’officine ... 114
Figure 33. Moyens de prévention secondaire ... 115
Figure 34. L’utilisation de la BPG durant la grossesse et l’allaitement ... 116
Table des tableaux
Tableau 1. Protéines se liant à la fibronectine. Adapté de (45) et (47) ... 29 Tableau 2. Pathologies liées au streptocoque bêta-hémolytique du groupe A. Source :(72)
... 38
Tableau 3. Les adhésines du SGA, d’après (47) et (73) ... 39 Tableau 4. Résumé des critères de Jones révisés de 2015. Source : (173) ... 70
Tableau 5. Résumé des critères cliniques majeurs et l’évaluation diagnostique. Source : (180) ... 72 Tableau 6. Résumé des critères cliniques mineurs et l’évaluation diagnostique. Source :
(180) ... 72 Tableau 7. Seuils des titres d’anticorps anti-streptococciques selon l’âge de l’individu.
Source : (181) . ... 73 Tableau 8. Classement des cardites par sévérité selon les critères échographiques.
Source : (183) ... 74 Tableau 9. Examens complémentaires à réaliser pour orienter le diagnostic. D’après
(185) ... 75 Tableau 10. Diagnostic différentiel selon le tableau clinique. Source : (185) adapté de
(10) ... 76 Tableau 11. Critères de Jones et diagnostic du RAA ... 77 Tableau 12. Modalités d’administration des traitements des symptômes articulaires.
Source : (196). ... 82 Tableau 13. Modalités de l’antibiothérapie de l’épisode de RAA au relais pour la
prophylaxie secondaire. D’après (183). ... 84 Tableau 14. Fréquence d’administration et durée de la prophylaxie secondaire selon la
sévérité de la cardite. D’après : (183) ... 85 Tableau 15. Modalités de suivi et prophylaxie secondaire du patient atteint de RAA.
Source :(209) ... 88 Tableau 16. Répartition des pharmacies d’officine dans les archipels de la Polynésie
Sommaire
1 Introduction ... 13
1.1 Généralités ... 13
1.2 Pourquoi s’intéresser à la Polynésie française ? ... 14
2 Epidémiologie générale et particularités de la Polynésie française ... 16
2.1 Estimations mondiales ... 16
2.2 En Polynésie française ... 17
2.3 Réalité des données épidémiologiques ... 17
2.4 Facteurs de risques ... 18 2.4.1 Individuels ... 18 2.4.2 Génétiques ... 19 2.4.3 Sanitaires ... 19 2.4.4 Socio-économiques et environnementaux ... 19 3 Physiologie/physiopathologie ... 21 3.1 La bactérie ... 21 3.1.1 Morphologie ... 21
3.1.2 Détails des parties antigéniques ... 24
3.1.2.1 Facteurs liés au SGA ... 25
3.1.2.2 Facteurs de diffusion tissulaire ... 31
3.1.3 Milieu de culture ... 34
3.1.4 Habitat et transmission : ... 35
3.1.5 Pouvoir pathogène et maladies provoquées : ... 35
3.2 Réaction immune efficace face à une infection pharyngée à S.pyogenes ... 39
3.2.1 Introduction du SGA dans l’organisme ... 39
3.2.1.1 L’adhérence : ... 39
3.2.1.2 L’internalisation ... 41
3.2.1.3 La prolifération ... 42
3.2.2 Régulation de l’expression des gènes de virulence : ... 42
3.2.3 Mécanisme d’élimination du SGA ... 44
3.2.3.1 Réponse du SI inné ... 45
3.2.3.2 Réponse du SI adaptatif ... 47
3.3 Réaction immune inefficace à une angine à SGA et complication en RAA : ... 48
3.3.1 Susceptibilité de l’hôte : mécanisme additif ... 48
3.3.2 Mécanismes de résistance au SI : ... 51
3.3.2.1 Résistance à l’opsono-phagocytose ... 52
3.3.2.2 Peptides antimicrobiens : ... 54
3.3.3 Echappement à la réponse immune adaptative et mimétisme moléculaire : ... 55
3.3.3.1 Les manifestations cardiaques ... 57
3.3.3.2 Les autres manifestations ... 63
4 Clinique ... 64
4.1 Critères majeurs ... 64
4.1.1 La cardite ... 64
4.1.2 L’arthrite ... 64
4.1.3 L’érythème marginé (6%) ... 65
4.1.4 Les nodules sous-cutanés (1-3%) ... 65
4.1.5 La chorée de Sydenham (2-19%) ... 66
4.2 Critères mineurs ... 66
4.2.3 Arthralgie ... 66
4.2.4 Marqueurs inflammatoires élevés ... 66
4.3 La révision des critères de Jones de 2015 ... 67
4.3.1 Les différents degrés de risque ... 67
4.3.2 Modifications des critères majeurs ... 67
4.3.3 Modifications des critères mineurs ... 68
4.3.4 Récurrences de RAA ... 68
4.3.5 Diagnostic de possible RAA ... 69
5 Diagnostic ... 71
5.1 Clinique : ... 71
5.2 Preuve d’une infection antérieure à SGA : ... 73
25 à 34 ans ... 73
5.3 Echocardiographie : ... 73
5.4 Examens complémentaires : ... 75
5.5 Diagnostic différentiel : ... 76
5.6 Diagnostic en Polynésie française ... 76
6 Traitements ... 78
6.1 Modalités de traitement d’une angine à SGA : ... 78
6.1.1 Antibiotiques ... 78
6.1.2 Prévention primaire ... 79
6.2 Prise en charge d’un épisode aigu de RAA : ... 79
6.2.1 Les médicaments ... 80
6.2.1.1 Anti-inflammatoires ... 80
6.2.1.2 Antibiotiques ... 80
6.2.2 Stratégie de prise en charge médicamenteuse : ... 80
6.2.2.1 Eradication du SGA et début de la prophylaxie secondaire ... 81
6.2.2.2 Prise en charge des symptômes articulaires ... 81
6.2.2.3 Prise en charge de la cardite ... 82
6.2.2.4 Prise en charge de la chorée de Sydenham ... 83
6.3 Relais et prévention secondaire ... 84
6.3.1 Antibioprophylaxie ... 84
6.3.1.1 Sensibilité à la pénicilline ... 86
6.3.1.2 Résistance aux macrolides ... 86
6.3.2 Programme de lutte et spécificités de la Polynésie française ... 87
6.4 Perspectives de traitement : les vaccins ... 89
6.4.1 Généralités : ... 89
6.4.2 Chronologie : ... 89
6.4.3 Préparations à base de protéines M ... 90
6.4.3.1 Région N-terminale ... 90
6.4.3.2 Région C-terminale ... 91
6.4.4 Préparations à base de MrP ... 93
6.4.5 Autres cibles vaccinales ... 94
6.4.6 Les barrières au développement d’un vaccin ... 94
7 Rôle du pharmacien d’officine en Polynésie française - questionnaire ... 96
7.1 Les particularités de la Polynésie française ... 96
7.1.1 Géographie et démographie ... 96
7.1.2 Conditions de vie et climat ... 97
7.2 Réalisation d’une enquête à destination des pharmaciens d’officine ... 103 7.2.1 Problématique ... 103 7.2.2 Objectifs de l’enquête ... 103 7.3 Matériels et méthodes ... 104 7.3.1 Type d’enquête : ... 104 7.3.2 La population visée : ... 104 7.3.3 Durée : ... 104 7.3.4 Le recueil : ... 104 7.4 Résultats ... 106
7.4.1 Caractéristiques socio-professionnelles des répondants : ... 106
7.4.1.1 Titre du pharmacien ... 106
7.4.1.2 Ancienneté en tant que pharmacien ... 106
7.4.1.3 Ancienneté en Polynésie française ... 107
7.4.1.4 Type d’officine ... 108
7.4.1.5 Ampleur du RAA dans l’officine ... 108
7.4.2 Connaissances générales sur le RAA ... 109
7.4.2.1 Physiopathologie du RAA ... 109
7.4.2.2 Facteurs de risques de développer un RAA ... 110
7.4.2.3 Manifestations cliniques d’un épisode de RAA ... 110
7.4.2.4 Complications d’un RAA ... 111
7.4.3 Intervention et conseils du pharmacien d’officine ... 112
7.4.3.1 Conseils en prévention primaire ... 112
7.4.3.2 Conseils en prévention secondaire ... 112
7.4.4 Connaissances sur les traitements et la prophylaxie secondaire ... 113
7.4.4.1 Prise en charge d’un épisode de RAA ... 113
7.4.4.2 Moyens de prévention de complication du RAA en CRC ... 114
7.4.4.3 Dosage de BPG utilisé dans la prévention secondaire du RAA ... 115
7.4.4.4 Effets indésirables les plus fréquents de la BPG ... 115
7.4.4.5 Surdosage de BPG ... 116
7.4.4.6 L’administration de la BPG aux femmes enceintes ou allaitantes ... 116
7.4.4.7 Alternative à l’administration IM de la BPG ... 117
7.4.4.8 Alternatives en cas d’allergies aux pénicillines ... 117
7.5 Discussion ... 118
Liste des abréviations
RAA Rhumatisme articulaire aigu
SGA Streptocoque bêta-hémolytique du groupe A
CANVAS Coalition to Accelerate New Vaccines Against Streptococcus CRC Cardiopathie rhumatismale chronique
Pf Polynésie française
CPS Caisse de Prévoyance Sociale TDR Test de diagnostic rapide
MSCRAMMs Microbial surface components recognizing adhesive matrix molecules AHA American Heart Association
1 Introduction
1.1 Généralités
Le rhumatisme articulaire aigu (RAA) est une maladie résultant d’une réaction auto-immune acquise inappropriée. C’est une complication inflammatoire retardée d’une infection pharyngée à un streptocoque bêta-hémolytique du groupe A (SGA) non, mal ou insuffisamment traitée (1,2).
C’est à dire :
-‐ Pour laquelle il n’y a pas eu de traitement,
-‐ Due à un mauvais choix du traitement antibiotique
-‐ Due à une erreur de dosage et/ou posologie et/ou durée de traitement, -‐ Due à un défaut d’observance du traitement antibiotique prescrit.
Le RAA se développe 2 à 3 semaines après le début de l’infection à S. pyogenes (3). Elle peut provoquer des atteintes articulaires, neurologiques et cutanées réversibles mais également une atteinte cardiaque irréversible conditionnant la sévérité du RAA.
Le streptocoque b-hémolytique du groupe A est une bactérie pathogène spécifique, strictement humaine. Les porteurs sains représentent 5% de la population (4). C’est le premier agent bactérien responsable d’angine (20% des angines érythémateuses ou érythémato-pultacées, tout âge confondu) (4). Si on regarde de plus près, la fréquence du SGA dans ce type d’angine est de 25 à 40% chez les enfants et 10 à 25% chez les adultes.
Le mot angine vient du grec « angere » qui signifie serrer ou étrangler (quelque chose qui fait mal). L’angine se caractérise par une inflammation douloureuse d’origine infectieuse des amygdales et/ou de l’oropharynx (4). Il s’agit d’une des infections à S. pyogenes les plus fréquentes avec un pic d’incidence de 5 à 15 ans. Les angines sont rares avant 3 ans et exceptionnelles après 45 ans (4). En France l’incidence de l’angine est d’environ 9 millions de cas par an (4).
Les angines sont le plus souvent bénignes et évoluent de façon favorable en 3-4 jours. Cependant elles peuvent se compliquer, les complications sont uniquement le fait du SGA : les souches rhumatogènes peuvent ainsi provoquer un RAA (4). Le RAA est une maladie de type
l’auto-tolérance sont mal connus. Ce qui reste certain, c’est que cela implique de multiples facteurs, dont l’infection en elle-même (5). Le mimétisme moléculaire entre les épitopes antigéniques du streptocoque et ceux du soi est un argument pouvant justifier le rôle déclenchant de l’infection dans le RAA (5). L’étude du lien entre l’infection pharyngée à S.
pyogenes et le développement du RAA semble donc pertinente.
La connaissance de la physiopathologie de cette maladie en lien notamment avec le mécanisme d’action et la morphologie de la bactérie pourrait éclairer d’éventuelles perspectives thérapeutiques telles que les vaccins. Des études récentes ont été faites à ce sujet (6). On peut ainsi citer le CANVAS (Coalition to Accelerate New Vaccines Against Streptococcus) : un programme de développement d’un vaccin contre le streptocoque créé par l’Australie et la Nouvelle-Zélande (6).
Il s’agit également d’une maladie pouvant se compliquer en cardiopathie rhumatismale chronique (CRC). Cette CRC est à l’origine de la gravité du RAA ; on peut éviter sa survenue par la prévention secondaire, qui a donc toute son importance. Le RAA reste un problème de santé publique majeur dans les pays en développement et les pays d’outre-mer.
En effet le RAA et les CRC sont les maladies cardiovasculaires les plus fréquentes chez les enfants et jeunes adultes dans les pays en développement (3).
1.2 Pourquoi s’intéresser à la Polynésie française ?
La Polynésie française (Pf) reste très largement touchée par cette maladie, avec une incidence qui reste bien supérieure à l’incidence moyenne mondiale.
Dans les pays en zone d’endémie tels que la Polynésie française, l’administration de la prévention secondaire est intégrée dans un programme de lutte contre le RAA(3). En effet, en Polynésie, le RAA est considérée comme maladie endémique de gravité majeure à caractère prioritaire depuis le 3 mars 1988 (7). L’éducation sanitaire a une place majeure dans ce programme (3).
patients. Il semble intéressant de faire un état des connaissances des pharmaciens d’officine de Polynésie française sur le RAA.
Cette thèse se focalisera sur les 3 points suivants : -‐ Les mécanismes immunologiques du RAA,
-‐ L’avancée dans la recherche d’un vaccin contre le S. pyogenes,
-‐ La place des pharmaciens d’officine dans l’éducation sanitaire des patients à risque et atteints de RAA en Polynésie française.
2 Epidémiologie générale et particularités de la Polynésie
française
Le RAA reste un problème majeur de santé publique dans les pays en développement et dans les collectivités d’outre-mer. Des zones où justement les données épidémiologiques manquent (3). C’est un fardeau mondial, prédominant dans les pays à faible revenu (8) où la CRC demeure une des causes majeures de morbidité et mortalité (5).
Le RAA présente un pic d’incidence chez les enfants de 5 à 15 ans et est rare après 30 ans. Environ 60% des individus atteints de RAA en zone d’endémie développent par la suite une CRC (9,10).
2.1 Estimations mondiales
En 2005, on estimait le nombre d’individus atteints de CRC entre 15,6 et 19,6 millions (8)dont
plus de 2,4 millions étaient des enfants de 5 à 14 ans dans les pays en développement. Il y avait 282000 nouveaux cas de CRC et 233000 décès annuels (8). Environ 350000 décès par an étaient imputés au RAA ou à la CRC (8).
L’incidence du RAA était de 471000 cas par an, la plupart des cas étant des enfants et adolescents entre 5 et 15 ans.
Le taux d’incidence annuel dans cette tranche d’âge étant de : -‐ 10 pour 100000 dans les pays développés
-‐ 374 pour 100000 dans le Pacifique (8)
La prévalence de la CRC variait en fonction des régions du globe avec une haute prévalence : -‐ En Afrique sub-saharienne avec 5,7 cas pour 1000
-‐ Dans les îles du Pacifique et les minorités indigènes d’Australie et Nouvelle-Zélande : 3,5 cas pour 1000
-‐ En Asie du Sud : 2,2 cas pour 1000 (8)
En 2010, au moins 34,2 millions de personnes vivaient avec une CRC. On estimait ainsi que
10,1 millions d’années de vie en bonne santé seraient perdues (11).Enfin, 275000 décès annuels étaient attribués au RAA avec une prédominance dans les pays à revenu faible ou intermédiaire (12).
Le Pacifique, comme le témoignent l’incidence et la prévalence, est donc l’une des zones les plus touchées au monde.
2.2 En Polynésie française
La Polynésie française est une zone où le RAA est endémique. Selon les bases de données locales, comme celles de la Caisse de la Prévoyance Sociale (CPS), en 2015 :
-‐ La prévalence du RAA était de 3502 cas, -‐ 158 nouveaux cas ont été diagnostiqués.
Ces données sont probablement sous-estimées, de nombreux cas ne seraient pas déclarés.
2.3 Réalité des données épidémiologiques
Les données épidémiologiques sont mal documentées dans les pays à revenu faible ou intermédiaire où les CRC sont fréquentes. Il est difficile d’avoir des données précises au niveau mondial sur le RAA et les CRC car le diagnostic du RAA reste difficile dans de nombreuses régions du globe.
Ainsi, l’incidence et la prévalence du RAA sont très souvent sous-estimées. En effet, les données sont variables ou faibles dans les pays pauvres où les cas de RAA et CRC sont souvent les plus importants (13).
Les causes de ce décalage pourraient être : un manque d’infrastructures pour la surveillance de la maladie ou encore un nombre insuffisant de cas de RAA recensés par les services de santé par rapport à la réalité (14).
En effet, certaines personnes atteintes de RAA choisissent de ne pas se faire soigner ou ne sont pas diagnostiquées comme ayant un RAA par le personnel de santé.
Les défauts de diagnostic peuvent arriver du fait :
-‐ De connaissances insuffisantes du RAA par le médecin
-‐ D’une inaccessibilité aux outils et examens facilitant le diagnostic
-‐ D’un nombre important de cas de RAA infra-cliniques, atypiques dans les pays endémiques (14).
2.4 Facteurs de risques
2.4.1 Individuels
L’âge en premier lieu : le RAA touche principalement les enfants âgés de 5 à 15 ans (9). L’épisode initial de RAA peut survenir un peu avant (mais rare avant 3 ans). Les épisodes récurrents ou rechutes surviennent en général plus tard : chez des enfants plus âgés et jeunes adultes. Les CRC, qui sont souvent le résultat de dommages cumulatifs, surviennent plus tard avec un pic de prévalence vers les 20 à 30 ans (9). La prévalence de la CRC augmente avec l’âge (9)avec une survie variable selon l’atteinte valvulaire, l’accès et l’adhésion au traitement (8,15).
Le genre : l’incidence du RAA est la même chez l’homme et la femme, cependant le risque de développer une cardiopathie cardiaque rhumatismale est 1,6 à 2 fois plus élevé chez la femme (9,16). Diverses causes peuvent être mises en évidence :
- Une susceptibilité plus importante des femmes à développer une réponse auto-immune suite à une infection par S. pyogenes.
- Une exposition au S. pyogenes des mères élevant leur(s) enfant(s), donc un risque plus important de développer une infection à SGA.
- La CRC peut se manifester et/ou s’aggraver pendant la grossesse (17,18). - L’implication de facteurs intrinsèques, hormonaux.
2.4.2 Génétiques
Une prédisposition génétique est suspectée de jouer un rôle dans le développement du RAA. Certaines molécules du système d’histocompatibilité (HLA) responsables de la présentation de l’antigène aux lymphocytes T semblent associées au RAA mais aucun haplotype spécifique n’est clairement identifié (10).
2.4.3 Sanitaires
Les facteurs liés au système de santé tels que (19): -‐ Le manque de ressources pour les soins de santé,
-‐ Le manque de connaissance du RAA par les professionnels de santé, -‐ La sensibilisation insuffisante de la population sur la maladie.
Cela engendre potentiellement (19):
-‐ Des diagnostics et traitements inappropriés des angines à SGA, donc un risque augmenté de RAA
-‐ Un diagnostic manqué de RAA, donc plus de risques de rechutes
-‐ Une administration inappropriée de la prophylaxie secondaire, donc une augmentation du risque de CRC.
Il est donc primordial d’avoir un programme local de lutte contre le RAA dans les pays en zone d’endémie. Ceci est le cas de la Polynésie française.
2.4.4 Socio-économiques et environnementaux
La prévalence du RAA et de sa complication, la CRC, a considérablement diminué dans les pays développés. Ceci grâce à l’amélioration des conditions de vie, des soins de santé et l’usage des antibiotiques (3).
Il est cependant à noter que le RAA reste endémique chez certaines populations autochtones des pays développés. C’est le cas des maoris de Nouvelle-Zélande et des aborigènes d’Australie (6). Ces inégalités pourraient s’expliquer par des conditions de vie ou encore des susceptibilités génétiques différentes.
Les facteurs socio-économiques et environnementaux en faveur d’une plus grande exposition au S. pyogenes sont : la pauvreté, la précarité, le surpeuplement et la promiscuité, les mauvaises conditions de vie, la malnutrition, l’accès aux soins limité (20).
La multiplication bactérienne et la persistance du SGA sont ainsi favorisées. Cela aboutit à une propagation rapide et une augmentation de l’incidence des angines à SGA. On a ainsi une potentielle augmentation du risque de RAA et de ses récurrences (19).
Le climat tropical a également une implication dans la multiplication bactérienne du streptocoque du groupe A (3).
3 Physiologie/physiopathologie
Le RAA et la CRC représentent un modèle convaincant de maladie auto-immune provoquée par une infection dès lors que celle-ci est prouvée (5). Toutefois, lors d’un épisode de RAA, on remarque l’absence de signes d’infection dans les tissus atteints. En effet, au niveau des articulations, par exemple, le liquide synovial montre une inflammation mais est stérile. Cependant, malgré l’absence de preuves d’implication directe du SGA dans les tissus affectés des patients avec un RAA, plusieurs arguments laissent à penser que le S. pyogenes a un rôle indirect dans l’initiation de cette maladie.
En effet :
-‐ Les épidémies de RAA suivent de près les épidémies de pharyngites streptococciques (21).
-‐ Un traitement antibiotique adéquat et bien mené de pharyngites à SGA diminue de façon significative le risque de complication en RAA (22).
-‐ Une antibioprophylaxie appropriée et suivie correctement prévient la récidive de RAA et sa complication en CRC (23).
-‐ La plupart des patients ayant eu un épisode de RAA ont des concentrations élevées d'anticorps anti-streptococciques (streptolysine "O" et DNAse B), qu’il y ait eu une angine récente ou pas (24).
Dans cette partie, il s’agira de démontrer le lien entre une infection pharyngée à SGA et le développement du RAA.
3.1 La bactérie
3.1.1 Morphologie
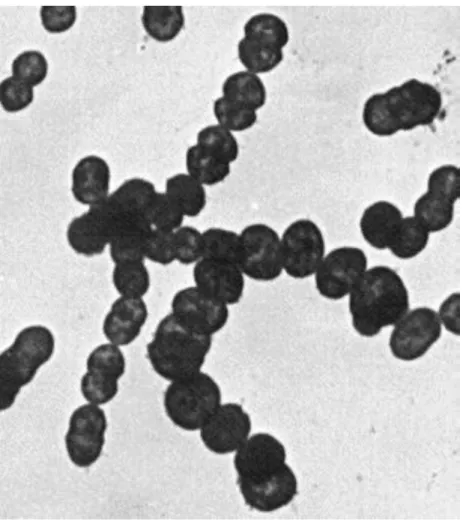
Le streptocoque bêta-hémolytique du groupe A ou Streptococcus pyogenes appartient à la famille des Streptococcaceae. Il se présente sous la forme de cocci Gram positif groupés en chaînettes au microscope, comme on peut le voir dans la figure 1.
Figure 1. Vue au microscope électronique à transmission (X 6500) de streptocoques du groupe A groupés en chaînettes. Source : (25)
Si l’on s’intéresse de plus près à la structure cellulaire bactérienne :
- A l’extérieur de la paroi : il y a une capsule d’acide hyaluronique qui tapisse la surface bactérienne ; elle n’a pas de propriétés antigéniques mais son aspect mucoïde confère une forme de virulence en s’opposant à la phagocytose.
- Au niveau de la paroi : on retrouve de l’extérieur à l’intérieur : les protéines de surface, le polysaccharide C puis le mucopeptide (6).
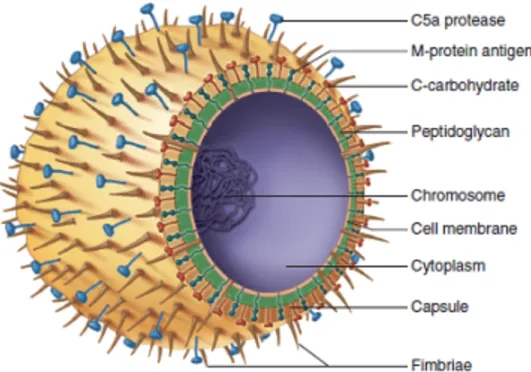
Figure 2. Représentation schématique de la structure morphologique d’un streptocoque du groupe A. Source : (26).
La capsule d'acide hyaluronique
C’est une couche de glycosaminoglycane dense entourant les bactéries ; elle est essentielle pour la résistance à la phagocytose et peut également jouer le rôle d’adhésine (27).
La couche protéique
Elle contient les protéines de surface permettant la fixation du SGA aux muqueuses. Le protéome de la paroi du SGA compte de nombreuses adhésines permettant des interactions avec de multiples composants de l’hôte. Ceci permet à la bactérie de coloniser divers sites tissulaires.
Le polysaccharide ou polyoside C
C’est une structure propre aux Streptococcaceae, il s’agit d’un polymère de sucre dont la variation antigénique est à la base de la classification des sérogroupes des streptocoques bêta-hémolytiques (groupes A à V) décrite par R. Lancefield. Il se constitue d’une répétition d’unités de rhamnose captées par des molécules de N-acétylglucosamine. Certains patients avec un RAA à localisation cardiaque ont des taux élevés et persistants d’anticorps anti polysaccharides C (ils ne sont pas retrouvés dans d’autres infections streptococciques). C’est également ce polyoside C du sérogroupe A qui est identifié dans les tests de diagnostic rapide (TDR) des angines.
Le peptidoglycane ou mucopeptide
C’est une structure composée de la répétition d’unités d’acide muramique et de N-acétylglucosamine. Ce réseau épais de peptidoglycane confère la rigidité de la paroi du SGA. De plus, il constitue une cible d’action des bêta-lactamines qui agissent sur les protéines liant les pénicillines (PLP). Ces PLP sont des enzymes nécessaires à l’assemblage du peptidoglycane via leur action sur le dipeptide D-Ala-D-Ala. Les bêta-lactamines vont bloquer leur action, inhibant ainsi la synthèse du peptidoglycane.
3.1.2 Détails des parties antigéniques
Divers constituants de la paroi du streptocoque interviennent dans les caractéristiques antigéniques, la virulence, la classification et la physiopathologie des infections streptococciques et post-streptococciques (10). Un schéma représentant les facteurs antigéniques du SGA est retrouvé dans la figure 3.
3.1.2.1 Facteurs liés au SGA
3.1.2.1.1 Protéine M :
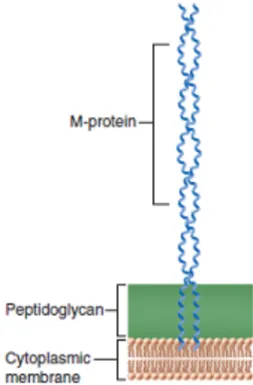
La protéine M est une protéine de surface, identifiée en 1927 par R.Lancefield (29).Il s’agit d’un dimère constitué de 2 chaînes polypeptidiques enroulées dans une configuration en hélice alpha (30) qui forme des fibrilles. Cette protéine est composée d'environ 450 acides aminés. On peut voir dans la figure 4 une représentation schématique de cette protéine M.
Figure 4. Schéma de la structure de la protéine M et de sa position dans la paroi bactérienne. Source : (26).
Les régions répétées de la protéine M : La protéine M est divisée en séquences répétées en tandem réparties sur quatre régions (A, B, C et D). Ces régions varient en taille et en composition d’amino-acides. L’extrémité C-terminale (contenant les régions C et D) est hautement conservée. Elle est responsable de la liaison de la bactérie à la muqueuse de
l'oropharynx et des propriétés antiphagocytaires (31). L’extrémité N-terminale de la protéine
M est polymorphe. Elle contient une région hypervariable (région A) et une région semi-variable (région B) (32). L’immunité spécifique est liée à la région N-terminale hypersemi-variable. En effet, des différences au sein des 150 premiers résidus d'acides aminés de la région A permettent la classification de différents sérotypes (33). La figure 5 montre le détail du
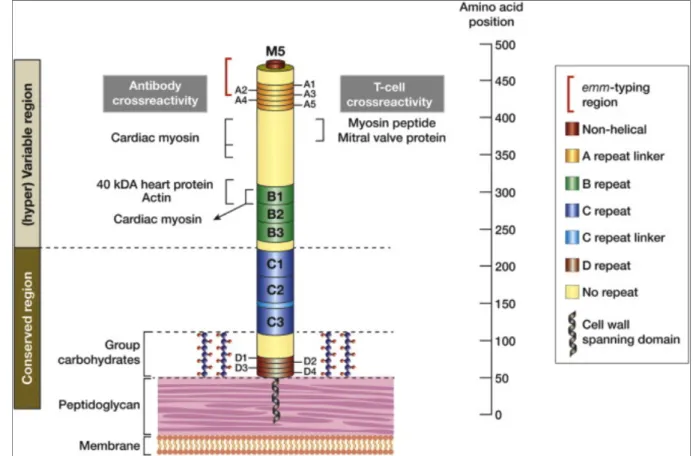
Figure 5. Détail du positionnement des régions répétées contenues dans la protéine M Source : (34).
Les sérotypes rhumatogènes : Cette protéine M est codée par le gène emm doté d’un grand polymorphisme. De ce fait, plus de 200 sérotypes de cette protéine M ont été identifiés à ce jour (35). Cependant, seules les souches contenant des sérotypes « rhumatogènes » peuvent entraîner un RAA. Il s’agit des souches de sérotype M3, 5, 6, 14, 18, 19, 24, 27, 29 et certaines souches de sérotype M1.
Les modèles de la protéine M : Plusieurs réarrangements de la région chromosomique emm sont observés, dénommés « modèles emm » dont trois groupes principaux sont reconnus : A à C, D et E. La classification des souches selon leur tropisme tissulaire pour la gorge (modèles A à C), la peau (modèle D) ou les deux (modèle E) est basée sur l'organisation des gènes emm et
emm-like situés en aval du régulon mga du génome de S. pyogenes (37). La figure 6 représente cette
région chromosomique emm. Selon une étude de McGregor et al, pour la quasi-totalité des souches de SGA examinées, un type d'emm donné est limité à un seul groupe de motifs emm
(37). De ce fait, en se basant sur la connaissance du type d'emm, on pourrait en déduire le modèle d'une souche donnée.
Figure 6. Représentation schématique de la région chromosomique emm et des loci contenus dans cette région. Source : (38).
Légende = mga : régulon mga ; emm : gène codant pour la protéine M ; scpa : gène codant pour la protéase du facteur C5a du complément ; enn : gène codant pour une protéine M-like ; sof : gène
codant pour le facteur d’opacité du sérum ; sfbx : gène codant pour la protéine Sfbx se liant à la fibronectine.
La souche M1 est la plus commune dans le monde et, en raison de la diversité de sa virulence, est impliquée dans des infections invasives et non invasives dans plusieurs pays (39).
Les principaux rôles de la protéine M : Cette protéine fibrillaire a été décrite comme l'antigène
bactérien majeur (36) et possède divers rôles. Elle détient un rôle majeur dans la diversité du
SGA et sa pathogénicité. Elle est notamment impliquée dans l’adhérence des streptocoques aux épithéliums. De plus, elle entraîne une diminution de la phagocytose du SGA par inhibition de l’activation du complément.
3.1.2.1.2 Protéines M-like : Mrp et protéine H
La superfamille des protéines M comprend les protéines M elles-mêmes, mais également les protéines M-like. Ces protéines sont codées par les gènes : mrp, emm-like ou enn contenus dans l’îlot de pathogénicité « emm » du chromosome de SGA (40). De nombreux sous-types existent dont l’expression est régulée par le régulon mga (41). Ici, nous allons nous intéresser principalement à deux protéines M-like : la protéine Mrp (M related protein) et la protéine H.
La protéine Mrp :
Cette protéine est structurellement similaire à la protéine M et est présente dans un pourcentage significatif de souches de SGA. La différence majeure avec la protéine M se situe au niveau
des extrémités N-terminales qui sont semi-conservées chez la Mrp. Trois groupes structuraux de Mrp ont été établis à ce jour : MrpI, MrpII et MrpIII. Récemment, il a également été démontré que les protéines Mrp contribuaient à la résistance à la phagocytose de S. pyogenes (42). Elle agirait comme un facteur de virulence de SGA en se liant préférentiellement aux IgG humaines via leurs fragments constants (Fc).
La protéine H :
Cette protéine n’est pas à confondre avec le facteur H humain. Il s’agit de l'une des protéines étroitement apparentées à la protéine M et possède une forte affinité pour les IgG et l'albumine (43). Sa liaison au Fc de l’IgG permettrait ainsi d’inhiber l'activation du complément à la surface bactérienne (44).
3.1.2.1.3 Protéines liant la fibronectine
La fibronectine (Fn) est une glycoprotéine de la matrice extracellulaire (MEC) connue pour lier une grande variété de protéines et d'intégrines sur la surface des cellules hôtes. Le SGA possède plusieurs protéines de surface cellulaire qui sont capables de lier la Fn. Le tableau 1 résume l’ensemble des 11 protéines se liant à la Fn identifiées à ce jour. Elles peuvent être divisées en 2 groupes :
-‐ celles contenant des répétitions de liaison à la fibronectine (comme les FBP) : les séquences répétitives de liaison à la fibronectine sont généralement situées vers l’extrémité C-terminale de la protéine et peuvent varier en longueur et en nombre (45). -‐ celles ne contenant pas de répétitions : ces adhésines sont les protéines M (M1, M3 et M6), la protéine H, le GAPDH (glycéraldéhyde- 3-phosphate déshydrogénase), la protéine Shr se liant à l’hémoprotéine et la protéine collagène-like Scl1 (qui se lie à la fibronectine et à la laminine) (46).
Tableau 1. Protéines se liant à la fibronectine. Adapté de (45) et (47)
Groupes protéiques Protéines Caractéristiques FBP (protéines se liant à la fibronectine) SfbI
PrtF1 / SfbI est composé d'une séquence signal, d'un domaine aromatique, d'une région riche en proline, de répétitions de liaison Fn et d'un motif d'ancrage de paroi cellulaire
FbaB
FbaB contient une séquence signal, des répétitions de liaison Fn et un motif d'ancrage de paroi cellulaire.
SOF
Le facteur d’opacité du sérum est composé d'un domaine d'opacification N-‐ terminal et d'une région de répétitions de liaison Fn C-‐terminale.
SfbX SfbX est codé immédiatement en aval de SfbII / SOF et contient des répétitions de liaison Fn sur l'extrémité C-‐terminale.
Fbp54
Fbp54 a une masse moléculaire de 54 kDa, et a une grande similitude avec les protéines liant Fn d'autres streptocoques
FbaA FbaA contient une séquence signal, une région variable hélicoïdale, des domaines répétitifs et un motif d'ancrage de paroi cellulaire. Le gène fbaA est contrôlé positivement par le gène mga
Protéines M et protéines M-‐like M1, M3, M6, protéine H
La protéine M1 est composée de deux chaînes polypeptidiques qui forment une configuration hélicoïdale ; ces chaînes sont constituées de quatre régions répétées et d'un motif d'ancrage de la paroi cellulaire.
Protéines se liant à la laminine
Shr Shr contient deux domaines « proches du transporteur » qui assurent la médiation de la liaison Fn et de la laminine
Protéines se liant au plasminogène
GAPDH
La protéine GAPDH, située dans le cytoplasme et sur la surface des cellules bactériennes, joue un rôle important dans la voie glycolytique et est essentielle à la croissance bactérienne
Protéines collagène-‐like
Scl1
La Scl-‐1 a été décrite comme étant une protéine streptococcique de type collagène et contient une région variable, une région de type collagène et un domaine d'ancrage de paroi cellulaire.
3.1.2.1.4 Pili / Antigènes T
Découverts en 2005, les pili du SGA apparaissent comme de longues tiges flexibles qui dépassent jusqu'à 3 µm la surface de la cellule bactérienne (48). Il s’agit de structures hétéropolymémiques composées de diverses sous-unités : une sous-unité principale qui est la protéine piline Spy0128 et deux sous-unités protéiques auxiliaires qui sont Spy0130 et Cpa. La Spy0130 est une piline basale qui agit comme une protéine de liaison pour la fixation à la paroi bactérienne (49) ; alors que la Cpa est une piline qui se fixe à l’extrémité du pilus. Ces sous-unités protéiques sont assemblées de manière covalente via la sortase C (SrtC), puis liées à la
paroi cellulaire via la sortase A (SrtA) par des réactions de type transpeptidase. Le pilus est
clivé via le motif LPXTG entre les résidus de thréonine et de glycine par la SrtA. Les gènes de biosynthèse des pili et de la sortase sont regroupés en un îlot de pathogénicité situé dans la région FCT du génome du SGA. Cette région FCT code les protéines se liant à la fibronectine, les protéines de liaison au collagène et les antigènes T (sous-unité pilus). Elle présente une diversité génétique considérable, avec neuf types de FCT différents identifiés (50). Les pili contribuent à la pathogénie du SGA via leur implication directe dans l'adhésion bactérienne. Ils peuvent jouer un rôle variable dans l’infection ; en effet, selon le type de FCT du pilus son action sera différente. Il est toutefois observé une implication constante dans l’agrégation bactérienne. Par exemple, il a été montré que les pili FCT de type 2 provenant du sérotype M1 induisent une adhérence aux surfaces cellulaires du pharynx, ce qui favorise la formation de biofilm et l'agrégation dans des conditions « statiques » (51). Cependant, d’autres types FCT de pili se lient à la glycocoprotéine gp340 du récepteur scavenger salivaire, favorisant ainsi l'agrégation des cellules bactériennes dans la salive. Cette agrégation réduit l'adhésion bactérienne aux cellules pharyngées et peut donc servir de mécanisme de clairance bactérienne (52). De ce fait, les pili jouent un rôle important dans l'interaction bactérienne avec l'hôte humain.
3.1.2.1.5 LTA
Il s’agit d’un polymère amphiphile de glycéro-phosphate lié à la membrane et contenant du glucose et des motifs D-alanine (53).
3.1.2.2 Facteurs de diffusion tissulaire
Ce sont des exo-enzymes produites et sécrétées par le SGA. Elles peuvent détruire le tissu conjonctif et les cellules, mais aussi interférer avec la coagulation, ce qui favorise l’invasion tissulaire et l’infection systémique. L’augmentation des taux d’antistreptolysines O (ASLO), d’anti-DNAse B, d’anti-hyaluronidase, ou d’antistreptokinase est un marqueur d’infection streptococcique. La recherche d’anticorps dirigés contre la SLO et la DNAse B fait partie du diagnostic sérologique rétrospectif d’infection à SGA en cas de suspicion de RAA (54).
3.1.2.2.1 Streptolysines S (SLS) et O (SLO)
Le SGA produit deux hémolysines, des toxines cytolytiques qui s’oligomérisent pour former des pores dans les cellules eucaryotes. Elles sont responsables du caractère bêta-hémolytique du S. pyogenes sur gélose au sang en lysant la membrane des érythrocytes.
Les SLO : elles sont très antigéniques, sensibles à l’oxygène et dépendantes du cholestérol. Lors d’une infection à SGA, l’organisme infecté produit des ASLO qui bloquent l’hémolyse des globules rouges. La SLO perturbe l'intégrité de la membrane de multiples types cellulaires tels que les cellules épithéliales, les neutrophiles et les macrophages. En plus de son activité cytotoxique directe sur la membrane, elle sert de véhicule pour la translocation de sa co-enzyme, NAD-glycohydrolase, dans le cytoplasme des cellules épithéliales de l'hôte. Cette action coordonnée conduirait à la survie bactérienne dans les kératinocytes oropharyngés et les macrophages (55). Les SLO sont inactivées par cholestérol libre et notamment le cholestérol des tissus épidermiques. Donc dans les streptococcies cutanées, on a une réponse ASLO faible ou nulle, alors que dans les streptococcies pharyngées (muqueuses) il y a une élévation significative des ASLO plasmatiques en 8 à 10 jours. Cette réponse atteint son maximum en 3 à 4 semaines et revient à la normale 2 à 4 mois après l’infection.
Les SLS : elles ne sont pas antigéniques et insensibles à l’oxygène. Elles sont principalement responsables de la formation de la zone hémolytique entourant les colonies cultivées sur gélose au sang. Elle a théoriquement un large spectre cytolytique contre les lymphocytes, les neutrophiles, les plaquettes et les cellules épithéliales ; cependant, son activité cytolytique nécessite la présence de cellules bactériennes. Par conséquent, SLS existe principalement sous forme liée à la bactérie.
3.1.2.2.2 Streptokinase
Elle active la transformation du plasminogène en plasmine qui lyse la fibrine. Elle favorise la dégradation de la matrice extra-cellulaire et des réseaux de fibrine formés par l’hôte pour confiner l’infection (56).
3.1.2.2.3 Hyaluronidase
Elle lyse la substance de base du tissu conjonctif, c’est un donc un facteur favorisant la diffusion de l’infection.
3.1.2.2.4 Protéase multifonctionnelle speB
Il s’agit d’une cystéine protéase codée par le gène chromosomique speB. Elle est présente chez toutes les souches de SGA, qui l’expriment à des degrés variables. Elle intervient à différentes étapes de l’infection, en hydrolysant aussi bien des protéines de l’hôte que bactériennes. Elle joue un rôle principal dans l’inflammation :
- au niveau de la bactérie : elle dégrade la protéine M en fragments libérés dans le plasma à l’origine de l’inflammation.
- au niveau de l’hôte : elle clive l'interleukine 1 (IL-1), les immunoglobulines (Ig) et des composants du complément (31). Le précurseur de l’interleukin-1 (IL-1) est clivé par SpeB en IL-1active, un médiateur pro-inflammatoire puissant. De plus, elle clive les IgG, IgA, IgM, IgD et IgE au niveau de leurs chaînes lourdes.
Elle est impliquée dans l’invasion bactérienne :
- elle clive les glycoprotéines matricielles (fibronectine, laminine, intégrine) et dégrade le collagène par activation des métalloprotéases humaines (MMP)
- elle est impliquée dans l'internalisation du SGA dans les cellules de l’hôte. En effet, elle a la capacité de cliver les complexes de jonction cellulaires tels que l'occludine et la E-cadhérine. La déstabilisation induite par SpeB de la barrière cellulaire peut permettre l'entrée de facteurs de virulence bactériens, comme les exotoxines pyrogènes présentant une activité superantigénique. C’est pourquoi des taux très élevés d’anticorps anti-SpeB sont produits par les malades présentant diverses infections invasives (57).
3.1.2.2.5 Mac
En 2001, une deuxième cystéine protéase a été découverte. Il s’agit de l’IdeS (enzyme de S.
pyogenes dégradant l’IgG) aussi appelée Mac en raison d’une homologie avec la sous-unité α
de la glycoprotéine Mac-1 humaine (58). La caractérisation du gène mac a montré l'existence de deux allèles appelés mac 1 et mac 2. Mac-1 possède une activité endopeptidase apparentée à celle de l’IgG qui pourrait contribuer à sa capacité à bloquer l'opsonophagocytose. Mac-2, se lie aux fragments constants de l’IgG empêchant la reconnaissance des IgG liées au SGA par les phagocytes (59). IdeS clive l'IgG humaine dans la région charnière à la même position que SpeB ; cependant, elle a un degré de spécificité supérieur à celui de SpeB, car elle ne dégrade pas les autres isotypes d'immunoglobulines.
3.1.2.2.6 Streptodornase ou Dnase
Elle libère des « filets » d’ADN produits par les polynucléaires neutrophiles (PNN) pour piéger les bactéries. Mais elle n’est pas cytotoxique, car elle ne pénètre pas dans les cellules eucaryotes et ne peut donc pas dégrader les acides nucléiques intracellulaires.
3.1.2.2.7 Sic
La protéine Sic (protéine streptococcique inhibitrice du complément) est une protéine extracellulaire associée au sérotype M1 du SGA. Elle permet à la bactérie d’échapper aux lésions membranaires liées à l’activation du complément. En inactivant des peptides antimicrobiens, elle diminue le recrutement des leucocytes et des cellules T. Sic inhibe également l’internalisation et la lyse des S. pyogenes par les polynucléaires neutrophiles (31).
3.1.2.2.8 ScpA
La protéine ScpA est une sérine endopeptidase qui clive spécifiquement le facteur C5a du complément ; de ce fait, elle inhibe le recrutement des cellules phagocytaires au site infectieux (31).
3.1.2.2.9 SpyCEP
de ScpC, est une peptidase qui perturbe le recrutement de neutrophiles au site d'infection en clivant et en inactivant la chimiokine IL-8 (60). L'activité de SpyCEP augmente la résistance du SGA à la destruction par neutrophiles (61).
3.1.2.2.10 EndoS
Il s’agit d’une endoglycosidase extracellulaire, elle possède une activité spécifique sur le glycane de la partie constante de la chaîne lourde de l’IgG. Ce motif de l’IgG est crucial pour plusieurs fonctions effectrices, y compris l'activation du complément et la liaison aux récepteurs du Fc présents sur les leucocytes. Par conséquent, une enzyme bactérienne hydrolysant cette fonction glycane pourrait avoir des effets profonds sur les processus induits par les IgG.
3.1.2.2.11 Toxines superantigènes
Plusieurs toxines superantigéniques du SGA ont été identifiées à ce jour : SpeA, SpeC, SpeD, SpeF, SpeG, SpeH, SpeI, SpeJ, SpeK, SpeL, SSA, SMEZ et SMEZ-2. Ce sont des molécules pouvant créer un pontage non spécifique entre le HLA de type II d’une cellule présentatrice d’antigène (macrophage, monocyte…), sans antigène microbien à sa surface, et le TCR (récepteur d’un lymphocyte T). Il y aurait activation polyclonale désordonnée de l’ensemble des lymphocytes T (LT) sans reconnaissance spécifique induisant la sécrétion massive de cytokines pro-inflammatoires (TNFalpha, IL-1, Il-6, IL-2, INFgamma). Ils vont désorganiser le système immunitaire (SI) pour le rendre inefficace avec un risque de choc toxinique en cas d’infection à SGA disséminée. Les réactions en chaîne d’activation du complément, de la coagulation et de la fibrinolyse, entraînent l’hypotension et la défaillance multiviscérale caractéristiques du syndrome de choc toxinique (31). Mais, attention, toute infection à SGA n’entraîne pas forcément de réaction toxinique : l’intensité de l’activation des LT et de la réponse varierait considérablement selon le groupe HLA de l’individu (62).
3.1.3 Milieu de culture
Le streptocoque du groupe A est une bactérie anaérobie-aérobie facultative. Elle est dépourvue d’activité catalase. De ce fait, l’eau oxygénée (H2O2) issue du métabolisme respiratoire lui est nuisible ; mais elle tolère l’oxygène (O2). La culture se fait sur gel d’agarose de sang, on observe
d’une bêta-hémolyse. En milieu liquide, la culture a un aspect « en mie de pain » dans le bouillon. La température de croissance optimale se situe entre 33°C et 37°C ; le pH optimal se situe aux alentours de 7,2.
3.1.4 Habitat et transmission :
S. pyogenes est une bactérie strictement humaine, ceci serait dû en partie à la stricte spécificité
de la streptokinase pour le plasminogène humain. De ce fait, le SGA est très fragile en milieu extérieur, l’homme constituant son seul réservoir. La muqueuse naso-pharyngée et la peau sont les principaux sites de colonisation asymptomatique du SGA chez l’homme (63). Ce sont également les principales sources d’infection étant donné la viabilité, dans ces sites, du SGA. La transmission du SGA se fait :
-‐ via les gouttelettes respiratoires (pflügge) à partir de personnes atteintes d’affections pharyngées.
-‐ par contact direct avec des personnes atteintes d’infections cutanées à SGA (63). Il s’agit d’une bactérie pathogène majeure chez l’homme causant des infections ayant des répercussions au niveau de la morbi-mortalité considérables (8).
3.1.5 Pouvoir pathogène et maladies provoquées :
Le SGA a beaucoup d’adhésines, mais la majorité de ces adhésines ne sont pas présentes dans tous les sérotypes du SGA. L’expression des adhésines du SGA est hautement régulée en réponse aux facteurs environnementaux (64). La diversité des adhésines pourrait jouer un rôle dans le tropisme tissulaire du SGA (56). Le réarrangement chromosomique des gènes emm et
emm-like est un marqueur génétique de préférence tissulaire. Ces réarrangements dénommés
modèles emm se divisent en 5 groupes majeurs, des modèles A à E (65). Comme le montre la figure 7, les modèles A à C sont considérés comme spécifiques de la gorge, alors que les modèles D sont spécifiques de la peau. Les modèles E peut être retrouvés dans les 2 tissus (66). Les affinités tissulaires pourraient être expliquées par l’expression et/ou la répression de facteurs spécifiques de colonisation tissulaire comme les adhésines. Les mécanismes exacts responsables du tropisme tissulaire n’ont pas encore été élucidés.
Figure 7. Détail des régions chromosomiques emm et FCT selon les modèles de streptocoque bêta-hémolytique du groupe A. Source : (67)
La plupart des gènes de SGA identifiés à ce jour sont regroupés dans deux régions génomiques : la région emm et la région FCT (68), positionnée à environ 300 kB d'emm. Les loci mga de la région emm et rofA / nra de la région FCT sont des régulateurs transcriptionnels de l'expression des gènes contenus dans chaque région ; ce sont des « régulons » (64). Par exemple, les loci
rofA / nra de la région FCT contrôleront l'expression des gènes structuraux du pilus (64). Le
locus mga de la région emm contrôlera l’expression des gènes emm, emm-like et sof notamment. Les pili, la protéine M et le facteur d’opacité du sérum étant des adhésines, leur régulation est importante, car elle contribuera à l’adhérence spécifique aux tissus humains. Les adhésines pouvant potentiellement contribuer au tropisme bactérien pour les tissus de l’hôte ; leur distribution parmi la population de SGA se fera conformément au tropisme de la souche. Un autre facteur affectant la localisation de l’infection pourrait être le CD44, une protéine de liaison à l'acide hyaluronique qui semble agir comme un récepteur phagique du SGA. Le SGA se divise en deux classes principales basées sur les différences dans les régions répétées C de la protéine M (69). Une classe est associée à l’infection streptococcique du pharynx, et l'autre (à quelques exceptions près) appartient à des souches communément associées à l'impétigo. Ainsi, la souche particulière de streptocoque peut être cruciale dans l'initiation du processus de la maladie. Dans
jouer un rôle important dans le déclenchement de la réponse immunitaire anormale. Il est, tout de même, à noter que certaines souches d'impétigo peuvent coloniser le pharynx. Cependant, elles ne semblent pas induire une réponse immunologique aussi forte que les souches pharyngiennes (70).
Le pouvoir pathogène du SGA est vaste, trois catégories de pathologies sont mises en évidence : -‐ Des infections bénignes :
o Angine (la plus fréquente) +/- rash cutané (forme typique = scarlatine)
o Infections cutanéo-muqueuses : impétigo, anite, vulvite, abcès cutanés bénins… o Autres infections de la sphère ORL : otite souvent avec otorrhée, sinusite,
rhinopharyngite
-‐ Des infections invasives sévères :
o Ensemencement via une effraction cutanée : pénétration dans les tissus sous-cutanés avec risque de fasciite nécrosante
o Extension du foyer infectieux par contiguïté : infections pleuro-pulmonaires o Bactériémie avec formation d’un foyer secondaire : infections ostéo-articulaires o Complication redoutable, pouvant être fatale : syndrome de choc toxique
streptococcique (71).
-‐ Des infections post-streptococciques potentiellement invalidantes, non suppuratives : o RAA : la plus redoutable car il y a un risque de cardite, c’est la première cause
d’insuffisance cardiaque dans les pays en développement (54) o Glomérulonéphrite aigue
Le tableau 2 résume parfaitement les pathologies provoquées par le SGA. Cette variété d’expressions cliniques serait due à l’interaction complexe entre les facteurs de pathogénicité de la bactérie, le mode d’infection et le système immun de l’hôte (71).
Tableau 2. Pathologies liées au streptocoque bêta-hémolytique du groupe A. Source :(72)
Infections suppurées Infections focales superficielles
-‐ Pharyngite aiguë -‐ Infections cutanées :
-‐Impétigo ou Pyodermite superficielle -‐Surinfection de plaie ou de vésicule
de varicelle
-‐Autre cellulites superficielles -‐ Otite
-‐ Vulvo-‐vaginite -‐ Conjonctivite
-‐ Autres foyers superficiels Infections invasives -‐ Septicémie -‐ Erysipèle -‐ Dermo-‐hypodermite nécrosante -‐ Autres dermo-‐hypodermites ou « cellulites » profondes -‐ Fièvre puerpérale et endomètrite -‐ Pneumopathie et pleurésie purulente -‐ Arthrite septique et ostéomyélite -‐ Méningite
-‐ Péritonite -‐ Endocardite
-‐ Autres suppurations profondes Manifestations toxiniques
-‐ Scarlatine
-‐ Toxi-‐infection alimentaire
-‐ Syndrome de choc toxique streptococcique
Syndromes post-‐streptococciques -‐ Rhumatisme articulaire aigu
-‐ Glomérulonéphrite aiguë -‐ Syndromes neurologiques
3.2 Réaction immune efficace face à une infection pharyngée à
S.pyogenes
3.2.1 Introduction du SGA dans l’organisme 3.2.1.1 L’adhérence :
Elle se fait via des adhésines dont les caractéristiques sont résumées dans le tableau 3.
Tableau 3. Les adhésines du SGA, d’après (47) et (73)
Adhésines Protéines Cellules Récepteurs et/ou
action
Capsule Kératinocytes Récepteur CD44 de l’acide hyaluronique Acide lipoteichoïque Cellules épithéliales
bucco-‐pharyngées Fibronectine fibrinogène et Protéine M M1, M3, M6 Cellules épithéliales
et kératinocytes Récepteur CD4 Fibronectine et fibrinogène
Protéines M-‐like Protéine H Cellules épithéliales Fibronectine et fibrinogène
Protéines de liaison à
la fibronectine SfbI, FbaB, SOF, SfbX, Fbp54, FbaA Cellules épithéliales Fibronectine + fibrinogène (SOF et Fbp54)
Pili Spy0130, Spy0128
(antigène T), Cpa Cellules épithéliales Collagène, agrégation gp340, plaquettaire,
formation de biofilm Protéines collagen-‐
like Scl1, Scl2 Laminine intégrine alpha 2ß1 et Protéines de liaison à
la laminine Shr Laminine fibronectine et Protéines de liaison