REPUBLIQUE DE COTE D’IVOIRE
Union-Discipline-Travail
Ministère de l’Enseignement supérieur et de la Recherche Scientifique UFR BIOSCIENCES 22 BP : 582 Abidjan 22 Tél. /Fax : 22 44 44 73 Courriel : biosciences@univ-cocody.ci ufrbiosciences@yahoo.fr UNIVERSITE DE COCODY-ABIDJAN N° d’ordre : 665 / 2010 Année universitaire : 2009 - 2010
THESE
Présentée à l’UFR Biosciences pour obtenir le titre de
DOCTEUR DE L’UNIVERSITE DE COCODY-ABIDJAN EN PHYSIOLOGIE VEGETALE
Option : Agrophysiologie
Par
BOYE Mambé Auguste Denise
THEME :Soutenue publiquement le 24 Juillet 2010, devant le jury composé de : Soutenue publiquement le 24 Juillet 2010, devant le jury composé de :
M. AKE Séverin Professeur Titulaire, Université de Cocody Président
M. ANNO AboPierre Maître de Conférences, Université de Cocody Directeur de Thèse M. KOUADIO Yatty Justin Maître de Conférences, Université d’Abobo-Adjamé Rapporteur M. ZOUZOU Michel Professeur Titulaire, Université de Cocody Rapporteur M. DICK Emmanuel Maître de Conférences, Université de Cocody Examinateur
LABORATOIRE DE PHYSIOLOGIE VEGETALE
MULTIPLICATION DU BANANIER PLANTAIN (Musa sp. AAB, cultivar Corne 1) : STRATEGIES DE CONSERVATION DES REJET-ECAILLES UTILISES
I
A mon père Beugré BOYE, qui m’a engagé sur la voie de l’école, m’a enseigné la rigueur et la persévérance et a souhaité l’aboutissement de cette thèse ;
A mon épouse Madame BOYE née Hoguiaboro Y. Damase DANOU, pour son affection, sa patience, sa tendresse, ses encouragements, ses prières et ses conseils ;
A mes enfants Grace Marie et Ange Edna qui n’ont pas toujours compris les raisons de mes absences répétées.
I
AVANT-PROPOS
Le présent mémoire est l’aboutissement d’un travail de recherche qui a été réalisé au laboratoire de Physiologie végétale de l’UFR Biosciences de l’Université de Cocody, sous la direction scientifique de Monsieur le Professeur ANNO Abo Pierre, Maître de Conférences. Nous lui exprimons à l’occasion de cette thèse toute notre gratitude pour l’intérêt constant qu’il a su porter au bon déroulement du protocole expérimental. Pendant plus de 10 ans nous avons pu bénéficier de ses conseils et profiter de ses encouragements, ses connaissances en physiologie végétale qui ont contribué à l’accomplissement de cette thèse. Nous tenons également à le remercier de nous avoir accueillis dans son laboratoire et de nous avoir formés à la recherche. Nous lui renouvelons notre gratitude pour la confiance qu’il nous a témoigné et lui exprimons combien son aide fut précieuse pour la rédaction de cette thèse.
Nous exprimons toute notre reconnaissance au Docteur Louise TURQUIN, vice-responsable du service de valorisation de la recherche (SERVAL), à l’Université de Cocody-Abidjan à qui pour des raisons professionnelles le Professeur ANNO Abo Pierre confia la co-direction de l’encadrement de cette thèse, de nous avoir enseigné les rudiments de la démarche scientifique et la rigueur rédactionnelle lors de la rédaction de cette thèse. Nous lui adressons également nos remerciements pour sa disponibilité, ses conseils et ses encouragements.
Nous remercions Messieurs les membres du jury d’avoir accordé une attention particulière à cette étude malgré leurs innombrables responsabilités.
Nous témoignons notre gratitude à Monsieur le Professeur Séverin AKE, Directeur du service de valorisation de la recherche (SERVAL), à l’Université de Cocody-Abidjan, qui malgré ses lourdes tâches a pu nous faire bénéficier de ses critiques pertinentes pour la finalisation de ce travail de recherche.
Nous sommes reconnaissant envers Monsieur le Professeur Michel ZOUZOU, Directeur du laboratoire de physiologie végétale pour son encouragement permanent.
Nous remercions très sincèrement Monsieur le Professeur Justin Kouadio YATTY, Maître de conférence, Directeur du Laboratoire de Biologie et Amélioration des Productions Végétales de l’Université d’Abobo-Adjamé pour avoir accepté que nos expérimentations sur le terrain se passe au sein sa structure. Qu’il trouve ici l’expression de notre profonde gratitude pour le soutien apporté.
II
Nous remercions également les Docteurs Mongomanké KONE et Hilaire TANOH, Maître assistant au Laboratoire de Biologie et Amélioration des Productions Végétales de l’Université d’Abobo-Adjamé, pour les suggestions, les conseils et les encouragements.
Nos remerciements vont également à l’endroit du Docteur Daouda KONE, Maître assistant au Laboratoire de Physiologie végétale, pour son esprit d’ouverture et ses judicieuses remarques qui nous ont aidées lors de nos essais en champ.
Aux enseignants chercheurs du Laboratoire de Physiologie Végétale qui à divers degrés, ont contribué à ce travail, nous exprimons notre profonde gratitude. Il s’agit des Docteurs Kaddy KAMATE, Fatogoma SORHO, Mamadou SHERIF, Jacques ATTOUMGRE, Emmanuel DICK, Privat KOUASSI et Laurent BIEGOT. Nous les remercions pour leurs encouragements et leurs nombreux conseils.
Notre reconnaissance va à Messieurs Joseph AKA et Kouamé KOUASSI et Nabé SORO Techniciens au Laboratoire de Physiologie Végétale dont l’efficacité et l’esprit d’équipe nous ont permis de réunir les résultats qui sont exposé dans ce présent travail.
Nous adressons nos sincères remerciements au Docteur, Dodiomon SORO, pour ses conseils judicieux et ses remarques avisées.
Que nos collègues du Laboratoire de Physiologie Végétale en particuliers Faustin Dago SOKO, Joseph M’PIKA, Brahima CAMARA, reçoivent nos sincères remerciements pour leur soutien moral et matériel.
Nous adressons nos remerciements aux membres de la fraternité Cœur Miséricorde de Jésus et à la communauté Catholique Missionnaire de Villaregia pour le soutien matériel et spirituel qu’ils nous ont apporté dans les plus durs moments de cette thèse.
A notre petit frère Jacques Beugré BOYE, qu’il trouve ici l’expression de notre gratitude pour son soutien moral, financier et sa présence permanente à nos côtés.
Nous accordons une mention spéciale à notre Epouse Madame Damase BOYE et nos enfants Grâce Marie Emmanuella M. BOYE et Affoua Ange Edna BOYE, pour leur soutien tout au long de ces années de recherche. Nous n’avons souvent pas été à leur côté occupé que nous étions par nos travaux de laboratoire. Cette thèse est l’expression de notre affection de toujours. Que Dieu vous bénisse.
Cette thèse est également le fruit de longues années d’études, mais surtout des efforts et des sacrifices de notre famille. Nous exprimons toute notre reconnaissance à notre père, Monsieur Beugré BOYE et notre mère, Madame BOYE née Gnabani Rose ALIA.
Enfin, nous rendons grâce à la TRINITE SAINTE pour tous Ses bienfaits. Que Sa Gloire soit proclamé à jamais. Amen !
III
SOMMAIRE
Pages
LISTE DES ABREVIATIONS ... VII LISTE DES FIGURES ... XI LISTE DES TABLEAUX ... XV
INTRODUCTION ... 1
CHAPITRE I : REVUE BIBLIOGRAPHIQUE ... 6
1.1 GENERALITES SUR LE BANANIER ... 7
1.1.1 Origine et systématique ... 7 1.1.2 Géographie et écologie ... 8 1.1.2.1 Géographie ... 8 1.1.2.2 Ecologie ... 12 1.1.3 Biologie ... 12 1.1.3.1 Description de la plante ... 12
1.1.3.2 Caractéristiques du sous-groupe de plantain ... 16
1.2 Système de culture BANANIER ... 18
1.2.1 Cultures traditionnelles sans intrants ... 18
1.2.2 Culture intensive ... 18
1.2.2.1 Plantation en culture pure ... 19
1.2.2.2 Plantation en culture intercalaire ... 19
1.3 VALEUR NUTRITIVE ET SOCIO-ECONOMIQUE DU BANANIER PLANTAIN ... 19
1.3.1 Au niveau nutritionnel ... 19
1.3.2 Au niveau socio-économique ... 20
1.4 REGENERATION ET CONSERVATION DES UNITES DE PROPAGATION ... 22
1.4.1 Eléments de régénération des bananiers ... 22
1.4.2 Conservation des unités de propagation ... 23
IV
1.5.1 Détection et mesure du stress hydrique ... 24
1.5.2 Conséquences du stress hydrique ... 25
CHAPITRE II : MATERIEL ET METHODES ... 27
2.1 MATERIEL VEGETAL ... 28
2.1.1 Rejet-écailles ... 28
2.1.2 Rejets baïonnettes ... 28
2.2 METHODES ... 30
2.2.1 Choix des sites d’étude ... 30
2.2.2 Culture des rejets en conditions contrôlées au laboratoire ... 30
2.2.2.1 Prélèvement et calibrage des rejets ... 30
2.2.2.2 Déshydratation des rejets ... 31
2.2.2.3 Culture hydroponique des rejets ... 33
2.2.3 Mesure expérimentale en champ ... 34
2.2.3.1 Données climatiques et pédologiques ... 34
2.2.3.2 Sevrage des jeunes plants de bananiers ... 36
2.2.3.3 Culture en champ ... 38
2.2.3.4 Expression des résultats sur la croissance et le développement des bananiers plantain en champ ... 40
2.2.3.4.1 Croissance du bananier plantain ... 40
2.2.3.4.2 Paramètres de développement ... 41
2.2.3.4.3 Paramètres de rendement ... 41
2.2.4 Etude anatomique et histologique ... 42
2.2.4.2 Observation anatomique ... 42
V
CHAPITRE III : RESULTATS ... 45
3.1 COMPORTEMENT DES REJET-ECAILLES ET DES REJETS BAÏONNETTES SOUMIS A DIFFERENTS REGIMES DE DESHYDRATATION ET DE CULTURE HYDROPONIQUE ... 45
3.1.1 Rejets non déshydratés ... 45
3.1.1.1 Morphogenèse en culture hydroponique ... 45
3.1.1.2 Caractéristiques du système racinaire ... 52
3.1.1.3 Production de matière fraîche végétale ... 52
3.1.1.4 Effectifs des racines formées ... 52
3.1.2 Rejets déshydratés ... 55
3.1.2.1 Morphogenèse des rejets déshydratés ... 55
3.1.2.2 Evolution des caractéristiques pondérales et hydriques en condition de déshydratation ... 56
3.1.2.2.1 Variation de la masse fraîche des rejets ... 56
3.1.2.2.2 Variation du déficit hydrique ... 63
3.1.3 Rejets déshydratés en culture hydroponique ... 65
3.1.3.1 Morphologie des rejets en condition de culture hydroponique ... 65
3.1.3.2 Production de matière fraîche végétale ... 71
3.1.3.3 Effectifs des racines formées ... 74
3.1.4 Evaluation de la survie en pépinière des rejets soumis à différents temps de déshydratation et éveillés en culture hydroponique ... 76
3.1.5 Conséquences des temps de déshydratation sur le rhizome des rejet-écailles de bananiers plantain cv Corne 1 ... 80
3.1.5.1 Observation en coupe transversale ... 80
3.1.4.2 Description des tissus et cellules du bulbe des rejet-écailles déshydratés ... 82
3.2 ETUDE DES PARAMETRES AGRONOMIQUES DES BANANIERS ISSUS DES REJETS SOUMIS A DIFFERENTS TEMPS DE STRESS HYDRIQUES ... 85
VI
3.2.2 Paramètres agronomiques des bananiers plantain ... 88
3.2.2.1 Paramètres de croissance et de développement ... 88
3.2.2.1.1 Bananiers issus des rejets non déshydratés ... 88
3.2.2.1.2 Bananiers issus des rejets déshydratés pendant un mois ... 91
3.2.2.1.3 Bananiers issus des rejet-écailles déshydratés pendant de 2 à 4 mois... 93
3.2.2.2 Classification des bananiers issus des rejet-écailles en rapport avec leurs paramètres de croissance et de développement ... 95
3.2.2.3 Paramètres de production ... 98
3.2.2.3.1 Bananiers issus des rejets non déshydratés ... 98
3.2.2.3.2 Bananiers issus des rejets déshydratés pendant un mois ... 105
3.2.2.3.3 Bananiers issus des rejet-écailles déshydratés pendant de 2 à 3 mois... 110
3.2.2.4 Identification des bananiers à meilleurs potentiels agronomiques ... 115
CHAPITRE IV : DISCUSSION ... 119
CONCLUSION ET PERSPECTIVES ... 132
REFERENCES BIBLIOGRAPHIQUES ... 137
VII
LISTE DES ABREVIATIONS
Organismes internationaux et structures nationales
FAO : food and agriculture organization (fond des nations unies pour l’alimentation et l’agriculture)
CNRA : centre national de recherche agronomique
SODEXAM : société d’exploitation et de développement aéroportuaire aéronautique et météorologique
INPHB : institut national polytechnique Houphouet Boigny
Statistique
ANOVA : analyse of variance (analyse de variance) ACP : analyse en composante principale
CAH : classification ascendante hiérarchique R2 : coefficient de détermination
a : pente de la droite de régression r : coefficient de corrélation p : niveau de probabilité
Paramètres agronomiques
H : hauteur C : circonférence
FE : nombre de feuilles émises FF : nombre de feuilles à la floraison FR : nombre de feuilles à la récolte IPF : intervalle plantation floraison IPR : intervalle plantation récolte Rm : masse du régime en kg
M : masse de la main en g (indices 1 à 4 = rang de la main) NM : nombre de mains du régime
VIII
Dm : masse du doigt central par main en g, (indices 2 et 4 = rang de la main)
Lem : longueur externe du doigt central par main en cm (indices 2 et 4 = rang de la main) Lim : longueur interne du doigt central par main en cm (indices 2 et 4 = rang de la main) Cm : circonférence du doigt central par main en cm (indices 2 et 4 = rang de la main) Hc : circonférence du de la hampe florale en cm
Hp : masse de la hampe florale en g Hl : longueur de la hampe florale
Codes des rejets et bananiers
Ecx,y : rejet-écaille (indice x = temps de déshydratation en mois et indice y = temps de réhydratation en j)
Bax,y : rejet baïonnette (indice x = temps de déshydratation en mois et indice y = temps de réhydratation en j) Sigles t : tonne % : pourcentage Mt : million de tonne K : potassium P : phosphore Mg : magnesium Ca : calcium C : carbone JL : jour long ha : hectare cv : cultivar méq : milliéquivalent l : litre
ppm : partie par million
IX
Autres
Mt : masse des rejets frais
Ms : masse des rejets déshydratés Te : teneur partielle en eau Nt : nombre de rejets frais Nn : nombre de rejets nécrosés Ts : taux de survie des rejets ra : racine principale
fl : feuille lancéolée rh : rhizome ;
efn : écaille foliaire nécrosée ef : écaille foliaire
ba : bourgeon apical f : fente latéral
rs : racines secondaires rai : racine intermédiaire ra : racines principales rh : rhizome
ne : nécrose
rsn : racine secondaire nécrosée rn : racine nécrosée ba : bourgeon apical ra : racine principale rs : racine secondaire ba : bourgeon apical br : bourgeon racinaire rh : rhizome p : pétiole am : axe mâle af axe femelle
l : longueur au cours des prises de mesures g : gaine foliaire enveloppante
X bp : le bulbe périphérique séparé
M : ligne de Mangin n : nécrose f : fibres de liber de : décoloration pa : parenchyme lacuneux ma : méristème apical l : lacune bp : bulbe périphérique zn : zone nécrosée ci : cellules indifférenciées
oc : cristaux d’oxalate sous forme de raphide cd : cellules désorganisées
ETP : l’évapotranspiration potentielle ETR : l’évapotranspiration réelle SES : le stock d’eau du sol SEI : stock d’eau initial
AEA : plus les apports d’eau annexes PE : des pertes d’eau
Fo : feuille origine FV : feuilles vivantes Rj : jeune rejet
Ra : rejet adulte
XI
LISTE DES FIGURES
Pages
Figure 1. Systématique des bananiers plantain ... 9
Figure 2. Aires de répartition des bananiers plantain en Afrique ... 10
Figure 3. Zones de culture des bananiers plantain en Côte d’Ivoire ... 11
Figure 4. Représentation schématique d’un bananier plantain cv Corne 1 ... 13
Figure 5. Polymorphisme des feuilles de bananiers plantain qui passent du stade écailles foliaires à celui de feuilles lancéolées ... 15
Figure 6. Première feuille fonctionnelle d’un rejet en phase adulte ... 15
Figure 7. Caractéristiques des cultivars de bananiers plantain de type Corne 1 et French ... 17
Figure 8. Rejets frais de bananier plantain cv Corne 1 débarrassés de leurs racines ... 29
Figure 9. Rejet-écaille de bananier plantain cv Corne 1 déshydraté un mois et débarrassé de ses écailles foliaires nécrosées ... 35
Figure 10. Croissance des rejets de bananier plantain cv Corne 1 préalablement déshydratés un mois et en culture hydroponique 15 j ... 37
Figure 11. Bananiers plantain âgés d’un mois issus des rejet-écailles déshydratés 1 mois et éveillés en culture hydroponique pendant 15 j ... 39
Figure 12. Schéma du bloc expérimental mis en place sur le site de culture au champ ... 39
Figure 13 A-B. Apparition de bourgeons racinaires sur le rhizome des rejets de bananiers plantain en culture hydroponique ... 46
Figure 14 A-B. Disposition des racines principales sur le rhizome des rejets de bananiers plantain cv Corne 1 en culture hydroponique ... 46
Figure 15 A-B. Présence de racines secondaires sur les racines principales des rejets de bananiers plantain cv Corne 1 en culture hydroponique pendant 15 j ... 47
Figure 16. Formation d’une touffe de racines après section de la racine principale chez un rejet-écaille en culture hydroponique pendant 21 j ... 49
Figure 17. Nécrose des racines principales et des racines secondaires formées sur un rejet-écaille de bananier plantain après 30 j de culture hydroponique ... 49
Figure 18. Emergence du bourgeon apical d’un rejet-écaille de bananier plantain cv Corne 1 en culture hydroponique durant 15 j ... 50
XII
Figure 19 A-B. Feuilles lancéolées de 1er, 2è et 3è ordre d’un rejet en culture hydroponique durant 30 j ... 51 Figure 20. Cinétique d’évolution de la masse des rejet-écailles et des rejets baïonnettes de bananier plantain cv Corne 1 préalablement non déshydratés en culture hydroponique .... 53 Figure 21. Evolution de la vitesse journalière de production de matière végétale de rejet-écailles et des rejets baïonnettes de bananier plantain cv Corne1 préalablement non déshydratés en culture hydroponique ... 53 Figure 22. Cinétiques d’évolution du nombre de racines formées chez les rejet-écailles et les rejets baïonnettes de bananier plantain cv Corne 1 préalablement non déshydratés en culture hydroponique ... 54 Figure 23. Symptômes sur les rejets baïonnettes déshydratés de bananier plantain cv Corne 1, après 1 mois de déshydratation ... 57 Figure 24. Symptômes sur les rejet-écailles déshydratés de bananier plantain cv Corne 1, après 1 mois de déshydratation ... 57 Figure 25. Symptômes sur les rejet-écailles déshydratés de bananier plantain cv Corne 1 après 2 à 4 mois de déshydratation ... 58 Figure 26. Cinétique d’évolution de la masse des rejet-écailles et des rejets baïonnettes de bananier plantain cv Corne 1 au cours d’un régime de déshydratation de 1 mois ... 59 Figure 27. Evolution des vitesses journalières de déshydratation des rejet-écailles et des rejets baïonnettes de bananiers plantain cv Corne 1 au cours d’un régime de déshydratation de 1 mois ... 61 Figure 28. Evolution de la masse fraîche des rejet-écailles de bananier plantain cv Corne 1 au cours d’une déshydratation de 2 à 4 mois... 62 Figure 29. Evolution des vitesses de déshydratation des rejet-écailles de bananier plantain cv Corne 1 au cours d’un régime de déshydratation de 2 à 4 mois ... 62 Figure 30 A-B. Morphologies des rejets de bananier plantain cv Corne 1 préalablement déshydratés un mois, en culture hydroponique durant 15 j ... 66 Figure 31. Bourgeons racinaires après 3 j de culture hydroponique sur un rejet-écaille de bananier plantain déshydraté un mois ... 66 Figure 32. Racines principales et racines secondaires après 15 j de culture hydroponique sur un rejet-écaille de bananier plantain déshydraté un mois... 67
XIII
Figure 33. Emergence du bourgeon apical après 15 j de culture hydroponique sur un rejet-écaille déshydraté un mois ... 67 Figure 34. Racines principales et secondaires après 15 j de culture hydroponique sur un rejet baïonnette de bananier plantain déshydraté un mois ... 69 Figure 35. Disposition des racines principales après 15 j de culture hydroponique sur le rhizome d’un rejet-écaille de bananier plantain déshydraté 2 mois ... 69 Figure 36. Grossissement de l’apex après 15 j de culture hydroponique sur un rejet-écaille de bananier plantain déshydraté durant 2 mois ... 70 Figure 37. Evolution en culture hydroponique de la masse fraîche des rejet-écailles et des rejets baïonnettes de bananier plantain cv Corne 1 déshydratés un mois ... 72 Figure 38. Evolution des vitesses de croissance pondérale des rejet-écailles et des rejets baïonnettes de bananiers plantain cv Corne 1 préalablement déshydratés 1 mois en culture hydroponique ... 72 Figure 39. Evolution en culture hydroponique de la masse de matière fraîche des rejet-écailles de bananier plantain cv Corne 1 déshydratés pendant 2 à 4 mois ... 73 Figure 40. Evolution des vitesses de croissance pondérale en culture hydroponique des rejet-écailles de bananier plantain cv Corne 1 préalablement déshydratés pendant 2 à 4 mois ... 75 Figure 41. Evolution du nombre de racines formées en culture hydroponique sur les rejet-écailles et les rejets baïonnettes déshydratés 1 mois ... 75 Figure 42. Evolution du nombre de racines formées sur des rejet-écailles de bananier plantain cv Corne 1 en culture hydroponique déshydratés durant 2 à 4 mois ... 77 Figure 43. Symptômes de la déshydratation sur le rhizome des rejet-écailles en coupe transversale chez le bananier plantain cv Corne 1 ... 81 Figure 44. Description des cellules du bulbe d’un rejet-écaille de bananier plantain déshydraté durant 1 à 4 mois ... 83 Figure 45. Evolution mensuelle annuelle des précipitations de la température et de l’hygrométrie à Abidjan de 2004 à 2006 ... 87 Figure 46. Analyse en composante principale sur les caractéristiques de croissance et de développement des bananiers issus des rejets préalablement soumis à un traitement hydrique et transférés en champ ... 97 Figure 47. Masses des régimes de bananes chez le bananier plantain cv Corne 1 issus des rejet-écailles et rejets baïonnettes non déshydratés en culture hydroponique ... 99
XIV
Figure 48. Masses de la hampe florale du régime de bananes chez le bananier plantain cv Corne 1 issus des rejet-écailles et rejets baïonnettes non déshydratés et éveillés en culture hydroponique de 15 et 30 j ... 103 Figure 49. Masses des régimes de bananes chez le bananier plantain cv Corne 1 issus des rejet-écailles et rejets baïonnettes déshydratés un mois et éveillés en culture hydroponique de 15 et 30 j ... 106 Figure 50. Masses de la hampe florale du régime de bananes chez le bananier plantain cv Corne 1 issus des rejet-écailles et rejets baïonnettes déshydratés un mois et éveillés en culture hydroponique de 15 et 30 j ... 109 Figure 51. Masses des régimes de bananes chez le bananier plantain cv Corne 1 issus des rejet-écailles déshydratés 2 et 3 mois et éveillés en culture hydroponique de 15 et 30j ... 111 Figure 52. Masses de la hampe florale du régime de bananes chez le bananier plantain cv Corne 1 issus des rejet-écailles déshydratés 2 à 3 mois et éveillés en culture hydroponique de 15 et 30 j ... 114 Figure 53. Analyse en composante principale sur les données morphologiques et de rendement des bananiers issus des rejets non déshydratés et déshydratés durant 1 à 3 mois puis éveillés en culture hydroponique ... 117
XV
LISTE DES TABLEAUX
Pages Tableau I. Valeur alimentaire et nutritionnelle de la banane ... 21 Tableau II. Effectifs des racines formées par les rejet-écailles et les rejets baïonnettes de bananier plantain cv Corne 1 préalablement non déshydratés en culture hydroponique ... 54 Tableau III. Perte en eau des rejet-écailles et des rejets baïonnettes de bananiers plantain cv Corne 1 après déshydratation d’un mois ... 64 Tableau IV. Perte en eau des rejet-écailles de bananiers plantain cv Corne 1 après déshydratation de 2 à 4 mois ... 64 Tableau V. Comparaison des effectifs moyens de racines formées à 15 j et 30 j de culture hydroponique sur les rejet-écailles et les rejets baïonnettes déshydratés un mois ... 77 Tableau VI. Comparaison des effectifs moyens des racines formées sur des rejet-écailles déshydratés pendant 2 à 4 mois à 15 j et 30 j de culture hydroponique ... 78 Tableau VII. Taux de survie en pépinières des rejets soumis à différents temps de déshydratation ... 79 Tableau VIII. Caractéristiques chimiques et granulométriques du site expérimental sis à Abobo-Adjamé ... 86 Tableau IX. Paramètres de croissance et de développement de bananiers plantain cv Corne 1 issus des rejets non déshydratés éveillés en culture hydroponique durant 15 et 30 j ... 89 Tableau X. Paramètres de croissance et de développement de bananiers plantain cv Corne 1 issus des rejets déshydratés un mois ... 92 Tableau XI. Paramètres de croissance et de développement de bananiers plantain cv Corne 1 issus des rejet-écailles déshydratés pendant 2 à 3 mois ... 94 Tableau XII. Masses et nombre de mains de régimes de bananes chez le bananier plantain cv Corne 1 issus des rejet-écailles et rejets baïonnettes non déshydratés éveillés en culture hydroponique de 15 et 30 j ... 101 Tableau XIII. Masses et effectifs des doigts de bananes chez le bananiers plantain cv Corne 1 issus des rejet-écailles et rejets baïonnettes non déshydratés éveillés en culture hydroponique de 15 et 30 j ... 101 Tableau XIV. Mensurations des doigts de bananes chez bananiers plantain cv Corne 1 issus des rejet-écailles et rejets baïonnettes non déshydratés et éveillés en culture hydroponique de 15 et 30 j ... 103
XVI
Tableau XV. Mensurations de la hampe florale du régime de bananes chez le bananier plantain cv Corne 1 issus des rejet-écailles et rejets baïonnettes non déshydratés et éveillés en culture hydroponique de 15 et 30 j ... 104 Tableau XVI. Masses et nombre de mains de régimes de bananes chez le bananier plantain cv Corne 1 issus des rejet-écailles et rejets baïonnettes déshydratés un mois et éveillés en culture hydroponique de 15 et 30 j ... 106 Tableau XVII. Masses et effectifs des doigts de bananes chez le bananiers plantain cv Corne 1 issus des rejet-écailles et rejets baïonnettes déshydratés pendant mois et éveillés en culture hydroponique de 15 et 30 j ... 108 Tableau XVIII. Mensurations des doigts de bananes chez le bananier plantain cv Corne 1 issus des rejet-écailles et rejets baïonnettes déshydratés pendant un mois et éveillés en culture hydroponique de 15 et 30 j ... 108 Tableau XIX. Mensurations de la hampe florale du régime de bananes chez le bananier plantain cv Corne 1 issus des rejet-écailles et rejets baïonnettes déshydratés un mois et éveillés en culture hydroponique de 15 et 30 j ... 109 Tableau XX. Masses et effectif des mains chez le bananier plantain cv Corne 1 issus des rejet-écailles déshydratés 2 et 3 mois et éveillés en culture hydroponique de 15 et 30 j ... 111 Tableau XXI. Masses et effectifs des doigts de bananes chez le bananiers plantain cv Corne 1 issus des rejet-écailles déshydratés 2 à 3 mois et éveillés en culture hydroponique de 15 et 30 j ... 113 Tableau XXII. Mensurations des doigts de bananes chez les bananiers plantain cv Corne 1 issus des rejet-écailles déshydratés 2 à 3 mois et éveillés en culture hydroponique de 15 et 30 j ... 113 Tableau XXIII. Mensurations de la hampe florale du régime de bananes chez le bananier plantain cv Corne 1 issus des rejet-écailles déshydratés 2 à 3 mois et éveillés en culture hydroponique de 15 et 30 j ... 114
1
2
INTRODUCTION
Le bananier est une plante dont la culture intéresse de nombreux pays situés dans la zone intertropicale à cause de son importance alimentaire et économique (ORELLANA et al. 2002). Originaire d’Asie du Sud, elle est cultivée dans plus de 120 pays du monde (JONES, 2000). La production mondiale de bananes a été estimée à 102,687 Mt dont 40 Mt de bananes plantain en 2003 (ANONYME 1, 2004). Deux sous-groupes de cultivars de cette plante sont impliqués dans cette exploitation. Il s’agit des bananiers à fruits consommés après cuisson (Plantain Corne, Plantain French) et ceux à fruits consommés crus, dont la banane de dessert (Figue sucrée, Pomme). Cette production est repartie sur les 5 continents. L’inde avec 24 % de la production mondiale en est le premier producteur. Par ailleurs, 75 % de la production de plantain ont été récoltés en Afrique (ANONYME 2, 2004). Du point de vue commercial la banane de dessert est incluse dans un système commercial mondial très florissant (Mc NEIL, 1995 ; ANONYME 3, 2004), alors que la banane plantain est reléguée à une culture traditionnelle et à un commerce certes très important mais avec une forte consommation locale (YAO, 1988). Ainsi donc, l’industrie de la banane engendre une source importante de revenus et d’emplois pour la majeure partie des pays exportateurs (FOURE et TEZENAS, 2000). Outre ses divers implications dans le domaine économique, la banane constitue un fruit riche en hydrates de carbone, en minéraux tels que le phosphore, le carbone, le potassium et aussi en vitamines A et C pouvant combler les insuffisances nutritionnelles (KLOTZ et GAU, 2002).
En Côte d’Ivoire, la banane plantain occupe la 3e place des productions vivrières après l’igname (3 Mt) et le manioc (1,7 Mt), avec une production annuelle estimée à 1,42 Mt (DUCROQUET, 2002 et ANONYME 4, 2005). Sa consommation moyenne annuelle par personne (75 à 90 kg) combinée à celle du manioc et de l’igname permet de fournir 30 % des besoins journaliers calorifiques estimés à 2525 kcals (ANONYME 5, 1997 ; ANONYME 6, 2004). Les superficies occupées par cette culture sont difficiles à estimer car, très souvent, les bananiers plantain sont cultivés aux abords des maisons (culture dite de case) pour profiter au maximum des déchets ménagers. Ils sont également associés à certaines cultures pérennes (caféier, cacaoyer) et à la plupart des cultures vivrières (manioc, taro, maïs, haricot, arachide) (MOLINA, 1987 ; N’DABALISHYE, 1995). Toutefois, la monoculture de bananier plantain démarre timidement et le système de production est extensif avec une faible productivité.
3
Cette production insuffisante par rapport à la demande reste saisonnière. Elle est marquée par une période d’abondance de Septembre à Mars et une période de pénurie d’Avril à Août.
La production bananière est malheureusement menacée par de nombreuses contraintes. Il s’agit de problèmes liés à la prolifération d’agents pathogènes (champignons, nématodes, virus et bactéries) qui provoquent d’énormes dégâts au niveau des feuilles, des racines et du régime de bananes, ce qui entraine une baisse de la production (TUSHEMEREIREWE et al. 2003 ; RANDY, 2004). Une autre limite à la culture bananière réside dans l’utilisation des rejets baïonnettes réduits à l’unité par pied-mère. Cet effectif réduit crée des problèmes de disponibilité des unités de propagation pour la création ou le renouvellement des exploitations bananières (TURQUIN, 2005). Par ailleurs, l’inhibition naturelle observée chez les rejets baïonnettes après leur séparation du bulbe parental constitue aussi un obstacle à la mise en place des plantations (ANNO, 1981). La résolution de ce problème passe par une levée de dormance de ces unités de propagation.
L’approche paysanne consiste à utiliser des rejets baïonnettes en quantité importante au détriment des rejet-écailles de petite taille et à les maintenir après récolte en séjour prolongé de 2 semaines avant leur plantation. Cette pratique culturale réalisée de façon empirique a pour but de résoudre la problématique de disponibilité et de dormance des rejets baïonnettes. Habituellement, les rejets baïonnettes sont récoltés et stockés dans le champ afin de constituer une réserve d’unité de plantation. Cette conservation entraine un départ d’eau des tissus par déshydratation. Ensuite les rejets baïonnettes sont mis en culture. La pratique de cette méthode traditionnelle trouve sa justification dans l’utilisation courante des graines de céréales séchées (mil, maïs, sorgho etc.) pour la mise en place des exploitations céréalières dans le cadre d’une production normale ou de contre-saison. En effet, les graines de céréales de façon courante ne sont pas immédiatement plantées après récolte. Un séchage traditionnel ou artificiel de ces graines se fait par la chaleur ou l’action des rayons solaires (la déshydratation) (WINFIELD et HART, 1983 ; CRUZ et al. 1988). Le tout étant de permettre à la graine de perdre suffisamment d’eau afin de rentrer dans un état de vie ralentie. Car Plus l’eau est libre dans la graine, plus elle y est disponible pour les réactions (biochimiques) d’altération. Par contre si elle est absente ou liée dans la graine, l’activité des substances chimiques (enzymes) est arrêtée. Le retour à la normalité nécessite pour certaines semences un traitement de levée de dormance et pour d’autres une plantation directe après un court trempage dans de l’eau (COME et al. 1984). De même, les plantes à tubercule telles que l’igname subissent un temps de déshydratation avant leur transfert en champ (KOUAKOU et DUMONT 1998 ; DUMONT et al. 2005). Cette pratique a pour but de levé l’inhibition dans
4
le matériel végétal et ainsi facilité l’émission du bourgeon axillaire organe régénérateur du pied chez l’igname (ZOUNDJIHEKPON et al. 1995 ; TOSTAIN et al. 2003). Tout ceci révèle l’importance de la conservation des tubercules pour la levée de dormance des boutures d’igname (ZOUNDJIHEKPON, 1997 ; DANSI et al.1998).
Le choix de la déshydratation comme procédé de conservation des semences de céréales et des boutures d’igname est motivé par les avantages que présente cette méthode naturelle. En effet, l’utilisation de cette méthode ne nécessite pas de ressources financières. Elle est donc moins onéreuse. De plus, elle permet un taux de survie élevé des semences ou boutures tout en évitant une dénaturation brutale des tissus et des métabolites cellulaires.
Corrélativement à l’utilisation des rejets baïonnettes d’autres éléments de propagation de la plante ont été créés et valorisés à savoir : les vitroplants acclimatés et mis en champ (GUBBUK et PEKMEZCI, 2006 ; CHA-UM et al. 2007) ; les vivoplants issus d’une stimulation préférentielle du rhizome (MANZUR, 2001) et les méristèmes apicaux enrobés dans une matrice d’alginate (SADIK et al. 2007). Mais les coûts de revient onéreux et les comportements différenciés au champ ont rendu difficile la vulgarisation de ces unités de plantation en Côte d’Ivoire. Par conséquent, la rareté des semences demeure toujours et constitue aujourd’hui un des problèmes majeurs de la mise en place de nouvelles plantations.
Depuis la découverte des potentialités agronomiques des rejet-écailles, de leur importance (nombre élevé de 5 à 8) sur le rhizome du bananier plantain (SEGUIN et ANNO, 1986) ainsi que l’étude de leur morphogenèse (TURQUIN, 2005 et 2007) une nouvelle opportunité s’est offerte à la culture bananière. Ces rejet-écailles constituent un matériel nouveau de plantation possédant un fort potentiel agronomique. Toutefois, ils sont puissamment inhibés une fois détachés du bulbe parental. A l’instar des graines de céréales et des tubercules d’igname que se passerait-il si les rejet-écailles étaient stockés en champ après la récolte avant d’être mis en culture ? Autrement dit, comme cela est le cas pour les rejets baïonnettes ne serait-il pas possible de levé cette inhibition par la déshydratation des rejet-écailles ? Un des moyens pour contourner cette dormance naturelle des rejet-rejet-écailles serait de les conserver pendant un temps qu’il restera à déterminer. Cette approche permettra de disposer d’unités de plantation en quantité suffisante. En Côte d’Ivoire, la recherche sur la conservation des unités de propagation est encore fragmentaire. Les seuls travaux réalisés se rapportent aux essais sur la caractérisation pathologique in vivo du stress hydrique appliqué aux rejet-écailles de bananiers plantain cv Corne 1 (BOYE et al. 2008).
La présente étude a pour objectif de contribuer à la résolution des contraintes de production du bananier plantain, dues à la faible disponibilité des semences, à travers la
5
valorisation et l’utilisation des rejet-écailles en passant par une déshydratation et des conditions d’éveil contrôlées.
L’hypothèse générale de notre travail peut être formulée comme suit : Il est possible de valoriser les unités de plantation que constituent les rejet-écailles en mettant en œuvre une déshydratation et des conditions d’éveil contrôlées.
Les sous hypothèses sont les suivantes :
1. la déshydratation des rejet-écailles est possibles jusqu’à 4 mois ;
2. l’éveil des rejets après des temps de déshydratation peut être conduit dans des conditions de cultures hydroponiques minimales ;
3. il est possible de mesurer les caractéristiques morphologiques, la diversité et la dynamique racinaires qui sont exprimées au cours de l’éveil en culture hydroponique minimale ;
4. les performances au champ des bananiers issus des rejet-écailles sont meilleures par rapport à celles des rejets baïonnettes.
Les résultats attendus sont les suivants :
- les rejet-écailles déshydratés sont disponibles ;
- les conditions de culture hydroponique sont maîtrisées ;
- les caractéristiques morphologiques, la diversité et la dynamique racinaires sont connus ;
- les bananiers issus des rejet-écailles déshydratés sont performants au champ. Ce mémoire comporte quatre chapitres. Après l’introduction, la revue bibliographie est présentée dans le chapitre I. Le matériel et la méthodologie de recherche utilisés sont abordés dans le chapitre II. Les résultats obtenus sont exposés dans le chapitre III. La discussion constitue le chapitre IV. Enfin, une conclusion et les perspectives terminent le document.
6
7
CHAPITRE I : REVUE BIBLIOGRAPHIQUE
1.1 GENERALITES SUR LE BANANIER
1.1.1. Origine et systématique
Les cultivars actuels de bananiers proviennent d’espèces sauvages séminifères originaires d’Asie du Sud-Est (de l’Inde à l’Ouest aux Philippines à l’Est, de la Malaisie au Nord à l’Australie au Sud), où se situe le centre primaire de diversification du genre. Son introduction en Afrique occidentale remonte, à l’instar d’autres plantes, au 16e siècle (N’DABALISHYE, 1995). Ces cultivars se sont répandus dans toutes les régions intertropicales humides et chaudes, des plaines jusqu’à 2000 m d’altitude, débordant parfois dans certaines zones subtropicales. Des centres de diversification secondaire existent en Afrique de l’Ouest et Centrale (bananiers plantain) et sur les hauts plateaux d’Afrique de l’Est (bananes à cuire et à bière) (AKED et KYAMUHANGIRE, 1996).
La taxonomie des bananiers est assez complexe. Plusieurs auteurs s’y sont intéressés (EMBERGER, 1960 ; SIMMONDS, 1962 ; CHAMPION, 1963 ; BRICKELLE, 1980 ; ANNO, 1981 ; TEZENAS, 1985 ; HORRY, 1989 ; BAKRY et al. 2002).
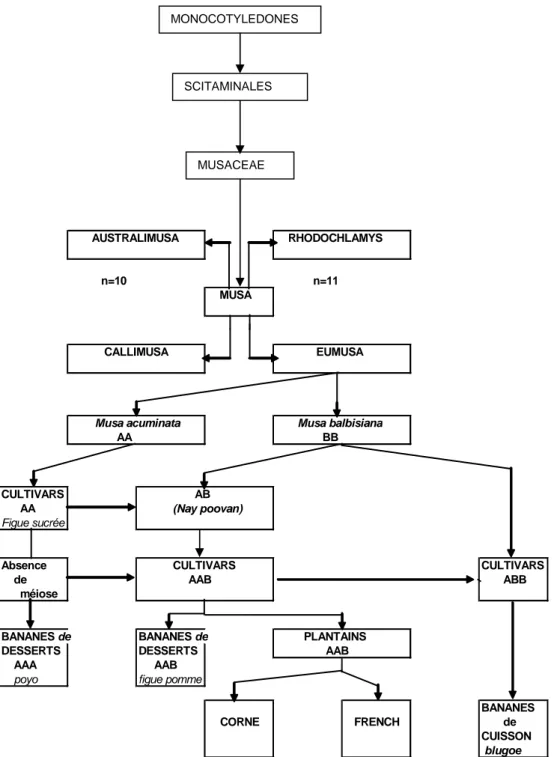
D’après ces travaux, les bananiers sont des plantes herbacées, de la classe des Monocotylédones et de l’ordre des Scitaminales dans lesquels sont inclus les Cannaceae, les Maranthaceae, les Zingibéraceae, les Strelitziaceae et les Lowiaceae. Les bananiers appartiennent à la famille des Musaceae qui se compose de deux genres (Musa et Ensente) caractérisés par la présence d’un androcée non pétaloïde à 5 et 6 étamines. Les feuilles et les bractées sont en spirales, les fleurs mâles et femelles ou hermaphrodites sont séparées à l’intérieur d’une inflorescence ; les fruits (séminifères) possèdent plusieurs graines. Le genre
Musa renferme à la fois des espèces séminifères à fruits comestibles et des espèces à fruits
charnus sans graines (parthénocarpiques). Il se divise en quatre sections : Australimusa, Rhodochlamys, Callimusa et Eumusa. Parmi les Musa séminifères, deux espèces de la section Eumusa (Musa acuminata et Musa balbisiana) sont à la base de l’apparition des bananiers à fruits parthénocarpiques selon divers processus génétiques (CHEESMAN, 1933 ; KURZ, 1965 ; BAKRY et al. 2002) (Figure 1). Ces bananiers contiennent à la fois des génomes de l’une ou l’autre espèce selon l’hypothèse suggérée par SIMMONDS et SHEPERD (1955).
8
Les plantain sont, ainsi, des hybrides triploïdes ayant deux génomes de Musa
acuminata et un génome de Musa balbisiana. Ce sont des cultivars du groupe AAB.
Les bananiers plantain du groupe AAB, se composent de deux sous groupes qui se distinguent par la présence de ou l’absence de l’axe floral mâle (ANNO, 1981) :
- si l’axe mâle est persistant, habituellement revêtu de survivances persistantes de fleurs mâles ou de bractées, ce sont des "French"
- si l’axe mâle est absent ou très tôt dégénérescent, ce sont des "Corne".
Les travaux de DE LANGHE (1961) sur les plantain du Congo ont contribué à mettre en relief la distinction entre ces sous-groupes. Les variétés exploitées, communément cultivées, sont appelées "Cultivars".
Le cultivar, qui fait l’objet de notre étude, appartient au groupe de triploïde (hybride de M. acuminata et de M. balbisiana) AAB de type Corne. Il s’agit du bananier plantain cultivar Corne1.
1.1.2 Géographie et écologie
1.1.2.1 Géographie
Le genre Musa se rencontre depuis les Indes jusqu’au Népal. Mais également en Birmanie, en Indochine, en Malaisie, en Indonésie, aux Philippines, en Nouvelle Guinée et dans quelques archipels de l’Est-Pacifique. Cependant, les travaux de JAIN (1965) sur les Musacées fossiles semblent montrer que cette répartition serait plus étendue. En Afrique, il se rencontre particulièrement dans la zone côtière du Golfe de Guinée et à l’intérieur de la forêt mésophile humide (FLINN, 1976), autour de l’équateur entre 10° de latitude, Nord et Sud (Figure 2). En Côte d’Ivoire, la zone de production du bananier correspond à la zone forestière. Elle s’étend entre le 5e et le 8e degré de latitude sud et entre le 3e et le 8e degré de longitude sud. La production de plantain a lieu particulièrement sur la bande côtière du Golf de Guinée (Figure 3).
9
Figure 1 : Systématique des bananiers plantain
Source : Anno (1981) MONOCOTYLEDONES SCITAMINALES AUSTRALIMUSA RHODOCHLAMYS n=10 n=11 MUSA CALLIMUSA EUMUSA
Musa acuminata Musa balbisiana
AA BB
CULTIVARS AB AA (Nay poovan)
Figue sucrée
Absence CULTIVARS CULTIVARS de AAB ABB méiose
BANANES de BANANES de PLANTAINS DESSERTS DESSERTS AAB AAA AAB
poyo figue pomme
BANANES CORNE FRENCH de
CUISSON
blugoe MUSACEAE
10
10° 0 10°
Figure 2 : Aire de répartition des bananiers plantain en Afrique (à l’intérieur des
11
Figure 3 : Zones de culture du bananier plantain en Côte d’Ivoire
*Odienné *Korhogo Bouna* Bondoukou * * Tanda Agnibilekrou * Abengourou* *Touba *Man *Danané Guiglo* *Soubré *Issia *Daloa *Vavoua Lakota * *Divo *Bouaké Béoumi * Tiassalé * Adzopé * *Abidjan Aboisso * Sassandra * San-Pedro * Tabou * YAMOUSSOUKRO
*
Ghana Libéria Guinée Mali Burkina Faso Golfe de Guinée12 1.1.2.2 Ecologie
Des conditions climatiques et pédologiques favorables sont nécessaires pour une bonne production (BAKRY et al. 2002). La pluviométrie pour la culture du bananier plantain doit être importante et bien répartie sur tous les mois de l’année. Elle varie de 1800 mm à 2000 mm par an, en général. Une température optimale annuelle voisine de 28 °C est favorable à la croissance bananière. Au-delà de 35 - 40 °C, des anomalies surviennent. En dessous de 24 °C, la vitesse de croissance baisse pour s’annuler entre 10 - 12 °C. Le bananier a besoin pour grandir d’un ensoleillement variant de 2000 à 2400 h / an. Une insolation brutale ou faible provoque un ralentissement de la croissance. De préférence, l’on recherche des zones protégées du vent, pour éviter des chutes dans les plantations. Si possible, l’on utilise des haies brise-vent.
Le sol des terrains en culture bananière doit être meuble, bien aéré La nappe doit se trouver au moins à 80 cm de profondeur. Le bananier supporte des pH de 3,5 à 8 en général, on essaye de l’amener entre 5,5 et 7,5 par des amendements. Le bananier a des besoins importants en azote et en potassium. A l’opposé, il est peu exigent en magnésium (Mg), phosphore (P) et calcium (Ca) (TEZENAS, 1985).
1.1.3 Biologie
1.1.3.1 Description de la plante
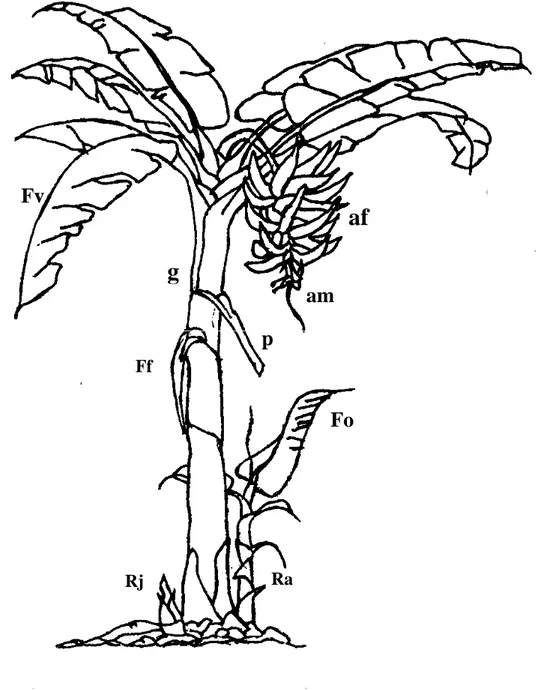
La description du bananier, en général, a été faite par plusieurs auteurs (CHAMPION, 1963 ; SIMMONDS, 1966 ; ANNO, 1981 ; SERY, 1983 ; KWA, 1993 ; KOBENAN et al. 1997 ; SCHOOPS, 1997). Les bananiers plantain ne s’écartent pas de cette description (Figure 4). La description générale présentée ici du système souterrain et aérien du bananier est effectuée d’après celle d’ANNO (1981) et TEZENAS (1985).
- Système souterrain
Le système souterrain est composé essentiellement d’un organe souterrain appelé rhizome souche ou pied-mère. Ce dernier, désigné improprement sous le terme de tige souterraine, émet jusqu’à la floraison de nombreuses racines qui restent groupées dans la couche des 30 cm superficiel du sol. La nutrition en eau et en éléments minéraux dépend du système racinaire.
13
af
am
Fo
Ra Rj Ffg
Fv
p
Figure 4 : Représentation schématique d’un bananier plantain, cultivar Corne 1
Source : ANNO (1981)
Feuilles vivantes (FV), jeune rejet (Rj), rejet adulte (Ra), feuille lancéolée (Fo),
14
Plus les racines seront nombreuses, longues et en bon état et plus le bananier absorbera dans le sol les éléments qui lui sont nécessaires. Le rhizome se ramifie également au niveau de la même assise génératrice pour donner des rejets, pour perpétuer le cycle de développement de la plante. Le méristème apical à ce stade émet des feuilles en disposition hélicoïdale (feuilles lancéolées, feuilles adultes ou fonctionnelles) qui appartiennent au système aérien (ANNO et LAMBERT, 1976).
- Système aérien
Les parties basales des feuilles s’élargissent en gaines foliaires, dont l’imbrication, selon une phyllotaxie spiralée, constitue le faux-tronc encore appelé pseudotronc des bananiers. Il joue un rôle de soutien, de stockage des réserves minérales et hydriques et d’un rôle de conduction de la sève. La rigidité de ce faux-tronc tient essentiellement à sa forte teneur en eau et à la disposition particulière des fibres de ses vaisseaux.
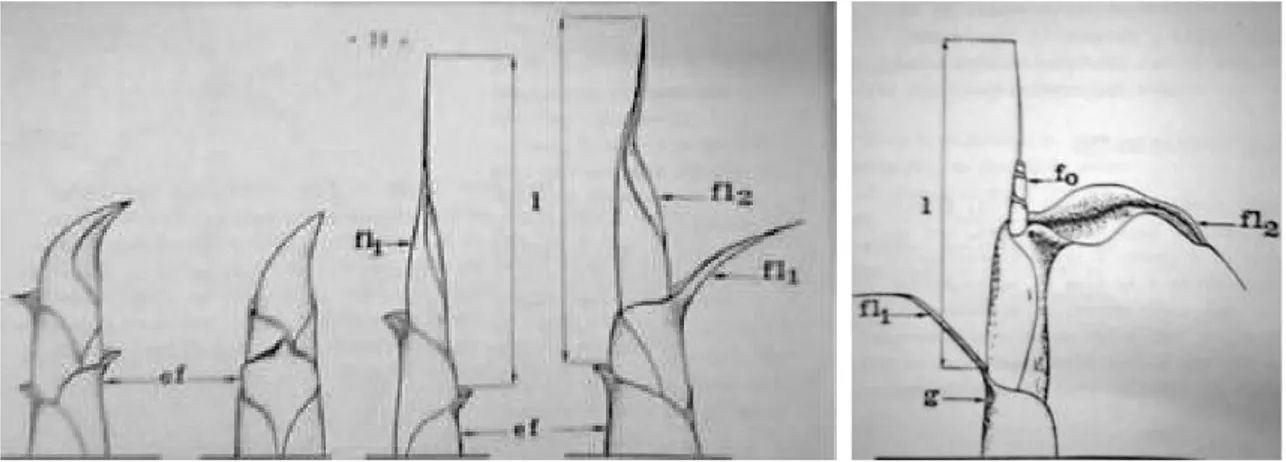
Chez le bananier, la formation des feuilles à lieu au niveau de l’unique méristème du bulbe souterrain. Ces feuilles sont caractérisées par un polymorphisme évolutif (SKUTCH, 1930 ; BARKER, 1969 ; ANNO, 1981). Pour ANNO (1981), ce polymorphisme n’est pas seulement une transformation qualitative mais aussi une modification quantitative qui se propage et se développe au cours du cycle floral. Selon cet auteur, deux phases se distinguent dans l’ontogenèse du bulbe. L’action du polymorphisme se manifeste d’abord de façon apparente sur la forme et les dimensions foliaires du stade juvéniles, puis de façon perceptibles mais caractéristiques sur les dimensions foliaires du stade adulte (ANNO, 1981). De ce qui précède, il ressort que la phase juvénile est caractérisée par un polymorphisme apparent où la feuille passe du stade d’écaille foliaire à celui de feuille lancéolée (Figure 5) par une série de modifications perceptibles jusqu’à la feuille lancéolée de 4è ordre (Fo). Le terme de lancéolée, se rapporte à l’extrémité distale de la feuille. Après la formation des feuilles lancéolées dont le nombre (1, 2, 3 ou 4) varie avec la vigueur de la plante, apparaît la première feuille fonctionnelle (F1) illustrée par la figure 6. Cette feuille est caractérisée par une troncature gauche au sommet du limbe au niveau du filament précurseur, une nervure centrale, une gouttière pétiolaire et une gaine pétiolaire (Figure 6). La forme de la feuille est alors définitive ; c’est la phase de feuille adulte ou feuille fonctionnelle. Dans les conditions optimales de croissance, le bananier émet un nombre déterminé de feuille (35 à 45 feuilles). Le nombre théorique de feuille dépend du cultivar (TEZENAS, 1985).
15
Figure 5 : Polymorphisme des feuilles de bananier plantain qui passent du stade écailles foliaires à celui de feuilles lancéolées
Source : ANNO (1981)
(ef) écaille foliaire ; (fl1) feuille lancéolée de premier ordre, (fl2) feuille lancéolée de deuxième ordre, (fo) feuille origine ; l = longueur au cours des prises de mesures ; g = gaine foliaire enveloppante.
Figure 6 : Première feuille fonctionnelle d’un rejet en phase adulte
Source ANNO (1981)
(ef) écaille foliaire ; (fl1) feuille lancéolée de premier ordre, (fl2) feuille lancéolée de deuxième ordre, (fo) feuille origine ; l = longueur au cours des prises de mesures ; g = gaine foliaire enveloppante.
16
La formation des fleurs qui entraîne la montée de la hampe inflorescentielle a été particulièrement étudiée par BARKER et STEWARD en 1962. L’inflorescence qui apparaît au centre du bouquet foliaire comprend :
- des fleurs femelles, disposées par groupe en deux rangées imbriquées et pressées entre la bractée qui recouvre l’inflorescence et le bourgeon sous-jacent ; un groupe de fleurs femelles s’appelle « main » et par analogie, les fruits sont appelés « doigts ». - des fleurs mâles, qui apparaissent le long de l’axe inflorescentiel après les fleurs femelles selon la même disposition ; le processus de leur formation se poursuit bien au-delà de la formation des fruits.
A maturité l’ensemble des fruits constitue le régime de bananes. Les plantain étant parthénocarpiques, la transformation des ovaires femelles en fruits se fait sans fécondation préalable. De ce fait, le fruit ne renferme pas de graines. Ce sont des triploïdes stériles (DE LANGHE, 1961) dont la reproduction se fait à partir du bulbe souterrain par bourgeonnement d’éléments reproducteurs que sont les rejets. Dans la vie du bananier, il y a donc une phase végétative durant laquelle le même méristème apical produit des feuilles, puis une phase florale durant laquelle il donnera des pièces florales (bractées, fleurs femelles ou mâles).
1.1.3.2 Caractéristiques du sous-groupe de plantain
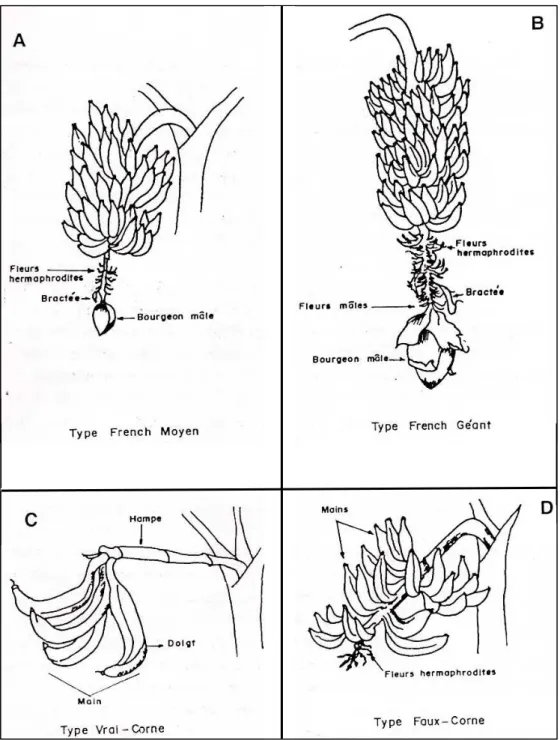
Selon ROWE (1976) le sous-groupe des plantain renferme deux types de cultivars représentés par les « French » et les « Corne ».
- Cultivars de type "French"
Les cultivars de type“French” se distinguent par un nombre élevé de mains, (6 à 10), de doigts relativement courts mais nombreux. L’inflorescence est complète, le bourgeon mâle est toujours présent, la hampe florale porte de nombreuses fleurs hermaphrodites et mâles persistants. Les cultivars de type“French” géants (Figure 7 A) émettent plus de 40 feuilles, avant la floraison, leur nombre de mains est supérieur à 10. Les cultivars de type “French” géants ont des cycles relativement longs (15 à 18 mois). Les cultivars de type “French”moyens (Figure 7 B) émettent entre 24 et 38 feuilles avant la floraison. Leurs cycles sont d’une durée moyenne de 12 à 15 mois. L’inhibition des rejets est faible. Le poids des régimes varie entre 15 et 30 kg (ANNO, 1981 ; TEZENAS, 1985).
17
Figure 7 : Caractéristiques des cultivars de bananiers plantain de type Corne 1 et French
18 - Cultivars de type "Corne"
Les cultivars de type “faux Corne” (Figure 7 C) se distinguent par un nombre peu élevé de mains (3 à 6), des doigts longs et gros mais peu nombreux. L’inflorescence est incomplète ; le bourgeon mâle disparaît à maturité. Après la dernière main de bananes, la hampe porte quelques fleurs hermaphrodites. Les types “faux Corne” ont un cycle relativement court (inférieur ou égal à 12 mois). L’inhibition des rejets est faible et leur nombre est élevé. Le poids des régimes varie entre 5 et 10 kg. Les cultivars de type “vrai Corne” (Figure 7 D) n’ont que 1 à 3 mains. Leurs doigts sont très longs et souvent très gros mais ils sont très peu nombreux (moins de 10). L’inflorescence est incomplète. Les "vrais Corne" ne présentent pas d’intérêt pour l’agriculteur (ANNO, 1981 ; TEZENAS, 1985).
1.2 SYSTEME DE CULTURE DU BANANIER
1.2.1 Cultures traditionnelles sans intrants
La culture dite « de case » consiste à planter des bananiers plantain aux abords des maisons afin que ceux-ci profitent au maximum des ordures ménagères. C’est, en général, dans ce type de culture que l’on voit les plus beaux bananiers. Les cendres provenant du foyer sont dispersées autour des touffes formées par les bananiers apportant des éléments minéraux et, aux dires des paysans, jouant un rôle insecticide contre le charançon du bananier (TEZENAS, 1985)
Avec le développement de l’urbanisation dans de nombreux pays tropicaux, les bananes sont de plus en plus souvent produites dans des arrières cours, le long des routes, et en ville sur des terrains vagues. Cette production péri-urbaine est devenue une source très importante d’énergie et de vitamines pour les citadins (ANONYME, 2001). Le système de culture associée repose sur des combinaisons de différentes cultures, chacune exploitant un espace souterrain et aérien différent. Le bananier est, généralement, cultivé en association avec le piment, le manioc et la tomate.
1.2.2 Culture intensive
Dans ce système de culture, la production bananière est destinée à la vente sur les grands centres urbains les plus proches voire à être exportée (N’DABALISHYE, 1995). Les plantations sont de deux types : plantation en culture pure et plantation en culture intercalaire.
19 1.2.2.1 Plantation en culture pure
Chaque parcelle est composée d’un seul cultivar. Le matériel sélectionné est aussi homogène que possible. La densité de plantation est fonction des caractéristiques du climat, du sol, du cycle de culture et des cultivars utilisés. Plus la densité sera élevée, plus les cycles seront longs et plus les poids moyens des régimes seront faibles (TEZENAS, 1985)
D’autres dispositifs peuvent être utilisés :
- plantation à faible densité avec remplacement des pieds morts au cours des cycles ; - plantation à très forte densité avec des cultivars de type ‘’faux Corne’’ en espérant récolter le maximum de fruits au premier cycle ;
- une technique particulière consiste à planter avec des écartements doubles entre les lignes pour permettre sur la même parcelle une seconde plantation décalée dans le temps, en intercalaire de la première (N’DABALISHYE, 1995).
1.2.2.2 Plantation en culture intercalaire
Les dispositifs de plantation en culture intercalaire sont fonction de la culture principale et l’accent mis par le planteur sur tel ou tel facteur : productivité, ombrage, importance accordée à la culture du plantain par rapport à l’autre culture. Les cultures les plus couramment cultivées avec le plantain sont : cultures vivrières (maïs, manioc, légumineuse, patates douces), cacaoyer ou le caféier, hévéa (N’DABALISHYE, 1995).
1.3 VALEUR NUTRITIVE ET SOCIO-ECONOMIQUE DU BANANIER PLANTAIN
Le bananier plantain est une plante dont l’importance se situe à différents niveaux : nutritionnel et socio-économique.
1.3.1 Au niveau nutritionnel
Les estimations de la FAO ont montré que 842 millions de personnes souffrent de sous-alimentation dans le monde (ANONYME 3, 2004). L’approvisionnement de cette population passe par une diversification des cultures vivrières notamment par l’utilisation de la banane plantain (MOURICHON, 1995).
20
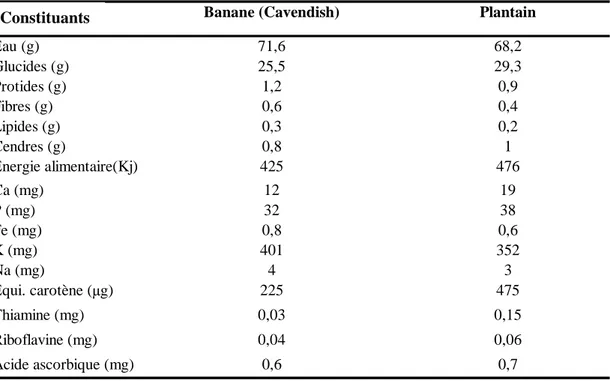
Certaines parties du bananier, notamment les feuilles sont utilisées pour l’alimentation du bétail (OTEGBAYO, 2002). Le pseudotronc, la pulpe et la pelure sont utilisés pour la fabrication de la bière et du vinaigre. En Afrique centrale et orientale, le jus des fruits mûrs de certains cultivars est utilisé pour obtenir une bière à faible teneur en alcool (ANONYME 7, 2003). La banane est particulièrement riche en éléments minéraux tels que le fer et le potassium. De même, elle constitue une bonne source de vitamines C, B6 et A et également d’oligoéléments, glucides et fibres (Tableau I). La banane, de ce fait, peut être utilisée pour suppléer les carences minérales chez l’homme. Elle peut être utilisée comme engrais minéral. Dans le même temps, son niveau de protéines est faible et elle ne contient quasiment pas de matières grasses (ANONYME 8, 2007). La banane pourrait donc constituer un complément utile à l’équilibre des rations alimentaires (KOTZ et GAU, 2002), dans les pays en voies de développement.
1.3.2 Au niveau socio-économique
Le bananier est une plante utilisée en phytothérapie, notamment par les tradipraticiens africains contre certaines affections. Son fruit possède des propriétés thérapeutiques, notamment contre les affections digestives, circulatoires et rhumatismales (RABBANI et al. 2001 ; 2004 ; PANNANGPETCH et al. 2001). Ainsi, la leucocyanidine du bananier protège-t-elle la muqueuse gastrique contre les effets secondaires de l’aspirine (LEWIS & SHOW, 2001). Les bananes, avec leur composition voisine de celle de la muqueuse stomacale, joue un rôle dans le traitement de l’ulcère gastrique. Par ailleurs, le pseudotronc et la pulpe sont utilisés pour la production de bioéléments comme l’essence et le biogaz. Les bananiers et bananiers plantain fournissent beaucoup de fibres très utilisées dans la fabrication de certains papiers et de cordage (INIBAP, 2001). Le pseudotronc est également utilisé pour la confection de vêtements, des chapeaux, de filets et de billets de banques. La banane est aussi une plante ornementale. Ses feuilles sont aussi utilisées comme matériau de couverture, colliers, parapluie, assiette biologique. Les fleurs de certains bananiers rentrent dans la confection des bouquets de fleurs (RIAZ et SURRENDE, 1998).
L’industrie de la banane engendre une source importante de revenus, d’emplois et recettes d’exportation pour la majeure partie des pays exportateurs. De nombreuses plantations de bananiers réalisées emploient du personnel et utilisent beaucoup d’intrants, d’ou son intérêt économique indéniable. La banane et la banane plantain occupent la 4e place des productions vivrières dans le monde après le riz, le blé, et le maïs.
21
Tableau I : Valeur alimentaire et nutritionnelle de la banane
Source : FAO, 1972
Pour 100 g Banane (Cavendish) Plantain
Eau (g) 71,6 68,2 Glucides (g) 25,5 29,3 Protides (g) 1,2 0,9 Fibres (g) 0,6 0,4 Lipides (g) 0,3 0,2 Cendres (g) 0,8 1 Energie alimentaire(Kj) 425 476 Ca (mg) 12 19 P (mg) 32 38 Fe (mg) 0,8 0,6 K (mg) 401 352 Na (mg) 4 3 Equi. carotène (µg) 225 475 Thiamine (mg) 0,03 0,15 Riboflavine (mg) 0,04 0,06 Acide ascorbique (mg) 0,6 0,7 Constituants
22
Elles constituent une ressource alimentaire importante pour la plupart des pays tropicaux et contribuent ainsi à leur sécurité alimentaire. La banane dessert qui fait l’objet d’échanges internationaux, vient en deuxième position après les agrumes (ANONYME 9, 2001). En 2003, la production mondiale de banane et banane plantain était de 102 685 000 t. L’Inde avec 24 % de la production mondiale en était le premier producteur. Les exportations totales de banane ont représenté 15,5 Mt avec l’Equateur qui fournit à lui seul 27 % des exportations mondiales (ANONYME 3, 2004). La Côte d’Ivoire avec 2% de la production mondiale exportait 767.000 t de banane et banane plantain, occupant ainsi le huitième rang mondial devant le Brésil et le Cameroun. La consommation nationale de banane plantain est estimée à 700.000 t par an avec une consommation par tête d’habitant évaluée à 90 kg (ANONYME 5, 1997 et ANONYME 6, 2004).
1.4 REGENERATION ET CONSERVATION DES UNITES DE PROPAGATION
1.4.1 Eléments de régénération des bananiers
La mise ne place des bananeraies traditionnelles se fait avec les rejets baïonnettes (LASSOURDIERE, 1978 ; ANNO, 1981 ; TEZENAS, 1985) qui sont réduits à l’unité par pied-mère ; entrainant du coup un problème de disponibilité des unités de propagation pour le renouvellement de plantation. D’un autre côté la production bananière est constamment menacée par de nombreuses contraintes dont certaines sont liées à des agents pathogènes (champignons, nématodes, virus et bactéries) et d’autres rattachés à des facteurs abiotiques (climat, sol, environnement) ce qui limite le rendement des bananiers (TUSHEMEREIRWE et
al. 2003 ; RANDY, 2004).
Dans ce contexte délétère, plusieurs aspects de la multiplication végétative ont été étudiés pour assurer la pérennité de la plante (NALINA et al. 2006 ; NOUPADJA et al. 2007). Ces derniers ont mis en évidence l’utilisation de diverses unités de propagation pour la régénération des bananiers. Ces éléments de plantation ont été créés dans le but de contribuer à l’essor de la culture bananière. Il s’agit entre autre des vitroplants obtenus à partir de la culture in vitro de tissus de bananiers. Ces derniers conservés dans des vitrothèques sont acclimatés et utilisés pour la reconstitution des plantations (COX et al. 1960 ; BERG et BUSTAMANTE, 1974 ; MOLINA, 1987 ; MATEILLE et FONCELLE, 1989 ; GUBBUK et PEKMEZCI, 2006 ; CHA-UM et al. 2007).
23
La stimulation préférentielle du rhizome à partir des substances hormonales a permis de mettre au point des vivoplants qui sont des œilletons, futurs plants de bananiers, destinés à la plantation (WILSON et al. 1987, CORDEIRO et DOS SANTOS, 1991 ; MANZUR, 2001).
Dans le souci de mettre au point des unités de propagation performantes, des essais d’encapsulation des méristèmes apicaux ont conduits les chercheurs à les enrobés dans une matrice d’alginate pour servir de " semences " artificielles (RAO et al. 1992 ; SADIK et al. 2007).
Des études plus poussés au niveau cellulaire ont montré l’intérêt des protoplastes et des embryons somatiques pour l’amélioration variétale et la régénération du bananier (NOVAK et al. 1989 ; MAS, 1991. ASSANI et al. 2005 ; BAKRY et al. 2008).
En Côte d’Ivoire, l’utilisation des rejet-écailles (habituellement éliminés) stimulés par des phytohormones comme unités de propagation pour le démarrage des exploitations bananière a été prouvée (TURQUIN, 1998 ; 2007). Ces unités de propagation peuvent à la fois être utilisées pour les plantain et les bananes de dessert.
1.4.2 Conservation des unités de propagation
Une des difficultés de la culture bananière réside dans la conservation des unités de propagation. Toutefois, des méthodes de conservation ont été mises au point avec des succès variés. Différents chercheurs (BETTENCOURT et al. 1992 ; SHARROCK et ENGELS 1997) ont expérimenté la conservation in situ ou ex situ des plants de bananiers qui consiste en une culture en champ sous forme de parcelle de collections. Mais ces collections ont été souvent détruites par des maladies. Par ailleurs, la conservation génétique au moyen de semences a été utilisée. Cette dernière a été possible uniquement pour les bananiers sauvages, leurs homologues cultivés étant sans graines viables. L’inconvénient, est la germination lente et erratique des semences (CHIN, 1995). RAO et al. (1992) ont proposé l’encapsulation des méristèmes apicaux pour servir de semence. Cependant, la longueur du cycle de production a conduit les chercheurs à explorer d’autres voies. Ainsi, la cryoconservation des tissus qui consiste en une conservation à long terme du matériel génétique a été étudiée (INES et al. 1998 ; PANIS et THINH, 2001). Elle est basée sur une technique de surgélation qui peut laisser apparaître une désorganisation cellulaire à la reprise. Corrélativement à ces travaux, les collections in vitro issues de la culture in vitro d’explants de bananiers plantain ont été expérimentés (BAKRY et al. 1985 ; INES et al. 1998 ; BAKRY, 2008). Toutefois, les coûts de revient onéreux et les comportements différents des vitroplants au champ ont rendu