HAL Id: tel-01752334
https://hal.univ-lorraine.fr/tel-01752334
Submitted on 29 Mar 2018HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
coeur liquide à base d’hydrogel d’alginate par
association de biopolymères
Ghazi Ben Messaoud
To cite this version:
Ghazi Ben Messaoud. Structuration et contrôle de l’architecture de capsules à coeur liquide à base d’hydrogel d’alginate par association de biopolymères. Alimentation et Nutrition. Université de Lorraine, 2015. Français. �NNT : 2015LORR0327�. �tel-01752334�
AVERTISSEMENT
Ce document est le fruit d'un long travail approuvé par le jury de
soutenance et mis à disposition de l'ensemble de la
communauté universitaire élargie.
Il est soumis à la propriété intellectuelle de l'auteur. Ceci
implique une obligation de citation et de référencement lors de
l’utilisation de ce document.
D'autre part, toute contrefaçon, plagiat, reproduction illicite
encourt une poursuite pénale.
Contact : ddoc-theses-contact@univ-lorraine.fr
LIENS
Code de la Propriété Intellectuelle. articles L 122. 4
Code de la Propriété Intellectuelle. articles L 335.2- L 335.10
http://www.cfcopies.com/V2/leg/leg_droi.php
UNIVERSITE DE LORRAINE
École Nationale Supérieure d'Agronomie et des Industries Alimentaires (ENSAIA)
Laboratoire d'Ingénierie des Biomolécules (LIBio)
THESE
Pour obtenir le grade deDocteur de l’université de Lorraine
Spécialité : Procédés Biotechnologiques et Alimentaires
École Doctorale : Sciences et Ingénierie Ressources Procédés Produits Environnement (RP2E)
Structuration et contrôle de l’architecture de
capsules à cœur liquide à base d’hydrogel
d’alginate par association de biopolymères
Présentée par
Ghazi BEN MESSAOUD
Présentée et soutenue publiquement le 29 Octobre 2015
Devant le jury composé de :
Amparo Chiralt Professeur, IIAD, Universitat Politècnica de Valencia Rapporteur
Jérôme Bibette Professeur, LCMD, ESPCI ParisTech Rapporteur
Denis Poncelet Professeur, GEPEA, ONIRIS Président du jury
Stéphane Desobry Professeur, LIBio, Université de Lorraine Directeur de thèse
Laura Sanchez-Gonzalez Docteur, LIBio, Université de Lorraine Co-Directrice de thèse
Remerciements
Cette th se a t alis e au sei du la o atoi e d i g ie ie des io ol ules LI io .
Je tiens en premier lieu à remercier Stéphane de avoi do l oppo tu it d effe tue ette thèse ! Je vous e e ie de vot e o fia e et p se e du a t es a es de th se. J ai énormément appris à votre contact sur le plan professionnel mais également humain. Un grand merci!
Je tiens également à remercier vivement Laura, d avoi a ept de odi ige ette th se et d avoi d ouve t ave oi es petits o jets st ieu ue so t les apsules à œu li uide ! Je te remercie pour tes nombreux conseils et tes encouragements tout au long de ce projet u o a vu volu e se le des te h ologies dou es à l i o po atio de pol es. E o e merci !
Ce t avail a t fi a pa la so i t Cookal da s le ad e d u e o ve tio CIF‘E. Je e e ie messieurs Laurent Probst et Patrick Karst pou la o fia e u ils o t a o d .
J ad esse gale e t es e e ie e ts à Cécile, Faviola et tout le pe so el de l e t ep ise, qui ont contribué au bon déroulement de ce travail.
Je remercie également monsieur Alain Giraud et la société Gymnokidi d avoi ofi a u e partie de cette thèse.
Je souhaite e e ie l Asso iatio Natio ale de la ‘e he he et de la Te h ologie (ANRT) d avoi a ept de fi a e e t avail de th se.
Je tiens à remercier tous les membres du jury.
Je remercie vivement les Professeurs Amparo Chiralt et Jérôme Bibette pour avoir accepté de juger ce travail en qualité de rapporteurs. Je remercie également le Professeur Denis
Poncelet et Monsieur Laurent Probst d avoi a ept de p e d e pa t à e ju .
Un grand merci également à Elmira, pour sa disponibilité, ses conseils, et sa contribution pour e e à ie ette th se. Me i d avoi su e e otive pe da t les o e ts diffi iles ! Je tiens à remercier tous mes stagiaires : Elise, Maeva et Nicolas pour leur contribution à l ava e e t de e p ojet.
Je e e ie gale e t, d a o d mes collègues de bureau Adrien, Nadia, Mariam et Rana sur ui j ai pu compter pour leur optimisme et leur bonne humeur.
Je e e ie tous les th sa ds pass s et p se ts du la o atoi e ue j ai eu l o asio de côtoyer: Yoana, Hassan, Mouna, Charlotte, Mahmoud, Ange, Magda, Smail, Jennifer,
Marie-Celeste, Majid, Citlalli, Justine, PH et tous eu ue j ai ou li de iter (Ne soyez pas vexés, je
suis en train de rédiger les derniers mots de ce manuscrit et la fatigue commence à se ressentir) !
Je remercie également la grande et la petite Carole(s) pour leur bonne humeur et pour nos discussions scientifiques et techniques… ais pas seule e t !
Je remercie également Aurélie pour son efficacité et sa réactivité au quotidien et surtout lors de mes inscriptions à la dernière minute aux congrès (Euromat 2013 par exemple).
Je e e ie tous les e es du LIBio ave ui j ai passé des moments agréables au cours de es a es. J ai v u au sei du la o atoi e u e e p ie e t s e i hissa te aussi ie su le plan professionnel que sur le plan humain.
Je remercie toute ma famille, mes parents Rachid et Rafika, mon frère Sélim et ma belle-sœu
Emna ui o t toujou s soute u et e ou ag . U g a d e i à vous ! Vous êtes un peu loin
mais toujours présents dans mes pensées. Un grand merci à Nana et à toute la famille.
Enfin je remercie ma Sonia, qui est toujours présente à mes côtés pour me soutenir et me do e du ou age pou alle de l ava t. Je te e e ie pou ta p se e et ta patie e. Je te
Sommaire
Liste des figures hors publications………..………...
Liste des tableaux hors publications ………
Liste des publications et communications………..………... Introduction et objectifs de l’étude……….………... Chapitre I: Synthèse bibliographique ………... 1. Encapsulation ………... 1.1. Définition ………... 1.2. Etapes de l’encapsulation ……….……… 1.3. Techniques d’encapsulation……….………. 1.ζ. Microcapsules ‘intelligentes’ ………..………….. 1.ζ.2. Stimuli physiques ………... 1.ζ.3. Stimuli biologiques ……….………….. 1.η. Microcapsules ayant des propriétés d’auto-éclatement ... 2. Encapsulation dans une matrice d’alginate ... 2.1. L’alginate ………... 2.2. Historique ………... 2.3. τrigine ………... 2.ζ. Structure chimique ………... 2.η. Propriétés ………... 2.η.1. Solubilité et stabilité ……….……….. 2.η.2. Viscosité ………... 2.η.3. Bioadhésion ………... 2.6. Gélification de l’alginate ………...……… 2.6.1. Généralités ………... 2.6.2. Gélification ionotropique ……….……….. 2.6.3. Gélification acide ………... 2.6.ζ. Différences entre les hydrogels ionotropiques et acides ……….………... 2.6.η. Autres méthodes de gélification ………. 2.7. Applications des hydrogels d’alginate………..………. 2.κ. Techniques d’encapsulation avec de l’alginate ... 2.λ. Capsules d’alginate à coeur liquide ... 2.9.1. Nano-capsules d’alginate ... 2.λ.2. Microcapsules d’alginate ... 2.9.3. Capsules millimétriques d’alginate ... 3. Capsules millimétriques intelligentes à base d’alginate ...
4. Conclusion………...
Chapitre II: Influence de l’agent épaississant sur les propriétés physicochimiques des capsules ...
Influence of internal composition on physicochemical properties of alginate aqueous-core capsules……….. Abstract... 1. Introduction... 2. Materials and methods... 2.1. Materials... 2.2. Solutions preparation and characterization……….
7 8 9 11 17 19 19 20 21 22 24 26 27 29 29 29 30 31 32 32 33 33 33 34 35 38 38 39 41 43 45 45 46 51 55 56 57 61 62 62 65 65 66
2.3. Alginate systems preparation... 2.3.1. Capsules... 2.3.2. Alginate hydrogels... 2.4. Capsules characterizations... 2.4.1. Measurements of capsule dimensions... 2.3.2. Mechanical stability... 2.3.3. Solutes release... 2.3.4. FTIR spectroscopy... 2.4. Hydrogels characterization... 2.5. Statistical analysis... 3. Results and Discussion... 3.1. Capsules dimensions... 3.2. Capsules mechanical stability... 3.3. Solutes release measurements... 3.4. Rheology of plane hydrogels... 3.5. FTIR spectroscopy... 4. Conclusion... Chapitre III : Contrôle des propriétés physicochimiques des capsules d’alginate par
incorporation de polymère dans la membrane pouvant interagir avec la molécule
encapsulée……….
Alginate/sodium caseinate aqueous-core capsules: a pH-responsive matrix ………... Abstract... 1. Introduction... 2. Materials and methods... 2.1. Materials... 2.2. Capsule preparation... 2.3. Characterization of solutions... 2.3.1. NaAlg-NaCas mixture... 2.3.2. Zeta potential of NaCas solution... 2.3.3. Dye-NaCas interaction... 2.4. Characterization of capsules... 2.4.1. Measurements of capsule size and membrane thickness... 2.4.2. Mechanical study... 2.4.3. Release properties... 2.5. Statistical analysis... 3. Results and Discussion... 3.1. Capsules characterization... 3.2. Mechanical stability... 3.3. Capsule release properties... 3.3.1. Kinetics of dye release... 3.3.2. pH-responsive release mechanism... 4. Conclusion... References... Composite alginate/sodium caseinate microspheres for anionic dye removal………. Abstract... 1. Introduction... 2. Material and methods... 2.1. Material... 69 69 69 70 70 71 71 72 72 72 73 73 74 76 79 83 85 87 91 91 92 94 94 94 95 95 95 95 96 96 97 97 98 98 98 101 104 105 107 113 114 117 117 118 120 120
2.2. Microspheres preparation... 2.3. Capsules characterization... 2.3.1. Optical microscopy... 2.3.2. Size... 2.4. Adsorption studies... 2.4.1. Batch experiments... 2.4.2. Kinetic study... 2.4.3. Influence of initial pH... 2.5. Data modeling... 3. Results and discussion... 3.1. Physicochemical characterization of microspheres... 3.2. Adsorption kinetic study... 3.3. Effect of pH... 4. Conclusion... Chapitre IV: Amélioration des propriétés barrières des capsules par incorporation d’un polymère pH-sensible……….
Physico-chemical properties of alginate/shellac aqueous-core capsules: influence of membrane
architecture on riboflavin release……….
Abstract... 1. Introduction... 2. Materials and methods... 2.1. Materials... 2.2. Samples preparation... 2.2.1. Solutions preparation... 2.2.2. Capsules preparation... 2.3. Characterization of capsules... 2.3.1. Measurements of capsule size and membrane thickness... 2.3.2. Release properties... 2.4. ATR-FTIR spectroscopy... 2.5. Scanning electronic Microscopy... 3. Results and Discussion... 3.1. Feasibility of shellac incorporation into alginate matrix... 3.2. Capsules structure... 3.3. FTIR spectroscopy... 3.4. Release properties... 4. Conclusion... Conclusion générale et perspectives... Références bibliographiques... 121 121 121 122 122 122 123 123 123 123 123 125 129 131 133 137 137 138 141 141 142 142 143 143 143 144 144 145 145 145 146 154 156 160 161 165
7
Liste des figures hors publications
Figure 1. Représentation schématique d’une microsphère (à gauche) et d’une
microcapsule (à droite)………
Figure 2. Image futuriste d’une microcapsule multifonctionnelle intelligente………..
Figure 3. Illustration schématique de stimuli potentiels qui peuvent influencer la
libération à partir des microcapsules………...
Figure 4. Evolution d’une microcapsule lors de la dégradation du microgel interne jusqu’à
son auto-éclatement. Représentation schématique (a), observation sous microscope
confocal laser (b)...
Figure 5. Structure chimique de l’alginate de sodiumμ monomères d’acides uroniques(a), conformation des chaînes (b) et distribution des blocs(c)………...
Figure 6. Mécanisme de gélification de l’alginate en présence d’ions calcium………...
Figure 7. Les points de jonction possibles dans un hydrogel d’alginate. Jonctions GG /
GG (a), jonctions GG/MG (b), et jonctions MG/MG (c)………...
Figure 8. Exemple de biomatériaux développés à partir d’un hydrogel d’alginate. Capsules millimétriques à cœur liquide avec une fine membrane
d’alginate(a),microspheres d’alginate obtenues par émulsification (b), nanocapsules d’alginate (c), photo de capsules anisotrope en forme de champignon (d), microfibre
pleine (e)et microfibre creuse (f)……….
Figure 9. Représentation schématique de la formation de nanocapsules d’alginate.
Solution d'alginate (a). Incorporation de la phase d'huile contenant le principe actif dissout dans la solution d'alginate (b). Addition de CaCl2 et formation de la membrane d'alginate à
l'interface des gouttelettes d'huile (c). Elimination du solvant, lavage et dispersion des nanocapsules (d)………..
Figure 10. Schéma de la formation de capsule par polymérisation multicouches. Des
couches successives sont déposées à la surface d’un colloïde exposé alternativement à des polymères de charges opposées. La matrice du colloïde est ensuite dissoute pour former une capsule à cœur liquide………..
Figure 11. Préparation de microcapsules par microfluidique. Illustration schématique du
dispositif microfluidique capillaire (a), photo de la double émulsion H/E/H (b) et structure des capsules à cœur d’huile………...
Figure 12. Etapes de préparation de microcapsules d’alginate par émulsification et
gélification à l’interface………...
Figure 13. Principe de l’encapsulator BUCHI B-395 Pro(a) et photo du jet à la sortie de la
buse coaxiale………...
Figure 14. Principe de l’éléctro-coextrusion (a) et de la coextrusion (b)………...
Figure 15. Etapes de préparation de capsules d’alginate à cœur liquide par polymérisation
multicouches………
Figure 16. Principe de l’encapsulation par sphérification inverse………...
Figure 17. Exemple de perles gastronomiques Cookal à base de vinaigre balsamique……. 20 22 23 28 32 36 37 42 46 47 49 50 51 52 53 54 55
8
Liste des tableaux hors publications
Tableau 1. Similitudes et différences entre gels acides et gels ionotropiques………...
Tableau 2. Synthèse des méthodes actuelles de production de particules à base d’hydrogel d'alginate...
39 44
9
Liste des publications et communications
Articles scientifiques :
G. Ben Messaoud, L. Sánchez-González, L. Probst, C. Jeandel, E. Arab-Tehrany, S.
Desobry. Physico-chemical properties of alginate/shellac aqueous-core capsules: influence of membrane architecture on riboflavin release. Carbohydrate Polymers 144 (2016) 428-437.
G. Ben Messaoud, L. Sánchez-González, L. Probst, S. Desobry. Influence of internal
composition on physicochemical properties of alginate aqueous-core capsules. Journal of
Colloid and Interface Science 469 (2016) 120-128.
G. Ben Messaoud, L. Sánchez-González, A. Jacquot, L. Probst, S. Desobry.
Alginate/sodium caseinate aqueous-core capsules: a pH-responsive matrix. Journal of
Colloid and Interface Science 440 (2015) 1-8.
M. Bekhit, L. Sánchez-González, G. Ben Messaoud, S. Desobry. Encapsulation of Lactococcus lactis subsp. lactis on alginate / pectin microbeads: effect of matrix composition on bacterial survival and nisin release. Journal of Food Engineering 180 (2016) 1-9.
R. Kadri1, G. Ben Messaoud1, A. Tamayol, B. Aliakbarian, H.Y. Zhang, M. Hasan, L. Sánchez-González, E. Arab-Tehrany. Preparation and characterization of nanofunctionalized alginate/methacrylated gelatin hybrid hydrogels. RSC Advances 6 (2016), 27879 – 27884.
M. Bekhit, L. Sánchez-González, G. Ben Messaoud, S. Desobry. Design of microcapsules containing Lactococcus lactis subsp. lactis in alginate shell and xanthan gum with nutrients core. LWT - Food Science and Technology 68 (2016) 446-453.
M. Hasan, G. Ben Messaoud, F. Michaux, A. Tamayol, C. Khan, B, N. Belhaj, M. Linder, E. Arab-Tehrany. Chitosan-coated liposomes encapsulating curcumin: Study of lipid-polysaccharide interactions and nanovesicles behavior. RSC Advances 6 (2016) 45290 - 45304
M.A Jmel, G. Ben Messaoud, M.N Marzouki, M. Mathlouthi, I. Smaali. Physico-chemical characterization and enzymatic functionalization of Enteromorpha sp. cellulose.
Carbohydrate Polymers 135 (2016) 274-279.
M. Mathlouthi, G. Ben Messaoud, B. Rogé. Role of water in the polymorphic transitions of small carbohydrates. Food Chemistry 132 (2012) 1630–1637
10
Communications orales :
G. Ben Messaoud, L. Sanchez-Gonzalez, Stephane Desobry (2013). Influence of the
thickening agent on mechanical characteristics and release properties of alginate capsules. Euromat, 8-13 Septembre 2013 Seville, Espagne
L. Sánchez-González, G. Ben Messaoud, S. Desobry (2015). Association of bioplymers in microencapsulation to control the release of active molecules. Colloque
Encapsulation/vectorisation des molécules actives, une stratégie dynamique en agro-alimentaire et en pharmacie. 22 July 2015 Dijon, France.
M. Bekhit, L. Sánchez-González, G. Ben Messaoud, S. Desobry (2015). Encapsulation
of Lactococcus lactis subsp. lactis on alginate / pectin composite microbeads: effect of matrix composition on bacterial survival and nisin release. Innovations in Food
Packaging, Shelf Life and Food Safety, 15-17 Septembre, Munich, Germany.
M. Mathlouthi., G. Ben Messaoud and B. Rogé (2010). Role of water in the
polymorphic transitions of small carbohydrates. International conference on Water
in Food, 21-23 Mars 2010 Reims, France.
Communications écrites (posters):
G. Ben Messaoud, L. Sanchez-Gonzalez, R. Kadri and S. Desobry (2015).
Alginate/caseinate microbeads for anionic dye removal from acidic solutions, Euromat,
20-24 septembre, Varsovie, Pologne.
G. Ben Messaoud, L. Sanchez-Gonzalez, E. Schnepf, L. Probst and S. Desobry (2015).
Physicochemical properties of pH-responsive alginate/shellac aqueous-core capsules,
5th International colloids conference, 21-24 juin, Amsterdam, Pays-bas.
G. Ben Messaoud, B. Rogé and M. Mathlouthi (2010). Extraction, purification and
physicochemical characterization of polysaccharides of green algae (Ulva sp. and Enteromorpha sp.), 6th International Conference on Polysaccharides Glycoscience,
11
13 Les capsules d’alginate à cœur liquide sont des systèmes biphasique (gel / liquide) de structure complexe. Ces capsules trouvent des applications dans des domaines aussi nombreux que variés, allant de la gastronomie moléculaire à la biotechnologie.
Dans ce contexte, l’entreprise ‘CττKAL’ développe des perles gastronomiques comme élément de décoration ou d’assaisonnement de plats. Ces perles sont préparées par sphérification inverse qui consiste en une extrusion goutte à goutte d’un mélange (contenant du chlorure de calcium) dans un bain de gélification à base d’alginate. Généralement un agent épaississant doit être ajouté à la solution de CaCl2 afin de garantir la formation de capsules
sphériques et de limiter leur déformation par le cisaillement du bain de gélification.
La fonctionnalité de ces capsules dépend considérablement de leur perméabilité, stabilité mécanique et chimique. Il est donc essentiel de maitriser les propriétés physicochimiques du produit fini. En général, le contrôle de ces propriétés peut se faire en premier lieu en jouant sur la transition sol-gel de l’alginate par maitrise de la cinétique de gélification, à savoir les concentrations en chlorure de calcium et en alginate ou par contrôle du temps de gélification (temps de séjour). Cependant, une augmentation de la concentration en chlorure de calcium ou du temps de gélification affecte les qualités sensorielles du produit fini μ formation d’une membrane épaisse, amertume, gout salé. D’un autre côté, une augmentation de la concentration en alginate et donc de la viscosité du bain de gélification affecte l’entrée des gouttes du mélange dans le bain de gélification.
Il existe des approches alternatives qui permettent de renforcer la structure de la membrane d’alginate. En effet, l’incorporation d’un second polymère dans un hydrogel d’alginate, qui peut être soit juste dispersé dans la matrice finale ce qui aboutit à la formation d’un hydrogel semi-interpénétré (semi-IPN), soit réticulé avec le même ou un second agent réticulant et dans ce cas on parle d’un réseau interpénétré (full-IPN). Le second polymère peut être également appliqué comme enrobage ou revêtement externe (coating).
14 Cette thèse a donc pour objectif d’étudier les propriétés physicochimiques de capsules à cœur liquide à base d'hydrogel d'alginate et de contrôler leur perméabilité et stabilité mécanique par association avec des biopolymères.
Le manuscrit s’organise comme suit :
Dans une première partie, les techniques d’encapsulation et des exemples de microcapsules ‘intelligentes’ répondant à différents types de stimuli chimiques, physiques ou biologiques sont présentés. S’ensuit une présentation détaillée de la structure chimique, des propriétés et des mécanismes de gélification de l’alginate qui est le polymère utilisé dans les différents travaux d’encapsulation au cours de cette thèse. Enfin, les différentes techniques de préparation de capsules d’alginate à cœur liquide à différentes échelles sont présentées avec un intérêt particulier pour les capsules millimétriques.
Dans une seconde partie, l’influence de la composition du cœur liquide et plus précisément du polymère utilisé pour ajuster la viscosité de la solution de CaCl2 sur la
perméabilité et la stabilité mécanique de la membrane d’alginate ont été étudiées. Les propriétés mécaniques des capsules et plus précisément de la membrane (module de Young surfacique) ont été corrélées avec les propriétés viscoélastiques d’hydrogels plans d’alginate obtenues par rhéologie oscillatoire aux faibles amplitudes.
Un troisième travail a consisté à élaborer des capsules composites avec une membrane alginate/caséinate de sodium. L’influence de la concentration en caséinate de sodium et du pH de préparation a été étudiée. Les capsules composites ont montré un renforcement des propriétés mécaniques qui peut être expliqué par des interactions entre les groupements carboxyliques du mélange protéique et les cations calcium, mais aussi par des interactions électrostatiques entre les groupements carboxyliques de l’alginate et les groupements amines du caséinate de sodium. La cinétique de diffusion de la rouge cochenille (utilisée comme molécule modèle dans cette
15 étude) a montré un profil de libération pH-dépendant. Cette libération contrôlée est expliquée par une adsorption membranaire du colorant par des interactions électrostatiques entre les groupements sulfonates et amines du caséinate.
Comme perspective à cette étude, des microsphères (hydrogels sphériques) à base d’alginate et de caséinate de sodium ont été développées en utilisant un équipement basé sur une technologie de buse vibrante combinée à un potentiel électrostatique. Trois types de systèmes ont été synthétisés : microsphères simples (alginate), composites (alginate/caséinate de sodium) et composites enrobées avec une couche de caséinate de sodium. L’efficacité des microsphères pour l’élimination des colorants azoïques (Rouge cochenille et noir amido) a été évaluée. Ce type de système trouve des applications dans l’élimination des colorants à partir des rejets industriels (textile, plasturgie, etc…) par un mécanisme d’adsorption.
Dans une quatrième partie, la gomme laque qui est un additif alimentaire (E904) issu de la sécrétion d’une cochenille asiatique (Kerria lacca) a été incorporée dans la membrane d’alginate ou comme revêtement externe. L’influence de la concentration de la gomme laque ainsi que son mécanisme de préparation (précipitation acide ou réticulation avec les ions calcium) a été étudiée. L’optimisation de l’architecture des capsules alginate/gomme laque a permis d’améliorer les propriétés barrières de la membrane d’alginate vis-à-vis des molécules de faible masse moléculaire (riboflavine dans cette étude).
Enfin, une conclusion générale des différentes expériences menées au cours de cette thèse ainsi que les principales perspectives susceptibles d’apporter un complément scientifique à ces travaux sont discutées.
17
Chapitre I:
19
1. Encapsulation 1.1.Définition
Généralement, l’encapsulation est définie comme un procédé physicochimique ou mécanique de piégeage d’un ou plusieurs objets au sein d’un matériau en vue de son immobilisation, sa protection, sa structuration, sa fonctionnalisation et le contrôle de son transport et de sa libération (Vandamme, Poncelet, & Subra-Paternault, 2007).
L’encapsulation permet de produire des particules d’une taille allant de quelques nanomètres à quelques millimètres. Cette large gamme de taille ainsi que la diversité des matériaux qui peuvent être utilisés pour former la matrice d’encapsulation (protéines, polysaccharides lipides,…matériaux organique/inorganique, hybrides) offrent une large gamme d’applications et en constante évolution dans plusieurs domaines:
Alimentaire μ Masquage d’odeurs, couleurs et arômes, libération contrôlée de composés actifs, contrôle de réactions d’oxydation (encapsulation d’antioxydants) ; encapsulation d’agents antimicrobiens.
La biotechnologie μ Encapsulation d’ADσ, de peptides et surtout de cellules afin de les protéger de l’environnement externe tout en assurant une perméabilité sélective de la matrice d’encapsulation afin de garantir la diffusion des nutriments nécessaires à la prolifération cellulaire vers l’intérieur de la capsules.
Pharmaceutique : Libération contrôlée de médicaments. Cosmétique
Environnement et énergie : Elimination de colorants et métaux lourds à partir des eaux usées.(Ngah, Teong, & Hanafiah, 2011)
20 Généralement, deux structures peuvent exister : les microsphères et les microcapsules (Figure 1). Les premières sont formées d’une matrice continue de polymère au sein de laquelle le principe actif est dissout ou dispersé (système matriciel). Les microcapsules sont quant à elles constituées d’un cœur de principe actif sous forme liquide, solide ou éventuellement gazeux, entouré par une membrane de matériau enrobant (système réservoir).
Figure 1. Représentation schématique d’une microsphère (à gauche) et d’une microcapsule
(à droite).
Selon le domaine d’applications des microparticules, des propriétés de biocompatibilité et/ou de biodégradabilité seront requises. Les lipides (acides gras, alcools gras, glycérides, cholestérol…) seront plutôt utilisés sous forme solide, de même que les cires naturelles ou minérales. D’autres molécules tels que des stabilisants (tensioactifs, dispersants, antimottants…) ou des cryoprotecteurs peuvent être ajoutés à la formulation des microparticules. L’ensemble des composés va intervenir sur le profil de libération de la matière active.
1.2.Etapes de l’encapsulation
D’une manière générale, l’encapsulation se réalise en trois grandes étapes : La première étape consiste à incorporer le principe actif dans le matériau d’encapsulation par dissolution ou
21 dispersion (cas de liquide) ou par agglomération ou adsorption (cas de poudre). S’ensuit une étape de dispersion ou de pulvérisation des particules contenant le matériau d’encapsulation et le principe actif. Enfin, les microcapsules (microparticules) sont stabilisées par différents types de procédés: chimiques (polymérisation), physicochimiques (gélification, coacervation), ou physiques (évaporation, solidification, coalescence) (Vandamme et al., 2007).
1.3.Techniques d’encapsulation
Il existe plusieurs méthodes de classification des techniques d’encapsulation. En effet les techniques peuvent être classées en fonction de la nature du procédé ou du milieu dispersant utilisé (Madene, 2006) (Legrand et al., 2007):
En fonction de la nature du procédé :
Techniques chimiques : coacervation, co-cristllisation, inclusion moléculaire et polymérisation interfaciale)
Techniques mécaniques ou physiques : atomisation, lyophilisation, séchage en lit fluidisé, atomisation à froid et extrusion)
En fonction de la nature du milieu dispersant utilisé lors de la préparation des capsules : En milieu liquide : coacervation, émulsification-évaporation, gélification de gouttes,
polycondensation interfaciale et la polymérisation en milieu dispersé.
En milieu gazeux : enrobage en lit d’air fluidisé « Spray-Coating» et la nébulisation / séchage « Spray-Drying ».
En milieu supercritique :
En utilisant le fluide supercritique en tant que non-solvant: procédés SFA (Supercritical Fluid Antisolvent) ou en tant que solvant RESS (« Rapid Expansion of Supercritical Solutions »)
En absence de solvant : extrusion sphéronisation, et congélation de gouttes «spray congealing»
22 σéanmoins, les techniques d’encapsulation sont très diverses et en constante évolution ce qui rend leur classification parfois ambiguë (Vandamme et al., 2007).
1.4.Microcapsules ‘intelligentes’
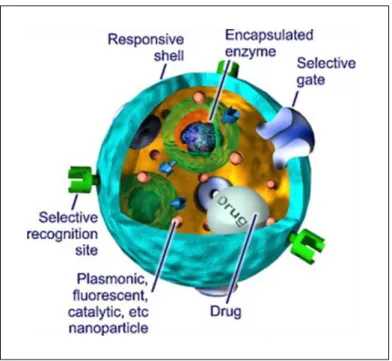
Le développement de microcapsules ‘intelligentes’ est un défi important dans le domaine de l’encapsulation. Dans le cas idéal, les capsules devraient ressembler dans leur complexité à une cellule vivante, où les multi-compartiments pourraient interagir, s’échanger des produits chimiques, recevoir de l'énergie, effectuer un travail mécanique, modifier les propriétés chimiques et physiques, tout cela en réponse à des stimuli environnementaux (Figure 2). Cette image pour l’instant futuriste pourrait être réalisable dans un futur pas aussi lointain qu’on puisse l’imaginer grâce notamment aux progrès réalisés dans ce domaine (Motornov, Roiter, Tokarev, & Minko, 2010).
Figure 2. Image futuriste d’une microcapsule multifonctionnelle intelligente (Motornov et al.,
23 Les microcapsules intelligentes présentent un large spectre d’applications surtout dans le domaine médical pour des applications de libération contrôlée (Delcea, Möhwald, & Skirtach, 2011).
L’objectif est de développer des microcapsules intelligentes qui protègent leur contenu contre les influences extérieures et le libèrent uniquement en réponse à certaines conditions environnementales (stimuli). Ces stimuli peuvent être chimiques (pH, force ionique,…), physiques (température, laser, champs magnétiques, stress mécanique, ultrasons,…) ou biologiques (enzyme, récepteurs) (figure 3).
Figure 3.Illustration schématique de stimuli potentiels qui peuvent influencer la libération à partir des microcapsules (Delcea et al., 2011).
Les microcapsules dites « intelligentes » peuvent donc réagir à ces stimuli extérieurs et subir des modifications relativement importantes de leur structure et de leurs propriétés telles que le la perméabilité ou encore la résistance mécanique.
24
1.4.1. Les stimuli chimiques 1.4.1.1.Le pH
Ce type de microcapsules comprend généralement des groupements ioniques qui peuvent accepter/donner des protons en réponse à un changement de pH : la variation du degré d’ionisation modifie la charge nette ce qui peut causer des transitions brusques de volume. Lorsque le pH est modifié par rapport au pKa des polymères constituant la membrane polyélectrolyte de capsules, une protonation / déprotonation des groupements chargés se déroule. La protonation conduit par exemple à une forte répulsion qui se traduit par un gonflement des capsules; cela aboutit à l'augmentation de la perméabilité. D'autre part, la déprotonation provoque le rétrécissement de la membrane et donc une diminution de la perméabilité. Le plus grand avantage de cette adaptation au milieu extérieur est sa réversibilité (Delcea et al., 2011).
1.4.1.2.La force ionique
La force ionique peut influencer la structure des microcapsules et en particulier les microcapsules avec une membrane polyéléctrolyte obtenue par polymérisation multicouches. Les modifications de la perméabilité induite par un sel peuvent être expliquées par la réduction des attractions électrostatiques à l'intérieur des multicouches ou par la formation de cavités dans la membrane (Delcea et al., 2011).
1.4.2. Stimuli physiques 1.4.2.1.La température
Les microparticules sensibles à la température sont des systèmes répondant à une diminution ou à une augmentation de la température. Les microgels sphériques physiques subissent une
25 transition gel-sol à une température critique alors que les microgels chimiques répondent par un changement de volume.
Dans le cas de capsules avec une membrane polyélectrolyte, une réduction significative de la perméabilité accompagne la variation de la température. Elle est due généralement à des forces hydrophobes. Ce phénomène se passe généralement à une température au-dessus de la température de transition vitreuse (Tg) de la membrane polyélectrolytes.
La réduction de volume de la membrane par expulsion de l’eau (déshydratation) est accompagnée par son durcissement et par l’augmentation de sa résistance mécanique (Delcea et al., 2011).
1.4.2.2.Contrainte mécanique
La rupture de la membrane des microcapsules et la libération de leur contenu peuvent être obtenues par application d’une contrainte mécanique au niveau de la membrane des microcapsules. Dans ce contexte, un groupe de chercheurs a étudié le mécanisme de libération à partir de microcapsules polyélectrolytes soumises à des contraintes mécaniques en combinant la microscopie de fluorescence avec la spectroscopie de force en utilisant la microscopie à force atomique (AFM) (Fernandes, Delcea, Skirtach, Möhwald, & Fery, 2010).
1.4.2.3.Energie Laser
Le principe est basé sur l’incorporation au niveau de la membrane des microcapsules des nanoparticules de métaux nobles qui absorbent efficacement l’énergie laser pour la convertir en chaleur. En raison du chauffage local autour des nanoparticules, la membrane devient transitoirement mobile ce qui permet de contrôler sa perméabilité d’une manière réversible. En effet, si l'irradiation est arrêtée, la production de chaleur est stoppée et le complexe polymérique autour des nanoparticules refroidit rapidement, revenant la membrane à son état imperméable.
26
1.4.2.4.Ultrasons
L’incorporation de nanoparticules de Znτ au niveau des hydrogels et plus particulièrement au niveau de la membrane des microcapsules a montré la possibilité de l’ouverture de microcapsules et de libération de leur contenu sous l'action des ultrasons.Le contrôle donc des propriétés mécaniques et de la sensibilité à un traitement aux ultrasons peut être réalisé en faisant varier la quantité de nanoparticules de ZnO. Néanmoins, le plus grand défi est de pouvoir diminuer l’intensité des ultrasons pour se rapprocher de la limite tolérée en médecine.
1.4.2.5.Champs magnétiques
Le principe est basé sur l’incorporation de nanoparticules magnétiques au niveau du cœur ou de la membrane de microcapsules. Bien que l'activation magnétique de microcapsules est une piste intéressante surtout pour la libération contrôlée de médicaments, la longue durée d’exposition et la forte intensité du champ magnétique nécessaire pour perméabiliser les capsules conduisent à une augmentation de la température.
1.4.3. Stimuli biologiques 1.4.3.1.Enzymes
Dans les organismes vivants tous les processus sont contrôlés à un moment ou un autre par des enzymes (Zelzer, Todd, Hirst, McDonald, & Ulijn, 2012). Inspiré par cela, les enzymes sont de plus en plus utilisés comme stimulus pour modifier les propriétés des microcapsules (B. G. De Geest, Vandenbroucke, et al., 2006).
27 Une des classes de récepteurs est les anticorps qui peuvent être greffés avec les antigènes correspondant à la surface des microparticules. En présence d’antigènes dans le milieu environnant, les interactions anticorps-antigènes sont affaiblies par échange avec les antigènes libres: les microparticules ou la membrane des microcapsules se perméabilise pour faciliter la libération du contenu des microcapsules (Cortez et al., 2007) (Zhang, Wu, Chen, Zhang, & Lin, 2008).
1.5. Microcapsules ayant des propriétés d’auto-éclatement
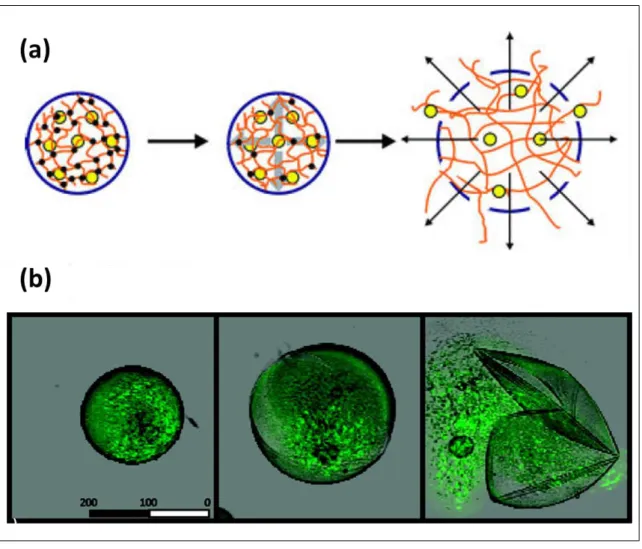
Ce type de microcapsules fait également partie de la catégorie des capsules ‘intelligentes’. Ces microcapsules avec des propriétés d’auto-explosion sont des capsules de structure cœur-coque dont le cœur est composé d’un microgel dégradable entouré d'une membrane semi-perméable. Pendant la dégradation du microgel interne dans des conditions bien déterminées (stimuli), et lorsque la pression de gonflement dépasse la résistance mécanique à la traction de la membrane, la microcapsule est rompue et son contenu est libéré rapidement.
Le concept d’auto-éclatement a été introduit par de Geest et son équipe qui ont développé plusieurs types de microcapsules ayant cette capacité (B. G. De Geest et al., 2005) (Bruno G. De Geest et al., 2006) (B. G. De Geest, Déjugnat, et al., 2006) (B. G. De Geest et al., 2007) (Bruno G. De Geest, McShane, Demeester, De Smedt, & Hennink, 2008) (Bruno G. De Geest, De Koker, Demeester, De Smedt, & Hennink, 2009) (Bruno G. De Geest, Koker, Demeester, Smedt, & Hennink, 2010).
En effet, ce type de microcapsules peut carrément éjecter son contenu dans le milieu externe lors de son auto-éclatement (Bruno G. De Geest et al., 2008). Par éjection à partir des microcapsules, les nanoparticules encapsulées peuvent se déplacer avec une vitesse presque 800 fois plus rapide que par le mouvement brownien. Cette fonction pourrait être
28 particulièrement intéressante dans les situations dans lesquelles le contenu à libérer doit traverser des longues distances dans un temps très court et à travers des milieux visqueux.
L’évolution de ce type de microcapsules au cours de la dégradation du microgel interne jusqu’à leur auto-éclatement est présentée dans la figure 4.
Figure 4. Evolution d’une microcapsule lors de la dégradation du microgel interne
jusqu’à son auto-éclatement. Représentation schématique (a), observation sous microscope confocal laser (b).Adaptée de (Bruno G. De Geest et al., 2008) (Bruno G. De
29
2. Encapsulation dans une matrice d’alginate 2.1. L’alginate
L’alginate est un biopolymère « polyvalent » très utilisé en industrie car il possède de nombreuses propriétés: épaississant, stabilisant, gélifiant et filmogène. Ce polysaccharide est abondant dans la nature. En effet, il s’agit d’un composé structural majeur des algues brunes (jusqu’à ζ0% de la masse sèche totale) et de capsules bactériennes.
La commercialisation des alginates a démarré en 1927, et la production mondiale a atteint de nos jours 30 000 tonnes/an. Environ 30% de cette production est destinée à l’industrie agro-alimentaire et le reste de la production est repartie sur plusieurs secteurs et plus particulièrement l’industrie pharmaceutique et cosmétique (Ertesvåg & Valla, 1998).
2.2. Historique
Le chimiste britannique E.C.C. Standford fut le premier à décrire l’alginate dans un brevet daté du 12 Janvier1881, détaillé par la suite en 1883 (Stanford, 1881) (Stanford, 1883).En effet, Standford parvint à préparer l’alginate par extraction de l’acide alginique à partir des algues brunes avec du carbonate de sodium puis par précipitation à pH acide. Il pensait que l’alginate contenait de l’azote. En 1926, deux équipes de recherche (Atsuki et Tamoda) et (Schmidt et Vocke) ont constaté la présence de l’acide uronique comme constituant principal de l’alginate (Atsuki & Tomoda, 1926) (Schmidt & Vocke, 1926). Les années suivantes, différentes équipes se sont intéressées à la nature de ces acides uroniques et se sont accordées sur le fait que l’alginate est constitué d’acide D-mannuronique. En 1939, Hirst et al., mit en évidence que la nature des liaisons entre les résidus d’acide mannuronique est de type β-1,ζ, à l’instar de la cellulose (Hirst, Jones, & Jones, 1939). Cette structure relativement simple fut remise en question par les travaux de Fisher et Dörfel en 1ληη, basés sur l’utilisation de la chromatographie des acides uroniques et des polyuronides, ils décélèrent la présence d’un second acide uronique présent en quantité non négligeable dans l’alginateμ l’acide
L-30 guluronique (Fischer & Dörfel, 1955). Depuis, l’alginate est considéré comme un copolymère binaire linéaire composé de résidus α-L-guluronique et β-D-mannuronique. Au cours des années 60-70 Haug, Larsen et Smidsrød ont mis en évidence la structure à blocs de l’alginate ainsi que la corrélation entre structure et propriétés de l’alginate (Haug, 1964) (Haug & Smidsrød, 1965) (Haug, Larsen, & Smidsrød, 1966) (Haug, Larsen, & Smidsrød, 1967b) (Haug, Larsen, & Smidsrød, 1967a) (Haug, Myklestad, Larsen, & Smidsrød, 1967) (Haug et al., 1970).
2.3. Origine
Les alginates sont très abondants dans la nature. Ils peuvent être extraits des parois cellulaires des algues brunes (phaeophyceae) essentiellement du genre laminaire (laminaria) telles que
Laminiaria hyperborea, Laminaria digitata, Laminaria japonica, Ascophyllum nodosum et Macrocystis pyrifera (O. Smidsrød & Skjåk-Braek, 1990).
L’alginate est extrait par traitement alcalin en utilisant de la soude puis filtré et précipité en ajoutant du calcium ou du sodium. Le sel d’alginate obtenu peut être transformé en acide alginique par traitement avec du HCl dilué (Shilpa, Agrawal, & Ray, 2003).
L’alginate peut être également isolé à partir de capsules de bactéries du genre Pseudomonas et
Azotobacter ou produit par fermentation ou par des voies biotechnologiques de biosynthèse
(Sabra, Zeng, & Deckwer, 2001). La biosynthèse par voie bactérienne pourrait aboutir à la production d’alginate avec une structure chimique et des propriétés physiques semblables à celle des algues brunes.
Les progrès récents dans la régulation de la biosynthèse de l'alginate dans des bactéries et la modification relativement facile des bactéries pourraient permettre la production d'alginate hautement spécifique pour une large gamme d’applications (K. Y. Lee & Mooney, 2012).
2.4. Structure chimique
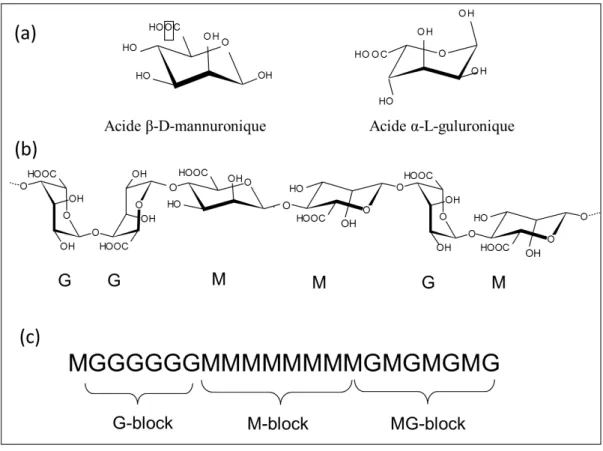
L’alginate est un copolymère qui consiste en une alternance d’acide β-D mannuronique (M) et d’acide α-L guluronique (G) liés en (1ζ). Les molécules d’acide uronique sont réparties le
31 long de la chaîne de l’alginate sous forme de blocs. Il en existe 3 types (Figure η) μ des séquences homopolymériques ne contenant que des unités d’acide mannuronique (blocs M) ou guluronique (blocs G), ainsi que des blocs hétéropolymèriques contenant à la fois des unités d’acide mannuronique et guluronique (blocs MG) (Pawar & Edgar, 2012). La composition et l’organisation des acides uroniques en séquences sont donc très variables en fonction du type d’alginate. A l’échelle moléculaire, à la différence de l’alginate d’origine algale, on note la présence de groupements O-acétyl au niveau du C2 et/ou C3 dans l’alginate d’origine
bactérienne (Skj, Grasdalen, Larsen, 1986).
En ce qui concerne la conformation des chaines, l’alginate possède quatre types de liaisons glycosidiques : di-axial (GG), di-équatoriale (MM), axial-équatoriale (GM) et équatoriale-axiale (MG) (Figure 5b).
Figure 5. Structure chimique de l’alginate de sodium: monomères d’acides uroniques(a),
32
2.5. Propriétés
Les propriétés physiques de l’alginate ont été très étudiées à partir de 1λ6ζ grâce notamment aux travaux de Haug, Larsen et Smidsrød (Haug, 1964)(Haug & Smidsrød, 1965)(Haug et al., 1966) (Haug, Larsen, et al., 1967b)(Haug, Larsen, et al., 1967a)(Haug, Myklestad, et al., 1967)(Haug et al., 1970).
2.5.1. Solubilité et stabilité
L'alginate de sodium est hygroscopique; par conséquent, la teneur en humidité s’équilibre rapidement avec l'humidité relative de l’eau. La stabilité au stockage est excellente à sec lorsque la poudre est stockée dans un récipient bien fermé.
L'alginate de sodium est soluble dans l'eau froide formant une solution colloïdale visqueuse. Il est insoluble dans l'alcool et dans les solutions hydro-alcooliques dans lesquels la teneur en alcool est supérieure à 30 % (m/m). Il est également insoluble dans les autres types de solvants organiques (chloroforme, éther…) (Shilpa et al., 2003).
La solubilité de l’alginate dépend de trois paramètres principaux (Kurt Ingar Draget, Smidsrød, & Skjåk-Bræk, 2005) :
pH du solvant : Il détermine la présence de charges électrostatiques au niveau des acides uroniques. Les valeurs de pKa déterminés par titration potentiométrique des deux résidus composant l’alginate à savoir l’acide β-D-mannuronique et α-L- guluronique sont de 3,3κ et 3,6η, respectivement. Le pKa final de l’alginate diffère faiblement du pKa des deux acides uroniques qui le compose.
La force ionique : Elle agit par la présence de groupements anioniques au niveau du polysaccharide et peut modifier la conformation moléculaire.
33 La présence d’ions divalents : Ils peuvent interagir avec les groupements carboxyliques et influencent donc la solubilité de l’alginate. La dureté de l’eau (teneur en Ca2+) par
exemple est un facteur important lors de la préparation d’une solution d’alginate.
2.5.2. Viscosité
La composition précise de l’alginate varie en fonction des espèces d’algues et de la saison ce qui engendre des propriétés structurales très variables du polysaccharide.
Il existe donc différents grades d’alginate de sodium donnant une viscosité variant entre 0.02-0.ζ Pa.s pour une solution à 1% m / v à 20°C. Les solutions d’alginate présentent généralement un comportement rhéo-fluidifiant avec une diminution de la viscosité en fonction de la vitesse de cisaillement (Lund, 1994).
2.5.3. Bioadhésion
La bioadhésion est définie comme l'adhésion ou le contact entre deux surfaces dont l'une est un substrat biologique. Si l'une des surfaces est une couche de muqueuse, le terme '' mucoadhésion '' est utilisé.
L’alginate est classé comme polymère naturel avec des propriétés mucoadhésives supérieures à d’autres polymères comme le chitosane, la carboxyméthylcellulose et l’acide polylactique. En effet, des études ont montré que les polymères polyanioniques sont plus efficaces que les polymères polycationiques et non-ioniques (Wee & Gombotz, 1998).
Cette propriété de l’alginate est à l’origine de son utilisation dans le domaine de la bioencapsulation comme matrice d’encapsulation des médicaments administrés par voie orale.
2.6. Gélification de l’alginate: 2.6.1. Généralités
34 De façon générale, un phénomène de gélification implique une transition sol-gel. L’état « sol » se réfère à un système colloïdal de caractère liquide. En revanche un état « gel » est un système colloïdal de caractère solide dans lequel la substance dispersée forme un réseau continu qui est interpénétré par un système (en général liquide) constitué par des unités plus petites que les entités colloïdales.
Un gel est donc un matériau semi-solide constitué d'au moins deux composantes: un réseau tridimensionnel (fraction solide) dans laquelle un solvant (fraction liquide) est immobilisé. Dans le cas où la fraction liquide est constituée par de l’eau, on parle d’un hydrogel.
Le terme hydrogel décrit donc des structures de réseau en trois dimensions obtenues à partir de polymères naturels ou synthétiques hydrophiles qui peuvent absorber et retenir des quantités importantes d'eau. Le caractère insoluble de l’hydrogel dans l’eau est lié à la présence de réticulation chimique ou physique. Les hydrogels peuvent donc être classés en fonction de ces réticulations qui sont à l’origine du maintien de l'intégrité structurale, en hydrogels physiques et chimiques (Rosiak & Yoshii, 1999).
L’intégrité structurale des hydrogels physiques est maintenue par des forces secondaires de type ioniques, Van der Waals, empilement Π-Π, hydrophobes ou liaisons hydrogènes. Ces hydrogels sont généralement réversibles. En revanche, les hydrogels dits chimiques sont généralement réticulés de manière covalente et ils sont donc irréversibles ou permanents (Rosiak & Yoshii, 1999).
L’alginate est un gélifiant naturel qui peut former des hydrogels physiques par gélification ionotropique en présence d’ions divalents ou par gélification acide par diminution du pH. D’autres méthodes de gélification ont été développées après modification chimique de l’alginate. Dans la section suivante, les mécanismes de gélification de l’alginate sont détaillés.
35 La gélification ionotropique de l’alginate est liée à son affinité pour certains ions par formation de liaisons sélectives (Haug et al., 1970) (Olav Smidsrød, 1974). En effet, les chaines de polymère d’alginate interagissent avec les cations bivalents ou trivalents (Fe3+, Al3+) pour
former des hydrogels. L'affinité de l’alginate vis-à-vis des ions bivalents diminue dans l'ordre suivant: Pb> Cu> Cd> Ba> Sr> Ca> Co, Ni, Zn> Mn (Mørch, Donati, Strand, & Skjåk-Braek, 2006). Un travail relativement récent a démontré que les ions Mg2+ longtemps considérés
comme des ions non gélifiants ou ayant une faible affinité pour l’alginate forment un hydrogel mais avec une cinétique de gélification relativement lente (2-3 heures) et dépendant fortement de la structure chimique de l’alginate.(Topuz, Henke, Richtering, & Groll, 2012)
Le calcium demeure le cation le plus couramment utilisé pour induire la formation de gel d'alginate.
Les étapes de la réticulation ionique de l’alginate sont schématisées dans la figure 6.
Figure 6. Mécanisme de gélification de l’alginate en présence d’ions calcium.
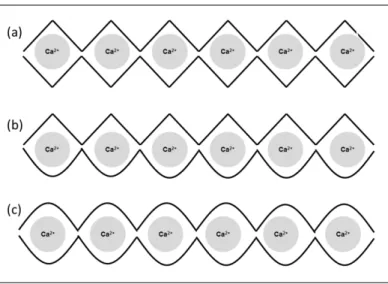
Deux blocs G ou MG de deux chaînes de polymères adjacentes peuvent être réticulés en présence d’un cation bivalent par des interactions électrostatiques entre deux groupements carboxyliques COO− du polysaccharide. Lorsque deux brins de polymère sont face à face, la conformation des blocs G ou MG forment des cavités dans lesquelles viennent se loger les ions Ca2+. Cette dimérisation des blocs est appelée structure type "boite d’œufs" (Grant, Morris,
36 La formation de gel est induite par des interactions entre les blocs G qui s’associent pour former des jonctions fortes en présence de cations bivalents. En plus de blocs G, les blocs MG participent également formant des jonctions plus faibles. Une représentation schématique des trois types de jonctions possibles dans un hydrogel d’alginate est présentée (Figure 7) (Donati et al., 2005).
Figure 7. Les points de jonction possibles dans un hydrogel d’alginate. Jonctions GG / GG
(a), jonctions GG/MG (b), et jonctions MG/MG (c).
Les propriétés mécaniques de l’hydrogel obtenu dépendent du ratio entre les blocs M et les blocs G (ratio M/G) qui compose l’alginate. En effet, les alginates composés d’un ratio (M/G) élevé forment des gels mous et élastiques, alors que les alginates avec un ratio (M/G) faible donnent des gels durs et cassants.
37 Une approche dite par « gélification externe » dans lequel les ions de réticulation diffusent vers la solution d'alginate à partir d'une solution externe. Elle permet une gélification très rapide de la solution d’alginate mais les hydrogels formés ne sont pas homogènes.
Une approche dite de "gélification interne ou in situ", où la source de calcium initialement sous forme insoluble (CaCO3, CaSO4,..) est dispersée dans la solution d'alginate. Ces ions
sont par la suite libérés de façon contrôlée typiquement par diminution progressive du pH (par solubilisation donc de la source de calcium) qui déclenche la libération des ions dans la solution d’alginate. La diminution progressive du pH est généralement obtenue par ajout de lactones à hydrolyse lente telle que la δ-gluconolactone (GDL). Il est également possible de contrôler le pH final du gel d’alginate en maitrisant le ratio (CaCO3/ GDL) (Kuo & Ma,
2001).
2.6.3. Gélification acide
Lorsque le pH d’une solution d'alginate est abaissé au-dessous du pKa des acides uroniques, un gel acide d’alginate est formé (King, 1983).
La préparation des gels acides peut se faire par deux méthodes :
La première méthode se base sur une acidification d’une solution d’alginate en dessous du pKa du polymère. L’abaissement du pH doit se faire de manière progressive. En effet une diminution rapide par ajout direct d’un acide par exemple engendre la formation d’un précipité plutôt qu’un gel. Il est donc nécessaire d’abaisser le pH de façon graduelle par ajout de lactones à hydrolyse lente telle que la δ-gluconolactone (GDL) (K. I. Draget, Skjåk Bræk, & Smidsrød, 1994). Dans la seconde méthode, un hydrogel d’alginate préalablement obtenu par réticulation ionique est converti en hydrogel acide par incubation dans une solution acide et échange de protons. Ce type d’hydrogels est généralement stabilisé par des liaisons de type hydrogène (K. I. Draget, Skjåk-Bræk, Christensen, Gåserød, & Smidsrød, 1996).
38
2.6.4. Différences entre les hydrogels ionotropiques et acides
Contrairement aux hydrogels d’alginate réticulés ioniquement qui ont été largement étudiées en terme de relation structure/fonction depuis les années 60-70, les hydrogels acides n’ont été caractérisés qu’à partir des années λ0 et notamment grâce aux travaux de Draget et son équipe qui ont pu donc déduire les différences entre les deux types de gels (Stokke et al., 2000) (Kurt Ingar Draget, Skjåk-Bræk, & Stokke, 2006).
Les similitudes et les différences entre les deux types de gels sont reportées dans le tableau 1.
Tableau 1. Similitudes et différences entre gels acides et gels ionotropiques(Kurt Ingar Draget et al., 2006).
Similitudes Différences
- Les blocs G sont les premières structures impliquées dans le mécanisme de
gélification.
- Des processus coopératifs semblent être impliqués dans la formation de la zone de jonction
- La présence de la zone de jonction multiplicités co-existantes.
- Contrairement aux gels ionotropiques, les blocs M donnent également des liaisons intermoléculaires stables dans les gels acides.
- La transition sol-gel des hydrogels acide est de nature d'équilibre
thermodynamique.
- Les plus grandes zones de jonction sont de multiplicité supérieure à celle des plus grandes zones de jonction dans les gels ionotropiques.
39
2.6.5. Autres méthodes de gélification
La gélification ionotropique est la méthode la plus utilisée pour la formation des gels d’alginate. En effet, c’est une gélification simple à mettre en œuvre dans des conditions relativement douces. Ces gels sont stables dans des conditions de pH neutre ou légèrement acide et sont convertis en gels acides par échange de protons à des pH acides < 3-3.η (pka de l’alginate). Cependant, dans des solutions faiblement basiques, les gels d’alginate subissent un gonflement suivis par une érosion et éventuellement une désintégration. Le contrôle des propriétés physicochimiques de ce type de biomatériau (propriétés mécaniques, gonflement, dégradation..) est également limité par la perte de cations bivalents dans le milieu environnant par échange d’ions ce qui affecte la stabilité chimique de la matrice.
Par exemple, un hydrogel d'alginate se dégrade en présence de solutions salines (Rolland, Santanach-Carreras, Delmas, Bibette, & Bremond, 2014).
Dans ce contexte, plusieurs équipes se sont intéressées à la préparation de gels en utilisant d’autres méthodes de réticulation après modification chimique de l’alginate.
2.6.5.1. Réticulation covalente
Birnbaum et al., ont testé trois méthodes de gélification de microsphères d’alginate. Dans la première méthode, des billes d’alginate préalablement formées en présence de polyéthylèneimine sont réticulées avec du glutaraldéhyde. Dans la seconde méthode, une solution d’alginate a été traitée avec du carbodiimide et du N-hydroxysuccinimide (pour former des esters actifs). Les billes obtenues par gélification ionotropique sont ensuite réticulées avec la polyéthylèneimine. Pour la troisième méthode une solution d’alginate traitée avec du periodate (pour former des groupements aldéhydes), est gélifiée dans une solution de CaCl2
40 Mooney et son équipe, ont réticulé l’alginate de manière covalente en utilisant du polyéthylène glycol-diamines avec différentes masses moléculaires après activation des groupements carboxyliques avec de 1-éthyl-3- (3-diméthylaminopropyl) carbodiimide et le N-hydroxysuccinimide (Eiselt, Lee, & Mooney, 1999)(K. Y. Lee et al., 2000).
Gattás-Asfura et Stabler, ont modifié l'alginate avec des groupements azide via des liaisons amides stables et des segments de polyéthylène glycol. La ligation de Staudinger a été ensuite utilisée pour former des hydrogels d’alginate réticulés de manière covalente avec des caractéristiques variables, telles que le gonflement et la stabilité mécanique (Gattás-Asfura & Stabler, 2009).
2.6.5.2. Photoréticulation
Récemment de l'alginate photoréticulé sous UV a été préparé par réaction de l'alginate de sodium et du méthacrylate de 2-aminoéthyle, en présence de 1-éthyl-3-(3-diméthylaminopropyl) carbodiimide et le N-hydroxysuccinimide. L’alginate méthacrylé a été par la suite, photoréticulé sous UV en présence d'un photoinitiateur. L’intérêt de ce type de système est que ses propriétés physicochimiques pourraient être contrôlées en faisant varier le degré de méthacrylation (Jeon, Bouhadir, Mansour, & Alsberg, 2009).
2.7. Applications des hydrogels d’alginate
Les hydrogels d’alginate constituent une classe de biomatériaux avec un large spectre d’applications dans plusieurs domaines : l’alimentaire (Farris, Schaich, Liu, Piergiovanni, & Yam, 2009), nutraceutique (Chen, Remondetto, & Subirade, 2006), environnement et traitement
41
L
es hydrogels d’alginate connaissent un intérêt grandissant dans le domaine biomédical (Hoffman, 2012).Cette dernière catégorie regroupe différents domaines d’applications tels que l’ingénierie tissulaire (Drury & Mooney, 2003), l’administration de médicaments (George & Abraham, 2006)et la microfluidique (K. H. Lee, Shin, Park, & Lee, 2009).
L’intérêt des hydrogels à base d’alginate a également donné naissance au développement d’une large gamme de biomatériaux avec différentes architectures tels que des hydrogels plans ou sphériques (billes et capsules), de fibres et des structures anisotropes à l’échelle milli-, micro- et nanométriques (Figure 8).
Figure 8. Exemples de biomatériaux développés à partir d’un hydrogel d’alginate. Capsules
42
obtenues par émulsification (b), nanocapsules d’alginate (c), photo de capsules anisotrope en forme de champignon (d), microfibre pleine (e)et microfibre creuse (f). Adaptée de (Bremond,
Santanach-Carreras, Chu, & Bibette, 2010)(H. Zhu, Srivastava, Brown, & McShane, 2005)(Lertsutthiwong, Noomun, Jongaroonngamsang, Rojsitthisak, & Nimmannit,
2008)(Mele et al., 2013)(Shin et al., 2007)(K. H. Lee et al., 2009)
Comme détaillé dans la section (2.η) l’alginate présente de nombreuses caractéristiques favorables pour des applications d'encapsulation, comme une bonne biocompatibilité, une grande disponibilité, un faible coût, et une procédure de gélification simple dans des conditions relativement douces (Pawar & Edgar, 2012).
2.8. Techniques d’encapsulation avec de l’alginate
Plusieurs techniques d’encapsulation en utilisant l’alginate ont été développées permettant d’obtenir des particules avec une large gamme de taille. En effet, le diamètre de particules d'alginate peut être > 1000 µm (macro), de 0,2 à 1000 µm (micro) ou <0,2 µm
(nanoparticules). Le tableau 2 résume les techniques d’encapsulation utilisant l’alginate, la taille des particules obtenue ainsi que les applications potentielles des différents systèmes (Ching, Bansal, & Bhandari, 2015).
43
Tableau 2. Synthèse des méthodes actuelles de production de particules à base d’hydrogel d'alginate (Ching, Bansal, et al., 2015).
Techniques Taille des particules Applications
Simple extrusion 1000-2000 µm
Encapsulation des probiotiques, des levures, huile de poisson, des médicaments, des protéines, des enzymes, des extraits de plantes et saveurs
Potentiel électrostatique
0.9-1.5 µm 50-350 µm
Encapsulation de nanoparticules lipidiques, des probiotiques, des tissus animaux et humains et des enzymes.
Buse vibrante <20 µm
200-5000 µm
Encapsulation de cellules et de protéines
Jet rompu 200- 5000 µm Encapsulation de cellules et de protéines
Disque tournant 300-600 µm Encapsulation des bactéries, de la levure et les protéines
Buse tournante 270-2000 µm Encapsulation de cellules et de protéines
Buse de pulvérisation 80-130 µm Encapsulation de nanoparticules lipidiques, vaccin BCG, des antigènes, des protéines et des bactéries.
Atomisation (à contre-courant)
« Impinging aerosol »
11-47 µm Encapsulation de l'huile de poisson, le lysozyme, l'ibuprofène, le chlorhydrate de propranolol, les probiotiques, l'insuline
Emulsification 100- 1000 µm Encapsulation de l’insuline
Microfluidique 50 - 70 µm Encapsulation de cellules (probiotiques,
mammifères)
Micro- nano-moulage 120 – 200 nm Encapsulation de protéines (BSA)
Microgels hybrides 250-600 nm Encapsulation de médicaments
(doxorubicine), cellules (hémoglobine), l'insuline et herbicides
44
2.9. Capsules d’alginate à cœur liquide
Nous présentons dans cette partie les procédés relativement récents de préparation de capsules d’alginate à cœur liquide à différentes échelles (de l’échelle nano- à millimétrique).
2.9.1. Nano-capsules d’alginate
Une des méthodes les plus couramment utilisées pour la formation des nanocapsules est le dépôt de polymère à l'interface d'une goutte d’émulsion suivi de l’élimination du solvant. Une fois la couche de polymère déposée à l’interface, la membrane est stabilisée par réticulation intermoléculaire covalente ou physique (Paques, van der Linden, van Rijn, & Sagis, 2014). Des nanocapsules d’alginate préparées par cette méthode ont été utilisées avec succès pour encapsuler différents principes actifs tels que la testostérone, des dérivés d'acyl ayant une activité anti-tumorale ainsi que de l’huile essentielle.
La préparation de ce type de système est schématisée dans la figure λ. Tout d’abord, le principe actif est solubilisé ou dispersé dans un solvant organique. Le mélange est ensuite lentement ajouté dans une solution aqueuse d'alginate contenant un agent tensio-actif (Tween-80). Par la suite, une émulsion huile-dans-eau (H/E) est réalisée par sonication (Fig. 9b). Du chlorure de calcium est ensuite ajouté lentement à l'émulsion pour former et stabiliser la membrane de nanoparticules (Fig. 9c). Enfin, la suspension aqueuse de nanocapsules est laissée au repos pendant un certain temps avant l'élimination du solvant (Fig. 9d) (Paques et al., 2014).
45
Figure 9. Représentation schématique de la formation de nanocapsules d’alginate. Solution
d'alginate (a). Incorporation de la phase d'huile contenant le principe actif dissout dans la solution d'alginate (b). Addition de CaCl2 et formation de la membrane d'alginate à
l'interface des gouttelettes d'huile (c). Elimination du solvant, lavage et dispersion des nanocapsules (d) (Paques et al., 2014).
2.9.2. Microcapsules d’alginate
2.9.2.1. La polymérisation multicouches (LbL assembly)
La technique de polymérisation multicouches par le dépôt séquentiel de polymères de charges opposées pour fabriquer des films a été rapportée la première fois par Iler, il y a presque 50 ans (Iler, 1966). A partir des années λ0, cette technique s’est largement développée grâce aux travaux pionniers de Decher et Hong (Gero Decher & Hong, 1991)(G. Decher & Hong, 1991)(GHJD Decher, Hong, & Schmitt, 1992) (Hong, Lowack, Schmitt, & Decher, 1993). Cette approche a été par la suite appliquée pour la préparation de microcapsules notamment grâce aux travaux de Möhwald et Caruso (Caruso, Caruso, & Möhwald, 1998) (Caruso, Caruso, & Möhwald, 1999) (Donath, Sukhorukov, Caruso, Davis, & Möhwald, 1998).
Les microcapsules obtenues par polymérisation multicouches sont préparées par dépositions consécutives de polymères "complémentaires" à la surface d’une particule colloïdale sacrificielle (par exemple: CaCO3) par des interactions électrostatiques, liaisons hydrogènes,