HAL Id: hal-01733945
https://hal.univ-lorraine.fr/hal-01733945
Submitted on 14 Mar 2018HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Polymorphisme génétique du cytochrome P450 2E1 et
susceptibilité à l’alcool
Rachida Elouardi
To cite this version:
Rachida Elouardi. Polymorphisme génétique du cytochrome P450 2E1 et susceptibilité à l’alcool. Sciences pharmaceutiques. 2000. �hal-01733945�
AVERTISSEMENT
Ce document est le fruit d'un long travail approuvé par le jury de
soutenance et mis à disposition de l'ensemble de la
communauté universitaire élargie.
Il est soumis à la propriété intellectuelle de l'auteur. Ceci
implique une obligation de citation et de référencement lors de
l’utilisation de ce document.
D'autre part, toute contrefaçon, plagiat, reproduction illicite
encourt une poursuite pénale.
Contact : ddoc-theses-contact@univ-lorraine.fr
LIENS
Code de la Propriété Intellectuelle. articles L 122. 4
Code de la Propriété Intellectuelle. articles L 335.2- L 335.10
http://www.cfcopies.com/V2/leg/leg_droi.php
UNIVERSITE
HENRI
POINCARE -
NANCY 1
2
000
FAC
ULT E
DE
PHARMACIE
P
OLYMORPHISME G
ENETIQU E
DU C
YTOCHROM E
P4
50 2E
I
E
T
•SUSCEPTIBIUT
E
A L
'ALCOOL
THESE
Présentée etsoutenue publiquement
Le 12 Décembre 2000
pourobtenir
leDiplôme d'Etatde Docteur en Pharmacie
par
Rachida ELOUARDI
Née le 29 mai 1973 àMONT SAINT MARTIN (54)
Mem bres du Jury
Présid ent :Mademoiselle Marie-Madeleine GALTEAU,Professeur
Juges : Madame Sylvie FOURNEL-GIGLEUX,Directeurde recherche INSERM Madam eGhislaine HUBSCH,Pharmaciend'officine
F
ACULTE
DE PH
AR MACIE
UNIVERSITEHen ri Poincaré - NANCY1Memb
res
du p
e rson ne l
en
sei gna nt
Doyen:Mme Chanlai FINANCE Vice Doyen :MilleAnne ROVEL
DOYENS HONORAIRE""S~ --1
M.BERNA NOS E André M.VIGNERONClaude
F'ROFESSEURS HONORAIRES _
Mie BESSO NSuzanne MieGIRARDThérè se M.LECTARDPier re l'ROFESSEUREMERITE M. LOP PINET Vince nt PROF ESS~E~U:!lR:>..S _ M.MIRJOL ETMarcel M.PIERFITTEMaurice
M. M. M. Mie M. M. Mme Mme Mme Mie M. M. M. M. M. M. M. M. M. M.
AST IERAlain ATKINSON JetTrey BAGRELAlain BAITAnneMarie BLOCK JeanClaude BONALy Roger
CAPDE VILLE-AT KINSON FINA NCE Chantal
FRIANT-MICIIELPascale GALTEAU Marie Madele ine HENRY Max
HOFFM ANMaurice JACQ UE Michel LABRUD EPierre LALLOZLucien LEROY Pierre MAINCENTPhilippe MARS URA Alain MARTINJean Armand MORTIER François
Pharm acieClinique Pharm acologi e
Biochimiefondamentale etclinique,Biotechnologies Toxico logie
SanteetEnvironnement Biochimiemicrobienne
Pharm acologieCard iovas culaire
Microbiologiemoléculaire
Biomathématiques,BiophysiquectAudioprothèse Biochimie Biologievégétale Pharmacieclinique Pharmacodyn amie Physiologie Chimieorganique
Phys ico-chimieappliquéeàlaformulati onpharmaceu tiqu e Pharm aciegalénique
Chimiethérapeutique
Chimie minérale et Minéralogie Pharmacogn osie
MAITRESDE CONFE RENCES _ Mme M. M. M. M. M. Mme M. M. M. Mme M. Mie Mme M. M. Mme Mie M. Mie M. Mme Mme Mme Mme Mme Mme Mme M. M. M. Mme Mme Mme Mme Mme M. Mme Mme ALBERTMonique BONNEAUX François CATAU Gérald CHEVINJean Claude CHILLON Jean Marc COLLINJean François COLLOMB Jocelyne COULON Joël DECOLINDominique DUCOURNEAUJoël FAIVRE-FIORINA Béatrice FERRARI Luc
FONS Françoise
FUZELLLlERMarieClaude GANTZER Christophe GIBAUDStéphane
HASENFRATZ-SAUDERMariePaule HINZELIN Françoise
HUMBERT Thierry IMBSMarie Andrée JORAND Frédéric
KEDZIEREWICZFrancine
LARTAUD-IDJOUADIENEIsabelle LEININGER-MULLERBrigitte LETOT Michèle
L1VERTOUXMarie Ilélène
MARCHAL-HEUSSLER Emmanuelle MARCHAND-ARVIER Monique MENUPatrick
MONAL JeanLouis NOTTERDominique PAULUS Francine pERDICAKISChristine PICHONVirginie POCHON Marie France ROVEL Anne
VISVIKISAthanase
WELLMAN-RO USSEAU Maria Monika ZINUTTIColette
Bactériologie -Virologie ChimieThérapeutique Pharmacodyna mie Chimie minérale Pharm acologie Pôleeuropéen Parasitologie Biochimie Chimie analytique
Biophysique,Audioproth èse,Acoustique GBM - Hématologie
Biochimie
BiologieVégétaleetMycologie Pharmacognosie
Virologie
PharmacieCliniq ue Biologie Végétale
Biologie végétaleet Phannacognosie Interactionsmoléculaires
Bactériologie>Virologie et Parasitologie Santé elEnvironnement
Pharm acieGalénique
Pharm acologie
Biochimie
Bactériologie· Virologieet Parasitologie Toxicologie
ChimieAnalytique
Immunologie -Hématologie Physiologie
Chimie Thérapeutique Biologiecellulaire Infonnatique
Chimie organique
Biophysique Chimieana lytique
Immunologie -Ilématologie Toxicologie
Biochimie
Pharmaciegalénique
ASSISTANTS Mme Mme M. Mme Mme M. BEAUDMariette BERTI IE Marie-Catherine DANGIEN Bernard MOREAU Blandine l'AVIS Annie TROCKLE Gabriel
Biologie Cellulaire
Biochimie Botanique Pharmacognosie Parasitologie Phannacodynamie
PROFESSEURASSOCIE. --' Mme GRISONGeneviève
PROFESSEUR AGREGE
A N
OTRE P
RESIDENT DE THESE,
Mademo iselle Marie-Ma deleineGALTEAU, Professeur de biochimie,
Vous nous avezguidéstout au long de ce travail.
A
N
OS J
UG ES
MadamcSylvicFOU RNEL-G IGLEUX,
Directeur derecherche INSERM
Qui nous a/ail l'honneurde siégerdans notre jury. Nousvousenremercions vivement.
Madamc Ghislainc HUBSeH,
Pharmacien d' officine,
Noussommes honorésde vouscompter parminos juges.
Noussommes très sensibles àla compréhensionquevous nous avez témoignée et aux conseils
A mes pare nts,
Ames frè res etsoeu rs :Touria ,Mohamed, Halima,Ali.
A Emma n uel,
A mon neveu Axelet ma nièee Sa ra,
Atoutema famille,
A tousmes amis,
SERMENT DES ApOTHICAIRES
-
-+--Je jure, en présence des maîtres de la Faculté, des conseillers de l'ordre des pharmaciens et de mes condisciples:
D'honorer ceux qui m'ont instruit dans les préceptes de mon art et de leur témoigner ma reconnaissance en restant fidèle
à
leur enseignement.D'exercer, dans l'intérêt de la santé publique, ma
profession avec conscience et de respecter non
seulement la législation el) vigueur, mais aussi les
règles de l'honneur, de la probité et du
désintéressement.
De ne jamais oublier ma responsabilité et mes devoirs envers le malade et sa dignité humaine; en aucun cas, je ne consentirai à utiliser mes connaissances et mon état pour corrompre les mœurs et favoriser des actes criminels.
Que les hommes m'accordent leur estime si je suis fidèle à mes promesses.
Que je sois couvert d'opprobre et méprisé de mes confrères si j'y
manque.
-«LA FACULTE N'ENTEND DONNER AUCUNE APPROBATION, NI IMP RO B ATI O N AUX OPINIONS EM ISE S DANS LE S THESES, CES OPINIONS DOIVENT ET RE CO N S IDE R EE S CO MME PROPRES A LEUR AUTEUR ».
LIST EDES AIUŒVIATIONS
LIST E DES FIGUIŒS
LIST EDES TABLEAUX
INTROD UCTIO N
1- ACTIV ITE ENZYMATIQUE 2
1.1 - Présentation duCYP2EI 2
1.2 - Distributiontissulaire 4
1.2.1-Chez lerat 4
1.2.2- Chez l'homme 5
1.2.2.1-Distribution hépatique
1.2.2.2-Distribution extra-hépatique
1.3- Les substrats 6
lA- Lesinducteurs 8
104. 1-Définitionduphénomèned'induction 8
1.4.2- Mécanismedel'induction enzymat ique 8
104.3-Lessubstancesind uctrices 9
104.3.1-Caractéristiq uescommunes des substances inductrices
1.4.3.2-Classificatio n des inducteurs
104 04 - L'inductionduCYP2E 1 10
1.5.3-L'isoniazide 1.5.4 - Autresinhibiteurs
2- MESUREDE L'A CTIVITEDU CYP2EI : UTILISATIONDE LA
CHLORZOXAZO NE
2.1 -Testà laehlorzoxazone
2.2- Variations biologiquesdutest 2.2.1- Sujets
2.2.2-Résultats
2.2.2.1- Effet du tabac 2.2.2.2- Effet du sexe
2.2.2.3 - Effet de J' état physiologiqu e 2.2.2.4 -Effet des solvantsorganiques 2.2.2.5 -Effet du jusde pamplemousse
2.3- Régulation del'activitéduCYP2E 1 2.3.1- Physiologique 2.3.1.1 - L'âge 2.3. 1.2-L' alimentation 2.3.2 - Pathologique 2.3.2.1- Lediabète 2.3.2.2- L'obésité 3 - POLYMORPHISMEGENETIQUE 3. 1- Définitiondu polymorphisme
3.2 - Localisation duCYP2El sur le génome 3.3 -Méthodedegénoty page
3.4-Différentspolymorphismes connus
3.4.1 - Présentation des polymorphismes
14 17 18 18 26 26 27 35 35 40 43 43 43 44 44
3.4.2- InfluencedupolymorphismedusiteRsaIsur l'activité du CYP2E I et surl'inductibilitépar l'alcool
3.5-Fréquencesalléliques observée sauseinde différentespopulations 54
3.5.1 -Population saine 3.5.2- Populationalcoolique
3.6- Susceptibilitéàl' alcool 57
3.6.1-Implicationdupolymorphisme RsaIdans le syndromealcoo lique 3.6.2-Etudesassociant polymorphisme duCYP2EI etsusceptibilitéà l'alcool
LIST E DES ABREV IAT IONS
CYP2E l : Cytochrome P4502El.
CYP2El :Gène du cytochrome P450 2El.
MEOS: Microsomal ethano l-oxidizingsystem.
ADH :Alcooldéshydrogénase.
NAD: Nicotinamideadéninedinucléotide,
NADH : Nicotinamide adéninedinucléotidedéshydrogénase.
NADP:Nicotinamide adéninedinucl éotidephosph ate,
NADPH : Nicotinamide adéninedinucléotidephosphatedéshydrogénase.
REL :Reticulumendoplasmiquelisse.
CYP2C9 :Cytochrome1'4502C9.
CYP IA2:Cytochrome 1'450 IA2.
CZX :Chlorzoxazone.
HCZX :6-hydroxychlorzoxazone.
DNID:Diabète non insulino-dépendant.
LIST E DES FIGU RES
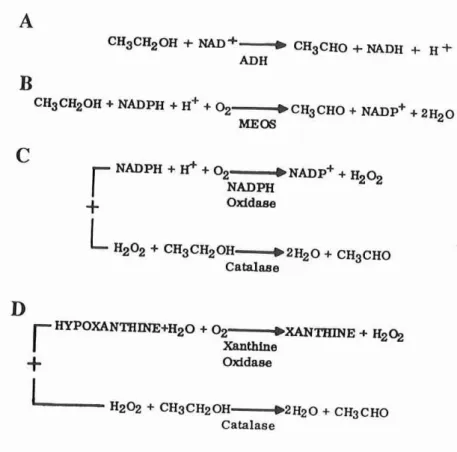
Figure 1: Oxydation del'éthanolparl'alcooldéshydro génase (ADH)ct le NAD, leMEOS ct le NADPH,une combinaison deNADPH oxydaseetcatalase, ct la xanthine
oxydasectla catalase.
Figure2 :Concentrationplasmatique dela chlorzoxazoneen fonctiondutemps.
Figure 3:(A) Concentrations en fonctiondutempsdela chlorzoxazoneet de la
6-hydroxychlorzoxazone après administrationoralede 250mg de chlorzoxazonechez 16 volontairessains.
(B)Excrétion urinaire cumulative dela6-hydroxychlorzoxazo neen pourcentage de ladose.
Figure4 : Courbesconcentrations-tempsde la chlorzoxazoneet dela 6-hydroxychlorzoxazone après desdoses de 250 mg et de750mg.
Figure5 :Excrétion urinaire cumulative dela 6-hydroxychlorzoxazo ne en pourcentagede la dose aprèsadministrationorale de 250 mg et750 mgde chlorzoxazone.
Figure6 :Rapport métaboliquedela chlorzoxazonechez deshomm esversusdes femmes.
Figure 7 : Rapportmétaboliquedela chlorzoxaz one chezdesfumeursnon alcooliq ues versus
desnon fumeursetchez desfumeurs alcooliques versusdes non fumeurs.
Figure 8:Rapportmétaboliquedela chlorzoxazonechezdes sujets obèses avec ousans DNID.
Figure 10:Rapport métabolique de la chlorzoxazonechez neuf sujetscontrôlesayant reçu 500 mgde chlorzoxazo ncseule et avec 200 ml de jus depamplemousse.
Figure II :Effetdu régime glucidiquechez despatientscompliants et non compli antsaprès
administration orale de 250 mgde chlorzoxazo ne.
Figure 12 :Représentation schématiquedugène duCYP2El.
Figure 13:Carte derestriction dela région en amontdu gène du CYP2El en utilisant
l'enzymederestrictionXbal.
Figure 14 : Cartede restrictionde larégionen amont dugène du CYP2El en utilisant
l'enzyme derestriction Dra!.
Figure 15 : Relationentrelaprésence del'insertiondela mutationet !'activité métabolique du
CYP2E I,décrite scionle rapport métaboliquedelachlorzoxazoneà 3heures en
LIST E DESTABLEA UX
Tableau 1: Substratsmétabolisés par le CYP2E 1.
Tableau Il: Effet d'unedose uniquededisulfirame (500 mg)sur les paramètres
pharmaeoeinétiques dela chlorzoxazone .
Tableau III:Effet de l' administration d'i soniazide sur laclairance plasmatique totale de la chlorzoxazo ne.
Tableau IV:Mesuredesparamètrespharmacocinétiquesdela chlozoxazo nect dela 6-hydroxychlorzoxazoneaprès administrationoraledede250mg .
TableauV: Caractéristiquesbiochimiques ct physiquesdespatients au débutdel'étude. TableauVI:BMI,ALT,ct pharmacocinétiquedelachlorzoxazone chezlespatientsau début
del' étude et deuxmois aprèsprescription d'un régime glueidique.
Tableau VII: Influencede l' obésité surle métabolismede certainssubstratsdu CYP2El.
Tableau VIII :Fréquences des mutations, au niveau du gène duCYP2EJ,observées dansles
trois groupesde sujets.
Tableau IX: Distributiondes variantsallèliquesausein de trois populations différentes étudiées.
Tableau X: Nouveaux polymorphismes au niveau du gèneduCYP2EJ.
Seule une minorité d' alcooliques développe une cirrhose hépatiqu e suite à un abus
chronique durant plusieursannées oudécennies.
Leslésionsprécirrhotiques et fibreuseshépatiqu essontcourantes chez les alcooliques, mais plusd'u ntiers desalcooliques surviventaux effets toxiques chroniquesde l'alcool sans développer aucunsignehistopathologiquede syndrome hépatiqu e alcooli que.
Des agents environnementaux, nutritionnels et infectieux agissant , séparément ou de
manière combinée,peuvent expliquer l'absenced'un effet dose-réponsedel'alcoolsur lefoie.
Des étudeschezdes jumeauxont néanmoins montré que la susceptibilité àla maladie
alcooliqu ehépatique étaitau moinspartiellement déterminée génétiquement.
Jusqu'àprésent,lesrecherchessur lagénétiqu edu syndrome hépatiqu elié àl'alcool se
sontconcentréessurlesenzymes impliquéesdans lemétabolismedel' éthanol.
Parmices enzymes, le cytochrome P450 2EI (CYP2E I)est leplus intéressant,dans la mesure où une importante consommation chronique d'alcool muliplie fortement son expression,résultant en uneaugmentation dela formation dcmétabolites toxiques.
Plusieurs polymorphismes ont étéobservés sur legène du CYP2EI et de nombreuses
études ont été réalisées afin d' établir une éventuelle association entre le polymorphisme
génétique duCYP2E I et la susceptibilité àl'alcool.
Ainsi l'obj etdece travail sera-t-il d'expliquerlerôledu CYP2 E I dansla susceptibilité génétiqu e à l' alcool.
Dans une première partie, nous présenterons le CYP2E 1 en précisant sa distribution
tissulaire, ses substrats,ses inducteurs et sesinhibiteurs.
La seconde partie de ce travail nous permettra d'étudier l'activité du CYP2E l : nous aborderonslamesure ctlarégulationde cetteactivité.
La troisième ct dernière partie de ce travail sera consacrée au polymorphisme génétiqu edu CYP2El et àson implication dansla susceptibilité à l'alcool.
1.I - PRESENTATI ONDUCYP2El
Les cytochromes P450 constituent une superfamille d' enzymesjouant un rôle majeur dans la détoxification de xénobiotiqueset dans lemétabolisme de lipides endogènes (1,2,3).
Douze famillesde gènes etvingt deux sous-famillesontétédécrites chez l'homme (1).
Les protéines sont classées en familles et sous-familles, selon leurs similarités dans
les séquences d'acides aminés (4), mais chacun des membres de ces familles présente une
spécificité de substrat, une activité catalytique et des caractéristiques immunologiq ues
distinctes.
Parmi les différents cytochromes P450 humains, le CYP2El suscite beaucoup
d'intérêt (5,6,7,8) en raison de son implication dans l'activation métabolique de plusie urs
composéschimiques toxiques etcarcinogènes.
Le CYP2E I est le principal composant du système d' oxydation microsomale de
l' éthanol: microsomal ethanol-oxidizingsystem(MEOS) (7).
Prése ntation du microsomal ethanol-oxidizing system (MEO S) :
L' éthanol n'estpas uniquement produit par les levures de bière mais ilest également
présent chez les mammifères en faiblequantité (7). La fermentation bactérienne au niveau
intestinal constitue unedes voiesde production del' éthanol.
Cependant, l' éthanol est principalement un composé exogène facilement absorbé au
niveaudu tractus gastrointestinal.Seuls2 à 10%de J' éthanol absorbésontéliminésau niveau rénal et pulmonaire (7), le reste est principalement oxydé au niveau hépatique. Une hépatotectomie ou des lésions hépatiques provoquent une importante diminution du taux d'éliminationdel' éthanol dansle sang.
Jusqu'à ces trentedernièresannées,un seul mécanisme significatifdu métabolisme de
l'éthanol était supposé exister (7). Ce mécanisme impliquait de multiples formes d'alcool
déshydrogénase(ADH),quiest une enzyme cytosoliquecatalysant la conversionde l'éth anol
A
CH3CH20H + NAD+ • CH3CHO + NADH + H+ ADH
B
CH3CH20H + NADPH + H+ +~ • CH3CHO + NADP+ + 2H 0
MECIS 2
c
D
r
HYPOXANTIIINE+H20 +~ •XANTllINE + H2~ Xanthine+
Oxld. . .1
_ _
Hn.. 2~. + CH3CH20H . 2H20 + CHaCHO Catalas eFigure 1 : Oxydationde l' éthanolpar l'alcool déshydrogénase (ADH) et le NAD (A), le MEOS et le NADPH (B),une combinaison de NADPH oxydase et catalase(C),et
la xanthine oxydaseet catalase (D) (d'après 7).
Le rôle de la catalase, localisée dans les péroxysomes, dansl'oxydation de l'éthanol in vitroen présence d'un système générant du péroxyde d'hydrogène (H202)était connu (figure 1) mais cette catalase ne semble pas jouer un rôle majeur dans les conditionsphysiologiques.
Cependant, certaines caractéristiques du métabolisme de l'éthanol, telles que l'augmentation adaptative après ingestion chronique, ne peuvent pas être compatibles avec l'ADH ou la catalase. Par conséquent l'hypothèse de l'existence d'un autre mécanisme a été émise(7).
La première indication sur la possibilité d'une interaction de l'éthanol avec le réticulum endoplasmique repose sur des observations morphologiques chez l'homme et les rats :l'ingestion d'éthanol a pour conséquence une prolifération du réticulum endoplasrnique lisse (REL). Cette prolifération du REL était similaire à celle observée après administration d'une grande variété d'hépatotoxines, de barbituriques, et autres agents thérapeutiques et additifs alimentaires. Comme la plupart des substances provoquant une prolifération du REL sont partiellement rnétabolisées par le système enzymatique du cytochrome P450 localisé
dans le REL, il aéte supposé que l' éthanol était métabolisé par un processus similaire (7). Ce système est présent au niveau desmicrosomes hépatiqu es invitro et ilest inductible par une ingestion chronique d'éthanol in vivo. Ce nouveau mécanisme de métabolisme de l'éthanol fait intervenir uncytochrome P450 :leCYP2E1.
Le CYP2E1est impliqué dans l'oxydation de l' éthan ol ainsi quedans la producti on de radicaux libres, pouvant initier une peroxyd ation lipidique (9,7, 10, 11). 11 joue égaleme nt un rôle clé dans la toxicitéde certains xénobiot iques tels que les N-nitrosa mines, prése ntes dans la fumée de cigarette et l'alimentation et suspectées de jouer un rôle non négligeab le dans l'app aritionde certains types de cancer.Le chlorurede viny le, les hydrocarbures halogén és,le benzène et certainsde sesdérivés sont d' autres xénobiotiques métabolisés parle CYP2E l .
Le système enzymatique P450 est le plus important et le plus largem ent étudié . Bien que le CYP2E I soit localisédansplusieurs organes (12),les concentrat ions les plus élevéesse renco ntrent dansle foie et en particulierdanslazonepérive ineuse(13).
1.2. DISTRIBUTIONTISSULAIR E
1.2.1• Chez le rat
Le CYP2E l est présent dans les hépatocytes de la région périveineuse du lobule hépatique, au niveau du reticulum endoplasmique ainsi qu'au niveau de la membrane plas matique.
Lescellules de Küpffer présentent aussi du CYP2El mais en plus faible quantité que leshépatocytes (7).
On observe aussi du CYP2E l au niveau des tissus du tractus alimentaire, comme la langu e, l' oesophage, l'épithélium squameux de l' estomac, et la surface épithéliale du côlon proxim al.
Le CYP2E l est également localisé dans les poum on s, les reins, et les micros om es de lamuqueusenasale (7).
1.2.2 - Chez 1'homme
1.2.2.1 - Distribution hépatique
Au niveau hépatique, le CYP2E 1 est essentiellement localisé dans la région
périveineuse dulobulehépatique (7).
Chez le nourrisson, il existe toujours une expression du CYP2E 1, ainsi que chez le
foetus,àpartirde seizesemaines de grossesse. Cependant, dans cederniercas, ladétection de l'enzyme semble être fonction de l'âge gestationnel : le CYP2E I n'est pas présent à la dixième semaine de gestation.
Le poids moléculaire du CYP2E l foetal est légèrement inférieu r à celui du CYP2E l
adulte maisd'unpointde vue fonctionnel,ilestsimilaireà la formeadulte de CYP2E l :ilest capable d' oxyder l'éthanol et il est inductible par de nombreux xénobiotiques tels que
l' éthanolet leclofibrate (LIPAVLON®); ce qui impliquequeJ' inductionin utero du CYP2E I pourrait survenir chez des mères alcooliques ou traitées pour hypercholestérol émie (14).
L' induction du CYP2E I foetal pourrait augmenter la formation de métabolites toxiques
dérivés non seulement de l' éthanol mais aussi d' autres substrats du CYP2E l (comme le
paracétamol ou la N-nitrosodiméthylamine) et pourrait alors augme nter la susceptibilité foetale auxeffets tératogènesde ces agents (14).
Enoutre, comme leCYP2E I intervientdans le métabolisme de l' acidearachidonique
et probablement dans celui des prostaglandines, l'induction du CYP2El foetal risquerait de
perturber l'équilibre des prostaglandines impliquées dans la croissance et ledéveloppement foetal(14).
Enconsidérant lesdiverses conséquencespossiblesdel'inductiondu CYP2El chez le foetus, ces informations pourraient avoir un impact profond sur la compréhension de la
tératogénicitéassociée àlaconsommation d' alcooldurant la grossesse (14).
1.2.2.2- Distribution extra-hépatique
Le CYP2E 1estégalement présent danslemucus oesophagien,quiest un tissu capable d' activerdes produits chimiques carcinogènes en métabolites réactifs pouvant se lieràl' ADN
(15).
L' épithélium de l'endom ètre humain a la capacité de produire du CYP2E I, connu
Au niveau des macrophages, il existe aussi une expression du CYP2E 1 (17). Différentes méthodes ont permis de détecter le CYP2EI dans les lymphocytes ct selon leur sensibilité, on pourrait mesurer l'induction du CYP2El après exposition à différents xénobi otiquesmétabolisésparcecytochrome (18).
Enfin le CYP2E 1 est exprimé dans le cerveau ct il est détectable dès la septiè me semai nede gestation(19).
1.3 - LES SUBSTRATS
Le CYP2EI catalyse l'oxydation deplusde soixante-quinzesubstrats xénobiotiqueset leurs caractéristiques structurales permettent de déterminer si la catalys e par le CYP2E 1 condu iraàunedétoxification ouà unetoxifi cation (20). Lesmétabolites produits au niveau desmicrosomespeuventdans certainscasêtreplustoxiques que les précurseurs(7).
Cessubstrats, qui peuvent être des substances médicamenteuses ou non, appartiennent àdifférentes classeschimiques (tableau1).
Substances médicamenteuseset leurs utilisations thérap eutiques
Parac étamol Antalgique etantipyrélique
Caféin e Psychostimulant
Chlon.:oxazone Myorelaxant d'actioncentra le
Théophylline Antiasthmatique
Isoniazide Antituberculeu x
Tamoxlfène Antiestrogène utilisé dens le cancer du se in
horrnonodépendant
Enflurane,sévoflu ra ne, halothane, mèthoxyflurane, Aneslhés iqueshalogénés isoflurane
Su bstances non médicamenteuses
1)Alcools, aldéhydes,cétoneset nitriles:
Acétaldéhyde Isopropanol
Butanol Méthanol
Ethanol Propanol
Glycérol' Pentano l
2) Nitrosamines.composésazotés: Azo xyméthane
N,N-Diéthy lnitrosa mine
N,N-Dimélhylnitrosamine
3)Substra tsréductib les:
Tétrachlorure de carbone
Chro me
Oxygène
4)Composésaromatiques:
Bromobenzène p-Nitrophénol
Benzène 3-Hydroxypyrid ine
Phénol P.yrazole Pyridine Styrène Toluène 5)Ethers: Diéthy le éther Méth yler-butyleéther 6)Acidesgras' :
Acide arachidonique
Acide laurique
7)Alcanes etalcèneshalogénesetnon halogénés :
Acétone' Dibromoéthane Pentane
Acétol Dichlorométh ane 1,1,1,2-Tétrafluoroéthane
Acétoacétate ' 1,2-Dichloro propane 1,1,1-Trichloroéthane
1,3-Buladiène 1,2- Epoxy-3-butène Trichloroéthylène
Chloroforme Ethane Chlorure de vinyle
Chloro méthane Hexane Bromure de vinyle
, Composésendogè nes
1.4 -LES INDUCT E URS
1.4.l - Définitiondu phénomèned'induction
Le phénomène d' induction enzymatique est connu depuis longtemps pour ses consé quences sur la réponse des enzymes de biotransformation d' autres médi caments. Une
substance inductrice estcapable d' entraîner une activa tiondes enzymes de biotransformation
d'autres médicaments.
Deplus,certa insinducteurs activent leurpropre métabolisme (21 ). Pourquel'inductionsemanifeste,ilfaut:
-+quel'agent inducteu r soit utilisédemanièrechronique;
-+ quelemédicam entinduitsoit fortement métaboli sé.
Unmédicamentdont lepourcentagedemétab olisation est faible, sera donc peu sensibleà cet
effet. Les principalesconséquencesde cette inductionseront:
*
unediminution des taux plasmatiquesdû médicament induit;*
une diminution de sademi-vie avec augme ntation dela clairance totale(21).L'inducteurpeutréduirel'efficacitédes substancesadministréesde façonconco mitante.
1.4.2- Mécanismedel'induction enzyma tique
L' activité d'une enzyme peut augmenter sous l'influence de différents phénom ènes
(22) :
- par l'actionde facteursagissantsurle tauxde protéines
-+augmentation delasynthèse des protéines etdonc del'enzyme; -+ ralentissement deladégradation et del' éliminationdecesprotéin es;
Du point de vue expérimental, il a été prouvé que l'induction enzymatique est indissociable d'une synthèse protéique de novo. En effet, l'induction est inhibée pa r l'actinomycineDct lapiromycinequisontdesinhibiteurs delasynthèseprotéique.
1.4.3 - Les substancesinductrices
Les inducteurs des enzymes du métabolisme des médicament s sont très variés, au niveaude :
-leursstuctureschimiques; -IFurs effets inducteurs; - les enzymes qu'ils induisent; -leurmécanismed' action;
- lesanimaux et les organesqui ysontsensibles; -lesphénomènesannexes engendrés.
1.4.3.1 - Caractéristiques communes des substances inductrices
Si les substances inductrices sont très hétérogènes en struc ture ct en activité, elles possèdentnéanmoinsdespoints communs(22) :
- ellessont liposolubles,notammentpour pénétreràl'intérieurde l'hépatocyte;
-elles se concentrentàdestaux suffisants dans la cellule,avec une affinité pour leréticulum endop lasmique;
- ellessont des substrats des enzymes qu' elles induisent,ouau moins sont liéesà elles.
1.4.3.2 - Classification des inducteurs(21)
Les inducteurs de type hydrocarbure aromatique polycyclique qui agissent plus particulièrement surles cytochromesP450 de type lA.
Lesinducteursdetype phénobarbital qui vont augmenter la synthèsedescytochromes detype 28 et 3A.
Les inducteurs de type cyanoprégnénolone concernant plus particulièrement les cytochromes P450detype3A.
Lesinducteurs de type éthanol,connuspour induirelescytochromesP450 de type 2E.
Les inducteursde typec1ofibrate,inducteursdescytochromesP450 detype 1.
L'inducteur va stimuler la production de certaines isoenzymes du cytochrome 1'450 après qu'unsignalsoittransmis jusqu'àl' ADN afind'enaugmenterlatranscription.
1.4.4-L'induction duCYP2El
Le CYP2El est induit par une variété d'états chimiques et physiologiques. En effet,
l'un des traitsles pluscaractéristiquesdu CYP2EI ,qui ledistingue des autres mécanismesde
métabolisme de l' éthanol, est son inductibilité démontrée chez plusieurs espèces incluant
l'homme (7, 23).
L'induction du CYP2El est un phénomène complexe pouvant s'expliquer par
différents mécanismes : activation de la transcription, augmentation de l' efficacité de la
traduction del' ARNm , stabilisation del' ARNm ou delaprotéine (7).
De nombreux xénobiotiques augmentent le taux de CYP2E1 dans les microsomes
hépatiques. La plupartdes composés induisant le CYP2El sontaussides substrats pour cette
enzyme(20).
Lesinducteursdu CYP2E1sont donc nombreux et sontégalement des substratspour
l'enzyme. Il s'agit par exemple de l'éthanol, l'acétone, l'isoniazide, due benzène, du
phénobarbital, et deshydrocarbures polycycliquesprésentsdans la fuméede cigarette.
En raisonde sa large consommation, l'éthanol est l'un des plus importants composés
métabolisésparle CYP2E1.
Le CYP2El participefaiblement au métabolisme de l'éthanol chez les individus non
alcooliques (24), mais à des concentrations alcooliques sanguines élevées et chez des consommateurs chroniques, le CYP2El joue un rôle majeur dans le métabolisme de cc
substrat car l'alcoolmultipliesonactivitépardix(24).
Pendant l'administration d'éthanol, le pourcentage de métabolisme de cette drogue
chez des patients alcooliques, est supérieur à celui que l'on observe chez des sujets non
alcooliques, ce qui résulte probablement d' une augmentation du contenu hépatique en
hépatiq ue lié à l'alcool et la fibrose, et les radicaux hydroxyéth yles pourra ient initier des atteintes immuno logiques par liaison covalenteavec des protéines microsomales (24,Il).
La consommation chronique d'alcool contribue à l'inducti on du CYP2E I (6), en
agissant au niveau post-transcri ptionne l (et donc sans élévat ion du taux d' AR Nm ) par
stabilisation protéique. Cette consomma tion excessive d'alcool multiplie par vingt
l'expr ession duCYP2E 1in vivo,augment ant ainsi la form ation des métabolites toxiqu es, des
radi caux oxygénésetla peroxydation lipid ique au niveau hépatiqu e.
Oc nombreux substrats du CYP2E 1 sont bioactiv és en hépat otoxines ou hépatocarcin ogènes et l'induction du CYP2E l provoque une plus fort e susce ptibilité à la
toxicité de ces composés (25,26,23).
Le paracétamol,par exemple,estmétabolis épar le CYP2E1 en un métabol ite réactif :
laN-acétyl-p bcnzoquinoneimine (NAPQI).Cetteactivation conduitàunctoxi cité hépatiqu e
chezdes sujets non alcooliques, lorsque les dosesde paracétamolsontélévées.
Cependant, des doses beaucoup plus faibles sont hépatotoxiques chez des sujets
alcooliques. On peut donc penser que l'ingestion chronique d'éthanol potenti alise le mét abolismeduparacétam ol en un métaboliteréacti f via le CYP2E1 (20).
L'induction du CYP2E I par un produitchimique peut donc augme nter la toxic itéd'un
autre composé chimique; e'est le cas, par exempl e, du tétrachl orure de carbone , dont
l'hépatotoxicitéest augme ntée chez des rats traités avec de l'acétone ou d' autres alcoo ls
1.5 - LES INHIBITEURS
1.5.1 - Ledisulfirame
Ledisulfirame: ESPERAL®, utilisécommeadjuvantdansla préventi on des rechu tes au cours du traitement de l'alcoolo-d épendance et son métabolite réduit, le diéthyldithiocarbamate, ont étéidentifiéscomme des inhibiteurs sélectifs du CYP2E I in vitro
(27,3).
L'effet du disulfirame sur l'activité du CYP2E l in vivo a été étudié en mesurant les paramètres pharmacocinétiques de la chlorzoxazone (drogue myorelaxante, utilisée comme marqueur de l'activité du CYP2E I) (27)chez des sujets sainsprétraitésavec une doseunique de 500 mgdedisulfirame;ladosedechlorzoxazone administréeétant de750 mg.
Les sujets de l'étude sont des hommes non fumeurs, ne présentant pas de signes de maladie hépatiqueou rénale et n'ayantprisaucunmédicament pendant laduréede l'étude. De même, ils n'ont pris ni caféine, ni alcool. Chacun des sujets a reçu 750 mg de chlorzoxazone aprèsunenuit de jeûne et 500 mgde disulfirame neufàdix heures avant l' administration de chlorzoxazone (27).
Letableau Il représente l' effetd'unedosede 500 mgdedisulfiramesur les param ètres pharmacocinétiques de lachlorzoxazone.
Cmax:Concentrationplasmatique maximum;CL:clairance totale;T~:demi-v ied élim inat ion
Sujetscontrôles Sujets traitésavec du disulfirame
Suj ets Poids Cmax CL TV,(h) Cmax CL TV,(h)
(kg) (Ilgl ml) (mUkglmi (Ilgl ml) (mVkglmin)
n) 1 73 31,5 2,75 0,66 47,2 0,55 3,5 2 73 29,7 2,06 1,40 40,5 0,41 5,8 3 76 7,8 5,92 0,75 30,6 0,53 5,8 4 66 26,9 3,33 0,59 53,7 0,46 5,1 5 89 15,6 3,37 0,91 27,6 0,56 5,4 6 98 12,3 2,24 1,20 32,5 0,41 5,2 Moyenne± 79±12 20.6±9.9 3.28±1.40 0.92±0.32 38.7 ± 10.3" " 0.49±0.07" 5. 1±0.9"" Ecart type ,
Cc tableau montre que, par rapport aux sujets contrôles, les sujets traités avec du disulfirame présentent une concentration plasmatique de la ehlorzoxazone (Cmax) et une demi-vie d'élimination de la ehlorzoxazone (TV,) plus importantes ainsi qu'une clairance totale (CL) moins élevée.Chez ces suje ts, le métabolismede la ehlorzoxazone est diminué ; l' activité duCYP2EI(qui métabolisela ehlorzoxazo ne)estdonc diminuée.
Chez les sujets contrôles, les concentra tions plasmatiques de chlorzoxazone sont peu homogènes, ce qui s'explique par la grande variabilité interindividuelle dans l'activité du CYP2El.
»
Ledisulfirame est donc un inhibiteur efficace de j' activité du CYP2E I, comme le montre l'importantediminutionde la clairance dela chlorzoxazone.L'administration d' une dose unique de disulfirame pourrait donc servir de moyen efficace pour décrire l'impli cation du CYP2E1 dans la biotransformation des xénobiotiques chez l' homme (27). En outre, l' administration de disulfirame pourrait constituer une alternative thérapeutique efficace dans le traitement des toxicités dues aux pro-toxines activées parle CYP2El.
Cependant, lemécanisme d'inactivation n' a pas encore été démontré; le disulfirame serait réduit endiéthyldithiocarbamate, produisant une formesoufrée active quiinactiverait le CYP2El (28).
En complément de l' étude précédente, des recherches ont été menées afin d' éval uer l' effet d'un e administration au long cours de disulfirame sur le métabolisme de certains médicaments chez l'homme (27). Dans ce cas, on observe une inhibition du métabolism e et de la clairance de nombreux composés tels que l'antipyrine, la théophy lline, la caféine, le paracétamol ou encorela phénytoïne.
Pourcertains de ces composés(antipyrine, paracétamol et théophylline), ledisul firam e agirait par inhibition du CYP2El. Cependant, les altérationsdu métabolisme de la phénytoïne (substrat du "C YP2C9) et de la caféine (substrat du CYPIA2), suggèrent qu' une administration au long cours de disulfirame se traduit par une inhibition généralisée des cytochromes P450.
D' autres études sont nécessaires afin de confirmer l'inhibition spécifique du CYP2E 1 par untraitementaiguau disulfirame (27).
1.5.2- Le chlométhiazole
Des études in vivo chez le rat ont montré que le chlométhiazole (drog ue sédative et anticonvulsivante)est uninhibiteurduCYP2E I agissantau niveau post-traductionnel(29).
Chez l'h omme, ce produit est un inhibiteur efficace du métabolisme de la chlorzoxazone et donc del'activitéduCYP2E I (30).
1.5.3 - L'isoniazide
L'isoniazide, médicament antituberculeux, a été identifié comme un agent inducteur chezlerat,
Le premier mécanisme majeur de métabolisme pour l'isoniazide est la N-acétylation par la NAT-2 : N-acétyl transférase de type 2, dont l'activité est distribuée de manière polymorphique et dont deux phénotypes sont communément présents dans la population : acéty leurs lents et acétyleurs rapides. Ainsi, par rapport aux acétyleurs rapides, les acétyleurs lents ont une concentration plasmatique d'isoniazide plus élevée après administrationoraleet un taux réduit d' éliminationdumédicament(31).
De plus,chez l'homme,l'isoniazidea un effet d'inhibition- induction sur le CYP2EI
une étude chez des volontaires sains (de phénotype acétyleur lent) reposant sur l'administration concomitante d'isoniazide et de chlorzoxazone, a montré que l'isoniazide provoqueunediminutiondela clairancedelachlorzoxazone (32).
Les suje ts n'ont pris ni alcool ni médicame nt durant l'étude et la semaine précédant l'étude.
L'isoniazide est administréàraisonde 300mg/j our pendantseptjours(JI à 17). La chlorzoxazoneestadministréeàtrois moments;
quatrejours avant le début del'administration de l'isoniazide (J-4)
ledernierjour d'administrationde J'i soniazide (17) deuxjours après ladernièredose d'isoniazide (J9).
La figure 2 présente les résultats de l'administration concomitante d'isoniazide et de
chlorzoxazonechezdes sujetssains .
...
-
E--
Coll -/),.-1-4 :2 20-
Ü Cl - . - 17 0u
~ .... ...19 c 0 N 10 CIl a< 0 N..
.s
.cl U Temps (heures)Figure2: Concentration plasmatiquedela chlorzoxazone en fonction du temps (d'après 32)
Lorsquela chlorzoxazone estadministrée seule (1-4),le pic plasm atique est atteint en 2heures et sonéliminationest terminéeen 6 heures.
Lorsque l'isoniazide est administré de manière concomitante (17), l'élimination de la
chlorzoxazone se fait plus lentement (en 8 heures) alors que le pic plasmat ique est aussi
atteint en 2 heures. L'isoniazide ralentit donc le métabolisme de la chlorzoxazone et, par conséquent,inhibel'activitédu CYP2El.
Quarante huit heures après l' arrêt de l' isoniazide (19), une nouvelle administration de chlorzoxazone se traduit par un pic plasmatique toujours atteint en 2 heures, mais mo ins
élevé,ainsiqueparune élimination plusrapide(4heures environ).
Il semble donc que l'i soniazide agisse par un mécanisme d'inhibition-induction sur l'activitédu CYP2El. Le mécanismede cet effet biphasique est probablement une induction par stabilisation protéique ( il s'agitdonc d'un mécanisme post-transcriptionnel) (33), ce qui provoquerait une inhibition de l' activité catalytique lorsque l'isoniazide est présent.
Le tableau III présente l' effet de l'admin istration d'i soniazide sur la clairance plasmatique totaledela chlorzoxazone. CLCh lorzo xazone(Uh) Suje t n° J·4 ,17 J9 1 t3,4 5,9 2t,8 2 8,0 2,8 12,7 3 14,4 5,2 17,t 4 10,9 4,6 16,4 5 13,0 4,9 27,4 6 9,0 3,6 21, 1 7 9,2 6,4 22,3 8 t1,5 5,4 19,5 9 24,3 5,7 19,7 10 12,5 10,3 t9,O Moyenne± 12,6±4,6 5,5±2.0' 19,7± 3,9 Ecart type • p<0.001
Tableau III:Effetde l'administration d'isoniazide sur laclairance plasmatique totaledela chlorzoxazo ne(CL) (d'après32)
Dans ce tableau, on observe que pour tous les suje ts, la clairance totale de la chlorzoxazo ne diminue de manière significat ive (56%) quand elle est administrée avec l' isoniazide (J7), ct augmente d' environ 56%, 48 heures après la dernière dose d' isoniazide (J9).Cependant,onobserve une exception : le sujet9 présente la CL la plusimportant eàJ-4; cette clairance diminue à J7 mais contrairement aux autres suj ets, à J9 elle est inférieure à
celle de J·4.
Ceci est le refletde l'importante variabilité individuelle dans l'activité du CYP2EI les facteurs environnementaux, tels que l' état physiologique, le statut hormonal et l'alim entation, sont détermin ants (I I).
}> Cette étude a montré que l'apparente stabilisation du CYP2E l par l' isoniazide provoquerait une inhibition de l' activité catalytique pendant que l'i soniazide serait lié à
inhibiteurs, agissant par un mécanisme de stabilisation protéique, peuvent avoir des effets similaires (32).
1.5.4-Autresinhibiteurs
Il existe d'autresinhibiteurs du CYP2El mais les mécanismesd'inactivation n'ont pas encore été établis (35): c'est le cas par exemple du 3-amino-l,2,4-triazole, de la dihydrocapsaïcine (présent dans le poivron rouge), du phénéthyl isothiocyanate (constituant
2. MESURE DE L
'ACTIVITE
DU CYP
2EI
:
UTILISATION DE LA CHLORZOXAZONE
2.1-TEST A LA CHLORZOXAZONE
Le CYP2E l est responsablede la bioacti vation de plusieurs composéssuspec tés d' être
carc inogè nes, tels que le N-nitrosodiméthylamine, l'anilin e, les hydro carbures fluorés, le
benzène et les N-alkylformamides (36) . L' acti vité catalytique du CYP2E l pourrait être un
important modulateur de la toxicité ou du pouvoir carcino gène de ces composés; par
conséquent, une méthode atox ique et sure d' évalu ation de l'activité de cette enzyme chez
l'homm e,s'avère nécessaire.
La chlorzoxa zone est un myorelaxant d' action centrale dont l'hydroxylation conduit à
la formation de la 6-hydroxychlorzoxazone (qui est ensuite glucuroco njuguée puis éliminée)
(37).
Cette réaction est essentiellement catalysée par le CYP2E I in vitro, et la
chlorzoxazone est largement utilisée comme marqueur de l'activité in vivo du CYP2E 1;
cependant, lescaractéristiqu esdemesu reet les dosesutiliséesvarient largem ent (36).
Avant d'étudi er la mesure de l' activi tédu CYP2E l, il est nécessairede faire quelqu es
rappelsde phannacocinétique (38):
Définitions:
»
La clairance plasmatique totale d'un médicament représente le volume de plasmacomplètementépuré du médicament par unité de temps. Elle est exprimée habituellement en
unité de volumepar unité detemps (ml/minouml/minlkg).
La clairan ce plasmatique totale constitue ainsi le paramètre cinétique qui rend compte des
capacitésd' élimination que possèdel'organisme pour ce médicament. Elle estaussi la somme
Jo> La clairancc hépatique d'un médicament, correspond au volume de sang hépatique totalement débarrassé du médicament par unité dc temps. Elle s' exprime en unité de volume par unité de temps ( ml/minou ml/min/kg).
La clairance hépati que traduit la capacité de l'organ ism e à épurer un médicament par le foie. Elle résult e de deu x clairances distinctes : la claira nce métabolique hépatique ou clairan ce
intrin sèqu e, correspondan t à l' activité de biot ransform ation enzymatiq ue du foie, et la clairance biliaire.
Jo> La clairance rénale est la capacité de l' organ isme à éliminer un médicament par voie urinaire. Elles'exprime en unitéde volume par unité de tem ps : ml/min ouml/min/kg,
Jo> Le volu me apparent de distributi on (Vd) d'un médicament représente un volume
hyp othétique dans lequel le méd icament , uniform ément répart i, est à la même concentratio n que celle mesurée dans le plasma. A l' état d' équilibre cinét ique, il obé it à la formul e suivante:
Quantitéde médicamentdansl'organisme
V(d)=- - -
-Concentration demédicamentdansle plasma
Ca letll des principales cons ta n tes pharmacoeinétiques :
Pour y parvenir, la méth od e la plus simple consiste à admin istrer par voie in tra-veineuse ou orale, une dose unique du médi cam ent à un groupe de volontaires sains, pu is à prélever des échanti llons de sang,régulière me ntespacés aucours du tem ps suivant la prisedu
médicament. Le dosage des conce ntrations plasmatiques obtenues va permettre de bâtir une
courbe représenta/Il l'évolution de ces concentraiions (en ordonnée) au cours du temps (en abscisse) et de calculerles constantes cinétiquessuivantes:
Cmax: concentration plasmatique ou pic plasmatique est lavaleurla plus haute ; elle se situeengénéralà la fin delaphased' absorption etavant laphased' élimination du produit.
Tmax : représentele tempsnécessaire,après administration du produit,pour atteindre lepic plasmatique.
» L' aire sous la courbe (AUC: Area Under Curve) est la surface délimitée par les axes et la courbe reliant les différentes concentrations au cours du temps. Elle représente la
quantité de médicament qui se retrouve dans la circulation générale associée à la vitesse de son élimination. Elle s'exprime par le produit des unités de temps et de concentrati on (exemple: flglmllh)
»
La demi-vie d' élimination est le temps nécessaire pour que la concentration du principe actif diminue de moitié pendant la phase d'élimination. Elle peut être également définie commeétantle tempsnécessaireà l'élimination de la moitié de la quantitéde principeactifprésent dansl'organisme.
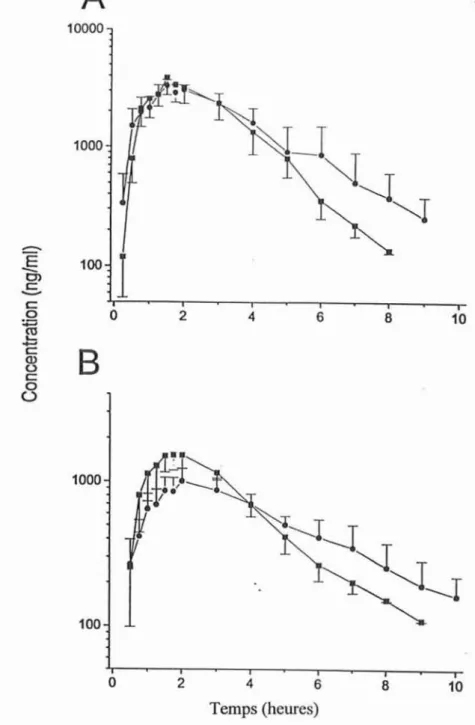
Les résultats d'un e étude récente ont permi s d'évaluer les paramètres pharmacocinétiquesde la chlorzoxazone et de son métabolitechez des volontaires sains et de
valider ainsi un index phénotypique acceptable de la clairance de formation de la 6 -hydroxychlorzoxazone (36).
Les sujets :
• Seizevolontaires sainsnon fumeurs âgés de 18à 38 ans, n'ayant pris aucun produit
contenant dela caféineou del'alcooldansles 3jours précédantl'étude etaucun médicam ent. • Aprèsunenuitde jeûne, lessujets ont reçu 250 mgde chlorzoxazonepar voie orale.
Six sujets ont reçu, en plus de cette dose, 750 mg de chlorzoxazo ne afin d' évaluer une éventuelle dosedépendancedansla biodisponibilitédelachlorzoxazone.
LetableauIVprésentelesparamètrespharmacocinétiquesde la chlorzoxazoneetdela
6-hydroxychlorzoxazone.
Paramètres Moyenne± éca rt typ e
(limites)
Chlorroxazone
AUC(pglml/h) 1J,8±3,8 (3,5- 19,4)
tv,(h) 1, 1±O,2 (0,7-1,5)
Volumededislribution/F (1) 36±13 (20 -73) CItotalelF (ml/minJkg) 5,1±2,3 (3,0-12,6)
CIautre(ml/min/kg) 1,8 ±1,0 (0,5-4,3) 6-hyd roxyehlorz oxazone
AUC (pglmllh) 5,5± 1,2 (3,6-7,5)
tv,(h) 1,4±0,4(0,8-2,3)
Récupérationurinaire(mg) 159 ±37 (97-220) CIformation (ml/min/kg) 3,2± 1,6 (1,3-8,3) CIrénale (ml/min/kg) 6,3±2,0(2,9- 10,7)
AUC:airesousla courbe; tv, :demi-vied'élmination;F:facteurdebiodi spon ibililé;CI:clairance
Tableau IV :Mesuredesparamètres pharmaeocinétiquesdelachlorzoxazoneet dela
6-hydroxychlorzoxazone aprèsadministrationorale de 250mg(N=16) (d 'après 36).
La demi-v ie d' élimination de la 6-hydroxychlorzoxazo ne (1,4 ± 0,4 heures) est plus
longue quecelle delachlorzoxazone(1,1±0,2heures).
L'aire sous la courbe delachlorzoxazone (11,8±3,8 ug/ml/h) estplus importante que
cellede son métabolite(5,5±1,2 ug/ml/h).
100 10 8 6 10 8 6 4 • 2
•
o 100 80 :J~
QI -E- 60 1000 CIl c: a a 0 ~-
a ë ë QI QI 0 ~ 40 c: a QI o a. A BTemps(heures) Temps(heures)
Figure3 : (A) Concentrations en fonction 'du temps de lachlorzoxazone (.) etdela
6-hydroxychlorzoxazone (_) après une administrationorale de 250 mg de chlorzoxazone chez 16 volontairessains. (B) Excrétion urinaire cumulative de la 6-hdroxychlorzoxazone en % de
la dose (d'après36).
Après administration orale de250 mg de chlorzoxazone, les pics plasmatiques sont
atteints en 1 heure 30 pour la chlorzoxazone et 2 heures pour la 6-hydro xychlorzoxazone
(figure 3A)
La récupération urinaire de la ô-hydroxychlorzoxazone après 10 heures représente
. approximativement les deux tiers (63,5± 14,8%) de la dose administrée; cependant, cette récupération urinaire estl' objet d'une importante variabilité(figure 3B).
Il n'y a pas de trace de chlorzoxazone inchangée dans les urines; environ 35 % de la dose ne sont pas récupérés, suggérant donc l' existence de mécanismes alternatifs dans le
Cetteétude pharmacocinétique a été réalisée afin devaliderun unique pointdemesur e
d'index phénotypiquedelaclairancefractionnelledela 6-hydroxychlorzoxazo ne.
Les rapports des concentrations plasmatiques de la 6-hydroxychlo rzoxazone sur la
chlorzoxazone à 2 et 4 heures montrent les plus fortes corrélations avec la clairance de
formation de la 6-hydroxychlorzoxazonc ct, peuvent donc ainsi servir d'index de mesure de
l' activitéduCYP2E l.
La récupération unnarre totale de la 6-hydroxycWorzoxazo ne et l'index
d'hydroxylation*, ne sontpas corrélésde manièresignificative avec la clairance de formation
du métabolite.
• :rapport dosede chlorzoxazo nesur la récupérationurinaire dela 6-hydrox ychlorzoxazone.
Pour évaluer une éventuelle dose dépendance dans la biodisponibil ité de la
chlorzoxazone,six des sujets del'étude ont recuen plus750mg de chlorzoxazone.
La mesure des paramètres pharmacocinétiques de la chlorzoxazone ct de la
6-hydroxychlorzoxazone aprèsadministration des deuxdosesmontre,une augmentation de 30%
del'airesous la courbe dela chlorzoxazoneaprès unedosede750 mg par rapport à unedose
de 250 mg. Bien que cette aire soit augmentée de manière significative, il n' y a pas de
différence notable au niveaude l' aire sous la courbe de la6-hydroxycWorzoxazone entre les
deux doses, ce qui résulte d'une demi-vie d'élimination plus longue après une dose de 750
mg.
La figure 4 présente les courbesconcentrations-temps de la chlorzoxazone et dela
6-hydroxychlorzoxazo neaprèsadministrationde 250mg et de750 mgde chlorzoxazo nechez6 des 16 sujetsétudiés.
A
10000 1000 .--..-ê
100l
Cl c:---
c: 0 0 2 4 6 8 10 :0=-ro....
...
c:B
Q) u c: 0 U 1000 100o
2 4 6 Temps(heures) 8 10Figure4 : Courbes concentration-tempsdela chlorzoxazone (A)et dela6
-hydroxychlorzoxazone(B)après desdosesde 250 mg (_) et de 750 mg (e) (d'après 36).
Quelle que soit la dose administrée (250 mg ou 750 mg), le pic plasmatique de la chlorzoxazone est identique etil est atteint en 1heure 30.
Le pic plasmatique de la 6 hydroxychlorzoxazone est atteint en 2 heures pour les deux doses mais,il est plus important lorsque la dose administrée est de 250 mg.
Lafigure 5 illustrel'excrétionurinairecumulativede la 6-hydroxychlorzoxazoneen% de ladoseaprès administraiion oralede 250 mg et 750mg de chlorzoxazone.
100
Figure 5 : Excrétion urinairecumulativede la6-hydroxychlorzo xazone en %dela doseaprès administration oralede 250 mg (_) et 750 mg (e)de chlorzoxazone (d'après 36).•p<0.05
Bien que la récupération urinaire totale de la 6-hydroxychlorzoxazone à 10 heures ne soit pas différente entre les 2 doses, la récupération fractionnelle après administration de 750
mg est plus faible les premières heures, suggérant que la clairance est saturée par ce
mécanisme quand les doses de chlorzoxazone sont plus fortes, ce qui pourrait
considérablementaltérer lesmesures de trait phénotypiqueàdesdoses élevées.
Ceci est illustré par une diminution d' environ 48% du rapport plasmatique de la 6-hydroxychlorzoxazone surlachlorzoxazone à 4heures chez5 des 6 sujets.
»
Les résultatsde cetteétude montrentqu'unedosede 250mg dechlorzoxazonedoit être utilisée et qu'un rapport plasmatique obtenu dans les 2 à 4 heures suivant6-2.2-VARIAT1üNS BIOLOGIQ UES DU TEST
Le métabolisme de la chlorzoxazone, et donc l'activité du CYP2E I, peu t être influencé par différents facteurs (39). Une étude inclu ant différents groupes d'individu s a permi sd' évaluer l' effetdediverses conditions physiopath ologiques et de sty le de vie.
2.2.1- Sujets
- L'activité du CYP2EI a été mesurée en utilisant le test de la chlorzoxazone :après une nuit de jeûne, lesindividus ontabsor bé 500 mg de chlorzoxazone avec un verre d'eau ou de jus de pamplemousse. Une prise de sang leur a été faite 2 heures après la prise de chlorzoxazoneafin demesurerle rapport métaboliquede la chlorzoxazone(HCZXlCZX).
- Les sujets n'ont pris aucun médicam ent susceptible d'i nterférer avec l' acti vité du CYP2E I avant le test (tels que le paracétam ol, le disulfi rame, ou l'isoni azid e). La consommation tabagique etalcooliquea étéévaluéeaucours d' entr et iensindi vidu els (39).
+sujetscontrôles :
- 42 Français (21 hommes et 21 femmes);
- II Italiens (5hommes et 6femmes); - 16 Mexicains (8homm es et8 femmes).
Ces personn es se sontabstenues deprendrede l'alcoo l durant les 5 jours précédantle test.
+sujetsalcooliques:
72 sujets (49 hommes et 23 femmes, dont la consommation alcoo lique est de 162 ±65 glj ). Ces personnesont été admises à l'hôpital pour une cure de désintoxi cation et ont participé au test de la chlorzoxazone le jour suivant leur admissio n à l'hôp ital rCYP2El ind uit par
l'éthanol") et/ou après 21 jours d'abstinence alcoolique rCYP2El non-induit"). Tous les
de 1.45g/1 ± 0.95, et lc test de la chlorzoxazone a été réalisé après vérification de toute
absence alcooliquesanguine.
•sujets fumcurs :
- 75 sujetsfumant 23±II cigarettes par jour ct non alcooliques;
- 35 sujetsfumant30±12 cigarettes par jour et alcooliques.
•sujets obèses:
30 obèses dont 12 hommes et 18 femmes avec un BMI > 30 kg/rn" ; parmi ces patients, 13
souffrent de diabètenon insulinodépendant (DNID).
• sujetstravaillant dans une entreprise de chaussureet soumisàdifférents solvants:
10 Mexicains (6 hommes et 4 femmes), exposés à différentes quantités de solvants volatils tels que lepentane,l' acétone, l'hexane,l'alcoolisopropylique,le toluène et le xylène.
Ces sujets ont égalementcessé touteabsorptionde boissons alcoolisées 5 jours avant le début du test.
2.2.2-Résultats
L'effet de différentes conditions physiopathologiques et de style de VIe sur le métabolisme dela chlorzoxazone,a été évaluéauseinde plusieursgroupesd'individus.
2.2.2.1- Effet du sexe sur le rapport métaboliqu e de la chlorzoxazone
•••p<O.OOO1 Alcohol-induced CYP2E l .2 4 iô
...
.
.
' .~ 0 3 .0 ni • ......
' ~.'
QJ 2 • c: 0 • •.
.
l;j non-inducedCYP2E 1
,.'
• •)( • •
.
0 ·'T'1' N,
••...
y
.:,. ,
0 ••:c
•
66 Ali •.
'
U 61.66 66 ••• 0Male Female Male Female
0"49 0"44 0"37 0"13
Figure 6 : Rapportmétaboliquede lachlorzoxazonechezdeshommesversusdes femmes
(d'après 39).
Les individus "CYP2El non-induit" regroupent les sujets contrôles sains (21 hommes
et21 femmes)et les alcooliques s' étant abstenus de boire depuis 21 jours (28 hommes et 21
femmes ).
Lerapport métabolique de la chlorzoxazone chez les femmes est légèrement inférieur
à celui des hommes, aussi bien chez les sujets non alcooliques ("CYP2E l non induit") que
chez lessujets alcooliques; cependant,ladifférencen'est statistiquement pas significative.
Des études antérieuresont suggéréque les femmes présentaientun plus faible rapport
métabolique delachlorzoxazoneque leshommes.
»
Lesexeneconstitue pasun réelfacteurde variabilitéd
ë
l' activitédu CYP2El.Les sujets alcooliques présentent un rapport métabolique de la chlorzoxazone plus
élevé que les sujetsnon alcooliqueset ce,quel que soit le sexe.
»
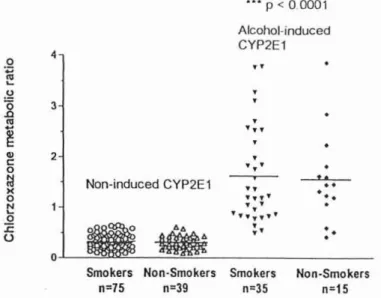
L'alcool provoquedonc une augmentation dumétabolisme de la chlorz oxazone et2.2.2.2- Effet du tabagisme et de l'alcool sur le rapportmétabolique de la chlorzoxazo ne(figure7)
"'p<O OOOl
Alcohol-induced
CYP2E1 4 .2
..
ôi ~ .2:g
3..
,~
'..
~ 2 • c ••• 0i;j Non-inducedCYP2E1
..
t t.
,
><.
0 • ,."y'.
~'
.
• 0 """" ".." :ë..
•.
U.'
.
0Smokers Non-Smokers Smokers Non-Smokers
n=75 n=39 n=35 n=15
Figure 7 : Rapport métabolique de la chlorzoxazone chez des fumeurs non alcoolique s ('CYP2E l non-induit") versus des non fumeurs, et chez des fumeurs alcooliques ('CYP2E I induit")versusdes non fumeurs.
Lesindividus 'CYP2El non-induit"incluent les sujets contrôles sains (n= 23) et les alcooliquesquiont arrêtédeboiredepuis 21 jours (n= 52) (d'a près39).
Ce schéma montre que le tabac ne modifie pas de manière significative l'hydroxylation de la chlorzoxazone, aussibienchez les fumeurs non alcooliques versus les non fumeursquechez les fumeurs alcooliquesversus les nonfumeurs.
Par opposition,cesdonnées montrentque l'alcool provoqueunenette augmentation de cette réaction d'h ydroxylation. Eneffet, lerapportmétaboliquede la chlorzoxazone chez les suje tsalcooliquesestplus élévéquechez les non alcooliques, que ce soit chezles fumeurs ou lesnon fumeurs.
D'autresétudesont montré quele métabolisme de la chlorzoxazoneétait troisfois plus rapidechez des suje tsalcooliquesque chez des sujetsquise sontabstenus deboire de l'alcool
métabolisme de laehlorzoxazone, ou siune lésion hépatique sévère est une conséquence de
l' activitéaltérée du CYP2E I (26).
D'autres études doiventêtremenées afin de déterminersi le métabolisme des drogues
par le CYP2El est diminué chez tous les sujets présentant un stade de malad ie hépatique
avancé endehors de touteétiologie.Néanmoins,ilsembleprudent dediminu er les posologies des médicaments substrats du CYP2El chez les patients souffrant de lésion hépatique sévère (26).
L'activité du CYPE I est induite après une consommation chro nique d'alcool mais retrouvesa valeurbasaleaprès 5 à 8jours d'abstinence alcooliquechez des sujets alcooli ques
(5).
»
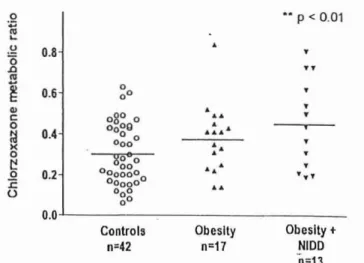
Contrairementàl'alcool,le tabacn'adoncpas d'incidencesurl'acticitédu CYP2El.2.2.2.3 - Effet de l'obésité sur le rapport métabolique de la chlorzoxazone (figure8) .2 ··p<O.Ol 10~ .2 0.8
,
'0 .D..
"ê
0.6 000 G> •,
c aga a..
,
0 oooQ • l;j 0.4 o 0 01.01. ..."
00 0:.
0 80 6 0 , ~o
ooggo
'.
.
, 0 0.2 '" :;: 00°8°°..
o ·0 00 0.0Control. Obeslly Obesllyt
n-42 n=17 NIOO
'n-13
Figure 8 : Rapport métaboliquedela chlorzoxazonechezdessujetsobèses avec ousans
DNID (d'après39)
Cette figuremontre que le rapport métaboliquede lachlorzoxazonechez les sujets
\
obèses est supérieuràcelui des sujetscontrôles(0,4versus 0,3).Lorsque l' obésité estassociée
àun diabètenon insulino dépendant,cerapport devient encoreplusimportant: 0,5 contre0,3 chez les sujetscontrôles.
Le CYP2E 1 est impliqué dans lemétaboli sme des corps cétoniques et sonactivitépeut
être modifiée par l'obésité.
Dans cette étude, l' obésité augmente le rapport métabolique de la chlorz oxazone,
notamm entquand elleestassociéeà un diabètenon-insulinodépendant (DNID).
:> L' obésité etlediabète sont desfacteursphysiopatholo giquesprovoquant une
inductionduCYP2EI.
2.2.2.4 - Effet des solvants organiques sur le rapport métabolique de la chlorzoxazone(figure9)
De nombreux produits volatils courants sont des inducteurs et des substrats du
CYP2E I( 5). Par conséquent, le métabolisme de la chlorzoxazone a été évalué chez des
travailleurs exposésà dessolvantsorganiqu es,telsqueletoluène, le xylène, l'acétate d' éth yle
et l' acétone dans uneentreprisedefabriquede chaussures mexicaine.
.f! 0.6 1ii ~ a u ~ 0.6 a .0
..
00 a~
ago•
··p<O.Ol" 0.4 °00°° 00 c: 00
•
0 000 0 i:!.
'
ocgg •• x 8~o 1>1/' cooo • 0 a 00.
' a,
N 0.2 °000°•
0 ~ 0 °0000•
.
'
z
000..
' o 00 , 0.0French Itallan Mexlcan Mexlcan
controls controls controls shoemakers
0"42 0"11 n"16 n"10
Figure 9:Rapport métaboliquedela chlorzoxazo nechezdestravailleurs exposésàdes
solvants organiques volatilsdansunefabriquedechaussures au Mexique (d'après39).
En dépit d'habitudes alimentaires et de manières de vivre présumées différentes,
:» L'exposition à des solvants organiques a pour conséquence une diminution significative du rapport métabolique de la ehlorzoxazone suggérant que ces solvants sont probablement in vivo des substrats compétitifs du CYP2El; comme tous ces produits sont sûrementprésentsenmême temps dans le sang des sujets, il est probablequ'ils n'aient pas été complètement éliminés pendant la nuit. Par conséquent ils pourraient rentrer en compétition avec la chlorzoxazone pour le métabolisme par le CYP2El (39). Aucune corrélation n' a étéobservéeentre lesconcentrations dans l'air de ces solvants et l'activité du CYP2E l, ce qui peut s'expliquer par la diversité qualitative et quantitative de ces solvants dans les différents lieux de travail, couplée aux différences inter-individuelles des taux de CYP2E l.
Celle étudepermet derenforcer l'hypothèseselon laquellela chlorzoxazone serait un marqueurbiologique de l'expositionàdes solvantsorganiquessur lelieudetravail (39).
2.2.2.5 - Effet du jus de pamplemousse sur le rapport métabolique de la chlorzoxazone
Lejusde pamplemousseest connupour augmenter ladisponibilité orale d' une variété de substrats du CYP3A4, incluant la félodipine (FLODIL Lp®) ct la nifédipin e (ADALATE®) (39). Lemécanismede celte augmentation de la biodisponibilité est supposé être soit une inactivation de l'enzyme par les composés dujus de pamplemousse, soit une autoinhibitionde l'enzyme.
Dans le but d'évaluer la contribution du CYP3A4 dans l'hydroxylation de la chlorzoxazone, les individus ont reçu simultanément 500 mgde chlorzoxazone et200 ml de jusde pamplemousseconcentré.
La figure 10 illustre les résultats de l' administration concomitante de JUS de
pamplemousse et dechlorzoxazone chez9sujetscontrôles.
U.b 0.5 0.29 ±O.l l:l: :2 N 004 :I: U 0.3 0.2 Control 0.1 0.0 0.31±O.II +Grapefruitjuice
Figure 10 : Rapport métaboliquede la chlorzoxazonechez9 sujetscontrôles ayant reçu 500
mg de chlorzoxazone seuleet avec200ml de jus de pamplemousse(d'après39).
L'administration concomitante de jus de pamplemousse et de chlorzoxazone ne
modifie pas demanière significative lerapport métabolique moyen: 0,29
±
0,1 versus 0,31±
0,1, respectivement sans et avec jus de pamplemousse, chez 9 sujets contrôles (39). La différencemoyenne entreles deuxgroupesest de 8% (39).
En outre, une étude in vitro a montré que le jus de pamplemousse naturelconcentré à
10%, était capabled'inhib erl'oxydationde lanifédipine, une activitéspécifique duCYP3 A4.
Par opposition, la 6-hydroxylation dela chlorzoxazone, quiest spécifique du CYP2E I , n'est pas modifiée par ce même jus de pamplemousse.
Ces données suggérent que le CYP3A4 inhibé par le jus de pamplemousse est peu impliquédansle métabolisme dela chlorzoxazone, aussi bienin vivo qu'in vitro(39).
» Cette étude permet de eonfinner que la ehlorzoxazone est un marqueur sélectif de l'activité du CYP2El chez l'homme. Le choix de la ehlorzoxazone repose aussi sur son
caractère sûr etson absence d'effetpharmacologiquedanslesconditions du test du CYP2El.
Cependant, il existe de nombreux facteurs intervenant dans la régulation de l'activité
du CYP2E1, qu'il est nécessaire de connaître afin d'interpréter correctement les résultats de
mesure d'activité du CYP2El. Ces facteurs sont essentiellement endogènes (état
2.3-REGULATIO NDE L'ACTIVITE DU CYI'2EI
Ilexiste une grande variabilitéinter-individuelle dans l'acti vité du CYP2E I (34,40) . Cette observation repose sur des mesures in vitro(en utilisantdes microsomes hépat iques) et
desmesuresinvivo(en utilisant la chlorzoxaz onecomme marqueur).
Les facteurs modulant l'activité du CYI'2E I, et contribuan t par conséquent à celte
variabilité, peuvent être d' ordre physiopathologique (obésité, jeûne, dysfonctionn ement hépatique), ouenvironnemental (induction par l' éthanol, inhibition par certains médicaments commeledisulfirame oupar des constituants alimentairescomme les isothiocyanates).
De plus, la régulation de l'expression du CYI'2EI survient à de multiples niveaux transcription, stabilisation de l' ARNm, augmentatio n de la traduction de l'ARNm et stabilisation protéique (19). Une telle complexité dans la régulation peut être le reflet d'un importantrôleendogène pour le CYP2E 1(4 1).
Il semble donc intéressant de déterm iner le degré de cette variabilité (41) afin
d'évaluer la susceptibilité individuelleàcertaines maladies, ainsi quelatoxicité des substrats
duCYI'2EI.
2.3.1- Physiologique
2.3.1.1 - L'âge
Contrairement au sexe, l'âge est un facteur qui influence le taux hépatique de CYP2E 1;cedernierdiminueen effet de 5% tousles10 ans(42).
2.3.1.2-L'alimentation
La consommation de fruitsetde légumes est associéeà un faiblerisque de développer certaines formes de cancer. Les mécanismes pouvant expliquer cette protection sont nombreuxmais, dans la plupartdes cas, l'inhibition des enzymes participantàl'activation des