MINISTERE DE L’ENSEIGNEMENT SUPERIEUR ET DE LA RECHERCHE SCIENTIFIQUE UNIVERSITE AKLI MOHAND OULHADJ – BOUIRA
FACULTE DES SCIENCES DE LA NATURE ET DE LA VIE ET DES SCIENCES DE LA TERRE DEPARTEMENT DE BIOLOGIE
Réf : ……./UAMOB/F.SNV.ST/DEP.AGR/2018
MEMOIRE DE FIN D’ETUDES
EN VUE DE L’OBTENTION DU DIPLOME MASTER
Domaine : SNV Filière : Sciences Agronomique
Spécialité : Technologie agroalimentaire et contrôle de qualité
Présenté par :
Hadj amer kenza
Thème
L’incorporation des margines dans une huile de friture et
l’étude de son effet sur l’oxydation thermique
Soutenu le : 30
/ 06/ 2018Devant le jury composé de :
Nom et Prénom Grade
Mme. Mahdi Khadidja MCA Univ. de Bouira Presidente Mme. Bourfis Nassima MAA Univ. de Bouira Promotrice Mme Iazourène Ghania
M Chadri Abd Aladjid
MCB Univ. de Bouira Univ .de Bouira
Examinatrice Co-promoteur
Nous tenons à remercier DIEU le tout puissant et miséricordieux,
qui nous a donné, la force et la patience d’accomplir ce modeste
travail.
Tout d’abord, je tiens à remercier ma promotrice : BOURFIS.N
enseignante (MAA) à l’université de Bouira Pour son implication dans
nos recherches, son aide lors de l’élaboration de notre problématique
et son suivi durant la finalisation de ce projet. Son soutien, sa grande
disponibilité, le temps qu’il nous a consacré et ses compétences dans
ce domaine nous a permis de mener à bien ce travail.
Mes sincères remerciements à mon Co-promoteur :CHADRI.M
(DOCT) à l’université de Bouira pour
Son aide de l’élaboration de notre et son suivie durant la finalisation
de ce projet.
Nous vifs remerciements vont également aux membres du jury qui
ont acceptés d’examiner notre travail et de l’enrichir par leurs
propositions.
Et tous les enseignants de la promotion de technologie
agroalimentaire et contrôle de qualité.
On voudrait remercier aussi toutes les personnes qui ont participé de
prés ou de loin à nous recherches et l’élaboration de ce
mémoire.
Je remercie ma grande mère KERFOUF .Z pour ses efforts.
Dédicaces
Avec un énorme plaisir, un cœur ouvert et immense joie, que je dédie ce
modeste travail
A mon adorable très chère ma grande mère pour son affection
Sacrifice et ses efforts afin de me voir réussir
Je lui serais reconnaissante pour le restant de ma vie
La mémoire de mon grand père qui aurait été si fier de moi
A mon trésor, ma chère mère
A mon cher père Hadj amer Rabah
A ma deuxième mère ma tendre tante
A mes oncles et leurs femmes
A mes frères, A mon unique sœur
A ma cousine Bissem
A mes amis (e) : Faiza, Fifi, Ghania, Lamia, Imen, yamina, Karima.
LISTE DES ABREVIATIONS LISTE DES TABLEAUX LISTE DES FIGURES RESUME
SUMMARY
INTRODUCTION ... ERREUR ! SIGNET NON DEFINI.
I. CHAPITRE I : OLIECULTURE………....3
I.1 L’OLEICULTURE EN ALGERIE………...3
I.2 EXTRACTION D'HUILE D'OLIVE ... 4
I.2.1 Procédés en discontinu ou système à presse ... 5
I.2.2 Procédés en continu ou système à centrifugation ... 5
I.3 LES SOUS-PRODUITS DE LA PRODUCTION D’HUILE D’OLIVE ... 6
I.3.1 Grignons ou tourteau ... 6
I.3.2 Margine ... 8
II. CHAPITRE II : OXYDATION DES HUILES ET LES ANTIOXYDANTS ... 11
II.1 L’OXYDATION DES LIPIDES ... 11
II.2.1 Altérations biologiques ... 11
II.2.2 Altérations chimiques ... 11
II.2.2.1 Acidification ... 11
II.2.2.2 L’oxydation ... 12
II.2.2.3 Les conséquences des réactions d’altération des corps gras : ... 14
II.3. LES ANTIOXYDANTS ... 15
II.3.1. Définition : ... 15
II.3.2. Mécanisme d’action ... 15
II.3.3. Utilisation des antioxydants ... 16
II.3.4. Classification des antioxydants ... 16
II.3.4.1 Antioxydants de synthèses ... 16
II.3.4.2 Substances synergiques ... 16
II.3.4.3 Antioxydants d’origine végétale ... 17
II.4. LES POLYPHENOLS... 18
II.4.1.1 Polyphénols simples ... 19
II.4.2. Polyphénols complexes (tanins) ... 21
II.5 BIOSYNTHESE DES COMPOSES PHENOLIQUES ... 22
III. CHAPITE III : MATERIELS ET METHODES ... 23
III.1 EXTRACTIONS DES POLYPHENOLS A PARTIR DE LA MARGINE ... 23
III.2 L’HUILE VEGETALE UTILISEE ... 23
III.3 CARACTERISATIONS PHYSICOCHIMIQUES DES MARGINES ... 23
III.3.1 Détermination du taux d’humidité ... 23
III.3.2 Détermination de la teneur en cendres ... 24
III.3.3 Détermination de pH ... 25
III.3.4 Détermination de la conductivité ... 25
III.3.5 Détermination de l matière en suspension(MES) ... 25
III.3.6 Détermination de la turbidité ... 25
III.3.7 Demande biochimique en oxygène(DBO5) ... 26
III.4 DETERMINATION DE LA TENEUR POLYPHENOLS TOTAUX ... 26
III.5 DOSAGE DES FLAVONOÏDES ... 27
III.6.Le pouvoir réducteur……….28
III.7 LA CAPACITE ANTIRADICULAIRE ... 31
III.8 LES ANALYSES EFFECTRICES POUR L’HUILE VEGETALE : ... 32
III.8.1 Indice de réfraction à 20°C ... 32
III.8.2 Indice d’acide ) ... 33
III.8.3 Indice de peroxyde ... 34
III.8.4 L’indice d’iode ... 35
III.8.5 Détermination des extinctions spécifiques : NFISO3656 ... 36
IV. CHAPITRE IV : RESULTATS ET DISCUTIONS ... 37
IV.1 RESULTATS D’ETUDE PHYSICOCHIMIQUES DES MARGINES ... 37
IV.1.1 Détermination de la teneur en eau ... 38
IV.1.2 Détermination de la teneur en matière sèche ... 38
IV.1.3 Détermination de la teneur en matière organique ... 38
IV.1.4 Détermination de la teneur en cendres ... 38
IV.1.5 Le pH ... 39
IV.1.6 Détermination de la conductivité ... 39
IV.1.9.Détermination de DBO………40
IV.2 DOSAGE DES POLYPHENOLS TOTAUX ... 40
VI.3.Dosage des flavonoïdes………41
IV.4 LE POUVOIR REDUCTEUR ... ERREUR !SIGNET NON DEFINI.42 IV.5 La capacité antiradiculaire DPPH ………..42
IV.6 Les analyses effectuées pour l’huile végétale………...…43
IV.6.1 Caractéristiques physico-chimiques de l’huile Elio : ... 44
IV.6.1.1 L’indice de réfraction ... 44
IV.6.1.2 L’indice d’acide ... 45
IV.6.1.3 L’indice de peroxyde ... 45
IV.6.1.4 .L’indice d’iode ... 46
IV.6.1.5 Détermination de l’extinction spécifique ... 46
CONCLUSION ... 51
REFERENCES ANNEXES
Les abréviations utilisées COI: Conseil Oléicole International.
CPT: Composés Phénoliques Totaux.
DPPH: radical 2,2 Diphenyl 1-Picryl-Hydrazyl. EAG : Equivalent d’Acide Gallique.
EAT: Equivalent d’Acide Tannique. EQ: Equivalent de Quercitine. MES: Matière En Suspension. Mo : matière organique. Méq: Milliéquivalent. MS : Matière sèche. mS/cm: Milli siémens/centimètre. nm: Nanomètre. PH: Potentielle d’Hydrogène. tr/min: Tour par Minute. UV: Ultra-violet.
CP : composés phénoliques.
MM : matière minérale.
DBO : demande biologique en oxygène.
AG : acide gras.
Ia : indice d’acide. G : gramme.
RH : acide gras libre. R˙ : radical libre.
ROO˙: radical peroxyle. ROOH : hydroxyperoxyde. RO˙ : radical alkoxyle.
OH˙ : radical hydroxyl.
AH : antioxydant .
Tableau I. 1 : Les types de grignons et leurs caractéristiques ………..6
Tableau I. 2 : Composition du grignon humide. ... 7
Tableau I. 3 : Composition du grignon épuisé séché (en % de matière sèche) ... 7
Tableau I. 4 : Les principaux composants des margines. ... 10
Tableau II. 1 : Les principales classes des composés phénoliques. ... 22
Tableau IV. 1: les résultats des analyses physicochimiques des margines. ... 37
Tableau IV. 2 : Caractéristiques physico-chimiques d’une huile alimentaire ... 44
Tableau IV. 3: Caractéristiques physico-chimiques de l’huile Elio. ... 44
Tableau IV. 4: Résultats des travaux antérieurs pour le paramètre acidité libre. ... 45 Tableau IV. 5: Résultats des travaux antérieurs pour le paramètre indice de peroxyde …46
Liste des figures
Figure I. 1 : Les principaux procédés d’extraction d'olive ... 4
Figure II. 1 : Mécanisme général des réactions d’oxydation des lipides ... 13 Figure II .2 : Conséquences de la peroxydation des lipides ... 15 Figure II .3 : Deux exemples des structures des caroténoïdes ... Erreur ! Signet non défini. Figure II .4 : Structure du noyau phénol ... Erreur ! Signet non défini. Figure II .5 : Squelette de base des flavonoïdes. ... 20 Figure II .6 : Structures de l’hydroxytyrosol (a) et du tyrosol (b). ... 20 Figure II. 7 : Structure chimique (a) d’un tanin condensé (proanthocyanidine) et (b) d’un gallotanin (1, 2,3-tri-O-galloyl-β-D-glucose). ... 21
Figure III. 1 : Organigramme représentant dosage des polyphénols totaux.Erreur ! Signet non défini.
Figure III. 2 : diagramme de détermination de pouvoir réducteur des margines. ... Erreur ! Signet non défini.
Figure III. 3 : réduction de radical libre DPPH en DPPH ... 30 Figure III. 4 : Étapes de test de DPPH. ... Erreur ! Signet non défini. Figure III. 5 : organigramme représentant le dosage des flavonoïdes dans l’extrait de la margine……….32
Figure IV. 1 : Pourcentage d’inhibition de radical libre DPPH. .... Erreur ! Signet non défini. Figure IV. 2: évolution de l’extinction spécifique de l’huile vierge K232 ET K270. .. Erreur ! Signet non défini.
Figure IV. 3: évolution de l’extinction spécifique de l’huile vierge K232 ET K270 pour 25ml. ... Erreur ! Signet non défini. Figure IV. 4: évolution de l’extinction spécifique de l’huile vierge K232 ET K270 pour 50ml. ... Erreur ! Signet non défini. Figure IV. 5: évolution de l’extinction spécifique de l’huile vierge K232 ET K270 pour 100ml. ... 50
Résumé
La dégradation des lipides par L’o² est la cause de la détérioration des aliments pendant le stockage et le traitement thermique. Cette dégradation se manifeste au niveau organoleptique, nutritionnel et hygiénique. A fin de stabiliser les lipides, on a recours à certains antioxydants naturels ou synthétiques. Il existe une forte tendance à limiter les composés synthétiques en industrie alimentaire, suspectés de toxicité. De ce fait, on s’intéresse de plus en plus à l’utilisation d’antioxydants naturels.
Dans ce travail, les composés phénoliques (CP) sont extraits à partir des margines, et utilisés en tant qu’antioxydant naturel. Les résultats des analyse physicochimiques nous renseignons que ils ont un pH un acide (4.73±0.15) et ont une teneur élevée en eau
(90.42±1.73) et en matière organique (99.62±0.17), pauvre en matière minérale (0.35±à 0.17) et de DBO de l’ordre (337mg/L) et une teneur de (50mg/L) en PPT.
L’extrait de margines est un inhibiteur puissant des radicaux générés lors de l’oxydation thermique des huiles, comme il a été observé lors de la mesure de coefficient d’extinction spécifique l’absorbance à 232 nm et 270nm des réductions de l’oxydation.
Les résultats obtenus pour le coefficient d’extinction pour l’huile végétale est : k232=2,54Et k270= 0, 31, donc cette huile dés la deuxième friture est totalement oxydée cette huile est oxydée rapidement.
- Pour l’huile végétale additionnée de 100ml des margines : k232=1, 14, k270= 0,17, donc cinq friture n’est pas oxydée .Donc les polyphénols on diminué l’activité d’oxydation de l’huile.
- Pour l’huile végétale additionnée de 50ml des margines : k232= 2,61, k270= 0,44 donc après quatre friture est totalement oxydée. Donc les polyphénols on diminué l’activité d’oxydation de l’huile.
- Pour l’huile végétale additionnée de 25ml des margines : k232= 2,69 , k270= 0,68 donc après quatre friture est totalement oxydée donc les polyphénols on diminué d’oxydation de l’huile.
Mots clés : Huiles végétales, altération thermique, oxydation, antioxydants, polyphénols, margines.
Sammuray
The breakdown of lipids by oxygen is the major cause of food deterioration during storage and heat treatment. This degradation is manifested organoleptically, nutritionally and hygienically. In order to stabilize lipids, certain natural or synthetic antioxidants are used. There is a strong tendency to limit synthetic compounds despite their proven efficacy in the food industry, suspected of toxicity. As a result, there is growing interest in the use of natural antioxidants incorporated in oils.
In this work, phenolic compounds (CP) are extracted from vegetable waters, these CPs are used as natural antioxidants.
The vegetable water extract is a potent inhibitor of the radicals generated during the thermal oxidation of the two oils, as observed when measuring the specific extinction coefficient absorbance at 232 nm and 270 nm. Oxidation reductions, so these phenolic compounds have to participate in the protection of oils.
The results obtained for the extinction coefficient for the vegetable oil is: k232 = 2.54Et k270 = 0.31, so this oil from the second frying is completely oxidized this oil is oxidized rapidly under the effect of heat treatment.
The results obtained after five cycles of frying (with addition of polyphénols) are:
- For vegetable oil with 100ml of vegetable water: k232 = 1, 14, k270 = 0.17, so five frying is not oxidized. So polyphénols decreased the oxidation activity of cooking oil therefore there is a slow oxidation of the oil under the effect of heat treatment.
- For the vegetable oil added with 50ml of the vegetable water: k232 = 2,61, k270 = 0,44 so after four frying is completely oxidized so the polyphenols decreased the oxidation activity of the cooking oil under the heat treatment effect but when the concentration is decreased the oil is oxidized.
- For the vegetable oil supplemented with 25ml of the vegetable water: k232 = 2,69, k270 = 0,68 so after four frying is completely oxidized so the polyphénols decreased the oxidation activity of the cooking oil under the heat treatment effect
Key words: Vegetable oils, weathering, oxidation, antioxidants, polyphenols, vegetable waters.
ا ن ھ ا O² را ا او ا ء أ ءا!" ا ر ھ #$ ھ . % ر ھ ا ا!ھ &' و ( ا )* ا + ( او !" او . , -.أ % )$ / ة أ )1 2 وأ ) )$ ا ة 3ا تاد '% ما ا 7 ، ن ھ ا )2 9:ا . $ ا % 1 ي < -)% ك ھ 2 9 >+ )2 9:ا ت ، !?3ا % @A >+ B$ C و . ) A ،D ! ) )$ ا ة 3ا تاد '% ما ا >+ ا % م ھا ك ھ . % ) )E ا ت $ ا جا ا 7 ، - ا ا!ھ >+ ج ا ) )$ ا ة G د ' @%ا او . HI A أ A $ )I ) )J ا )I )E ا -) ا 7@ ن pH ً'% * ) 4.73 ± 0.15 ( ء ا % ) 2 $ A 7@ و ) 90.42 ± 1.73 ( ' ا دا او ) 99.62 ± 0.17 ( ، و )L+ ة )A ا دا ا >+ ) 0.35 ± M إ 0.17 ( ( و BOD #1 1 ) 337 mg / L ( ى %و ) 50 mg / L ( >+ ) )E ا ت $ ا . P1 % نإ ج ا ) J دا 1 ي < Q$,% ھ ء أ R* ، ت 1 را ا ة 3ا لTU ة ا ت 2 ضا LA:ا ص X %: >2 ا ص X %:ا س )< 232 و % A A 270 ة 3ا ت ')E % % A A . . >ھ ) $ ا ت 1 ضا LA:ا -% @)12 -X ا HI ا : k232 = 2.54Et k270 = 0.31 ا!ھ D ! ، 2 / ا ا!ھ ة أ 7 ً% >A , ا ر L ا % 2 / ا . >1L ا % تارود Z U @)12 ل X ا 7 > ا HI ا ) + [إ \% ) )E ا ت $ ا ( >ھ : \% > $ ا / 1 $ 100 > $ ا ء ا % -% : 14 ، k232 = 1 ، 14 ، k270 = 0.17 D ! ، : >1< U . ن]+ ا! ) )E ا ت $ ا / ا >+ ة 3ا ط CA % /11< . ـ 1 J ا ) $ ا ت 1 $ 50 > $ ا ء ا % -% : k232 = 2،61 ، k270 = 0،44 D ذو 1% ة أ رأ . ةد % ن]+ ا! ) )E ا ت $ ا >+ ة 3ا ط CA % /11< / ا . ـ -ّ J ا > $ ا / 1 $ 25 > $ ا ء ا % -% : k232 = 2،69 ، k270 = 0،68 رأ M * ن]+ ا! ً% ة b% ر C< ) )E ا ت $ ا / ا ة أ /11< . ا ت ا : ا ، ا ت ا را ا ت ، ة !ا تاد # ، ة !ا ، ) )E ا ت $ ا ، ج ا
Introduction
Les huiles végétales tell que les huiles de table occupent une place importante dans la nutrition humaine en effet les lipides sont indispensables à notre alimentation, ils doivent apporter 1/3 de notre énergie quotidienne. Ils ont un rôle nutritionnel sur les plans énergétique et métabolique et sont intéressants par leurs apports en acides gras essentiels et vitamines liposolubles. Ces huiles sont utilisées dans l’alimentation pour les fritures, les plats cuisinés et dans l’assaisonnement. Comme tout aliment, des qualités organoleptiques, nutritionnelles, hygiéniques sont requises car tout manquement pourrait avoir une répercussion directe sur la santé humaine (Salta et al .,2009).
Les huiles issues des graines oléagineuses comme l’huile de tournesol et de soja sont riches en tocophérols et presque dépourvues de composés phénoliques (Fritsch et al., 1997 ; Salta et al., 2009). Ces huiles peuvent être soumises à des altérations qui peuvent être de différents ordres. Durant le stockage, le traitement thermique et la friture, la détérioration graduelle de l’huile prend place dû aux réactions de décomposition à savoir l’hydrolyse, l’oxydation, l’isomérisation et la polymérisation (Gertz et al., 2000 ; Gòmez-Alonso et al ., 2003 ; Lee et al ., 2007).
L’oxydation est la cause principale de détérioration des huiles. En effet, cette dégradation oxydative dépend de plusieurs facteurs : composition en acides gras de l’huile, présence d’antioxydants ou pro oxydants, température, présence d’oxygène, de métaux lourds, (Kalogianni et al ., 2009). En effet, la conséquence de cette dégradation est la perte des qualités organoleptiques, nutritionnelles et hygiéniques (Warner, 2002). Cependant, la quantité des antioxydants naturels n’est pas toujours suffisante pour stabiliser les huiles, d’où la nécessité d’addition des antioxydants synthétiques. Les plus utilisés par l’industrie agroalimentaire sont : Le butylhydroxyanisole (BHA), le butylhydroxytoluéne (BHT), le tributylhydroquinone (TBHQ) et le gallate de propyl (PG), du fait de leurs avantages(Augustin et Berry, 1983). Malheureusement, plusieurs rapports indiquent que ces antioxydants peuvent avoir des effets carcinogéniques (Reddy et al ,. 2005) et sont actuellement mal acceptés par la plupart des consommateurs .Il existe une forte tendance à limiter leur utilisation malgré leur efficacité et favoriser l’utilisation des antioxydants naturels comme alternative des premiers.
De ce fait, les industries agroalimentaires développent l’utilisation des antioxydants naturels et surtout leur incorporation dans les huiles destinées à la friture. (Almi Dalila, 2010).
2 L`utilisation la plus connue de l`olivier est sans nul doute l`extraction de l`huile a partir de son fruit, l`olive. Cette huile a une importance capitale dans la nutrition et la santé humaine, si bien que la recherche s`est élargie à l`étude des sous-produits de l`olivier, notamment les margines. Ces dernières sont riches en nombreux composés phénoliques. (Iguergaziz N, 2012). Elles constituent 10% de poids total.
Dans ce contexe le travail est réalisé dans le but de :
-appliquer des méthodes simples d’extraction des antioxydants à partir des margines en utilisant le méthanol local ,et la détermination des polyphénols totaux et les flavonoïdes.
-tester le pouvoir antioxydant de ces extraits phénoliques.
-L’évolution de l’oxydation des huiles de friture enrichies par ces extraits en étudiant le coefficient d’extinction.
ChapitreI oléiculture
3 Chapitre I : oléiculture
L'olivier est parmi les plus vieux arbres cultivés dans le monde, Les premiers vainqueurs des jeux olympiques au 7eme siècle avant Jésus Christ se voyaient couronnés de rameaux d’olivier et recevaient des jarres d’huile d’olive en récompense de leurs performances. L’olivier a été associé à des vertus telles que la sagesse, la paix, la victoire, la richesse, la fertilité et la fidélité (Liphschitz et al., 1991).
L'origine de l'olivier a été le sujet de plusieurs débats (Loukas et Krimbas, 1983). Bien que des fossiles datant de la période tertiaire (il y a 1 million d'années) aient prouvé l’existence d'un ancêtre de l'olivier en Italie (Boskou, 1996), il paraît certain que l'olivier existait depuis 5000 ans dans la région qui correspond à l’ancienne Perse et Mésopotamie, puis sa culture s’est étendue dans le "croissant fertile", aire englobant l'Egypte, la Syrie, la Palestine et la Phénicie (Di Giovacchino et al., 2002).
En Algérie, la culture de l'olivier remonte à la plus haute antiquité. En effet, l'huile d'olive faisait l'objet d'un commerce intense entre Algérie et Rome, durant l'époque romaine et constituait l'une des bases essentielles des activités économiques des populations rurales (Alloum, 1987).
I.1 L’oléiculture en Algérie
L'oléiculture est la première richesse arboricole de l'Algérie. C’est une source de subsistance pour de nombreuses familles. L’oliveraie occupe 45% du verger arboricole total et compte 32 millions d’arbres dont 80% sont destinés à la production d’huile d’olive (Mendil, 2009), estimée à 55.000-70.000 tonnes/an (Vossen, 2013).
Le potentiel oléicole est concentré dans les régions montagneuses principalement dans trois régions : le Centre nord, Tizi-Ouzou, Bouira et Bejaia avec 54,3 % de la surface totale, l’Est (Jijel, Guelma, Skikda, et Mila) avec 28,3 % et l’Ouest qui occupe à peine 17% (Tlemcen, Mascara). La plupart des oliveraies (80 %) est donc cultivée sur des terrains accidentés et marginaux, peu fertiles et caractérisés par une pluviométrie moyenne comprise entre 400 et 900 mm/an. Le reste est situé dans les plaines occidentales où la pluviométrie moyenne annuelle est de 300-400 mm (Vossen, 2013).La production d'huile d’olives est une activité traditionnelle en Algérie. L'activité compte près de 1650 huileries, dont seulement 165 huileries modernes (Vossen, 2013). Dans ce contexte, l’Algérie vise à moderniser le secteur
4
de l’huile d’olive afin d’améliorer la qualité et la quantité du produit à travers plusieurs programmes nationaux.
L’Algérie dispose de 150 cultivars d’olives représentés majoritairement par des arbres vieux, cultivés localement et utilisant des critères locaux pour leur appellation. Ces critères peuvent refléter des caractères morphologiques ou agronomiques, comme par exemple la période de maturation du fruit (exemple "Chetoui"; maturation tardive ou leur site d’origine (exemple "Chemlal" de Kabylie). Dans une étude récente, basée sur des données morphologiques et agronomiques, ont été reconnus seulement 36 cultivars (Mendil et Sebai, 2006).
I.2 .Extraction d'huile d'olive
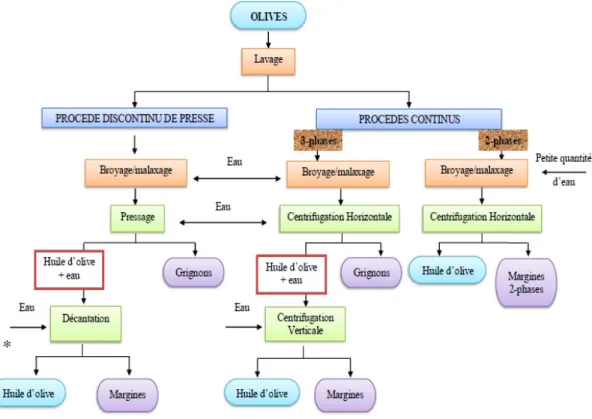
Après les opérations préliminaires de nettoyage et de lavage des olives, et de stockage pour et qui pour objectif de préparer les olives pour le traitement. Le traitement des olives en vue d'extraction de l'huile peut se faire par des moyens mécaniques par pression ou centrifugation. Il existe principalement deux procédés : un procédé discontinu et un procédé continu.(Figure I-01)
*
ChapitreI oléiculture
5 I.1.1 Procédés en discontinu ou système à presse
Le système de presse correspond à la production traditionnelle de l’huile d’olives selon un procédé discontinu, les étapes d'extractions sont :
Broyage : Il est réalisé par des meules en pierre de granit. Elles tournent dans un bac dont le sol est également en pierre. Les meules utilisées pour le broyage sont légèrement décentrées par rapport à l'axe de rotation, ce qui accentue la possibilité d'écrasement des olives.
Malaxage : Des raclettes ramènent en permanence la pâte sous les meules qui jouent alors le rôle de malaxeuses. La pâte est obtenue au bout d'une demi-heure environ.
Séparation des phases : La pâte est placée en couche de 2 cm d'épaisseur environ sur des disques en fibre de nylon (les scourtins), eux-mêmes empilés les uns sur les autres autour d'un pivot central (appelé aiguille) monté sur un petit chariot.
L'ensemble est placé sur un piston de presse hydraulique qui permet de faire subir à la pâte une pression de l'ordre de 100 kg/cm2. La phase liquide s'écoule dans un bac. Le grignon reste sur les scourtins. Cette opération dure environ 45 minutes. Ensuite chaque scourtin est débarrassé de son grignon en le tapant comme un tapis.
Décantation : l'huile ayant une densité inférieure à celle de l'eau (0,920 g/litre) remonte à la surface. Il s'agit de la décantation naturelle. Cependant cette méthode n'est presque plus utilisée, en raison de sa lenteur et de la difficulté pour bien séparer l'huile de l'eau dans la zone de limite entre les deux fluides. Ce sont des centrifugeuses verticales à assiettes qui permettent aujourd'hui de séparer l'huile d'olive des margines.
I.1.2 Procédés en continu ou système à centrifugation
Broyage : Il est réalisé par des broyeurs mécaniques à disques ou à marteaux. Ces broyeurs peuvent travailler en continu, la pâte étant obtenue presque instantanément.
Malaxage : La pâte est versée dans un bac en inox, dans lequel tourne une spirale ou une vis sans fin, également en inox.
Séparation des phases : La pâte malaxée est injectée par une pompe dans une centrifugeuse dont l'axe est horizontal. Cet appareil est appelé décanteur horizontal.
6
Décantation : On utilise des centrifugeuses verticales à assiettes qui permettent de séparer l'huile d'olive des margines.
I.2 Les sous-produits de la production d’huile d’olive
Les margines et les grignons d’olives représentent la masse restante considérée comme résidu de la trituration des olives.
I.2.1 Grignons ou tourteau
Les grignons sont les résidus solides issus de la première pression ou centrifugation et sont formés des pulpes et noyaux d’olives. On distingue quatre types de grignons (voir Tableau I.1) selon (Chiofali et al .,2004):
Tableau I. 1 : Les types de grignons et leurs caractéristiques (Chiofali et al.,2004)
Type de grignon Caractéristiques
Grignon brut C’est le résidu de la première extraction de l’huile.
Grignon épuisé Produit après une seconde extraction avec un solvant. Il est caractérisé par une faible teneur en huile et en eau.
Grignon partiellement dénoyauté
Produit après dénoyautage du grignon brut. Grignon épuisé partiellement
dénoyauté
Les grignons sont constitués essentiellement par la pulpe (mésocarpe) et contiennent encor une petite proportion de coques qui ne peuvent pas être séparés.
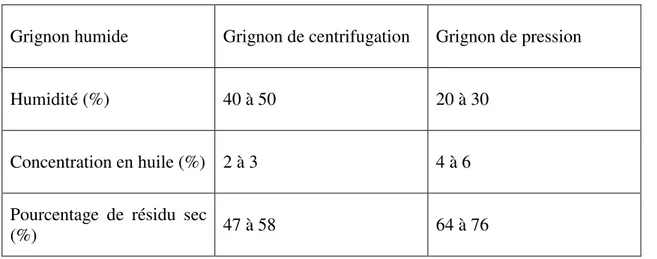
a. Composition chimique des grignons d’olive
Varie dans de très larges limites selon le stade de maturité des olives, le procédé d’extraction de l’huile et l’épuisement par les solvants. Le Tableau I.2 résume cette composition (Sebban et al ., 2004).
ChapitreI oléiculture
7
Grignon humide Grignon de centrifugation Grignon de pression
Humidité (%) 40 à 50 20 à 30
Concentration en huile (%) 2 à 3 4 à 6
Pourcentage de résidu sec
(%) 47 à 58 64 à 76
Tableau I. 3 : Composition du grignon épuisé séché (en % de matière sèche) (Sebban et al., 2004) Elements C N Cellulose p k Mg Ca % de matière sèche 51.67 1,06 39.75 0.095 0.59 0.083 0.14
b. Valorisation de grignons d’olive
D’après (Annibal et al ., 2003), les champs d’application des grignons sont nombreux et variés on peut citer :
Extraction de l’huile de grignons ; Utilisation comme combustible ; Utilisation de grignon comme engrais ;
Utilisation comme milieu de culture pour les levures ; Utilisation comme alimentation de bétails ;
Utilisation de la coque comme matière première pour la fabrication du furfural; Utilisé dans l’industrie du bois, ou pour le nettoyage de certaines surfaces
8 I.2.2 Margine
Sont de couleur rouge foncè à noire liqiude faiblement acides avec une conductivité elévée ,obtenus par la transformation mécaniques des olives durant la production d’huile d’olive (Kapellakis Et al.,2008). Sa couleur sombre depend de l’age et le type des olives transformés ainsi que la technologie utilisées (Yeşilada et al .,1999).
Dans le procédé à trois phases, des margines sont produites à diverses étapes ; après extraction et centrifugation horizontale de l’huile ; les margines produites, contenant encore des résidus d’huile et de grignons, sont soumises à une centrifugation verticale. L’huile obtenue est alors injectée à la centrifugation, avec l’huile issue de l’extraction, et les margines restantes sont évacuées (Ranalli et al., 2003).
Les margines réceptionnées (le sous-produit liquide de l’extraction d’huile) ont été stockées au frais (4°C) et à l’abri de la lumière afin d’éviter leur fermentation.
a. Caractérisation microbiologiques de la margine
Dans les margines, seuls quelques microorganismes arrivent àse développer. Ce sont essentiellement des levures et des moisissures. Dans la plupart des cas, il y a absence de bactéries pathogènes et ils ne posent alors aucun problème de point de vue sanitaire. (Ben Sassi et al., 2006).
Le pouvoir antimicrobien des margines est lies essentiellement à l’action exercée par les composés phénoliques et les bruns ou catéchol-mélaniques (Hamadi M. et Ellouz R., 2003).Ces influents agissent sur les bactéries en dénaturant les protéines cellulaires et en altérant les membranes (Renalli et al., 1991). Ils peuvent aussi inhiber également l’activité des bactéries symbiotiques fixatrices d’azote dans le tube digestif des ruminants en inhibant leur activité enzymatique (Hattenschuniler s. et Vitousek, 2000).
b. Caractéristiques physico-chimiques de la margine
La qualité et la quantité des margines dépendent de l’opération d’extraction d’huile d’olive. Elles sont aussi influencées par la variété d’olive, la saison des cueillettes, le taux de maturation des fruits et les conditions climatiques. Les composée fondamentaux des margines sont l’eau 83.2%, les substances organiques15% les substances minérales 1.8% (Leulmin, 2011).
ChapitreI oléiculture
9
Les margines contiennent des quantités significatives de sels minéraux, dont 80% sont solubles (phosphates, sulfates et chlorures) et 20% insolubles (carbonates et silicates). Les éléments les plus représentatifs sont le potassium (47%), les carbonates (21%), les phosphates (14%) et le sodium (7%) (COI, 2008).
Fraction organique
Les margines comportent deux fractions organiques : une fraction insoluble constituée essentiellement de pulpes d’olives qui représente la matière en suspension et colloïdale et une fraction soluble dans la phase aqueuse qui contient les sucres, les lipides, les composés azotés, les vitamines, les acides organiques et les composés phénoliques ( Fki et al., 2005).
Les glucides sont essentiellement représentés par les composants pariétaux, en particulier la cellulose et les pectines, ces dernières jouent un rôle important dans la texture des olives où ils représentent environ 0,6 % du poids de la pulpe fraîche. Récemment, de nombreux travaux ont montré que les margines sont très riches en sucres simples (Gomri, 2013).
Les sucres simples les plus fréquents dans les margines sont, en particulier, la raffinose, le saccharose, l’arabinose, la xylose, le glucose, le mannose, le fructose (Salvemini, 1985).
Les margines sont acides et extrêmement chargée en matières organiques qui contiennent essentiellement des sucres, des lipides, des acides organiques, des acides aminés, et des composés phénoliques. Le fruit d’olive est très riche en composés phénoliques mais seulement 2% du contenu total du fruit passe dans la phase liquide approximativement 53% et dans les grignons. (Djadoun, 2006).
La vitamine la plus abondante dans cet effluent est la vitamine de groupe D avec une concentration moyenne de 124 mg/Kg de margine (Aissam et al., 2002). Les margines sont caractérisées par un pH de 4.5 à 5.5 une conductivité de l’ordre de 10-6S/cm2 due principalement aux ions potassium (0.6 à 2 kg/m3), calcium (0.3 à 0.6kg/m3) et magnésium (0.05 à 0.3kg/m3) (Tableau I.4) (Boudissa, 2012).
10
Tableau I. 4 : Les principaux composants des margines (Nefzaoui, 1991).
Composants Pourcentage (%) Eau 83,4 Matières organiques (14,8%) - Matières grasses - Protéines - Glucides - Autres - Polyalcools
- Pectines, gommes, tanins - Glucosides 0,02 – 1 1,2 - 2,4 2,0 - 8,0 0,5 -1,5 1,0 - 1,5 0,5 -1,5 Traces Matières minérales (1,8%) - Carbonates - Phosphates - Sels potassiques - Sels sodiques - Autres 21 14 47 7 7
ChapitreII Oxydation des huiles et antioxydants
11 Chapitre II : Oxydation des huiles et les antioxydants
II.1.L’oxydation des lipides
Du fait de leur importance nutritionnelle, les acides gras insaturés sont des composants importants dans des nombreuses formulations alimentaires. Toutefois, ces acides gras sont sensibles à l’oxydation. La dégradation conduisant au rancissement hydrolytique sont la lipolyse enzymatique et l’hydrolyse des lipides. Elles sont caractérisées par une forte augmentation de l’acidité des produits altérés.
Le rancissement oxydatif ou hydrolytique des lipides, limite leur durée de conservation et les rend inaptes à la consommation alimentaire (Rahmani.M ,2007).
On distingue plusieurs types d’altérations : des altérations biologiques, chimiques et thermiques.
II.2.1.Altérations biologiques
Les huiles végétales sont peu altérées par les micro-organismes ; elles subissent surtout des changements physico-chimiques. Cependant, les germes lipolytiques peuvent parfois participer à des phénomènes d’hydrolyse et d’oxydation pourtant le contrôle microbiologique des huiles est rarement appliqué (Guiraud, 2003).
II.2.2. Altérations chimiques
Les huiles végétales sont peu altérées par les altérations chimiques ; comme l’acidification et l’oxydation, ils subissent des dégradations physico-chimiques. Les enzymes et l’o² c’est elles qui participe dans ce type d’altération (Guiraud, 2003).
II.2.2.1.Acidification
L’acidification résulte d’après (Servilli 2008) de l’hydrolyse d’un, deux ou trois liaisons esters. L’hydrolyse peut être de nature enzymatique (action des lipases) ou chimique et elle conduit à la formation d’acides gras libres et de glycérides partiels. Ce phénomène ne s’observe pratiquement jamais sur les huiles raffinées car les enzymes responsables sont éliminées au cours de raffinage, il peut cependant intervenir sur les huiles brutes et sur les huiles de friture (Aluyor et Orijeu, 2008). Les acides gras (AG) libérés sont préjudiciables à la qualité du corps gras, ils s’oxydent plus vite et donnent un goût désagréable.
12 II.2.2.2.L’oxydation
L'oxydation des lipides prend lieu quand l'oxygène atmosphérique réagit avec les acides gras insaturés des huiles .Cette réaction se déroule en utilisant un mécanisme radicalaire. Elle constitue, à cet effet, un des facteurs responsables de la détérioration des aliments complexes. L'oxydation des lipides est, de même, considérée comme l'une des réactions majeures correspondant à la dégradation de la qualité de l'huile durant la cuisson et la friture. Il s'agit d'un problème qui touche, principalement, les produits industriels. En effet, l'oxydation des lipides entraîne une diminution de la qualité organoleptique du produit non seulement par la formation d'odeurs rances mais également par la diminution de la qualité nutritionnelle. Cette dernière se manifeste à travers la formation de radicaux libres, d'hydrocarbures, d'aldéhydes, de cétones, d'acides, d'esters, de peroxydes. Ces éléments constituent, pour la plupart, des composés toxiques, voire, cancérigènes, favorisant le développement de certaines maladies telles que l'artériosclérose (Kahouli,2010 ).
L’oxydation des lipides, ou rancissement oxydatif des acides gras, est classiquement décomposée en trois étapes principales, initiation, propagation et terminaison, généralement décrites comme étant successives.
L’oxydation lipidique peut être, selon le milieu et les initiateurs mis en jeu, le résultat de plusieurs voies réactionnelles :
L’auto-oxydation, initiée par la température, les ions métalliques, ou les radicaux libres correspondants à des lipides déjà oxydés ;
La photo-oxydation, initiée par la lumière UV en présence de photosensibilisateurs ; L’oxydation enzymatique, catalysée par la lipoxygénase et la cyclooxygénase
(Dridi,2016).
a-L’Auto oxydation
Dans les aliments, l’auto-oxydation est le phénomène le plus important suivi par la photooxydation. L’auto-oxydation est une réaction en chaîne de radicaux libres se déroulant en trois étapes : initiation, propagation et terminaison (figure II.1).
Initiation : La première étape est la formation de radicaux libres à partir des lipides, ils sont produits par l’arrachement d’un proton de l’instauration des AG. La réaction peut être déclenchée par l’irradiation, la chaleur et très souvent par réaction avec un radical libre.
ChapitreII Oxydation des huiles et antioxydants
13
Propagation : c’est une réaction radicalaire en chaîne et rapide. Elle consiste en une profusion de radicaux libres qui progressivement fixent de l’oxygène. La propagation génère des hydroperoxydes (ROOH) (ALAIS et al., 2003). La réaction en chaîne est courte à haute température et dans les systèmes polyinsaturés tels que les huiles de friture.
Réaction d’arrêt: les radicaux libres s’associent donner des composés non radicalaires. (ALMI ,2010).
(RH : acide gras libre, R˙ : radical libre, ROO˙: radical peroxyle, ROOH : hydroxyperoxyde, RO˙ : radical alkoxyle, OH˙ : radical hydroxyl).
Figure II.1 : Mécanisme général des réactions d’oxydation des lipides (Alais et al. 2003).
14 b-Photo-oxydation
La photo-oxydation est une voie de peroxydation lipidique initiée par des substances photo-sensibilisatrices. La photo-oxydation correspond à la dégradation oxydative des lipides en présence d’oxygène, d’énergie lumineuse et de photosensibilisateurs .Dans les aliments, les photosensibilisateurs sont des molécules telles que les hémoprotéines, la riboflavine ou d’autres pigments .En présence d’un photo-sensibilisateur, l’énergie lumineuse convertit l’oxygène triplet (3O2) en oxygène singulet (1O2), qui peut réagir directement sur les doubles
liaisons insaturées des chaînes grasses .En effet, dans son état fondamental, la molécule d'oxygène sous son état triplet est stable et incapable de réagir avec les acides gras insaturés. Les photosensibilisateurs interviennent dans l’oxydation des lipides selon deux types de mécanismes .Selon le premier mécanisme, les molécules photosensibles réagissent dans leur état excité avec l’oxygène triplet auquel elles transfèrent leur énergie pour donner un oxygène singulet l’oxygène singulet est très réactif et peut attaquer les acides gras insaturés pour former les hydroperoxydes.
Dans un second mécanisme, la molécule photosensible dans son état excité agit comme les radicaux libres initiateurs et arrache un hydrogène de l'acide gras insaturé pour former un radical libre qui est capable de réagir avec la molécule d'oxygène dans son état fondamental (Dridi, 2016).
c-Oxydation enzymatique
L’oxydation des lipides se produit par voie enzymatique principalement par l’action de la lipoxygénase, la cyclooxygénase, la peroxydase et la polyphénol-oxydase. Cette oxydation se produit soit dans les tissus végétaux et animaux soit au niveau de la trituration des graines et des fruits ; soit dans l’huile (Dridi, 2016).
C’est une réaction radicalaire en chaîne qui se déroule de façon similaire à l’autooxydation. Les lipoxygénases (lipoxydases) sont très répandues dans les règnes végétal et animal. En général, ces enzymes exigent des AG libres comme substrat, bien qu’il y ait quelques isoenzymes qui réagissent avec les triglycérides. Ces enzymes sont actives à basse température et peuvent donc limiter la durée de conservation des produits surgelés. Ce type d’oxydation peut être ralenti par les antioxydants phénoliques (ALMI ,2010) .
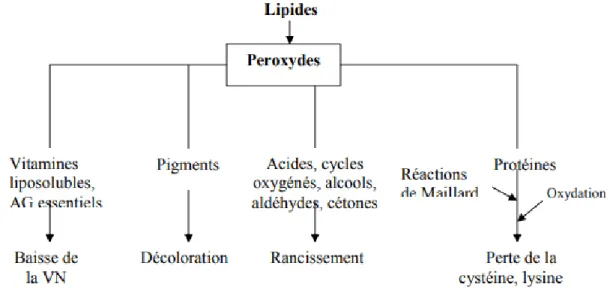
II.2.2. 3.Les conséquences des réactions d’altération des corps gras :
L’oxydation des lipides alimentaires entraîne des altérations qualitatives (rancissement), nutritionnelles (perte des vitamines liposolubles, acides gras essentiels (AGE)
ChapitreII Oxydation des huiles et antioxydants
15
voir même toxicité due aux produits issus de la peroxydation des lipides (figure). Les composés carbonyles peuvent réagir avec les protéines ou plus généralement favoriser le brunissement non enzymatique.
AG : Acides gras, VN : valeur nutritionnelle
Figure II.2: Conséquences de la peroxydation des lipides (Frenot et Vierling, 1997). II.3. Les antioxydants
II.3.1. Définition : Le mot « antioxydant » est utilisé, en général, pour n’importe quel agent chimique qui inhibe l’attaque par l’oxygène ou l’ozone (Scott G, 1965 et Halliwell 1995) a donné une définition large du terme antioxydant : « toute substance qui, présente à faible quantité comparée à celle du substrat oxydable, retarde ou prévient d’une manière significative l’oxydation de ce substrat». (Halliwell . 1995). Appliqués aux huiles végétales, les antioxydants sont des composés qui interrompent le processus d’oxydation en réagissant préférentiellement avec les radicaux libres pour former d’autres radicaux plus stables (Anonyme 2007).
II.3.2. Mécanisme d’action
D’une manière générale, un antioxydant peut empêcher l’oxydation d’un autre substrat en s’oxydant lui-même plus rapidement que celui-ci Un tel effet résulte d’une structure de donneurs d’atome d’hydrogène ou d’électrons souvent aromatiques cas de dérivés du phénol. En plus leurs radicaux intermédiaires sont relativement stables du fait de la délocalisation par résonance et par manque de positions appropriées pour être attaqué par l’oxygène moléculaire
16
Les antioxydants sont en fait des agents de prévention, ils bloquent l’initiation en complexant les catalyseurs, en réagissant avec l’oxygène, ou des agents de terminaison capables de dévier ou de piéger les radicaux libres, ils agissent en formant des produits finis non radicalaires. D’autres en interrompant la réaction en chaine de peroxydation, en réagissant rapidement avec un radical d’acide gras avant que celui-ci ne puissent réagir avec un nouvel acide gras. Tandis que d’autres antioxydants absorbent l’énergie excédentaire de l’oxygène singulet pour la transformer en chaleur. (Yaacoub, 2009 ; Hellal , 2011).
II.3.3. Utilisation des antioxydants
Dans l'industrie chimique : pour éviter le durcissement du caoutchouc ou en métallurgie pour protéger les métaux de l’oxydation.
Dans l'industrie agro-alimentaire : pour éviter le rancissement des corps gras.
Dans l'industrie teinturerie : pour éviter l'oxydation des colorants au soufre ou des colorants de cuve lors de la teinture.(Bouhadjra .2011).
II.3.4. Classification des antioxydants
Les antioxygènes sont classés dans trois catégories différentes : Les antioxydants synthétiques;
Les substances synergiques;
Les antioxydants d’origine végétale ( Bouhadjra 2011).
II.3.4.1. Antioxydants de synthèses
Les antioxydants de synthèse sont introduits dans toutes les formulations contenant des corps gras insaturés et parfois aussi dans des phases aqueuses où se trouvent des extraits végétaux riches en oxydases. Leur concentration d'utilisation est généralement dix fois plus faible que celle des conservateurs et se situe entre 0,02 et 0,05 %. Ce sont :
le butylhydroxytoluène (BHT) ; le butylhydroxyanisole (BHA) ;
les gallates de propyle, octyle et de dodécyle. II.3.4.2. Substances synergiques
Ce sont des molécules qui améliorent l’action de certains antioxydants. Ce qui se traduit souvent par un accroissement de la période de protection, parmi eux se trouvent : Les acides lactique, tartrique et ortho phosphorique et leurs sels de sodium, potassium ou calcium. Leurs propriétés peuvent s'expliquer par un effet chélatant de métaux comme le fer ou le cuivre, dont on connaît bien l'effet pro-oxydant à faible dose. Cependant, ce n'est peut-être pas
ChapitreII Oxydation des huiles et antioxydants
17
la seule explication, car plusieurs de ces produits sont d'assez mauvais chélatants. (Bouhadjra .2011)
II.3.4.3. Antioxydants d’origine végétale
Les plantes constituent des sources très importantes d’antioxydants. Les antioxydants naturels dont l’efficacité est la plus reconnue aussi bien dans l’industrie agroalimentaire que pour la santé humaine sont : les tocophérols, les caroténoïdes et les polyphénols.(Bouhadjra .2011)
A- Tocophérols (vitamine E)
Les vitamines sont des substances organiques, sans valeur énergétique propre, qui sont nécessaires à l’organisme et que l’homme ne peut synthétiser en quantité suffisante .Elle doivent donc être fournies par l’alimentation. Parmi elles, on distingue la vitamine E qui est une vitamine liposoluble de formule brute C29H50O2 et de masse molaire 430g.
Vitamine E est le terme générique utilisé pour désigner les différents tocophérols qui se distinguent entre eux par le nombre et la situation des groupements méthyles fixés sur le noyau aromatique (Chekroun.2013)
Leurs Principales sources : les huiles végétales (tournesol, pépin de raisin, maïs, ...), les légumes et fruits frais (amande, noisette, fenouil, mûre, avocat, épinard, …), les aliments d’origine animale (crevette grise cuite...)( Chekroun .2013).
B- Les caroténoïdes
Sont des pigments fabriqués par les végétaux. Les plus importants sont le bêta-carotène, l’alpha-bêta-carotène, la lutéine, la zéaxanthine et le lycopène. Ce sont eux qui donnent aux fruits et légumes des couleurs orange, rouge et jaune. Leur fonction essentielle est de protéger les plantes. La plupart des caroténoïdes ont une propriété antioxydante Comme ils le font pour les plantes, ils ont des effets bénéfiques sur notre santé. Ce sont d'excellents piégeurs d'espèces radicalaires particulièrement vis-à-vis de la lipoperoxydation des phospholipides membranaires grâce à leurs structures.
18
Figure II.3: Deux exemples des structures des caroténoïdes
Les caroténoïdes sont des substances polyéniques caractérisées par un système de doubles liaisons conjuguées. Le nombre de doubles liaisons conjuguées varie de 7 à 15 (Boubekri ).
II.4. Les polyphénols
Les composés phénoliques ou les polyphénols sont des métabolites secondaires largement répandues dans le règne végétal étant trouvé dans tous les fruits et les légumes. Ces composés sont présents dans toutes les parties des plantes mais avec une répartition quantitative qui varient entre les différents tissus. Plus de 8000 structures ont été identifiées (Rinalli ,1991) allant de simples molécules comme les acides phénoliques à des substances hautement polymérisées comme les tanins (Hamadi et Ellouz,1993) Ils sont synthétisés par l’ensemble des végétaux et ils participent aux réactions de défense face à différents stress biotiques (agents pathogènes, blessures, symbiose) ou abiotiques (lumière, rayonnements UV, faible température, carences). Les polyphénols contribuent à la qualité organoleptique des aliments issus des végétaux (couleur, astringence, arôme, amertume) (RaL’élément structural fondamental qui les caractérise est la présence d’au moins un noyau phénolique à 6 carbones (Figure II.4), auquel est directement lié au moins un groupe hydroxyle (OH) libre ou engagé dans une autre fonction : éther, ester ou hétéroside. (Chérifa BOUBEKRI ).
ChapitreII Oxydation des huiles et antioxydants
19
Figure II.4: Structure du noyau phénol (Sarni-Manchado et Cheynier ,2006)
II.4.1. Classification des polyphénols
La classification des polyphénols est basée essentiellement sur la structure, le nombre de noyaux aromatiques et les éléments structuraux qui lient ces noyaux. On peut distinguer deux catégories : les composés phénoliques simples et les composés phénoliques complexes
II.4.1.1. Polyphénols simples
a- Acides phénoliques
Ce sont des composés organiques possédant au moins une fonction carboxylique et un hydroxyle phénolique. Ils sont représentés par deux sous-classes : les dérivés de l’acide hydroxybenzoïque et de l’acide hydroxycinnamique (De Marco et al.,2007).
b- Dérivés de l’acide hydroxybenzoïque (C6-C1)
Ces acides sont très communs aussi bien sous forme libre que sous forme combinée à l’état d’esters ou hétérosides [11, 14]. Cette catégorie est abondante dans les végétaux et les aliments, notamment les épices, les fraises, certains fruits rouges et l'oignon dans lesquels les concentrations peuvent atteindre plusieurs dizaines de milligrammes par kilogramme de fruits frais (De Marco et al., 2007).
c- Dérivés de l’acide hydroxycinnamique (C6-C3)
Ces composés ont une distribution très large. Rarement libres, ils sont souvent estérifiés [14] et peuvent également être amidifiés ou combinés avec des sucres (O-acylglucosides, Oarylglucosides) ou des polyols tels que l’acide quinique (De Marco et al.,2007).
20 d- Flavonoïdes
Les flavonoïdes sont des composés possédant un squelette de base à quinze atomes de carbone, constitués de deux noyaux aromatiques et d'un hétérocycle central de type pyrane, formant une structure C6-C3-C6 (Figure II.5) (Arouma et al . ,2003).Ce sont les composés les plus abondants parmi tous les composés phénoliques. Ils interviennent dans la pigmentation des fleurs et dans les processus de défense contre le rayonnement UV, les herbivores et les attaques microbiennes (Ghedira ,2005). Les flavonoïdes sont présents dans une grande variété d'aliments (fruits et légumes, céréales, jus de fruits, thé et vin...).
Figure II.5: Squelette de base des flavonoïdes (Arouma et al . ,2003).
e - Alcools phénoliques
Un alcool phénolique est un composé organique possédant au moins un alcool aliphatique et un hydroxyle phénolique. Le tyrosol (4-hydroxyphenylethanol) et hydroxytyrosol (3,4 dihydroxyphenylethanol) (Fig. 9) sont les principales molécules de cette classe. Ces composés sont très abondants dans l’olive (fruit et feuille), libres ou associés à l’acide élénolique
.
ChapitreII Oxydation des huiles et antioxydants
21 II.4.2. Polyphénols complexes (tanins)
Les tanins représentent une classe très importante de polyphénols localisés dans les vacuoles [39]. Historiquement, le terme « tanin » regroupe des composés polyphénoliques caractérisés par leurs propriétés de combinaison aux protéines, d’où leur capacité à tanner le cuir. Sur le plan structural, les tanins sont divisés en deux groupes, tanins hydrolysables et tanins condensés (BOUBEKRI).
a-Tanins hydrolysables : ce sont des esters du D-glucose et de l’acide gallique ou de ses dérivés, en particulier l’acide ellagique (Figure II.7) .Ces substances est facilement hydrolysables par voie chimique ou enzymatique (tannase) (Monties ,1980).
b- Tannins condensés : les tannins condensés ou les proanthocyanidines sont des polymères constitués d’unités flavane reliées par des liaisons entre les carbones C4 et C8 ou C4 et C6.
Figure II.7: Structure chimique (a) d’un tanin condensé (proanthocyanidine) et (b) d’un gallotanin (1, 2,3-tri-O-galloyl-β-D-glucose).
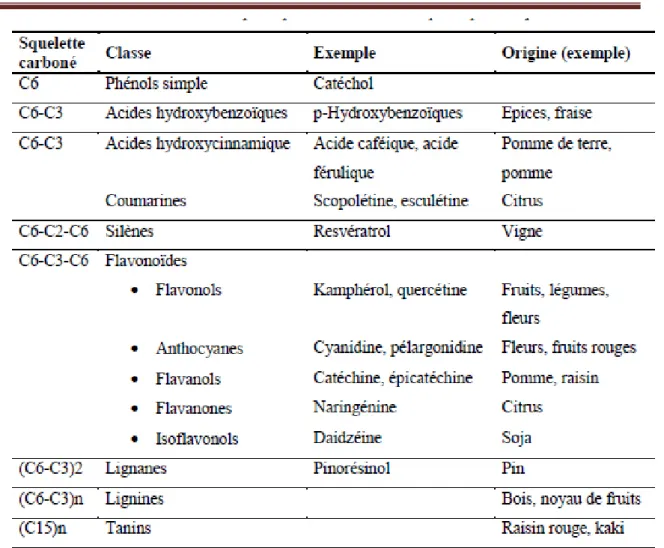
(voir le tableau II.1) qui s’inspire du Macheix et al. Regroupent les principales classes des composés phénoliques.
22
Tableau II.1: Les principales classes des composés phénoliques.( Macheix et al.,)
II.5. Biosynthèse des composés phénoliques
Les CP sont des produits du métabolisme secondaire des plantes. Ils sont synthétisés à partir de deux voies biosynthétiques qui sont d’après ( Bravo et al., 1994) et (Visioli et al., 2000) :
Celle de l’acide shikimique, qui conduit après transamination et désamination aux acides cinnamiques et à leurs nombreux dérivés tels que les acides benzoïques ou les phénols simples ;
Celle issue de l’acétate, qui conduit à des poly ß-coesters (polyacétates) de longueur variable menant par cyclisation à des composés polycycliques.
ChapitreIII Matériel et méthodes
23
III.1. Extractions des polyphénols à partir de la margine
Les margines ont été prélevées à partir d’une unité de trituration moderne dans la région de Bouira et conservées dans un réfrigérateur à 4°C, pour éviter l’auto-oxydation et la polymérisation ultérieure des composés phénoliques, qui donnent lieu à des margines sombres, qui ne sont pas facilement biodégradables (Assas et al. 2002).
Pour extraire les polyphénols, 50 ml de margines ont été filtrées par un papier filtre standard (porosité de 10 à 20 µm) et à partir desquels 10ml ont été dilués dans 50 ml d’hexane dans une ampoule à décanter à trois reprises. L’extraction des polyphénols a été réalisée en ajoutant 60 ml du méthanol : eau (60% :40%) (Oumrhar, 2008). L’ensemble a été décanté dans un ballon à col rodé de 250 ml et mis en évaporation à l’aide d’un rotavapeur à la vitesse 4 et à 60°C. Les polyphénols ont ensuite été concentrés et repris par 10ml du méthanol à 1%. Le rendement des margines en polyphénols est de (2,12 ± 1,10) g de polyphénols /10 ml de margines.
III.2. L’huile végétale utilisée
L’huile utilisée pour le test de la stabilité oxydative, est une huile commerciale de marque Elio, caractérisée par sa richesse en alpha-tocophérol (Vit E). Tous les échantillons sont incorporée des margine brute (margine séché à l’aide de l’étuve pour réduire la quantité d’eau), une quantité de 25g de marine est incorporée à 500ml de l’huile , depuis solution mère on a prit 25 ; 50 ; 100 ml et chaque quantité est été rajouté par 1 Litre de l’huile végétal.
Ces échantillons qui ont subit une friture de cinq fois, sont mis dans des tubes à essai propres et secs muni d’un bouchon. Une étiquette est collée sur chaque tube, indiquant combien de fois l’huile est utilisée dans la friture.
III.3. Caractérisation physicochimiques des margines
III.3.1. Détermination du taux d’humidité (NF T 60-305, JUIN 1976)
L’humidité est mesurée par la méthode de séchage à l’étuve ; 5g d’échantillon sont séchés à l’étuve à 105°C jusqu’à obtention d’une masse constante. La différence entre le poids avant et après séchage exprime la teneur en eau de l’échantillon initial.
24 Où:
H% : humidité +matières volatiles.
M1 : masses des capsules + matière fraîche avant séchage en g. M2 : masse de l’ensemble après séchage.
P : masse de la prise d’essai en g.
III.3.2. Détermination de la teneur en cendres (NF V 05-113,1972)
Dans une capsule on met 5g de la margine (M1), puis on les calcines dans un four à moufle à 550± 5c° pendant 7 heures jusqu’ à obtention d’une couleur grise, claire ou blanchâtre, après le refroidissement on pèse la masse (M2).
Expression des résultats :
Soit :
MO% : matière organique.
M1 : masse des capsules + prise d’essai. M2 : masse des capsules +cendres. P : masse de la prise d’essai.
La teneur en cendres (cd) est calculée comme suit :
Cd : teneur en cendres.
MO% : matière organique.
H(%)=((M1-M2) /p)* 100
Matière sèche : 100 -(H%)
MO%=((M1-M2)/p) * 100
ChapitreIII Matériel et méthodes
25 III.3.3. Détermination de pH (NF V 05 -108,1970)
Le pH (potentiel hydrogène) mesure la concentration des ions H+ de l'eau. Il traduit ainsi la balance entre acide et base sur une échelle de 0 à 14, 07 étant le pH de neutralité. ce paramètre caractérise un grand nombre d'équilibre physico chimique et dépend de facteurs multiple.
Le pH doit être impérativement mesuré sur le terrain à l'aide d'un pH-mètre. III.3.4. Détermination de la conductivité : (RODIER.1984)
La conductivité mesure la capacité de l'eau à conduire le courant entre deux électrodes. La plupart des matières dissoutes dans l'eau se trouvent sous forme d'ions chargés électriquement. La mesure de la conductivité permet doc d'apprécier la quantité de sel dissous
dans l'eau.Ce paramètre doit être impérativement mesuré sur le terrain. L’unité de
conductivité utilisée en chimie des eaux est le microsiemens µS/cm.
III.3.5. Détermination de l matière en suspension(MES) :(RODIER 1996)
Dépôt d’un volume connu de boues sur une capsule puis mise à l’étuve à 105. On calcul MES après pesée.
La teneur en matière en suspension est déterminée par la différence de poids du filtre avant (PF) et après filtration et séchage (PS) à l’étuve à 105c.
Soit
MES : matière en suspension(%). PF : poids du filtre avant séchage. PS : poids de filtre après séchage.
III.3.6. Détermination de la turbidité : ISO7027 :1999
La mesure de la turbidité permet de préciser les informations visuelles sue l'eau. la turbidité traduit la présence de particules en suspension dans l'eau(argile, débris organiques, organismes microscopiques...).
A l’aide d’un turbidimètre on mesure la turbidité, l'unité en FTU.
26
III.3.7. Demande biochimique en oxygène(DBO5)
A l’aide des fioles jaugées de volume de 157 et 428ml on mesure le volume de la margine, puis on le verse dans des flacons de l'appareil OxiTop .
Dans certains flacons on introduit l’inhibiteur puis on met le godet à soude dans le goulot du flacon et dans chaque flacon on met 02 à 03 pastilles de soude dans le godet avec une pince. (L’oxydation des matières organiques provoque la formation de CO2 qui sera piégé par une solution de KOH) (Attention : les pastilles de soude ne doivent jamais être en contact avec l’échantillon).
L’adjonction de thiosinamine (N-allyl-thiourée) permet de bloquer la nitrification car l’oxydation des dérivés ammoniacaux et des nitrites en nitrates absorbe également de l’oxygène et ce phénomène parasite la mesure. Cette amine joue un rôle d’inhibiteur.
Puis on ferme hermétiquement le flacon avec l’OxiTop. Commencer la mesure et mettre les flacons avec OxiTop dans l’incubateur pendant 05 jours. Pendant 05 jours l’échantillon est agité en continu. L’OxiTop enregistre automatiquement une valeur toutes les 24h pendant 05 jours. Pour connaitre la valeur actuelle presser la touche M. Apres 05 jours lire les valeurs mémorisées : presser la touche S. Convertir les valeurs affichées (digits) en valeur DBO.
III.4. Détermination de la teneur polyphénols totaux
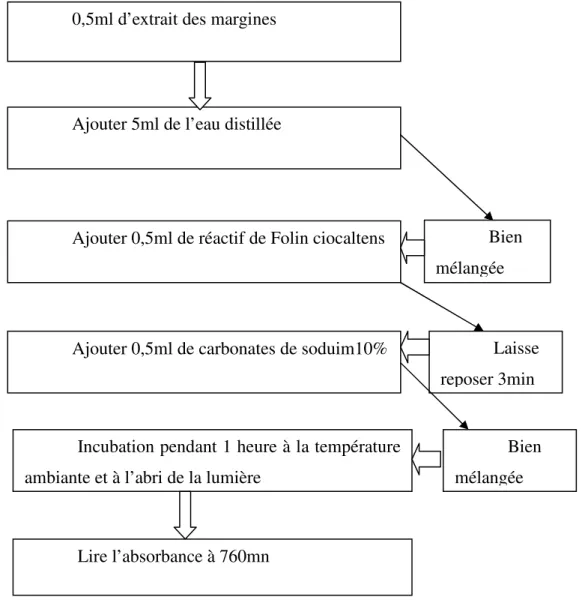
Le dosage des polyphénols totaux a été déterminé par spectrophotométrie, selon la méthode colorimétrique utilisant le réactif de Folin-Ciocalteu . Ce dosage est basé sur la quantification de la concentration totale de groupements hydroxyles présents dans l’extrait.
Le protocole utilisé est basé sur celui décrit par (Singleton et Ross, 1965) en y apportant quelques modifications. Brièvement, dans des tubes à hémolyse en verre, un volume de 500 µl de l'extrait de la margine a été ajouté, avec un mélange de 1 ml de réactif Folin-Ciocalteu dilué 10 fois, et 0.5 ml d’une solution de carbonate de sodium à 10 %. Les tubes sont agités et conservés pendant 60 min. L’absorbance est lue à 760 nm.
Une courbe d’étalonnage a été réalisée en parallèle dans les mêmes conditions opératoires en utilisant l’acide gallique à différentes concentrations (0 à 1000 µg/ml).
ChapitreIII Matériel et méthodes
27
Figure III.1 : organigramme représentant dosage des polyphénols totaux.
III.5. Dosage des flavonoïdes
Principe selon (Ayoola et al. ,2008)
L’échantillon de la teneur en flavonoïdes totaux continus dans les extraits éthanoïques de la margine est réalisé par la méthode décrite dans la littérature. (Bahorum et al) Les flavonoïdes possèdent un groupement hydroxyle (oH), en position 5 qui est susceptible de donner avec le groupement Co, un complexe coloré avec le chlolorure d’aluminium.
0,5ml d’extrait des margines
Ajouter 5ml de l’eau distillée
Bien mélangée Ajouter 0,5ml de réactif de Folin ciocaltens
Laisse reposer 3min Ajouter 0,5ml de carbonates de soduim10%
Bien mélangée Incubation pendant 1 heure à la température
ambiante et à l’abri de la lumière
28
Ils forment des complexes jaunâtres par chélation des métaux (fer et aluminium). Ceci traduit le fait que le métal (Al) perd deux électrons pour s’unir à deux atomes d’oxygène de la molécule phénoliques agissant comme donneur d’électrons.
Mode opératoire :
On prépare trois tubes à essais, dans chaque tube on met 2ml de l’extrait phénolique, puis on ajoute 2ml de chlorure d’aluminium 2%, après on laisse à l’obscurité pendant dix minutes .l’absorbance est lue à 430nm.
Préparation des solutions de la quercitine pour la réalisation de la courbe standard des flavonoïdes.
Figure III.2 : organigramme représentant le dosage des flavonoïdes dans l’extrait de la margine.
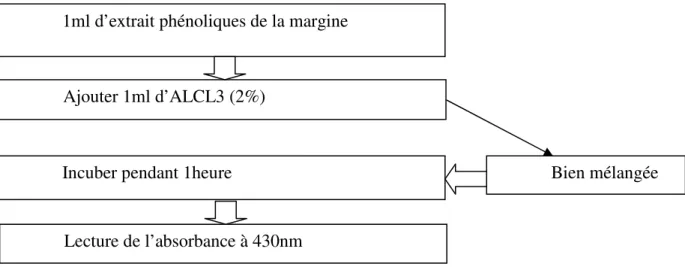
III.6. Le pouvoir réducteur Principe
La méthode décrite par (Chew et al. 2009) est adoptée pour déterminer le FRP des extraits phénoliques. Ce test est utilisé pour tester la capacité des antioxydants à réduire les ions Fe3+ en Fe2+ impliquant le mécanisme de transfert des électrons.
1ml d’extrait phénoliques de la margine
Ajouter 1ml d’ALCL3 (2%)
Incuber pendant 1heure
Lecture de l’absorbance à 430nm
ChapitreIII Matériel et méthodes
29 Mode opératoire
On prépare 1 ml d’extrait phénolique additionné à 2,5 ml de tampon phosphate (0,2 M ; pH 6,6) et 2,5 ml ferricyanure de potassium K3 [Fe (CN) 6] à 1% ,après incubation à 50°C pendant 20 min, 2,5 ml d’acide trichloracétique à 10 % sont ajoutés au mélange puis, centrifugé pendant 10 min à 2600 tours/min. 2,5 ml du surnageant sont mélangés à 2,5 ml d’eau distillée et 0,5 ml de chlorure ferrique (FeCl3) à 0,1 %. L’absorbance est mesurée à 700 nm après 10 min de réaction.
La quantité d’antioxydants ayant un pouvoir réducteur est déterminée d’une courbe d’étalonnage réalisée avec vitamine C. Les résultats sont exprimés en mg d’EVC/Kg.
30
Figure III.3 : diagramme de détermination de pouvoir réducteur des margines. 2,5ml de l’extrait phénolique
Ajouter 2,5ml de la solution tampon (pH=6,6)
Ajouter 2,5ml de potassium ferricyanure (1%)
Bien mélangée et incubation à 50c°/20min
Ajouter 2,5ml de l’acide trichloracétique (10%)
Centrifugation pendant 10minà 5000tour/min
Mesure l’absorbance à 700nm
On prend 5ml de l’extrait +5ml de l’eau distillé +1ml de l’acide ferrichloridrique
ChapitreIII Matériel et méthodes
31 III.7. La capacité antiradiculaire
Principe
Le 1,1-diphenyl -2-picryl-hydrazyl(DPPH) est défini comme radical libre stable par vertu de la délocalisation de l’électron disponible qui provoque la couleur violette profonde, caractérisée par une absorption. Il réagit avec des groupements amines, les phénols, les acides, les composés hydro-aromatiques, etc. … cette propriété largement recommandée et utilisé dans la pratique analytiques.
Quand la solution de DPPH est mélangée à celle d’une substance qui peut donner un atome d’hydrogène ou un électron , alors ceci provoque la forme réduite (1,1diphenyl1-2-(2, 4,6- trinittrophenyl)hydrazine (DPPH2) avec la perte de la couleur violette et apparition d’une couleur jaune pale résiduelle due à la présence de groupement picryl selon la réaction suivante (Molyneux .P ,2004 )
Figure III.4 : réduction de radical libre DPPH en DPPH (Molyneux.P ,2004). Mode opératoire :
a-Préparation de DPPH
on dissous 0,038g de DPPH dans 100 ml de la solution éthanol-méthanol à proportion 1/ 1 , sous l'agitation jusqu'à la dissociation totale de DPPH.