Mémoire
Présenté parHAMRI KHADIDJA
KHALDI NOUR EL HOUDA
Pour l’obtention du diplôme de
MASTER
Filière : Génie des ProcédésSpécialité : Génie Chimique
Soutenue publiquement le 18/12/2019 Devant le Jury composé de :
Mme HAMMACHE F. M.C.B. Université de Bouira Présidente
Mme ZAABAR A. M.C.A. Université de Bouira Examinatrice
Mme TALBI O. M.A.A. Université de Bouira Examinatrice
Mr MOUNI L. PROFESSEUR. Université de Bouira Promoteur
Mme BOUCHELKIA N. D. LGVRNAQ,Université de Bouira Co-promotrice
Valorisation des noyaux de jujube en vue de leur
utilisation dans la préparation de charbons actifs :
application a l’élimination d’un colorant cationique
REMERCIEMENT
Le plus grand merci revient à DIEU qui lui seul nous a guidé
dans le bon sens durant notre vie
et nous a aidé à réaliser ce travail.
Nous exprimons notre plus profonde gratitude à Mr le
professeur Mouni Lotfi et M
meBouchelkia Nasma qui nous ont
encadrés et orientés. Nous les remercions pour tous leurs
conseils, leur esprit critique et soutien tout le long de la
réalisation de ce modeste travail.
Nos vifs remerciements vont également aux membres du jury qui
ont accepté d’examiner notre travail et de l’enrichir par leurs
propositions.
Grand merci aux membres du laboratoire de recherche
LGVRNAQ pour leurs encouragements.
Enfin, nous tenons également à remercier toutes les personnes
qui ont participé de près ou de loin à la réalisation de ce travail.
Dédicace
C’est grâce à Dieu, le tout puissant et avec beaucoup d’effort et d’abnégation que j’ai pu terminer mes études. Je dédie du fond du mon cœur ce modeste travail : A ma mère, qui a œuvré pour ma réussite, de par son amour,
son soutien, ses sacrifices consentis et ses précieux conseils, pour toute son assistance et sa présence dans ma vie, reçois à
travers ce manuscrit, l’expression de mes sentiments les plus sincères et une éternelle gratitude.
A mon père, qui peut être fier de voir le résultat des longues années de sacrifices et de privations, pour l’aide qu’il m’a apporté pour avancer dans la vie. Puisse Dieu faire en sorte
que ce travail porte son fruit. Merci pour les valeurs nobles, pour l’éducation que tu m’a inculpé et pour ton soutient
permanent.
A mon frère Youcef et sa femme Hasina.
A mes sœurs Meriem et son mari ahmed, Akila et son mari Kamel et son fils Adem et Inass.
A mon oncle laid et son fils Brahim.
A ma binôme Nour el houda et mes amies et toutes ma familles.
Je vous remercie tous et toutes.
Dédicace
Je tiens à dédier ce modeste travail avant tout, à la lumière de ma vie, la source de mon bonheur et le guide de mon chemin; Ma mère qui m’a vraiment soutenu; tout au long de
mon existence.
Mon père qui était toujours a mes cotés dans les moments difficiles Mes chères sœurs: Souhila et Imane
Mes chers frères : Bilal ; Walid ; Islem et Dahmane Mon binôme : Khadidja
Mes très chères amies: Nawal et khadidja Et enfin à tous ceux que j’aime et qui m’aime
SOMMAIRE
Introduction générale 1 Partie théorique
Chapitre I : Généralités sur les colorants
I.1.Introduction 3
I.2.Définition 3
I.3.Classification des colorants textiles 4
I.3.1.Classification chimique 4
I.3.2.Classification tinctoriale 6
I.4.Utilisations des colorants. 8
I.5.Toxicité et impact environnemental 8
I.6. Traitements des colorants 9
I.6.1.Traitement biologique 9
I.6.2.Méthodes chimiques 9
I.6.3.Méthodes physico-chimiques : coagulation-floculation 9
I.6.4.Méthodes physiques 10
I.6.4.1.Filtration sur membrane 10
I.6.4.2. Adsorption 10
Chapitre II : Généralités sur l’adsorption
II.1.Introduction. 11
II.2.Types d’adsorption. 11
II.3.Mécanisme d’adsorption. 12
II.4.Facteurs influençant d’adsorption. 12
II.5.Isothermes d’adsorption. 13
II.5.1.Classification des isothermes d’adsorption 14 II.5.2.Modélisation des isothermes d’adsorption 15
II.5.2.1.Le modèle de Langmuir 15
II.5.2.2.Le modèle de Freundlich 17
II.6.La cinétique d’adsorption 18
II.6.2.Modèle de la cinétique du pseudo second ordre 19
II.7.Les différents types d’adsorbants 19
II.7.1.Gels de silice 19
II.7.2.Alumines activées 20
II.7.3.Adsorbants à base de polymères 20
II.7.4.Argiles activés (ou terre décolorantes) 20
II.7.5.Charbons actifs 20
Chapitre III : Généralités sur le charbon actif
III.1.Définition 21
III.2.Origine du charbon actif 21
III.3.Les types de charbon actif 21
III.4. Préparation du charbon actif 22
III.5. Structure et propriétés superficielles du charbon actif. 22 III.6. Domaines d’utilisation des charbons actifs. 24
III.7.Le charbon actif a partir du jujube 25
III.8.Méthodes de caractérisation du charbon actif 25 III.8.1.Analyses par Diffraction des rayons X 25
III.8.2.Analyses par spectroscopie IR 25
III.8.3.Détermination du pH charge point zéro: (pHpzc) 26 III.8.4.Dosage des groupements chimiques:(méthode de BOEHM) 26 III.8.5.Détermination de l’indice de bleu de méthylène 26 III.8.6.Détermination de l’indice d’iode 27
Partie expérimentale
Chapitre IV. Caractérisation et préparation des charbons actifs
IV.1.Introduction 28
IV.2.Préparation de la matière première 28
IV.4.Préparation de charbon actif. 28
IV.4.Méthodes de caractérisation des charbons actifs préparés 29
IV.4.1. Taux d’humidité: (MC) 29
IV.4.2.Teneur en cendres: (AC) 29
IV.4.3.Pourcentage de matières volatiles: (VC) 30
IV.4.5.Dosage des groupements chimiques: (méthode de BOEHM) 30
IV.4.6.Détermination de l’indice d’iode. 30
IV.4.7.Détermination de l’indice de bleu de méthylène et la surface accessible au BM
30
IV.4.8.Détermination du pH de point de charge nulle (pHpzc) 32 IV.5.Effet de la pureté de l’acide phosphorique sur les caractéristiques de charbons actifs préparés
32
IV.6.Effet de ma température de carbonisation 34
Chapitre V : Adsorption du bleu méthylène sur charbon actif
V.1.Introduction 39
V.2.Colorant utilisés 39
V.3.Préparation de solution mère de colorant BM 40 V.4.Influence de quelques paramètres sur la capacité d’adsorption du
BM.
41
V.4.1. Effet de la concentration initiale du BM et du temps de contact 42
V.4.2.Effet de la masse du charbon actif 43
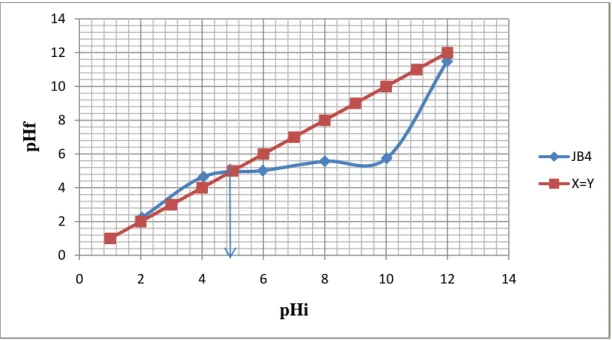
V.4.3.Effet du pH de la solution sur adsorption 44
V.4.4.Effet de la taille de particule. 45
V.4.5. Effet de la température 45
V.5.La modélisation de la cinétique d’adsorption 46
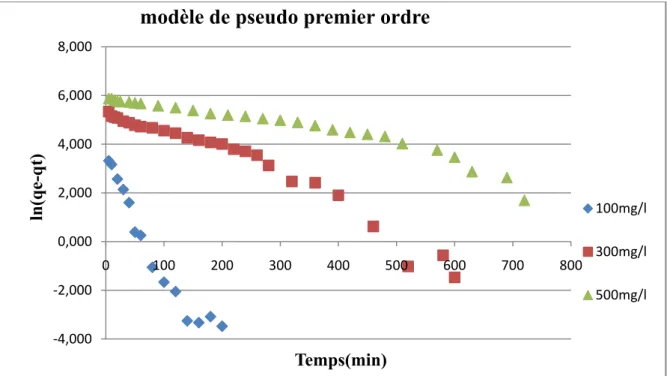
V.5.1.Le modèle pseudo 1er ordre 46
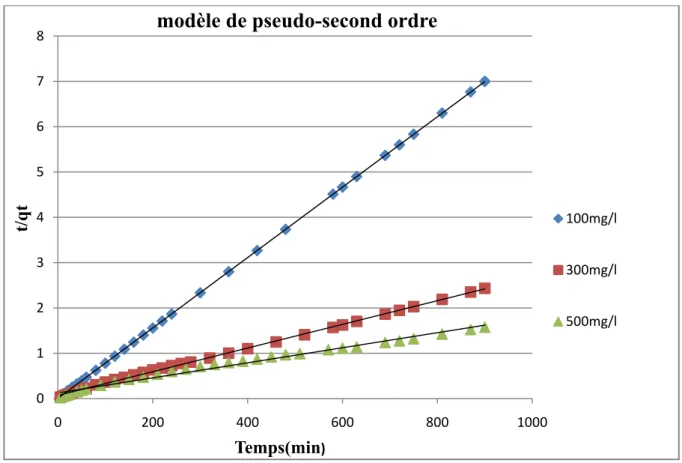
V.5.2.Le modèle pseudo 2eme ordre 48
V.6.Isothermes d’adsorption du Bleu méthylène 49
V.6.1.L’isotherme de Langmuir 50
V.6.2.L’isotherme de Freundlich 52
Conclusion générale 54
Références bibliographiques Résumé
Liste des figures
Figures
Pages
Figure II.1: Le mécanisme d’adsorption. 12 Figure II.2: Types des isothermes d’adsorption. 15 Figure III.1:Une feuille de graphène. 23
Figure III.2:Représentation schématique des microstructures du charbon actif. 23
Figure III.3: Représentation schématique des différents types de pores. 23
Figure IV.1: Différentes parties du fruit du Zizyphus lotus. 28
Figure IV.2: Détermination du pH charge nulle de charbon JB85/4. 36
Figure IV.3: Digramme de diffraction de rayons x du charbon actif JB85/4. 37
Figure IV.4: Spectre infrarouge du charbon actif préparé JB85/4. 37 Figure V.1:Structure moléculaire du Bleu de Méthylène. 39
Figure V.2 : la courbe d’étalonnage du BM. 41
Figure V.3: Effet du temps de contact et de la concentration sur l’adsorption. 42
Figure V.4: Effet de la masse des charbons actifs sur l’adsorption du BM sur le
JB85/4.
43
Figure V.5: Effet de pH de la solution sur l’adsorption du BM sur le JB85/4. 44
Figure V.6 : Effet de la taille de particule sur l’adsorption du BM sur le JB85/4. 45
Figure V.7 : Effet de la température sur l’adsorption du BM sur le JB85/4. 46
Figure V.8 : Représentation graphique du modèle de pseudo 1er ordre. 47
Figure V.9 : Représentation graphique du modèle de pseudo-second ordre. 48
Figure V.10: Adsorption isotherme du BM sur le JB85/4. 49
Figure V.11: Application du modèle de Langmuir-1 à l’adsorption du BM sur le
JB85/4.
50
Figure V.12: Application du modèle de Langmuir-2 à l’adsorption du BM sur le
JB85/4.
50
Figure V.13 : Application du modèle de Langmuir-3 à l’adsorption du BM sur le
JB85/4.
51
Figure V.14 : Application du modèle de Langmuir-4 à l’adsorption du BM sur le
JB85/4
51
Figure V.15 : Application du modèle de Langmuir-5 à l’adsorption du BM sur le
JB85/4.
Liste des figures
Figure V.16: application du modèle de Freundlich pour la modélisation des
isothermesdu BM sur le JB85/4.
Liste des tableaux
Tableau pages
Tableau I.1 : Principaux groupes chromophores et auxochromes, classés par
intensité
4
Tableau I.2 Classification chimique des colorants. 4
Tableau I.3 Caractéristiques et propriétés générales des colorants insolubles
dans l‘eau.
7
Tableau II.1 : Les différentes formes de l’équation de Langmuir 17
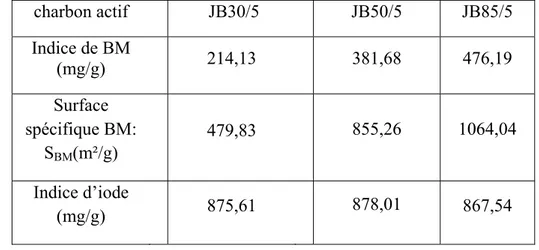
Tableau IV.1 : Analyse approximative des trois charbons actifs préparés. 32
Tableau IV.2 : Effet de la pureté de l’acide phosphorique sur les
caractéristiques de charbons actifs préparés.
33
Tableau IV.3 : Analyse de Boehm des trois charbons actifs 33
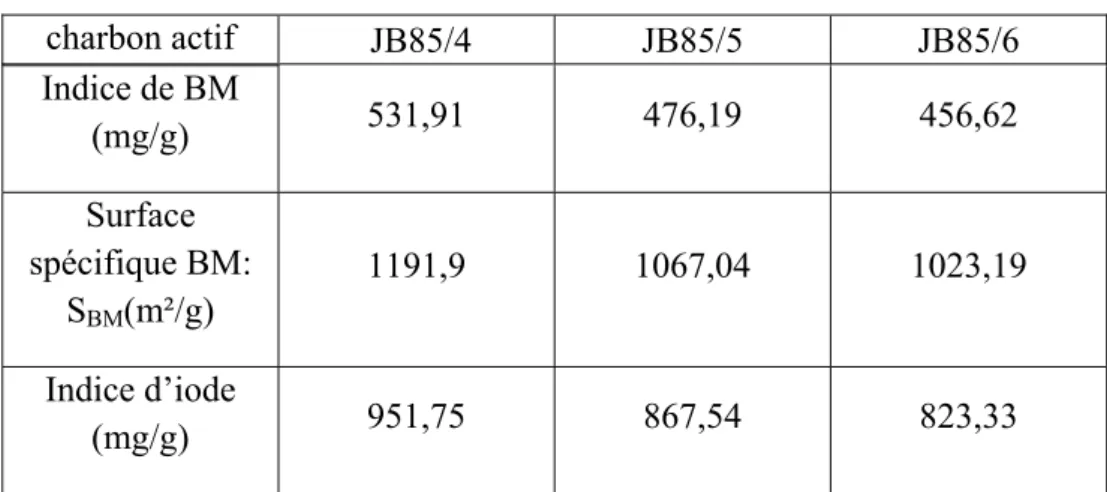
Tableau IV.4 : Effet de la température de carbonisation. 34
Tableau IV.5 : Analyse approximative de trois charbons actifs préparés. 34
Tableau IV.6 : Analyse de Boehm des trois charbons actifs. 35
Tableau V.1 : Paramètres cinétiques pour l’adsorption de BM sur le JP85/4
aux diverses concentrations (Modèle de 1er ordre)
47
Tableau V.2: Paramètres cinétiques pour l’adsorption de BM Sur le
charbons actifs aux diverses concentrations (modèle de pseudo second ordre). 49
Tableau V.3: Résultats de la modélisation des isothermes d’adsorption du
BM sur le JB85/4 par le modèle Langmuir.
52
Tableau V.4 : Résultats de la modélisation des isothermes d’adsorption du
BM sur le JB85/4 par le modèle Freundlich.
Liste des abréviations
Abréviation Définition BM Bleu méthylène. CA Charbon actif. DRX Diffraction de Rayon X. JB Jujubier. pH Potentiel d’hydrogène.pHpzc Potentiel d’hydrogène au point de charge zéro. IR Spectroscopie infrarouge.
Introduction générale
1
Introduction générale :
Les rejets industriels contenant des produits toxiques sont devenus très préoccupants ce qui a provoqué une large prise de conscience et conduit les législations à une plus grande sévérité au regard des limites tolérées [1]. Malgré l’amélioration continue des procédés ou des comportements humains, les techniques de traitement des pollutions inéluctables se heurtent encore à des difficultés.
Parmi les effluents aqueux, ceux contenant des colorants. Une fois dissouts dans l’eau, les colorants seront parfois difficiles à traiter de fait que la grande majorité d’entre eux ont une origine synthétique et une structure moléculaire complexe, ce qui les rend plus stables et difficiles à être biodégradables [2].
Le bleu de méthylène est le colorant le plus couramment utilisé dans la teinture du coton, du bois et de la soie. Il peut provoquer des brulures oculaires responsables de blessures permanentes aux yeux de l’homme et des animaux, son inhalation peut donner lieu à des difficultés respiratoires et son ingestion par la bouche produit une sensation de brulure et provoque des nausées, des vomissements, transpiration et sueurs froides abondantes. Le traitement des rejets industriels contenant ce type de colorant s’avère d’un grand intérêt. Une large variété de techniques physiques, chimiques et biologiques a été développée et testée dans le traitement des effluents chargés en colorants. Cependant, ces procèdes sont couteux et conduisent à la génération de grandes quantités de boues ou à la formation de dérivés [3-4]. L’application de la technique d’adsorption pour le traitement des colorants est très ancienne et reste la technique la plus répandue vue les avantages qu’elle présente par rapport aux autres techniques. Le charbon actif est l’adsorbant le plus utilisé en raison de sa grande capacité d’adsorption des matériaux organiques. Toutefois, les charbons actifs commerciaux ont un cout élevé. La recherche d’un autre adsorbant efficace et moins couteux s’avère donc intéressante. Dans cette optique, beaucoup de chercheurs ont montré un grand intérêt pour les adsorbants préparés à base de matériaux naturels ou de déchets industriels ou agricoles comme : les noyaux de jujube.
L’objectif de ce travail est d’étudier les performances des charbons actifs préparés à partir d’une biomasse locale; les noyaux de jujube et son application dans l’élimination par adsorption du bleu de méthylène.
Introduction générale
1- la synthèse bibliographique subdivisée en trois principaux chapitres portant dans Le 1er chapitre des généralités sur les colorants. Le deuxième chapitre décrit le phénomène d’adsorption et le dernier traitre le charbon actif.
2- La deuxième grande partie, nommée étude expérimentale, dans laquelle sont présentés les résultats relatifs à la préparation et la caractérisation du charbon actif et aux essais d’adsorption du bleu de méthylène sur le charbon actif.
Enfin le manuscrit se termine pour une conclusion générale relatant les principaux résultats de cette étude.
Partie
Chapitre I:
Généralités sur les
colorants
Chapitre I Généralités sur les colorants
3
I.1. Introduction
Les colorants constituent un groupe très diversifié de composés ayant en commun la propriété de colorer d’une manière permanente les tissus, cuirs ou papiers. Tous ces colorants sont des composés organiques insaturés et aromatiques dont les électrons très délocalisés peuvent absorber la lumière pour certaines longueurs d’ondes [5].Les propriétés colorantes des composés organiques dépendent de leur structure et de leur composition chimique [6].
Les colorants rejetés par les industries textiles et les officines de nettoyage des vêtements, sont peu ou pas biodégradables et résistent bien aux traitements classiques d’épuration. Ils créent surtout une nuisance visuelle dans les eaux contaminées bien qu’un certain nombre d’entre eux est mutagène et cancérogène [7].
I.2. Définition
Un colorant est défini comme étant un produit capable de teindre une substance d’une manière durable. Il possède des groupements qui lui confèrent la couleur: appelés chromophores et des groupements qui permettent sa fixation: auxochromes [8].Ce sont des composés organiques comportant dans leurs molécules trois parties essentielles: le chromophore, l’auxochrome et la matrice [9]. Le site actif du colorant est le chromophore, il peut se résumer à la localisation spatiale des atomes absorbant l’énergie lumineuse. Le chromophore est constitué de groupes d’atomes dont les plus classiques sont le nitro (–NO2), le diazo(-N=N-), le nitroso (-N=O), le
thiocarboxyl (-C=S), le carboxyl (-C=O), ainsi que les alcènes (-C=C-).L’absorption des ondes électromagnétiques par le chromophore est due à l’excitation des électrons d’une molécule [9]. La molécule qui les contient devient chromogène [7]. La molécule chromogène n’a des possibilités tinctoriales que par l’adjonction d’autres groupements d’atomes appelés «auxochrome» [7]. Ces groupes auxochromes permettent la fixation des colorants et peuvent modifier la couleur du colorant. Ils peuvent être acides (COOH, SO2, OH) ou basiques (NH2, NHR, NR2). Le reste des
Chapitre I Généralités sur les colorants
Tableau I.1 : Principaux groupes chromophores et auxochromes, classés par intensité [10].
Groupe chromophores Groupe auxochromes
Groupe donneurs d’electrons
Azo(-N=N-) Amino (-NH2)
Nitroso(-N=O) Méthylamino(-NHCH3)
Carbonyle(C=O) Dimèhlamino(-N(CH3)2)
Vinyle(-C=CH2)ou méthine(>C=) Hydroxyle(-OH)
Nitro(-NO2) Alkoxy(-OR)
Thiocarbonyle(> c=s)
I.3. Classification des colorants textiles
Les principes de classification les plus couramment rencontrés dans les industries textiles, sont basés sur les structures chimiques des colorants synthétiques et sur les méthodes d’application aux différents substrats (textiles, papier, cuir, matières plastiques, etc...) [11].
I .3.1. Classification chimique
La classification chimique des colorants est résumée dans le tableau I.2 suivant
:[12-13]
Tableau I.2 Classification chimique des colorants.
Colorants Caractérisation et propriétés générales
Azoïque Présence au sein de la molécule d’un groupement azoïque (-N=N-) reliant deux noyaux benzénique
-on distingue les mono-azoïques. et les poly-azoïques suivant le nombre de chromophores azo rencontrés dans la molécule. -représentent plus 50%de la proudection mondiale des colorants et le plus important sur le plan de l’application ;
-se repartissent en colorant basique, acides , directs et réactif solubles dans l’eau , et les azoïques dispersé et à mordant non –
Chapitre I Généralités sur les colorants
5 ioniques insolubles dans l’eau ;
-toxiques, cancérogènes et récalcitrants aux traitements biologiques.
Antraquinoniques -formes générale dérivée de l’anthracène, le chromophore est un noyau quinonique sur lequel peuvent s’attaches des groupe hydroxyles ou amino ;
-présentent le groupe chomophore carbonyle> C=0 sur un noyau quinonique qui est le chromophore ;
-utilisés pour la coloration des fibres polyester, acétate de cellulose;
-présentent une stabilité à lumière et aux agents chimique. Indigoïdes -forme génitale dérivée de l’indigo ;
-utilisés comme additifs en produits pharmaceutique, la confiserie ,ainsi que dans des diagnostiques médicales et dans l’industrie de textile ;
-résistance remarquable au de lavage.
Triphénylméthane -Hydrocarbures possédant trois cycles phényle lies à un carbone central ;
-utilises intensivement dans les industries papetières et textiles pour teindre le nylon, la laine, la soie et le coton .
Phtalocyanines -structure complexe basée sur l’atome central de cuivre ;
-employés dans l’industrie de pigmente pour peinture et dans la teinture des fibre textiles.
Xanthénes -Intense fluorescence ;
-marqueurs lors d’accidente maritimes ou traceurs d’écoulement pour des rivières souterraines ;
Utilisés comme colorants alimentaires, cosmétique, textiles et impression
Nitrés et nitrosés Présence d’un groupe nitro (-NO2) en position ortho par rapport
à un groupement électrodonneure (hydroxyle ou groupes aminés) ;
Chapitre I Généralités sur les colorants
I.3.2. Classification tinctoriale
Si la classification chimique présente un intérêt pour le fabricant de matières colorantes, le teinturier préfère le classement par domaines d’application. Ainsi, il est renseigné sur la solubilité du colorant dans le bain de teinture, son affinité pour les diverses fibres et sur la nature de la fixation [14].
. On distingue différentes catégories tinctoriales définies par les auxochromes [8].
I.3.2.1. Colorants solubles dans l’eau a. Colorants acides ou anioniques
Ils sont solubles dans l’eau grâce à leurs groupes sulfonâtes NaSO3- ou carboxylates
NaCOO- Ils sont ainsi dénommés parce qu’ils permettent de teindre les fibres animales (laine et soie) et quelques fibres acryliques modifiées (nylon, polyamide) en bain légèrement acide.
b. Colorants basiques ou cationiques
Sont des sels d’amines organiques, ce qui leur confère une bonne solubilité dans l’eau. Les liaisons se font entre les sites cationiques des colorants et les sites anioniques des fibres.
c. Colorants réactifs
Leur appellation est liée à la présence d’une fonction chimique réactive, assurant la formation d’une liaison covalente forte avec les fibres [15].
I.3.2.2. Colorants insolubles dans l’eau
Le tableau I.3 résume les différents types de colorants insolubles dans l’eau avec leurs propriétés, mode d’application et domaines d’utilisation [16].
Chapitre I Généralités sur les colorants
7
Tableau I.3 : Caractéristiques et propriétés générales des colorants insolubles dans
l‘eau.
Colorant Caractéristiques et propriétés générales Colorants de
cuve
-les colorants de cuve appartiennent à la classe chimique des anthraquinones à celée de indigoïdes.
-En milieu alcalin, ils se transforment par réduction en leuco-dérives incolores ou blancs et solubles dans l’eau
-Ils sont utilisés pour l’application de l’indigo qui nécessite la préparation d’une cuve de bonne résistance aux agents de dégradation
-le leuco –dérivé présente une affinité pour certaines fibres textiles telles que le coton .le lin, la laine et la soie
Colorants disperse
-les colorants disperses sont des colorants non ioniques pratiquement insolubles dans l’eau
-Des colorants dispersés sont appliqués sur des fibres
hydrophobes synthétiques sous forme d’une poudre dispersée dans le bain de teinture.
-Ces colorants ont été développes à l’origine pour la teinture de l’acétate de cellulose mais maintenant ils sont utilisés pour teindre le nylon, le tr acétate de cellulose et les fibres acryliques -Ils sont caractérisés par une cinétique lente du processus de teinture ce qui oblige à opérer à haute température et à haute pression
Colorants à mordant
-La fibre est d’abord traitée avec un sel d’aluminium de chrome et de fer puis mise en contact avec un colorant formant un lac
(dérivés azoïques et anthraquinoniques).
-l’interaction avec la fibre s’établit par liaison entre les groupes anioniques métallique est les cations d’ammonium disponible sur la fibre.
-le précipite très résistance à la lumière et au lavage.
-ces colorants sont habituellement utilisés pour la teinture de coton ,de laine ou d’autres fibres protéiques.
Chapitre I Généralités sur les colorants
I.4. Utilisations des colorants
Les colorants présentent de nombreuses applications dans différents domaines, dont voici quelques-unes essentielles :
- Teinture et impression sur fibre et tissus de tous genres ; - Teinture du bain de filage des fibres chimiques ;
- Teinture du cuir et des fourrures ; - Teinture du papier et du parchemin ;
- Teinture des caoutchoucs, des feuilles et des matières plastiques ; - Colorants pour toutes les techniques de la peinture ;
- Préparation des couleurs à la chaux pour les pré-colorations et enduits sur bâtiments; - Colorants pour l’impression des papiers peints ;
- Préparation des encres ;
- Colorations des denrées alimentaires ;
- Colorants pour les emplois médicinaux et cosmétiques [17-18-19].
I.5. Toxicité et impact environnemental
I.5.1. Toxicité sur la santé humaine
Cette toxicité est due à certaines capacités de ces colorants qui peuvent: Etre mutagènes.
Etre Génotoxiques.
Entraîner des cancers de la thyroïde.
Entraîner des tumeurs des glandes surrénales. Contenir des substances cancérigènes.
Avoir des actions sur le système nerveux central. Inhibition ou déficit de certaines enzymes
Augmentation de la perméabilité intestinale [20].
I.5.2. Toxicité des milieux aquatiques par les rejets industriels
-Les algues peuvent être inhibées par les rejets d'effluents dans les industries textiles. Ces résultats ont été obtenus lors des prélèvements effectués sur la cote Est des U.S.A
[21].
-Un certain nombre de colorants présente un caractère toxique sur le milieu aquatique provoquant la destruction directe des communautés aquatiques [22].
-le bleu de méthylène est toxique pour les algues et les petits crustacés à partir des concentrations de 0,1 mg/l et 2 mg/l respectivement [23].
Chapitre I Généralités sur les colorants
9 -La fuchsine, inhibe la croissance des algues et des petits crustacés pour des concentrations minimales de 1mg/l et 20mg/l respectivement [24].
I.6. Traitements des colorants
L’élimination des colorants dans les eaux résiduaires de l’industrie textile se base sur l’utilisation des méthodes de traitement suivantes :
I.6.1. Traitement biologiques
Basé sur les micro-organismes en milieu aérobie (présence d'oxygène) ou anaérobie (absence d'oxygène), le traitement biologique est une méthode qui pourrait être nécessaire à la dégradation des composés organiques synthétiques tels que les colorants. Ce procédé peut conduire soit à une biodégradation totale avec formation de CO2 et de H2O, soit à une biodégradation incomplète, pouvant aboutir à un
composé ayant une structure différente du parent produit. Cependant, les colorants synthétiques utilisés dans le textile se sont avérés résistants à la biodégradation [25].
I.6.2. Méthodes chimiques
Dans la littérature, les techniques d’oxydation chimiques sont généralement appliquées pour le traitement des composés organiques dangereux présents en faibles concentrations, en prétraitement avant des procédés biologiques, pour le traitement d’eaux usées chargées de constituants résistants aux méthodes de biodégradation et en post traitement pour réduire la toxicité aquatique. Les oxydants les plus utilisés sont l’ozone, le chlore, l’air et le permanganate de potassium. Leur action est très dépendante du pH et de la présence de catalyseur [26].
I.6.3. Méthodes physico-chimiques Coagulation-floculation
le but de ce procédé est de se débarrasser des matières en suspension (MES) et les particules colloïdales. Il implique le plus souvent la dispersion d’un ou de plusieurs produits chimiques qui déstabilisent les particules colloïdales et mène à la formation de micro-flocs. Le pontage de ces micros-flocs, grâce à l’ajout d’un adjuvant de floculation, forme des flocons plus denses et volumineux, et surtout plus facilement séparables. Une simple décantation ou une étape de flottation permet ensuite l’élimination des flocs formés [27].
Chapitre I Généralités sur les colorants
I.6.4. Méthodes physiques
I.6.4.1. Filtration sur membranes
La filtration sur membrane pilotée par pression hydraulique se décline en microfiltration, ultrafiltration, nanofiltration et osmose inverse. L’effluent passe à travers une membrane semi- perméable qui retient en amont les contaminants de taille supérieure au diamètre de pores, pour produire un perméat purifié et un concentré qui reçoit les impuretés organiques [28].
I.6.4.2. Adsorption
L’adsorption est un procédé d’élimination des polluants organiques ou minéraux présents dans des effluents aussi bien liquide que gazeux. Plusieurs modèles théoriques ont été élaborées pour décrire les mécanismes de ces phénomènes. Par ce procédé, le polluant est transféré de la phase fluide vers la surface du solide [29].
Chapitre II:
Généralités sur
l’adsorption
Chapitre II Généralités sur l’adsorption
II.1. Introduction
L’adsorption est un phénomène physique ou chimique se traduisant en particulier par une modification de la concentration à l’interface de deux phases (liquide ou gazeuse/ solide) due à la fixation des molécules (ou atomes) de la phase liquide ou gazeuse sur une surface solide.
Le procédé d'adsorption est l’une des méthodes les plus largement utilisées pour l'élimination des polluants. Simple, peu coûteux (par rapport à d'autres procédés de séparation), et sans formation de boue, ce procédé fournit une alternative intéressante pour le traitement des eaux contaminées, en particulier si l'agent d’adsorption est bon marché et ne nécessite pas d'étapes de prétraitement supplémentaires avant son application [30].
Nous distinguons deux types d’adsorption : physique et chimique [31].
II.2.Type d’adsorption
II.2.1. Adsorption physique (Physisorption)
C'est une adsorption qui se produit lorsque les forces qui fixent l’adsorbat dans une couche à la surface de l'adsorbant sont du même ordre que les forces de Van der Waals. Ce type d'adsorption se caractérise par :
La rapidité dans l'établissement de l'équilibre entre la phase adsorbée et la phase fluide Une réversibilité relativement facile et une absence de spécificité [32].
II.2.2. Adsorption chimique (Chimisorption)
C'est une adsorption de type chimique, qui résulte des forces de liaison de nature chimique (nettement supérieures aux forces de Van der Waals) avec mise en commun ou transfert d'électrons; il y a donc des ruptures et des créations de liaisons chimiques en surface entre l’adsorbat et les sites actifs de l'adsorbant.
La chimisorption se caractérise par :
Un équilibre long à atteindre entre la phase adsorbée et le milieu fluide
Une chaleur dégagée durant l'adsorption environ 10 fois plus importante à celle dégagée dans le cas d'adsorption physique.
La non-réversibilité.
Chapitre II Généralités sur l’adsorption
12
II.3. Mécanisme d'adsorption
L’adsorption peut se faire en trois étapes différentes (Figure.1)
Diffusion externe: elle correspond au transfert du soluté (molécules de la phase liquide ou gazeuse) au sein de la solution à la surface externe de l’adsorbant. Le transfert de matière dépend de l’écoulement du liquide sur la surface de l’adsorbant
Diffusion interne : les molécules de liquide pénètrent à l’intérieur des pores. La diffusion dépend du gradient de concentration du soluté.
Diffusion de surface : elle correspond à la fixation des particules à la surface des pores de l’adsorbant [33].
Figure II.1: Le mécanisme d’adsorption [34].
II.4. Facteurs influençant le phénomène d’adsorption
Plusieurs paramètres influent sur l’adsorption, parmi lesquels: la température, la nature de l’adsorbat et de l’adsorbant.
La température
La quantité adsorbée à l’équilibre augmente quant la température diminue, de plus, l’adsorption libère une chaleur d’adsorption comme toute réaction exothermique, elle est donc favorisée par les basses températures.
Chapitre II Généralités sur l’adsorption
La surface spécifique
La surface spécifique est une mesure essentielle de la capacité d’adsorption de l’adsorbant. Elle désigne la surface accessible rapportée à l’unité de poids d’adsorbant. Une surface spécifique est d’autant plus grande, si l’adsorbant est plus fin.
La polarité
ddd. L’adsorption est meilleure pour les corps qui ont relativement plus d’affinité pour le soluté que pour le solvant [35-31].
La structure de l’adsorbant
L’adsorption d’une substance croit avec la diminution de la taille des particules et avec les dimensions des pores de l’adsorbant. Si le diamètre des pores est inférieur au diamètre des molécules, l’adsorption de ce composé sera négative, même si la surface de l’adsorbant a une grande affinité pour le composé. La distribution des tailles des pores joue un rôle important dans la cinétique globale du processus d’adsorption
Le pH
Le pH est un paramètre déterminant dans le processus d’adsorption, la détermination du pH isoélectrique permet de choisir l’intervalle de pH favorisant l’adsorption de l’adsorbat en question.
La masse de l’adsorbant
La capacité d’adsorption est d’autant plus grande que la masse de l’adsorbant dans la solution est importante. Du fait du coût élevé des adsorbants, le choix d’un rapport liquide solide optimal est recommandé [36].
II.5. Les isothermes d'adsorption
Le processus d’adsorption peut être décrit à l’aide d’une isotherme d’adsorption. Une telle isotherme est une courbe qui représente la relation entre la quantité de soluté adsorbée par unité de masse d’adsorbant qe et la concentration de soluté en solution Ce.
On obtient une telle courbe à partir des résultats d’essais de laboratoire effectués à une température constante. Pour ce faire, on introduit des quantités connues d’adsorbant dans des volumes d’eau à
Chapitre II Généralités sur l’adsorption
14
traiter et, après un temps de contact donné, on mesure la concentration résiduelle de soluté en solution [37]. La quantité de soluté adsorbé est calculée à l’aide de l’équation:
q =
.=
(II.1)Où : C0 : concentration initiale de soluté (mg/L).
Ce : concentration de soluté à l'équilibre (mg/L).
: quantité de soluté adsorbé à l'équilibre par unité de poids de l'adsorbant (mg/g). X : quantité de soluté adsorbé à l'équilibre (mg); X = (c -c ).V.
m : masse d’adsorbant (g). V : volume de la solution (L).
II.5.1. Classification des isothermes d’adsorption
L’allure de la courbe d’isotherme varie selon le couple adsorbat-adsorbant étudié. Les isothermes d’adsorption ont été classées par Giles et al [38].en quatre principales classes: S (Sigmoïde),
L (Langmuir), H (Haute affinité) et C (partition Constante).
II.5.1.1. Les courbes de type S : Les isothermes de cette classe présentent, à faible concentration,
une concavité tournée vers le haut. Elles décrivent la plupart du temps une adsorption coopérative, dans laquelle l'interaction adsorbat-adsorbat est plus forte que celle entre adsorbant et adsorbat.
II.5.1.2. Les isothermes de type L (dite Langmuir) : Ces isothermes sont les plus fréquentes, les
isothermes de cette classe présentent, aux faibles concentrations de la solution, une concavité tournée vers le bas qui traduit une diminution des sites libres au fur et à mesure de la progression de l'adsorption. Ce phénomène se produit lorsque les forces d'attraction entre les molécules adsorbées sont faibles.
II.5.1.3. Les isothermes de type H (haute affinité) : Elles décrivent une interaction forte entre
adsorbat et adsorbant et représentent un cas extrême de la classe L, où la pente à l'origine est très élevée. Ce cas a été distingué pour représenter le cas où le composé possède une grande affinité pour la phase solide
Chapitre II Généralités sur l’adsorption
II.5.1.4. Les isothermes de type C : sont sous forme de ligne droite, La linéarité montre que le
nombre de sites libres reste constant au cours de l'adsorption [36]. Ceci signifie que les sites sont créés au cours de l'adsorption. Ce qui implique que les isothermes de cette classe sont obtenues quand les molécules de soluté sont capables de modifier la texture du substrat en ouvrant des pores qui n'avaient pas été ouverts préalablement par le solvant.
Figure II.2: Types des isothermes d’adsorption.
II.5.2. Modélisation des isothermes d’adsorption
Plusieurs modèles ont été développés afin d’interpréter les différents phénomènes d’adsorption sur les surfaces des solides. Parmi ces modèles, nous distinguons :
II 5.2.1. Le modèle de Langmuir
Ce modèle est basé sur les trois hypothèses suivantes:
Seule une couche monomoléculaire se forme sur le solide,
L’adsorption s’effectue sur des sites bien définit uniformément distribués sur la surface du solide, chaque site ne peut recevoir qu’une molécule de soluté,
Tous les sites sont thermodynamiquement identiques et il n’ya pas d’interactions entre les particules adsorbées [40].
Chapitre II Généralités sur l’adsorption
16
qe =
.. .(II.2)
qe : quantité de soluté adsorbé à l’équilibre par gramme de solide (mg/g)
∶ quantité maximale de soluté par gramme de solide nécessaire pour obtenir une monocouche (mg/g).
b: constante de Langmuir relative à la capacité et à la vitesse d’adsorption (L/mg). Ce: concentration du soluté dans la solution à l’équilibre (mg/L)
La linéarisation de l’équation de Langmuir permet de déduire la capacité maximale et la constante de Langmuir b.
La possibilité d’un processus d’adsorption peut se définir à partir du facteur de séparation adimensionnel, noté RL, donné par la relation :
R
L= (II.3)Où C0 est la concentration initiale en adsorbat (mg/L).
Si RL> 1 : les conditions du processus d’adsorption sont défavorables.
Si 0<RL< 1: les conditions du processus d’adsorption sont favorables.
Si RL=0: L’adsorption est irréversible.
Selon Hamdaoui et al. [41]. La linéarisation de l’équation de Langmuir donne lieu à cinq différentes formes (Tableau 1):
Chapitre II Généralités sur l’adsorption
Tableau II.1 : Les différentes formes de l’équation de Langmuir [41].
Equation Tracé Langmuir-1 Langmuir-2 Langmuir-3 Langmuir-4 Langmuir-5 =
. . le tracé de vs. permet de déterminer b et
q
= .ce+ . le tracé de vs.ce permet de déterminer b et q
qe= . +q le tracé de qe vs permet de déterminer b et q
=-bq +bb le tracé vs .q permet de déterminer b etq
=-bq + -b le tracé de vs . permet de déterminer b et q
II.5.2.2. Modèle de Freundlich
Le modelé de Freundlich est un modèle semi empirique qui permet de modéliser des isothermes d’adsorption sur des surfaces hétérogènes (dont les sites d’adsorption ne sont pas tous équivalents). L’expression mathématique associée à ce modèle est donnée par l’équation (II.3) [42].
q = K
f.
Ce
/(II.4)
Où :
: La quantité (mg) du soluté adsorbée par gramme (g) de solide. Ce : la concentration du soluté à l’équilibre (mg/l).
n et Kf : des constantes de Freundlich caractéristiques de l’efficacité d’un adsorbant donné vis-à-vis
Chapitre II Généralités sur l’adsorption
18
adsorbant/adsorbat, elles sont obtenues graphiquement en traçant log (qe) en fonction de log (Ce) selon l’équation (II.4).
Log q = 1/n log Ce + log K
f (II.5)Selon la valeur de 1/n, on distingue les différents cas suivants : 1/n=1 l’isotherme est linéaire de type C.
1/n >1 l’isotherme est convexe de type S.
1/n<1 l’isotherme est concave de type L. (ou de type H pour des valeurs plus faibles, H est un cas extrême du type L).
II.6. Cinétique d’adsorption
L’étude de la cinétique d’adsorption repose sur la détermination des concentrations des substances étudiées dans une phase liquide en fonction du temps. Elle informe sur le mécanisme d’adsorption et sur le mode de transfert des solutés de la phase liquide à la phase solide. Plusieurs modèles cinétiques ont été développés afin de mettre en évidence les paramètres intrinsèques des cinétiques d'adsorption. L'adsorption peut être modélisée en utilisant les équations du pseudo premier ordre (équation de Lagergren [1898] et du pseudo-second ordre (équation Ho et McKay 1998) [43].
II.6.1. Cinétique du pseudo premier ordre (équation de Lagergren)
C’est le plus ancien des modèles cinétiques, il a été proposé par Lagergren en 1898 [44]. Ce système peut être décrit par l’équation suite:
=k (q -q )
(II.6)La linéarisation de l’équation de pseudo-premier ordre donne l’équation suivant :
Ln (q -q ) =Ln q
k t
(II.7)Avec : k1 : Constante de vitesse du premier ordre en
t : Temps de contact en min ;
Chapitre II Généralités sur l’adsorption
: Quantité de colorant adsorbée par unité de masse d’adsorbant à l’instant t en mg/g
Les valeurs de k1 et peuvent être calculées en portant graphiquement ln ( - ) en fonction de t.
II.6.2. Cinétique du second ordre
La vitesse d’adsorption de pseudo second ordre, dépend de la quantité adsorbée à l’équilibre, le modèle du second ordre suit l’équation (II.7) [45].
=k
(q
q
)²
(II.8)
L’intégration de cette équation entre 0 et t pour le temps de contact adsorbat-adsorbant et entre 0 et qt pour la quantité adsorbée conduit à l’équation:
= +k t
(II.9)L’équation (I.8) peut être réarrangée pour donner la forme linéaire suivante :
=
.+ t
(II.10)Avec :
k2 : Constante de vitesse du second ordre en mg. g-1.
Dans le cas d’un système répondant à la cinétique de second ordre, la représentation de t/qt en
fonction de t conduit à une droite de pente 1/ et d’ordonnée à l’origine 1/ . , permettant d’accéder à la constante de vitesse .
II.7. Les différences type d’adsorbants
II.7.1. Gels de silice
Les gels de silice sont préparés à partir de Si(OH)4 en phase aqueuse, obtenus par acidification
d'un silicate de sodium, ou bien à partir d'un sol de silice. Les groupements SiOH conduisent à des liaisons d’hydrogène. Il existe deux types de gels de silice : les microporeux, assez hydrophiles, et les macroporeux, versatiles qui diffèrent par la taille des pores comme le nom l'indique. Leur surface spécifique peut être de 300 à 800 m²/g [46].
Chapitre II Généralités sur l’adsorption
20
II.7.2. Alumines activées
Les alumines activées disposent d’une surface de 200 à 500 m²/g avec des pores de 20 à 140 Å
[37]. Elles sont obtenues par déshydratation thermique du trihydrate d’alumine. Elles sont très
hydrophile et ont une affinité réelle pour l’eau et sont souvent utilisées pour sécher différents gaz
[47].
II.7.3. Adsorbants à base de polymères
Les adsorbants à base de polymères organiques ont trouvé des applications pour l’élimination des composés organiques, la purification des eaux ou la fabrication des médicaments. Les polymères de base sont des polystyrènes, des esters polyacryliques ou des résines phénoliques. Ce sont généralement des matériaux mésoporeux [48].
II.7.4. Argiles activés (ou terre décolorantes)
On obtient les argiles activées, par addition d’eau à certaines qualités d’argiles (bentonite, kaolinite), puis incorporation à la pate ainsi obtenue d’une certaine quantité d’acide chlorhydrique. L’opération est suivie d’un lavage et séchage à des conditions déterminés. La décoloration et la purification des huiles minérales et végétales utilisent ce type d’adsorbant [36].
II.7.5. Charbons actifs
Les charbons actifs sont préparés par pyrolyse d'une matière contenant du carbone, charbon ou matériau végétal. Il existe plusieurs centaines de qualités de charbons actifs, suivant le précurseur et les conditions de traitement. On peut aussi trouver des charbons actifs dits « chimiques », activés à chaud en présence d'agents chimiques déshydratants, acide phosphorique par exemple. Ce sont des adsorbants hydrophobes dont la surface spécifique se situe entre 500 et 2000 m²/g. Leur porosité, leur vaste domaine d’application et leur coût font des charbons actifs les adsorbants les plus répandus [49].
Chapitre III:
Généralités sur
Le Charbon
Chapitre III Généralités sur le charbon actif
21
III.1. Définition
Le charbon actif est un carbone microporeux inerte qui a subi un traitement pour augmenter sa surface spécifique, pouvant aller de 100 à 2000 m².g-1 d'où sa grande capacité d'adsorption [50]. Le charbon actif est un adsorbant non spécifique avec une structure poreuse bien développée formée majoritairement par des micropores et des mésopores de différents diamètres [51],
Ces adsorbants jouent un rôle très important dans la protection de l’environnement, la purification de l’eau, l’élimination des polluants atmosphériques, la purification des gaz, la séparation des mélanges de gaz et la récupération des solvants [52-53].
III.2. Origine du charbon actif
D’origine organique ou minérale, les charbons actif proviennent de diverses matières animales et végétales (coque de noix de coco, tourbe, houille…)[54] ; noyaux de fruit [55-56], bagasse de canne à sucre [57-58] ; paille et enveloppes de céréales; blé et riz [59] ; noyaux d'abricot
[60] ; pulpe de pomme [61] ; noyaux d’olives [62-63]; le café [64], les résidus de thé [65].
La grande gamme des précurseurs explique les différentes structures physico-chimiques des charbons actifs préparés.
III.3. Les types du charbon actif
La classification des charbons actifs selon leur granulométrie permet de distinguer deux types: charbon actif en poudre (CAP) et charbon actif granulaire (CAG) [66].
III.3.1. Charbon actif en poudre (CAP)
Ce type a une taille de particules typique inférieure à 0,1 mm. Il est moins cher que le charbon actif granulé et l’adsorption dans les micropores est beaucoup plus grande que sur la surface des mésopores.
Le CAP est surtout utilisé pour lutter contre des pollutions légères et/ou de courte durée. Il représente également un traitement de sécurité appréciable pour faire face à une pollution accidentelle.
III.3.2. Charbon actif granulé (CAG)
Le charbon actif granulé a une taille de particules moyenne comprise entre 0,6 et 4 mm. Sa forte densité apparente, sa haute dureté et son indice d'abrasion réduit ont rendu le CAG plus adapté que CAP pour diverses applications [67-68]. Ce type est couramment utilisé dans les installations de traitement de l'eau où le lit de charbon granulé permet d'éliminer les goûts, les couleurs, les odeurs et les matières organiques dissoutes. En outre, le charbon actif granulé peut également être utilisé pour une application en phase gazeuse.
Chapitre III Généralités sur le charbon actif
III.4. Préparation du charbon actif
La préparation d’un charbon actif comprend les deux principales étapes suivantes :
A. La carbonisation
La pyrolyse est la décomposition thermique d’un matériau organique à des températures comprises entre 400 et 1000°C. Les hétéroatomes (oxygène, azote et hydrogène) sont éliminés sous l’effet de la chaleur et le matériau devient plus riche en carbone. Les atomes de carbone restants se regroupent en feuillets aromatiques possédant une certaine structure planaire. Ces feuillets s’arrangent ensuite d’une manière irrégulière laissant ainsi des interstices entre elles donnant naissance à une porosité primaire du produit carbonisé [69].
B. L’activation
L’activation consiste à développer la structure poreuse en éliminant les goudrons qui obstruent les pores, et a créer des fonctions de surface (généralement oxydées) qui sont a l’origine des interactions entre le solide et les molécules adsorbées. Elle peut être physique ou chimique [70].
L’activation physique
Consiste en une oxydation thermique d’un charbon à une température variant entre 300 °C et 1000 °C en présence de l’oxygène, du gaz carbonique ou de la vapeur d’eau. Ce traitement est relativement long et peut durer de 10 à 48 h et même plus[71].
L’activation chimique
L'activation chimique est généralement réalisée en plusieurs étapes mais elle ne comporte qu'un seul traitement thermique. Dans un premier temps, il s'agit de mettre en contact l'agent activant et le précurseur, [72] favorisant la déshydratation, puis une réorganisation structurale à des températures plus faibles que dans l’activation physique. Après réaction, le matériau est lavé abondamment à l’eau a fin d’éliminer toute trace d’agent chimique restant. Ce traitement améliore le développement de la structure poreuse et permet la création des fonctions de surface responsables des interactions entre le solide et les molécules adsorbées.[73]. les agents activants les plus utilisés sont l'acide phosphorique (H3PO4), la potasse (KOH) et le chlorure de zinc (ZnCl2) [72].
III.5. Structure et propriétés superficielles du charbon actif
La structure des charbons actifs est constituée d’une association aléatoire de plans d’atomes de carbone. Ces atomes sont organisés sous forme de cycles aromatiques qui forment des feuillets de carbone appelés graphène. Le graphène a une structure bidimensionnelle d’atomes de carbone rappelant celle d’un nid d’abeille [74].
Chapitr Figure III Un charbo porosité. Les poreuses te pendant le Une classi Mi Mé Ma Chaque ty permettent transport d micropores d’un charb re III
I.1:Une feu
on actif se c s capacités d elles que la processus d ification sim icropores : d ésopores : d acropores : Figure III ype de pore t au fluide d de ce fluid s sont les si bon actif : il uille de grap caractérise e d'adsorption a surface, le de carbonisa mple permet diamètre inf diamètre com diamètre su I.3: Représe s joue un r d’accéder à de et interv tes de l’ads s représente phène [75] essentiellem n élevées de volume de ation et d'ac t de distingu férieur à 2 n mpris entre upérieure à 5 entation sch rôle particu à la surface viennent da sorption, ils ent presque Figure I des mi ment par deu
e charbon a es pores et l ctivation ch uer trois sor
nm. 2 nm et 50 50 nm [77]. hématique d ulier dans le e interne du ans l’adsor Peuvent dé la totalité d III.2:Repré crostructure ux paramètr actif sont fo la distributi imique ou b rtes de pore nm. des différent e phénomèn u charbon a rption de q éterminer à de la surface Généralit ésentation s es du charbo res qui sont ortement liée on de la tai bien physiqu es; il s’agit d ts types de p ne d’adsorp actif. Les m quelques gr eux seuls la e offerte pou tés sur le ch schématiqu on actif [74] t l'aire spéc es aux cara ille des pore ue des [76] : pores [78]. ption. Les m mésopores fa rosses molé a capacité d ur l’adsorpt harbon actif ue ]. cifique et la actéristiques es, formées macropores avorisent le écules. Les d’adsorption tion [78].
23 a s s s e s n
Chapitre III Généralités sur le charbon actif
La surface spécifique d'un adsorbant est une surface par unité de masse. Elle est généralement exprimée en m2.g-1, son estimation est conventionnellement fondée sur des mesures de la capacité d'adsorption de l'adsorbant en question, correspondant à un adsorbat donné [79].
Les principaux hétéroatomes de la structure du charbon actif sont l’oxygène, l’hydrogène, l’azote, le phosphore, le soufre et les halogènes. La source des hétéroatomes peut être le précurseur, l’agent d'activation et les processus de carbonisation /activation [80].
Les propriétés chimiques superficielles d'un charbon actif dépendent fortement et majoritairement de la présence et de la nature des complexes oxygénés. Ceux-ci sont responsables en grande partie de ses propriétés acido-basiques superficielles lesquelles jouent un rôle important dans le phénomène d'adsorption. La surface d'un charbon actif peut développer soit des charges positives soit des charges négatives selon les groupements fonctionnels qu’elle comporte [76].
III.6. Domaines d’utilisation des charbons actifs
Les utilisations du charbon actif sont diverses, nous citons ci-dessous quelques une par secteur d’activité :
III.6.1. Domaine de filtration
Décontamination de l'eau potable : le charbon actif retient un grand nombre de composés organiques, tels les pesticides.
masques à gaz. filtres à cigarettes.
Egalement utilisé pour filtrer les polluants organiques [81-82].
III.6.2. Chimie
Décoloration de liquides: eau potable et autres liquides alimentaires (boissons gazeuses, etc).
Décoloration du sucre. Décaféination du café.
Elimination des hydrocarbures dans l’eau [81-82].
III.6.3. Industrie
Extraction de l’or de ses minerais.
Stockage de l’hydrogène et des combustibles gazeux [81-82].
III.6.4. Médecine
Anti-diarrhéique dans les cas des diarrhées. Aigreurs d'estomac, aérophagies, flatulences.
Chapitre III Généralités sur le charbon actif
25
Traitement de l’intoxication alimentaire.
Antidote en cas d’intoxication par médicaments, produits chimiques, métaux lourds, détergents, solvants organiques [82].
III.7. Le charbon actif à partir le jujube
Le zizyphus jujuba (jujubier) est un arbuste fruitier, épineux appartenant à la famille des rhamnacée. Cette famille des plantes dicotylédones qui comprend 900 espèces auprès de 58 genres [83]. Communément appelé en Afrique du Nord « Sedra » [84].Il forme des touffes de quelques mètres de diamètres pouvant atteindre 2m de haut [83].Ses feuilles sont courtement pétiolées. Les fleurs sont jaunes. Les fruits sont des drupes à noyaux soudés, l’endocarpe mucilagineux appelé « Nbeg ». Le jujubier est peu exigeant en eau. Cet arbrisseau a une croissance très lente et commence à porter des fruits vers l’âge de 4 ans. Il peut continuer à paraitre vers 20 à 25 ans. Les fruits sont cueillis parfaitement murs en septembre-octobre. C’est la période au cours de laquelle ils se détachent facilement. Il existe environ 122 espèces de ce genre. Notre étude porte sur la valorisation du zizyphus lotus L [85].
III.8. Méthodes de caractérisation du charbon actif
III.8.1. Analyses par Diffraction des rayons X
La diffraction des rayons X par les cristaux est un phénomène important pouvant servir à indiquer les positions relatives des atomes dans un solide [86]. Les techniques se servant de la diffraction des rayons X sont universellement utilisées pour identifier la nature chimique et la structure des composés cristallisés. En effet, ces techniques ne s’appliquent qu’a des produits présentant les caractéristiques de l’état cristallin, c’est-à-dire un arrangement périodique tridimensionnel des atomes ((roches, cristaux, minéraux, pigments, argiles…).
Les radiations X possèdent la propriété de traverser un matériau et d'être diffractées par les atomes. La technique permet de déterminer les distances interatomiques et l'arrangement des atomes dans les réseaux cristallins. Comme les rayons X sont diffractés de façon différente par les éléments du réseau suivant la construction de ce dernier, l'irradiation de la matière par rayons X permet de connaître sa nature cristallographique [30].
III.8.2. Analyses par spectroscopie IR
La spectroscopie infrarouge à transformée de fourrier (IRTF) est une méthode d'analyse basée sur l'absorption d'un rayonnement infrarouge par le matériau analysé. Elle permet via la détection des vibrations caractéristiques des liaisons chimiques, d'effectuer l'analyse des fonctions chimiques présentent dans le matériau [87].
Chapitre III Généralités sur le charbon actif
Le rayonnement infrarouge (IR) est un rayonnement électromagnétique d'une longueur d'onde supérieure à celle de la lumière visible mais plus courte que celle des micro-ondes [88-89]. L'infrarouge, dont la longueur d'onde est comprise entre 0,78μm et 1000, est usuellement subdivisée en trois régions :
IR proche (PIR : de 0,78 μm à 1,4 μm), IR moyen (MIR : de 1,4 à 25 μm), IR lointain (de 25 μm à 1000 μm).
La partie la plus riche en informations et la plus accessible du point de vue expérimental est celle du moyen infrarouge (λ comprise entre 2,5 et 25 μm soit v (nombre d’onde v=1/λ) compris entre 0,04 et 0,4 cm-1). Les absorptions dans ce domaine forment une sorte d’empreinte spectrale des
composés caractéristiques des liaisons inter atomiques qui le composent [90].
III.8.3. Détermination du pH charge point zéro (pHpzc)
Le pH au point de charge nulle (pHPZC) est une propriété électrochimique importante d’un adsorbant, elle est définie comme étant le pH de la solution aqueuse dans laquelle le solide existe sous un potentiel électrique neutre [91-30].
III.8.4. Dosage des groupements chimiques (méthode de BOEHM)
L’identification et la quantification des fonctions de surface d’un charbon actif peuvent être réalisées par la méthode de Boehm. Cette dernière est basée sur un titrage acidimétrique. Les groupements fonctionnels oxygénés présents à la surface du charbon actif sont de différentes acidités qui pourraient être évaluées par titrage avec des solutions basiques de forces différentes
[92-93].
Leur détermination s’effectue par neutralisation avec des solutions d‘hydrogénocarbonate de sodium (NaHCO3 : Bicarbonates de sodium), carbonate de sodium (Na2CO3) et hydroxyde de
sodium (NaOH) de forces basiques croissantes. L’hydroxyde de sodium (NaOH) neutralise les groupements acides (carboxyliques, lactoniques et phénoliques), le carbonate de sodium (Na2CO3)
neutralise les groupements carboxyliques et lactoniques et l’hydrogénocarbonate de sodium (NaHCO3) neutralise uniquement les groupements carboxyliques. Le dosage des fonctions basiques
s‘effectue par neutralisation avec une solution d’acide chlorhydrique.
III.8.5. Détermination de l’indice de bleu de méthylène
L’indice du bleu de méthylène est le nombre de milligrammes du bleu de méthylène adsorbé par un gramme de charbon actif. Il est déterminé suivant la norme Chemviron- Carbon company method TM-11 [94]. La surface occupée par une molécule du bleu de méthylène est prise égale à 119 Å2 [95].
Chapitre III Généralités sur le charbon actif
27
III.8.6. Détermination de l’indice d’iode
L’indice d’iode représente l’un des paramètres fondamentaux utilisés pour la caractérisation des performances du charbon actif [96]. Elle permet la détermination de la capacité du charbon actif à adsorber les petites molécules, et donc de déterminer la microporosité du charbon actif (0-20A°). Elle est définie comme étant le nombre de milligrammes d’iode adsorbé par gramme d’adsorbant à une concentration résiduelle de 0,02N. Elle a été déterminée par iodométrie.
Partie
Chapitre IV:
Préparation et
caractérisation
des charbons
actifs
Partie expé
IV.1. Int
Dan Jujube, pou notamment protocole e de leurs caIV.2. Pré
Les noyau l’abondanc alimentaire centre de l Les noyau ensuite été d’impureté étuvés à10IV.3. Pré
Les charbo Une masse H3PO4 à di d’activatio chauffés d de carboni l’eau distil érimentale:troduction
ns cette étu ur produire t pour la dé expérimenta aractéristiquéparation
ux de jujube ce est impo e et médicin ’Algérie. F ux ont d’ab é lavés jus és adhérente 5°C jusqu’àéparation
ons actifs pr e m de la po ifférentes p on achevée, ans un four sation allan llée jusqu’n
ude nous av des charbo écoloration al de la pré ues.n de la ma
es provienn ortante dans nale. Le juju Figure IV.1 bord été sép squ’à avec es ainsi que à poids consn des char
réparés ont é oudre des no uretés (30% les mélang r à moffle à nt 400 à 600 obtention d vons choisi ns actifs mo des effluen éparation deatière prem
nent de la v s notre pays ube utilisé d : Différente parés de la de l’eau c e les substan stant, broyérbons acti
été activés c oyaux de Ju %, 50%, 85% ges obtenus à une vitess 0°C. Les ch de pH=7 et Prépa i de valorise oins coûteu nts utilisés d es charbonsmière
variété appe s et dont l’ dans cette é es parties du pulpe par courante afi nces hydros és et tamisésifs
chimiqueme ujube broyé %) et à un t s ont été ré se de chauff harbons acti séchés à 6 aration et ca er un déche ux et applica dans l’indu actifs, leur elée ‘Zizyph usage se li tude a été r u fruit du Zi chauffage fin d’élimin solubles, pu s avant d’êtr ent avec du és a été imp taux d’impr écupérés da fe de 10°C/ fs obtenus o 0°C jusqu’à aractérisatio et végétal q able dans le ustrie textile rs caractéris hus jujuba’ imite souve écupéré de izyphus lotu dans une e ner toute so uis rincés a re stockés d l’acide pho régnée avec régnation d ans des creu /min et à deont été ensu à poids con
on des charb qui est les
traitement e. Ce chapit sations et co (nommé N ent à la con la région de us. eau bouillan orte de pou avec de l’ea dans un dess osphorique ( c l’acide ph e 1/1. Une usets en po es températu uite neutrali nstants, tam bons actifs noyaux de des eaux et tre décrit le omparaison Nebka) dont nsommation e Bouira au
nte. Ils ont ussières ou au distillée, siccateur. (H3PO4). hosphorique fois l’étape orcelaine et ures finales isés avec de misés sur un
e t e n t n u t u , e e t s e n
Partie expérimentale: Préparation et caractérisation des charbons actifs
29
tamis de 100µm. ils ont été objet d’une caractérisation permettant le choix du charbon actif le plus performant.
IV.4. Méthodes de caractérisation des charbons actifs préparés
IV.4.1. Taux d’humidité (MC)
La méthode d'essai de séchage au four a été utilisée selon la norme (ASTM D2867 - 70) [97]. Un échantillon de carbonisât de 1g est placé dans un creuset sec et fermé par un couvercle (de poids connu) et pesé avec précaution après avoir été mis dans une étuve préchauffée (150°C). L'échantillon est séché pendent 3h de façon constante puis enlevé de l‘étuve (creuset fermé), refroidi à température ambiante dans un dessiccateur.
Le creuset fermé est pesé à nouveau avec précision. La différence de pourcentage de poids est exprimée en tant que teneur en humidité de l'échantillon par l‘équation suivante :
Mc=
.100
(IV.1)B : masse du creuset avec couvercle plus masse carbonisat avant séchage. F : masse du creuset avec couvercle plus masse ce carbonisé après séchage. G: masse du creuset et couvercle vide.
IV.4.2. Teneur en cendres (AC)
C’est le critère utilisé pour la détermination de la concentration en produits inorganiques dans les matériaux de départ. La teneur en cendres est déterminée selon la norme ASTMD-70. On chauffe un creuset vide pendant une heure à une température de 650°C puis on pèse le creuset après un passage au dessiccateur pour un refroidissement et enfin on note son poids .Ensuite on pèse une masse du carbonisât et on introduit le tout dans le four à 650°C pendant trois heures; on pèse puis remet au four pendant une heure. On répète plusieurs fois cette opération jusqu’a ce que la masse soit constant [97]. La teneur en cendres représentée en pourcentage (% massique est déterminée selon l’équation suivante :
A
C=
. 100
(IV.2)B : masse du creuset plus masse carbonisé séché. F : masse du creuset plus masse de cendre. G : masse du creuset vide.

![Tableau II.1 : Les différentes formes de l’équation de Langmuir [41].](https://thumb-eu.123doks.com/thumbv2/123doknet/13922251.449842/31.892.109.780.149.644/tableau-ii-formes-l-équation-langmuir.webp)