Gefässchirurgie 2011 · 16:462–468 DOI 10.1007/s00772-011-0889-z Online publiziert: 14. September 2011 © Springer-Verlag 2011 M. Mayr1 · G. Bongartz2 1 Medizinische Poliklinik, Universitätsspital Basel 2 Institut für Radiologie, Universitätsspital Basel
Nephrogene systemische Fibrose
(NSF): Wie hoch ist das Risiko und
wie können wir es vermeiden?
Leitthema
Gadolinium- (Gd-)basierte Magnet- resonanztomographien/-angiogra-phien (Gd-MRT) zeichnen sich durch ihre hohe Kontrastauflösung, ihre günstige Dosis-Wirkungs-Relation und ihre gute diagnostische Wertig-keit aus. Bis vor wenigen Jahren gal-ten Gd-MRT als sehr sicher und ka-men in weit über 200 Millionen Fällen zur Anwendung [32]. Gd-MRT waren Mittel der Wahl bei Patienten mit Nie-reninsuffizienz (NI), da Gd-verursach-te Nierenversagen selGd-verursach-ten und meis-tens nur nach intraarterieller Gabe hoher Gd-Dosen (>0,2 mmol/kgKG) zu beobachten waren [14]. Diese Ein-schätzung hat sich geändert, nach-dem bei Patienten mit NI Fälle einer fibrosierenden Systemerkrankung in Assoziation mit Gd-MRT auftraten [10, 11]. Dies hat zu einer Verunsiche-rung in der Anwendung von Gd-MRT geführt.
Hintergrund
Die Erstbeschreibung der NSF geht auf S. Cowper zurück [4]. Im Jahr 2000 publizierte er eine Serie von 15 dialyse-pflichtigen Patienten aus den USA, bei welchen beginnend ab 1997 ein neues Krankheitsbild auftrat, das an das extrem seltene Skleromyxödem erinnerte und deshalb als „Skleromyxödem ähnliche Hauterkrankung“ bezeichnet wurde [4]. Hervorstechendes Merkmal dieser neu-en Erkrankung war eine Verdickung und Verhärtung der Haut, welche v. a im Be-reich der Extremitäten zu beobachten war. Da auch bei neuen Fällen ausschließlich Patienten mit einer NI betroffen waren,
wurde die Erkrankung später als „neph-rogene fibrosierende Dermatopathie“ be-zeichnet [5].
Nach Fallberichten mit Hinweisen auf eine Mitbeteiligung tiefer gelegener Organstruk-turen und der Vermutung, dass zirkulie-renden Fibrozyten eine wichtige Rolle zu-kommt, wurde die Erkrankung schließlich als „nephrogene systemische Fibrose“ (NSF) bezeichnet [6].
Da das Krankheitsbild offenbar vor 1997 nicht existierte, wurde vermutet, dass ein neues Agens die NSF verursachen könnte. Diese Vermutung begann sich 2006 zu be-stätigen, als T. Grobner aus Wien bei 5 Pa-tienten mit dialysepflichtiger NI eine zeit-liche Assoziation zwischen der Gabe des Gd-basierten Kontrastmittels (Gd-KM) Gadodiamid (Omniscan®) und dem Auf-treten der NSF beobachtete [10, 11]. Kurz darauf erschien aus Dänemark eine Serie von 13 Patienten mit schwerer NI, bei welchen vor Auftreten der NSF ebenfalls Gadodiamid (Omniscan®) appliziert wor-den war [17]. Seither sind mehr als 350 Fäl-le im „YaFäl-le International NSF Registry“ re-gistriert und über 500 Fälle der „US Food and Drug Administration MedWatch da-tabase“ gemeldet worden [3, 7, 30].
Krankheitskonzept
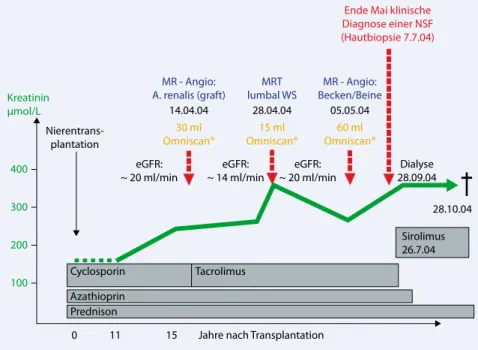
Patienten, bei welchen eine NSF auftrat, hatten zwei wesentliche Gemeinsamkeiten: Sie litten an einem akuten Nierenversagen (ANV) oder an einer chronischen, häu-fig dialysepflichtigen NI (Stadium 4 und 5, . Tab. 1) und hatten vorgängig eine Gd-KM-Untersuchung. . Abb. 1 zeigt eine typische Krankengeschichte.
Interessanterweise traten gut 80% der Fälle nach Applikation von Gadodiamid (Omniscan®) auf (. Tab. 2, [24]). Dies lies vermuten, dass offenbar die Zusam-mensetzung der Gd-KM eine wesentli-che Rolle spielt. Freies Gd3+ kann u. a. mit
Ca2+ kompetetieren und ist für den
Or-ganismus hoch toxisch [27]. Die Einbin-dung von Gd3+ in Chelate ist deshalb
es-senziell. Die chemische Bindung von Gd3+ und seinem spezifischen
Ligan-den ist ein dynamischer Prozess, wobei das chemische Gleichgewicht möglichst stark aufseiten der Chelate liegen sollte (. Abb. 2a). Die Stärke der chemischen Bindung selbst und das Mengenverhält-nis des betroffenen Ions zu seinem Ligan-den sind hierbei entscheiLigan-dende Variablen. Die auf dem Markt befindlichen Gd-Che-late unterscheiden sich in Ihrer thermo-dynamischen und kinetischen Stabilität [27]. Vereinfacht gilt, makrozyklische Gd-Chelate sind in der Regel stabiler als linea-re und ionisch linealinea-re stabiler als nicht- ionisch lineare (. Abb. 2b). Gd-Chela-ten mit schwächeren Bindungen werden Liganden im Überschuss hinzugesetzt, um das Gleichgewicht möglichst aufsei-ten der Komplexbildung zu halaufsei-ten und somit Menge und toxische Wirkungszeit von freiem Gd3+ möglichst gering zu
hal-ten (. Abb. 2c).
Die Bedeutung einer schweren NI für die Entwicklung einer NSF dürfte mit gro-ßer Sicherheit darin liegen, dass die rena-le Eliminationsrate der Gd-Chelate redu-ziert und die Halbwertszeit entsprechend verlängert ist, im Falle von Gadodiamid von durchschnittlich 1,3 auf 34,3 Stunden (13.4.–89.2) [13]. Dadurch können sowohl Transmetallierungsprozesse, bei welchen
Salze aus ihrer Chelatbindung gelöst wer-den, als auch Transchelationsprozesse mit Bindung der Gd-Ionen an neue Liganden begünstigt werden (. Abb. 2d).
Die Tatsache, dass trotz der immen-sen Anzahl durchgeführter Gd-MRT mit einem hohen Anteil linear basierter Gd-Chelate nur bei wenigen Patienten mit NI eine NSF auftrat, lässt vermuten, dass zu-sätzliche Faktoren mitwirken. So dürf-te der Applikation hoher Gd-KM-Dosen im Rahmen bestimmter Anwendungen (z. B. MRA) oder der Repetition in kur-zen Zeitabständen eine wichtige Rolle zu-kommen (. Abb. 1, [24]). Weiter werden pathophysiologische Prozesse diskutiert, die wiederum gerade bei Patienten mit NI überproportional häufig vorkommen oder mit einer NI assoziiert sind: (pro-) inflammatorische Ereignisse (z. B. chir-urgische Eingriffe, Thrombosen, Infek-tionen, Myokardinfarkte, Antiphospholi-pid-Syndrom), welche Makrophagen und Monozyten aktivieren („primen“) und für die Noxe Gd „sensibel“ machen könnten [21]; Hyperphosphatämien, wobei Phos-phat als kompetitiver Ligand Gd3+ bindet
(Transchelation) und zur Ablagerung von Gd-Phosphat-Komplexen führen könnte [3, 24]; hohe Dosen von Erythropoietin, welche die Freisetzung/Produktion von zirkulierenden Fibrozyten begünstigen könnten [7, 24]; eine Eisenüberladung, wobei Eisen als konkurrenzierendes Ion mit Gd3+ in Kompetition stehen
könn-te (Transmetallierung) [3] oder das Vor-handensein einer Azidose über eine Ab-nahme der Bindungsstärke der Gd-Che-late im sauren pH-Bereich [24].
Bei einer Gewichtung der Risikofaktoren ist der mit Abstand wichtigste Faktor für die Entwicklung einer NSF die Applika-tion eines Gd-KM auf dem Boden einer re-levanten NI in Abhängigkeit des Schwere-grades derselben. Lineare Gd-KM mit einer schwachen Bindung sind mit einem beson-ders hohen Risiko behaftet (. Abb. 3). Diese Beobachtung konnte mittlerweile durch Tiermodelle untermauert werden [28]. Hohe Einzeldosen oder repetitive Do-sen in kurzer Zeit erhöhen zusätzlich das Risiko [24]. Für alle anderen Faktoren exis-tieren bislang keine ausreichenden Beweise, die eine hierarchische Ordnung in Bezug auf das Risiko ermöglichen.
MRT
lumbal WS Becken/BeineMR - Angio: MR - Angio:
A. renalis (graft)
14.04.04 28.04.04 05.05.04
30 ml
Omniscan® Omniscan®15 ml Omniscan®60 ml
eGFR: ~ 20 ml/min
Nierentrans-plantation
eGFR:
~ 14 ml/min ~ 20 ml/mineGFR:
28.10.04 Dialyse 28.09.04 Sirolimus 26.7.04 Cyclosporin Azathioprin Prednison Tacrolimus
Jahre nach Transplantation
0 11 15 400 Kreatinin µmol/L 300 200 100 Abb. 1 8 Krankheitsverlauf einer 70-jährigen Patientin. Nierentransplantation mit 55 Jahren bei autosomal dominanten polyzystischen Nieren. 15 Jahre später repetitive Gabe von Gadodiamid (0,5 mmol/ml) zur Abklärung einer Funktionsverschlechterung des Transplantats (MRA der A. renalis), einer Claudicatio spinalis (MRT der lumbalen Wirbelsäule) und einer peripheren arteriellen Verschluss- krankheit (MRA der Becken- und Beinarterien) auf der Basis einer schweren chronischen Niereninsuf-fizienz. Innerhalb von 4 Wochen Entwicklung des klinischen Bildes einer NSF. Die Patientin verstirbt wenige Monate später im Rahmen einer Sepsis. eGFR estimated glomerular filtration rate; Umrech-nung Serumkreatinin: µmol/L geteilt durch 88,4=mg/dL Gd3+ (frei) Ligand Gd- Chelate Gd3+ (frei) unlöslich,
toxisch „nicht-toxisch”löslich,
Ligand Phosphat
Fe2+
Zn2+
„Freies Gd” oder Gd-Präzipitate Gd3+ Ligand Transchelation Transmetallierung „instabiler” „stabiler” Dotarem® Omniscan®Gd - DTPA BMA
Gd-Chelate Gd - DOTA N N N N OH O O O O O O O O O O O N N N N H N H O O O O Gd3+ Gd3+ H3C CH3
Lineares, nicht-ionisches Gd-Chelat Makrozyklisches Gd-Chelat
a
c
b
d
Abb. 2 8 a Chemisches Gleichgewicht zwischen Gd3+ und seinem Chelat. b Beispiel eines instabileren
und stabileren Gd-Chelats. c Zugabe von Liganden im Überschuss. d Skizze von Transmetallierungs-prozessen (hier kompetitive Verdrängung von Gd3+ via Fe2+ und Zn2+) und Transchelationsprozessen
(hier „Abfangen“ von freiem Gd3+ via Phosphat). Roter Blitz in . Abb. 2d: Freies Gd3+
Pathophysiologie
Ausgehend vom Konzept der Freisetzung von Gd3+ geht man davon aus, dass das in
den Geweben präzipitierte Gd von Ma-krophagen phagozytiert wird, was zur Freisetzung von profibrotischen Zytoki-nen und Wachstumsfaktoren führt, die zirkulierende Fibrozyten anlocken und gewebsständige Fibroblasten aktivieren [23]. Als Folge wird ein Prozess der
Fibro-se initiiert und in Gang gehalten, der für die NSF charakteristisch ist. Neben dieser „freien Gd-Hypothese“ gibt es mittlerwei-le auch experimentelmittlerwei-le Daten, die darauf hinweisen, dass im entsprechenden (pro-) inflammatorischen Milieu möglicherwei-se Gd-Chelate möglicherwei-selbst von Makrophagen phagozytiert werden und es auf diesem Wege zur Ablagerung von Gd im
Gewe-be kommt („bioaktive Gd-Chelat-Hypo-these“). Somit könnten Gd-Chelate selbst wie auch Gd3+ als Auslöser eines
Fibrosie-rungsprozesses infrage kommen [21].
Histologie
Das histologische Bild zeigt neben mono- und mehrkernigen Makrophagen zahlrei-che CD34 und prokollagen-I positive fi-broblastenähnliche Spindelzellen, die im Bereich der mittleren und tiefen Dermis anzutreffen sind und entlang der Septen in das subkutane Fettgewebe und in die darunterliegende Skelettmuskulatur vor-dringen können. Weiter sind verbreite-te, ungerichtete Kollagenbündel mit Mu-zinablagerungen, welche durch „Spal-ten“ voneinander getrennt sind, typisch (. Abb. 4). Der Nachweis von Gd-Ab-lagerungen ist aufwendig und wird nicht routinemäßig durchgeführt. Zudem ist die diagnostische Wertigkeit im klini-schen Alltag unklar [12].
Klinik
Die NSF ist eine schwerwiegende, poten-ziell lebensbedrohliche Erkrankung mit einem massiven Einfluss auf die Lebens-qualität. Aufgrund fehlender prospek-tiver Daten sind keine exakten Anga-ben über den Krankheitsbeginn der NSF nach Gd-KM-Applikation zu machen. In retrospektiven Analysen variierte der Krankheitsbeginn zwischen wenigen Ta-gen und mehreren Monaten, selten so-gar Jahren, wobei in diesen Fällen suk-zessive Gd-Mobilisationen aus dem Kno-chen diskutiert werden [19]. Aus unserer Erfahrung ist in der Regel von einem ra-schen Krankheitsbeginn innerhalb we-niger Wochen maximal Monaten auszu-gehen (. Abb. 1). Die Krankheit ist ge-kennzeichnet durch eine Verhärtung und Verdickung der Haut, wobei die Läsionen symmetrisch auftreten und sich von dis-tal nach proximal ausbreiten. Stamm und im Besonderen das Gesicht sind in der Re-gel deutlich weniger oder nicht betroffen. Im Frühstadium bestehen die Läsionen aus festen hautfarbenen, erythematösen Papeln/Knötchen, die in rötlich-bräunli-che Plaques übergehen. Je nach Lokalisa-tion und Ausprägung erscheint die Haut glänzend, „peau d’orange“, pflastersteinar-Tab. 1 Stadieneinteilung der chronischen Nierenerkrankunga [1] Sta-dium Beschreibung GFRb (mL/min/ 1,73 m2) 1 Nierenschadenc mit nor-maler oder erhöhter GFR ≥90 2 Nierenschadenc mit leicht eingeschränkter GFR 60–89 3 Mittelschwer eingeschränkte GFR 30–59 4 Schwer eingeschränkte GFR 15–29 5 Terminale Niereninsuffizienz <15
a Chronic kidney disease (CKD). bGFR Glomeruläre Filtrationsrate.
c Nierenschaden definiert als (histo-)pathologische
Abnormalität oder via einem Surrogatmarker, inklusive abnormer Blutwerte, Urinbefunde oder aufgrund einer abnormen Bildgebung.
Tab. 2 Anzahl von Fällen einer neph-rogenen systemischen Fibrose (NSF) in Abhängigkeit des vorgängig applizierten Gadolinium-Chelats [24] Gadolinium-Chelat Fälle einer NSF (n) Gadodiamid (Omniscan®, GE Healthcare, Chalfont St.-Giles, United Kingdom) 167 Gadopentetat-Dimeglumin (Magnevist®, Bayer Schering Pharma AG, Berlin, Germany) 11 Gadoversetamid (OptiMARK®, Covidien, St. Louis, USA) 5 Gebrauch mehrerer Präparate 6 Gadodiamid + anderes Gd- Chelat, 1 Gadopentetat-Dimeg-lumin + anderes Gd-Chelat, 1 Gadobenat dimeglumin (Multi-Hance®) + anderes Gd-Chelat 8 Nicht spezifiziertes Präparat 26 Total 217a
a Diagnosen bioptisch abgesichert.
Tab. 3 Einteilung der gadolinium-basierten Kontrastmittel in Risikogruppen gemäß European Medicines Agency (EMEA) [9] Risikogruppe Kontrastmittel High risk Gadodiamid (Omniscan®) Gadoversetamid (Optimark®) Gadopentetat-Dimeglumin (Magnevist®) Gadopentetat-Dimeglumin (Magnegita®) Gadopentetat-Dimeglumin (Gado-MRT ratiopharm®) Medium risk Gadofosveset Trinatriumsalz (Vasovist®) Gadoxetat Dinatriumsalz (Primovist®) Gadobenate-Dimeglumin (MultiHance®) Low risk Gadoterate Meglumin ( Dotarem®) Gadoteridolum (ProHance®) Gadobutrolum (Gadovist®) Tab. 4 Fragebogen zur Beurteilung eines erhöhten Risikos für eine chroni-sche oder akute Niereninsuffizienza [15] Fragen Ja Nein Sind Sie älter als 60 Jahre? Leiden Sie unter oder hatten Sie eine/einen Nierenerkrankung oder Einnierigkeit Hohen Blutdruck Zuckerkrankheit Schlaganfall Herzinfarkt Periphere arterielle Verschluss-krankheit Organtransplantation Chemotherapie für ein Tumor-leiden
a Sollte sich bei der Anamnese eine positive
Ant-wort ergeben, empfehlen wir die Bestimmung des Serumkreatinins zur Abschätzung der glomerulä-ren Filtrationsrate (eGFR estimated GFR).
Leitthema
tig oder hölzern von der Textur. Ein Be-gleitödem ist typisch. Die Fibrosierung ist gelenksübergreifend und führt zu Verstei-fungen und Kontraktionen mit den Fol-gen einer massiven Behinderung bei den alltäglichen Verrichtungen bis hin zur Rollstuhlpflichtigkeit [19]. . Abb. 5 zeigt ein typisches klinisches Bild einer NSF bei einem 68-jährigen Patienten mit dialyse-pflichtiger NI. Er entwickelte infolge einer massiven Induration der Haut eine Ulze-ration im Bereich der Achillessehne, die aufgrund der schwierigen lokalen Ver-hältnisse mit entsprechenden Komplika-tionen zu einer Unterschenkelamputation führte. Neben der daraus resultierenden Rollstuhlpflichtigkeit war der Patient auf-grund einer massiv eingeschränkten Be-weglichkeit der Hände und Finger ganz auf die Hilfe seiner Ehefrau angewiesen. Es ist gut dokumentiert, dass auch tiefere subkutane Strukturen wie Muskeln, Seh-nen und Gelenke betroffen sein könSeh-nen. Auch liegen Fallbeschreibungen vor, die auf eine Mitbeteiligung innerer Organe, teils mit Todesfolge, hinweisen. Die Be-urteilung dieser Fälle ist allerdings
auf-grund von Überlagerungen durch Co-Morbiditäten schwierig [19]. Der oben ge-nannte Patient verstarb 8 Jahre nach Dia-gnosestellung im Rahmen einer Sepsis. Die Autopsie zeigte ein untypisches Ver-teilungsmuster einer Myokardfibrose als Hinweis auf eine Mitbeteiligung des Her-zens im Rahmen der NSF.
Diagnose und
Differenzialdiagnose
Bei passender Klinik und Histologie soll-te immer dann an eine NSF gedacht wer-den, wenn ein zeitlicher Zusammenhang zwischen der Gabe eines Gd-KM und dem Auftreten der Symptome zu erkennen ist und gleichzeitig eine NI oder ein ANV vor-liegt und die in . Infobox 1 aufgezeigten Labortests nicht auf andere Erkrankungen hinweisen, die als Differenzialdiagnose in Frage kommen (. Infobox 2).
Prognose und Therapie
Die Prognose ist schlecht. Die NSF ist eine gefährliche, chronische Erkrankung und
Gefässchirurgie 2011 · 16:462–468 DOI 10.1007/s00772-011-0889-z © Springer-Verlag 2011 M. Mayr · G. Bongartz
Nephrogene systemische
Fibrose (NSF): Wie hoch ist
das Risiko und wie können
wir es vermeiden?
Zusammenfassung Das Krankheitsbild der nephrogenen sys-temischen Fibrose, das nach Durchführung einer Gadolinium unterstützen Magnetreso- nanztomographie/-angiographie bei Patien-ten mit schwerer Niereninsuffizienz auftreten kann, hat zu einer massiven Verunsicherung in der Anwendung dieser wertvollen Unter- suchungstechnik geführt. Das Ziel der vorlie-genden Arbeit ist es, neben der Diskussion des Krankheitskonzepts, der zugrundeliegen- den Pathophysiologie, der Klinik und der the-rapeutischen Optionen, die Risikofaktoren zu beleuchten und Konzepte der Prävention auf-zuzeigen. Schlüsselwörter Gadolinium · Magnetresonanztomographie · Kontrastmittel · Niereninsuffizienz · Nephrogene systemische FibroseNephrogenic systemic
fibrosis: what is the risk
and how to prevent it?
Abstract Nephrogenic systemic fibrosis is a severe sys-temic disease which can occur in patients with severe chronic kidney disease or acute kidney injury after the administration of gad- olinium-based contrast agents. This observa-tion led to a great uncertainty in the use of gadolinium-enhanced magnetic resonance imaging techniques. The purpose of this re-view is to discuss the concept of the disease, the clinical aspects, prognosis and therapeu- tic options. In particular, the risk factors in- volved are emphasized and preventive mea-sures presented. Keywords Gadolinium · Magnetic resonance imaging · Contrast agent · Chronic kidney disease · Nephrogenic systemic fibrosis Niereninsuffizienz (Pro-)inflammatorische Zustände Gefässtraumata Eisenüberladung Hyperphosphatämie Hohe Erythropoietin Dosen
Azidose ... Kumulative Riskofaktoren Kumulative Gd-Dosis Makrozyklische Gd Chelate Ionische lineare Gd Chelate Nicht-ionische lineare Gd Chelate Kumulativ es Risiko für NSF R i s i k o f a k t o r e n G d E x p o s i t i o n Abb. 3 8 Oben: Modifiziertes kumulatives Risikomodel nach Swaminathan [29] und Mayr [19]. Die wesentlichen Risikofaktoren sind: der Schweregrad der Niereninsuffizienz, die Applikation eines Gd-KM, die Stabilität des Gd- Chelats und die Höhe der Gd-KM-Dosierung. Unten: Bei Vorliegen mehre-rer oder starker Risikofaktoren steigt das Risiko, eine NSF auch bei geringer Gd-KM-Dosierung zu entwickeln. Farbkodierung der Gd-KM: grün low risk, gelb medium risk, rot high risk. (Adaptiert nach [19] und [29], mit freundli-cher Genehmigung von John Wiley and Sons und der American Society of Nephrology)
ist mit einer erhöhten Morbidität, Morta-lität und einer relevanten Einbuße der Le-bensqualität assoziiert. Komplette spon-tane Remissionen sind nicht beschrieben [7]. Eine etablierte Therapie gibt es nicht und eine Regression ohne Verbesserung der Nierenfunktion ist kaum zu erwar-ten [7, 19]. Neben physiotherapeutischen Maßnahmen sollten die therapeutischen Anstrengungen deshalb auf eine rasche Verbesserung der Nierenfunktion ausge-richtet sein [7]. Mittel der Wahl für chro-nisch dialysepflichtige Patienten ist die
Nierentransplantation. Wir dürfen an-nehmen, dass es günstig ist, wenn die-se so früh wie möglich erfolgt, bevor sich die Erkrankung voll etablieren kann und die Fibrosierungsprozesse nicht mehr zu stoppen sind. Auch wenn es vom Kon-zept her richtig erscheint, geht der Erfolg nicht immer über einen Stopp oder eine Progressionsverzögerung hinaus, wie wir aus der Literatur und eigener Erfahrung wissen [8, 16, 22]. Unklar ist, ob die Wahl der Immunsuppression den Krankheits-verlauf zusätzlich beeinflussen kann [22].
Bei den oben diskutierten Patienten hatte die im Verlauf erfolgte Nierentransplanta-tion keinen erkennbaren Einfluss auf den Krankheitsverlauf.
Prävention
Ohne NI und ohne Gd gibt es keine NSF. Die einfachste Maßnahme wäre deshalb bei einer NI (insbesondere Stadium 4 und 5, . Tab. 1) auf Gd-MRT zu verzichten. Dies ist jedoch unrealistisch, denn gerade die NI ist häufig mit einer relevanten, teils lebensbedrohlichen Atherosklerose asso-ziiert. Insbesondere die präinterventionel-le Diagnostik einer peripheren arterielpräinterventionel-len Verschlusskrankheit und/oder Nieren-arterienstenose ist häufig auf KM-basier-te UnKM-basier-tersuchungsverfahren angewiesen. Es gilt deshalb vernünftig zwischen Nut-zen und Risiko abzuwägen. Klar ist, dass bei über 200 Millionen durchgeführten Gd-MRT und bisher 350 bis 500 doku-mentierten Fällen einer NSF das Risiko eines Auftretens einer NSF extrem klein ist und in der ganz überwiegenden Mehr-zahl Patienten mit NI nach Applikation von Gadodiamid (Omniscan®) betrifft. Somit ist klar, dass das Risiko eines KM-induzierten Nierenversagens nach Gabe eines iodhaltigen KM bei weitem höher einzustufen ist als das Risiko, eine NSF im Rahmen einer Gd-MRT zu erleiden [18].
Um die Applikation von Gd-KM mög-lichst sicher zu gestalten, wurden von den verschiedenen Fachbehörden Empfehlun-gen herausgegeben, die in den wichtigsten Punkten deckungsgleich sind. Die Euro-pean Medicines Agency (EMEA) teilt die Abb. 4 8 a,b Hautbiopsie eines 68-jährigen Patienten mit NSF im Überblick und in der Vergrößerung. Die verdickte Dermis ist von zahlreichen Spindelzellen infiltriert und von dicken und plumpen Kollagenbündeln durchsetzt, die voneinander durch Spalten getrennt sind (Färbung: Hämatoxylin-Eosin, H&E). (Aus [2], mit freundlicher Genehmigung der EMH Schweizer Ärzte-verlag AG) Abb. 5 8 a,b 68-jähriger Patient mit NSF. Beachte die Flexionskontrakturen der Hand und der Finger. Die Haut ist verdickt, zeigt ein vergröbertes Relief, spiegelt und glänzt durch die Spannung und zeigt typische bräunliche Plaques. (Aus [2], mit freundlicher Genehmigung der EMH Schweizer Ärztever-lag AG)
Leitthema
[9]).
Gemäß EMEA sind „high risk“ Gd-KM (. Tab. 3) bei einer NI im Stadium 4 und 5, inklusive Dialysepflichtigkeit (. Tab. 1), bei akuter Niereninsuffizienz und bei Patienten, die auf eine Lebertransplan-tation warten oder gerade transplantiert wurden, kontraindiziert, ebenso bei Neuge-borenen (<4 Wochen). Mütter, welche stil-len, sollten bei Applikation entsprechender Gd-KM das Stillen für 24 Stunden unter-brechen.
Unter Berücksichtigung dieser Guide lines empfehlen wir folgendes praktisches Vor-gehen:
I. Patienten sollten bezüglich ihres Risikos für eine NI beurteilt wer-den. Zur Beurteilung kann ein Fragebogen nützlich sein (. Tab. 4). Sollte ein erhöhtes Ri-siko vorliegen, ist die Bestimmung des Serumkreatinins zur Abschät-zung der glomerulären Filtrations-rate (eGFR) notwendig. Es gibt ver-schiedene Formeln, die auch online zur Verfügung stehen [20].
II. Bei Patienten ohne Risiko für eine NI und Patienten mit einer norma-len oder nur leichten NI (Stadium 1–2, . Tab. 1) können alle Gd-KM-Untersuchungen unter Berücksich-tigung der Herstellerhinweise ange-wendet werden.
III. Da die NI unterschätzt werden kann, empfehlen wir bereits bei einer mäßig schweren NI (Stadium 3, . Tab. 1) ein Gd-Chelat mit einer hohen Stabilität auszuwählen, d. h. entweder ein makrozyklisches Gd („low risk“, . Tab. 3) oder ein li-neares Produkt mit einer hohen Re-laxivität („ medium risk“, . Tab. 3) in einer maximalen Dosierung von 0,2 mmol/kgKG, wobei auf die repe-titive Gabe innerhalb von 7(–10) Ta-gen zu verzichten ist.
IV. Bei Patienten mit schwerer NI ( Stadium 4 und 5, . Tab. 1) muss immer ein Gd-Chelat mit einer ho-hen Stabilität („low“ oder „medium risk group“, . Tab. 3) zur Anwen-dung kommen, d. h. entweder ein makrozyklisches Gd oder ein
linea-von 0,1 mmol/kgKG, wobei auf die repetitive Gabe innert (7–)10 Tagen zu verzichten ist.
V. Art und Menge des verabreichten Gd-KM müssen protokolliert wden und auf dem Befundbericht er-scheinen. Die Dokumentation der Nierenfunktion, der Menge und des Namens des verabreichten Gd-KM soll auch dazu dienen, zukünftige Nebenwirkungen exakt aufarbeiten zu können.
VI. Um die renale Elimination wie auch, je nach Präparat, die hepati-sche Clearance zu optimieren, ist auf eine optimale Kreislaufsituation im Sinne einer guten Euvolämie zu ach-ten. Hierbei können entsprechenden Maßnahmen analog zu den Vor-bereitungen einer jodhaltigen KM-Untersuchungen getroffen werden. VII. Bei dialysepflichtigen Patienten muss
die Gd-KM-Untersuchung unmittel-bar vor der geplanten nächsten Hä-modialysesitzung stattfinden. Extra-dialysen, Akutdialysen oder eine Um-stellung von Peritonealdialyse auf Hä-modialyse werden nicht empfohlen.
Ausblick
Unter Einhaltung der entsprechenden Maßnahmen, dürfen wir davon ausge-hen, dass die NSF bald eine historische Erkrankung sein wird. Die Warnung der FDA im Juni 2006 mit Kontraindikatio-nen für „high risk“ Gd-KM bei schwerer NI und dem Hinweis auf Dosisbeschrän-kungen für alle Präparate bei NI hat be-reits jetzt zu einem dramatischen Rück-gang von Fällen mit NSF geführt [24, 30, 31]. Hieraus lässt sich ableiten, dass auf-grund der vermeintlich fehlenden Neben-wirkungen bei NI Gd-KM häufig zu hoch dosiert eingesetzt wurden. Die Weiterent-wicklung neuerer MRT-Technologien in-klusive des Sequenzdesigns dürfte mithel-fen, dass in Zukunft die Gd-KM- Dosen weiter reduziert werden können [26].
Fazit für die Praxis
Die NSF ist eine seltene, aber äußerst schwerwiegende Erkrankung, die nach Gabe gadoliniumbasierter Kontrastmit- teluntersuchungen im Rahmen von Ma- gnetresonanztomographien/-angiogra- phien bei Patienten mit relevanter Nie- reninsuffizienz (NI) oder akutem Nieren-versagen (ANV) auftreten kann. Durch die Einhaltung entsprechender Vorsichts-maßnahmen, insbesondere durch die Verwendung stabiler Gadoliniumpräpa-rate und einer angepassten Dosierung bei NI kann das Risiko einer NSF extrem minimiert werden. Gd-MRT haben des- halb weiterhin einen wichtigen Stellen-wert in der Diagnostik, gerade auch bei Patienten mit schwerer NI, bei welchen kontrastmittelunterstützte Computer-tomographien aufgrund des Risikos eines ANV keine Alternative darstellen. der nephrogenen systemischen Fibrose (NSF) von anderen Erkrankungen mit potenziell systemischer Fibrosierung F Serumkreatinin F Serumharnstoff F Differenzialblutbild F Blutsenkungsrate F Leberenzyme F Schilddrüsenhormone F Serumprotein- und Immunoelektro-phorese F Hepatitis B und C Serologie F HIV-Serologie F Plasma- und Urinporphyrine Infobox 2 Differenzialdiagnose der nephrogenen systemischen Fibrose (NSF). (Mod. nach [5]) F Skleromyxödem F Eosinophilie-Myalgie-Syndrom F Eosinophile Fasziitis (Shulman-Syndrom) F Systemische Sklerosis/Morphea F Sklerodermoide Graft-versus-Host- Erkrankung F Porphyria cutanea tarda F Fibroblastic rheumatism F Sklerödem F Toxisches Öl-Syndrom (toxic oil syndrome) F Vinylchlorid-Exposition F β2-mikroglobulin Amyloidose F Amyloidose F Dermatofibrosarcoma protuberans F Karzinoid-Syndrom F Kalziphylaxie F Dystrophische Kalzifikation
Unabhängig davon sollte nicht verges-sen werden, dass auch bei der Gabe von Gd-KM lokale oder systemische allergi- forme Reaktionen, wenn auch insge-samt selten und in den seltensten Fällen schwerwiegend, auftreten können [25].
Korrespondenzadresse
Dr. M. Mayr Medizinische Poliklinik, Universitätsspital Basel Petersgraben 4, 4031 Basel Schweiz mmayr@uhbs.ch Interessenskonflikt. Der korrespondierende Autor gibt an, dass kein Interessenkonflikt besteht.Literatur
1. Anonymous (2002) K/DOQI clinical practice guide- lines for chronic kidney disease: evaluation, clas-sification, and stratification. Am J Kidney Dis 39(2 Suppl 1):S 1–S 266 2. Bongartz G, Weishaupt D, Mayr M (2008) Neue Kontrastmittelproblematik bei Niereninsuffizienz: Gadolinium-induzierte Nephrogene Systemische Fibrose (NSF). Schweiz Med Forum 8:116–123 3. Braverman IM, Cowper S (2010) Nephrogenic sys-temic fibrosis. F1000 Med Rep 2:84 4. Cowper SE, Robin HS, Steinberg SM et al (2000) Scleromyxoedema-like cutaneous diseases in renal-dialysis patients. Lancet 356:1000–1001 5. Cowper SE, Su LD, Bhawan J et al (2001) Nephro-genic fibrosing dermopathy. Am J Dermatopathol 23:383–393 6. Cowper SE (2005) Nephrogenic systemic fibrosis: the nosological and conceptual evolution of ne-phrogenic fibrosing dermopathy. Am J Kidney Dis 46:763–765 7. Cowper SE Nephrogenic Fibrosing Dermopathy [ICNSFR Website]. 2001–2009. Available at http:// www.icnsfr.org. Zugegriffen: 25. Juni 2011 8. Cuffy MC, Singh M, Formica R et al (2011) Renal transplantation for nephrogenic systemic fibrosis: a case report and review of the literature. Nephrol Dial Transplant 26:1099–1101 9. European Medicines Agency (2011) http://www. ema.europa.eu/docs/en_GB/document_library/ Press_release/2009/11/WC500015569.pdf. Acces-sed 25.06.11 10. Grobner T (2006) Gadolinium – a specific trig-ger for the development of nephrogenic fibrosing dermopathy and nephrogenic systemic fibrosis? Nephrol Dial Transplant 21:1104–1108 11. Grobner T (2006) Gadolinium – a specific trigger for the development of nephrogenic fibrosing der- mopathy and nephrogenic systemic fibrosis? [erra-tum]. Nephrol Dial Transplant 21:1745 12. High WA, Ayers RA, Cowper SEJ (2007) Gadolinium is quantifiable within the tissue of patients with nephrogenic systemic fibrosis. J Am Acad Derma-tol 56:710–712 13. Joffe P, Thomsen HS, Meusel M (1998) Pharmaco-kinetics of gadodiamide injection in patients with severe renal insufficiency and patients undergoing hemodialysis or continuous ambulatory peritoneal dialysis. Acad Radiol 5:491–502 14. Ledneva E, Karie S, Launay-Vacher V et al (2009) Renal safety of gadolinium-based contrast media in patients with chronic renal insufficiency. Radio-logy 250:618–628 15. Leiner T, Kucharczyk W (2009) NSF prevention in clinical practice: summary of recommendations and guidelines in the United States, Canada, and Europe. J Magn Reson Imaging 30:1357–1363 16. Leung N, Shaikh A, Cosio FG et al (2010) The out- come of patients with nephrogenic systemic fibro-sis after successful kidney transplantation. Am J Transplant 10:558–562 17. Marckmann P, Skov L, Rossen K et al (2006) Ne-phrogenic systemic fibrosis: suspected causative role of gadodiamide used for contrast-enhanced magnetic resonance imaging. J Am Soc Nephrol 17:2359–2362 18. Martin DR, Semelka RC, Chapman A et al (2009) Nephrogenic systemic fibrosis versus contrast-in- duced nephropathy: risks and benefits of contrast-enhanced MR and CT in renally impaired patients. J Magn Reson Imaging 30:1350–1356 19. Mayr M, Burkhalter F, Bongartz G (2009) Nephro- genic systemic fibrosis: clinical spectrum of disea-se. J Magn Reson Imaging 30:1289–1297 20. National Kidney Foundation. Calculators for Health Care Professionals. http://www.kidney.org/profes-sionals/kdoqi/gfr_calculator.cfm 21. Newton BB, Jimenez SA (2009) Mechanism of NSF: New evidence challenging the prevailing theory. J Magn Reson Imaging 30:1277–1283 22. Panesar M, Banerjee S, Barone GW (2008) Clinical improvement of nephrogenic systemic fibrosis af-ter kidney transplantation. Clin Transplant 22:803– 808 23. Perazella MA (2007) Nephrogenic systemic fibro-sis, kidney disease, and gadolinium: is there a link? Clin J Am Soc Nephrol 2:200–202 24. Prince MR, Zhang HL, Roditi GH et al (2009) Risk factors for NSF: a literature review. J Magn Reson Imaging 30:1298–1308 25. Prince MR, Zhang H, Zou Z et al (2011) Incidence of immediate gadolinium contrast media reactions. AJR Am J Roentgenol 196:W138–W143 26. Roditi G, Maki JH, Oliveira GJ et al (2009) Renova- scular imaging in the NSF Era. Magn Reson Ima-ging 30:1323–1334 27. Sherry AD, Caravan P, Lenkinski RE (2009) Primer on gadolinium chemistry. J Magn Reson Imaging 30:1240–1248 28. Sieber MA, Steger-Hartmann T, Lengsfeld P et al (2009) Gadolinium-based contrast agents and NSF: evidence from animal experience. J Magn Reson Imaging 30:1268–1276 29. Swaminathan S, Shah SV (2007) New insights into nephrogenic systemic fibrosis. J Am Soc Nephrol 18:2636–2643 30. U.S. Food and Drug Administration. Available at http://www.fda.gov/cder/drug/advisory/gadolini-um_agents.htm. Accessed 25.06.11 31. Wang Y, Alkasab TK, Narin O et al (2011) Incidence of Nephrogenic Systemic Fibrosis after Adoption of Restrictive Gadolinium-based Contrast Agent Gui-delines. Radiology 260:105–111 32. Weinreb JC, Abu-Alfa AKJ (2009) Gadolinium-ba- sed contrast agents and nephrogenic systemic fi- brosis: why did it happen and what have we lear-ned? Magn Reson Imaging 30:1236–1239Katheterbehandlung bei
chronischen
Koronararterien-verschlüssen
Chronische Koronararterienverschlüsse (engl. chronic total occlusions, CTO) werden bei 30% der Patienten mit Herzgefäßerkrankun- gen mit Angina-Symptomen und vermin- derter Herzleistung diagnostiziert. Im Unter-schied zu akuten Gefäßverschlüssen zeichnen sich CTOs durch eine höhere Konzentration an fibrosiertem und kalzifiziertem Material aus, wodurch die Katheterbehandlung mit Ballondilatation und Stent (PCI) kompliziert ist. Meist wird deshalb eine aufwändige Bypass-Operation durchgeführt, wenn eine medikamentöse Therapie nicht ausreicht. Die europäischen Fachgesellschaften ESC und EACTS haben eine PCI empfohlen, wenn für den distalen Bereich anginöse bzw. ischä-mische Beschwerden vorhanden sind, ein Ischämienachweis bei über 10% des totalen Myokards 2 erfolgte, und die Erfolgsrate des Operateurs wenigstens 80% beträgt. Die Erfolgsquote von CTO-Behandlungen per PCI stieg in den letzten 3 Jahren durch intensiven Erfahrungsaustausch und durch die Entwicklung eines umfangreichen Instru-mentariums von 78% auf 86% an, wobei die erfahrensten Operateure mehr als 90% errei-chen. Retrospektive Meta-Analysen aus den USA konnten zeigen, dass sowohl die Drei-Jahres-Mortalität als auch die Notwendigkeit einer Bypass-Behandlung nach einer PCI an CTOs signifikant sank. Damit wird nicht nur eine Besserung der Beschwerden erreicht und die Herzleistung gesteigert, sondern möglicherweise auch das Leben verlängert. Die Analysen ermöglichen auch einen di-rekten Vergleich von Operationstechniken und eingesetztem Material, wie etwa der Vergleich von retrogradem zu anterogradem Eingriff.Quelle: Euro CTO Club, www.eurocto.eu
![Tab. 3 Einteilung der gadolinium- Einteilung der gadolinium-basierten Kontrastmittel in Risikogruppen gemäß European Medicines Agency (EMEA) [9] Risikogruppe Kontrastmittel High risk Gadodiamid (Omniscan®) Gadoversetamid (Optimark®) Gadopentetat-Dimegl](https://thumb-eu.123doks.com/thumbv2/123doknet/14846480.627617/3.892.333.560.158.499/einteilung-einteilung-kontrastmittel-risikogruppen-risikogruppe-kontrastmittel-gadoversetamid-gadopentetat.webp)