Le fardeau et les tendances dans les hospitalisations
liées aux infections des voies respiratoires inférieures
chez les enfants de moins de 5 ans au Québec
Mémoire
Gregory Anderson
Maîtrise en épidémiologie
Maître ès sciences (M. Sc.)
Québec, Canada
© Gregory Anderson, 2017
Le fardeau et les tendances dans les hospitalisations
liées aux infections des voies respiratoires inférieures
chez les enfants de moins de 5 ans au Québec
Mémoire
Gregory Anderson
Sous la direction de :
Yv Bonnier Viger, directeur de recherche
Philippe De Wals, codirecteur de recherche
iii
Résumé
Deux manifestations cliniques d’infections des voies respiratoires inférieures (IVRI) sévères nécessitent des soins hospitaliers chez les enfants : la bronchiolite, causée principalement par des infections virales et la pneumonie, associée à une grande variété de pathogènes viraux et bactériens. Le Streptococcus pneumoniae demeure un des pathogènes importants de la pneumonie acquise dans la communauté et des programmes d’immunisation utilisant un vaccin conjugué anti-pneumococcique (VCP) ont été implantés dans presque tous les pays pour réduire le fardeau des infections pneumococciques chez les enfants. Un programme de vaccination systématique avec des VCP ciblant tous les nouveau-nés a débuté au Québec en décembre 2004.
Basée sur des données administratives, la présente étude visait à décrire l'épidémiologie et le fardeau des infections respiratoires basses chez les enfants de 6 à 59 mois au Québec d’avril 2000 à mai 2015. Les analyses de tendances dans les proportions et les taux ont été faits avec le test de Cochran-Armitage et le modèle de régression de Poisson.
Une tendance à la baisse dans les taux d’hospitalisation a été observée pour les IVRI. La diminution était plus prononcée pour la pneumonie que pour la bronchiolite, alors qu’une stabilité s’est démarquée dans les taux d’hospitalisation parmi ceux admis aux soins intensifs. En effet, une diminution de la moyenne des durées d’hospitalisation a été identifiée, mais pas chez les enfants admis aux soins intensifs. Toutes ces tendances à la baisse ont débuté avant l’introduction du programme VCP en décembre 2004.
Peu d'évidence montre que la diminution de la fréquence des hospitalisations pour pneumonie de toutes causes soit principalement attribuable au VCP. Les modifications observées peuvent être expliquées en grande partie par des changements dans les pratiques cliniques. Des facteurs environnementaux peuvent également avoir joué un rôle. Cette étude montre que de nombreux facteurs doivent être pris en compte dans l’interprétation de l’impact des VCP sur les hospitalisations pour pneumonie et bronchiolite.
iv
Abstract
There are two main clinical manifestations of serious lower respiratory tract infections (LRTI) in young children which require hospitalization: bronchiolitis, mainly caused by viral infections, and pneumonia which is associated with a large variety of viral and bacterial pathogens. Streptococcus pneumoniae remains an important cause of community-acquired pneumonia and vaccination programs using pneumococcal conjugate vaccines (PCV) have been implemented in almost all countries to reduce the burden of pneumococcal infections in children. A routine vaccination program targeting all newborns with PCV-7 was started in the province of Quebec, Canada in December 2004. An ecological study using administrative data was carried out in order to assess the epidemiology and burden of LRTI in 6 to 59 month old children in Quebec from April 2000 to May 2015. Trend analyses of proportions and rates were calculated with Cochran-Armitage tests and Poisson regressions.
Diminishing trends in the hospitalization rates were found for both LRTI. The reduction was more pronounced in pneumonia than in bronchiolitis. The hospitalization rate for those admitted to a paediatric intensive care unit (PICU) was stable. A reduction in the mean duration of hospital stays was also identified, but not among children admitted to a PICU. All of these downward trends started before the introduction of the PCV program in December 2004.
There is little evidence that the reduction in the frequency of hospitalisations for all-cause pneumonia is primarily attributable to PCVs. Many of the changes observed can be explained by changes in clinical practice. Environmental factors could have also played a role. This study demonstrates that many factors must be taken into account in the interpretation of the impact of PCVs on hospitalisations for pneumonia and bronchiolitis.
v
Table des matières
Résumé __________________________________________________________________________________ iii Abstract __________________________________________________________________________________ iv Table des matières _________________________________________________________________________ v Liste des figures ___________________________________________________________________________ vi Liste des tableaux _________________________________________________________________________ vii Liste des abréviations ______________________________________________________________________ viii Contributions des auteurs ____________________________________________________________________ ix Remerciements ____________________________________________________________________________ x 1. Introduction _____________________________________________________________________________ 1 2. Revue de la littérature _____________________________________________________________________ 2 2.1 Le pneumocoque ________________________________________________________________________ 2 2.2 La colonisation du nasopharynx ____________________________________________________________ 2 2.3 Les infections invasives pneumococciques ____________________________________________________ 3 2.4 La pneumonie acquise dans la communauté __________________________________________________ 3 2.5 L’étiologie des pneumonies ________________________________________________________________ 4 2.6 La co-infection __________________________________________________________________________ 5 2.7 L'incidence de la pneumonie pneumococcique _________________________________________________ 6 2.8 Les VCP _______________________________________________________________________________ 7 2.9 Le programme vaccinal au Québec __________________________________________________________ 8 2.10 Les programmes de vaccination des VCP contre les IIP _________________________________________ 9 2.11 Les VCP contre la pneumonie chez les enfants ______________________________________________ 10 3. Hypothèses et objectifs ___________________________________________________________________ 12 4. Méthodes ______________________________________________________________________________ 13 5. Résultats ______________________________________________________________________________ 16 6. Discussion _____________________________________________________________________________ 24 7. Conclusion _____________________________________________________________________________ 30 8. Bibliographie __________________________________________________________________________ 31
vi
Liste des figures
Figure 1 : Le pourcentage annuel des cas admis aux soins intensifs chez les enfants de 6 à 59 mois au
Québec, 2000-2014. 17
Figure 2 : La durée moyenne annuelle d'hospitalisation (jours) des IVRI selon l'âge et le statut d’admission
aux soins intensifs chez les enfants au Québec, 2000-2014. 18
Figure 3 : Le taux d'incidence annuel (/1000 p-a) des hospitalisations des IVRI selon le groupe d'âge chez
les enfants québécois, 2000-2014. 20
Figure 4 : Le taux d'incidence annuel (/1000 p-a) des hospitalisations des IVRI selon la catégorie
diagnostique chez les enfants de 6 à 59 mois au Québec, 2000-2014. 21
Figure 5 : Le taux d'incidence annuel (/1000 p-a) des hospitalisations des IVRI selon l'âge et le statut d'admission aux soins intensifs chez les enfants de 6 à 59 mois au Québec, 2000-2014. 22 Figure 6 : Le taux d'incidence hebdomadaire (/1000 p-a) de plusieurs diagnostics et les résultats de tests de
laboratoire de virus laboratoires. 23
Figure 7 : Le ratio du taux d'incidence de la pneumonie et de la bronchiolite chez les enfants au Québec,
vii
Liste des tableaux
Tableau 1 : Le taux d’incidence des résultats liés au pneumocoque dans une cohorte d’enfants au Canada,
selon l’âge. 4
Tableau 2 : Les codes de diagnostic inclus. 13
Tableau 3 : Fardeau des hospitalisations des IVRI chez les enfants de 6 à 59 mois au Québec hospitalisés entre le 1er avril 2000 et le 31 décembre 2014.
viii
Liste des abréviations
CHUQ Centre hospitalier universitaire de Québec
DMSP Département de médecine sociale et préventive, Université Laval DRBST Direction des risques biologiques et de la santé au travail
EV Efficacité vaccinale
IIP Infections invasives pneumococciques INSPQ Institut national de santé publique du Québec ISQ Institut de la statistique du Québec
IVRI Infections des voies respiratoires inférieures LRTI Lower respiratory tract infection
NAM Numéro d’assurance maladie PCV Pneumococcal conjugate vaccines PICU Paediatric intensive care unit RCP Réaction en chaîne par polymérase VCP Vaccins conjugués anti-pneumococciques VCP-7 Vaccin conjugué anti-pneumococcique 7-valent VCP-10 Vaccin conjugué anti-pneumococcique 10-valent VCP-13 Vaccin conjugué anti-pneumococcique 13-valent VRS Virus respiratoire syncytial
ix
Contributions des auteurs
Conception, design de l’étude et obtention du financement : Philippe De Wals Acquisition des données : Geneviève Deceuninck
Analyse des données et interprétation des résultats : Gregory Anderson, Geneviève Deceuninck, Philippe De Wals et Zhou Zhou
Rédaction du manuscrit : Gregory Anderson, Geneviève Deceuninck et Philippe De Wals
Révision critique du contenu intellectuel important du manuscrit : Gregory Anderson, Geneviève Deceuninck, François D. Boucher, Philippe De Wals, Rodica Gilca, Yv Bonnier Viger et Zhou Zhou
Assistance administrative, technique ou concrète : Geneviève Deceuninck et Zhou Zhou Révision linguistique : Véronik Desrochers
Approbation finale : Gregory Anderson, Geneviève Deceuninck, François D. Boucher, Philippe De Wals, Rodica Gilca, Yv Bonnier Viger et Zhou Zhou
Affiliations : Département de médecine sociale et préventive (Université Laval), Centre hospitalier universitaire de Québec, Direction des risques biologiques et de la santé au travail (Institut National de Santé Publique du Québec) et Département de pédiatrie (Université Laval)
Supervision de l’étude : Philippe De Wals (Adresse postale : IUCPQ 2725 Chemin Ste-Foy, Québec (QC) G1V 4G5, Canada. Courriel : philippe.dewals@criupq.ulaval.ca)
x
Remerciements
Même si les noms ne figurent pas tous sur la page titre, une maîtrise est un grand projet qui ne peut être réalisé qu’avec l’aide de plusieurs personnes. Un tel projet exige beaucoup de travail, de souci, de détermination et de collaboration. Plusieurs personnes y ont contribué. Même si vous n’êtes pas nommé, sachez que je suis reconnaissant pour votre contribution.
Avant tout, j’aimerais remercier mon directeur le Dr Yv Bonnier Viger et mon co-directeur le Dr Philippe De Wals. Ce projet n'aurait pas pu se concrétiser sans votre appui, vos conseils et vos idées. Je suis reconnaissant pour votre patience, votre encadrement, vos conseils et votre disponibilité pendant tout le processus.
Je voudrais également remercier tous les collègues avec qui j’ai travaillé directement tous les jours sous la direction du Dr De Wals à l’unité de recherche en vaccination du Centre de recherche du CHU de Québec - Université Laval. Plus particulièrement, je remercie la Dre Geneviève Deceuninck et le Dr Zhou Zhou qui ont répondu à mes innombrables questions sur la méthodologie, le design d’étude, les statistiques, le logiciel SAS et le français. Ce fut un plaisir de travailler avec vous deux. J’aimerais aussi remercier tout le monde à l’unité de recherche avec qui je n’ai pas travaillé directement, mais avec qui j’ai parlé tous les jours. Ce fut un plaisir de partager mes midis et de converser avec vous.
Merci à la Dre Lynne Moore qui m’a donné de bons conseils et qui m’a beaucoup aidé pendant ce projet. Je remercie aussi la Dre Rodica Gilca et le Dr François D. Boucher pour vos conseils et votre apport critique. Merci aussi à ceux qui ont révisé mon français, surtout à Véronik Desrochers qui a fait la révision finale. Vous avez su faire des phrases fluides et élégantes avec mes mots maladroits.
Je remercie aussi ma famille et mes amis. Vous m’avez aidé et appuyé pendant ce long projet. Vous m’avez donné la détermination de continuer, ainsi que diverti aux moments opportuns. Merci particulièrement à Mathilde Cinq-Mars, à mes colocataires et à mes amis de Québec pour votre soutien.
Finalement, je remercie le ministère de la Santé et des Services sociaux du Québec pour l’octroi de la bourse qui a rendu possible la réalisation de ce projet.
1
1. Introduction
Globalement, les infections des voies respiratoires inférieures (IVRI) sont une cause importante de morbidité et de mortalité (McIntosh, 2002). Il existe principalement deux formes cliniques d’IVRI qui nécessitent une hospitalisation chez les jeunes enfants : la bronchiolite, provoquée par des infections virales, notamment le virus respiratoire syncytial, et la pneumonie, associée à plusieurs pathogènes bactériens et viraux (Moore et coll., 2012). La bactérie Streptococcus pneumoniae reste une cause importante de la pneumonie acquise dans la communauté et des programmes d’immunisation ont été implantés dans presque tous les pays pour réduire son fardeau (Greenwood, 1999).
Le Canada a homologué un vaccin conjugué anti-pneumococcique à 7-valent (VCP-7) en mai 2001. Celui-ci a été mis à disposition du marché privé peu de temps après (Poirier et coll., 2009). Le Québec a commencé à vacciner les enfants à risque élevé en octobre 2002 sur un calendrier de 4 doses (3 + 1). Puis, un programme de vaccination systématique ciblant tous les nouveau-nés (avec un rattrapage offert à tous les enfants de moins de 5 ans) a été lancé en décembre 2004 sur un calendrier de 3 doses (2 + 1), en gardant le calendrier de 4 doses pour les enfants à risque élevé (Crisinel et coll., 2010; De Wals et coll., 2009). Un vaccin conjugué anti-pneumococcique à 10-valent (VCP-10) a finalement remplacé le VCP-7 et, peu après, le vaccin à 13-valent (VCP-13) a remplacé le VCP-10, sans rattrapage dans les deux cas (Crisinel et coll., 2010; De Wals et coll., 2009).
L'efficacité des programmes de vaccination avec les VCP a principalement été évaluée par la comparaison avant-après de la fréquence des hospitalisations liées aux pneumonies de toutes causes. Les informations ont été tirées de bases de données administratives aux États-Unis (Grijalva et Griffin, 2008; Griffin et
coll., 2014). L'objectif de la présente étude est de décrire l’épidémiologie du fardeau des IVRI chez les enfants de
6 à 59 mois hospitalisés d'avril 2000 à mai 2015 au Québec, une période qui couvre l'implantation du programme de vaccination systématique avec les VCP.
2
2. Revue de la littérature
2.1 Le pneumocoque
Le Streptococcus pneumoniae (pneumocoque) est l’une des bactéries pathogéniques les plus importantes chez les humains. Mondialement, elle est une des causes bactériennes principales de la méningite, de la pneumonie, de l'otite et de la bactériémie (WHO, 2007; ACIP, 2000; Williams et al., 2002). Annuellement, les maladies pneumococciques causent le plus de décès parmi les maladies évitables chez les enfants ayant moins de cinq ans (CDC, 2008; O'Brien et coll., 2009).
Même si le pneumocoque a plus de 90 sérotypes, la plupart des maladies sont causées par moins de 30 d'entre eux (WHO, 2009). Chaque sérotype produit une capsule polysaccharide distincte dont les différences exercent une forte influence sur la capacité des pneumocoques à envahir les tissus de l'hôte (Hostetter, 1986; Melin et coll., 2010a; Melin et coll., 2010b). Cela fait en sorte que certains sérotypes, comme les 6B et 23F, sont plus associés au portage dans le nasopharynx, et que d'autres, comme les 1, 7F, 14 et 18C, sont plus associés aux maladies invasives, même s'ils se trouvent rarement dans le nasopharynx (Hanage et coll., 2005, Sandgren et coll., 2004).
Le pneumocoque touche surtout les âges extrêmes (Grijalva et Griffin, 2008), donc cause beaucoup de morbidité chez les enfants et chez les personnes âgées. Le taux de létalité est toutefois beaucoup plus élevé chez les personnes âges (ACIP, 1997).
2.2 La colonisation du nasopharynx
La colonisation bactérienne du nasopharynx est un facteur important favorisant plusieurs pathogènes respiratoires. Les maladies pneumococciques commencent avec la colonisation du nasopharynx par le pneumocoque. Ensuite, la bactérie peut infecter l'oreille moyenne, les sinus, les poumons, le liquide céphalorachidien ou le sang, ce qui peut causer des conséquences sur la santé (Shak et coll., 2013). Cependant, être porteur de la bactérie n’entraîne pas toujours le développement d’une infection. Certains facteurs de risque affectent le taux de colonisation chez les populations en santé. Par exemple, le taux de portage le plus élevé se trouve chez les tout-petits qui fréquentent les garderies (Obaro et Madhi, 2006). D'autres facteurs déterminants de la colonisation sont l'ethnicité, les caractéristiques environnementales, la promiscuité, la situation socio-économique, la taille de la famille, le salaire, le statut de fumeur et l'usage d'antibiotiques (Bogaert et al., 2004). Plusieurs organismes (et différentes souches d’un même organisme) colonisent le nasopharynx et interagissent de manière complexe et diversifiée (Bogaert et al., 2004). Il existe donc une compétition entre les organismes et
3
même entre les différentes souches du même organisme (Obaro et Madhi, 2006). Des avantages écologiques peuvent être donnés aux organismes bénéfiques par l’élimination ou la suppression d'organismes nuisibles, par la vaccination par exemple, ce qui entraîne une augmentation de la compétition au pneumocoque dans le nasopharynx (Obaro et Madhi, 2006).
2.3 Les infections invasives pneumococciques
En 1999, soit un an avant l'introduction des vaccins conjugués anti-pneumococciques, le taux d'incidence des infections invasives pneumococciques (IIP), aux États-Unis, chez les enfants ayant moins de 12 mois et de 12 à 23 mois, était respectivement estimé à 163 et 205 cas par 100 000 (CDC, 2000). De plus, le pneumocoque était la source bactérienne la plus courante de l'otite, représentant de 28 à 55 % des cas (Johnson et coll., 1991; Luotonen et coll., 1981; Bluestone et coll., 1992; Block et coll., 1997). À la même époque, la bactériémie était l'IIP la plus courante chez les enfants, représentant environ 70 % de cas chez les moins de 2 ans (ACIP, 2000). Le taux de létalité générale de l'IIP, aux États-Unis, de 1995 à 1997, était de 12 %, alors qu’il était de 4 % chez les enfants ayant moins de 2 ans et de 23 % chez les adultes ayant 85 ans et plus (Feikin, 2000).
2.4 La pneumonie acquise dans la communauté
La pneumonie acquise dans la communauté est une maladie courante et potentiellement grave (McIntosh, 2002) dont l'incidence est supérieure chez les jeunes enfants et les personnes âgées (Prina et coll., 2015). L'incidence annuelle chez les moins de 5 ans en Europe et en Amérique du Nord est de 34 à 40 par 1000 personnes (McIntosh, 2002). Celle-ci est plus élevée qu'à tout autre âge, sauf chez les plus âgés, c’est-à-dire chez les 75 ou 80 ans et plus (McIntosh, 2002). Aux États-Unis, chez les moins de 18 ans, la pneumonie est la deuxième cause d'hospitalisation après les blessures (NCHS, 2011), tandis qu’elle représente de 3 % à 18 % des hospitalisations chez les enfants (Farha et Thomson, 2005). En Amérique du Nord, les enfants âgés de moins de 5 ans présentent le plus haut taux d'incidence de la pneumonie de toute la population, soit 34 à 40 par 1000 (Schuchat et coll., 1997).
L'incidence de la pneumonie acquise dans la communauté est plus élevée chez les hommes et les garçons que chez les femmes et les filles (NCHS, 2011). Les patients n'ayant pas besoin d'être hospitalisés ont un taux de létalité de moins de 1 %, mais le taux de létalité à court terme (30 jours et plus à l'hôpital) de ceux qui sont hospitalisés est de 4,0 % à 18,0 %, tout âge confondu (Prina et coll., 2015). La pneumonie peut être difficile à diagnostiquer chez les jeunes enfants puisqu’elle ressemble à la bronchiolite. En effet, toutes deux sont courantes
4
et leurs caractéristiques se chevauchent (McIntosh, 2002). De plus, des spécimens des voies respiratoires inférieures ne sont pas facilement disponibles chez les enfants (Wallihan et Ramilo, 2014).
Petit et coll. ont estimé l'incidence de la pneumonie et les IPP chez les enfants au Canada (2003). Les taux d'incidence estimés de plusieurs maladies associées au pneumocoque se retrouvent dans le Tableau 1. Le taux d'hospitalisation le plus élevé lié à une pneumonie de toutes causes est observé chez les 6 mois à 1 an (11,15 par 1000 p-a) et diminue pour chaque groupe d'âge, et ce, jusqu'à 9 ans, où l'étude s'arrête (0,75 par 1000 p-a). Le taux de pneumonie de toutes causes, non hospitalisée, présente une évolution similaire en commençant à 33,80 par 1000 p-a chez les enfants entre 6 mois et 1 an, et diminuant à 11,80 par 1000 p-a chez les enfants à 9 ans (Petit et coll., 2003).
Tableau 1 (reproduit de Petit et coll., 2003)
2.5 L’étiologie des pneumonies
La pneumonie acquise dans la communauté peut être due à plusieurs micro-organismes et il est souvent difficile de déterminer lequel exactement en est la cause (McIntosh, 2002; Rudan et coll., 2013). Chez les enfants, les tests de routine ne sont pas suffisamment sensibles ni spécifiques; il n'y a pas de test définitif, fiable et non invasif (McIntosh, 2002; Obaro et Madhi, 2006; ACIP, 2000; Michelow et coll., 2004). L'étiologie des cas est donc rarement déterminée (Wallihan et Ramillo, 2014).
Des spécimens biologiques doivent être prélevés pour déterminer l’étiologie de la pneumonie. Pour les diagnostics bactériens. Le prélèvement devrait idéalement provenir directement du tissu des poumons par aspiration à l'aide d'une fine aiguille (Rudan et coll., 2013). Les études qui prennent leurs spécimens directement des poumons de l'enfant trouvent des infections bactériennes dans 32 à 66 % des cas chez les moins de 15 ans
5
(Vuori-Holopainen et Peltola, 2001). Cependant, cette technique très invasive n'est souvent pas possible ou acceptable pour les professionnels de santé ou pour les patients et leur famille (McIntosh, 2002).
Des échantillons peuvent aussi être prélevés d'un exsudat dans la cavité pleurale ou d'une hémoculture, mais ces procédés présentent certains problèmes. L'hémoculture a une sensibilité limitée (Obaro et Madhi, 2006). Moins de 10 % d'enfants font une bactériémie avec la pneumonie, ce qui limite l’efficacité du prélèvement sanguin (Michelow et coll., 2004). Dans les cas où des pathogènes peuvent être isolés dans le sang, ceux-ci peuvent être différents des cultures isolées des poumons (Obaro et Madhi, 2006). Cela peut être difficile à interpréter (Rudan et coll., 2013).
L’analyse des crachats ou des prélèvements du nasopharynx est également une possibilité (Rudan et coll., 2013). Cependant, l'interprétation des résultats de ces prélèvements est complexe puisque plusieurs pathogènes peuvent être isolés dans ces zones (Rudan et coll., 2013; Esposito et coll., 2012). Le nasopharynx et l'oropharynx portent souvent des pathogènes potentiels, même si le sujet est en bonne santé (McIntosh, 2002). De plus, les enfants sont rarement capables de donner des crachats qui viennent d'assez profond, permettant l'isolation des pathogènes responsables de la maladie (McIntosh, 2002; Esposito et al., 2012).
Les résultats des examens radiologiques sont souvent utilisés pour diagnostiquer des pneumonies. Cependant, ces tests ne distinguent pas la pneumonie bactérienne de la pneumonie virale ni ne déterminent quelle bactérie particulière est responsable du cas (Obaro et Madhi, 2006). Les tests urinaires, qui détectent les antigènes du pneumocoque, sont souvent utilisés chez les adultes pour diagnostiquer les infections pneumococciques. Disponibles en 15 minutes, les résultats pour le pneumocoque ont une sensibilité adéquate et une spécificité élevée chez les adultes (Engel et coll., 2012). Cependant, chez les enfants, le test est incapable d'établir une distinction entre les cas de pneumonies pneumococciques et la colonisation du nasopharynx ou de l'oropharynx. En effet, étant donné que la colonisation se produit régulièrement chez les enfants, le test pour déterminer l'étiologie des cas bactériens dans cette catégorie d’âge devient peu fiable (Dowell et coll., 2001). 2.6 La co-infection
Des virus sont souvent détectés dans les cas de pneumonies. Les études utilisant des tests PCR en trouvent chez 88 % des enfants hospitalisés pour pneumonie acquise dans la communauté (Bonzel et coll., 2008). Les études utilisant la sérologie et des tests d'immunofluorescence directe ont montré que les virus sont la seule étiologie dans 19 à 33 % des cas chez les enfants (Michelow et coll., 2004; Virkki et coll., 2002; Moulin et coll., 2001). Ce taux est même plus élevé chez les moins de 2 ans (Michelow et coll., 2004; Virkki et coll., 2002).
6
Michelow et coll. ont fait une étude pour établir la présence de divers pathogènes dans les cas de pneumonies communautaires chez les enfants, et ce, à l'aide de plusieurs types de tests diagnostiques. Des 143 patients testés pour les virus, 65 (45 %) avaient une infection virale (2004).
Le taux d'incidence de la pneumonie virale le plus élevé est observé pendant les 2 premières années de vie où il atteint jusqu'à 80 % de cas de la pneumonie. L'incidence diminue avec l'âge et les pneumonies virales sont répertoriées dans environ un tiers des cas chez les plus de 5 ans (Esposito et coll., 2012; Virkki et coll., 2002). Cependant, la présence d'un virus peut ouvrir la porte à une infection bactérienne, et ces bactéries, dont le pneumocoque, sont responsables d'une proportion importante des pneumonies. Dans 23 % des cas, Michelow et coll. ont observé une co-infection bactérienne et virale et des bactéries dans 93 des 154 cas (60 %) (2004).
Comme le démontre l'étude de Michelow et coll., il est souvent possible d'isoler plusieurs pathogènes chez un même cas (Wallihan et Ramilo, 2014; Bonzel et coll., 2008). Certaines études ont trouvé des co-infections virales et bactériennes dans 30 % des pneumonies acquises dans la communauté chez les enfants (Michelow et coll., 2004; Virkki et coll., 2002). Il est toutefois impossible de déterminer quel pathogène a initié l'infection et lequel en a profité pour s'introduire dans les voies respiratoires inférieures (Esposito et coll., 2012). Plus il y a de tests effectués, plus le nombre de pathogènes trouvés augmente. Il est donc difficile et complexe d'interpréter leurs contributions à l'étiologie de la maladie (Rudan et coll., 2013). De plus en plus, cela représente un problème puisque les méthodes actuelles des laboratoires sont très sensibles et identifient plusieurs pathogènes potentiels concurrents dont les rôles ne sont pas clairs (Rudan et coll., 2013). Par ailleurs, le mécanisme par lequel plusieurs pathogènes interagissent pour causer des co-infections et des pneumonies reste inexpliqué (McIntosh, 2002).
Il est aussi important de se rappeler que le traitement antibiotique est souvent commencé tôt dans le cas des pneumonies, et ce, avant même le prélèvement des échantillons (Michelow et coll., 2004). Ainsi, l'étiologie bactérienne est souvent sous-estimée, quand elle n’est pas tout simplement impossible à déterminer. En raison de toutes ces difficultés, une partie importante des pneumonies n'est pas associée à une étiologie, surtout chez les enfants (Rudan et coll., 2013; Wallihan et Ramilo, 2014).
2.7 La proportion de la pneumonie pneumococcique
Même s'il est difficile d'estimer la proportion des pneumonies qui sont causées par le pneumocoque chez les enfants, de nombreuses publications estiment qu’il est la cause principale de la pneumonie acquise dans la communauté chez ce groupe d’âge (Esposito et coll., 2012; Heiskanen-Kosma et coll., 1998). Ces études estiment la proportion des hospitalisations pour pneumonie chez les enfants dans les pays développés comme
7
allant de 17 % à 44 % (McIntosh, 2002; ACIP, 2000; Michelow et coll., 2004; McCracken, 2000). En Europe, on estime que 35 % (12 % à 68 %) des cas de pneumonies acquises dans la communauté sont causés par le pneumocoque (Drijkoningen et Rohde, 2014). Dans une étude réalisée en Finlande, Juvén et coll. ont constaté la présence du pneumocoque chez 37 % des enfants de moins de 17 ans hospitalisés pour une pneumonie acquise dans la communauté (2000). Aux États-Unis, en 1996 et en 1997, une étude de Wubbel et coll. a révélé des résultats positifs pour des infections pneumococciques chez 27 % des 168 enfants ambulatoires de moins de 17 ans ayant été hospitalisés pour une pneumonie acquise dans la communauté (1999). Dans l'étude internationale (américaine et européenne) de Michelow et coll., des maladies pneumococciques ont été détectées dans 73 % des cas avec une infection bactérienne, dans 56 % de tous les cas où un pathogène était confirmé et dans 44 % de tous les cas chez les moins de 17 ans (2004).
À l’aide des bases de données des autorités sanitaires provinciales, Petit et coll. ont estimé qu’au Canada, le risque cumulatif de présenter une pneumonie pneumococcique entre 6 mois et 9 ans était de 1 sur 20 (2003). Le taux d’incidence de la pneumonie pneumococcique hospitalisée était de 2,45 par 1000 p-a chez les enfants de 6 mois à 1 an (voir le Tableau 1). De là, le taux d’incidence diminuait jusqu’à l’âge de 9 ans où il était de 0,17/1000 p-a (Petit et coll., 2003), au même titre que celui de la pneumonie pneumococcique non hospitalisée qui était estimé à 7,44/1000 p-a chez les enfants de 6 mois à 1 an et diminuait à 2,60/1000 p-a chez les enfants de 9 ans (Petit et coll., 2003).
2.8 Les vaccins contre le pneumocoque
En 1983, un vaccin polysaccharidique 23-valent contre le pneumocoque (PPV-23) a été homologué aux États-Unis. Son efficacité vaccinale contre les IIP chez les adultes en bonne santé est estimée entre 60 et 80 %. Cependant, les réponses immunitaires chez les enfants de moins de 2 ans sont inconsistant. Le vaccin n’est donc pas recommandé (ACIP, 1997; Melegaro et Edmunds, 2004). Le vaccin PPV-23 induit une réponse immunitaire indépendante des cellules T qui est peu développée chez les jeunes enfants. Il n’est donc pas assez immunogène chez ce groupe d’âge. Ce vaccin a également peu d’impacts sur la présence du pneumocoque dans le nasopharynx (ACIP, 2000). Bref, le PPV-23 ne protège pas assez les groupes les plus à risque de contracter les maladies pneumococciques, tels les enfants. Les vaccins conjugués anti-pneumococciques (VCP) ont été développés pour pallier ces carences (WHO, 2009; Wallihan et Ramilo, 2014).
Les VCP couplent des polysaccharides capsulaires provenant de certains sérotypes à une protéine porteuse. Ce processus rend le vaccin capable de stimuler une réponse immunitaire puissante chez les enfants (Edwards et Griffin, 2003). Des essais randomisés cliniques ont montré que les VCP sont efficaces dans la
8
prévention des IIP, de la pneumonie et de l’otite chez les enfants vaccinés (Black et coll., 2002; Eskola et coll., 2001; Black et coll., 2000; Cutts et coll., 2005; Klugman et coll., 2003; Prymula et coll., 2006). De nombreuses études ont aussi montré que les VCP réduisent le portage des souches des sérotypes présents dans les vaccins, et ce, dans l’oropharynx et le nasopharynx chez les vaccinés (O’Brien et al., 2008). Les VCP permettent toutefois l’augmentation de la colonisation des sérotypes non présents dans les vaccins. La prévalence du portage du pneumocoque demeure donc pratiquement inchangée (Davis et al., 2013). Cependant, la réduction de la colonisation nasopharyngée par les sérotypes inclus dans les vaccins permet de réduire la transmission interhumaine et produit l’immunité de groupe contre les sérotypes parmi les plus virulents (ACIP, 2000; O’Brien et Dagan, 2003; Dagan et coll., 2002; Fitzwater et coll., 2012).
Le premier VCP homologué, le VCP-7, comprend des polysaccharides capsulaires des sérotypes 4, 6B, 9V, 14, 19F et 23F, ainsi que des oligosaccharides de 18C. Les polysaccharides et les oligosaccharides sont couplés à une variante non toxique de la toxine diphtérique (ACIP, 2000). Les anticorps produits en réponse au VCP-7 peuvent provoquer une réaction croisée avec quelques sérotypes qui ne figurent pas dans le vaccin comme les sérotypes 5 et 6A (Whitney et coll., 2006). Il était estimé que les 7 sérotypes inclus dans le VCP-7 combinés avec les sérotypes à réaction croisée représentaient 85 % de la bactériémie pneumococcique, 83 % de la méningite pneumococcique et 65 % de l’otite pneumococcique aux États-Unis chez les enfants ayant moins de 6 ans entre 1978 et 1994 (Butler et coll., 1995). Les sérotypes inclus dans le VCP-7 étaient aussi les sérotypes les plus associés à la résistance aux antibiotiques aux États-Unis (ACIP, 2000). Ce vaccin a été permis au Canada en 2001 et a fait partie d’un programme de vaccination systématique au Québec à partir de 2004 (Poirier et coll., 2009).
Le VCP-10 contient tous les sérotypes du VCP-7, mais aussi les sérotypes 1, 5 et 7F (Tin Tin Htar et coll., 2015). Il présente toutefois des protéines porteuses différentes du VCP-7 et du VCP-13. En effet, les siennes sont des variantes non toxiques de la toxine diphtérique ainsi que de la protéine D du Haemophilus influenzae et de la toxine tétanique (Palmu et coll., 2013). Quant au VCP-13, il contient toutes les souches du VCP-10, ainsi que les sérotypes 3, 6A et 19A (CDC, 2010).
2.9 Le programme vaccinal au Québec
Le VCP-7 a rapidement été mis à disposition sur le marché privé après qu'il eut été homologué en mai 2001 au Canada (Butler et coll., 1995). Au Québec, le vaccin a été offert aux enfants à risque élevé et aux résidents des deux régions du nord du Québec, dès octobre 2002, grâce à un programme gouvernemental (Butler et coll., 1995; Crisinel et coll., 2010). Quatre doses étaient recommandées, selon le calendrier 3 + 1 (2, 4, 6 et 12
9
à 18 mois), conformément aux directives du Comité consultatif national de l'immunisation (Butler et coll., 1995; Crisinel et coll., 2010; De Wals et coll., 2009; CSQ, 2005). En décembre 2004, le VCP-7 a été offert à tous les moins de 5 ans dans le cadre d'un régime universel de soins de santé. Un calendrier 2 + 1 (2, 4 et 12 mois) était recommandé pour la vaccination systématique de tous les enfants peu vulnérables (Butler et coll., 1995; Crisinel et coll., 2010; De Wals et coll., 2009; CSQ, 2005). Goldblatt et coll. ont montré que la réponse immunitaire d'une série primaire de 2 doses de VCP-7 était comparable à la réponse d'une série primaire de 3 doses (2006). Pour la vaccination de rattrapage, deux doses de la vaccination de rattrapage étaient suggérées pour les enfants de 12 à 23 mois et une dose pour les 2 à 5 ans (Crisinel et coll., 2010; De Wals et coll., 2009). Avant l’implantation du programme universel, la couverture vaccinale était de moins de 20 % chez les enfants ayant moins de 5 ans. Le taux a augmenté à 90 % après l'autorisation de la gratuité (Crisinel et coll., 2010; De Wals et coll., 2009). Le VCP-10 a été homologué au Canada en décembre 2008 (HC, 2009). Le Québec a commencé à l'utiliser au cours de l'été 2009 en remplacement du VCP-7 dans le programme de vaccination des enfants, sans rattrapage (De Wals et coll., 2014). De même, le VCP-13 a remplacé le VCP-10 sans rattrapage, en janvier 2011, après qu'il eut été homologué au Canada en décembre 2010 (De Wals et coll., 2014; HC, 2010). La vaccination avec le VCP-10 et le VCP-13 a conservé le calendrier 2 + 1 (2, 4 et 12 mois) (De Wals et coll., 2014).
2.10 Les programmes de vaccination des VCP contre les IIP
Feikin et coll. ont fait une méta-analyse combinée de 21 banques de données provenant principalement de pays développés, dont 19 examinaient l'effet sur les moins de 5 ans. Cette étude a examiné les effets sur les IIP des programmes de vaccination systématique avec les VCP où au moins 70 % de la couverture vaccinale était atteint à l’âge de 12 mois (Feiken et coll., 2013). Les chercheurs ont mesuré l'effet des programmes sur les IIP causées par les sérotypes présents dans les VCP, les IIP causées par les sérotypes non présents dans les VCP et les IIP causées par tous les sérotypes pendant les 7 ans après l'introduction des programmes de vaccination. Chez les moins de 5 ans, les IIP causées par tous les sérotypes diminuaient rapidement et significativement après l'implantation des programmes de vaccination par rapport au nombre de cas attendus. Les RR (IC à 95 %) étaient de 0,55 (0,46 à 0,65), 0,43 (0,34 à 0,54), 0,44 (0,35 à 0,55), 0,33 (0,23 à 0,46), 0,48 (0,37 à 0,61), 0,41 (0,35 à 0,50) et 0,49 (0,35 à 0,68) de la 1ère à la 7e année respectivement (Feiken et coll., 2013). Les IIP causées par les
sérotypes non retrouvés dans les VCP ont toutefois augmenté au cours de cette période. Cependant, cet effet était moins important que la diminution des IIP causées par les sérotypes dans les VCP. Selon Freiken et coll. les VCP contenant plus de sérotypes devraient éviter le remplacement des sérotypes dans le VCP-7 par d’autres puisque plusieurs des sérotypes causant des IIP sont inclus dans le 10 et le 13, mais pas dans le VCP-7 (2013).
10 2.11 Les VCP contre la pneumonie chez les enfants
Dans l'essai contrôlé randomisé du VCP-7 de Northern California Kaiser Permanente, les chercheurs ont obtenu des résultats sans ambiguïté qui ont montré l'efficacité du vaccin contre les IIP chez les enfants vaccinés (Black et coll., 2000). Cependant, les résultats concernant les pneumonies de toutes causes étaient moins clairs. Dans les analyses en « intention de traiter », Black et coll. ont trouvé que le VCP-7 a eu une efficacité vaccinale (EV) de 10,3 % (IC à 95 % de 1,6 à 18,2) contre les pneumonies cliniques où une radiographie a été faite chez les enfants ayant moins de 24 mois (Black et coll., 2002). Cependant, contre les pneumonies cliniques confirmées radiologiquement, ils ont observé une EV de 22,7 % (IC à 95 % de 8,7 à 34,5) chez les enfants au même âge. Pour la pneumonie clinique avec des radiographies montrant seulement des infiltrats périhilaires, l’EV était de 3,9 % (IC à 95 % de -27,2 à 27,4), alors que contre la pneumonie clinique de toutes causes, l’EV était de 6,9 % (IC à 95 % de -0,3 à 13,6) (Black et coll., 2002). Les chercheurs n'ont pas trouvé de résultats statistiquement ou cliniquement significatifs chez les enfants ayant entre 24 et 60 mois, sauf pour la pneumonie clinique avec des radiographies montrant seulement des infiltrats périhilaires où ils ont obtenu des résultats cliniquement, mais non statistiquement, significatifs avec une EV estimée de 32,4 % (IC à 95 % de -14,7 à 60,2) (Black et coll., 2002).
Patrzałek et coll. ont fait une étude comparant les taux d’incidence de pneumonie confirmée avec une radiographie avant et après l'introduction d'un programme de vaccination systématique du VCP-7 en 2006 en Pologne (Patrzałek et coll., 2010). Le taux de vaccination du programme était environ 99 %. Ils ont observé qu'en 2004 et 2005 (avant l'introduction du programme de vaccination systématique) le taux d'incidence de pneumonie confirmée avec une radiographie était de 41,32 par 1000 p-a chez les enfants de 0 à 1 an et de 6,11 par 1000 p-a chez les enfants de 2 à 4 ans. En 2007, soit un an après l'introduction du programme de vaccination systématique en 2006, ces taux d'incidence sont passés à 15,00 par 1000 p-a et à 4,73 par 1000 p-a, réspectivement. Cela signifie une réduction de 65 % (p<0,0000001) chez les enfants de 0 à 1 an et de 23 % chez les enfants de 2 à 4 ans (p=0,01) (Patrzałek et coll., 2010).
Grijalva et coll. ont fait une analyse de séries temporelles, de 1997 à 2004, qui a examiné l'effet de l'introduction du VCP sur les hospitalisations causées par des pneumonies chez les enfants aux États-Unis (2007). À la fin de 2004, le taux d’incidence de pneumonie de toutes causes chez les enfants ayant moins de 2 ans a été réduit de 39 % (IC à 95 % de 22 à 52) par rapport à 2000, année précédant l'introduction des VCP. Chez les enfants de 2 à 4 ans, la réduction était de 17 % (IC à 95 % de -3 à 34) (Grijalva et al., 2007).
De Wals et coll. ont fait une étude sur l'épidémiologie de la pneumonie de toutes causes au Québec pendant une période de 9 ans. L'étude a commencé avant l'introduction du VCP-7, puis a porté sur la période où
11
le vaccin était seulement disponible sur le marché privé, ensuite la période où le programme de vaccination systématique a commencé à être implanté et, finalement, la période où le programme de vaccination était complètement implanté (De Wals et coll., 2008a). Ils ont constaté que la fréquence de la pneumonie pendant la période de 19 mois lors de laquelle le VCP-7 était seulement disponible sur le marché privé ne différait pas substantiellement de la fréquence de la pneumonie avant que le vaccin ne soit disponible (De Wals et coll., 2008a). Lorsque le vaccin a été offert gratuitement pour les enfants à risque élevé, une baisse de la fréquence de la pneumonie lobaire de 22 % a été observée, mais une augmentation de 4,2 % de la pneumonie non spécifiée a été observée en même temps (De Wals et coll., 2008a). Pendant la période de 24 mois de l'implantation du programme de vaccination systématique et du programme de rattrapage pour les enfants ayant moins de 5 ans, une baisse de 72,3 % de la pneumonie lobaire, une augmentation de 22,8 % de la pneumonie non spécifiée et une réduction de 13,2 % de la pneumonie de toutes causes ont été observées par rapport au nombre de cas attendus. Après la pleine application du programme de vaccination systématique, les chercheurs ont noté une réduction de 69,4 % de la pneumonie lobaire et de 8,2 % de la pneumonie de toutes causes chez les enfants ayant moins de 2 ans. Chez les 2 à 4 ans, ces réductions étaient respectivement de 75,8 % et de 19,0 % (De Wals et coll., 2008a).
Dans cette étude, le taux d'incidence global des hospitalisations ayant pour causes des pneumonies était de 7,4 par 1000 p-a chez les moins de 5 ans. Chez les enfants de moins d'un an, le taux d'hospitalisations était de 10,4/1000. Il était respectivement à 12,1/1000 et à 5,1/1000 pour les enfants âgés de 1 an et de 2 à 4 ans (De Wals et coll., 2008a). Au total, 1,7 % des cas ont été admis aux soins intensifs, mais cette proportion diminuait avec l'âge. Il y avait aussi un effet de saisonnalité marqué avec un pic de cas en hiver. La pneumonie non spécifiée représentait 55,3 % des 25 319 cas de pneumonies; la pneumonie lobaire représentait quant à elle 32,2 % des cas; la pneumonie virale 6,4 % (De Wals et coll., 2008a). Les hospitalisations mensuelles liées à la pneumonie de toutes causes ont diminué régulièrement d'avril 2004 à mars 2006, soit à la fin de l'étude, pour tous les groupes d'âge de moins de 5 ans.
12
3. Hypothèses et objectifs
L'hypothèse de recherche est que l'introduction de la vaccination systématique avec le VCP-7 au Québec en 2004 a réduit le taux d'incidence de la pneumonie de toutes causes chez les enfants entre 6 mois et 5 ans et que le passage au vaccin 10-valent et ensuite 13-valent a entraîné une réduction supplémentaire du taux d’incidence.
L'objectif général est de décrire l'épidémiologie et le fardeau de la pneumonie de toutes causes nécessitant une hospitalisation chez les enfants entre 6 mois et 5 ans, selon les programmes de vaccination avec les différents VCP. Les objectifs spécifiques sont :
– Décrire l’incidence et la distribution des pneumonies, des bronchites, des bronchiolites, des empyèmes et des pleurésies nécessitantes une hospitalisation chez les enfants entre 6 mois et 5 ans au Québec entre le 1er avril 2000 et le 31 mars 2014, et ce, en fonction des programmes de vaccination avec des VCP, des
cycles saisonniers et de l'âge.
– Examiner le fardeau des pneumonies de toutes causes, des bronchites, des bronchiolites, des empyèmes et des pleurésies : la fréquence des hospitalisations, des admissions aux soins intensifs et des décès ainsi que la durée des hospitalisations et des soins intensifs chez les enfants entre 6 mois et 5 ans au Québec entre le 1er avril 2000 et le 31 mars 2014 en fonction de la vaccination avec des VCP, des cycles
saisonniers et de l'âge.
– Évaluer l'impact des programmes de vaccination avec des VCP sur le fardeau des pneumonies de toutes causes, des bronchites, des bronchiolites, des empyèmes et des pleurésies en décrivant le changement de l’incidence et la distribution des maladies avant et pendant les programmes de vaccination : la fréquence des hospitalisations, des admissions aux soins intensifs et des décès ainsi que la durée des hospitalisations et des soins intensifs chez les enfants entre 6 et 59 mois au Québec entre le 1er avril 2000 et le 31 mars
13
4. Méthodes
Les cas analysés ont été identifiés rétrospectivement dans Med-Écho, la base de données administrative des sorties d’hôpital de la Régie de l’assurance maladie du Québec (RAMQ) qui couvre toutes les admissions aux services de soins aigus au Québec. Nous avons pris en considération toutes les hospitalisations des enfants de 6 à 59 mois ayant une date d’admission entre le 1er avril 2000 et le 31 mars 2015 et ayant un diagnostic principal ou
un premier diagnostic secondaire de pneumonie, de bronchiolite, de bronchite, d’empyème ou de pleurésie. Les hospitalisations des enfants de moins de 6 mois ont été exclues en raison de la présence importante d’infections associées à des causes périnatales et parce que les vaccins anti-pneumococciques ne visent pas cette tranche d’âge. Le 1er avril 2006, la codification de Med-Écho est passée de la CIM-9 à la CIM-10. Les données viennent
donc de deux bases de données avec deux systèmes de classification différents (les codes pertinents sont dans le Tableau 2).
Tableau 2 – Les codes de diagnostic inclus.
Pneumonie CIM-9 480.x, 481, 482.x, 483, 484.x, 485, 486, 487.0, CIM-10 J10.0, J11.0, J12.x, J13, J14, J15.x, J16.x, J17.x, J18.x Bronchiolite CIM-9 466.1 CIM-10 J21.x, J40 Bronchite CIM-9 466.0, 490, CIM-10 J20.x Empyème CIM-9 510.x CIM-10 J86.x Pleurésie CIM-9 511.x CIM-10 J90
Les deux bases de données ont été fusionnées et des variables ont été créées pour la pneumonie, la bronchiolite, la bronchite, l’empyème, la pleurésie et l’IVRI de toutes causes. De la base de données totale contenant 77 877 hospitalisations, 58 ont été exclues parce que la date d’admission était avant le 1er avril 2000.
De plus, les 1 833 hospitalisations ayant une date d’admission après le 31 décembre 2014 ont également été retirées parce que, dans la base de données de Med-Écho, seulement les cas qui sont sortis avant le 1er avril
2015 y figuraient. Cela a causé une diminution de taux fictive en 2015 parce que ceux qui ont été admis avant le 1 avril 2015, mais qui sont pas sortis avant le 1 avril n’étaient pas inclus dans la base de données.
Les données de Med-Écho étaient classées à l’aide d’un système d’identifiants personnels créés par la RAMQ afin de préserver l’anonymat des numéros de carte d’assurance maladie. Après l’élimination des
14
hospitalisations avant le 1er avril 2000 et après le 31 décembre 2014, 1 076 cas de plus ont été retirés parce que
l’identifiant personnel manquait, ce qui rendait impossible de savoir s’il s’agissait d’un transfert.
Toutes les hospitalisations d’une même personne ayant eu lieu à 7 jours ou moins d’un congé précédent (1542) ont été fusionnées en un seul épisode. La majorité des transferts avaient le même diagnostic, mais dans 260 cas, la personne avait plus d’un diagnostic principal pertinent (ce qui fait que les totales dans le tableau ### égal). Cela faisait donc un échantillon total de 73 368 hospitalisations pour notre étude.
Pour les dénominateurs de la population, nous avons utilisé les données des statistiques officielles de l’Institut de la statistique du Québec (ISQ). Cette base de données estime la population de tout âge, de toute l’année et de toutes les régions au Québec, à compter du 1er juillet 2015. La population des enfants de 6 à 11
mois a été estimée. Ces estimations annuelles ont été utilisées pour déterminer les estimations hebdomadaires pour chaque groupe d’âge. De plus, nous avons utilisé ces mêmes estimations pour calculer les taux d’incidences hebdomadaires et faire de meilleures estimations de la population annuelle. Dans notre étude, l’année commence le 1er avril et se termine le 31 mars, comme dans Med-Écho. Cependant, les estimations de la population ont été
faites le 1er juillet. Comme le nombre de personnes augmente chaque année au Québec, cela aurait sous-estimé
la population. Pour avoir de meilleures estimations pour l’année commençant le 1er avril, nous avons donc fait la
moyenne de toutes les estimations hebdomadaires de la population (en commençant le 1er avril).
Les taux d’incidence hebdomadaires des IVRI de toutes causes, de la pneumonie, de la bronchiolite, de la bronchite, de l’empyème et de la pleurésie comme diagnostic principal ont été calculés. Les semaines des CDC ont été utilisées. Nous avons calculé le nombre total d’hospitalisations, le pourcentage des cas admis aux soins intensifs, la durée moyenne des hospitalisations (pour tous les cas, seulement les cas admis aux soins intensifs et seulement les cas non admis aux soins intensifs), la mortalité, la létalité et les taux d’incidence pour toutes les maladies en diagnostic principal ainsi qu’en diagnostic secondaire primaire. Ces calculs ont été faits, selon l’âge (6 à 11 mois, 1, 2, 3 et 4 ans), le groupe d’âge (6 à 23 mois, 24 à 59 mois), le sexe, l’année, le mois et la période d’immunisation (avril 2000 à mai 2001, juin 2001 à sept. 2002, oct. 2002 à nov. 2004, déc. 2004 à déc. 2005, janv. 2006 à mai 2009, juin 2009 à déc. 2010, janv. 2011 à janv. 2015).
Dans les calculs par année, la dernière année utilisée a été 2013-2014 puisqu’il s’agissait de la dernière année avec des données complètes. Étant donné que les IVRI ont des incidences hautement saisonnières, l’inclusion des années incomplètes (2014-2015) aurait faussé les calculs.
15
Des tests de tendance de Cochran-Armitage ont été réalisés pour établir les tendances annuelles de proportions. Des modèles de régression de Poisson ont été réalisés pour tester les tendances annuelles des taux d’incidence. Les tendances séculaires de la moyenne des durées d’hospitalisation ont été testées avec des modèles de régression linéaire. La signification statistique a été définie comme des probabilités ≥ 0,05 (bilatéral). Pour réaliser les analyses de sensibilité, les 1 076 cas sans identifiant personnel ont été réintégrés dans les calculs des taux d’incidence et des analyses de tendance. Toutes les analyses statistiques ont été effectuées avec le logiciel SAS 9,4 (SAS Institute, Cary, NC).
Le protocole d’étude a été approuvé par le Comité d’éthique en recherche du Centre hospitalier universitaire de Québec.
16
5. Résultats
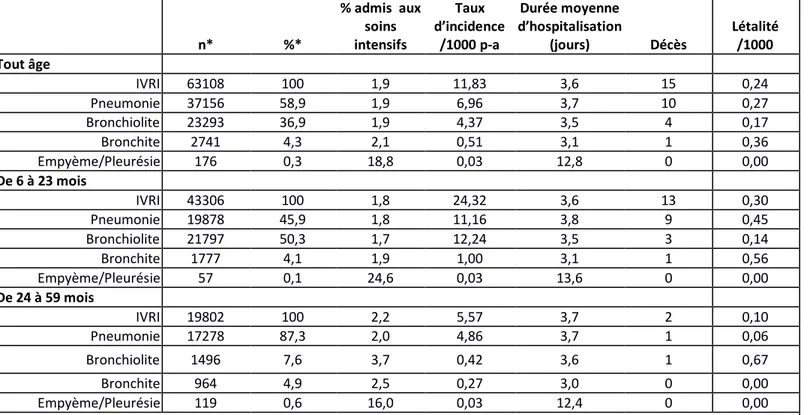
Un total de 63 108 cas a été analysés. De toutes les hospitalisations liées à une IVRI, 58,9 % étaient diagnostiquées comme des pneumonies, 36,9 % comme des bronchiolites, 4,3 % comme des bronchites et 0,3 % comme des empyèmes ou des pleurésies. Chez les enfants de 6 à 23 mois, la bronchiolite était le diagnostic le plus fréquent (50,3 %), suivi de la pneumonie (45,9 %). Chez les enfants de 2 à 4 ans, la pneumonie (87,3 %) était plus fréquente que la bronchiolite (7,6 %).
Le fardeau des hospitalisations, l'admission aux soins intensifs, la durée d’hospitalisation et la létalité figurent dans le Tableau 3. Les hospitalisations ayant pour cause une IVRI étaient plus fréquentes chez les enfants de 6 à 23 mois (11,16/1000 p-a) que chez les 24 à 59 mois (4,86/1000 p-a). De tous les cas, 1,9 % ont été admis aux soins intensifs, et cette proportion n’était pas influencée par l’âge ni la catégorie de diagnostic, à l’exception de l'empyème et de la pleurésie. La moyenne des durées d’hospitalisations était 3,6 jours. Seulement 15 décès ont été observés (une létalité de 0,24/1000 cas).
Tableau 3 – Fardeau des hospitalisations des IVRI chez les enfants de 6 à 59 mois au Québec hospitalisés entre le 1er
avril 2000 et le 31 décembre 2014. n* %* % admis aux soins intensifs Taux d’incidence /1000 p-a Durée moyenne d’hospitalisation (jours) Décès Létalité /1000 Tout âge IVRI 63108 100 1,9 11,83 3,6 15 0,24 Pneumonie 37156 58,9 1,9 6,96 3,7 10 0,27 Bronchiolite 23293 36,9 1,9 4,37 3,5 4 0,17 Bronchite 2741 4,3 2,1 0,51 3,1 1 0,36 Empyème/Pleurésie 176 0,3 18,8 0,03 12,8 0 0,00 De 6 à 23 mois IVRI 43306 100 1,8 24,32 3,6 13 0,30 Pneumonie 19878 45,9 1,8 11,16 3,8 9 0,45 Bronchiolite 21797 50,3 1,7 12,24 3,5 3 0,14 Bronchite 1777 4,1 1,9 1,00 3,1 1 0,56 Empyème/Pleurésie 57 0,1 24,6 0,03 13,6 0 0,00 De 24 à 59 mois IVRI 19802 100 2,2 5,57 3,7 2 0,10 Pneumonie 17278 87,3 2,0 4,86 3,7 1 0,06 Bronchiolite 1496 7,6 3,7 0,42 3,6 1 0,67 Bronchite 964 4,9 2,5 0,27 3,0 0 0,00 Empyème/Pleurésie 119 0,6 16,0 0,03 12,4 0 0,00
19
Presque 2 % des cas de pneumonies ont été admis aux soins intensifs. Cette proportion a augmenté de façon générale pendant la période étudiée (Figure 1; p=0,0029). La moyenne de la durée d’hospitalisation
liée à la pneumonie était 3,7 jours et la valeur médiane était 3,0 jours. Cette moyenne a diminué pendant la période d'étude (p<0,0001). Dans l’ensemble, 87 % de toutes les hospitalisations ont duré moins de 6 jours. La moyenne de la durée d’hospitalisation des enfants admis aux soins intensifs avec un diagnostic principal était de 10,0 jours. Ceux admis seulement à une unité de soins pédiatriques généraux ont été hospitalisés en moyenne 3,6 jours (Figure 2).
Des 23 293 cas de bronchiolites, 21 797 (93,6 %) se sont produits chez les enfants de 6 à 23 mois. Le taux d’incidence pour tous les âges s’élevait à 4,37/1000 p-a. Chez les enfants de 6 à 23 mois, le taux passait à 12,24/1000 p-a. La moyenne de la durée d’hospitalisation à cause de la bronchiolite était 3,5 jours et 1,9 % des hospitalisations a compris un séjour aux soins intensifs.
Des 2 741 cas de bronchites, 1 777 (64,8 %) ont été observés chez les enfants de 6 à 23 mois. Le taux d’incidence se chiffrait à 0,51/1000 p-a pour tous les âges et à 1,00/1000 p-a chez les enfants de 6 à 23 mois.
Le taux d’incidence des hospitalisations en raison de l'empyème et de la pleurésie combinés était de 0,03/1000 p-a chez les deux groupes d'âge. Moins d’un cinquième de ces cas (18,8 %) ont été admis aux soins intensifs et la moyenne du séjour était 12,8 jours pour tous les cas (20,3 jours pour ceux admis aux soins intensifs; 11,1 jours pour ceux non admis aux soins intensifs). Le test de tendance était non significatif au seuil 5% (p=0,4233).
En ce qui concerne les décès, 10 ont été observés chez les patients hospitalisés à cause d’une pneumonie, dont 9 chez les moins de 2 ans. Cela représente une létalité de 0,27/1000 pour la pneumonie. De plus, 4 décès ont été enregistrés chez les cas de bronchiolites. Aucun décès n’a été observé parmi les cas d'empyèmes ou de pleurésies. La majorité de décès s’est produite chez les enfants souffrant d’affections graves expliquant cette issue fatale. En raison de la grande variabilité due à un petit échantillon, il était impossible de tester les tendances de la létalité.
20
Pendant la période étudiée, des tendances générales de réduction du taux d’incidence de la pneumonie, de la bronchiolite et des IVRI, tous âges confondus, ont été observées (Figure 4; p<0,0001 pour les 3 diagnostics). Des tendances à la baisse ont aussi été constatées pour la pneumonie et les IVRI chez les deux groupes d'âge, ainsi qu’une baisse pour la bronchiolite chez les enfants de 6 à 24 mois (Figure 5; p<0,0001). Cependant, le taux d’incidence de la bronchiolite chez les enfants de 24 à 59 mois a augmenté (p=0,0017). La tendance de la moyenne du risque relatif annuel était de 0,9838 (IC de 95 % 0,9819 à 0,9857), de 0,9818 (0,9793 à 0,9843) et de 0,9871 (0,9840 à 0,9903) pour toutes les IVRI, la pneumonie et la bronchiolite, respectivement, pour tous les âges. Chez les enfants de 6 à 23 mois, nous avons observé une moyenne de 0,9843 (0,9820 à 0,9867), de 0,9846 (0,9811 à 0,9880) et de 0,9847 (0,9814 à 0,9880). Tandis que chez les enfants ayant 24 à 59 mois, nous avons trouvé une moyenne de 0,9821 (0,9787 à 0,9855), de 0,9784 (0,9748 à 0,9821) et de 1,0206 (1,0077 à 1,0338), pour les mêmes maladies.
En incluant dans l’analyse les cas sans NAM, la fréquence des hospitalisations pour IVRI, pneumonie ou bronchiolite se modifie que très peu : 12,01/1000 p-a contre 11,83, 7,05 contre 6,96 et 4,45 contre 4,37, respectivement. Les pentes de régression de Poisson du taux par année restent statistiquement significatives et sans grand changement (p<0,000 1) : 0,9824 (IC à 95 % 0,9805 à 0,9843), 0,9807 (0,9782 à 0,9832) et 0,9851 (0,9819 à 0,9882), respectivement.
21
Le taux d’incidence hebdomadaire des IVRI, de la pneumonie et de la bronchiolite est illustré à la Figure 6. Ce graphique montre les fluctuations saisonnières du taux d’incidence pour les trois maladies. On voit que le nombre de tests d’influenza A et B et de VRS a augmenté grandement vers la fin de l’étude. Cependant, il n’y a pas d’effet évident après l’introduction du VCP-7, du VCP-10 ou de VCP-13.
25
6. Discussion
Dans notre étude, nous observons d’abord une réduction graduelle de la fréquence des hospitalisations pour une IVRI, durant les années 2000-2014, puis une réduction plus importante pour les infections causées par une pneumonie que par une bronchiolite. Les diminutions sont décelables dès 2002, c’est-à-dire avant l’introduction du programme de vaccination universelle des enfants avec le VCP-7, en décembre 2004.
Plusieurs facteurs peuvent avoir joué un rôle dans cette diminution, et il convient d’évoquer les différentes hypothèses. Une première explication potentielle est la diminution du tabagisme. La prévalence de la cigarette dans la population du Québec est passée de 28,2 % à 17,1 % entre 2000 et 2013 (Ried et coll., 2015). L’exposition à la fumée du tabac est un facteur de risque reconnu des maladies respiratoires chez les jeunes enfants (Cheraghi et Salvi, 2009).
Un autre élément d’explication pourrait être la variation du niveau de pollution atmosphérique, un facteur de risque des maladies respiratoires chez les jeunes (Anderson et coll., 2012). Des analyses faites par Statistique Canada à l’aide des données du Programme national de la pollution de l’air montrent des diminutions dans les concentrations annuelles moyennes du dioxyde de soufre, du dioxyde d’azote et des composés organiques volatils, de 1999 à 2013, dans le sud du Québec. Toutefois, il existe une stabilité de concentrations annuelles moyennes d’ozone, tandis que les concentrations annuelles des particules fines ont en fait augmenté durant la même période (ECCC, 2012). Il existe une grande variabilité géographique dans les niveaux de pollution atmosphérique et ces variations de moyennes nationales reflètent mal le niveau de risque d’une population tout entière.
L’épidémiologie des virus respiratoires doit également être examinée. Au Québec, il existe des données de surveillance des infections causées par les virus de l’influenza A et B, depuis 2000, et le virus respiratoire syncytial (VRS), depuis 2001 (Zhou et coll., soumis publication). De manière générale, la fréquence des tests de diagnostic liés à un virus respiratoire a augmenté au fil des ans. De plus, il y a eu une évolution dans le type et la sensibilité des tests. Tandis que le nombre de cultures et de tests de détection antigénique est resté relativement stable, la fréquence des tests d’amplification des acides nucléiques par réaction en chaîne par polymérase (RCP) a fortement augmenté durant les dernières années. Tous ces facteurs doivent être pris en compte dans l’interprétation des données étant que le VRS cause les maladies respiratoires chez les jeunes (Jha et coll., 2016). Pour l’influenza, il existe une forte variabilité dans la fréquence hebdomadaire des tests positifs, tant au niveau du type de virus que de la date du pic hivernal, de l’intensité et de la durée des périodes d’activité élevée caractérisées par un pourcentage de tests positifs égaux ou supérieurs à 10 %. Les années 2009-2010 ont été
26
particulièrement atypiques avec un premier pic d’infections par le virus pandémique A (H1N1) au printemps 2009, un deuxième durant l’automne et une activité très réduite durant l‘hiver 2010. Toutes ces variations ne se retrouvent pas au niveau des hospitalisations pour les IVRI. Cela peut être expliqué par la faible contribution du virus de l’influenza dans les infections respiratoires sévères des jeunes enfants. Dans une étude écologique réalisée au Québec, il a été montré que l’influenza n’expliquait que 5 % de la variabilité de la fréquence des hospitalisations chez les enfants âgés de 3 à 23 mois, alors que le metapneumovirus humain expliquait 13 % et le VRS 34 % de la variabilité (Zhou et coll., 2016).
Une étude réalisée en Australie a observé que les hospitalisations pédiatriques pour un diagnostic clinique de bronchiolite étaient associées à un test positif pour le VRS dans 57 % des cas (Moore et coll., 2012). Concernant les hospitalisations pour pneumonie, il existait une plus grande diversité de tests microbiologiques positifs, mais la première cause était encore le VRS avec 26 %. Dans le système de surveillance des laboratoires sentinelles du Québec, en se limitant aux cultures virales et aux tests de détection antigénique, on observe une tendance à la baisse dans la proportion de tests positifs pour le VRS. En effet, de 19 % en moyenne en 2001, il diminue à 12 % en 2014 (Zhou et coll., soumis publication). Cela pourrait avoir contribué à la diminution des hospitalisations pour une IVRI, tel que mis en évidence dans notre étude, mais n’explique pas pourquoi la diminution est plus importante pour les pneumonies que pour les bronchiolites.
Finalement, nous ne possédons pas de statistiques couvrant la période d’étude pour de nombreux autres pathogènes respiratoires comme l’adénovirus, le picornavirus ou les virus para-influenza (Moore et coll., 2012). Il s’agit d’une limite importante de notre étude.
Des changements dans les pratiques cliniques et de codification pourraient également affecter les séries chronologiques. Le 1er avril 2006, la CIM-10 a remplacé la CIM-9 pour le codage des raisons d’hospitalisation
dans le Med-Écho. Cependant, tel qu’indiqué dans le Tableau 2, les catégories diagnostiques reprises dans nos analyses n’ont pas été affectées par ce changement parce que nous avons utilisé seulement les grandes catégories diagnostiques (la pneumonie, la bronchiolite etc) qui n’ont pas changé. L’application plus stricte des règles concernant l’obligation des résidents du Québec à produire des numéros d’assurance maladie (NAM) valides pour recevoir des soins pourrait expliquer pourquoi 2,0 % d’hospitalisations dans notre base de données avaient un NAM inconnu avant le 1er avril 2006, mais seulement 1,0 % après cette date. Ces cas ont été exclus
dans nos analyses. Toutefois, des analyses de sensibilité ont été faites pour mesurer l’importance de ce facteur et cela ne change pas les résultats de manière substantielle (7,05/1000 p-a contre 6,96 pour l’hospitalisation pour la pneumonie de tout âge).
27
La plus grande baisse des hospitalisations pour la pneumonie supérieure que pour la bronchiolite s’expliquerait potentiellement dans les pratiques de diagnostic clinique. Les manifestations cliniques de ces deux maladies peuvent parfois être confondues chez les jeunes enfants (Klig et Chen, 2003). Dans un contexte d’utilisation croissante des tests de diagnostic virologique et d’une prévalence très élevée de la vaccination contre les infections pneumococciques, qui est réputée prévenir la pneumonie et non la bronchiolite, il n’est pas impossible que certains cliniciens aient, au fil des ans, plus tendance à diagnostiquer la bronchiolite plutôt que la pneumonie en cas de présentation clinique équivoque. Cela pourrait entraîner une modification du ratio pneumonie/bronchiolite, ce qui a été effectivement constaté dans notre étude chez l’enfants de 24 à 59 mois (Figure 7).
La grande majorité des enfants vus dans les salles d’urgence pour une possible IVRI ne sont pas hospitalisés. Une étude réalisée dans l’état de Washington aux États-Unis a montré que la proportion de patients avec un diagnostic présomptif de pneumonie ayant été hospitalisés variait entre 12 % chez les enfants de moins d’un an et 4 % chez les 4 ans et plus (Nelson et coll., 2008). Une limite importante de notre étude est que des données valides sur les patients ayant reçu des soins ambulatoires ne sont pas disponibles pour l’ensemble de la période d’étude dans tout le Québec. Le fait que les taux d’hospitalisations et la durée moyenne des séjours à l’hôpital aient diminué pour les qui ne nécessitaient pas de soins intensifs, mais non pour les cas admis aux soins intensifs est une indication claire que les critères d'admission à l’hôpital se sont modifiés de manière progressive au fil des ans. Ce changement de pratique pourrait être associé à l’utilisation décroissante de l’antibiothérapie parentérale, au développement de la thérapie intraveineuse ambulatoire pour les enfants et à la mise en place d’une unité d’observation pour des soins de courte durée dans de nombreux hôpitaux (Moore and Bortolussi, 2011).
On peut aisément distinguer une période de non-utilisation ou de faible utilisation des vaccins pneumococciques, qui se termine en 2004, et une période de forte utilisation après cette date (De Wals et coll., 2009). Par contre, les limites des périodes subséquentes en fonction de différents vaccins ne sont pas évidentes. Au Québec, les passages du VCP-7 au VCP-10 et du VCP-10 au VCP-13 se sont faits de manière progressive en quelques semaines ou mois, mais sans rattrapage (De Wals et coll., 2014). Ainsi, de longues périodes sont caractérisées par la coexistence d’enfants ayant reçu différents vaccins ou une combinaison de vaccins. Qui plus est, à tout moment, l’exposition des jeunes enfants au pneumocoque est modulée par la présence d’enfants plus âgés qui ont reçu des vaccins différents. La dynamique de l’immunité de groupe et du remplacement est particulièrement complexe et peut difficilement être étudiée dans le cadre d’une série chronologique portant sur des catégories diagnostiques non spécifiques (Loo et coll., 2014; Hausdorff et Hanage, 2016).