Université Toulouse III - Paul Sabatier
U.F.R. P.C.A.
THESE
Présentée en vue de l’obtention du grade de docteur de l’Université Paul Sabatier
Spécialité : Chimie et Physico-Chimie des Eléments de Transition
Carole PAGES
Etude du comportement en solution de nanoparticules d'oxyde de
zinc préparées par voie organométallique : étude du milieu
réactionnel, chimie de surface et conditions d'organisation
Directeurs de thèse : André Maisonnat, Myrtil Kahn et Bruno Chaudret
Soutenance le 17 décembre 2007 devant la commission d’examen :
V. Paillard Professeur, Université Paul Sabatier, Toulouse, France. Président D. Frot Ingénieur de recherche, IFP, Rueil-Malmaison, France. Rapporteur P. Poulin Directeur de recherche, CRPP, Bordeaux, France. Rapporteur F. Ribot Chargé de recherche, Université Pierre et Marie Curie, Paris, France.
F. Demangeot Maître de conférence, CEMES, Toulouse, France.
A. Maisonnat Directeur de recherche, LCC, Toulouse, France.
M. Kahn Chargé de recherche, LCC, Toulouse, France.
B. Chaudret Directeur de recherche, LCC, Toulouse, France.
Laboratoire de Chimie de Coordination 205, route de Narbonne
Remerciements.
___________________________________________________________________________
MES REMERCIEMENTS
Je remercie tout d’abord, Myrtil, André et Bruno pour la gentillesse et la patience qu’ils
ont manifestées à mon égard durant ces trois ans. Merci à tous les trois pour m’avoir aidé et
guidé dans ce travail. Votre générosité m’a donné un plaisir immense à travailler à vos côtés.
Je tiens également à remercier Monsieur Frot et Monsieur Poulin d’avoir accepté d’être
rapporteurs de mon travail, et Monsieur Ribot et Monsieur Demangeot pour me faire l’honneur de
participer à mon jury, ainsi que, Monsieur Paillard pour avoir accepté d’être président de mon
jury de thèse.
Je remercie Joseph Sarrias, directeur de la société « Marion Technologies » localisée à
Verniolle (Ariège), pour les discussions scientifiques que nous avons pu avoir.
Merci à François Demangeot et à Pierre-Marie Chassaing pour votre enthousiasme, votre
générosité et votre compétence. Merci à Yannick Coppel, pour ton aide et pour avoir toujours
répondu présent pour discuter de mes travaux de thèse. Merci à Pierre Fau pour m’avoir guidé
dans le monde de la nanoélectronique. Merci à Magali Brunet pour les discussions que nous avons
pu avoir et pour tous les substrats que tu m’as toujours gentiment donnés.
Un grand merci aussi aux équipes L et O, permanents et non permanents (Myrtil, André,
Remerciements.
___________________________________________________________________________
Javier, Clément, Jordi, Mar, Vincent, Raymond, Victor, Rosa, Virginie, Jérôme et tous les autres)
pour votre générosité et pour la bonne ambiance qui règne dans le labo ; sans oublier les membres
de l’équipe localisés à l’INSA (Nancy, Lise-Marie, Fabien, Séb, Céline, Kat, Fred, ...) et les
services commun du LCC (IR : Corinne Routaboul, Diffraction des RX : Laure Vendier, RMN :
Yannick Coppel, TEMSCAN : Vincent Collière et Lucien Datas).
Enfin, je tiens aussi à remercier mes parents, ma famille toulousaine/ventenacoise et mes
amis, Mathieu et Gaëlle, Sylvie et Léandre, Serge et Valérie, Sandrine et Jean-Marc, Didier,
Stéphane, Laurent, Pierre, Karyne et bien d’autres, sans oublier mes p’tits chous Adrien et Denis,
Plan de la thèse : « Etude du comportement en solution de nanoparticules d'oxyde de zinc préparées par voie organométallique : étude du milieu réactionnel, chimie de surface et conditions d'organisation ».
___________________________________________________________________________
Plan de la thèse
Etude du comportement en solution de nanoparticules d'oxyde de
zinc préparées par voie organométallique : étude du milieu
réactionnel, chimie de surface et conditions d'organisation
Chapitre I : Insertion des objectifs dans le contexte
bibliographique
I. Les nanoparticules de ZnO, des matériaux à fort potentiel de développement
I.1. Bref regard sur l’essor des nanotechnologies ... …1
I.2. Généralités sur ZnO ... …3
I.2.1 Propriétés structurales ... …3
I.2.2 Structure électronique ... …4
I.2.3 Propriétés optiques ... …5
I.2.4 Propriétés électriques ... …7
I.2.5 Quelques exemples d’applications ... ..8
II. Les voies d’accès et les processus de formation des nanoparticules d’oxyde de zinc II.1. Bref aperçu sur les procédés de production industrielle de ZnO ... ..10
II.2. Développements récents sur la synthèse de l’oxyde de zinc ... ..11
II.3 Voies physiques ... .11
II.3.1 Méthode par évaporation/condensation/oxydation. ... .12
II.3.2 Méthode par dépôt chimique en phase vapeur ... .12
II.4 Voies chimiques ... .13
Plan de la thèse : « Etude du comportement en solution de nanoparticules d'oxyde de zinc préparées par voie organométallique : étude du milieu réactionnel, chimie de surface et conditions d'organisation ».
___________________________________________________________________________
II.4.2 Méthode par précipitation ... ……14
II.4.3 Méthode par voie organométallique ... ……15
II.4.4 Méthode par voie organométallique développée dans le groupe de recherche « Nanostructures et Chimie Organométallique » . ... ….. 16
II.4.4.1 Les nanoparticules d’oxyde d’étain ... …….17
II.4.4.2 Les nanoparticules d’oxyde d’indium ... …….18
II.4.4.3 Les nanoparticules d’oxyde de zinc ... …….19
III Description de mes objectifs de recherche... …….20
Références bibliographiques ... …….22
Chapitre II : Etudes par RMN du système précurseur
moléculaire/ligands stabilisants préalablement à la formation
des nanoparticules de ZnO
I. Introduction ... ...29II. Etudes par spectroscopies RMN 1H et RMN DOSY II.1 Etude de l’interaction [ZnCy2]/Amine ... ...30
II.1.1 Mise en évidence de la complexation de l’amine ... ...30
II.1.2 Mise en évidence de la réversibilité de la complexation de l’amine …...32
II.1.3 Mesure des coefficients d’autodiffusion des composantes du système par RMN DOSY ... ...36
II.2 Etude de l’interaction [ZnCy2]/acide carboxylique ... ...41
II.3 Etude de l’interaction [ZnCy2]/ amine/acide carboxylique ... ...43
II.3.1 Etude de l’interaction amine/acide carboxylique ... ...43
II.3.1.1 Apports de la spectroscopie RMN NOE et DOSY à la compréhension du système ... ...45
II.3.1.2 Apport de la RMN à l’étude de l’équilibre entre acide, amine et carboxylate d’ammonium ... ...51
Plan de la thèse : « Etude du comportement en solution de nanoparticules d'oxyde de zinc préparées par voie organométallique : étude du milieu réactionnel, chimie de surface et conditions d'organisation ».
___________________________________________________________________________
II.3.2 Etude du système [ZnCy2]/octylamine/0,5 acide oléique...55
III. Conclusion ... …...57
Références bibliographiques ... .... 58
Chapitre III : L’état de surface des nanoparticules de ZnO
I. Introduction ... ... 59II. Etudes RMN des nanoparticules d’oxyde de zinc II.1 Cas des nanoparticules de ZnO stabilisées par une amine ... ...60
II.1.1 Cas de nanoparticules stabilisées par l’octylamine ... ...60
II.1.2 Cas de nanoparticules stabilisées par l’hexadécylamine... ...71
II.2 Cas des nanoparticules de ZnO stabilisées par l’acide oléique ... ...72
II.3 Cas des nanoparticules de ZnO stabilisées par le couple amine/acide ... ...80
II.3.1 Cas du couple octylamine/acide oléique ... ...80
II.3.2 Cas du couple hexadécylamine/acide oléique ... ...89
III. Etudes physiques des nanoparticules d’oxyde de zinc-Etude par spectroscopie RAMAN III.1 Effet RAMAN ... ...90
III.2 Influence de la puissance de l’excitation ... ...92
III.3 Influence de la taille des nanoparticules ... ...93
III.4 Influence de la longueur de la chaine alkyle des ligands ... ...96
IV Conclusion ... ....102
Plan de la thèse : « Etude du comportement en solution de nanoparticules d'oxyde de zinc préparées par voie organométallique : étude du milieu réactionnel, chimie de surface et conditions d'organisation ».
___________________________________________________________________________
Chapitre IV : Relation solvant/ligand : relations
ligand-solvant/taille et forme des nanoparticules
I. Introduction ... ... 105
II. Synthèses et essais de croissance des nanoparticules de ZnO II.1 Effet de la labilité des ligands sur la croissance des nanoparticules ... ... 106
II.1.1 Travaux antérieurs : cas des nanoparticules stabilisées par une amine...106
II.1.2 Stabilisation par un acide carboxylique ...107
II.2 Influence de l’eau sur la croissance des nanoparticules ... ....108
II.2.1 Variation de la quantité d’eau ajoutée ... ….108
II.2.2 Variation de la vitesse d’introduction de l’eau ... ....111
II.3 Variation de la longueur de la chaîne alkyle du ligand ... ....114
II.4 Variation du mode opératoire sur la croissance des nanoparticules ... ....115
III. Organisations 2-D et 3-D de nanoparticules de ZnO ... ....115
IV. Conclusion ... ....120
Références bibliographiques ... ....121
Chapitre V : Caractérisations physico-chimiques des
nanoparticules de ZnO en solution : étude de l’organisation
I. Introduction sur les organisations de nanoobjets I.1 L’organisation de nanoobjets existe à l’état naturel ... ... 123I.2 Point bibliographique sur l’organisation de nanoobjets ... ... 123
Plan de la thèse : « Etude du comportement en solution de nanoparticules d'oxyde de zinc préparées par voie organométallique : étude du milieu réactionnel, chimie de surface et conditions d'organisation ».
___________________________________________________________________________
II. Etude du comportement en solution des nanoparticules de ZnO
stabilisées par des amines ou par des acides carboxyliques : influences du
solvant, de la concentration et des ligands ... ... 126
III. Etude du comportement en solution des nanoparticules de ZnO stabilisées par des couples amines/acides carboxyliques : influences du solvant, de la concentration et des ligands III.1 Influence de la concentration sur les systèmes ZnO//OA/OlAc/THF ………… 131
III.2 Influence de l’ajout d’acide sur les systèmes ZnO//OA/THF ... …..137
III.3 Influence de l’ajout d’amine sur les systèmes ZnO//OlAc/THF ... ....139
III.4 Influence de la longueur de la chaîne alkyle des ligands ... .. .141
III.5 Influence du solvant ... .. .144
III.6 Liaisons hydrogène et organisation des nanoparticules en solution... .. .147
IV. Conclusion ... .. 152
Références bibliographiques ... .. 153
Chapitre VI : Approche organométallique pour la synthèse de
couches d’oxydes métalliques sur substrats silicium : étude
préliminaire
I. Introduction ... .. 155II. Mode de conditionnement des substrats utilisés II.1 Décontamination et traitements hydroxylants des surfaces ... .. 156
II.1.1 Décontamination de la surface du substrat ... ...156
II.1.2 Traitements hydroxylants ... .. 157
II.2. Caractérisation des surfaces hydroxylées ... .. 160
Plan de la thèse : « Etude du comportement en solution de nanoparticules d'oxyde de zinc préparées par voie organométallique : étude du milieu réactionnel, chimie de surface et conditions d'organisation ».
___________________________________________________________________________
II.2.1.1 Caractérisation par angle de goutte après traitements
chimiques ... ...161
II.2.1.2 Caractérisation par angle de goutte après traitements plasma dioxygène ... ...162
II.2.2 Caractérisation par spectrographie infrarouge.. ... ... 163
III. Interaction entre substrats Si/SiO2 conditionnées et précurseurs organométalliques III.1 Mise en œuvre expérimentale ... ... 166
III.2 Caractérisations des dépôts effectués dans le cas du bis-cyclohexylzinc.. ... 167
III.2.1 Caractérisations des dépôts sur substrats conditionnés par traitement H2O2/H2SO4... ... 168
III.2.1.1 Apport de la microscopique électronique à balayage ... ....168
III.2.1.2 Apport de la spectrographie des électrons XPS et Auger ... ...170
III.2.2 Caractérisations des dépôts sur substrats conditionnés par traitement plasma dioxygène ... ... 174
III.3 Extrapolation au cas du tantale : étude de l’interaction entre le complexe [Ta=CHtBu(CH2tBu)3] et les substrats Si/ SiO2 hydroxylés... .... 176
IV. Conclusion ... ... 179
Références bibliographiques ... ... 180
Conclusion générale
... .... 181Chapitre VII : Partie expérimentale
I Réactifs chimiques utilisés I.1 Les solvants ... ... 183I.2 Les réactifs ... ... 183
I.2.1 Les sels métalliques ... ... 183
Plan de la thèse : « Etude du comportement en solution de nanoparticules d'oxyde de zinc préparées par voie organométallique : étude du milieu réactionnel, chimie de surface et conditions d'organisation ».
___________________________________________________________________________
I.2.2.1 Les acides carboxyliques ... ... 184
I.2.2.2 Les amines ... ... 184
I.2.2.3 Abréviations et formules chimiques ... .... 184
II. Techniques d’analyses II.1 Microcopie électronique à transmission .. ... ...185
II.2 Microcopie électronique à balayage ... ... 186
II.3 Techniques vibrationnelles ... ... 187
II.3.1. Spectroscopie infrarouge ... ... 187
II.3.2 Spectroscopie RAMAN ... ... 187
II.4 Techniques de diffusion ... ... 188
II.4.1 Diffusion de la lumière ... ... 188
II.4.2 Spectroscopie par RMN ... ... 190
II.5 Technique XPS (X-Ray Photoelectron Spectroscopy) ... ... 193
II.6 Technique du Karl-Fisher ... ... 194
II.7 Traitement thermique ... ... 194
II.8 Traitement par plasma O2 ... ... 194
III. Synthèses chimiques III.1 Synthèse du précurseur organométallique : [ZnCy2] ... ... 196
III.2 Synthèses de nanoparticules d’oxyde de zinc ... ....196
III.2.1 Synthèses par évaporation ... ....197
III.2.2 Synthèses par ajout d’eau ... ....199
III.2.3 Synthèses à l’aide d’un tube en U ... ....200
III.2.4 Synthèses à l’aide d’un pousse-seringue ... .. .201
III.2.5 Synthèses par ajout successif de précurseur ... ....202
III.2.6 Synthèse avec différentes quantités de ligand ... .. 203
III.2.7 Synthèses à haute et à basse températures ... .. 204
III.2.8 Synthèses avec l’acétate de zinc ... .. 205
III.2.9 Synthèses avec l’acétylacétonate de zinc ... .. 206
IV. Dépôt sur silicium ... .. 207
Chapitre I.
Insertion des objectifs dans le
contexte bibliographique
Plan du Chapitre I
I. Les nanoparticules de ZnO, des matériaux à fort potentiel de
développement
I.1. Bref regard sur l’essor des nanotechnologies ...1
I.2. Généralités sur ZnO ...3
I.2.1 Propriétés structurales ...3
I.2.2 Structure électronique ...4
I.2.3 Propriétés optiques ...5
I.2.4 Propriétés électriques ...7
I.2.5 Quelques exemples d’applications ...8
II. Les voies d’accès et les processus de formation des
nanoparticules d’oxyde de zinc
II.1. Bref aperçu sur les procédés de production industrielle de ZnO ... ..10II.2. Développements récents sur la synthèse de l’oxyde de zinc .. ..11
II.3 Voies physiques ...11
II.3.1 Méthode par évaporation/condensation/oxydation.12 II.3.2 Méthode par dépôt chimique en phase vapeur...12
II.4 Voies chimiques ...13
II.4.1 Méthode par sol-gel ...13
II.4.2 Méthode par précipitation ...14
II.4.3 Méthode par voie organométallique ...15
II.4.4 Méthode par voie organométallique développée dans le groupe de recherche «Nanostructures et Chimie Organométallique» . ... 16
II.4.4.2 Les nanoparticules d’oxyde d’indium ...18
II.4.4.3 Les nanoparticules d’oxyde de zinc ...19
III Description de mes objectifs de recherche ... 20
Chapitre I - Insertion des objectifs dans le contexte bibliographique.
___________________________________________________________________________
1
Dans ce chapitre, nous exposerons en quoi les nanoparticules et plus particulièrement, en quoi l’oxyde de zinc est à l’heure actuelle un matériau fort intéressant et prometteur tant par ses propriétés que par les applications qui s’y rattachent, puis, nous essayerons de montrer la richesse des modes de synthèses et les processus qui en découlent. Enfin, nous présenterons les dernières découvertes du groupe « Nanostructures et Chimie Organométallique » qui ont été à l’origine du sujet de recherche qui m’a été confié et que nous allons développer dans ce qui suit.
I.
Les nanoparticules de ZnO, des matériaux à fort potentiel
de développement
I.1. Bref regard sur l’essor des nanotechnologies
Un nanomètre, c'est un millionième de millimètre, soit 10-9 mètre. Ainsi, un homme mesure 1,7 milliard de nanomètres, et un cheveu fait 50 000 nanomètres de diamètre. Nous sommes donc dans le domaine de l'infiniment petit. Par exemple, il faut dix atomes d'hydrogène mis bout à bout pour atteindre 1 nanomètre (Figure I.1.1).
Chapitre I - Insertion des objectifs dans le contexte bibliographique.
___________________________________________________________________________
2
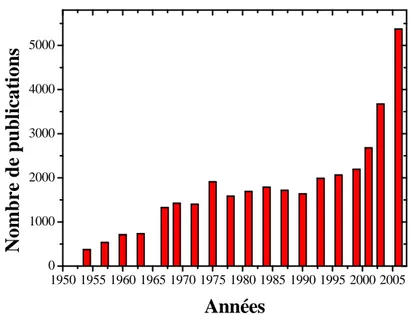
L'échelle nanométrique n'est pas une simple miniaturisation du monde : c'est un bouleversement complet des lois de la physique que nous connaissons. A l'échelle de l'atome, les propriétés des matériaux (conductivité, point de fusion, opacité…) changent du tout au tout. Si à l’échelle macroscopique l’effet collectif de millions d’atomes prédomine, en isolant quelques atomes contenus dans des nanostructures des comportements particuliers apparaissent, liés par exemple, à l’augmentation prodigieuse du nombre d’atomes localisés à leur surface, ou encore au phénomène de confinement électronique. Il en découle des propriétés optiques, mécaniques, électriques nouvelles. Le cuivre devient élastique, les métaux isolants et le carbone quant à lui devient plus durs que l'acier. C'est pourquoi certains parlent de "tournant nanotechnologique". L’histogramme de la figure I.1.2 illustre ce véritable boom des nanotechnologies à travers l’évolution du nombre de publications parues dans ce domaine. 1950 1955 1960 1965 1970 1975 1980 1985 1990 1995 2000 2005 0 1000 2000 3000 4000 5000
N
o
m
b
re
d
e
p
u
b
li
ca
ti
o
n
s
Années
Figure I.1.2 : Evolution des nanotechnologies au travers du nombre de publications.
Les nanotechnologies font désormais partie intégrante de notre vie. Leur développement connaît une forte hausse et d’après la NSF (National Science Fondation), les produits issus des nanotechnologies devraient générer un marché de mille milliards de dollars d’ici 2015. Si cette prévision s’avère juste, cette technologie aura connu le développement le plus rapide de toute l’histoire.
Chapitre I - Insertion des objectifs dans le contexte bibliographique.
___________________________________________________________________________
3
I.2. Généralités sur l’oxyde de zinc
Dans ce qui suit, nous allons évoquer de façon succincte quelques unes des propriétés qui font de l’oxyde de zinc un matériau d’une grande richesse tant par l’originalité de ces propriétés physiques que par les domaines d’exploitation dans lesquels il joue un rôle irremplaçable.
I.2.1 Propriétés structurales de l’oxyde de zinc
ZnO est connu sous trois formes cristallographiques : la forme cubique (Rocksalt), la forme blende, et la forme hexagonale (Würtzite). [2-4] La plus stable thermodynamiquement est la structure hexagonale compacte, zincite, avec une structure de type Würtzite, appartenant à la classe 6mm. [4, 5] Cette structure est constituée de couches d’atomes de zinc en alternance avec des couches d’oxygène. C’est un matériau à structure anisotrope dont l’axe préférentiel de croissance cristalline est l’axe c.
Cette structure est représentée par un empilement de type -Zn-O-Zn-O-, de couches d’atomes arrangés selon le système hexagonal (Figure I.2.1.1). La maille élémentaire comprend deux côtés a = b séparés par un angle de 120°C. L’axe c est perpendiculaire au plan formée par les axes a et b. Les coordonnées du premier atome de la base sont (0;0;0), et celles du deuxième atome sont (2/3 ; 1/3 ; 1/2). Cela signifie que, selon l’axe c, les atomes s’empilent “tous les ½ c ”. La structure Würtzite contient deux atomes de zinc par maille.
Figure I.2.1.1 : Structure hexagonale compact de type Würtzite et alternance ZnOZnOZnOZnO.
L’anisotropie structurale (structure non centro-symétrique), de cette forme cristallographique confère une anisotropie optique et des propriétés piézoélectriques. Le long de l’axe c, le cristal de ZnO présente deux faces polaires distinctes, la face (0001) considérée
Zn2+
O
2-Zn2+
Chapitre I - Insertion des objectifs dans le contexte bibliographique.
___________________________________________________________________________
4
comme la face oxygène et la face comportant les atomes de Zn (000-1). Ces deux faces sont biens connues chimiquement et structuralement. [6] La croissance anisotrope se fait prioritairement selon les plans cristallographiques : V(0001)>V(101-1)>V(-1010)>V(-1011)>V(000-1) [7]
En 1970, les travaux de Reeber montrent que les paramètres de maille de l’oxyde de zinc peuvent varier selon la température. [8] Les paramètres de maille de l’oxyde de zinc ont été déterminés par différentes méthodes comme la diffraction des rayons X, des calculs ab initio, LCAO ou EDXD, ... Dans une structure sans défauts, les paramètres de maille sont les suivants : a = 3,25 Å, c = 5,20 Å, et, c/a = 1,6. [9]
De plus, les atomes de zinc et d’oxygène n’occupent que 40% du volume du cristal, laissant des espaces vides de 0,95Å de rayon. Ainsi, d’autres éléments peuvent se loger dans ces lacunes, par exemple, des dopages par les ions Co2+ [10, 11], Mn2+ [12, 13], Tb3+ [14] In3+ [15] ou V2+ [16] sont possibles. Cela permet ainsi d’expliquer les propriétés particulières de l’oxyde de zinc, en termes de semi-conductibilité, de luminescence, ainsi que les propriétés catalytiques et chimiques à l’état solide. [5]
I.2.2 Structure électronique de l’oxyde de zinc
A l’état massif, l’oxyde de zinc de type Würtzite est un semi-conducteur caractérisé par un écart énergétique important entre la bande de valence (peuplée) et la bande de conduction (vide). La structure de bande de ZnO est discutée dans de nombreuses publications. [17-23] Le passage d’électrons de la bande de valence à la bande de conduction est possible et assure une conductivité électrique. Selon la pureté du matériau, l’écart énergétique varie et on la considère généralement de 3,35 eV. [24] En outre, les propriétés semi-conductrices de l’oxyde de zinc sont connues depuis 1950 avec les travaux de Wagner. [5, 25]
Comme dans le cas des autres semi-conducteurs de type II/VI, la largeur de la bande interdite, et d’une façon générale la structure électronique est dépendante de la taille des domaines monocristallins du matériau. Quand la taille du domaine monocristallin diminue jusqu’à atteindre la taille nanométrique, la théorie prévoit d’abord un élargissement de la largeur du gap puis l’apparition de niveaux discrets d’énergie par levée de dégénérescence. Les niveaux d’énergie du monocristal deviennent ainsi représentables, comme pour les molécules, en terme d’orbitales occupées et vides, parmi lesquels on peut distinguer les
Chapitre I - Insertion des objectifs dans le contexte bibliographique.
___________________________________________________________________________
5
niveaux HOMO et LUMO. (Figure I.2.2.1) Ce phénomène a été abondamment illustré dans la littérature en terme de confinement quantique. [26-30]
Figure I.2.2.1 : De l’état massif aux nanocristaux.
Cette ouverture de gap a un effet considérable sur les propriétés physiques et notamment optiques. En effet, sachant qu’un semi-conducteur soumis à une excitation se désexcite en émettant, par fluorescence, des photons d’énergie égale au gap, ces variations de taille du semi-conducteur doivent permettre la modulation de cette émission. Plus les particules sont petites, plus l’émission est décalée vers les longueurs d’onde courtes (grandes énergies). [31-35]
I.2.3 Bande interdite et propriétés optiques de l’oxyde de zinc
La largeur de la bande interdite peut être mesurée de diverses façons. On peut, en particulier, utiliser les mesures d’absorption optique. A basse température il y a très peu de porteurs de charges dans un semi-conducteur intrinsèque. Les semi-conducteurs sont transparents au rayonnement IR. Ils ne deviennent absorbants que lorsque des transitions inter-bandes sont excitées, c’est à dire lorsque l’énergie du photon est suffisante pour faire passer un électron de la bande de valence à la bande de conduction. On s’attend donc à observer un seuil d’absorption, qui permet de déterminer la largeur de la bande interdite. Dans le cas d’un semi-conducteur à gap direct, l’énergie du photon est directement reliée à la
Energie Bande de conduction (vide) Bande de valence (pleine) Solide Nanocristal Eg HOMO LUMO R1 > R2 > R3
Chapitre I - Insertion des objectifs dans le contexte bibliographique.
___________________________________________________________________________
6
largeur de la bande interdite, hν = Eg. La modulation du gap est très importante pour les applications en optoélectronique.
La photoluminescence est le processus de retour à l’équilibre d’un matériau préalablement excité par une onde lumineuse. L’absorption d’un photon d’énergie supérieure ou égale au gap du matériau envoie un électron sur la bande de valence. Il se crée ainsi une paire « électron/trou » dont la cohésion est assurée par l’attraction coulombienne. D’un point de vue quantique, on fait correspondre à cette entité une particule appelée exciton, et qui présente des états d’énergie à l’intérieur du gap. L’exciton peut être libre, lié à une impureté ionisée ou neutre, donneuse ou acceptrice, cette impureté pouvant avoir plusieurs causes : lacune, atome étranger en position interstitielle ou substitutionnelle, dislocation … Les niveaux d’énergie dépendent de l’environnement de l’exciton. Il s’ensuit diverses recombinaisons excitoniques dont quelques exemples sont illustrés sur la figure I.2.3.1.
Figure I.2.3.1 : Processus de photoluminescence.
Plusieurs travaux récents sur ZnO ont montré en quoi la variation de taille ainsi que la présence de défauts à la surface des nano objets influençaient les spectres de diffusion RAMAN et d’émission photoluminescente. [36-42] Dans certains cas, les propriétés optiques sont exaltées grâce à des méthodes de synthèses particulières. [43-47] Par exemple, lorsque la taille de la nanoparticule diminue, le nombre d’atomes d’oxygène en surface augmente ce qui favorise le mécanisme d’émission dans le vert. [5, 26, 48]
D’une façon générale, l’émission luminescente peut donc apporter des informations précieuses sur les propriétés structurales d’un semi-conducteur.
Exciton lié à un accepteur Exciton libre
Bande de conduction
Bande de valence
Donneur/accepteurExciton lié à un donneur
Niveau donneur Niveau de l’exciton libre
Chapitre I - Insertion des objectifs dans le contexte bibliographique.
___________________________________________________________________________
7
I.2.4 Les propriétés électriques de l’oxyde de zinc
Tout comme les propriétés optiques, il est possible de moduler les propriétés électriques en fonction des défauts engendrés par l’état de surface du matériau. Ainsi, plus la couche de ZnO possède des impuretés (par exemple, des atomes de zinc interstitiels), plus celles-ci provoquent la diffusion des porteurs de charge. L’étude de l’importance de cette diffusion en fonction des différents types d’impuretés est très complexe et est sujette à beaucoup de discussions et théories. [49-52]
a) ZnO, matériau semi conducteur : contrairement aux matériaux conducteurs, la résistivité d’un matériau semi-conducteur diminue lorsque la température augmente. Cette propriété électrique est due au fait que l’énergie thermique accroît le nombre de porteurs de charge. ZnO est un semi conducteur intrinsèque c’est-à-dire que l’énergie thermique est suffisante pour exciter des électrons de la bande de valence vers la bande de conduction. La conductivité électrique est alors assurée par les trous créés dans la bande de valence et les électrons situés dans la bande de conduction. De plus, la conductivité est aussi variable selon l’environnement gazeux. Le ZnO stœchiométrique est un semi-conducteur intrinsèque ayant un gap minimal de 3.37 eV. Mais en général on obtient plutôt, par les techniques usuelles de fabrication, du ZnO ayant une conductivité de type n. Cette conductivité de type n est produite par un excès de zinc dans les couches de ZnO. Afin d’améliorer encore la conductivité des couches de ZnO, il est possible de doper ces couches. Les mécanismes de dopage sont soit substitutionnels soit interstitiels. [53, 54]
b) Comportement non ohmique de ZnO : De plus, selon l’état de surface de l’oxyde de zinc, il peut avoir un comportement de varistances (comportement non ohmique avec une transition entre l’état conducteur et l’état isolant). Une varistance est connue comme étant un matériau dont sa résistance varie avec la tension. (Figure I.2.4) [55]
Figure I.2.4 : Caractéristique d’une varistance. I
Chapitre I - Insertion des objectifs dans le contexte bibliographique.
___________________________________________________________________________
8
Une varistance se présente sous forme d’un disque fabriqué à base d’agglomérats de grains de ZnO séparés par une couche riche en Bi2O3 responsable de l’effet de varistance.
[56-58] Cet effet est du aux barrières de potentiel aux joints de grains au voisinage desquels sont piégés les charges libres. Les joints de grains représentent des barrières de potentiel que les électrons doivent passer. Plus il y a de joints de grains et plus les électrons sont ralentis, et donc, plus leur mobilité est réduite. [59]
c) Propriétés piézoélectriques de ZnO : C’est en tant que matériau piézoélectrique que l’oxyde de zinc est utilisé dans le domaine des capteurs et micro-capteurs à couplage thermomécanique. C’est la propriété d’un matériau à générer une tension électrique suite à l’application d’une force mécanique. [60] Le premier film de ZnO réalisé par pulvérisation date de 1965. Le ZnO fut le premier matériau piézoélectrique en couches minces à être commercialisés. [61] L’orientation de son axe c doit être perpendiculaire au substrat pour que l’effet piézo-électrique puisse être utilisé. L’effet piézoélectrique de l’oxyde de zinc a été montré par Song et al. [62] Il y a transformation d’une énergie mécanique en électricité lorsque le fil de ZnO est plié sous l’action d’une pointe AFM. Un signal électrique est provoqué par la déformation. Celle-ci entraîne l’apparition de charges électriques (piézo-électricité). [62] ZnO est un bon candidat pour le transport des charges, il devient donc un bon matériau pour les électrodes. [65]
Ainsi l’oxyde de zinc est exceptionnellement riche de nombreuses propriétés physiques (optiques, électriques et mécaniques) qui dépendent de la morphologie et de l’état de surface du matériau.
I.2.5 Quelques exemples d’applications de ZnO
- Varistances :
La varistance est un composant dont la résistance varie avec la tension appliquée. Elle est placée entre l’alimentation et l’installation électrique d’une maison. Elle est utilisée pour la protection contre les surtensions. Des varistances à base d’oxyde de zinc [66] ou des éclateurs sont commercialisées comme parafoudres. Ils permettent d’écouler les courants de foudre. La forte non linéarité du parafoudre ZnO fait qu'une forte variation de courant
Chapitre I - Insertion des objectifs dans le contexte bibliographique.
___________________________________________________________________________
9
provoque une faible variation de tension. Par exemple, lorsque le courant est multiplié par 107, la tension n'est multipliée que par 1,8. [67] Ainsi, en 1989 sur 15 000 parafoudres de ce type installés par EDF, après dix huit mois d’expérimentation, seules deux défaillances ont été constatées ; et les caractéristiques, vérifiées par des essais, n’avaient pas varié.
- Capteurs de gaz :
Les oxydes métalliques tels que SnO2 [68], In2O3 [68] ou ZnO [69] sont des
semi-conducteurs à grand gap dont la conductivité dépend fortement de la nature du gaz environnement. Ainsi la présence d’un gaz réducteur (CO, hydrocarbures, H2…) va entraîner
une augmentation de la conductivité de l’oxyde métallique alors que la présence d’un gaz oxydant se traduira par un comportement inverse. Le seuil de détection, la reproductibilité, la stabilité dans le temps sont étroitement liés aux matériaux employés, qu’il s’agisse de leur composition, de leur morphologie ou de leur état de surface. On citera à titre d’exemple quelques références bibliographiques relatives à l’utilisation de couches sensibles de capteurs de gaz à base de ZnO pour la détection du dioxyde d’azote [70] ou du monoxyde de carbone [71, 72].
- Protection UV :
Son aptitude à absorber la lumière UV fait de l’oxyde de zinc un candidat de choix pour les crèmes solaires. Beaucoup de matériaux de type oxyde métallique sont employés dans la formulation de produits à usage cosmétique (crème, fond de teint, vernis à ongle…), curatif (produits hygiène et soin) ou préventif (crème solaire). L'oxyde de zinc (ZnO) et le dioxyde de titane (TiO2) sont utilisés dans les crèmes solaires.
Cependant, pour la majorité des applications industrielles, des contraintes de transparence sont imposées : le matériau ne doit pas absorber dans le visible. Un tel matériau peut alors être transparent ou blanc selon sa morphologie et le milieu dans lequel il est dispersé. Tout dépend de son indice de réfraction et de sa granulométrie. En effet un matériau n'absorbant pas dans le visible, peut néanmoins présenter une coloration blanche par diffusion en raison d'un indice de réfraction dans le visible trop élevé ou des particules trop larges. Il en va ainsi de la grande majorité des absorbeurs UV actuels (TiO2 et ZnO) qui ne sont, en fait,
Chapitre I - Insertion des objectifs dans le contexte bibliographique.
___________________________________________________________________________
10
ZnO de bonnes conductivités et possédant une forte transparence dans le visible [63] ont été utilisés comme électrode transparente pour des cellules solaires. [64]
II.
Les voies d’accès et les processus de formation des
nanoparticules d’oxyde de zinc
D’après ce qui est développé précédemment, l’oxyde de zinc est déjà largement utilisé pour les nombreuses propriétés qu’il présente. Depuis peu, l’oxyde de zinc connaît un regain d’intérêt à cause notamment de son potentiel d’applications en nanoscience et en nanotechnologie. En particulier, l’oxyde de zinc nanostructuré connaît un essor en électronique, en photonique et en spintronique. Ce regain d’intérêt est évidemment suscité par les propriétés nouvelles que l’on peut prévoir pour ce matériau pour peu que l’on puisse atteindre l’échelle nanométrique. Ce qui rend ses nanoobjets intéressant réside dans la relation étroite morphologie/propriétés. Ces propriétés seront, à l’évidence, étroitement dépendante des voies de synthèses employées et des contrôles morphologiques qu’elles permettent.
II.1. Bref aperçu sur les procédés de production industrielle de ZnO
Actuellement, deux procédés sont utilisés pour la préparation industrielle d’oxyde de zinc. Le premier procédé, dit « procédé français », est un procédé indirect. Le zinc est chauffé au voisinage de son point d’ébullition. Ses vapeurs sont oxydées au contact de l’oxygène de l’air. L’oxyde ainsi préparé (appelé aussi fleur de zinc, ou blanc de zinc) est très pur. Le second procédé, dit « procédé américain » ou procédé direct, au départ du minerai, remonte à la moitié du XIXème siècle. Il consiste à mélanger le minerai de zinc lui-même (mélange complexe de sulfure, de silicate et de carbonate de zinc) à du charbon. L’ensemble est chargé dans un four où circule un courant d’air. La chaleur produite par la combustion du charbon est suffisante pour réduire le minerai de zinc en métal et le vaporiser. Les vapeurs de zinc sont alors oxydées par CO2 ou par O2 fournis en excès. L’inconvénient de ce procédé est qu’il peut
conduire quelquefois à un oxyde moins pur, dû à des inclusions de poussières de charbon et de minerai, ou de sulfures métalliques. [5]
Chapitre I - Insertion des objectifs dans le contexte bibliographique.
___________________________________________________________________________
11
II.2. Développements récents sur la synthèse de l’oxyde de zinc
Après une période de calme au niveau des publications sur ZnO, nous connaissons actuellement un fort intérêt pour les nanostructures à base de ZnO. Cet essor est essentiellement dû aux progrès faits sur les modes de synthèses. Ainsi, il est possible d’accéder à diverses nanostructures de ZnO incluant des bâtonnets [74], des tubes [75], des tétrapodes [76], des nanopeignes [77] et des nanohélices [78] par différentes méthodes de synthèses.
D’une façon générale, on trouve dans la littérature deux types d’approche pour les procédés de synthèse d’oxyde de zinc nanostructuré (couches minces, nanofils, nanoparticules…).
- Les méthodes physiques, sont des méthodes dites « Top-Down », car elles partent généralement du matériau massif pour aller vers les plus petites tailles. Les particules ainsi synthétisées présentent généralement une grande dispersité en taille et en forme.
- Les méthodes chimiques, quant à elles, sont dites « Bottom-Up », car elles partent de molécules et utilisent les atomes métalliques comme briques de construction des particules. Elles sont assez variées et généralement faciles à mettre en œuvre.
Dans ce qui suit, je vais donner un aperçu synthétique sur ces deux types d’approche. Bien sûr, toutes les méthodes de synthèses ne seront pas exposées car il en existe beaucoup trop. Je me focaliserai sur celles pour lesquelles les modes opératoires semblent les plus représentatifs et sont les plus employés.
II.3 Approche « Top-Down »
Beaucoup de travaux sur la synthèse de nanoparticules de ZnO par les voies physiques ont été publiés. Par exemple, des techniques de vaporisation de cibles métalliques ou d’oxydes métalliques par pulvérisation cathodique, par ablation laser sont citées dans la littérature pour préparer des grains de ZnO nanométriques utilisables comme couches sensibles de capteurs de gaz. [79, 80]
Chapitre I - Insertion des objectifs dans le contexte bibliographique.
___________________________________________________________________________
12
II.3.1 Méthode par évaporation/condensation/oxydation
Des nanohexagones de ZnO cristallisés dans la phase Würtzite ont été préparés par un procédé physique de type évaporation/condensation/oxydation. [81] Le matériau de départ est de la poudre de sulfure de zinc, ZnS. Ce précurseur est réduit sous l’action du dihydrogène, à 1300°C, soit au-delà de la température de vaporisation du métal (Zn : bp = 911°C). Les vapeurs de zinc ainsi générées sont transportées dans des zones plus froides sous un flux Ar/H2 où elles peuvent se condenser. Le zinc déposé sur le substrat sous forme de gouttelettes
liquides (Zn : mp = 419,6°C) est ensuite oxydé en ZnO sous flux de dioxygène. La croissance de ces objets est contrôlée par un mécanisme de type de Vapeur-Liquide-Solide (VLS : confinement de la croissance cristalline dans le volume d’une gouttelette liquide). [82, 83]
Le dépôt en phase vapeur est probablement la méthode qui a été la plus utilisée pour la synthèse de structures 1-D [83-88] comme l’illustrent les travaux de Zhang et al. [89], Yao et al. [90] ou Kong et al. [85]. Ce procédé peut être étendu à d’autres oxydes métalliques comme l’oxyde de tantale. [91, 92]
En 2003, Ren et al. ont synthétisé des nanoponts et des nanoaiguilles par cette méthode de synthèse en phase vapeur. [93, 94] A partir d’un mélange de poudres contenant ZnO, In2O3 et du graphite, un contrôle de la forme des nanoobjets est possible. Ces nanoobjets
sont synthétisés à 1000°C. Les diamètres de ces nanobâtonnets peuvent aller jusqu’à 200 µm de longueur. [81, 95, 96]
D’autres morphologies et d’autres matériaux ont été synthétisés par cette voie, des nanodisques de Zn et ZnO [97, 98], des aiguilles de ZnO [99] ou encore des nanodisques de SnO [100].
Les mécanismes peuvent se compliquer par la formation d’intermédiaires à cause des hautes températures. Ainsi de nouvelles réactions peuvent intervenir et elles doivent être prises en considération dans le bilan des espèces. [101]
II.3.2 Méthode par dépôt chimique en phase vapeur (CVD)
La méthode par CVD est largement utilisée pour la synthèse d’oxydes métalliques nanostructurés. Elle est employée notamment pour des applications en optoélectronique. Elle permet en effet, de synthétiser des objets nanostructurés de faible dimensionnalité. [102, 103]
Chapitre I - Insertion des objectifs dans le contexte bibliographique.
___________________________________________________________________________
13
Elle consiste d’abord à vaporiser un composé moléculaire, tel que l’acétylacétonate de zinc. Les vapeurs de ce composé moléculaire sont transportées dans un flux de O2/N2 vers le
substrat chauffé à une température suffisante pour provoquer la pyrolyse du précurseur et la formation de l’oxyde. [104] De nombreux travaux font états et discutent des modes de formation et de croissance de nanostructures de ZnO monocristallins. [85, 105-107] Cette technique mène à la fabrication de nanobâtonnets de ZnO de très grande pureté. Des variantes à la CVD sont également utilisées telles que la MOCVD (Metal Organic Chemical Vapour Deposition) [86, 108, 109] ou la LP-CVD (Low Pressure-CVD). [110]
II.4 Approche « Bottom-Up »
Les méthodes chimiques de type « bottom-up » ont l’avantage d’être plus simple à mettre en œuvre, moins coûteuses et offrent un large éventail de paramètres permettant généralement un bon contrôle morphologique. Vue la grande richesse des méthodes par voies chimiques, je détaillerai celles qui me semble les plus pertinentes et les plus rencontrées dans la littérature.
La méthode chimique la plus connue et la plus utilisée pour accéder à une grande variété d’oxyde est certainement la méthode sol-gel.
II.4.1 Méthode par « sol gel »
La méthode « sol-gel » (abréviation de « solution-gélification ») est la méthode la plus utilisée pour générer des oxydes métalliques nanostructurés. La littérature fournit un grand nombre de publications mettant en jeu cette méthode. Les synthèses par voie sol-gel se déroulent schématiquement selon les étapes suivantes :
- hydrolyse d’un précurseur moléculaire, généralement un dérivé alkoxo, pour donner un hydroxo, puis la formation d’un gel polymérisé obtenu par polycondensation,
- séchage du gel pour obtenir une poudre (xérogel) qui est déshydratée à haute température pour obtenir l’oxyde métallique.
La poudre ainsi obtenue est amorphe. L’augmentation de la cristallinité est assurée par un traitement thermique prolongé et peut être suivie par XRD.
L’acétate de zinc peut être aussi utilisé comme précurseur. Dans ce cas, l’hydroxyde de zinc, Zn(OH)2 est bien identifié comme intermédiaire de réaction. [111-114] La synthèse
Chapitre I - Insertion des objectifs dans le contexte bibliographique.
___________________________________________________________________________
14
de cristallites de ZnO nanostructurés en milieu alcoolique a été observée par Anderson et Spanhel, à partir de l’acétate de zinc. [114] Dès l’introduction du précurseur, il y a formation de petits clusters de ZnO de 3,5 nm de diamètre. Les particules continuent de grossir, même si elles sont conservées à 0°C. Après 5 jours, les particules atteignent une taille de 5,5 nm. Ces tailles ont été estimées à partir des largeurs à mi-hauteur des pics de diffraction observés sur les diagrammes XRD (par application de la formule de Scherrer-Warren). L’émission luminescente dans le visible de ce matériau est fortement dépendante de la taille des particules (de 500 nm pour les particules de 3,5 nm, l’émission luminescente est déplacée vers les plus faibles énergies, 560 nm, pour les particules de 5,5 nm).
Les travaux dans ce domaine montrent que la voie sol-gel donne des résultats reproductibles et autorise un certain contrôle de morphologie dès lors que tous les paramètres sont fixés de manière judicieuse (choix du solvant et des ligands). [115, 116] Des nanostructures anisotropes telles que des nanobâtonnets de ZnO de 100 à 200 nm ou des « fleurs » de ZnO peuvent aussi être synthétisées par cette méthode. [74, 117, 118] En outre, l’ajout de surfactants permet un contrôle efficace de la morphologie des nanoparticules. Ainsi, Ramesh et al. [58, 119] montrent qu’en présence de l’acétate de zinc et du couple de ligands diéthanolamine/ acide oxalique, des nanoparticules de ZnO de 30 nm de diamètre sont obtenues. Le gel obtenu après ajout de tous les réactifs est séché et chauffé à 80°C pendant 20 heures produisant ainsi un xérogel. Un chauffage à 1000°C de ce xérogel permet à ses objets d’être ensuite utilisés pour des cellules solaires. L’acide citrique ou le bromure de cetyltrimethylammonium peut aussi être utilisé pour assister la formation de ZnO. [120-122] Les diols et les amines utilisés comme surfactants jouent un rôle dans la production de matériaux par voie sol-gel. [123, 124]
La méthode sol-gel est parfaitement adaptée à la synthèse de matériaux nanostructurés de type céramique. En revanche, elle n’est pas bien adaptée pour la préparation de structures nanoparticulaires cristallines de zinc bien individualisées possédant des tailles, des formes et des états de surface bien contrôlés.
II.4.2 Méthode par précipitation
De nombreuses publications font état de la synthèse de nanoparticules de ZnO de 2 à 3 nm par précipitation. [125-128] Par exemple, à une solution contenant comme précurseur l’acétate de zinc et du 2-propanol est ajoutée une solution de soude. La température est
Chapitre I - Insertion des objectifs dans le contexte bibliographique.
___________________________________________________________________________
15
ensuite maintenue à 65°C. La réaction produit de l’oxyde de zinc, sous forme de petites particules, et de l’acétate de sodium (Equation 1).
Zn(CH3COO)2 2 NaOH ZnO H2O 2 NaCH3COO
Eq.1
Il est intéressant de noter que l’ajout d’un ligand tel que l’octanethiol au milieu réactionnel permet de contrôler la croissance à l’échelle nanométrique des particules de ZnO produites. [125]
II.4.3. Synthèses par voie organométallique
La voie de synthèse organométallique fait intervenir des précurseurs moléculaires possédant des liaisons métal-carbone qui sont décomposés de diverses façons (H2, O2, H2O,
par exemples). Cette décomposition fait intervenir la coupure de liaisons métal-carbone du précurseur organométallique. Il se forme alors, des particules élémentaires, appelées « nucleis ». Cette transformation est appelée étape de nucléation (tout comme pour les méthodes par voie sol-gel et précipitation). Plus précisément, ce processus peut être homogène ou hétérogène. La nucléation homogène correspond à la condensation spontanée des atomes du métal, c’est une propriété de stabilité intrinsèque [129]. La nucléation peut être hétérogène ; dans ce cas, ce sont des impuretés, des défauts ou même des sels de métaux nobles comme [AgNO3, K2PtCl4] qui constituent le point de départ à la croissance des
particules [130-132], (par exemple, dans un verre de champagne, il existe une nucléation hétérogène à partir des bulles d’air piégées sur les défauts de la paroi, alors qu’il n’existe pas de bulles dans la bouteille !).
Les « nucleis » ainsi formés grossissent, par un phénomène de croissance, jusqu’à atteindre une taille optimale. Dans ce cas aussi, la croissance peut être décrite par deux mécanismes (ou une combinaison des deux) : l’adsorption d’atomes au noyau en croissance ou la coalescence de clusters. Ces deux types de croissance ont été observés par le groupe de F. Fievet, lors de la synthèse en milieu polyol de nanoparticules sphériques de ZnO de 10 à 20 nm. [133]
Les étapes de nucléation et de croissance sont suivies d’une dernière étape appelée mûrissement d’Ostwald qui permet d’obtenir des particules dont la dispersion en taille diminue avec le temps. Ce vieillissement des particules est un phénomène thermodynamique, qui repose sur le fait qu’une interface est coûteuse en énergie.
Chapitre I - Insertion des objectifs dans le contexte bibliographique.
___________________________________________________________________________
16
Le processus mis en jeu repose donc, sur trois étapes distinctes, une étape de nucléation, une étape de croissance, et une dernière étape dite de mûrissement d’Ostwald. [134, 135] Contrôler ces étapes revient à contrôler la taille, la forme et l’organisation des particules.
Plus précisément, depuis 1993, cette voie de synthèse a été largement utilisée par Bawendi, pour la synthèse de nanoparticules de semi-conducteurs II/VI tels que ME (où E est un chalcogène : S, Se, Te et M = Zn, Cd, Hg), et de semi-conducteurs III-V (InP, InAs, …). [136] Les travaux d’Alivisatos, en 2000, sont également une référence pour la synthèse de nanoobjets semi-conducteurs par voie organométallique. Par exemple, des nanoparticules de CdSe de 4-5 nm de diamètre sont préparées, par thermolyse de Cd(CH3)2 en présence de
surfactants. Les nano objets ainsi formés possèdent une faible distribution en taille et une excellente monocristallinité. [137]
Plus récemment, des nanoparticules d’oxyde de zinc de 3 nm ont été obtenues lors de la décomposition thermique du mélange Zn(C2H5)2/O2/trioctylphosphinoxide. [138] Un
chauffage à 850°C sous flux Ar/O2 durant 2 heures du précurseur organométallique,
[MeZnOtBu]4 conduit également à de l’oxyde de zinc. [139] D’autres travaux montrent que
l’utilisation de précurseurs de type alkyl-alkoxyde permet de former des nanoparticules de ZnO de bonne pureté et de bonne cristallinité. [140] L’hydrolyse du dibutyloxyde de zinc en milieu micellaire conduit à la formation de nanoparticules de ZnO ayant des tailles de l’ordre de 30 nm. [141]
II.4.4 Synthèse par voie organométallique développée dans le groupe de recherche « Nanostructures et Chimie Organométallique »
La synthèse de nanoparticules développée dans l’équipe « Nanostructures et Chimie Organométallique », créée par Bruno Chaudret, repose sur une approche organométallique originale. Cette méthode est performante, reproductible et a été appliquée à la synthèse de nanoparticules de nombreux métaux à propriétés catalytiques (Ru, Rh, Pd, Pt) [142, 143] ou magnétiques (Fe, Co, Ni) [144] ainsi qu’à la préparation de particules bimétalliques tels que Pt/Ru, Pd/Cu et Pt/Co, Fe/Co. [145] Cette approche s’est révélée également extrêmement performante pour la préparation d’oxydes métalliques tels que SnO2, In2O3 et ZnO. Son
principal avantage réside dans le fait qu’elle permet un contrôle précis de la taille, de la dispersion en taille, de l’état de surface et de l’organisation des particules, ce qui s’avère très
Chapitre I - Insertion des objectifs dans le contexte bibliographique.
___________________________________________________________________________
17
important pour en étudier les propriétés et établir des relations structure/propriétés. Le stabilisant joue aussi un rôle très important dans la formation de ces nanoparticules. La stabilisation des particules en solution est réalisée à l’aide de stabilisations de type électrostatiques [146], stériques [147], par les ligands [148] ou en milieu micellaire [149]. La stabilisation par des ligands entraîne une interaction entre la surface de la particule et un ligand, qui peut être irréversible, comme par exemple, les thiols qui réagissent avec la surface d’or et se coordonnent sous forme de ligands thiolato. [148] L’interaction peut être réversible, il existe alors un équilibre entre le ligand libre et le ligand lié. Il s’agit généralement d’une liaison de coordination de type donneur-accepteur. Il y a donc, formation d’une liaison chimique plus ou moins forte avec possibilité de modifier les propriétés électroniques des particules (réarrangements structuraux induits par les ligands [150], ou modification des paramètres de maille [151]). Quelques exemples de nanoparticules stabilisées par un ligand oxygéné (acide carboxylique) ou par un couple de ligands (amine/acide carboxylique) ont été également rencontrés et notamment dans le cas de nanoparticules d’indium [152], de cobalt [153, 154] ou de fer/platine [155, 156].
Dans ce qui suit, nous allons nous attacher à décrire succinctement les résultats obtenus par l’équipe dans le domaine de la synthèse des nanoparticules d’oxydes métalliques et plus particulièrement ceux qui sont à l’origine du sujet de thèse que je développerai dans ce manuscrit.
II.4.4.1 Les nanoparticules d’oxyde d’étain
Les premiers travaux relatifs à la synthèse de nanoparticules d’oxyde métallique ont débutés, dans l’équipe « Nanostructures et Chimie Organométallique » vers les années 1997. Ils concernent la synthèse de particules de dioxyde d’étain utilisables comme couche sensible de micro capteurs de gaz. Le mode de synthèse qui a été mis au point consiste d’abord en la décomposition par thermolyse d’un précurseur de type amidure, [Sn(NMe2)2]2, en solution
dans l’anisole et en présence de micro quantités contrôlées d’eau. Cette première étape aboutit à des nanoparticules d’étain zérovalent de petites tailles (12-20 nm) entourées d’une couche d’oxydes SnO et SnO2. Ces particules, de morphologie « cœur/coquille » ont été entièrement
caractérisées par diverses méthodes physico-chimiques comme la microscopie électronique à transmission à haute résolution, la spectroscopie Mössbauer, la diffraction des rayons X, la spectroscopie des photoélectrons X… Dans une deuxième étape, les particules [Sn/SnOx] sont
Chapitre I - Insertion des objectifs dans le contexte bibliographique.
___________________________________________________________________________
18
oxydées par traitement thermique sous air. Ce traitement produit des nanoparticules de dioxyde d’étain cristallisées majoritairement dans la phase tétragonale « cassitérite », avec conservation de la taille et de la dispersité de taille (12-20 nm) (Equation 2). [157, 158]
Eq.2
Les procédés de synthèse et de mise en œuvre des nanoparticules d’étain comme couche sensible sur la plateforme silicium de micro capteurs de gaz ont été optimisés pour qu’ils soient industrialisables. [159] Ils sont actuellement commercialisés pour la détection de gaz toxiques (CO, NO2…) ou inflammables (alcanes) à l’échelle du ppm (quelques ppb dans
le cas de NO2). Ainsi, cet exemple démontre une bonne compatibilité entre une approche
purement chimique et les contraintes inhérentes à l’ingénierie microélectronique. [160-162]
II.4.4.2 Les nanoparticules d’oxyde d’indium
Des nanoparticules d’oxyde d’indium (In2O3) ont pu être synthétisées par voie
organométallique en deux étapes. [68, 163] Le précurseur organométallique choisi est le cyclopentadiényl indium, In(C5H5). Sa décomposition en présence d’un alcool comme le
méthanol dans le toluène à température ambiante donne des particules métalliques d’indium zérovalent dont les tailles sont de l’ordre de 15 nm. Le chauffage sous air de ses particules métalliques conduit à la formation de nanoparticules d’oxyde d’indium, In2O3 avec
conservation de tailles et cristallisées dans la phase cubique. La réaction de synthèse est donnée en équation 3. Comme les nanoparticules d’étain, les nanoparticules d’indium ont pu être mise en œuvre comme matériaux de couche sensible pour micro capteurs de gaz. Ces capteurs sont particulièrement bien adaptés pour la détection de gaz oxydants.
InCp Toluène/MeOH rt [In0]n Air Chauffage [In2O3]n Eq.3
Chapitre I - Insertion des objectifs dans le contexte bibliographique.
___________________________________________________________________________
19
II.4.4.3 Les nanoparticules d’oxyde de zinc
En suivant le même protocole de synthèse que pour les deux oxydes précédents, des nanoparticules d’oxyde de zinc ont pu être préparées par la thermolyse d’un précurseur organozincique, le bis-cyclohexylzinc [Zn(C6H11)2]. [164] Le chauffage de ce précurseur
organométallique au reflux de l’anisole permet en effet, d’obtenir des particules métalliques de zinc cristallisées dans la phase hexagonale dont la taille est de l’ordre de 15 nm. Ces particules sont stabilisées par une très fine couche d’oxyde de zinc, elle-même cristallisée dans la phase hexagonale Würtzite comme l’ont montré des études de microscopie électronique à haute résolution. Leur oxydation par traitement thermique sous air produit aussi des nanoparticules d’oxyde de zinc bien cristallisées, avec conservation de taille (Equation 4).
ZnCy2 Anisole Chauffage [Zn0]n Air Chauffage [ZnO]n Eq.4
Le précurseur utilisé est un organozincique que l’on prépare au laboratoire par synthèse magnésienne classique (réaction de deux équivalents de MgCl(C6H11) avec le
dichlorure de zinc dans le diéthyléther à température ambiante).
Un procédé de synthèse directe d’oxyde de zinc par hydrolyse ménagée du précurseur organozincique en milieu organique et en présence d’agents stabilisants a plus récemment été développé dans le groupe de recherche (Equation 5). Ce procédé tire profit de l’exothermicité particulièrement importante de l’interaction entre le précurseur et l’eau qui permet d’aboutir, en une seule étape expérimentale, à l’oxyde. Les agents stabilisants utilisés sont des amines à longues chaînes alkyles (octylamine : OA, dodécylamine : DDA, hexadécylamine : HDA), des acides carboxyliques à longues chaînes alkyls (acide oléique, octanoïque, laurique).
Eq.5
Selon les conditions expérimentales utilisées, les premières observations ont permis de montrer que le procédé de synthèse aboutit à des nanocristaux de forme isotrope ou en forme de bâtonnets. Les nanoparticules isotropes ont des tailles de l’ordre de quelques nanomètres.
Chapitre I - Insertion des objectifs dans le contexte bibliographique.
___________________________________________________________________________
20
L’organisation de ces nanocristaux en super réseaux bi et tridimensionnels a pu être démontrée quand un mélange amine/acide est utilisé comme stabilisant. [165-168]
III Description des objectifs de mon travail de recherche
C’est dans le contexte des travaux décrits ci-dessus, (paragraphe II.4.4.3), que s’inscrit mon sujet de thèse. Fort de l’expérience de l’équipe pour synthétiser des nanoparticules d’oxyde métalliques, l’objectif principal du travail de thèse qui m’a été confié consiste dans une meilleure compréhension des processus de formation et de stabilisation des nanoparticules d’oxyde de zinc. Ce travail implique en particulier, une étude physico-chimique approfondie sur la nature des interactions entre ligands et précurseur organozincique, puis entre ligands et nanoparticules. Il doit aboutir à une meilleure identification des divers paramètres pertinents pour contrôler aussi bien la taille que l’organisation en réseau des nanoparticules. Il serait à cet égard très intéressant de pouvoir trouver les conditions expérimentales permettant de moduler les tailles dans la plus large gamme possible, typiquement de 2 à 30 nm.
Une part importante de ce travail est donc nécessairement liée à la compréhension des processus qui gouvernent les étapes de nucléation et de croissance des nanocristaux de ZnO consécutivement à l’hydrolyse du précurseur organométallique. Pour cette raison, nous envisageons de faire appel, outre les méthodes habituelles de microscopies électroniques et de diffraction des rayons X et des électrons, aux spectroscopies permettant d’accéder aux interactions ligands/particules, ligands/ précurseur, ligands/ligands et d’évaluer l’influence du solvant. Les outils dont nous disposons à cet égard au laboratoire de Chimie de Coordination comme la RMN, pour l’étude des équilibres chimiques, les expériences de transfert d’aimantation par effet Overhauser (NOE) pour l’étude des interactions, la RMN DOSY pour l’étude de la diffusion des espèces présentes en solution ainsi que la diffusion dynamique de la lumière, seront mis à contribution.
Le mémoire est constitué de cinq chapitres
- Le premier chapitre est consacré au contexte bibliographique et à l’insertion de nos objectifs dans ce contexte.
- Le deuxième chapitre est consacré aux études par RMN du système précurseur moléculaire/ligands stabilisants préalable à la formation des nanoparticules de ZnO.
Chapitre I - Insertion des objectifs dans le contexte bibliographique.
___________________________________________________________________________
21
- Dans le troisième chapitre, nous nous intéressons à l’état de surface des nanoparticules et des réactions qui s’y déroulent.
- Le quatrième chapitre est plus spécialement consacré à l’étude des diverses interactions existants entre ligands, solvants et particules.
- Dans le cinquième chapitre, une étude physico-chimique approfondie des solutions colloïdales de ZnO et des conditions de l’organisation des nanoparticules sont détaillées.
- Enfin, le sixième chapitre concerne une étude préliminaire visant à la synthèse de couches d’oxydes métalliques sur substrat par extension du travail accompli en phase homogène.
- Les détails expérimentaux sur les synthèses et les méthodes d’investigation sont rassemblés en fin du mémoire dans la partie expérimentale.

![Tableau II.1.1.1 : Déplacements chimiques en proton associés à l’OA et au mélange [ZnCy 2 ]/OA](https://thumb-eu.123doks.com/thumbv2/123doknet/2177188.10344/55.892.48.846.686.907/tableau-ii-deplacements-chimiques-proton-associes-melange-zncy.webp)
![Figure II.1.2.2 : Détermination de la constante d’équilibre pour les mélanges [ZnCy 2 ]/OA (K a =107 M -1 ) et](https://thumb-eu.123doks.com/thumbv2/123doknet/2177188.10344/59.892.115.740.656.882/figure-ii-determination-constante-equilibre-melanges-zncy-oa.webp)
![Tableau II.1.3.2 : Tableau récapitulatif des coefficients d’autodiffusion mesurés pour différents mélanges [ZnCy 2 ]/RNH 2 (en m².s -1 )](https://thumb-eu.123doks.com/thumbv2/123doknet/2177188.10344/63.892.96.797.119.533/tableau-tableau-recapitulatif-coefficients-autodiffusion-mesures-melanges-zncy.webp)
![Figure II.1.3.1 : Variation des coefficients d’autodiffusion relatifs pour le mélange [ZnCy 2 ]/OA en fonction](https://thumb-eu.123doks.com/thumbv2/123doknet/2177188.10344/64.892.124.740.398.650/figure-variation-coefficients-autodiffusion-relatifs-melange-zncy-fonction.webp)
![Figure II.2 : Spectres RMN 1 H de l’acide oléique (OlAc), du précurseur [ZnCy 2 ] et du mélange](https://thumb-eu.123doks.com/thumbv2/123doknet/2177188.10344/66.892.142.799.108.582/figure-spectres-acide-oleique-olac-precurseur-zncy-melange.webp)


![Tableau II.3.2 : Tableau regroupant les divers coefficients d’autodiffusion (m².s -1 ) utilisés pour l’étude des systèmes [ZnCy 2 ]/Amine/0,5 OlAc](https://thumb-eu.123doks.com/thumbv2/123doknet/2177188.10344/81.892.95.800.116.444/tableau-tableau-regroupant-coefficients-autodiffusion-utilises-etude-systemes.webp)