«
Itinéraire de production d’aliments enrichis en protéines
de levures, destinés à l’alimentation d’animaux d’élevage. »
Stagede fin d’étude effectué à l’INRA des Antilles-Guyane, Unité de Recherches Zootechniques(URZ).
Nom de l’étudiante : Mademoiselle Yannice ADAINE, Etudiante en cinquième année d’école d’ingénieur en Biotechnologies et E-santé.
Maître de stage : Monsieur Louis FAHRASMANE, Ingénieur de Recherche en Agro-transformation de l’unité zootechnique de l’INRA des Antilles-Guyane, Domaine de Duclos.
Tuteur ESIEE : Monsieur Bertrand ROUDIER, Responsable filière Biotechnologies & E-santé, Master TIC & Santé.
Remerciements
Je tiens tout d’abord à remercier mon maître de stage Monsieur Louis FAHRASMANE, qui m’a offert l’opportunité de travailler avec lui et fourni toutes les armes nécessaires à la réussite de ce projet. Je lui suis aussi reconnaissante pour la patience et le temps qu’il a consacré à m’expliquer des notions essentielles à ma formation. Je reste également admirative par rapport au dévouement et à la passion qu’il voue à la Recherche.
Mes remerciements s’adressent aussi à l’équipe entière de l’Unité de Recherches Zootechniques (URZ) au sein de laquelle j’ai eu le plaisir de travailler dans la bonne humeur, avec générosité, sans oublier le sérieux.
Mes remerciements s’adressent aussi à toute l’équipe du laboratoire de l’URZ qui a été présente et aimable avec moi. Mes remerciements s’adressent particulièrement à Tatiana ETIENNE, Yoann FELICITE et Lucien PHILIBERT qui m’ont aidée durant ce stage et ont été disponibles à chaque fois que j’ai fait appel à eux.
Je n’oublie surtout pas mes professeurs: Monsieur Bertrand ROUDIER, Monsieur Alain LACOMBE, Madame Gaëlle LISSORGUES et Monsieur Olivier DE CAMBRY qui ont été à notre écoute tout au long de notre formation et participent au développement de notre filière encore récente au sein de l’ESIEE.
J’ai une forte pensée pour ma famille qui m’a épaulée tout au long de mon parcours scolaire. Mes sœurs et mon frère, Rosy, Stéphanie et Alain ainsi que ma cousine Cécile qui m’ont écoutée et soutenue moralement. Ma mère qui a été là pour moi et me l’a montré au travers des nombreux voyages qu’elle effectuait entre la Guadeloupe et la Métropole pour me ramener un peu de chaleur de notre île. Mon père dont j’ai le soutien et me montre tous les jours qu’il garde un œil sur moi malgré la distance qui nous sépare.
Je tiens aussi à remercier tous ceux et celles que je n’ai pas pu citer mais pour lesquels j’éprouve une grande reconnaissance.
Ce stage du projet AgroEcoDiv est cofinancé par l’Union européenne et la Région Guadeloupe.
SOMMAIRE
I) INTRODUCTION………..3
II) PRESENTATION GENERALE DE L’ENTREPRISE……….4
A. Les principaux axes et unités de Recherche de l’INRA Antilles-Guyane……….4
B. Des chiffres clés……….5
C. Description de l’URZ (Unité de Recherches Zootechniques)………...5
III) TRAVAIL REALISE AU SEIN DE L’ENTREPRISE……….6
A. Etude bibliographique et prise en considération du contexte………7
1) Le choix des levures comme sources protéiques dans l’alimentation des animaux………8
2) La fermentation oxydative : Procédé utilisé pour le développement des levures et l’enrichissement en protéines alimentaires………..8
3) Les différents types de conduite des fermentations/Réacteurs………...10
4) Présentation de l’expérimentation préalablement menée sur l’enrichissement en protéines à partir de levures à l’URZ...…....11
B. Présentation du protocole expérimental………...13
1) Matériels……….13
2) Méthodes………...17
3) Echantillonnage et analyses………...22
C. Déroulement des diverses expérimentations………22
1) Série 1 d’expérimentations avec de la canne à sucre : Test de deux types de Fed-batch……....22
2) Série 2 d’expérimentations avec de la canne à sucre : Test de Fed-batch croissant………24
3) Série 3 d’expérimentations avec de la canne à sucre : Test sur l’espacement de l’apport de matière première………..25
4) Série 4 d’expérimentations avec de la banane verte : Test avec une autre matière première…..26
5) Série 5 d’expérimentations avec du manioc : Test avec une autre matière première…………..28
6) Série 6 d’Expérimentations avec du manioc et de la canne à sucre : Test avec un mélange manioc/canne à sucre………...29
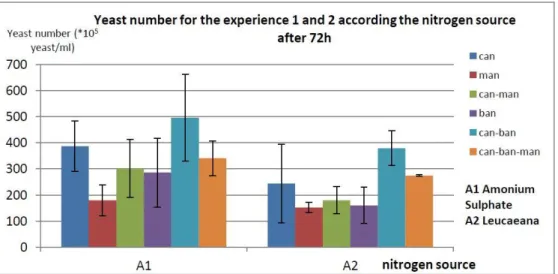
7) Série 7 d’expérimentations avec des mélanges et la canne à sucre : Test d’apports d’azote non limitant………30
8) Série 8 d’expérimentations avec du manioc et de la banane verte : Tests d’apports d’azote non-limitant………....32
9) Série 9 d’expérimentations avec de la canne à sucre : Test avec la bétonnière……….34
10) Série 10 d’expérimentations avec de la canne à sucre : Test avec une bétonnière…………...36
11) Série 11 d’expérimentations avec de la canne à sucre………..37
12) Série 12 d’expérimentations en bétonnière avec de la banane verte……….37
13) Série 13 d’expérimentations avec de la banane verte en bétonnière……….38
D. Résultats des dosages d’azote du laboratoire et discussions………...……….38
I)
Introduction
Ce rapport de stage s’inscrit dans le cadre de ma formation en cycle d’ingénieur au sein l’école ESIEE PARIS (Ecole Supérieure d’Ingénieur en Electronique et Electrotechnique). Pour valider cette formation il est essentiel pour chaque étudiant d’effectuer un stage de fin d’étude dans un cadre professionnel afin de consolider des connaissances techniques et scientifiques acquises tout au long du cursus. Ce stage a pour principaux objectifs d’acquérir des méthodes de travail du milieu professionnel et d’accroitre notre autonomie pour une meilleure insertion dans la vie active.
Afin d’atteindre ces objectifs j’ai effectué mon stage de fin d’étude et cela pendant six mois (du 01 Février au 29 Juillet 2016) au sein de l’INRA (Institut National de Recherches Agronomiques) dans l’unité de recherches zootechniques du Centre Antilles-Guyane, au Domaine Duclos, Prise d’eau, Guadeloupe. Mon stage à l’URZ reposait principalement sur l’apprentissage et la mise en œuvre de procédés tournés vers l’agro-transformation. Le but de ce stage était d’enrichir en protéines des produits végétaux agricoles glucidiques à l’aide de processus de fermentation pour l’alimentation des animaux d’élevage.
Mon travail a été de contribuer à l’établissement d’un protocole bien spécifique suite à l’acquisition de connaissances par le biais de recherches bibliographiques liées à cette problématique, la mise en œuvre de celui-ci ainsi que l’analyse des résultats obtenus.
II)
Pre sentation ge ne rale de l’entreprise
L’Institut National de Recherches Agronomiques (INRA) se positionne au deuxième rang mondial en sciences agronomiques par ses publications, la production de connaissances et l’innovation dans l’alimentation, l’agriculture et l’environnement. Au travers de son centre Antilles-Guyane, il s’investi activement dans la modernisation et la valorisation des écosystèmes agricoles et forestiers tropicaux. L’institut possède deux implantations dans la Caraïbe, une en Guadeloupe avec trois sites : Domaine de Duclos, Domaine de Gardel et Domaine de Godet ; et une en Guyane sur le Domaine de Kourou.
C’est dans le but de répondre aux différents enjeux agronomiques régionaux des Antilles Guyane que l’INRA s’implique fortement à travers ses diverses unités présentes sur ses sites et aussi à travers ses diverses collaborations comme l’INSERM, l’Institut Pasteur ou encore le CIRAD (Agreenium).
A. LES PRINCIPAUX AXES ET UNITES DE RECHERCHE DE L’INRA
ANTILLES-GUYANE
Diverses catégories d’unités existent sur les sites répondant à deux axes de recherche: « Stratégies agroécologiques et compétitivité des agrosystèmes tropicaux »
« Ecologie intégrée et valorisation des écosystèmes forestiers tropicaux » Unités de recherches
- Unité de recherche Agrosystèmes Tropicaux (ASTRO) - Unité de Recherches Zootechniques (URZ)
- Unité mixte de recherche Contrôle des maladies Animales exotiques et émergentes (CMAEE)
- Unité mixte de recherche en Ecologie des forêts en Guyane (Ecofog) Unités expérimentales
- Unité expérimentale Plateforme tropicale d’expérimentation sur l’animal (PTEA) - Le domaine expérimental Duclos-Godet, Péyi
Dispositifs scientifiques collectifs
Dispositif intégré d’ingénierie pour l’innovation agroécologique (D3i), CRB végétal et animal, les plateformes techniques et technologiques ainsi que des laboratoires d’analyses.
B. DES CHIFFRES CLES
Source : Bilan social 2014 INRA Science & Impact
L’INRA offre de nombreuses opportunités de formation aux jeunes étudiants afin d’acquérir des connaissances plus approfondies dans le domaine de l’agronomie et dans les disciplines d’appui tels que la comptabilité et la gestion, l’informatique etc…). Environ 44% des employés de l’institut sont des stagiaires. Avec plus de 17.7 millions d’euros de budget l’institut contribue à la recherche.
C. D
ESCRIPTION DEL’U
NITE DER
ECHERCHESZ
OOTECHNIQUES(URZ)
L’Unité de Recherches Zootechniques a été créée en 1965. Elle a pour but de produire des connaissances, des outils méthodologiques, des technologies et des innovations afin d’améliorer la production animale dans la zone tropicale humide. Cette unité comprend 3 chercheurs, 11 ingénieurs, 10 techniciens et administratifs et 4 doctorants/post doctorants.
L’unité a pour principal objectif de promouvoir des systèmes d’élevage efficients dans un milieu à fortes contraintes et dans une perspective agroécologique. Pour ce faire 4 grands axes ont été mis en avant :
- L’équilibre de l’animal avec son milieu - La valorisation de l’agrobiodiversité - L’optimisation de l’économie circulaire - Les systèmes d’élevage tropicaux
Directeurs de
Recherches; 6 Recherches; 12 Chargés de Ingénieurs de Recherches; 14 Ingénieurs d'Etudes; 22 Assistants Ingénieurs; 18 Techniciens de Recherches; 79 Adjoints Techniques; 73
l’alimentation des animaux d’élevage (ruminants et monogastriques) a été effectué.
III) Travail re alise au sein de l’entreprise
Suite à mon étude bibliographique, j’ai fait une importante constatation sur l’emploi des levures pour l’enrichissement en protéines dans l’alimentation humaine et animale. En effet, au niveau des systèmes polycultures élevages, les compléments alimentaires fréquemment utilisés pour les ruminants sont le Soja, le Maïs et le Sorgho qui sont des denrées non produites en Guadeloupe.
Ces ressources végétales sont aussi employées dans l’alimentation humaine. Face à cette compétition, entre l’alimentation humaine et animale il est nécessaire de proposer d’autres ressources. C’est donc à cette problématique que des éléments de réponse ont été en prenant en compte les spécificités régionales
Des travaux menés dans les années 60 ont identifiés des sources protéiques alternatives en proposant les micro-algues, les bactéries, les moisissures et les levures. Elles ont pour avantage :
- Ressources permettant une production abondante,
- Une vitesse de croissance relativement élevée (Temps de génération: 30min à 2h), - Très riches en protéines (Simon et Meunier, 1970)
Nous pouvons mentionner quelques expériences qui ont mis en évidence l’enrichissement en protéines à partir de la levure Saccharomyces cerevisiae sur :
- De la mélasse (Lee et Kyun Kim, 2001)
- Des pelures de pommes de terre ou des carottes (Bacha et Al, 2011) - Des vins de pommes (Araújo et Al, 2011)
Elles ont donné de bons résultats en termes d’enrichissement. Les études menées sur la production de Protéines d’Organismes Unicellulaires (POU) à partir de levures, bactéries et micro-algues ont utilisées des moyens qui ne sont applicables qu’en laboratoire. Cependant, l’un des principaux objectifs de cette étude est de pouvoir enrichir des aliments en protéine,
de façon rustique (économique et simple d’utilisation) afin qu’un exploitant puisse être en
mesure d’appliquer seul ce procédé sur son exploitation.
Et de valoriser les ressources locales disponibles dans la Caraïbe et singulièrement en Guadeloupe. Nous avons utilisé le manioc, la canne à sucre, la leucène, la banane et la
répond au schéma suivant :
Schéma représentant les étapes de préparation du produit enrichi
Une fois l’itinéraire d’enrichissement esquissé, l’idée de mélanger ces différentes ressources locales a été testée afin de pouvoir diversifier le contenu des aliments proposés aux animaux.
Pour l’enrichissement en protéines de substrats, par culture de levure, l’apport d’une source d’azote dans le milieu de culture est nécessaire. Au cours de cette étude trois sources d’azote ont été comparées : le sulfate d’ammonium, l’urée et la leucène.
A. E
TUDE BIBLIOGRAPHIQUE ET PRISE EN CONSIDERATION DU CONTEXTEL’étude sur la production de protéines levuriennes fit son apparition afin d’optimiser la qualité nutritionnelle d’une ressource tropicale, la canne à sucre, de la Caraïbe (Pierre
Christen IRD, 2006).
La canne à sucre fait souvent l’objet d’une utilisation standard avec la production de sucre, de boissons alcoolisées distillées ou du jus. Mais elle peut aussi contribuer à l’alimentation des animaux d’élevage par l’utilisation de ses feuilles et/ou ses tiges. En effet, la plupart des ressources tropicales sont souvent sous exploitées.
La mise en place de processus rustiques vise à faciliter la vie des exploitants en améliorant l’économie de leurs activités tout en répondant au mieux aux besoins nutritifs des animaux (monogastriques et ruminants). Ces processus doivent respecter les réglementations agroalimentaires et agroécologiques. C’est dans ce contexte que j’ai mené ce stage intitulé :
« Itinéraire de production d’aliments enrichis en protéines de levures, destinés à l’alimentation d’animaux d’élevage. »
1) Le choix des levures comme sources protéiques dans l’alimentation des animaux
Les levures sont des microorganismes qui sont riches en protéines avec 40 à 50% de protéines par rapport à leur matière sèche (MS) (Adrian et Al, 1981). Comparé à la protéine animale (viande : ~10% de protéines/MS) les levures présentent un taux protéique plus élevé. Autre avantage, les levures présentent un temps de génération (X2) relativement court d’environ 2 heures. Elles se caractérisent par les aspects suivants :
- Croissance vigoureuse
- Possibilité d’utilisation de substrats variés - Rendements élevés
- Résistance relative aux contaminants
- Croissance à des températures élevées (pour certaines catégories de levures)
- GRAS (Generally Recognized As Safe)
En revanche, les levures ont besoin d’une quantité importante d’oxygène, d’une source d’azote et du sucre pour leur croissance en aérobie sinon celles-ci entrent en métabolisme fermentaire alcoolique.
2) La fermentation oxydative : Procédé utilisé pour le développement des levures et l’enrichissement en protéines alimentaires
Le mot fermentation vient du mot fervere et signifie « bouillir » en latin. Elle consiste en un processus de transformation d’un substrat biochimique sous l’effet d’un microorganisme. Son rôle est de produire de la biomasse ou un métabolite comme l’éthanol, l’acide organique ou une enzyme, ... (Adrian et Al, 1981).
Il existe deux grandes catégories de fermentation :
Fermentation aérobie : L’oxygène joue le rôle d’accepteur d’hydrogène (exemple : fermentation acétique)
Fermentation anaérobie : L’oxygène de l’atmosphère n’intervient pas mais certaines substances comme l’acide pyruvique servent d’accepteurs d’hydrogène (exemple : fermentation alcoolique)
De nombreux produits alimentaires sont issus de la fermentation de divers substrats, comme la bière, le cidre ou même le vinaigre. Au cours de cette étude, des processus de fermentation conduits dans des conditions rustiques ont été considérés ; avec comme objectif de produire de la biomasse de levure sur des substrats agricoles riches en carbohydrates. La finalité étant d’obtenir des produits fermentés enrichis en protéines, constituant des aliments pour les animaux d’élevage, avec des qualités nutritionnelles améliorées.
Cependant, pour garantir la fiabilité du résultat final, l’utilisation de la fermentation nécessite la prise en considération de nombreux paramètres. Au cours d’une fermentation plusieurs problèmes peuvent apparaitre :
- Des déviations métaboliques comme la fermentation alcoolique
- La présence surabondante de contaminants (on utilise pour les éliminer des installations de détergents, la vapeur des tubes et des tuyauteries dans le secteur industriel)
- La production de mousse lors d’une forte agitation (on emploi des agents anti-mousse comme l’huile de ricin, sulfonée…)
Dans le cadre de cette étude, il était nécessaire de favoriser l’apport d’oxygène et de contrôler d’autres paramètres comme l’acidification des milieux. Les levures ont une tolérance pour des milieux à des niveaux de pH se situant entre 4-5, les bactéries peuvent faire concurrence aux levures en dehors de cette zone de pH.
Il a été important de veiller à ce que le milieu ne soit pas trop chargé en sucre fermentescible (<_ 8 g/l) afin d’éviter la « fermentation alcoolique » (effet Crabtree ou effet glucose1) c'est-à-dire la formation d’éthanol au cours du processus fermentaire :
C6H12O6+ 2ADP+ 2Pi 2CO2 + 2CH3-CH2-OH + 54Kcal+2ATP
Pour prévenir cet effet, le substrat a été dilué puis des apports progressifs en matière première ont été faits pour que la fermentation soit orientée dans la bonne voie métabolique. L’équation de la production en biomasse est la suivante :
C6H12O6 + 6O2 6CO2 + 6H2O+ 38ATP
A noter : la quantité de biomasse produite est proportionnelle à la quantité d’énergie crée (ATP).
1
L’effet glucose apparait lors de conditions semi-anaérobies et de fortes concentrations en substrats (la levure entre en processus fermentaire et produit peu de biomasse)
3) Les différents types de conduite des fermentations/réacteurs
Les fermenteurs biologiques sont des systèmes de transformation à catalyseurs biologiques (enzymes ou microorganismes). Ces réacteurs peuvent être mis en œuvre de façon continue ou discontinue, dans les deux cas l’apport de la matière première est fait dans des conditions variables.
3.1) Fermentation discontinue (réacteur fermé, culture en batch)
Les substrats et les catalyseurs microbiens sont ajoutés au début du processus. Les produits et la biomasse sont récupérés à la fin de la réaction. Il est indispensable de tenir compte de la durée totale du procédé : préparation + remplissage + fermentation + vidange + nettoyage du réacteur.
3.2) Fermentation Fed-batch (méthode utilisée lors du protocole expérimental)
Elle permet d’éviter les problèmes d’inhibition liés à la toxicité d'un substrat en ajoutant de façon successive des milieux ou des substrats. Deux méthodes :
- On ajoute initialement un petit volume de milieu puis on fait des apports séquentiels successifs de manière à ce que le substrat demeure en concentration faible dans le réacteur. (augmentation de volume et biomasse quasi constante dans le cas de l’apport progressif du substrat sucré au cours de la production de biomasse)
- On travaille initialement sur un grand volume de milieu et on ajoute en continu du substrat concentré (augmentation de la biomasse, volume quasi constant)
3.2.1) Avantages
Celle-ci permet de procéder dans des fermenteurs qui contiennent de faibles volumes de culture initialement et donc de démarrer le processus fermentaire plus rapidement (possibilité d’aérer le milieu plus facilement et gain de temps). De plus le fait d’ajouter au fur et à mesure les matières premières permet de les changer en cours de route.
3.2.2) Inconvénients
L’inconvénient de ce type de fermentation c’est de savoir à quel moment la levure va nécessiter du substrat. Des temps de latence au cours du processus fermentaire peuvent être notés du fait que les matières premières ne soient pas ajoutées suffisamment tôt dans les fermenteurs (ralentissement de la production de biomasse) ; ou bien, il peut y avoir une fermentation alcoolique du fait que la levure n’ait pas le temps de consommer tout le substrat (excès de sucre dans le milieu). De plus, l’augmentation progressive du volume total peut rendre moins aisée l’aération dans les fermenteurs.
Avec ce type de réacteur on ajoute de façon continue les substrats ; le produit est récupéré de façon continue. On a ainsi une croissance de type exponentielle (Rivière, 1975).
3.3.1) Avantages
- Réduction des temps morts nécessaires au nettoyage, remplissage, vidange, stérilisation des appareils et leur refroidissement,
- Automation des opérations et facilité de travail, - Augmentation du rendement,
3.3.2) Inconvénients
- Emploi d’un personnel spécialisé,
- Nécessité de disposer au même moment de toutes formes d’énergie, - Coût élevé des installations,
- Manque d’homogénéité du milieu, - Maintien de la stérilité,
- Stabilité des souches,
Cette démarche de recherche bibliographique m’a permis de comprendre et d’identifier les limites de l’étude. Par la suite, un protocole expérimental a pu être établi en fonction des différentes conditions et des enjeux.
4) Présentation de l’expérimentation préalablement menée sur l’enrichissement en protéines à partir de levures à l’URZ
4.1) Etablissement du contexte
C’est dans le contexte du projet d’unité « Valorisation des savoirs, expertises et innovations » que cette expérimentation a été menée par Madame Berthe PARFAIT et Monsieur Louis FAHRASMANE. L’objectif étant de produire des aliments enrichis en protéines contenant à terme 15% de protéines en MS et ceci à partir de ressources végétales locales (tige de canne à sucre, manioc, banane verte…) et de la culture de levure S.cerevisiae, de boulangerie, peu chère et très disponible.
L’activation de la levure a été effectuée à partir de jus de canne dilué dans des erlenmeyers sous agitation permanente pendant deux heures. L’ensemencement des milieux a été effectué avec le levain activé et l’azote a été introduit initialement dans les milieux à base des matières premières testées. Pour favoriser la disponibilité de l’amidon et inactiver certaines réactions enzymatiques responsables du brunissement, la banane et le manioc ont été blanchis avant l’ensemencement. Au cours de la fermentation l’aération des milieux a été effectuée par agitation manuelle toutes les trente minutes.
homogénéisé entre la phase solide et la phase liquide. Ils ont été lyophilisés afin de pratiquer le dosage d’azote selon la méthode de DUMAS. Au cours de ce dosage il n’y a pas eu de différenciation entre l’azote protéique et l’azote non transformé. De ce fait c’est le dosage de l’azote total (N) par rapport à la MS qui a été fait. Le résultat de ce dosage a été converti en protéines, à l’aide d’un calcul : P= N*6.25.
4.3) Les Résultats obtenus
4.3.1) Résultats de comptage de levures
4.3.2) Résultats de dosage d’azote
L’analyse des résultats de comptage de levures a permis de voir que le milieu qui présente la quantité de levures la plus importante est celui qui contient le mélange banane/canne à sucre (source d’azote : sulfate d’ammonium) avec 5.107 levures/ml.
Pour le calcul des protéines, à partir du dosage de l’azote c’est le milieu contenant la canne à sucre et le sulfate d’ammonium qui présente un pourcentage protéique le plus élevé avec 7.86% de protéines/MS. Le milieu dans lequel la population de levure s’est plus développée n’apparaît pas comme le plus riche en protéines. Ces fermentations ont permis un enrichissement qui est encore loin de l’objectif de 15% de protéines/MS. Aussi, la méthode d’estimation des protéines a besoin d’être affinée pour ne prendre en compte que le dosage de l’azote contenu dans la protéine de la levure.
Sur la base de ce travail, je vais au cours de ce stage chercher à préciser et améliorer le développement de la levure, ainsi que l’estimation de l’enrichissement en protéine lors des fermentations.
B. P
RESENTATION DUP
ROTOCOLE EXPERIMENTAL 1) Matériels1.1) Matières premières
1.1.1) Matières premières riches en sucres ou amylacée pour composer les différents milieux d’étude
La canne à sucre (Saccharum spp)
C’est une herbe vivace qui peut atteindre 4 mètres de hauteur, dont la propagation est assurée par bouture. Elle contient 70% de liquide et 30% de matière sèche de plus le jus de sa tige (la sève) contient 140-220g/L de sucre (particulièrement du saccharose). La canne à sucre est la première production agricole au monde avec 1800 millions de tonnes produites annuellement (Source FAO stat). De plus elle est abondante dans les régions tropicales comme le Brésil, Porto-Rico ou la Guadeloupe (14000 hectares de champs). Elle est généralement cultivée pour l’extraction du saccharose sous forme cristallisée, la production de rhums et au Brésil en particulier le biocarburant.
De nouvelles voies d’utilisation de la canne à sucre ont permis la production de bioéthanol, de charbon de bagasse (Fahrasmane et Parfait, 1997), c’est aussi un substrat pour la production de biomasses de microorganismes dont la levure de boulangerie. Afin de pouvoir mener les différentes expérimentations l’approvisionnement en canne à sucre se faisait sur un des champs de canne à sucre disponibles sur le site de l’INRA, Domaine de Duclos et Domaine de Godet.
Le Manioc/ Ka-manioc (Manihot esculenta)
C’est un arbuste vivace dont les racines sont sources d’alimentation pour les pays tropicaux et subtropicaux. Il est consommé par 60% des pays de l’Afrique sub-saharienne et quelques pays d’Asie (Latif et Müller, 2015). Le manioc fait partie des dix premières productions agricoles au monde (source site de la Food and Agriculture Organization (FAO)). Son abondance dans les pays tropicaux, sa très forte consommation ainsi que sa composition de 22.3% d’amidon pour 100g de MS ont orienté le choix vers l’utilisation du manioc comme matière pour enrichir en protéines l’alimentation du bétail. Des agriculteurs ont fourni la matière première nécessaire pour les différentes expérimentations menées.
La Banane verte (Musa spp)
Le bananier est une herbe géante qui se compose d’une tige souterraine produisant à sa base des racines, à son sommet des feuilles. Les fleurs du bananier donnent naissance à un régime de banane. (Lassoudière, 2010).
La banane fait partie des premiers fruits produits au monde. En Guadeloupe nous pouvons compter environ 5000 hectares de champs de bananes. Du fait de sa forte disponibilité, nous avons décidé de travailler avec les écarts de triage de la filière exportation qui représente 20 à 30% des tonnages exportés. Ces écarts de triage présentent l’avantage d’être concentrés au niveau des centres de préparation de la banane à l’exportation.
Du point de vue de sa composition la banane verte fraiche contient 11.69% d’amidon en matière sèche. La banane verte broyée a été utilisée comme substrat alimentaire à enrichir en protéines par culture de levures.
La mélasse
C’est un sirop épais et visqueux sous-produit de la fabrication du sucre de canne à sucre ou de betterave. Il est très riche en sucre soit 70% de sucre par rapport à sa MS, riche en minéraux et facile à conserver. Son utilisation est diverse mais on peut souligner la fabrication de rhum industriel (fabriqué à base de mélasse) qui se différencie du rhum agricole (fabriqué à base du jus de la canne à sucre). Du fait de la teneur élevée en sucre de la mélasse, nous avons utilisé de petites quantités afin de pouvoir produire de grandes quantités de levures. La mélasse nous a été fournie par un industriel qui produit du rhum à partir de ce sirop.
Illustration n°1: Echantillon de mélasse
1.1.2) Matières premières sources d’azote apportées dans la composition des milieux de fermentation pour la production de protéines alimentaires
Pour sa nutrition la levure a besoin de trouver dans le moût (milieu de fermentation) un ensemble de nutriments nécessaires à son bon développement dont le sucre, de l’azote, des sels minéraux et des vitamines (Lamon, 2014) Aussi, l’azote qui est présent sous différentes formes est indispensable pour la synthèse de protéines de la levure. Seuls l’ammonium, les acides aminés et les peptides de petite taille peuvent être incorporés dans la cellule de levure. On peut donc parler d’azote assimilable. Les sources azotées que nous avons sélectionnées pour cette étude sont les suivantes :
Le sulfate d’ammonium ((NH4)2 SO4) (21% d’azote) de la marque AnalaR NORMAPUR® est utilisé comme source azotée de
référence.
La leucène (Leucaena leucocephala) qui est une plante arbustive et abondante en milieu tropical et donc en Guadeloupe contenant 21% de protéines/MS de feuilles.
L’urée CO (NH2)2 avec 46% d’azote en MS est très utilisé en milieu agricole pour l’amendement des sols, il est moins cher que le sulfate d’ammonium, et est facile à manipuler.
Ces trois sources d’azote ont pour caractéristiques d’être facilement disponibles pour l’exploitant.
1.2) Matériels pour l’expérimentation Réacteurs
- Des seaux en plastique alimentaire de 20L. Le choix d’utiliser ce contenant alimentaire est justifié par le fait qu’il soit simple d’utilisation et peu coûteux
- 2 bétonnières de 160L. L’intérêt de l’utilisation de la bétonnière est de pouvoir mettre en œuvre de gros volumes compatibles avec les besoins au niveau d’une exploitation et de mécaniser ainsi que d’automatiser l’agitation pour permettre l’aération des milieux de fermentation.
- Des erlenmeyers. Les milieux introduits dans les erlenmeyers ont été placés sous agitation magnétique avec des barreaux aimantés afin de pouvoir les aérer.
Illustration n°2: Feuilles de leucène
Matériels de préparation des matières premières
- 1 Broyeur muni d’une cuve de 30 litres pour préparer et homogénéiser la leucène (conservée en chambre froide à 4°C). Cet appareil nous a aussi permis de broyer et d’homogénéiser les produits transformés après l’étape du séchage (conservés à température ambiante)
- 1 Broyeur en acier de type SK1 de la marque Retsch (lames utilisées : 0.75mm et 1 mm le diamètre des trous) pour broyer finement les produits transformés qui doivent avoir une granulométrie fine afin de pouvoir procéder aux différents dosages (matière azotée totale, tanin condensés, matière sèche)
- 1 Appareil à découper la canne à sucre, le manioc et la banane verte qui sont conservés dans une chambre froide (à 4°C) après découpage.
- Balances (grande et petite capacité) afin de peser les différents éléments pour la mise en place des milieux de fermentation
- 3 agitateurs magnétiques
- Tubes à hémolyse stérile en plastique pour la collecte des échantillons à analyser - Béchers pour l’échantillonnage. Une certaine quantité de liquide a été prélevée dans
les seaux pour le comptage
- Eprouvettes graduées pour la dilution au dixième avant de procéder au comptage. - 1 pH-mètre de type Hi 9125 de la marque Hanna® pour contrôler les milieux
fermentaires.
1.3) Matériel microbiologique : Levure pour la production de biomasse riche en protéines
La levure d’ensemencement utilisée pour mener à bien cette étude est sous forme déshydratée (Saccharomyces cerevisiae). Elle est disponible dans le commerce comme levure de boulangerie. En effet, c’est l’une des espèces de levure les plus utilisées dans le secteur agroalimentaire au cours de processus de fermentations industrielles particulièrement pour fabriquer le pain, la bière et le vin. Mais elle est aussi utilisée pour la production d’une large variété d’enzymes et a fait l’objet de nombreuses études portant sur la génétique des levures. Un pain de levure de boulangerie de 500g de la marque Fermipan a été utilisé pour cette étude.
Sa composition moyenne est la suivante (Rivière, 1975):
Constituants En % du poids sec
Protéines 50
Lipides 6
Humidité 5
Cendres 7
Sodium 0.3
Tableau n°2: Composition brut de Saccharomyces
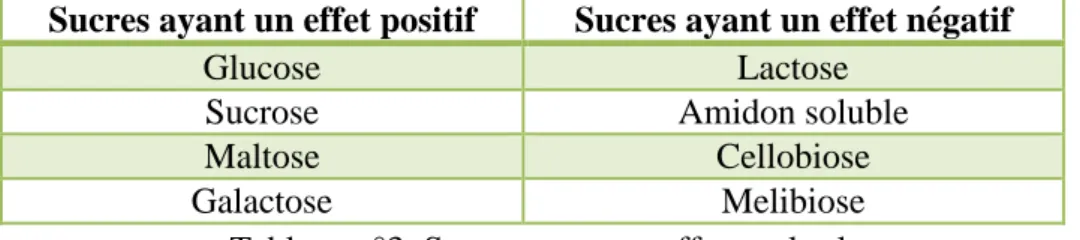
Nous pouvons mentionner aussi quelques sucres utilisés, lors d’une fermentation, présentés ci-dessous (Lodder, 1970):
Tableau n°3: Sucres ayant un effet sur les levures
Ce choix s’est porté sur ce type de levures car elle est très disponible sur le marché et peu coûteuse à l’achat.
2) Méthodes 2.1) Mode opératoire
2.1.1) Opérations mises en œuvre pour le déroulement des séries d’expérimentations
Le mode opératoire utilisé s’est décliné en 5 étapes:
1. Activation de la levure
2. Ensemencement du milieu de fermentation 3. Fermentation de type Fed batch
4. Séchage du milieu fermenté
5. Broyage du milieu séché et enrichi
2.1.2) Calculs préliminaires
Détermination de la quantité de sucre à ajouter dans les milieux
L’objectif fixé est de ne pas dépasser 8g/L (5g/L dans la littérature) de sucre dans les milieux de fermentation afin d’éviter que la levure ne passe en métabolisme fermentaire alcoolique par effet glucose. Dans ces conditions, la levure métabolise le sucre avec un rendement de 50%. En effet, 1g de matière sèche de levure est produit à partir de 2g de sucre.
Sucres ayant un effet positif Sucres ayant un effet négatif
Glucose Lactose
Sucrose Amidon soluble
Maltose Cellobiose
Idéalement il aurait fallu ajouter 85g de canne à sucre au départ dans un volume total de 1L. Mais nous avons décidé de travailler en excès, dans la mesure où les morceaux de canne à sucre libèrent progressivement le sucre qu’ils contiennent et donc d’ajouter 170g de canne à sucre initialement puis de faire des ajouts progressifs par la méthode Fed-batch. Lors de l’utilisation du manioc ou de la banane verte qui sont essentiellement amylacées, nous avons fait le choix d’apporter le sucre de fermentation sous forme de mélasse.
Détermination de la quantité de sulfate d’ammonium et d’urée à utiliser pour l’activation de la levure
Dans 1g de protéines il y a 6.25% d’azote soit 62.5 mg d’azote (que nous avons arrondi à 100 mg d’azote pour le calcul de la quantité d’azote à mettre dans le milieu de culture, car il valait mieux être en excès, dans la mesure où il n’y a pas de conséquences métaboliques négatives).
Le pourcentage d’azote contenu dans le sulfate d’ammonium est de 21% soit 21 mg d’azote pour 100 mg de sulfate d’ammonium.
D’où la quantité de sulfate d’ammonium à utiliser pour disposer de 100 mg d’azote est d’environ 500 mg/L de sulfate d’ammonium.
L’urée contient 46% d’azote d’où la quantité d’urée à utiliser lors de l’activation est d’environ 220 mg/L.
Détermination de la quantité de leucène à utiliser pour l’activation de la levure
La quantité de leucène fraiche utilisée est de 10.8g/L afin d’apporter suffisamment d’azote pour que la levure puisse bourgeonner. Nous sommes partis du principe que la leucène contient environ 30% de protéines sur sa matière sèche (Résultats de mesures internes à l’URZ).
2.1.3) Activation de la levure
L’activation de la levure a été effectuée dans un milieu composé de 5g de mélasse, comme substrat énergétique, diluée dans 1 L d’eau tiède (~37 °C) disposés dans des erlenmeyers de 5L, un pour chaque sources d’azote (leucène, sulfate d’ammonium et urée), sous agitation permanente pendant 2 à 3 heures et à environ 37°C afin d’accélérer le processus d’activation de Saccharomyces cerevisiae.
Le pH du milieu a été contrôlé entre 4 et 5 ce qui correspond à une zone de pH favorable au développement de la levure et réduire le développement de contaminants éventuels car nous travaillons de manière non aseptique. Dans un même temps, nous avons cherché à ne pas dépasser 8g/L de sucre (soit ~1°B) sachant que 50% de la matière sèche de la mélasse est composée de sucre.
2.1.4) Préparation du milieu de fermentation et ensemencement
Dans une première phase d’étude, le milieu à enrichir en protéines a été disposé dans des seaux en plastique alimentaire. Ce milieu a été fait à base de canne à sucre, de manioc ou de banane verte préalablement découpés en morceaux et mis initialement en suspension dans 1L de liquide (levain + eau). En fonction de la matière première utilisée (manioc et/ou banane), nous avons ajouté une certaine quantité
initiale de mélasse. Au cours de la fermentation nous avons introduit par Fed-batch la matière première (ajouts successifs), agité manuellement et périodiquement les seaux, à bouts de bras, pour
oxygéner le milieu et favoriser ainsi le
développement de la levure.
Le stock de matière première prédécoupée pour l’expérimentation a été conservé en chambre froide à une température d’environ 4°C afin de contrôler la flore microbienne.
L’azote nécessaire, à un cycle de fermentation (leucène, sulfate d’ammonium ou urée) permettant le développement de la levure à partir du substrat énergétique, a été introduit dans le milieu de fermentation dès le début. La durée de la fermentation était de 2 à 4 jours suivant le type de fermenteur.
Illustration n°3: Activation de la levure avec les différentes
sources d’azote
Illustration n°4: Les différents milieux de fermentation à T6 série 1
2.1.5) Séchage des milieux contenus par les fermenteurs
Une fois le processus fermentaire terminé, le séchage des milieux a été effectué en utilisant des sacs en plastique sur lesquels nous avons disposés les produits transformés. Ces sacs ont été déposés sous une serre afin de sécher les milieux de façon rustique (séchage sous effet solaire) durant 5 à 7 jours.
2.1.6) Broyage des produits transformés
Après l’étape du séchage, les produits transformés ont été broyé afin de les homogénéiser et d’obtenir soit une substance poudreuse ou fibreuse selon la matière première utilisée. Dans les milieux poudreux des échantillons ont directement été récupéré pour effectuer le dosage d’azote. Dans les milieux plus fibreux, il a fallu procéder à un deuxième broyage pour obtenir une granulométrie plus fine, nécessaire pour le dosage d’azote et les différentes analyses de quantification d’enrichissement en protéines du produit fini.
Illustration n°6: Broyat d’un milieu contenant de la canne à
sucre/urée
Illustration n°5: Séchage d’un milieu sous effet solaire
Illustration n°7: Broyat d’un milieu contenant de la canne à
3) Echantillonnage et analyses 3.1) Prélèvement d’échantillons
Le prélèvement d’échantillons du milieu de fermentation a été effectué à partir de la phase liquide du milieu au cours de la fermentation (1 à 2 fois par jour), afin de pouvoir suivre la dynamique de la croissance de la population de levures par comptage.
3.2) Analyses et dosages Comptage de la levure
Le dénombrement de la levure a été effectué à l’aide d’un microscope optique binoculaire au grossissement X40 sur une lame de Thoma (BIOS vol 8 n°4, 1977).
Dosage de l’azote et calcul de la teneur en protéine des produits fermentés
Les dosages d’azote par la méthode de Dumas ont été mis en œuvre pour quantifier le taux de protéines présentes dans le produit final après séchage. Avec 1,5 g d’échantillon préalablement broyés une dilution dans 30ml d’eau a été effectuée pour procéder à la centrifugation et le dosage du culot et du surnageant. Les protéines étant plus denses, elles vont donc se retrouver dans le culot. Ainsi l’azote mesuré dans le culot correspondrait à celui associé aux chaines protéiques et l’azote situé dans le surnageant correspondrait à celui qui n’a pas été métabolisé en protéines.
Pour procéder au dosage il s’agit dans un premier temps de procéder à la combustion de l’échantillon dans un four à haute température et dans un milieu riche en oxygène. Les gaz issus de la combustion sont alors séparés, piégés chimiquement et purifiés. Les NOx sont réduits en N2 sur du tungstène métallique et le flux gazeux est dirigé vers le détecteur thermo-conductif.
Le détecteur thermo-conductif fonctionne sur le principe d’une différence de conductivité thermique entre deux flux gazeux. Dans une première chambre s’écoule le flux gazeux de référence (CO2). Dans la seconde, s’écoule le mélange gazeux CO2 + N2. La différence de conductivité entre les deux gaz est alors intégrée et quantifiée.
Estimation de la matière sèche
L’analyse de la matière sèche du produit final permet d’évaluer la quantité d’eau présente dans le milieu. Ceci est nécessaire pour pouvoir exprimer le contenu en azote des échantillons par rapport à la matière sèche. Aussi, une forte présence d’humidité dans le
cela qu’il est nécessaire de connaitre la matière sèche (MS).
C. D
EROULEMENT DES DIVERSES EXPERIMENTATIONSDans cette partie, les expérimentations qui ont été menées et les conclusions progressives que nous avons pu tirer à la fin de celles-ci sont présentées ci-dessous. Par la suite, nous avons pu déterminer le meilleur itinéraire d’enrichissement en protéines qui pourrait être applicable au sein d’une exploitation et directement praticable par l’exploitant.
Dans l’approche expérimentale initiale nous avons tout d’abord commencé par l’utilisation en duplicate de seaux en plastiques comme fermenteurs dont les résultats sont moyennés, pour chacune des 3 sources d’azote à tester.
1) Série 1 d’expérimentations avec de la canne à sucre : Test de deux types de Fed-batch
Pour une prise en main de cette étude, nous avons fait le choix de travailler avec la canne à sucre comme matière première. Deux hypothèses ont été établies:
1/ La première où nous avons fait l’hypothèse du doublement de la population de levure à chaque apport séquentiel de canne à sucre.
2/ La seconde hypothèse où nous avons supposé qu’un apport constant de canne à sucre serait suffisant pour la levure.
Au cours de cette série d’expérimentations les ajouts de la matière première (canne à
sucre) ont été faits de façon diurnes par la méthode de Fed-Batch dans des milieux contenant une des trois sources d’azote (urée, sulfate d’ammonium et leucène) avec un
délai de deux ou trois heures entre chaque ajout (pendant deux jours d’apports diurnes). (cf. Annexe 1, page 47)
Illustration n°8: Les différents milieux de fermentation à T0 série 1
Modélisation Série°1: Canne à sucre
Lot 1 (Y1=, Y2=, Y3=)
Jours Heures Quantités de canne à sucre ajoutée (g) Evolution de la population de levures J0 T0 170 1X J0 T1 170 2X J0 T2 170 4X J1 T3 170 8X
Présentation des résultats de comptage de levures, Série 1
0,00E+00 5,00E+06 1,00E+07 1,50E+07 2,00E+07 2,50E+07 3,00E+07 Qu an tité d e le vu re s/m l Durée Y1+ (urée) Y2+ (sulfate) Y3+ (leucèn e) 0,00E+00 2,00E+06 4,00E+06 6,00E+06 8,00E+06 1,00E+07 1,20E+07 1,40E+07 Qu an tité d e le vu re s/m l Durée Y1= (urée) Y2= (sulfate) Y3= (leucène)
Modélisation Série°1: Canne à sucre
Lot 2 (Y1+, Y2+, Y3+)
Jours Heures Quantités de canne à sucre ajoutée (g) Evolution de la population de levures J0 T0 170 1X J0 T1 340 2X J0 T2 680 4X J1 T3 1360 8X
Graphique 2 : Evolution de la population de levures pour le lot 2
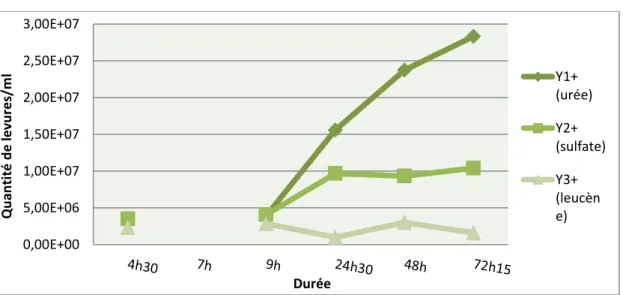
Lors des différents comptages les milieux qui présentaient de meilleurs résultats concernant l’évolution de la population de levures étaient ceux dont la source d’azote utilisée était l’urée.
Le maximum de levure atteint pour le lot 2 (ajout évolutif) avec l’urée est d’environ 3*107 levures/ml tandis que pour le lot 1 (ajout constant) nous avons obtenu un maximum de 1.3*107 levures/ml.
A partir de cette comparaison, nous avons fait le choix, pour les expérimentations suivantes, d’apporter le sucre toujours en Fed-batch mais de façon croissante évolutive (même scénario que le lot 2).
De plus l’augmentation de la population de levures est plus rapide avec le lot 2 que le lot 1. Ce qui laisse présager que la levure avait suffisamment de ressource énergétique dans le lot 2 que le lot 1 où le sucre pouvait être limitant et donc une croissance de la population moins importante.
Pour la leucène, les résultats ont été relativement bas lors du comptage des levures. De plus vers la fin du processus fermentaire il y eu apparition de moisissures dans les seaux qui présentaient le pH le plus bas (milieu acide).
De même, après séchage du milieu fermenté de la moisissure a aussi été observée dans des fractions échantillonnées. Ce qui a laissé comprendre qu’il fallait laisser les milieux à
sécher plus longtemps pour réduire d’avantage le taux d’humidité contenu dans les
échantillons et réduire par la même occasion l’activité de l’eau.
2) Série 2 d’expérimentations avec de la canne à sucre : Test de Fed-batch croissant
Pour cette série, le même protocole que la série 1 a été repris; c'est-à-dire deux seaux pour chaque source d’azote et la canne à sucre comme matière première utilisée. L’ajout de la
canne a été effectué de façon évolutive croissante dans tous les fermenteurs et ce dans un
délai d’ajout semblable à celui de la série précédente des ajouts séquentiels au cours de la journée pendant deux à trois jours. (cf. Annexe 2, page 50)
Présentation des résultats de comptage de levures
Les meilleurs résultats de comptage de la levure sont obtenus dans les milieux où l’urée
est la source d’azote, avec un maximum qui atteint environ 3.5*107
levures/ml qui est du
même ordre de grandeur que les résultats de la série 1 d’expérimentations avec le lot 2. En faisant la moyenne des deux seaux contenant la leucène nous avons pu remarquer que les
(même constat que pour la série 1). De plus, un écart important a été observé entre les résultats de comptage des seaux contenant la même source d’azote. D’où la décision de
travailler en triplicate afin d’assurer une meilleure fiabilité des résultats futurs.
(Résultats cf. Annexe 2, page 50)
3) Série 3 d’expérimentations avec de la canne à sucre : Test sur l’espacement de l’apport de matière première
Comme annoncé précédemment nous avons choisi de travailler avec trois seaux pour
chaque source azotée, pour matière première, la canne à sucre et d’espacer d’avantage
le délai des ajouts de la matière première. La durée des expérimentations a été allongée et le travail a été effectué sur trois jours au lieu de deux, ceci afin de laisser plus de temps de
croissance à la levure.
Pour mieux comprendre le comportement de la levure vis-à-vis de la leucène (les résultats de comptage les moins intéressants), un quatrième fermenteur a été introduit dans lequel
la quantité de leucène apportée a été doublée (Y10).
L’hypothèse qui a été faite est que la levure avait besoin de plus d’azote pour mieux se développer.
Présentation des résultats de comptage de levures
Malgré l’introduction de ce quatrième fermenteur contenant plus de leucène, les résultats restent toujours moins importants qu’avec les autres sources d’azote (sulfate d’ammonium et urée) que ce soit pour l’observation de la cinétique et du niveau de développement de la population.
Néanmoins, le milieu Y10 (quantité de leucène doublée) présentait des résultats un peu plus importants que les milieux Y7, Y8 et Y9 (quantité habituelle de leucène ajoutée).
De cette série d’expérimentations, le maximum de levures comptées est d’environ 2.5*107 levures/ml pour l’urée ce qui reste dans le même ordre de grandeur que les résultats obtenus dans les séries précédentes. Le milieu contenant du sulfate d’ammonium reste quant à lui en deuxième position par rapport au nombre de levures comptées. (cf. Annexe 3, page 54)
4) Série 4 d’expérimentations avec de la banane verte : Test avec une autre matière première
Après avoir eu une prise en main avec de la canne à sucre comme matière première, pour cette série d’expérimentation c’est la banane verte qui a été testée.
La source énergétique choisie pour la levure était de la mélasse qui fournit des sucres rapidement mobilisables par la levure, la banane (amidon qui doit être hydrolysé), qui sont les substrats nécessaires au développement de la levure. Comme pour les premières séries d’expérimentations, il a fallu calculer la quantité de sucre à apporter dans chaque fermenteur pour que la population de levures puisse disposer de source énergétique suffisante pour se multiplier.
Ainsi à partir des calculs effectués, le résultat obtenu était de : 17.86g de mélasse. Cette quantité de mélasse a été ajoutée dans chaque seau pour l’ensemencement et durant le processus fermentaire. Nous avons fait des apports de matière première qu’une fois par jour. Les résultats précédents ont laissé comprendre que la levure n’avait pas assez de temps pour consommer tout le sucre présent (cf. tableaux de modélisation ci-dessous).
Modélisation Série 4: Banane verte (ajout évolutif) Lots (Y1, Y2, Y3) (Y4, Y5, Y6) et (Y7,Y8, Y9)
Jours Heures Quantités de banane ajoutée (g) Evolution de la population de levures J0 T1 170 1X J1 T3 340 2X J2 T5 680 4X J3 T6 1000 et 871 (Y7) 8X
Modélisation Série 4: Mélasse (ajout constant) Lots (Y1, Y2, Y3) (Y4, Y5, Y6) et (Y7,Y8, Y9)
Jours Heures Quantités de mélasse ajoutée (g) Evolution de la population de levures J0 T1 17.86 1X J1 T3 17.86 2X J2 T5 17.86 4X J3 T6 17.86 8X
Illustration n°10: Milieux de la série 4 en cours de séchage
Illustration n°9: Fermenteur avec de la banane verte
Présentation des résultats de comptage de levures, Série 4
Graphique 3 : Evolution de la quantité de levure suivant les sources d’azote (moyenne)
Discussions
En ce qui concerne les résultats de comptage, les meilleurs résultats obtenus sont avec l’urée avec un maximum de 8*106 levures/ml. Ces résultats sont moins importants que ceux
obtenus pour la canne à sucre. De plus les résultats sont toujours aussi bas pour la leucène avec un maximum qui atteint 5*106 levures/ml et le sulfate d’ammonium est toujours en deuxième position avec un maximum qui atteint 7*106 levures/ml. Au cours du cycle fermentaire, après un accroissement de la population en levure, nous avons pu remarquer une baisse de la quantité de levures pour les trois milieux. La conclusion est qu’il était difficile de faire par comptage une estimation exhaustive de la quantité de levures dans tout le milieu car nous avons effectué nos échantillonnages que sur la partie liquide du milieu de fermentation et qu’une partie de la levure était très probablement sur la partie solide (morceaux de bananes) de nos milieux expérimentaux.
Au cours et en fin de la fermentation nous avons noté une quantité de liquide fermentaire plus importante que dans les milieux à base de canne à sucre. Ce qui a permis de voir que la canne a un pouvoir absorbant que ne présente pas la banane, cela avait des répercussions sur l’étape du séchage. En effet, il était plus simple de faire sécher les milieux à base de canne à sucre (peu de liquide) que les milieux avec de la banane (quantité plus importante de liquide).
0,00E+00 1,00E+06 2,00E+06 3,00E+06 4,00E+06 5,00E+06 6,00E+06 7,00E+06 8,00E+06 9,00E+06 4h40 23h40 29h 48h40 72h10 96h10 Qu an tité d e le vu re s/m l Durée Moyenne Y1 (urée) Moyenne Y2 (sulfate) Moyenne Y3 (leucène)
liquide. Ce milieu a bruni au cours de l’étape du séchage. Nous avons donc supposé qu’il y avait des substances favorables aux phénomènes de brunissement, certainement dû à la pelure des bananes vertes qui est riche en tannins.
Après le séchage, nous avons procédé à l’étape du broyage du produit fini et une
consistance farineuse du produit broyé a été observée contrairement à la canne où la consistance était plus fibreuse.
5) Série 5 d’expérimentations avec du manioc : Test avec une autre matière première
Lors de cette série, la matière première utilisée était du manioc. Pour la croissance de la levure la source énergétique était de la mélasse apportée de manière constante.
Présentation des résultats de comptage de levures
Au niveau des résultats de comptage le maximum obtenu est de 1.8*107 levures/ml avec l’urée, 1.6*107
levures/ml avec le sulfate d’ammonium et environ 1.6*107 levures/ml avec la leucène. Ces quantités sont plus importantes qu’avec la banane mais restent moins élevés que celles obtenues avec la canne à sucre. Les résultats de ce comptage ne sont pas significativement différents entre les trois sources d’azote. (cf. Annexe 4, page 59)
A l’étape du séchage des produits fermentés à base de manioc, nous n’avons pas remarqué de brunissement aussi important qu’avec les produits à base de banane. De plus, nous avons été confrontés au peu d’absorption du liquide de fermentation par la matière première. Le séchage a donc été plus long contrairement à la canne à sucre. Après broyage, une farine poudreuse d’amidon claire a été obtenue.
Illustration n°11: Farine poudreuse à base de manioc
Test avec un mélange manioc/canne à sucre
Pour cette série c’est l’évaluation du développement des levures en associant les matières premières utilisées en quantités équivalentes de matière fraîche qui a été testé. Ainsi, un milieu avec le mélange manioc/canne à sucre (lot (Y10, Y11, Y12)) a été introduit. La source énergétique était la mélasse et comme source azotée l’urée, compte tenu du fait
que c’est avec cette source d’azote que les meilleurs résultats ont été obtenus en terme de comptage.
Pour ce faire nous avons établi la modélisation suivante : Modélisation
Présentation des résultats de comptage de levures, Série 6
0,00E+00 5,00E+06 1,00E+07 1,50E+07 2,00E+07 2,50E+07 3,00E+07 3,50E+07 Qu an tité d e le vu re s/m l Durée Moyenne (urée) canne Moyenne (sulfate) canne Moyenne (leucène) canne Moyenne (urée) Manioc+canne
Modélisation Série 6: Canne à sucre (ajout évolutif) Lots (Y1, Y2, Y3) (Y4, Y5, Y6) (Y7,Y8, Y9) et (Y10, Y11, Y12)
Jours Heures Quantités de canne à sucre ajoutée (g) Evolution de la population de levures J0 T1 170 1X J1 T2 340 2X J2 T3 680 4X J3 T4 1360 8X J4 T5 2720(Y1, Y2, Y3) 16X
Modélisation Série 6: Manioc (ajout évolutif) Lot (Y10, Y11, Y12)
Jours Heures Quantités de manioc ajouté (g) Evolution de la population de levures J0 T1 170 1X J1 T2 340 2X J2 T3 680 4X J3 T4 1360 8X
Discussions
Au cours du processus fermentaire, il y avait moins de liquide pour le fermenteur contenant le manioc/canne à sucre que ceux qui ne contenaient que du manioc.
Les résultats des comptages dans les milieux à base du mélange manioc/canne à sucre (3*107 levures/ml) sont meilleurs que ceux obtenus dans les milieux à base de manioc.
Aussi, le milieu contenant le mélange manioc/canne à sucre présentait un maximum de 3*107 levures/ml ce qui est plus élevé que dans les autres milieux et se rapproche des résultats obtenus lors des expériences avec de la canne à sucre seule. Nous avons donc, à la lumière de ce résultat de comptage, conclut que le mélange des matières premières manioc/canne à sucre est plus favorable que la canne à sucre seule ou le manioc seul, à la production de biomasse levurienne.
7) Série 7 d’expérimentations avec des mélanges et la canne à sucre : Test d’apports d’azote non limitant
Le mélange des matières premières a été testé avec toujours le même objectif, qui est d’étudier le développement de la levure et de voir si de meilleurs résultats sont obtenus. Le comportement de la levure a été étudié en faisant varier la concentration d’azote ajouté initialement, ceci afin d’observer si l’apport en source d’azote n’était pas limitant pour le développement de la levure.
La matière première choisie est la canne à sucre car elle présente moins de contraintes au cours du séchage. La source d’azote choisie est l’urée dont nous avons fait varier la quantité à l’ensemencement. (cf. Annexe 5, page 63)
Dans le premier lot (Y7, Y8, Y9) ont été introduits :
La quantité habituelle d’urée (2.60g/L) dans le premier seau Y7.
Dans le second nous avons doublé cette quantité (5.20g/L) Y8.
Dans le troisième nous l’avons quadruplé (10.40g/L) Y9.
Pour le second lot nous avons voulu observer le comportement de la levure avec le mélange banane/manioc comme matière première en introduisant la mélasse comme source énergétique.
Pour le troisième lot c’est le comportement de la levure avec le mélange canne/banane qui a été testé. La canne à sucre a servi de source énergétique avec sa disponibilité en sucre.
En analysant les résultats de comptage, nous avons pu constater que les meilleurs résultats sont ceux du milieu avec la canne à sucre où la quantité d’azote ajoutée a été quadruplée avec un maximum de 6*107 levures/ml. C’est un des résultats les plus élevés des différentes séries d’expérimentations qui ont été menées jusqu’à maintenant, sans pour cela que l’augmentation de population soit proportionnelle à l’augmentation de l’apport d’azote.
Les résultats obtenus avec les mélanges canne à sucre/banane verte et banane verte/manioc sont moins intéressants que ceux obtenus avec le mélange canne à sucre/manioc. Le maximum atteint est de 1.0*107 levures/ml pour les deux mélanges. Le mélange canne à sucre/manioc serait envisageable, bien que les résultats soient moins intéressants que la série d’expérimentations précédentes (3*106
levures/ml), mais du point de vue pratique ce mélange permet de procéder plus facilement à l’étape du séchage.
Le fait d’avoir obtenu une population plus importante dans le milieu où la quantité d’azote a été doublée et quadruplée, nous avons pris la décision d’augmenter la concentration d’azote ajoutée initialement dans les milieux pour les séries d’expérimentation suivantes.
Nous avons choisi de tripler la concentration en azote (soit 7.8 g/L car l’analyse de la proportionnalité entre l’augmentation de la population de levure et l’augmentation de l’apport d’azote semble plausible dans cette gamme ce qui n’est pas le cas en la quadruplant. (Graphique 5) 0,00E+00 1,00E+07 2,00E+07 3,00E+07 4,00E+07 5,00E+07 6,00E+07 7,00E+07 Qu an tité d e le vu re s/m l Durée Y7+2.60 Y8+5.20 Y9+10.40
Graphique 5 : Cinétique de la population de levures pour la canne à sucre suivant les différentes quantités d’azote
8) Série 8 d’expérimentations avec du manioc et de la banane verte : Tests d’apports d’azote non-limitant
Lors de cette série, nous avons donc voulu étudier si la concentration d’azote utilisée dans les séries d’expérimentations précédentes n’était pas limitante en augmentant l’apport d’azote, en utilisant l’urée et le sulfate d’ammonium (doublé et quadruplé la quantité de ce dernier). Ces deux sources d’azote sont celles avec lesquelles de meilleurs résultats, en termes de comptage, sont observés au cours des expériences précédentes.
Pour les trois lots:
- Lot1 : Le manioc est utilisé comme matière première.
Dans le premier seau la quantité habituelle d’azote (2.60g/L d’urée) est introduite
Dans le second seau cette quantité est doublée (5.20g/L d’urée)
Dans le troisième seau la quantité d’azote est quadruplée (10.40g/L d’urée)
- Lot 2 : Le manioc est utilisé comme matière première.
Dans le premier seau la quantité habituelle d’azote est introduite (5.71g/L de sulfate d’ammonium)
Dans le second seau cette quantité est doublée (11.42g/L de sulfate d’ammonium)
Dans le troisième seau la quantité d’azote est quadruplée (22.84g/L de sulfate d’ammonium)
- Lot 3 : La banane verte et utilisée comme matière première.
Dans un premier seau 5.20g/L d’urée sont introduits
Dans le deuxième seau la quantité d’azote à introduire a été quadruplée (10.40g/L d’urée)
Présentation des résultats de comptage de levures, Série 8
Au niveau des résultats de comptage (cf. Annexe 6, page 67), le maximum est atteint avec le manioc où nous avons quadruplé la quantité d’azote introduite initialement avec 2.50*107 levures/ml. Les résultats les moins concluants sont ceux obtenus pour la banane. Une des raisons possibles : La matière première utilisée présentait un murissement plus avancé dû à un stockage d’un peu plus de trois semaines en chambre froide. Le produit fini que nous avons obtenu avait une consistance beaucoup plus pâteuse et un brunissement plus prononcé que la fois précédente
L’apparition d’asticots lors de l’étape du séchage a été constatée. Cette étape a été prolongée du fait qu’il y avait toujours une présence importante de liquide avec les substrats banane et manioc. La grande quantité de liquide présente lors de la mise en séchage en est la principale cause. En effet, des fermentations acidifiantes générant des odeurs ont le temps de se déclencher quand le milieu reste longtemps à l’air avec une forte activité en eau. Les mouches sont attirées et y pondent des œufs qui ont le temps de donner des asticots. Cela peut être évité en ayant peu de liquide à la mise en séchage, ce qui est moins favorable à l’apparition de fermentations putrides et à une durée d’exposition courte qui ne laisse pas de délais suffisants à l’apparition d’asticots.
Pour le lot avec le manioc-sulfate d’ammonium les quantités de levures obtenues sont proches de celles de la série 6 (mélange canne/manioc avec de l’urée) mais ces résultats ne sont pas meilleurs malgré le fait que les concentrations en azote ajoutées initialement ont été doublées et quadruplées. Donc l’apport d’azote sous forme de sulfate d’ammonium n’apparait pas limitant.
Cette série d’expérimentations nous a de voir, d’après les résultats du comptage (Cf Annexe 6, page 67), que la qualité de la matière première comme la fraîcheur de la banane pourrait avoir une influence sur la multiplication de la levure. Cette fraicheur reste essentielle car malgré un stockage en chambre froide à 4°C la matière première découpée continue à évoluer physiologiquement (présence d’enzymes) et cela agit sur la qualité du produit fini.
9) Série 9 d’expérimentations avec de la canne à sucre : Test avec la bétonnière
La particularité de cette série c’est que le travail a été effectué avec des bétonnières comme fermenteurs. Il a fallu donc la monter puis programmer sa fonction d’agitation avec un boitier électrique synchronisant le temps d’agitation avec un cycle de cinq minutes puis dix minutes de repos. Ce cycle s’est répété durant tout le temps d’utilisation de la bétonnière. Etant donné la capacité de la cuve des bétonnières (160 litres), environ 25Kg de matière fraîche ont été utilisés par cycle fermentaire.
L’activation de la levure et l’ensemencement ont été effectué dans la cuve d’une seule bétonnière.
Une modélisation a donc été établie :
Modélisation Série 9: Canne à sucre (ajout croissant évolutif) Bétonnière 1
Jours Heures Quantités de canne à sucre ajoutée dans chacun des milieux
(Kg) Evolution de la population de levures J1 T0 1,700 5X J1 T1 3,400 10X J1 T2 6,800 20X J2 T3 13,600 40X Illustration n°12: Bétonnières
Dans 5 L d’eau tiède ont été introduit : 52.5 g de mélasse, 2.5 g de levure, 2.64 g d’urée
Pour l’ensemencement
19.50 g d’urée ont été introduit avec de la canne à sucre suivant le tableau de modélisation précédent.
Les apports de matières premières ont été effectués sur 2 jours en 4 fois, puis le processus de développement de la levure s’est poursuivi sur 2 autres jours avant de mettre au séchage le milieu fermenté. Pendant toute cette durée de fermentation la bétonnière a fonctionné sans faillir selon le cycle de 5 minutes d’agitation puis 10 minutes d’arrêt.
Présentation des résultats de comptage de levures, Série 9
Au cours de cette expérimentation des prélèvements d’échantillons n’ont pu être effectués que sur les trois premiers ajouts car plus il y avait ajout de canne à sucre et plus il était difficile d’échantillonner dans la phase liquide du milieu du fait de sa raréfaction liée à l’absorption du liquide par la canne. De ce fait en termes de comptage les résultats n’étaient pas très élevés, le maximum atteint est de l’ordre de 2.50*106 levures/ml.
Discussions
Pour tester le fait que l’azote ne soit pas limitant, comme l’a montré la série d’expérimentations 7(Graphique 5) nous avons fait le choix pour l’expérimentation suivante d’augmenter le taux d’apport d’azote sous forme d’urée, en ajustant cet apport à la quantité de matière sèche à laquelle correspondait les quantités de canne à sucre prévues par notre modélisation (modélisation série 9). L’objectif étant d’en apporter au moins assez pour que la production de protéines de levure d’ensemencement permette au produit final d’être à 14% de protéines/MS.
De plus du fait qu’il y ait très peu de liquide en fin de fermentation de la série précédente une décision a été prise sur la quantité de liquide à introduire initialement dans la cuve de la bétonnière pour la série d’expérimentation suivante. Au lieu d’y ajouter 5L d’eau, 10L sont à introduire.