THÈSE
En vue de l’obtention
Du Doctorat de l’Université de Toulouse
Délivré par :
l’Université Toulouse III- Paul Sabatier
Discipline : Science de la Vie et de la Santé, Biotechnologies
Présentée et soutenue publiquement par :
BLASCO Hélène
Le 16 mai 2008
Facteurs pharmacocinétiques et variabilité de
réponse aux médicaments utilisés dans le
traitement des lymphomes
JURY :
M.CARTRON.G Maître de Conférences des Universités Montpellier
M.CICCOLINI.J Maître de Conférences des Universités, HDR Marseille
M.COLOMBAT.P Professeur des Universités
Tours
Mme LE GUELLEC.C Maître de Conférences des Universités, HDR Tours
M.URIEN.S Directeur Recherche INSERM Paris
Ecole doctorale : Biologie, Santé, Biotechnologies
Unité de Recherche : UPS EA 3035, rattachée à l’IFR 300
Directeur de Thèse : Chatelut Etienne, Professeur de l’Université Paul
Sabatier
Remerciements
A Etienne Chatelut : Merci pour votre disponibilité et vos précieux conseils, notamment sur
la modélisation pharmacocinétique. Je vous suis reconnaissante du temps consacré à mes travaux malgré les difficultés pratiques…
A Chantal Le Guellec : Tu m’as communiqué toute ton énergie et ta passion pour la
recherche. Tu t’es toujours rendue très disponible, pédagogue et patiente…une vrai mère pour tes étudiants. J’ai tant appris à tes côtés…je regrette sincèrement que ça s’arrête, mais je ne desespère pas de te retrouver dans nos futurs projets.
A Saik Urien, Joseph Ciccolini, Guillaume Cartron, Philippe Colombat : Je vous
remercie de prendre le temps de juger ce travail et de me faire l’honneur de faire partie du jury. Je vous témoigne toute ma gratitude.
A Gilles Lalmanach : Je suis très heureuse d’avoir fait votre connaissance lors de notre
collaboration scientifique qui s’est révélée par ailleurs constructive, enrichissante et fructueuse. Je vous suis reconnaissante de m’avoir enseigné votre rigueur scientifique et de suivre encore de près mes projets professionnels et personnels.
A Hervé Watier : Merci de m’avoir accueillie au sein de l’équipe IPGA pour réaliser mes
travaux sur le rituximab.
A Delphine Sénécal : Merci pour le temps que vous nous avez consacré lors de l’étude des
données cliniques dans l’étude sur le lymphome cérébral.
A Emmanuelle : Merci pour ton aide dans l’étude sur le méthotrexate dans le lymphome
Remerciements
A mes parents : Ca y est, c’est fini !! Merci pour ces vagues d’amour, votre patience, et
votre confiance…
A benjamin et Julia : Merci d’être toujours présents, compréhensifs et de trouver les mots
justes pour m’encourager.
A Isabelle : Tu as bien allégé la fin de mon stage ! Merci de ta compréhension, de ton aide
précieuse et de ton efficacité. Ta bonne humeur était bien essentielle ces derniers temps...
A Claude, Claudette, Christophe, Valérie, David, Dominique : Merci pour votre soutien
et votre compréhension, notamment ces dernières semaines…
A Jean-François et Marie : Merci de nous accueillir dans votre belle ville et merci encore
pour votre soutien en toutes circonstances.
A Nico, Carine, Raphaël, Cécile, Valou, Chloé, Philippe, Nanouch, Philou : Merci pour
ces merveilleux moments passés ensemble…et à venir…
A mimi et Romain : Vous m’avez bien épaulée pour veiller si tendrement sur mon trésor…
A mon coeur : Tu le sais, sans toi, je n’aurai pas tenu…je suis si heureuse de te dire que
c’est fini…jusqu’à la prochaine fois !
Résumé
L’importante variabilité de la réponse thérapeutique dans les Lymphomes Malins non Hodgkiniens reste une préoccupation majeure pour les cliniciens. Au delà des facteurs pronostiques dépendants des caractéristiques du patient et de la pathologie déjà décrits, nous nous sommes intéressés au rôle de la pharmacocinétique des médicaments anticancéreux dans la variabilité de la réponse.
Nous avons montré l’existence d’une relation exposition-réponse pour le méthotrexate dans le lymphome cérébral primitif, ce résultat pourrait permettre d’argumenter l’utilisation préférentielle de l’un des deux schémas d’administration étudiés. Concernant le rituximab, après avoir fait le point sur les données bibliographiques existantes, nous avons mis au point une méthode de dosage de cet anticorps monoclonal par ELISA (Enzyme-linked immunosorbent assay) qui a secondairement été utilisée pour analyser les données d’une étude pharmacocinétique. Nous avons notamment essayé d’identifier les sources de variabilité pharmacocinétiques de ce médicament telles que la masse tumorale.
Publications en rapport avec le sujet de Thèse
I
: Blasco H, Sénécal D, Pinard E, Legouge A, Benz I, Hulot JS, Chatelut E, Le Guellec C. Methotrexate exposure and outcome in patients receiving a MBVP chemotherapyfor primary CNS lymphomas. En cours de soumission
II : Cartron G, Blasco H, Paintaud G, Watier H, Le Guellec C.
Pharmacokinetics of rituximab and its clinical use: thought for the best use? Crit Rev Oncol Hematol. 2007 Apr;62(1):43-52. Epub 2007 Feb 6. Review.
III : Blasco H, Lalmanach G, Godat E, Maurel MC, Canepa S, Belghazi M, Paintaud G, Degenne D, Chatelut E, Cartron G, Le Guellec C.
Evaluation of a peptide ELISA for the detection of rituximab in serum. J Immunol Methods. 2007 Aug 31;325(1-2):127-39. Epub 2007 Jul 17.
IV : Blasco H, Cartron G, Thibault G, Congy-Jolivet N, Hervé Watier, Chatelut E, Le Guellec C.
Pharmacokinetics of rituximab as a function of tumour burden parameters in patients with non-Hodgkin lymphoma.
BILIOGRAPHIE
ABREVIATIONS
... 9
INTRODUCTION
... 11
ETAT DES CONNAISSANCES
...14
1.
PRESENTATION DU SUJET
... 14
1.1.
Les lymphomes malins
... 14
1.1.1.
Description
... 14
1.1.2.
Incidence
... 16
1.1.3.
Classification des lymphomes
... 17
1.1.4.
Lymphomes folliculaires
... 18
1.1.5.
Lymphomes diffus à grandes cellules
... 19
1.1.5.1.
Caractéristiques générales
... 19
1.1.5.2.
Cas des lymphomes cérébraux primitifs (LCP)
... 19
1.2.
Principaux schémas de traitement du Lymphome malin Non Hodgkinien
... 20
1.2.1.
Lymphomes folliculaires
... 20
1.2.1.1.
Lymphomes folliculaires localisés de faible masse tumorale
... 21
1.2.1.2.
Lymphomes étendus de faible masse tumorale
... 21
1.2.1.3.
Lymphomes localisés ou étendus de forte masse tumorale
... 21
1.2.2.
Lymphomes diffus à grandes cellules
... 22
1.2.3.
Lymphomes cérébraux primitifs (LCP)
... 23
1.2.3.1.
Traitement actuel
... 23
1.2.3.2.
Chimiothérapie intensive
... 24
1.2.3.3.
Autres modalités de traitement
... 25
1.2.3.4.
Chimiothérapie intrathécale
... 25
1.2.4.
Traitements étudiés dans notre travail
... 26
1.2.4.1.
Méthotrexate (MTX)
... 26
1.2.4.1.1.
Mécanisme d’action
... 26
1.2.4.1.2.
Caractéristiques pharmacocinétiques
... 27
1.2.4.1.2.1.
Distribution
... 27
1.2.4.1.2.2.
Métabolisme
... 27
1.2.4.1.2.3.
Excrétion
... 28
1.2.4.1.3.
Principaux effets indésirables
... 29
1.2.4.2.
Rituximab (RTX)
... 30
1.2.4.2.1.
Mécanisme d’action
... 30
1.2.4.2.2.
Caractéristiques pharmacocinétiques
... 32
1.2.4.2.2.1.
Distribution
... 32
1.2.4.2.2.2.
Elimination
... 32
1.2.4.2.3.
Principaux effets indésirables
... 34
2.
FACTEURS IMPLIQUÉS DANS LA RÉPONSE THÉRAPEUTIQUE
A CES MEDICAMENTS
... 34
2.1.
Facteurs pronostiques
... 34
2.1.1.
Facteurs indépendants du traitement
... 34
2.1.1.1.
Facteurs généraux s’appliquant à tous types de lymphomes
... 34
2.1.1.1.2.
Facteurs liés au patient
... 35
2.1.1.1.3.
Caractéristiques cliniques et biologiques de la masse
tumorale
... 35
2.1.1.1.4.
Index Pronostique International
... 37
2.1.1.1.5.
Nouveaux facteurs pronostiques
... 39
2.1.1.2.
Cas des lymphomes folliculaires
... 40
2.1.1.3.
Cas des LCP
... 41
2.1.2.
Facteurs dépendants du traitement
... 43
2.1.2.1.
Résistance au MTX
... 43
2.1.2.2.
Altération du transport de MTX
... 43
2.1.2.2.1.
Transport d’influx
... 43
2.1.2.2.2.
Transport d’efflux
... 44
2.1.2.3.
Enzymes cibles du MTX
... 45
2.1.2.4.
Résistance au RTX
... 47
2.1.2.4.1.
Facteurs intervenant avant la liaison RTX-CD20
... 47
2.1.2.4.1.1.
Distribution du RTX
... 47
2.1.2.4.1.2.
Niveau d’expression du CD20
... 47
2.1.2.4.2.
Facteurs intervenant après la liaison RTX- CD20
... 48
2.1.2.4.2.1.
Signalisation cellulaire
... 48
2.1.2.4.2.2.
Apoptose
... 50
2.1.2.4.2.3.
Complement Dependant Cytotoxicity (CDC)
... 51
2.1.2.4.2.4.
Antibody dependant cell-mediated cytotoxicity (ADCC)
... 51
2.2.
Importance du niveau d’exposition au médicament sur la réponse
thérapeutique
... 53
2.2.1.
Relation concentrations-effet du MTX
... 53
2.2.1.1.
Relation existant dans d’autres indications que le LCP
... 53
2.2.1.2.
Administration de hautes doses de méthotrexate et passage
méningé
... 54
2.2.1.3.
Relations concentrations-effet dans LCP
... 55
2.2.2.
Relation concentrations- effet du RTX
... 57
2.2.2.1.
Dans le lymphome de bas grade
... 58
2.2.2.2.
Dans le lymphome de haut grade
... 59
2.2.2.3.
En association à une autogreffe
... 60
2.2.2.4.
Application aux schémas d’entretien
... 60
3.
FACTEURS DE VARIABILITE PHARMACOCINETIQUE
... 61
3.1.
Variabilité pharmacocinétique interindividuelle du MTX
... 61
3.1.1.
Fonction rénale
... 61
3.1.2.
Interactions médicamenteuses
... 62
3.1.3.
Polymorphismes génétiques
... 63
3.1.4.
Autres facteurs
... 64
3.2.
Variabilité pharmacocinétique interindividuelle du RTX
... 65
3.2.1.
Facteurs démographiques
... 65
3.2.2.
Immunisation
... 66
3.2.3.
Caractéristiques de la tumeur
... 66
3.2.3.1.
Type histologique
... 66
3.2.3.2.
Type de tumeur
... 66
3.2.3.3.
Masse tumorale
... 67
TRAVAIL PERSONNEL
...69
1.
Application au méthotrexate
... 69
2.
Revue sur la pharmacocinétique du rituximab
... 95
3.
Mise au point d’une méthode de dosage du rituximab par ELISA
...107
4.
Étude pharmacocinétique du rituximab associé à une chimiothérapie CHOP
dans le LNH.
...125
DISCUSSION GENERALE
... 150
CONCLUSION
... 158
Bibliographie
...159
ABREVIATIONS
5-CH3-THF : Acide 5-méthyl-tétrahydrofolique
5,10-CH2-THF : Acide N5,N10-méthylène-tétrahydrofolique
10-CHO-THF : 10-formyl-tétrahydrofolotate
7-OH-MTX : 7-hydroxyméthotrexate
AA : Acide aminé
ABC : ATP binding Cassette
Ac : Anticorps
ADCC : Antibody dependant cell-mediated cytotoxicity
ADN : acide désoxyribonucléique
Ag : Antigène
AICAR : 5-aminoimidazole-4-carboxamide ribonucléotide
AICARTF : 5-aminoimidazole-4-carboxamide ribonucléotide transformylase
AMP : Adénosine monophosphate
ATP : Adénosine triphosphate
AUC : Aire sous la courbe (Area under the concentration-versus-time curve)
BEAM : BCNU, Etoposide, Aracytine, Melphalan
BCR : Récepteurs aux cellules B
BCRP : Breast cancer resistance protein
CD : Cluster differentiation
CDC : Complement dependant cytotoxicity
CEOP : Cyclophosphamide, Epirubicine, Vinscristine, Prednisone
CHOP : Cyclophosphamide, Doxorubicine, Vincristine, Prednisone
CHVP-I : Cyclophosphamide, Etoposide, Prednisone, Vincristine-Interféron
CL : Clairance
CLcréat : Clairance de la créatinine
Cmax : Concentration maximum
COP : Cyclophosphamide, vincristine, prednisone
CT : Chimiothérapie
CT-Scan : tomodensitométrie
CVP : Cyclophosphamide, Vincristine, Prednisone
DAMPA : 2,4-diamino-N10-méthylptéroïque
DHF : Dihydrofolate
DHFR : Dihydrofolate réductase
dTMP : Désoxythymidine monophosphate
dUMP : Désoxyuridine monophosphate
ELISA : Enzyme-linked immunosorbent assay
Fc : Portion effectrice des Ig
FcRn : Neonatal Fc receptor
FcγR : Récepteurs de la portion Fc des IgG
FDG : 18-fluoro-2-désoxyglucose
FLIPI : Follicular Index Pronostic International
FOCE : First order conditional estimation
FPGS : Folylpoly-gamma-glutamate synthétase
GAR : Glycinamide ribonucléotide
GARTF : Glycinamide ribonucléotide transformylase
GGH : Gamma-glutamyl hydrolase
GMP : Guanosine monophosphate
GOELAMS : Groupe Ouest Est d'Etude des Leucémies et Autres Maladies du Sang
Gy : Gray
HACA : Human anti-chimaeric antibodies
HAMA : Human anti-murine antibodies
IMP : Acide inosinique monophosphate
IPI : Index Pronostique International
IRM : Imagerie par résonance magnétique
IT : Intrathécale (voie)
IV : Intraveineuse (voie)
IWF : International Working Formulation
LAL : Leucémie Aigüe Lymphoblastique
LAM : Macrophages associés aux lymphomes
LCR : Liquide céphalorachidien
LLC : Leucémie Lymphoïde Chronique
LNH : Lymphome Non Hodgkinien
LCP : Lymphomes Cérébraux Primitifs
MBVP : MTX, BCNU, VP16, méthylprednisolone
MDR : Multi-Drug Resistance
MRP : Multidrug Resistance Protein
MTHFR : Méthylène tétrahydrofolate réductase
MTX : Méthotrexate
MTX-HD : Méthotrexate à hautes doses
NK : Natural killer lymphocytes
OMS : Organisation Mondiale de la Santé
RFC : Récepteurs aux folates réduits
RC : Rémission complète
RP : Rémission partielle
RTX : Rituximab
SAB : Serum albumine bovine
SHMT : Sérine hydroxyméthyl transférase
SNC : Système Nerveux Central
SNP : Single Nucleotide Polymorphism
T½ : Demi-vie
THF : Tétrahydrofolate
TEP : Tomographie d’émission à positon
TS : Thymidylate synthétase
Vd : Volume de distribution
INTRODUCTION
Les traitements n’ont cessé d’évoluer dans les différentes pathologies malignes, mais l’importante variabilité de la réponse thérapeutique pour un même traitement administré reste un problème clinique préoccupant. De nombreuses études ont été menées afin de trouver les facteurs à l’origine de la variabilité de réponse. Le niveau d’exposition aux médicaments anticancéreux est reconnu comme un facteur majeur dans de nombreux cas. La variabilité pharmacocinétique inter-individuelle concerne des médicaments comme le 5-fluorouracile, le carboplatine, le méthotrexate (MTX)… Le fait qu’une même dose administrée ne soit potentiellement pas optimale pour tous les sujets est donc bien admis et la gestion des doses de médicaments anticancéreux pour un patient donné est toujours un problème dans la pratique quotidienne. A l’heure actuelle, la prescription de ces médicaments anticancéreux est le plus souvent basée sur la surface corporelle, supposée être le meilleur paramètre morphométrique pour adapter la posologie. Cependant, ce concept n’est validé que pour très peu de médicaments anticancéreux et est très probablement inadapté pour la plupart d’entre eux (1, 2). Les facteurs à l’origine de la variabilité pharmacocinétique sont en partie connus, mais des études restent à mener pour permettre une adaptation individuelle de la posologie ou, tout au moins, l'identification de sous groupes de patients nécessitant une prise en charge thérapeutique particulière.
Dans ce travail, nous avons étudié le rôle de la pharmacocinétique sur la variabilité de la réponse thérapeutique des médicaments utilisés dans l’une de ces pathologies malignes. Nous avons pris l’exemple du Lymphome malin Non Hodgkinien (LNH) en nous focalisant sur les 2 entités les plus fréquentes que sont le lymphome folliculaire et le lymphome diffus à grandes cellules, dont notamment le lymphome cérébral primitif. Nous avons limité nos travaux à 2 médicaments anticancéreux majeurs, le MTX, principal médicament utilisé dans le lymphome cérébral primitif et le rituximab (RTX), utilisé notamment dans le lymphome folliculaire.
La première partie de ce travail positionne le rôle de la pharmacocinétique du MTX et du RTX dans la variabilité de réponse thérapeutique dans les LNH. Nous rappelons tout d’abord la place de ces médicaments dans le traitement des entités de lymphomes étudiés. Puis nous évoquons les facteurs à l’origine de la variabilité de la réponse thérapeutique, tant les facteurs pronostiques dépendants de la pathologie et du type de lymphome que les facteurs dépendants du traitement. Enfin, nous abordons les facteurs de variabilité pharmacocinétique connus du MTX et du RTX.
La deuxième partie présente notre contribution à l’étude de cette problématique en présentant les travaux effectués lors de notre thèse.
Le premier s’intéresse à la relation exposition-réponse au MTX dans le lymphome cérébral primitif, pathologie dans laquelle la variabilité de réponse est très importante. De nombreuses études ont montré une relation entre les concentrations de MTX et la réponse thérapeutique dans diverses indications, mais peu de données sont disponibles dans le lymphome cérébral primitif. Nous avons ainsi étudié la corrélation entre la réponse thérapeutique chez des patients traités par MTX pour un lymphome cérébral primitif et les paramètres d’exposition au MTX. Nous nous sommes intéressés à 2 modalités d’administration du MTX au sein du protocole MBVP (méthotrexate, BCNU, VP16, méthylprednisone) et avons analysé dans ces 2 schémas l’impact de l’exposition au médicament sur la réponse clinique.
Les 3 autres travaux concernent plus spécifiquement le RTX.
Nous avons tout d’abord effectué une revue de la littérature sur la pharmacocinétique du RTX dans différentes pathologies. Ceci nous a permis de rappeler les principaux facteurs pouvant influencer l’exposition au RTX, notamment la question de la masse tumorale, toujours controversée.
Dans le but de mener des études pharmacocinétiques centrées sur la question de la variabilité pharmacocinétique du RTX, notre troisième travail a porté sur le développement et l’optimisation d’une méthode de dosage du RTX facilement utilisable en routine.
Le dernier travail concerne l’étude de la pharmacocinétique du RTX en association à une polychimiothérapie CHOP (cyclophosphamide, doxorubicine, vincristine, prednisone). Nous avons ainsi étudié la variabilité pharmacocinétique, l’influence du taux de lymphocytes B avant traitement sur la pharmacocinétique, et avons évalué la stationnarité de la pharmacocinétique.
Enfin, nous terminons ce travail par une discussion générale qui reprend les principaux résultats obtenus et replace, au travers des 2 exemples de médicaments anticancéreux choisis, l’apport de la pharmacocinétique dans la compréhension de la variabilité de réponse dans le LNH.
ETAT DES CONNAISSANCES
1. PRESENTATION DU SUJET
1.1.
Les lymphomes malins
1.1.1. Description
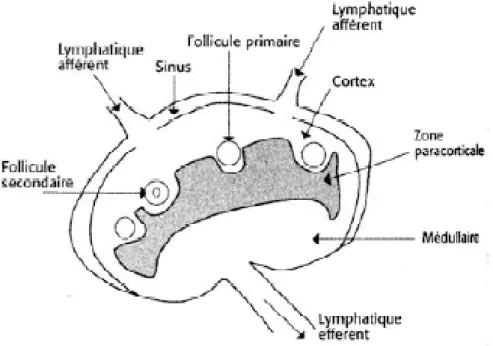
Les ganglions lymphatiques sont des organes lymphoïdes secondaires, situés sur le trajet des vaisseaux lymphatiques. Ils sont composés d’une zone corticale externe, siège des follicules lymphoïdes (lymphocytes B), d’une zone paracorticale, où se trouvent des lymphocytes T et des cellules dendritiques, et d’une zone médullaire centrale, peu cellulaire
(figure 1).
Les follicules sont des agrégats de lymphocytes et de cellules présentatrices d’antigène. Les ganglions non stimulés contiennent des follicules primaires qui se différencient en follicules secondaires après stimulation antigénique. Les follicules primaires sont constitués de petits lymphocytes B au repos et de cellules folliculaires dendritiques. Les follicules secondaires sont constitués d’une zone du manteau, en périphérie, reste du follicule primaire et d’un centre germinatif. Ce centre germinatif présente une zone sombre faite de «centroblastes» (grandes cellules, à noyaux non clivés) siège de la prolifération lymphoïde, et une zone claire faite de « centrocytes » (petites cellules à noyaux clivés) et de cellules dendritiques.
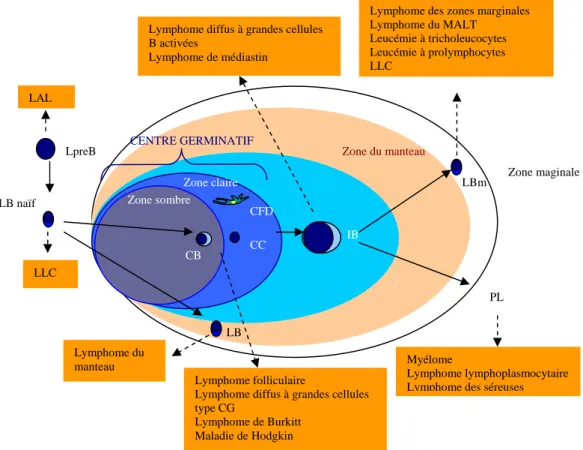
Les centres germinatifs sont importants pour le développement des cellules B mémoires et pour la réponse anticorps secondaires (figure 2).
Figure 2 : Composition d’un follicule secondaire
LAL : Leucémie aigüe lymphoblastique ; LLC : Leucémie lymphoïde chronique ; LpreB :
prélymphocyte B ; LB : lymphocyte B, CB ; centroblaste, CC, centrocyte, CFD : cellule folliculaire dendritique ; IB : immunoblaste ; LBm Lymphocyte B mémoire ; PL : plasmocyte
Zone sombre Zone claire Zone du manteau Zone maginale CB CC IB LBm PLB LpreB LB naïf LAL LLC Lymphome du manteau Myélome Lymphome lymphoplasmocytaire Lymphome des séreuses Lymphome folliculaire
Lymphome diffus à grandes cellules type CG
Lymphome de Burkitt Maladie de Hodgkin Lymphome diffus à grandes cellules B activées
Lymphome de médiastin
Lymphome des zones marginales Lymphome du MALT Leucémie à tricholeucocytes Leucémie à prolymphocytes LLC CFD CENTRE GERMINATIF LB
Les lymphomes malins correspondent à un ensemble hétérogène de proliférations lymphoïdes malignes atteignant principalement les organes lymphoïdes ganglionnaires et extraganglionnaires. Ces tumeurs se révèlent souvent par l’apparition d’adénopathies superficielles asymétriques, non inflammatoires, non douloureuses, localisées notamment au niveau cervical antérieur, sus-claviculaire et axillaire. Il est également possible de retrouver des adénopathies profondes, notamment médiastinales et sous-diaphragmatiques. La maladie peut s’accompagner de signes généraux, tels que la fièvre, l’amaigrissement et des sueurs profuses nocturnes. Une splénomégalie ou une hépatomégalie peuvent également être observées.
Les formes extra-ganglionnaires des LNH ne présentent pas de symptômes spécifiques mais des manifestations de l’envahissement des organes atteints (œil, moelle osseuse, estomac, cerveau...).
Le diagnostic des LNH repose sur un examen histologique après biopsie d’un ganglion ou d’un organe.
1.1.2. Incidence
Le LNH représente l’hémopathie maligne la plus fréquente et est en constante augmentation (5 % par an), sans que son étiologie ne soit totalement comprise. L'incidence mondiale des LNH est estimée à plus de 287 000 nouveaux cas par an, principalement dans les pays développés. Selon l’Institut National de Veille Sanitaire, le nombre de nouveaux cas estimés en France est d’environ 10 000 par an dont 56 % d’hommes. Cette pathologie est responsable d’environ 5250 décès par an. En vingt ans, le nombre de nouveaux cas a presque triplé. En France, le taux de survie moyen à 10 ans est estimé à 50 %.
1.1.3. Classification des lymphomes
La dernière classification publiée en 2001 (3) sous l’égide de l’Organisation Mondiale de la Santé (OMS) faisait suite à un consensus entre différents experts, principalement européens et américains, hématopathologistes, hématologues et oncologues (4). Cette classification définit une quarantaine d’entités de lymphomes qui se différencient par :
- La topographie prédominante, ganglionnaire, splénique ou extraganglionnaire ;
- Les données morphologiques telles que la taille des cellules, la forme du noyau, l’architecture de la prolifération tumorale…
- Les données immunophénotypiques afin de séparer les lymphomes B des lymphomes T/NK (natural killer) ;
- Les données génétiques, car certaines anomalies cytogénétiques sont utiles pour la classification de quelques entités de lymphomes ;
- Les données cliniques, telles que les signes généraux, les signes biologiques…
Cette classification distingue les lymphomes B des lymphomes T/NK.
- Les lymphomes B, caractérisés par la prolifération de cellules lymphoïdes de phénotype B, représentent 85 % des lymphomes de l’adulte. L’OMS sépare les néoplasies de précurseurs lymphoïdes B (lymphomes et leucémies lymphoblastiques) des proliférations lymphoïdes B matures.
- Les lymphomes T/NK caractérisés par la prolifération de cellules lymphoïdes de type T ou NK représentent moins de 15 % des lymphomes de l’adulte. L’OMS sépare également les néoplasies de précurseurs lymphoïdes T immatures (lymphomes et leucémies lymphoblastiques) des lymphomes T, dits « périphériques », constitués de lymphocytes T matures. Cette classification est donnée en annexe 1.
Il est nécessaire de distinguer les lymphomes agressifs (lymphomes B à grandes cellules, lymphomes de Burkitt, lymphomes T périphériques, lymphomes T à grandes cellules anaplasiques) des lymphomes indolents, à évolution lente (lymphomes folliculaires, de la zone du manteau, à cellules de la zone marginale, lymphoplasmocytoïdes).
Nous nous sommes focalisés essentiellement sur les 2 entités de lymphomes B les plus fréquentes : les lymphomes folliculaires et les lymphomes diffus à grandes cellules parmi lesquels les lymphomes cérébraux, dont l’incidence est faible mais en constante augmentation.
1.1.4. Lymphomes folliculaires
Les lymphomes folliculaires, dits indolents, représentent entre 20 et 25 % des LNH. Ces tumeurs sont composées de cellules B centro-folliculaires, mélange de centrocytes (petites à grandes cellules clivées), de centroblastes (grandes cellules non clivées), et de cellules dendritiques folliculaires. La richesse en centroblastes permet de grader ces lymphomes du grade 1 au grade 3 selon la classification OMS (5).
Sur le plan immunohistochimique, les cellules tumorales B expriment les antigènes (Ag) de surface CD20, CD10 et intracytoplasmiques BCL2 et BCL6. La cytogénétique montre dans 70 à 80 % des cas une translocation t(14 ; 18) (q32/q21), responsable de l’hyperexpression de la protéine BCL2, ayant un rôle anti-apoptotique dans les cellules lymphoïdes B centro-folliculaires tumorales. Le suivi de cette translocation est à la base de la détection de la maladie résiduelle par PCR chez les patients traités. Une transformation histologique (en LNH diffus à grandes cellules B) survient chez 70 à 80 % des patients au cours de l’évolution, parfois même dès le diagnostic.
Ces lymphomes, rarement localisés, se manifestent par des adénopathies périphériques et profondes, une atteinte splénique et un envahissement médullaire.
1.1.5. Lymphomes diffus à grandes cellules
1.1.5.1. Caractéristiques générales
Ces lymphomes, dits agressifs, représentent 35 % des LNH. Il s’agit de proliférations diffuses de grandes cellules B (CD20+, CD79a+), survenant de novo ou par transformation de lymphomes moins agressifs tels que le lymphome folliculaire ou le lymphome de la zone marginale.
Cette entité de lymphome est composée de différents sous-types histologiques, hétérogènes sur les plans morphologiques (variantes centroblastique, immunoblastique, riche en lymphocytes T et en histiocytes, anaplasique) et cliniques (lymphome à grandes cellules B du médiastin, lymphomes à grandes cellules B intravasculaires, lymphome des séreuses, granulomatose lymphomatoïde). Sur le plan cytogénétique, la translocation t(14 ; 18) est retrouvée dans 20 à 30 % des cas. De plus, des anomalies du gène LAZ-3/BCL6 sont fréquentes avec notamment un réarrangement dans environ 30 % des cas et des mutations dans 70 % des cas (6). Un réarrangement ou une amplification de C-MYC est observé dans de rares cas.
L’atteinte est localisée dans environ 30 % des cas avec des atteintes ganglionnaires médiastinale et abdominale augmentant rapidement de volume. Les atteintes extraganglionnaires sont par ailleurs révélatrices dans environ 30 % des cas.
1.1.5.2. Cas des lymphomes cérébraux primitifs (LCP)
Les lymphomes cérébraux primitifs sont des tumeurs peu fréquentes (environ 1 à 2 % des LNH et 4 à 7 % des tumeurs cérébrales primitives) (7, 8). Leur incidence a cependant été multipliée par 10 sur les 20 dernières années, notamment chez les sujets immunocompétents, sans qu’aucune raison ne soit identifiée (7, 9). L’incidence des tumeurs
primitives du système nerveux central (SNC) a en revanche diminué chez les sujets infectés par le VIH depuis l’introduction des traitements antirétroviraux.
Ces lymphomes sont relativement homogènes sur le plan histologique puisqu’il s’agit de lymphomes diffus à grandes cellules B dans 90 % des cas (10-12) et exceptionnellement des lymphomes à cellules T (2 à 6 % des cas).
La physiopathogénie est encore peu claire puisqu’il n’existe pas d’organes lymphoïdes ni de vaisseaux lymphatiques dans le système nerveux central. Les 2 hypothèses expliquant la survenue de LCP sont :
- la conséquence de la transformation maligne d’une lésion préexsitante de type inflammatoire ;
- la migration dans le SNC, par l’intermédiaire de « homing » (molécules d’adressages spécifiques), de lymphocytes B ayant subi une transformation maligne extracérébrale.
Les caractéristiques histologiques de ces tumeurs sont une infiltration périvasculaire et une atteinte disséminée du parenchyme cérébral (13). Ces lymphomes atteignent également les yeux (le vitré, la rétine, le nerf optique et la choroïde), les méninges ou la moelle épinière, en l’absence d’atteintes systémiques.
1.2.
Principaux schémas de traitement du Lymphome malin
Non Hodgkinien
1.2.1. Lymphomes folliculaires
La stratégie de traitement repose sur la détermination des facteurs pronostiques et du volume tumoral. L’évaluation du volume tumoral au diagnostic est souvent difficile du fait des techniques d’imagerie habituellement utilisées (tomodensitométrie) et du caractère souvent disséminé de ce lymphome. L’appréciation du volume tumoral repose alors sur l’évaluation dans trois dimensions de la taille de la ou des principales localisations lymphomateuses,
rendant très imprécise l’évaluation exacte du volume et donc de son évolution après traitement. Les techniques d’imagerie fonctionnelle telles que la tomographie d’émission à positron (TEP) utilisant le 18-fluoro-2-désoxyglucose (FDG-TEP), l’imagerie par résonance magnétique (IRM), ou le TEP-scan au FDG (FDG-TEP/CT) sont les plus communément utilisées pour l’appréciation de l’extension de la maladie et de la réponse au traitement en cancérologie (14). Ces techniques sont en cours d’évaluation dans le LNH.
1.2.1.1. Lymphomes folliculaires localisés de faible masse tumorale
La radiothérapie exclusive constitue le traitement classique dans ce type de tumeur. Certaines équipes préfèrent administrer une chimiothérapie de type CHOP (cyclophosphamide, doxorubicine, vincristine, prednisone) avant la radiothérapie (15) tandis que d’autres proposent une abstention thérapeutique.
1.2.1.2. Lymphomes étendus de faible masse tumorale
Il a été montré que l’abstention thérapeutique initiale donnait un taux de survie sans récidive à 5 ans comparable à celui obtenu après traitement par chimiothérapie d’emblée, sans modifier la fréquence de la transformation histologique.
1.2.1.3. Lymphomes localisés ou étendus de forte masse tumorale
Ce type de lymphome impose un traitement d’emblée. L’attitude la plus fréquente est d’utiliser un traitement comportant 6 à 8 cures de rituximab (RTX) en association à une polychimiothérapie (16) type CHOP (17) , CVP (cyclophosphamide, vincristine, prednisone)
(18) ou CEOP (cyclophosphamide, épirubicine, vincristine, prednisone) (19). Il a été montré que l’ajout de RTX au traitement CHOP améliorait la survie sans évènement à 5 ans (71 % vs 44 %) et la survie globale à 5 ans (98 % vs 75 %) dans les lymphomes folliculaires de grade III (20). Une évaluation médico-économique de l’ajout du RTX à une polychimiothérapie de type COP (cyclophosphamide, vincristine, prednisone) dans le lymphome folliculaire avancé a montré une amélioration de la survie globale et un bénéfice en terme de coût après ajout du RTX (21).
Ghielmini et al. ont montré dans une étude randomisée, que la survie médiane sans évènement était améliorée par un traitement d’entretien par RTX (4 administrations à 375 mg/m2, à 8 semaines d’intervalle) (22). De même, dans une revue récente (23), il est rapporté que le traitement d’entretien par RTX pouvant être poursuivi pendant plus de 2 ans sans problème de tolérance, permettait d’améliorer la survie sans évènement. L’utilisation de l’interféron en association avec le RTX en traitement d’entretien a également montré un bénéfice sur la qualité et la durée de la réponse ainsi que sur la survie sans évènement (24). L’autogreffe n’est pas recommandée en première ligne de traitement.
1.2.2. Lymphomes diffus à grandes cellules
La stratégie globale de traitement des lymphomes diffus à grandes cellules comprend une première phase de traitement dite d’induction reposant toujours sur une polychimiothérapie visant à obtenir une réponse complète. Les formes à hauts risque reçoivent également un traitement dit de consolidation, comportant plusieurs modalités : chimiothérapie (CT) identique au traitement d’induction, administrations successives de médicaments non utilisés dans le traitement d’induction et parfois intensification thérapeutique suivie d’une autogreffe de cellules souches.
Une méta-analyse réalisée en 2002 (25) a montré l’intérêt d’une chimiothérapie de type CHOP par rapport aux autres chimiothérapies de deuxième et troisième génération. De plus,
l’association du rituximab au CHOP semble désormais incontournable dans le traitement des lymphomes diffus à grandes cellules (26). Le Groupe d’Etude des Lymphomes de l’Adulte (GELA) (26), a mené une étude randomisée comparant la survie de patients âgés traités par CHOP seul ou par CHOP associé au rituximab (R-CHOP). L’analyse a montré un meilleur taux de réponse, un allongement de la survie sans évènement et de la survie globale chez les patients traités par R-CHOP. Cette amélioration de la survie globale pourrait être due à un plus faible taux de progression de la maladie pendant le traitement et à un moindre taux de rechute chez les patients en rémission complète. Récemment, une étude de pharmacoéconomie a montré le bénéfice clinique et économique de l’ajout de RTX à la chimiothérapie CHOP, chez des patients jeunes présentant un lymphome B diffus à grandes cellules de bon pronostic (27).
De même, le Groupe d’Etude Allemand sur le Lymphome Non-Hodgkinien de Haut Grade a comparé dans une étude randomisée, 6 cycles versus 8 cycles de CHOP séparés de 2 semaines, avec et sans RTX chez des patients âgés (28). Le schéma de traitement donnant les meilleurs résultats en terme de survie sans évènement est l’administration de 6 cycles de CHOP associés au RTX.
1.2.3. Lymphomes cérébraux primitifs (LCP)
1.2.3.1. Traitement
actuel
La nature infiltrante et diffuse des LCP limite le rôle de la chirurgie aux biopsies diagnostiques (10). Ces tumeurs sont sensibles à la radiothérapie qui ne peut cependant plus être exclusive et qui est associée à d’importantes complications (29, 30). Le traitement des LCP est limité par le problème de chimiorésistance, notamment au traitement de type CHOP. En effet, la barrière hématoencéphalique limite la pénétration des principaux médicaments cytotoxiques dans le cerveau et l’œil. Les caractéristiques immunohistochimiques de la tumeur pourraient également participer à cette chimiorésistance (31).
Le traitement standard utilisé actuellement repose sur une chiomiothérapie systémique comprenant le méthotrexate (MTX) à haute dose (3 g/m2), associé ou non à l’aracytine à haute dose, suivie d’une irradiation encéphalique. Les traitements combinés associés à une radiothérapie de la totalité de l’encéphale avec des doses de 40 à 45 Gy en fractionnement de 1,8 Gy par fraction montrent de bons résultats (32, 33) mais le risque de toxicité neurologique (troubles cognitifs, leucoencéphalopathies…) consécutif à ce traitement combiné chez les patients en rémission complète parait important (34). A ce jour, le traitement optimal des LCP n’est pas été parfaitement établi.
Le taux de réponse obtenu avec le traitement standard décrit précédemment peut parfois atteindre 90 %. Cependant, l’incidence des rechutes étant très élevée, de l’ordre de 50 %, la médiane de survie sans progression ou sans évènement varie selon les études de 12 à 24 mois (35, 36).
1.2.3.2. Chimiothérapie
intensive
L’intensification en première ligne thérapeutique a été évaluée dans des études américaine (37), française (38) et allemande (39). Il a été montré que cette intensification en première ligne thérapeutique était faisable et conduisait à des résultats encourageants. L’étude française du groupe GOELAMS a notamment inclus 25 patients atteints de LCP. La chimiothérapie d’induction comprenait 2 cycles MBVP (MTX, BCNU, VP16, méthylprednisone) suivies en cas de réponse par une association d’aracytine et d’ifosfamide et d’un recueil de cellules souches périphériques. L’autogreffe comportait un conditionnement par BEAM (BCNU, étoposide, aracytine, melphalan) et une irradiation corporelle totale. Quatre vingt % des patients étaient en rémission au terme de ce traitement, en incluant les patients autogreffés et les patients n’ayant reçu que la première phase de CT. La survie sans évènement et la survie globale étaient respectivement de 46 et 64 % à 34 mois.
1.2.3.3. Autres modalités de traitement
Kraemer et al. (40), ont étudié chez des patients jeunes, les effets d’une chimiothérapie intra-artérielle par méthotrexate et procarbazine administrée avec du mannitol afin de favoriser le passage à travers la barrière hématoméningée. La radiothérapie n’était effectuée qu’en cas de rechute. Dans cette étude, 65 % des patients étaient en rémission complète (RC). La survie globale à 5 ans était de 42 % avec une médiane de survie de 40,7 mois. Ce traitement n’est en pratique que peu diffusé car complexe et délicat.
1.2.3.4. Chimiothérapie
intrathécale
La chimiothérapie intrathécale (IT) est largement utilisée mais controversée. En effet, dans le traitement standard des LCP, le méthotrexate et l’aracytine utlisés à hautes doses ont une bonne diffusion méningée (41). Par ailleurs, De Angelis et al. (42), ont mené une analyse rétrospective qui a montré que l’adjonction d’une chimiothérapie intrathécale à la chimiothérapie systémique n’améliorait pas l’efficacité et pourrait augmenter la toxicité des traitements (43).
Le problème du traitement des méningites lymphomateuses est complexe et ne doit pas être sous estimé. L’incidence vraie de ces atteintes est mal connue car la ponction lombaire exploratrice, nécessaire à son diagnostic n’est pas toujours faisable au moment du diagnostic de LCP. Lors de ces atteintes, la diffusion des chimiothérapies IT peut être diminuée (41) ; il n’est donc pas utile d’envisager une prophylaxie complémentaire par chimiothérapie IT. Le traitement de ces méningites lymphomateuses persistant après la chimiothérapie d’induction peut être effectué par 2 injections intrathécales d’aracytine liposomale (Dépocyte ®) (44).
1.2.4. Traitements étudiés dans notre travail
Dans le cadre de notre travail, notre attention s’est portée sur les traitements par MTX administré à hautes doses et par le rituximab.
1.2.4.1. Méthotrexate
(MTX)
Dans le LCP, il a été montré que ce traitement, utilisé en première ligne seul ou en association, suivi ou non de radiothérapie permettait d’obtenir une réponse dans 70-80 % des cas, avec une survie globale à 2 ans de 60-70 % (45). Malgré le rôle central du méthotrexate à hautes doses (MTX-HD, > 1g/m2) dans le traitement du LCP, la dose optimale ainsi que le schéma d’administration n’ont à ce jour pas été déterminés et nécessitent d’être encore évalués.
1.2.4.1.1. Mécanisme
d’action
Le méthotrexate (acide N-(4-(((2,4-diamino-6-ptéridinyl)méthyl)méthylamino)benzoyl)-L-glutamique est un analogue structural de l’acide folique qui inhibe les processus métaboliques dépendants des folates. C’est un cytostatique sélectif de la phase S de la réplication cellulaire qui est actif sur les cellules à prolifération rapide : cellules cancéreuses, cellules normales de l'épithélium digestif et de la moelle osseuse.
Il agit principalement en inhibant la dihydrofolate réductase (DHFR), la thymidylate synthétase (TS) ainsi que la 5-aminoimidazole-4-carboxamide ribonucléotide (AICAR) et la glycinamide ribonucléotide (GAR) transformylase ( AICARTF, GARTF) (46), perturbant ainsi la synthèse de novo des purines et de la thymidine.
1.2.4.1.2. Caractéristiques
pharmacocinétiques
La pharmacocinétique du MTX n’est pas linéaire entre les doses standards et les hautes doses. Borsi et al. (47) ont montré que la clairance diminuait avec l’augmentation des doses mais que pour les différents schémas de MTX-HD les paramètres pharmacocinétiques restaient comparables.
1.2.4.1.2.1. Distribution
Après administration intraveineuse de MTX-HD, la diffusion tissulaire est rapide avec une demi-vie plasmatique courte, de l’ordre de 2 heures et une liaison aux protéines plasmatiques de l’ordre de 95 % (48). Le méthotrexate se concentre particulièrement dans les organes suivants : rein, rate, foie, vésicule biliaire, peau ainsi que dans les liquides d’épanchement pleural et d’ascite. Etant donné son fort taux d’ionisation à pH physiologique, le méthotrexate passe difficilement la barrière hémato-encéphalique, ce qui contribue à un ratio concentrations sériques-liquide céphalorachidien (LCR) de 30:1 à l’équilibre (49). Il pénètre dans les cellules par l’intermédiaire des transporteurs de folates réduits (RFC), récepteurs membranaires de haute affinité, par transport actif ou par diffusion passive lorsqu’il est présent à de fortes concentrations (> 20 µM) (50-52).
1.2.4.1.2.2. Métabolisme
Le MTX est métabolisé au niveau du foie en 7-hydroxyméthotrexate (7-OH-MTX). Ce métabolite, représentant moins de 10 % du médicament excrété, n’a pas d’action cytotoxique (53, 54) mais entre en compétition avec le méthotrexate pour le transport intracellulaire et
l’excrétion rénale. Il apparaît dans le plasma environ 6 heures après la perfusion de méthotrexate (55) et sa demi-vie est de 6 heures (47, 56).
L’autre principal métabolite du méthotrexate, l’acide 2,4-diamino-N10-méthylptéroïque (DAMPA), non toxique, représente moins de 5 % du médicament excrété dans les urines (57-59). Il est formé par hydrolyse du MTX par des carboxypeptidases bactériennes après sécrétion biliaire du MTX dans le tractus gastro-intestinal.
Le méthotrexate est également métabolisé au niveau intracellulaire, notamment dans les cellules néoplasiques et les hépatocytes. Dans la cellule, le MTX fixe un ou plusieurs résidus glutamate sous l'influence de la folyl-polyglutamate synthétase (FPGS) (60) et la forme polyglutamylée (figure 3) lui permet de rester plus longtemps à l'intérieur des cellules (61-68).
Figure 3 : Dérivés polyglutamylés du méthotrexate.
Les dérivés polyglutamylés du MTX bloquent de manière plus importante les enzymes cibles : DHFR, TS et de AICARTF (65, 67, 69-71). Leur formation dépend de la concentration extracellulaire de MTX et de la durée d’exposition au MTX (67, 71).
1.2.4.1.2.3. Excrétion
L’excrétion du méthotrexate se fait essentiellement par voie rénale par filtration glomérulaire, réabsorption par le tubule proximal puis sécrétion par les tubules distal et proximal. La fraction de dose totale excrétée dans les urines sous forme inchangée peut varier entre 60 et 90 % selon la voie et la durée d’administration (72, 73-76). Le méthotrexate et le 7-OH-MTX
sont mieux éliminés en milieu alcalin et un pH < 7 peut contribuer à une précipitation de ces composés dans les urines, en partie responsableS de la néphrotoxicité.
Moins de 10 % de la dose administrée sont excrétés par voie biliaire (77). La demi-vie terminale d’élimination est estimée à 8-15 heures lorsque la fonction rénale est normale.
1.2.4.1.3. Principaux
effets
indésirables
Parmi les complications majeures du MTX-HD, on retrouve des altérations de la fonction rénale pouvant être irréversibles ou létales (78-87). La fréquence de néphrotoxicité de grade 3 ou 4 varie de 0,6 % dans le traitement de l’ostéosarcome à 4-5 % chez les patients âgés traités pour un lymphome cérébral (84, 88, 89). Les mécanismes incriminés de cette toxicité sont notamment la cristallisation du MTX et du 7-OH-MTX dans les tubules rénaux (53, 54, 90, 91), une perturbation de la résistance vasculaire pré-glomérulaire, (53, 54, 90-95) et une toxicité directe sur les glomérules (85, 87) ou les tubules (54, 96). Le 7-OH-MTX est moins soluble que le MTX (53, 55), et sa formation rapide à partir du MTX peut accélérer cette néphrotoxicité.
L’élimination du MTX étant essentiellement rénale, l’insuffisance rénale fonctionnelle souvent induite par son administration contribue à l’augmentation de l’exposition, majorant ainsi sa toxicité rénale mais aussi hématologique - toxicité médullaire, thrombopénie, agranulocytose, pancytopénie - digestive, muqueuse et hépatique (81, 82, 87, 93, 97-99). De nombreux auteurs ont montré que la toxicité était largement corrélée à l’âge despatients, les sujets jeunes ayant une toxicité acceptable (100-102) et les plus âgés une toxicité plus sévère (103, 104).
1.2.4.2. Rituximab
(RTX)
Le rituximab est un anticorps monoclonal chimérique anti-CD20 de type IgG1 Kappa commercialisé sous le nom de Mabthéra® (laboratoire Roche). L’introduction du RTX a modifié les standards thérapeutiques avec d’abord la démonstration de son intérêt dans les lymphomes folliculaires en rechute ou réfractaire (105, 106), puis en première ligne (17, 18), ainsi que dans le traitement d’entretien des lymphome folliculaires répondant à un traitement de rattrapage par chimiothérapie seule ou associée au RTX (106). Une revue de la littérature publiée en 2007 à partir de l’analyse de 23 essais randomisés (107) rapporte les effets bénéfiques du RTX sur la survie globale et la survie sans progression dans différentes indications telles que les lymphomes indolents et agressifs en association à une chimiothérapie ou en traitement d’entretien. Une autre revue récente rapporte une amélioration du taux de réponse et de la survie chez les patients traités pour lymphome folliculaire et diffus à grandes cellules depuis l’instauration du RTX en association à une chimiothérapie standard (108).
1.2.4.2.1. Mécanisme d’action
Le rituximab se lie spécifiquement à l’antigène transmembranaire CD20 (figure 4) localisé à la surface des pré-lymphocytes B et des lymphocytes B matures ; la plupart des cellules B des lymphomes expriment cet antigène à leur surface (109-111).
Figure 4 : Fixation du rituximab au CD20. Liaison du fragment variable murin du rituximab
(en vert) à la boucle extracellulaire du CD20 entre le 3ème et le 4ème domaine transmembranaire.
Le CD20 est une phosphoprotéine non glycosylée de 35 000 Da, possédant 4 domaines transmembranaires et une boucle extracellulaire de 43 acides aminés (112) entre le 3ème et le 4ème domaine transmembranaire. Bien que son rôle physiologique soit mal connu, le CD20 pourrait participer à la régulation des flux calciques, et pourrait contribuer à la prolifération et à la maturation des cellules B (113-115). La liaison du RTX à sa cible conduirait à une activation des protéines tyrosines kinases, puis à la phosphorylation de la phospholipase C, augmentant ainsi le calcium intracellulaire et altérant la prolifération cellulaire (116-125) . Il a été montré par ailleurs que le RTX pouvait lyser les lymphocytes B exprimant le CD20 par CDC (« complement-dependant cytotoxicity »), ADCC ( « antibody-dependant cell-mediated cytotoxicity »), et induction d’apoptose (116-127) avec une internalisation du complexe antigène-anticorps très faible (128). Des auteurs rapportent que le mécanisme prédominant in vivo serait l’ADCC médié par les lymphocytes cytotoxiques, les monocytes, les macrophages et les neutrophiles (117, 129)
.
CD20
rituximab
1.2.4.2.2. Caractéristiques pharmacocinétiques
Les données pharmacocinétiques du rituximab disponibles sont essentiellement issues d’études réalisées chez des patients atteints de LNH traités par rituximab selon le schéma posologique de 375 mg/m²/ semaine pendant 4 semaines.
1.2.4.2.2.1. Distribution
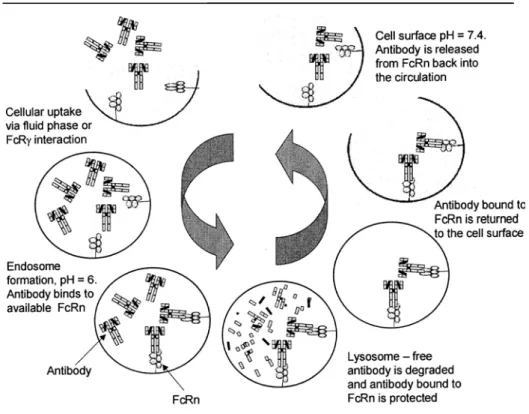
Il est communément admis que les anticorps ont une faible distribution tissulaire, du fait de leur hydrophilie et de leur important poids moléculaire. Les anticorps diffusent en fait dans les tissus par des mécanismes actifs, faisant notamment intervenir les récepteurs spécifiques FcRn (Neonatal Constant Fraction receptor) (130, 131).
Le rituximab suit une élimination biphasique avec une demi-vie (T½) de distribution de l’ordre de 33 heures (132). La distribution tissulaire du rituximab est limitée avec un volume central de distribution de l’ordre de 1,6 L/m² (132) et un volume de distribution à l’équilibre de 3,5 L/m² (133) ce qui caractérise une distribution dans le sérum uniquement.
1.2.4.2.2.2. Elimination
Très peu de données sont disponibles sur les voies d’élimination des anticorps monoclonaux. La monographie du RTX ne donne pas d’informations précises excepté la demi-vie d’élimination. Comme l’ensemble des protéines circulantes, les anticorps pénétrent dans les cellules endothéliales vasculaires par endocytose passive (134), mais les mécanismes de cette endocytose sont encore mal connus.
La demi-vie d’élimination des IgG endogènes est d’environ 21 jours chez l’homme, et a été décrite d’environ 20 jours pour le RTX (132).
La longue demi-vie d’élimination a pour conséquence une accumulation des concentrations sériques de rituximab à chaque administration hebdomadaire et la persistance de concentrations détectables plusieurs mois après la fin des administrations (133, 135). Cette longue demi-vie est liée à l’intervention d’un récepteur saturable, le FcRn situé à la surface des cellules endothéliales et des cellules intestinales et rénales (130, 131, 136). Identifié il y a plus de 30 ans, ce récepteur protège les IgG du catabolisme endogène. Les IgG endocytées mais non fixées au FcRn sont dégradées dans les lysosomes, les autres étant transportées hors de la cellule (130, 137, 138) (figure 5).
1.2.4.2.3. Principaux effets indésirables
Les principaux effets indésirables rapportés pour le RTX concernent une toxicité modérée liée à la perfusion : fièvre, nausées, prurit, frissons, asthénie, céphalées... Quelques cas d’hypotension, de troubles respiratoires dus au relargage des cytokines ont également été rapportés (139). Des cas de toxicité hématologique à type d’anémie, de thrombocytopénie ou de neutropénie ont été observés, certains patients développant même des toxicités sévères de grade III ou IV (140-145). Ces effets indésirables sont plus évidents lors de la première perfusion et tendent à décroître avec les administrations suivantes. Cette toxicité est le plus souvent modérée, transitoire et n’interfère pas avec le schéma d’administration initialement prévu (141-143, 145).
2. FACTEURS IMPLIQUÉS DANS LA RÉPONSE
THÉRAPEUTIQUE A CES MEDICAMENTS
2.1. Facteurs
pronostiques
2.1.1. Facteurs indépendants du traitement
2.1.1.1. Facteurs généraux s’appliquant à tous types de lymphomes
2.1.1.1.1. Caractéristiques anatomo-pathologiques
Il est reconnu que certaines formes histologiques ont un pronostic particulier. Ainsi, les lymphomes à cellules du manteau ou les lymphomes à haut grade de malignité (lymphome lymphoblastique…) sont plus difficiles à traiter car ils s’accompagnent fréquemment d’un envahissement médullaire et méningé. Les LNH de phénotype histologique T apparaissent également plus graves que ceux de phénotype B. En revanche les lymphomes diffus à grandes cellules B semblent présenter un pronostic homogène.
2.1.1.1.2. Facteurs liés au patient
L’âge est un élément important à prendre en compte dans le pronostic. Il ne semble pas que les lymphomes du sujet âgé soient très différents de ceux des plus jeunes mais les sujets jeunes supportent mieux le traitement qui peut donc être optimal. Les chimiothérapies proposées pour les différents types de lymphome sont couramment adaptées à l’âge et ces traitements peuvent dorénavant s’appliquer aux sujets de plus de 80 ans.
La tolérance de la maladie par le patient est un facteur important à prendre en compte. On la caractérise notamment par l’indice d’activité ou performance status (PS), détaillé dans le tableau (tableau 1) ci-dessous :
Tableau 1 : Description de l’indice d’activité
Les symptômes B définis dans la classification Ann Arbor (tableau 2) sont également le reflet de l’état général du malade. Le taux d’albumine sérique (< 35 g/L) et l’anémie (hémoglobine < 12 g/dL), reflétant probablement la sécrétion de cytokines par les cellules tumorales, sont également à prendre en compte.
2.1.1.1.3. Caractéristiques cliniques et biologiques de la masse
tumorale
L’extension de la maladie se définit par son stade, déterminé notamment par un examen clinique, un scanner, une biopsie médullaire et une ponction lombaire. La classification Ann Arbor détermine 4 stades distinguant les formes localisées (stades I et II) des formes
P S De scription
0 Activité normale
1 Présence de sym ptom es m ais poursuite d'une activité am bulatoire
2 Incapacité de travailler, alitement dans la journée, mais de m oins de 50% du tem ps 3 Alitement plus de 50% du tem ps
4 Alitement total 5 Décès
disséminées (stade III et IV). L’indice E prend en compte l’implication de sites extra-lymphatiques. Les suffixes A et B sont ajoutés dans cette classification : A indique notamment l’absence des symptômes suivants : fièvre inexpliquée avec une température supérieure à 38°C, sueurs nocturnes, perte de poids inexpliquée d'au moins 10% du poids du corps au cours des 6 mois précédents (tableau 2) (146). La taille de la masse tumorale (facteur X) a également une signification pronostique et on définit une maladie « Bulky » lorsque la taille de la tumeur est supérieure à 10 cm (tableau 2).
Biologiquement, l’élévation du taux sérique des LDH au-delà des valeurs normales (350 UI) (147-149) traduisant une importante lyse des cellules tumorales est un facteur de mauvais pronostic ; de même, pour le taux de béta-2-microglobuline au dessus de 3 mg/L, traduisant un degré élevé de malignité (150-152).
2.1.1.1.4. Index Pronostique International
Aucun de ces paramètres ne permet à lui seul de prédire l’évolution de la maladie. Les index pronostiques sont des combinaisons de facteurs pronostiques permettant d’établir un score dont le but est de prévoir l’évolution de la maladie en terme de taux de réponse complète, de survie sans évènement à 5 ans, de survie globale à 5 ans. A partir de ce score et de l’évolution prévue, on détermine la meilleure stratégie thérapeutique (149).
L’Index Pronostique International (IPI) (147) résulte d’un lourd travail coopératif international qui était développé au départ pour le diagnostic des lymphomes agressifs mais qui est également adapté à tous les types de LNH. Cet IPI a notamment été validé dans les lymphomes diffus à grandes cellules (153, 154). Il définit 5 facteurs qui ont chacun approximativement le même pouvoir pronostique (tableau 3) :
Tableau 3 : Facteurs pronostiques intervenant dans l’IPI (d’après Armitage et al.)(146)
Facteurs pronostiques
Age > 60 ans Indice d'activité > 2
Lactate déshydrogénase > 1 x normal Sites extraganglionnaires > 2
Stade III ou IV
Catégories de risques (Facteurs)
Bas (0 ou 1)
Bas-intermédiaire (2) Haut-intermédiaire (3) Haut (4 ou 5)
L’IPI ajusté à l’âge est un index simplifié, couramment appliqué, qui ne comporte que 3 facteurs de risque : le stade clinique, l’état général et le taux de LDH.
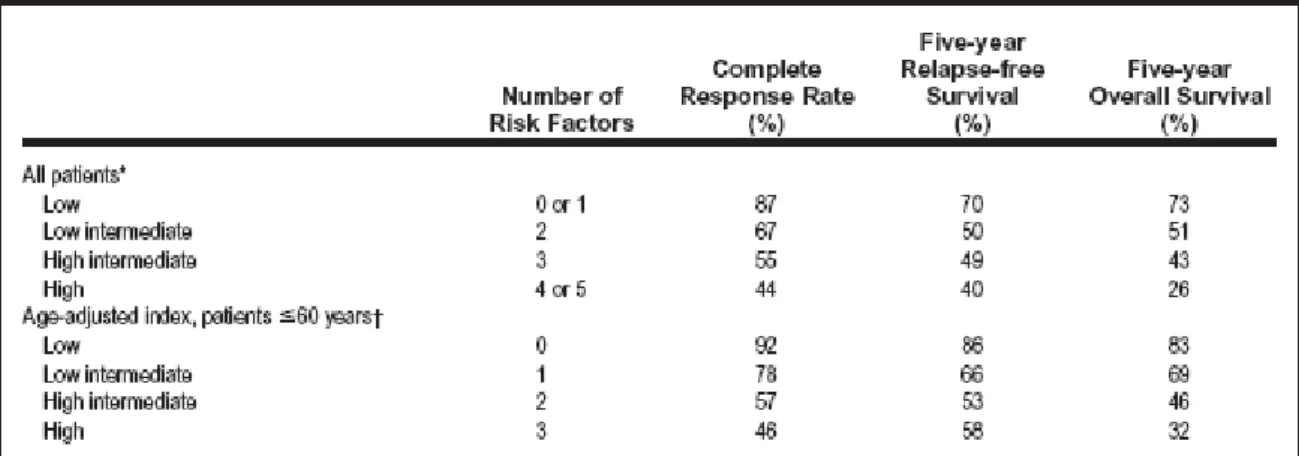
Pour calculer la valeur de l’IPI, on additionne le nombre de facteurs défavorables. Le score peut donc s’étendre de 0 à 3. Le taux de réponse complète, la survie sans évènement à 5 ans ainsi que la survie globale à 5 ans sont définis selon 4 catégories : bas (0 ou 1), bas-intermédiaire (2), élevé-bas-intermédiaire (3), élevé (4). (tableau 4)
Tableau 4 : Taux de réponse complète, survie sans rechute à 5 ans, survie globale à 5 ans
chez des patients atteints de LNH agressifs en fonction du nombre de facteurs de risques définis par l’IPI. D’après Armitage et al.(146),(147)
En France, chez les sujets de moins de 60 ans présentant un lymphome agressif localisé de stade I ou II, n’ayant aucun facteur de risque à l’IPI ajusté, la survie globale à 5 ans est estimée à 80 % (155). Par ailleurs, chez les patients de moins de 60 ans mais ayant au moins 2 ou 3 facteurs de l’IPI ajusté à l’âge, la survie globale à 8 ans est de 64 % (156). Chez des sujets de plus de 60 ans avec un facteur ou plus de l’IPI ajusté à l’âge et recevant un traitement de type CHOP associé au RTX, le taux de survie globale est de 59 % à 4 ans (26).
Certains auteurs ont postulé que l’introduction du RTX notamment dans le traitement du lymphome diffus à grandes cellules pouvait remettre en cause la pertinence de l’IPI et de l’IPI ajusté à l’âge (157). Des patients recevant CHOP vs R-CHOP ont été comparés en
terme de survie et de facteurs pronostiques. La survie à 2 ans a été plus élevée avec le traitement R-CHOP (85,6 % vs 64,7 % avec le traitement par CHOP), mais l’IPI et l’IPI ajusté à l’âge se sont révélés moins utiles dans le modèle pronostique des patients traités par R-CHOP. Ainsi, l’âge > 60 ans, le taux de LDH augmenté, la diminution du taux d’albumine sérique et le stade avancé de la maladie, étaient indépendamment associés à la survie chez les patients traités par CHOP, mais seuls les facteurs sexe et stade de la maladie se sont montrés indépendamment associés à la survie chez les patients traités par R-CHOP. Les critères IPI doivent donc être réévalués en cas d’ajout de RTX au traitement classique.
Malgré la détermination de ces facteurs, les classifications pronostiques actuelles ne reflètent pas totalement l’hétérogénéité évolutive de la maladie, avec des réponses thérapeutiques et des survies parfois très différentes.
2.1.1.1.5. Nouveaux facteurs pronostiques
L’agressivité et la sensibilité thérapeutique de la maladie dépendent de l’expression combinée de nombreux gènes intervenant notamment dans les processus de régulation du cycle cellulaire, de régulation de l’apoptose et de différenciation de cellules B (158). Une classification moléculaire, complémentaire à l’IPI, basée sur l’expression de milliers de gènes utilisant la technique de puces à ADN pourrait donc être utile. Cependant les études réalisées sur ces biomarqueurs pronostiques donnent souvent des résultats contradictoires qui ne permettent pas l’identification évidente d’un ou plusieurs gènes (159). A titre d’exemple, la signification pronostique de la présence d’une translocation t(14 ;18) reste controversée, et a été retrouvée meilleure, plus mauvaise ou identique. De même, la signification pronostique du site de cassure sur BCL2 est discutée. Certains auteurs (160) ont montré que la translocation t(14 ;18) impliquant le site mcr était associée à un meilleur pronostic, tandis que d’autres ne retrouvent pas de corrélation significative (161). De plus, ces biomarqueurs doivent être réévalués chez les patients traités par immunothérapie (159).
Le potentiel de ces facteurs pronostiques est très important et ils pourraient être utilisés en combinaison avec les facteurs cliniques pour améliorer la classification pronostique des lymphomes. On pourrait en effet identifier de nouvelles classes de tumeurs dans des groupes morphologiquement homogènes mais hétérogènes du point de vue de leur évolution clinique.
2.1.1.2. Cas des lymphomes folliculaires
Un Index Pronostic International adapté aux lymphomes folliculaires (FLIPI) a été développé afin d’adapter au mieux la décision thérapeutique (162). Dans cet index, on retrouve 5 facteurs : l’âge (< ou > 60 ans), le stade Ann Arbor (I-II ou III-IV), le taux d’hémoglobine (< 120 g/L, ou ≥ 120 g/L), le nombre d’aires ganglionnaires atteints (< 4 ou ≥ 4) et le taux de LDH (inférieur à la normale ou normal-supérieur). Trois groupes à risques sont définis : bas risque (0-1 facteur), risque intermédiaire (2 facteurs), risque élevé (> ou = 3 facteurs). Les risques de survie sans évènement à 5 ans et 10 ans selon les groupes à risque sont représentés dans le tableau ci-dessous (tableau 5).
Tableau 5 : Résultats de survie globale à 5 ans, à 10 ans et risque relatif de décès selon les
groupes à risque tels qu’ils sont définis par FLIPI (162).
N=1795,SE : Standard Error, NA : not applicable
Cet index a été développé avant l’introduction du RTX, mais il reste pronostique pour la réponse clinique après un traitement par R-CHOP (163). Cependant, le FLIPI seul ne peut
Groupe de risque Nombre de facteurs Distribution de patients Survie globale à 5 ans % (SE) Survie globale à 10 ans % (SE) Risque relatif Intervalle de confiance (95 %) Bas 0-1 36 90,6 (1,2) 70,6 (2,7) 1 NA Intermédiaire 2 37 77,6 (1,6) 50,9 (2,7) 2,3 1,9-2,8 Elevé >= 3 27 52,5 (2,3) 35,5 (2,8) 4,3 3,5-5,3
donner des prédictions précises de réponse à tous les individus présentant un lymphome folliculaire.
Le sous groupe histologique aurait également un impact pronostique non négligeable. Berinstein et al. ainsi que Mc Laughlin et al. (135, 143), ont observé que les patients dont l’histologie de la tumeur était de classe A selon l’International Working Formulation (IWF) avaient un taux de réponse plus bas que ceux dont l’histologie était de groupe B, C ou D, ou même que ceux qui présentaient un autre sous type de lymphome.
Il a été récemment montré que des acteurs de la réponse immunitaire tels que les macrophages associés aux lymphomes (LAM) ou les cellules T régulatrices étaient des éléments importants à prendre en compte comme facteur pronostique de la survie globale dans le lymphome folliculaire (164, 165).
2.1.1.3. Cas des LCP
Certaines études ont décrit des facteurs pronostiques de survie dans ce type de lymphome, sur le même modèle que l’IPI, incluant des variables liées à l’agressivité de la tumeur, au site et à l’extension de la maladie. Parmi ces facteurs, nous pouvons retrouver (166, 167) : l’âge (> ou < 60 ans), l’indice d’activité (> ou < 1), le taux de LDH élevé, la concentration protéique dans le LCR ou l’implication de régions profondes du cerveau. Ces facteurs sont significativement et indépendamment associés à un taux de survie plus faible et sont donc utilisés pour calculer un score pronostique (figure 6).
Figue 6 : Courbe de survie pour les patients atteints de LCP et regroupés selon l’IPI : les
patients (n=105) avec un nombre de facteur de risque entre 0 et 1 (ligne pleine), entre 2 et 3 (fins pointillé) et entre 4 et 5 (larges pointillés), d’après l’étude de Ferreri et al. (167).
Plus récemment, Abrey et al., (166) ont défini un modèle pronostique plus simple, basé sur le critère de l’âge et l’indice d’activité. Trois classes de patients ont ainsi pu être identifiées : les patients de moins de 50 ans, les patients de plus de 50 ans et avec un indice de Karnofsky, caractérisant l’état général du patient, supérieur ou égal à 70, et enfin les patients de plus de 50 ans avec un indice de Karnofsky inférieur à 70. Certains auteurs démontrent néanmoins que les scores qui incluent le taux de LDH, le taux de protéines dans le LCR, et l’implication de régions profondes du cerveau permettent une meilleure stratification du risque encouru par les patients atteints de LCP (168). D’autres facteurs tels que la présence de cellules lymphomateuses dans le LCR ont également été décrits comme significativement corrélés à une survie plus courte (169). Comme cela a été démontré dans quelques études chez des patients présentant un lymphome diffus à grandes cellules (170, 171), la surexpression de BCL6 a été montrée comme significativement corrélée à la survie (172).
Une étude récente (173) montre que l’analyse protéomique du LCR représente un biomarqueur individuel plus sensible dans l’identification du cancer que l’analyse cytologique. Ce marqueur pourrait également jouer un rôle dans le pronostic de LCP.
2.1.2. Facteurs dépendants du traitement
2.1.2.1. Résistance au MTX
Des études pré-cliniques et cliniques ont identifié de nombreux facteurs de résistance au MTX ; ils sont notamment associés à une altération qualitative et/ou quantitative des transports d’influx ou d’effux et des enzymes cibles du MTX.
2.1.2.2. Altération du transport de MTX
2.1.2.2.1. Transport d’influx
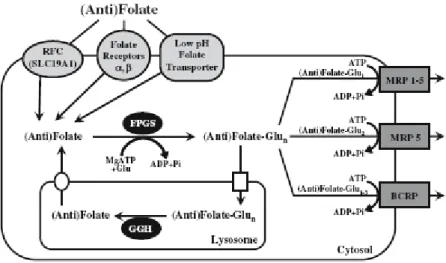
Nous avons précédemment indiqué que le transport du MTX à l’intérieur de la cellule se faisait principalement par les transporteurs aux RFC (figure 7).
Figure 7 : Transport d’influx et d’efflux du MTX ; formation et hydrolyse des polyglutamates
de MTX. D’après Assaraf et al. (174).
GGH : gamma glutamyl hydrolase ; FPGS : folylpoly-gamma-glutamate synthétase BCRP : Breast Cancer Resistance Protein ; MRP : Multidrug Resistance Protein