HAL Id: dumas-01784985
https://dumas.ccsd.cnrs.fr/dumas-01784985
Submitted on 4 May 2018HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Apport de la thérapie photodynamique en endodontie
Jean-Baptiste Duong
To cite this version:
Jean-Baptiste Duong. Apport de la thérapie photodynamique en endodontie. Sciences du Vivant [q-bio]. 2018. �dumas-01784985�
AVERTISSEMENT
Cette thèse d’exercice est le fruit d’un travail approuvé par le jury de soutenance
et réalisé dans le but d’obtenir le diplôme d’État de docteur en chirurgie
dentaire. Ce document est mis à disposition de l’ensemble de la communauté
universitaire élargie.
Il est soumis à la propriété intellectuelle de l’auteur. Ceci implique une obligation
de citation et de référencement lors de l’utilisation de ce document.
D’autre part, toute contrefaçon, plagiat, reproduction illicite encourt toute
poursuite pénale.
Code de la Propriété Intellectuelle. Articles L 122.4
UNIVERSITÉ PARIS DESCARTES
FACULTÉ DE CHIRURGIE DENTAIRE
Année 2018 N° 012
THÈSE
POUR LE DIPLÔME D’ÉTAT DE DOCTEUR EN CHIRURGIE DENTAIRE Présentée et soutenue publiquement le : 29 janvier 2018
Par
Jean-Baptiste DUONG
Apport de la thérapie photodynamique en endodontie
Dirigée par M. le Docteur Denis Bouter
JURY
Mme. le Professeur Tchilalo Boukpessi Président
Mme. le Docteur Catherine Besnault Assesseur
M. le Docteur Denis Bouter Assesseur
Remerciements
À Mme le Professeur Tchilalo Boukpessi
Docteur en Chirurgie dentaire
Docteur de l’Université Paris Descartes Docteur en Sciences odontologiques Habilitée à Diriger des Recherches
Professeur des Universités, Faculté de Chirurgie dentaire Paris Descartes Praticien Hospitalier, Assistance Publique-Hôpitaux de Paris
Qui me fait l’immense honneur de présider ce jury. Je vous suis très reconnaissant pour votre enseignement. Je salue votre professionnalisme et votre implication dans la préparation à l’internat. Veuillez-trouver ici l’expression de mes sincères remerciements.
À Mme le Docteur Catherine Besnault
Docteur en Chirurgie dentaire Docteur de l’Université Paris Diderot
Maître de Conférences des Universités, Faculté de Chirurgie dentaire Paris Descartes Praticien Hospitalier, Assistance Publique-Hôpitaux de Paris
Vous me faites l’honneur de juger ce travail. Je vous remercie pour votre pédagogie et vos précieux conseils tout au long de ces années passées. Vous avez su me transmettre la rigueur nécessaire à la pratique de l’endodontie. Mais vous m’avez également montré toute l’adresse et la douceur dans l’exercice de cette discipline qui vous sied si bien. Avec mes remerciements, je vous prie de trouver ici l’expression de mes sentiments distingués.
À M. le Docteur Denis Bouter
Docteur en Chirurgie dentaire
Docteur de l’Université Paris Descartes
Maître de Conférences des Universités, Faculté de Chirurgie dentaire Paris Descartes Praticien Hospitalier, Assistance Publique-Hôpitaux de Paris
Qui me fait l’honneur de diriger cette thèse. Je vous remercie pour votre soutien, votre disponibilité, votre aide, votre patience et surtout pour vos précieux conseils. Votre savoir infaillible dans tous les domaines force le respect et l’admiration. J’ai aimé discuter avec vous sur ce sujet et vos connaissances m’ont beaucoup apportées. Votre sens de l’humour a su me redonner le sourire lors de l’élaboration de ce travail.
À M. le Docteur Romain Orlu
Docteur en Chirurgie dentaire
Assistant Hospitalo-Universitaire, Faculté de Chirurgie dentaire Paris Descartes
Qui me fait le plaisir de juger ce travail. Je vous suis très reconnaissant pour toute l’aide que vous m’avez apportée. Je vous remercie pour m’avoir transmis votre savoir, de m’avoir sorti de situations complexes avec tant de facilité, saluant au passage votre excellente maîtrise de l’art dentaire. Je suis très honoré de votre participation.
A mes parents, à qui je dois la reconnaissance éternelle. Vous avez fait de moi l'homme que je suis maintenant. Vous avez su apporté tout l'amour dont un fils a besoin. J'espère que vous êtes désormais fiers de vos deux fils. Je vous aimerai toujours Papa et Maman !
A mon frère, tu as su me supporter pendant de longues années. Excuse-moi encore pour toutes les BD que j'ai pu déchirer, gribouiller, et pour tout tes jouets cassés. Je réparerai mes erreurs en prenant soin de tes dents et de celles de ma petite nièce adorée ! Je vous souhaite à Audrey, à Camille et à toi une vie heureuse et épanouie.
A mes grands-parents, je vous fais de gros bisous. A toi aussi mamie Jacky, bien que tu sois parti beaucoup trop tôt.
A tous les Reds qui m'ont accueilli dans l'équipe et à Bruno qui m'a orienté vers l'odontologie
A Snowbel! Croyais le ou pas, c'était le meilleur bichon frisé du monde.
A Tommy et à la famille Laval. Vous avez toujours su m'accueillir chez vous et avec tant de convivialité. Toto, j'ai fini mes études longues, à toi de te bouger les fesses maintenant !
A SteevO, Vitto, Franck et toute l'équipe de Maisons-Alfort, ça m'aura fait plaisir de vous revoir.
A la team de Moliets, le Bestio, le Zerboobs, le professeur Chen, le Dubs, le Guy, Mansouy et Calvin, mais aussi Léa, Lucille, Sophie, Popo, Jerry, Nem-Nem, le Gabin et toute la série, j'espère qu'on restera toujours en contact. Passez vite votre thèse pour ceux qui ne l'ont pas encore fait !
A Sybille et Casa, je vous souhaite beaucoup de bonheur pour votre nouvelle vie à Marseille. L'asso a su nous rassembler, j'espère que notre amitié permettra désormais de nous revoir.
A toute l'équipe de Créteil, le meilleur service. A mes trois binômes Chmoulick, Micka et Doussourzain (id. Dessarzin), ne nous embrouillons plus pour des histoires de box. A Jerem qui me ramenait toujours en scoot même sous la pluie.
Aux Goyat, merci à vous aussi de m'avoir accueilli dans votre famille. J'ai partagé de très bons moments avec vous. A Toutoujounet (alias Tigrou, Tijtij, Tiji, "et Tij alors", ou encore "Ohh qu'il est mignon le piti chat"), je ferai un effort pour me réveiller plus tôt.
Et enfin à toi, Blanche, mon amour, la femme de ma vie, je t’aime ! Ne sois pas triste parce que tu es la dernière citée, car tu as la meilleure place dans mon coeur ! Nous vivrons le meilleur et le pire, mais toujours ensemble ! Je t'aimerai toute ma vie !
Table des matières
INTRODUCTION ... 3
1: LA DESINFECTION ENDODONTIQUE ... 4
1.1L’INFECTION ENDODONTIQUE : ... 4
1.1.1. Définition : ... 4
1.1.2. Les différents types d’infections endodontiques... 5
1.1.3. Le biofilm bactérien ... 7
1.2LES MOYENS DE DESINFECTION ENDODONTIQUE ... 8
1.2.1 Une désinfection chimio-mécanique ... 8
1.2.2. L’irrigation canalaire ... 8
1.2.3. L’activation des solutions d’irrigation... 10
2 : LA THERAPIE PHOTODYNAMIQUE ... 14
2.1.HISTOIRE ... 14
2.2.PRINCIPED’ACTION ... 14
2.2.1 L’interaction photon-photosensibilisant ... 15
2.2.2 Création des espèces réactives de l’oxygène et d’oxygène singulet ... 16
2.3.LES PHOTOSENSIBILISANTS ... 18
2.3.1 Le bleu de méthylène ... 21
2.3.2 Le bleu de Toluidine ... 22
2.4.LES DISPOSITIFS LUMINEUX... 22
2.4.1 Généralités sur les lasers ... 22
2.4.2 Le choix du laser diode en thérapie photodynamique ... 23
2.4.3. Les paramètres d’irradiation ... 24
3 : INTERET DE LA THERAPIE PHOTODYNAMIQUE ANTIMICROBIENNE (APDT) DANS LA DESINFECTION ENDODONTIQUE : REVUE DE LITTERATURE ... 26
3.1.MATERIEL ET METHODE ... 26
3.2.ACTION DE LA THERAPIE PHOTODYNAMIQUE ANTIMICROBIENNE SUR LA REDUCTION DE LA CHARGE MICROBIENNE ... 27
3.2.1. L’action de l’aPDT seule contre celle de NaOCl... 27
3.2.2. L’action adjuvante de l’aPDT ... 32
3.3.EVALUATION DE LA TOXICITE DE LA THERAPIE PHOTODYNAMIQUE ANTIMICROBIENNE EN ENDODONTIE ... 40
3.4.LES LIMITES DE L’APDT ... 46
3.5.PERSPECTIVES ET AMELIORATIONS ... 49
3.5.2 L’aPDT combinée à une activation ultrasonore ... 49
3.5.3 Les nanoparticules ... 50
3.5.4 Advanced NonInvasive Light Activated Disinfection (ANILAD) ... 51
3.5.5 Fractionner les cycles d’aPDT ... 53
3.6.LA PROCEDURE CLINIQUE ... 53
4 : DISCUSSION ... 55
CONCLUSION ... 59
BIBLIOGRAPHIE ... 60
TABLE DES FIGURES ... 66
Introduction
Au cours de ces dernières décennies, les progrès technologiques survenus dans le domaine médical ont particulièrement bouleversé l’exercice du professionnel de santé, en tentant d’améliorer de jour en jour la qualité de leurs soins. L’endodontie n’échappe pas à cette règle puisque de nombreux systèmes de mise en forme, d’irrigation ou encore d’obturation fleurissent sur le marché, laissant ainsi le chirurgien-dentiste face à une multitude d’instruments de plus en plus sophistiqués.
Les lésions inflammatoires périradiculaires d’origine endodontique (LIPOE), ont pour origine la présence de micro-organismes au sein du réseau canalaire. L’élimination complète de cette flore pathogène reste actuellement un véritable défi en raison de la complexité anatomique de l’endodonte, de l’existence d’isthmes et de ramifications échappant à l’instrumentation et au nettoyage mécanique, mais aussi de l’organisation de biofilms bactériens résistants aux agents antiseptiques tel que l’hypochlorite de sodium, considéré depuis longtemps comme l’irrigant le plus efficace en endodontie.
Cependant, les procédures endodontiques actuelles permettraient d'obtenir un taux de succès de 80 à 85%1. Afin d’optimiser ces résultats, de nombreuses techniques de désinfection canalaire ont vu le
jour : l’activation manuelle à l’aide d’un maître cône, l’activation sonore et ultrasonore, les lasers etc. Parmi eux, la thérapie photodynamique ou PDT, initialement utilisé pour le traitement de certains cancers grâce à son action cytotoxique ciblée, semble prendre une part prometteuse dans la recherche de l’antisepsie parfaite du réseau endodontique.
1 : La désinfection endodontique
1.1 L’infection endodontique
1.1.1 Définition
En dehors des facteurs chimiques et physiques pouvant être à l’origine d’une inflammation pulpaire ou apicale, l’infection endodontique joue un rôle déterminant dans l’apparition de pathologies telles que la pulpite irréversible, ou encore la nécrose pulpaire, principales indications du traitement endodontique2.
Lors d’une infection endodontique, l’environnement canalaire devient dès lors une véritable niche écologique recensant de multiples micro-organismes : l’infection endodontique est dite polymicrobienne. Pour parvenir à développer une infection, ces espèces microbiennes doivent remplir certaines conditions34:
- les micro-organismes doivent être présents en quantité suffisante pour provoquer et entretenir une lésion péri-apicale ;
- ils doivent posséder des facteurs de pathogénicité qui peuvent être exprimés pendant le processus infectieux. Ces derniers doivent être localisés dans le canal radiculaire pour pouvoir atteindre les tissus périapicaux ;
- le canal doit permettre la survie et la croissance des micro-organismes ; - les relations antagonistes entre les micro-organismes doivent être limitées ;
- l’hôte doit se défendre en inhibant la dissémination de l’infection, affectant ainsi les tissus périapicaux.
L’invasion microbienne ne peut se faire que par l’intermédiaire de plusieurs voies de contamination à savoir5 :
- les tubuli dentinaires exposés lors de processus carieux, de fêlures ou de fractures coronaires, de restaurations non hermétiques, de processus attritifs/abrasifs, ou encore lors de dénudations radiculaires ;
2 Haute autorité de santé, « Traitement endodontique : rapport d’évaluation technologique ». 3 Siqueira, « Endodontic infections : concepts, paradigms, and perspectives ».
4 Simon, Machtou, et Pertot, Endodontie.
- les canaux accessoires et/ou le foramen apical par lesquels l’endodonte et le parodonte communiquent. En étant infecté, le parodonte serait ainsi susceptible d’être à l’origine d’une lésion endo-parodontale ;
- la circulation sanguine par anachorèse, mais cela reste sujet à controverse en raison de son caractère exceptionnel.
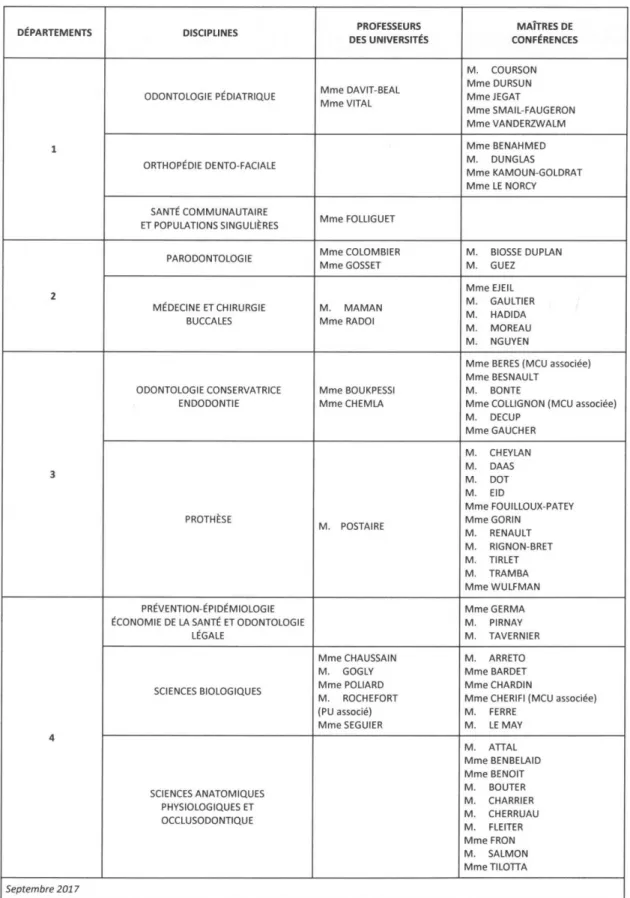
1.1.2 Les différents types d’infections endodontiques
Selon Siqueira et al.6, il est possible de classer les infections endodontiques d’une part en infections
intra-radiculaires regroupant les infections primaire, secondaire et persistante, et d’autre part en infections extra-radiculaires. Elles se distinguent par leur localisation, par le moment de l’infection endocanalaire et par leur flore.
1.1.2.1. L’infection primaire intra-radiculaire :
L’infection primaire est issue de l’invasion de micro-organismes au sein d’un tissu pulpaire nécrosé. La flore responsable de cette infection est mixte et anaérobie. Cependant, sa composition semble varier en fonction de l’ancienneté de la lésion : une lésion périradiculaire chronique va présenter une flore plus diversifiée qu’une lésion périradiculaire aiguë, possédant un nombre d’espèces plus restreint et à prédominance anaérobie Gram négatif.
1.1.2.2. L’infection secondaire ou persistante intra-radiculaire :
L’infection secondaire survient lorsque des micro-organismes, absents lors de l’infection primaire, pénètrent le système canalaire lors du traitement initial, en inter-séance, ou après la fin du traitement endodontique.
L’infection est dite persistante lorsque des micro-organismes, présents dès l’infection primaire ou secondaire, résistent aux procédures antiseptiques, voire même à des périodes de privation nutritionnelle. La présence de bactéries cultivables dans l’endodonte avant obturation ferait également baisser le taux de succès du traitement endodontique de 94% à 68%7.
La flore des infections secondaires (et persistantes) est caractérisée par la prédominance d’une espèce bactérienne : Enterococcus Fæcalis. E. Fæcalis est une cocci Gram positive, anaérobie facultative,
6 Siqueira.
7 Sjögren et al., « Influence of infection at the time of root filling on the outcome of endodontic treatment of
pouvant survivre plus d’un an dans les tubuli dentinaires, même après obturation canalaire8, en puisant
ses besoins nutritionnels au sein du collagène des tubuli. Cette espèce tolère particulièrement bien certains traitements antibactériens tel que l’hydroxyde de calcium, et peut développer des résistances à des antibiotiques comme l’ampiciline, le chloramphénicol, les macrolides et les tétracyclines9.
Toutefois, E. Fæcalis se cultive très facilement en laboratoire et sa présence peut dès lors être surestimée par rapport à d’autres espèces bactériennes plus pathogènes et moins tolérantes à la culture bactérienne. Malgré l’expression de nombreux facteurs de virulence comme la gélatinase, la hyaluronidase, les bactériocines ou encore l’acide lipotéichoïque, des études récentes semblent amoindrir son implication dans les infections persistantes10.
En dehors des bactéries, les levures ont elles aussi pu être identifiées dans les cas d’échec de traitement endodontique, et notamment l’espèce Candida Albicans11.
Enfin, même s’ils n’ont pas un rôle majeur, le cytomégalovirus et le virus Epstein-Barr ont pu être associé à l’apparition de parodontites apicales12.
1.1.2.3. L’infection extra-radiculaire :
Elle se développe lorsque les micro-organismes envahissent des tissus périapicaux enflammés. Lorsqu’elle est dépendante de l’infection intra-radiculaire, il s’agit d’un abcès alvéolaire aigu pouvant être traité par un traitement endodontique.
A l’inverse, lorsqu’elle est indépendante de l’infection intra-radiculaire, il s’agit d’actinomycose apicale où les micro-organismes, présents dans les tissus périapicaux, adhèrent à la surface radiculaire pour y former un biofilm. L’absence de communication entre la lésion et l’endodonte rend le traitement endodontique orthograde inefficace. Seule l’exérèse de la lésion et de l’apex par voie chirurgicale permettra la cicatrisation du site -
La flore de l’infection extra-radiculaire est constituée majoritairement des espèces Actinomyces et Propionibacterium13.
8 Sedgley et al., « Real-time quantitative polymerase chain reaction and culture analyses of Enterococcus faecalis
in root canals ».
9 Tannock, « The bifidobacterial and lactobacillus microflora of humans ». 10 Simon, Machtou, et Pertot, Endodontie.
11 Sundqvist et al., « Microbiologic analysis of teeth with failed endodontic treatment and the outcome of
conservative re-treatment ».
12 Simon, Machtou, et Pertot, Endodontie.
Tableau 1 : Composition de la flore endocanalaire en fonction de la pathologie périapicale Infections initiales Infections secondaires ou persistantes Infections extraradiculaires Lésion chronique périradiculaire Abcès périapical aiguë
Bacteroides Porphyromonas Enterococcus Actinomyces
Treponema Treponema Actinomyces Propionibacterium
Prevotella Fusobacterium Streptococcus
Porphyromonas Bacteroides Candida
Fusobacterium Prevotella Propionibacterium
Peptostreptococcus Streptococcus Staphylococcus
Streptococcus Peptostreptococcus Pseudomonas
Eubacterium Actinomyces Campylobacter
Source : Siqueira et al., « Endodontic infections : concepts, paradigms, and perspectives", 2002
1.1.3 Le biofilm bactérien
1.1.3.1. Définition :
Le biofilm bactérien est une communauté structurée de cellules bactériennes. Celles-ci sont incluses dans une matrice polymère qu’elles produisent, et adhérant ou non à une surface biologique. Au sein du biofilm, seulement 15% du volume est occupé par les espèces bactériennes, les 85% restant forment la matrice14
1.1.3.2. La formation du biofilm canalaire
Le biofilm canalaire se forme par l’adsorption de bactéries à l’état planctonique sur les tubuli dentinaires, les parois canalaires ou encore l’extrémité radiculaire. Une fois adhérentes à cette surface, elles permettent à d’autres bactéries, n’ayant aucun potentiel d’adhésion à la dentine, de venir se greffer sur ces colonisateurs initiaux. Il s’instaure dès lors une cohabitation entre diverses espèces microbiennes capables de croître, de se diviser, et de communiquer entre elles par l’expression coordonnée de certains gènes bactériens : c’est le « quorum sensing ». Une fois que les colonies arrivent à maturation, elles commencent à produire une matrice polysaccharidique formant une véritable barrière physique et chimique contre les éléments environnants (Oxygène, système immunitaire, agent antimicrobien). Le biofilm est également un concept dynamique puisque même
après sa formation, certaines bactéries s’en détachent pour former de nouvelles associations avec d’autres bactéries planctoniques.
1.1.3.3. L’impact du biofilm sur la désinfection endodontique
En développant une matrice extracellulaire, les bactéries organisées en biofilm décuplent leur résistance face aux agents antimicrobiens par l’intermédiaire de plusieurs mécanismes :
- La matrice extracellulaire limite la diffusion des agents antimicrobiens au sein du biofilm ;
- En ayant une croissance plus lente à l’intérieur du biofilm, les bactéries sont moins susceptibles aux agents ciblant la croissance microbienne ;
- Le biofilm contient des facteurs de résistance comme les β-lactamases inhibant l’action des antibiotiques à cycle β-lactame.
Afin de répondre à cette problématique, des méthodes de déstructuration chimique et mécanique du biofilm existent actuellement et seront détaillées dans les parties suivantes.
1.2 Les moyens de désinfection endodontique
1.2.1 Une désinfection chimio-mécanique
La désinfection canalaire est un concept chimio-mécanique. L’instrumentation mécanisée (limes en acier manuelles, limes rotatives en nickel-titane etc.) ne peut accéder à l’ensemble du réseau endodontique comme les isthmes ou les ramifications, et génère une quantité plus ou moins importante de débris en fonction du système de mise en forme employé. Cependant, l’action mécanique des limes est nécessaire au passage des solutions d’irrigation jusqu’à la zone apicale, et doit permettre le bon renouvellement de ces dernières pour une meilleure efficacité de leur action antiseptique, nettoyante et solvante.
1.2.2. L’irrigation canalaire
1.2.2.1. Rôle de l’irrigation :
L’irrigation canalaire doit remplir plusieurs objectifs :
- Evacuer les débris organiques et minéraux, ainsi que les micro-organismes mis en suspension au cours de la mise en forme ;
- Présenter un large spectre antibactérien et être capable d’éliminer le biofilm adhérant aux parois canalaires ;
- Avoir une bonne action solvante sur les débris organiques ; - Lubrifier les instruments mécaniques ;
- Ne pas être toxique pour les tissus périapicaux.
Parmi l’ensemble des solutions d’irrigation disponibles, aucune ne remplit à elle seule l’ensemble de ces objectifs. Afin d’assurer au mieux son rôle, l’irrigation canalaire doit se faire par l’action conjointe d’un agent antiseptique et d’un agent chélateur.
1.2.2.2. L’agent antiseptique : l’hypochlorite de sodium (NaOCl)
L’hypochlorite de sodium est la solution d’irrigation de choix dans le traitement endodontique car : - Elle a un large spectre antibactérien ;
- Elle présente une action solvante sur les tissus organiques.
En solution aqueuse, le NaOCl se présente sous 2 formes actives en fonction du pH de la solution : l’acide hypochloreux (HOCl) qui se dissocie en milieu basique en ion hypochlorite (OCl-).
𝑁𝑎𝑂𝐶𝑙 + 𝐻2𝑂 → 𝑁𝑎𝑂𝐻 + 𝐻𝑂𝐶𝑙 𝐻𝑂𝐶𝑙 → 𝐻++ 𝑂𝐶𝑙−
Les deux formes OCl- et HOCl déterminent la concentration du produit qui s’exprime en chlore actif.
L’acide hypochloreux HOCl a néanmoins une action oxydante plus importante que l’ion hypochlorite, et sa présence dépend du pH : à un pH inférieur à 7,6, l’acide hypochloreux sera l’espèce prédominante et à un pH supérieur à 7,6, il s’agira de l’ion hypochlorite.
Au fur et à mesure de leur consommation par leur effet oxydant sur les tissus organiques, la quantité d’agents actifs diminue et l’activité de la solution d’hypochlorite décroît. Le renouvellement de la solution d’irrigation est donc extrêmement important afin de conserver une efficacité bactéricide et protéolytique tout au long du traitement15.
Pour assurer une bonne désinfection canalaire, l’hypochlorite de sodium doit être utilisé à des concentrations allant de 2,5% à 6%16. Plus la solution est concentrée et plus elle est efficace, et
notamment dans la désintégration du biofilm bactérien17. En revanche à des concentrations élevées,
le risque de toxicité pour les tissus vivants est majoré, et notamment en cas de projection accidentelle dans le périapex. L’hypochlorite de sodium est en effet une solution toxique sur les tissus pouvant provoquer à la fois hémolyse, ulcération et nécrose. A ce tableau se rajoute une mauvaise odeur, un
15 Association dentaire française, Irrigation en endodontie. 16 Simon, Machtou, et Pertot, Endodontie.
mauvais goût, une capacité d’altération des vêtements et de brûlure oculaire, et pourrait y compris dégrader les propriétés mécaniques de la dentine en cas de contact prolongé.
Néanmoins, ces problèmes sont généralement le reflet d’une faute opératoire, pouvant être prévenue par l’emploi d’un protocole endodontique rigoureux (mise en place du champ opératoire, port de lunettes de protection, contrôle de la pression d’éjection de la solution etc.).
Ces propriétés font de l’hypochlorite de sodium la solution d’irrigation la plus efficace18, mais son
action reste tout de même limitée concernant la dissolution des débris minéraux. L’usage de l’hypochlorite de sodium doit donc être associé à celui d’agents chélateurs comme l’EDTA ou l’acide citrique.
1.2.2.3. Les agents chélateurs
La création systématique d’un enduit pariétal, la boue dentinaire, au cours de l’instrumentation mécanique des canaux peut empêcher l’accès des solutions d’irrigation aux micro-organismes intratubulaires. Cette boue dentinaire peut elle-même contenir des bactéries susceptibles d’être à l’origine d’un échec thérapeutique. Son élimination par des solutions chélatantes apparaît comme cruciale dans la désinfection endodontique. Parmi elles, l’EDTA, ou Ethyl Diamino Tétraacetic Acid, agit sur la portion minérale de la boue dentinaire, à des concentrations pouvant varier entre 8% et 15-17%. Dénué d’action antiseptique, l’EDTA doit laisser place à l’hypochlorite de sodium pour poursuivre la désinfection canalaire jusque dans les espaces non instrumentés. L’EDTA présente également l’inconvénient d’interagir avec l’hypochlorite de sodium en réduisant la teneur en chlore actif1920.
Irriguer avec de grande quantité d’hypochlorite de sodium ou bien évacuer l’EDTA/ sécher avant l’utilisation de l’irrigant permet une utilisation optimale de l’hypochlorite de sodium21.
1.2.3. L’activation des solutions d’irrigation
1.2.3.1. La dynamique des solutions
L’irrigation manuelle passive, consistant à la simple délivrance de l’irrigant à l’aide d’une seringue dans les canaux, permet un effet de lavage fonction de la quantité de solution utilisée et du type de seringue employée. Cependant son action est particulièrement limitée dans les derniers millimètres apicaux car
18 Zehnder, « Root canal irrigants ».
19 Grawehr et al., « Interactions of ethylenediamine tetraacetic acid with sodium hypochlorite in aqueous
solutions ».
20 Rossi-Fedele et al., « Antagonistic interactions between sodium hypochlorite, chlorhexidine, edta, and citric
acid ».
la solution ne pénètre qu’1mm au-delà de la pointe de l’aiguille22, et que la persistance d’une bulle de
gaz dans le canal peut s’opposer à la pénétration apicale de la solution (effet Vapor Lock)23.
L’adjonction de dispositifs d’activation, facilitant la propagation des solutions d’irrigation dans la région apicale et autres zones non instrumentées, revêt une importance considérable dans la désinfection optimale du réseau endodontique. L’activation canalaire peut se présenter sous plusieurs formes : thermique, mécanique, sonore, ultrasonore et photonique.
1.2.3.2. L’activation mécanique à l’aide du maître cône de gutta-percha
Cette activation consiste en la réalisation de mouvements de va-et-vient de faible amplitude à l’aide d’un cône de gutta, à une fréquence de 100 mouvements par minute. L’agitation du cône génère une surpression lors des poussées améliorant la répartition de la solution d’irrigation, ainsi que son renouvellement en apportant une solution fraîche apicalement lors du pompage. Cette technique est un moyen simple et efficace d’activation, capable de mettre en suspension des conglomérats bactériens qui seront éliminés par l’irrigation à la seringue conventionnelle. Elle favorise l’élimination des débris et permet d’obtenir des surfaces canalaires propres, même dans les canaux courbes des molaires24. Le degré de propreté est significativement supérieur à celui obtenu à l’aide d’une seringue
d’irrigation conventionnelle. Cependant, cette technique peut s’avérer contraignante car elle impose au praticien un mouvement répétitif pouvant être fatiguant et fastidieux lorsqu’il s’agit de dents pluriradiculées. D’autre part, le cône préalablement ajusté peut se retrouver déformé lors de la manœuvre, rallongeant ainsi le temps d’activation.
1.2.3.3. L’activation sonore
L’activation sonore est issue de la vibration d’un insert à une fréquence comprise entre 1 et 6kHz au sein de la solution d’irrigation. Le système Endoactivator® est un exemple de dispositif sonore, constitué d’une pièce à main faisant vibrer un insert en plastique résistant et flexible, à des calibres et des conicités variables. Grâce à ces vibrations, l’insert serait capable de générer des turbulences hydrodynamiques responsable de l’élimination de la boue dentinaire et du biofilm bactérien. Il permettrait une activation de la solution jusque dans les derniers millimètres apicaux tout en respectant, par sa souplesse, la trajectoire canalaire. Ses résultats restent néanmoins discutés, où certaines études semblent montrer une amélioration de l’élimination de la boue dentinaire
22 Zehnder, « Root canal irrigants ».
23 Boutsioukis et al., « Formation and removal of apical vapor lock during syringe irrigation : a combined
experimental and computational fluid dynamics approach ».
24 Caron et al., « Effectiveness of different final irrigant activation protocols on smear layer removal in curved
uniquement dans la portion coronaire. L’activation sonore est un système simple et efficace malgré la disparité des résultats. Le coût de la pièce à main reste le principal inconvénient, tout comme le renouvellement des inserts qui ne sont pas conçus pour des utilisations multiples.
Figure 1 : Le système Endoactivator
Source : Dentsply, 2016
1.2.3.4. L’activation ultrasonore
Les limes ultrasonores, montées sur une pièce à main spécifique, oscillent entre 25 et 30 kHz grâce à un générateur piézo-électrique. Elles génèrent des turbulences acoustiques favorisant la création de mouvements liquidiens au sein de la solution d’irrigation. Cette technique permettrait une bonne élimination des débris générés après la mise en forme canalaire25.Ses résultats sur l’élimination de la
boue dentinaire et sur son action sur le biofilm bactérien restent encore controversés. Le coût est moindre par rapport à l’activation sonore puisque seul l’achat des limes est à prévoir. L’inconvénient de l’activation ultrasonore réside principalement dans l’annihilation des turbulences acoustiques lorsque la lime rentre en contact avec les parois canalaires. Ceci pose donc le problème de l’apport de l’énergie ultrasonore dans les canaux à forte angulation. D’autre part, les limes ultrasonores sont en acier et pourraient donc induire une altération de la trajectoire canalaire, générer de la boue dentinaire, voire même se fracturer.
25 Lee, Wu, et Wesselink, « The efficacy of ultrasonic irrigation to remove artificially placed dentine debris from
1.2.3.5. L’activation photonique
L’utilisation des lasers dans la désinfection endodontique a été proposée depuis de nombreuses années mais son emploi reste assez peu répandu. Parmi les différentes sources lasers disponibles (Diode, CO2, Er-YAG, Er,Cr-YSGG, Nd-YAP, KTP etc.) et en fonction du paramétrage du dispositif, il est possible de générer un effet antibactérien par une augmentation localisée de la température (effet photo-thermique), ou encore la création d’ondes acoustiques pouvant être apparentées à celles d’une activation ultrasonore (« photon-initiated photo-acoustic streaming » ou PIPS). Toutefois, des dommages sur les tissus environnants et dentaires, tels que l’ankylose, la fonte ou la carbonisation du cément et de la dentine, des résorptions radiculaires et la nécrose périradculaire peuvent être associés aux lasers à haute puissance26.
La thérapie photo-dynamique est également une autre alternative de l’utilisation des lasers dans la désinfection canalaire, en associant à ces derniers une molécule photo-sensible pour générer son pouvoir bactéricide.
2 : La thérapie photodynamique
2.1. Histoire
2728Les effets thérapeutiques de la lumière sont connus depuis l’Antiquité. Il y a 3000 ans, les indiens associaient déjà l’action de la lumière à celle de substances naturelles, les psoralènes, dans le but de soigner certaines maladies de la peau comme le vitiligo ou le psoriasis.
Le concept de photosensibilisation réapparaît toutefois beaucoup plus tard quand, dans les années 1900, un jeune étudiant allemand du nom d’Oscar Raab décrit pour la première fois un phénomène phototoxique. Il remarqua qu’en combinant l’acridine rouge à de la lumière, il engendra la mort d’organismes vivants : les paramécies. Quelques années plus tard, Jesionek et Von Tappeiner (alors professeur de Raab) s’inspirèrent de ces découvertes pour traiter un cancer cutané par application topique d’éosine exposée à la lumière blanche. Tappeiner en conclut que l’oxygène est un élément essentiel à l’origine du processus et introduit ainsi le terme « photodynamique ».
Les recherches se sont dès lors multipliées sur l’animal puis en clinique, surtout après la Seconde Guerre mondiale.
Actuellement employé pour le traitement de cancer, la thérapie photodynamique ou PDT présente également des propriétés antibactériennes, élargissant ainsi son champ d’action au traitement des infections, notamment orales. Ainsi, l'aPDT, ou thérapie photodynamique antimicrobienne, se développe de plus en plus dans l’élimination du biofilm bactérien, particulièrement présent dans les maladies parodontales et les infections endodontiques.
2.2 Principe d’action
La thérapie photodynamique antibactérienne conjugue l’action de 3 éléments : - Un photosensibilisant
- De la lumière - De l’oxygène
27 Konopka et Goslinski, « Photodynamic therapy in dentistry ».
2.2.1 L’interaction photon-photosensibilisant
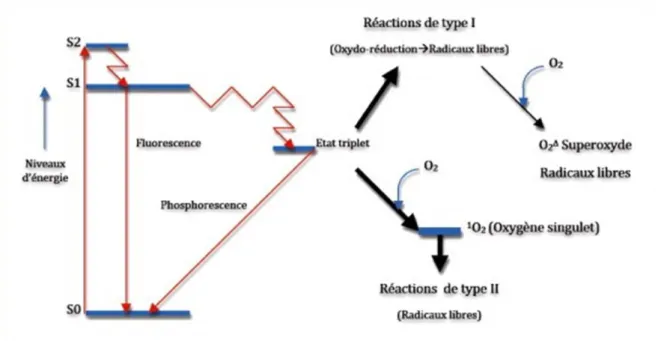
29Le photosensibilisant, soumis à une irradiation lumineuse d’une longueur d’onde qui lui est spécifique, entreprend une transition d’un état fondamental singulet de faible énergie (S0) à des états excités de plus haute énergie, appelé états singulets excités (S1, S2, S3 etc.). Plus précisément, lorsque le photon est absorbé par le photosensibilisant, un électron passe de son état basal à un état électroniquement excité et instable, changeant ainsi d’orbitale atomique. L'état singulet se caractérise de façon générale par des orbitales atomiques présentant des électrons appariés et de spins opposés (mouvement de rotation de l'électron sur lui-même). Seul l’état singulet de plus faible énergie (S1) a une durée de vie significativement longue (10-6 à 10-9 secondes). Le photosensibilisant à l’état singulet (S1) peut ensuite
revenir à son état fondamental (S0) en restituant l’énergie selon 3 voies : - sous forme de chaleur ;
- par émission de lumière grâce aux phénomènes de fluorescence ;
- par conversion interne vers un état triplet en restituant partiellement cette énergie sous forme de phosphorescence, impliquant un changement de spin d’un électron. L’état triplet présente, contrairement à l’état singulet, 2 électrons non appariés sur 2 orbitales atomiques différentes, avec 2 spins parallèles.
C’est cet état triplet, d’une durée de vie plus longue que l’état singulet de l’ordre de la milliseconde, qui va être principalement à l’origine de la création des espèces réactives de l’oxygène (oxygène singulet, ion superoxyde O2.-, radicaux libres, le peroxyde d’hydrogène…), responsables de l’action
bactéricide.
Figure 2 : Diagramme de Jablonski
Source : Urofrance, « Thérapie photodynamique et cancer de la prostate », 2011
2.2.2 Création des espèces réactives de l’oxygène et d’oxygène singulet
Le photosensibilisant à l’état triplet va réagir avec les molécules environnantes pour former soit des radicaux libres oxygénés par la réaction de type I, soit former de l’oxygène singulet par la réaction de type II. La prédominance d’une réaction par rapport à l’autre va dépendre de la concentration en oxygène et en photosensibilisant. L’ensemble de ces réactions conduit à la dégradation de nombreux constituants cellulaires (acides aminés, bases nucléiques, lipides) et donc à l’élimination bactérienne. Il semble cependant que la réaction de type II soit davantage impliquée dans l’élimination des micro-organismes30.
2.2.2.1 La réaction de type I
Le photosensibilisant dans son état excité, réagit avec un substrat via un transfert d’électron photo induit (a) ou l’abstraction d’hydrogène (b), afin de produire des radicaux libres. Ces derniers interagissent avec l’oxygène pour former des ions superoxydes, des radicaux hydroxyles et des
radicaux peroxyde, générant ainsi de nombreux dommages au niveau de la membrane cellulaire, des protéines et de l’ADN. a) 𝑃𝑆∗+ 𝑅 → 𝑃𝑆.− + 𝑅.+ 𝑃𝑆.− + 𝑂2 → 𝑃𝑆 + 𝑂2.− 𝑅 + 𝑂2.− → 𝑅.− + 𝑂2 b) 𝑃𝑆∗ + 𝑅𝐻 → 𝑃𝑆𝐻. + 𝑅. 𝑅. + 𝑂2 → 𝑅𝑂𝑂. 𝑅𝑂𝑂. + 𝑅𝐻 → 𝑅𝑂𝑂𝐻 + 𝑅.
𝑃𝑆∗ = Photosensibilisant à l’état excité 𝑅 = substrat ; 𝑅. = radical libre
𝑂2.− = anion superoxyde 𝑅𝑂𝑂. = radical peroxyde
2.2.2.2 La réaction de type II
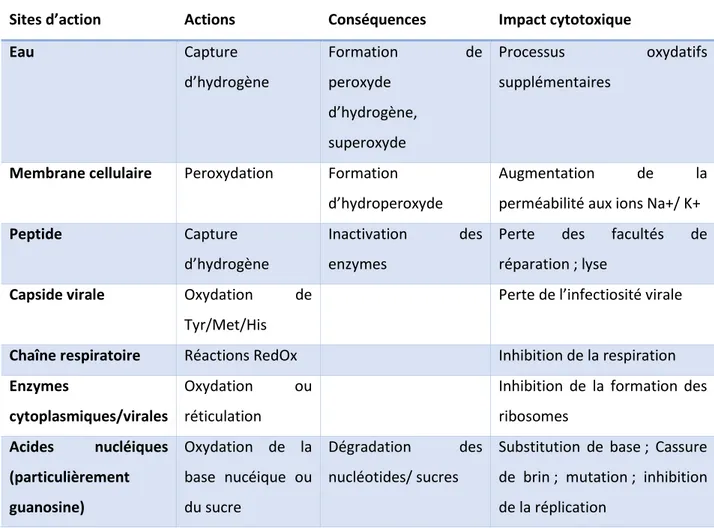
Dans la réaction de type II, le photosensibilisant à l’état triplet interagit directement avec l'oxygène (à l’état fondamental, il est sous la forme triplet) pour former de l’oxygène singulet. Cette espèce très réactive va pouvoir interagir avec la membrane bactérienne, les peptides et les acides nucléiques (Tableau 2)
Tableau 2 : les diverses voies cytotoxiques dans les cellules microbiennes et les virus
Sites d’action Actions Conséquences Impact cytotoxique
Eau Capture d’hydrogène Formation de peroxyde d’hydrogène, superoxyde Processus oxydatifs supplémentaires
Membrane cellulaire Peroxydation Formation
d’hydroperoxyde
Augmentation de la
perméabilité aux ions Na+/ K+
Peptide Capture
d’hydrogène
Inactivation des enzymes
Perte des facultés de réparation ; lyse
Capside virale Oxydation de
Tyr/Met/His
Perte de l’infectiosité virale
Chaîne respiratoire Réactions RedOx Inhibition de la respiration
Enzymes
cytoplasmiques/virales
Oxydation ou
réticulation
Inhibition de la formation des ribosomes Acides nucléiques (particulièrement guanosine) Oxydation de la base nucéique ou du sucre Dégradation des nucléotides/ sucres
Substitution de base ; Cassure de brin ; mutation ; inhibition de la réplication
Source : Auteur, Traduit de Wainwright, « Photodynamic antimicrobial chemotherapy », 1998
2.3 Les photosensibilisants
Les photosensibilisants sont des agents chimiques qui, lorsqu’ils sont activés par de la lumière à une longueur d’onde spécifique, réagissent avec les molécules d’oxygène environnantes pour former des espèces réactives de l’oxygène, et donc aboutir à des dommages cellulaires.
De nombreuses substances naturelles ou synthétiques possèdent des propriétés photosensibilisantes. Les photosensibilisants utilisés en thérapie photodynamique sont généralement constitués d’une structure hétérocyclique similaire à la chlorophylle ou à l’hème de l’hémoglobine.
Pour être considéré comme un « bon photosensibilisant », la molécule doit :
- Avoir un large spectre d’action pouvant agir à la fois sur les bactéries, les levures, les virus ; - Avoir un haut rendement quantique de génération d’oxygène singulet ;
- Avoir un court intervalle entre son administration et son pic maximal d’accumulation, en adéquation avec l’acte clinique ;
- Avoir une activation optimale aux longueurs d’onde couramment employées avec une pénétration tissulaire maximale (cf. dispositifs lumineux). Celle-ci est fonction de la courbe d’absorption de chaque molécule ;
- Ne pas présenter de toxicité ;
- Autre : être indolore, facilement disponible, peu coûteux…
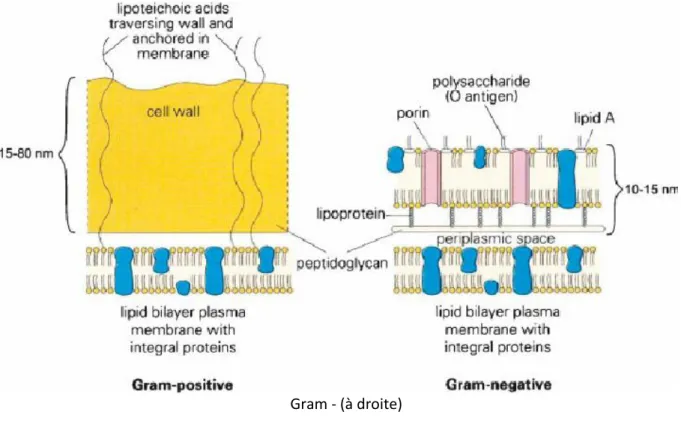
L’efficacité des photosensibilisants semble également dépendre de leur charge. Les molécules neutres ou anioniques sont en effet capables d’inactiver les bactéries Gram +, ce qui n’est pas le cas pour les bactéries Gram -. Cette différence s’explique par la composition de leur membrane (fig. 3).
Les bactéries Gram + sont constituées d’une membrane épaisse, riche en peptidoglycanes et naturellement perméable aux molécules de haut poids moléculaire ; des molécules de 30 000 à 60 000 Da sont retrouvées à l’intérieur de ces bactéries alors que le poids moléculaire des photosensibilisants n’excède pas 1 500 – 1 800 Da31.
Les bactéries Gram – présentent, en sus d’une couche plus fine de peptidoglycanes, une membrane externe dont la composition est plus complexe. Riche en lipides et en protéines, sa structure se caractérise principalement par des molécules de haut poids moléculaire chargées négativement telles que les lipopolysaccharides (LPS), mais aussi par la présence de porines. Cette composition rend les bactéries Gram – plus résistantes aux mécanismes de défense immunitaire et moins perméables que les bactéries Gram + ; en comparaison, les composés pouvant passer au travers des porines sont de l’ordre de 600-700 Da32.
31 Jori et al., « Photodynamic therapy in the treatment of microbial infections : basic principles and perspective
applications ».
Figure 3 : Composition des membranes cellulaires des bactéries Gram + (à gauche) et des bactéries
Gram - (à droite)
Source : Jori et al., « Photodynamic therapy in the treatment of microbial infections : Basic principles and perspective applications », 2006.
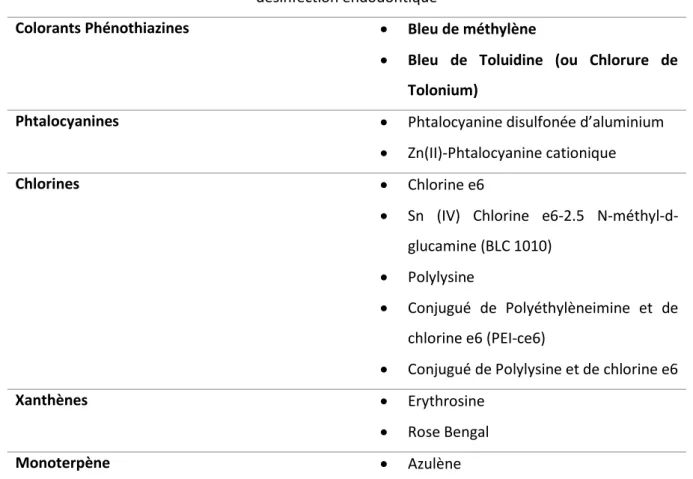
En dépit de ces obstacles, les photosensibilisants chargées positivement au pH physiologique tels que les phénothiazines, les phtalocyanines ou encore les porphyrines, sont capables de photo-inactiver efficacement à la fois les bactéries Gram + et les Gram -33.
D’autres stratégies ont également été recherchées comme l’association d’une molécule cationique au photosensibilisant (ex : la Poly-L-Lysine-chlorine e6), l’adjonction d’agents capables de perturber la membrane cellulaire (Polymyxine-B ; EDTA) ou encore d’anticorps monoclonaux34.
Parmi les photosensibilisants utilisés en thérapie photodynamique antimicrobienne (Tableau 3), le bleu de Toluidine et le bleu de méthylène sont les plus couramment employés.
33 Jori et al.
Tableau 3 : Les principaux photosensibilisants utilisés en thérapie photodynamique pour la désinfection endodontique
Colorants Phénothiazines Bleu de méthylène
Bleu de Toluidine (ou Chlorure de Tolonium)
Phtalocyanines Phtalocyanine disulfonée d’aluminium
Zn(II)-Phtalocyanine cationique
Chlorines Chlorine e6
Sn (IV) Chlorine e6-2.5 N-méthyl-d-glucamine (BLC 1010)
Polylysine
Conjugué de Polyéthylèneimine et de chlorine e6 (PEI-ce6)
Conjugué de Polylysine et de chlorine e6
Xanthènes Erythrosine
Rose Bengal
Monoterpène Azulène
Source : Auteur, D’après Singh et al. « Photodynamic therapy : an adjunct to conventional root canal disinfection strategies », 2015
2.3.1 Le bleu de méthylène
Le bleu de méthylène est un hétérocycle aromatique. Il est utilisé depuis plus d’un siècle comme colorant histologique. A température ambiante, il se présente sous la forme d’une poudre vert foncé et qui, une fois dissous dans l’eau, donne une solution bleue. Ce puissant photosensibilisant cationique possède un pic d’absorption maximal de la lumière rouge à 670nm. Son action est efficace sur les bactéries Gram + et Gram –. Sa forte hydrophilie, sa charge positive ainsi que son faible poids moléculaire lui octroient la possibilité de traverser les chaînes de porines et de protéines présentes au niveau de la membrane externe des bactéries Gram -. Le bleu de méthylène semble particulièrement toxique contre les espèces streptococci même avec une très faible exposition à la lumière. Toutefois, ce colorant serait moins efficace contre E. Fæcalis que le bleu de Toluidine35.
2.3.2 Le bleu de Toluidine
Le bleu de Toluidine, ou chlorure de Tolonium, est également un colorant bleu efficace contre de nombreuses espèces Gram + et Gram -. Il est utilisé à des concentrations allant de 0.001% à 0.01%, ce qui préviendrait ainsi le risque de coloration radiculaire ou coronaire, mais aussi l’irritation des tissus mous. Son exposition à une lumière rouge de 635nm permet la libération optimale d’oxygène singulet36.
2.4 Les dispositifs lumineux
La thérapie photodynamique nécessite l’emploi de dispositifs lumineux afin d’activer les photosensibilisants, utilisant pour cela une lumière visible de faible puissance à une longueur d’onde spécifique. Parmi l’ensemble de ces dispositifs, les lasers diodes sont les plus couramment utilisés dans la thérapie photodynamique appliquée en endodontie.
2.4.1 Généralités sur les lasers
Le terme de « laser » est en réalité un acronyme signifiant « Light Amplification by Stimulated Emission of Radiation », pouvant ainsi se traduire en français par « Amplification de Lumière par Emission Stimulée de Rayonnement ».
Le laser est un dispositif capable d’émettre un rayonnement cohérent, monochromatique et unidirectionnel, à l’inverse de la lumière ordinaire incohérente, multichromatique et multidirectionnelle.
Il se compose d’un milieu actif qui peut être soit liquide, soit solide, soit gazeux, soit un semi-conducteur dans le cas des lasers diodes. Ce milieu est excité par une source de pompage alimentée par une source d’énergie externe, le tout inclus dans une cavité résonante.
L’émission de lumière laser est fondée sur le processus d’émission stimulée décrit par Albert Einstein en 1917 : si un atome déjà excité par une première absorption d’énergie absorbe une énergie supplémentaire, il passe à un niveau d’énergie plus élevé et plus instable, puis restitue simultanément toute l’énergie absorbée en revenant à son état d’énergie initial.
Ainsi, pour entretenir l’émission de lumière laser, la source de pompage stimulant le milieu actif grâce à de l’énergie (dans le cas du pompage optique, il s’agit de lumière, donc de photons) génère une
inversion de population : le milieu actif possède alors plus d’atomes à l’état d’énergie élevé que d’atomes à l’état d’énergie faible. Ces atomes excités libèrent, par émission spontanée, des photons dans des directions aléatoires, afin de retrouver leur état d’énergie initial. Ces mêmes photons viennent alors interagir avec d’autres atomes hautement énergétiques et engendrent ainsi l’émission stimulée de photons au sein de la cavité résonante. La cavité résonante, constituée d’un miroir arrière totalement réfléchissant et d’un miroir avant semi-réfléchissant (à 99%), permet aux photons d’effectuer de nombreux aller-retours et d’amplifier ainsi l’énergie lumineuse. Le rayonnement laser est produit au travers du miroir avant, ne laissant passer que des photons strictement parallèles. Le rayonnement est ensuite concentré, grâce à une lentille focalisante, dans un système de transmission (ex : fibre optique) afin d’être appliqué secondairement aux tissus cibles à sa sortie.
2.4.2 Le choix du laser diode en thérapie photodynamique
Les lasers diodes sont des composants optoélectroniques capables de convertir l’énergie électrique à partir de semi-conducteurs, en énergie lumineuse. Les lasers diodes présentent de nombreux intérêts dans la thérapie photodynamique :
- Ils sont capables d’émettre un rayonnement rouge activant aisément les photosensibilisants bleus. En effet, les longueurs d’onde émises sont en adéquations avec le spectre d’absorption des photosensibilisants utilisées en thérapie photodynamique, généralement comprises entre 630 et 700 nm ;
Les lasers à cristaux utilisés en endodontie tels que le laser Nd-YAG (cristal d’yttrium aluminium et de grenat dopé au néodyme), Nd-YAP (cristal d’yttrium aluminium pervskite dopé au néodyme) ou encore Er : YAG (cristal d’yttrium aluminium et de grenat dopé avec des ions erbium) présentent des longueurs d’onde plus importantes et donc moins appropriées. L’action de ces derniers est essentiellement thermique, photo-ablatif, voire mécanique par effet PIPS ;
- Il est relativement moins onéreux que les autres lasers ;
- Il présente un encombrement minimum grâce à ses composants électroniques (semi-conducteurs) ;
- Il possède un excellent rendement de 30%, contre 3% pour les autres lasers37.
Figure 4 : Différence de compacité entre le laser diode (à gauche) et un laser à cristal de type Er-YAG (à droite) du même fabricant
Source : Kaelux, 2017
Bien qu’il présente un coût relativement plus faible que les autres lasers, le laser diode reste tout de même une technologie onéreuse. Les Diodes Electroluminescentes ou LED, se distinguant du laser diode par l'absence notamment de cavité résonante et donc de rayonnement cohérent, apparaissent dès lors plus abordables et gagnent en intérêt quant à leur application dans la thérapie photodynamique.
2.4.3. Les paramètres d’irradiation
La longueur d’onde, la densité de puissance et la fluence sont des facteurs influençant la thérapie photodynamique38, bien que les 2 derniers soient plus souvent associés dans la littérature à la notion
de puissance et d’énergie/dose cédée respectivement.
La longueur d’onde en nanomètre (nm) ; la distance entre 2 crêtes de l’onde laser ; détermine l’absorption du rayonnement par le photosensibilisant39.
38 Soukos et Goodson, « Photodynamic therapy in the control of oral biofilms ».
L’énergie d’un rayonnement, en joules (J), est comparable à la quantité de photons cédée par ce rayonnement. La notion de fluence (J/cm2), sujet à de nombreuses confusions parmi les auteurs40, se
définit comme l’énergie cédée sur une surface donnée.
La puissance en watts (w), faisant partie des réglages initiales du système laser, se définit par l’énergie cédée par unité de temps (1W = 1 J/s). Par analogie avec la fluence, la densité de puissance (W/cm2)
correspond à la puissance reçue sur une surface donnée.
𝑃𝑈𝐼𝑆𝑆𝐴𝑁𝐶𝐸 (𝑊) = 𝐸𝑁𝐸𝑅𝐺𝐼𝐸 (𝐽) 𝑇𝐸𝑀𝑃𝑆 (𝑠) 𝐷𝐸𝑁𝑆𝐼𝑇𝐸 𝐷𝐸 𝑃𝑈𝐼𝑆𝑆𝐴𝑁𝐶𝐸 ( 𝑊 𝑐𝑚2) = 𝑃𝑈𝐼𝑆𝑆𝐴𝑁𝐶𝐸 (𝑊) 𝑆𝑈𝑅𝐹𝐴𝐶𝐸 𝐷′𝐼𝑀𝑃𝐴𝐶𝑇(𝑐𝑚2) 𝐹𝐿𝑈𝐸𝑁𝐶𝐸 ( 𝐽 𝑐𝑚2) = 𝐸𝑁𝐸𝑅𝐺𝐼𝐸 (𝐽) 𝑆𝑈𝑅𝐹𝐴𝐶𝐸 𝐷′𝐼𝑀𝑃𝐴𝐶𝑇(𝑐𝑚2) = 𝐷𝐸𝑁𝑆𝐼𝑇𝐸 𝐷𝐸 𝑃𝑈𝐼𝑆𝑆𝐴𝑁𝐶𝐸 ( 𝑊 𝑐𝑚2) 𝑋 𝑇𝐸𝑀𝑃𝑆 (𝑠)
Par soucis de simplification, seules la puissance et la longueur d’onde seront précisées car ils font parties des réglages du dispositif lumineux, et sont le plus souvent citées par les auteurs dans leurs expériences.
3 : Intérêt de la thérapie photodynamique antimicrobienne
(aPDT) dans la désinfection endodontique : revue de
littérature
3.1 Matériel et méthode
Pour répondre à l’objectif de cette revue de littérature, la question suivante a été posée grâce à la méthode PICO : « Pour les patients soumis à un traitement endodontique, le recours à l’aPDT par rapport aux techniques classiques de débridement chimio mécanique réduit-il plus efficacement la charge bactérienne ? »
Une revue de littérature a été entreprise à partir de la base de données PubMed, en cherchant à recenser tous les articles portant sur la désinfection endodontique à l’aide de la thérapie photodynamique antimicrobienne (aPDT). L’équation de recherche a été élaborée grâce à l’utilisation des mots clés suivants :
« Endodontics[MeSH Terms] OR Dental pulp[MeSH Terms] OR Sodium hypochlorite[MeSH Terms] OR Root canal therapy[MeSH Terms] OR Root canal irrigants[MeSH Terms] AND Photochemotherapy[MeSH Terms] »
Les articles ont été sélectionnés après lecture de leur titre, puis de leur résumé et enfin, après lecture intégrale. Des listes de références ont également été recherchées à partir des articles identifiés ou des revues de littérature, afin de relever d’autres articles potentiellement pertinents. Les articles ont été inclus sans limite temporelle à partir des critères suivants :
- Essais contrôlés et randomisés, les études de cohorte prospectives et les études en cross-over. - Etudes in vivo ou ex vivo évaluant la diminution de la charge microbienne de l’aPDT, après
maturation d’un biofilm ;
- Etudes in vivo, ex vivo ou in vitro évaluant la cytotoxicité ou explorant de nouvelles méthodes d’optimisation de l’aPDT ;
- Lorsque les paramètres et/ou le matériel utilisés en aPDT sont employés de manière cohérente et clairement expliqués ;
- Ecrits en anglais.
La méthode in vitro n’a pas été un critère d’exclusion concernant les études évaluant la toxicité ou explorant de nouvelles méthodes d’optimisation de l’aPDT, s’expliquant par leur faible nombre et leur aspect pertinent.
A l’issue de la recherche, 66 articles ont été obtenus sur PubMed. Après lecture du titre, 51 ont été sélectionnés. 2 articles ont été ajoutés manuellement. Après lecture du résumé et du texte intégral, seuls 48 articles ont été conservés en accord avec les critères d’inclusion, d’exclusion et de jugement préalablement définis. Dans le cadre de cette revue de littérature, seuls 32 articles ont été utilisés.
3.2 Action de la thérapie photodynamique antimicrobienne sur la réduction de
la charge microbienne
3.2.1. L’action de l’aPDT seule contre celle de NaOCl
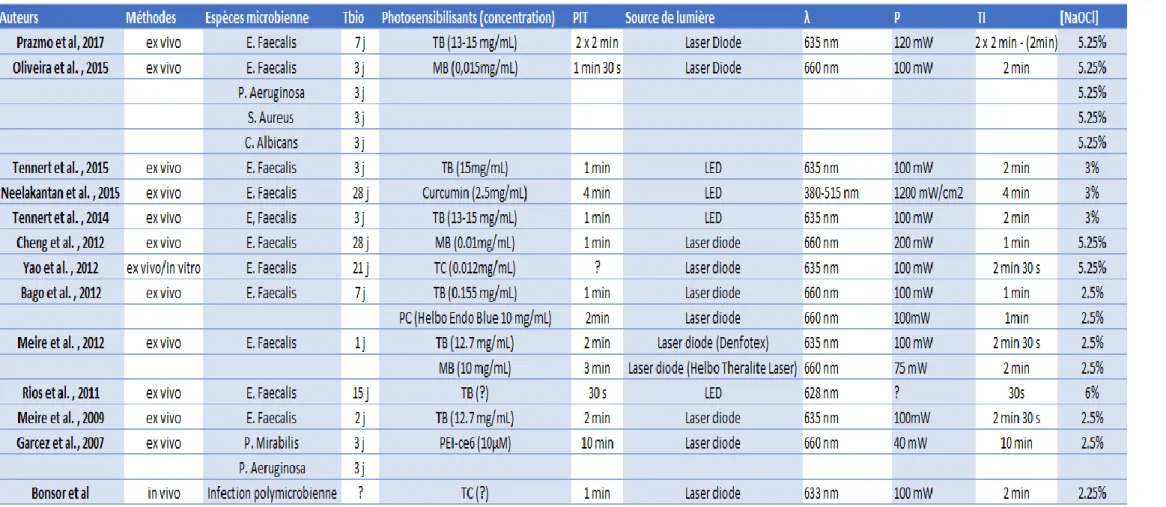
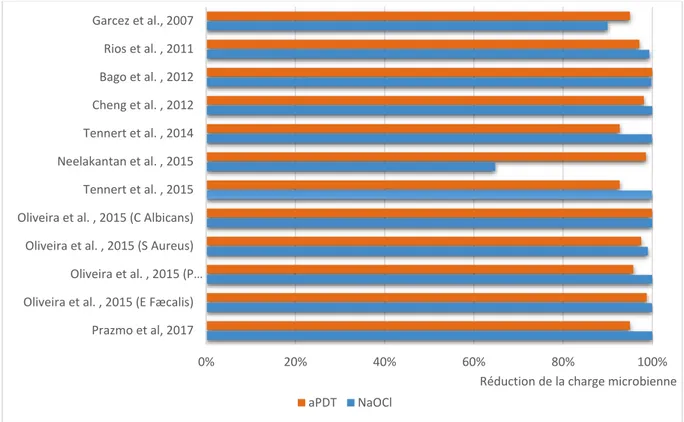
Les études comparant l’action antimicrobienne de l’aPDT seule avec celle de NaOCl sont répertoriées dans le tableau 4. Ce tableau met notamment en évidence la diversité des paramètres employés par chaque auteur au cours de leur expérience (le type de photosensibilisant, sa concentration, le temps d'irradiation etc.).
Tableau 4 : Ensemble des paramètres employés par les études comparant l’aPDT seule face à l’hypochlorite.
(Tbio= temps de formation du biofilm ; PIT = temps de pré-irradiation ; TI = temps d’irradiation ; TB = Bleu de toluidine ; MB = bleu de méthylène ; PC = chlorure de phénothiazine)
Figure 5: Comparaison de l'efficacité de la réduction de la charge microbienne entre l'aPDT seule et NaOCl
Source : Auteur
0% 20% 40% 60% 80% 100%
Prazmo et al, 2017 Oliveira et al. , 2015 (E Fæcalis) Oliveira et al. , 2015 (P… Oliveira et al. , 2015 (S Aureus) Oliveira et al. , 2015 (C Albicans) Tennert et al. , 2015 Neelakantan et al. , 2015 Tennert et al. , 2014 Cheng et al. , 2012 Bago et al. , 2012 Rios et al. , 2011 Garcez et al., 2007
Réduction de la charge microbienne aPDT NaOCl
Figure 6 : Comparaison du pourcentage de cultures négatives après traitement par aPDT seule et NaOCl
Source : Auteur
En 2006, Bonsor et al.41 réalisent une expérience in vivo sur l’Homme dans le but de comparer l’action
désinfectante de l’aPDT face à NaOCl 2.25% sur des parois canalaires préparées, associée à de l’acide citrique à 20%. Ils remarquent que l’usage de l’aPDT, après préparation canalaire alternant instrumentation mécanique et irrigation à l’acide citrique 20% et à l’eau stérile, permet d’obtenir 91.3% de cultures négatives, contre 76% pour NaOCl. Ils en concluent que l’aPDT, combinée à l’action de l’acide citrique, est une bonne alternative à l’utilisation de NaOCl dans la désinfection endodontique en in vivo.
En 2012, Bago et al.42 évaluent l’action antibactérienne de l’aPDT, de l’irrigation à NaOCl 2.5% avec ou
sans activation sonore (EndoActivator), et la désinfection par diode laser à haute puissance (2W) sur un biofilm d’E. Fæcalis de 7 jours. Au sein de cette même étude, ils utilisent 2 systèmes d’aPDT différents ; le système Helbo (PS ou photosensibilisant : Helbo Endo Blue ; SL ou source lumineuse : Laser diode) et une méthode plus classique exposant le bleu de Toluidine à un laser diode. Ils mettent en évidence l’absence de différence significative (p > 0.05) entre les 2 systèmes d’aPDT quant à la
41 Bonsor et al., « An alternative regimen for root canal disinfection ».
42 Bago et al., « Antimicrobial efficacy of a high-power diode laser, photo-activated disinfection, conventional
and sonic activated irrigation during root canal treatment ».
0,00% 10,00% 20,00% 30,00% 40,00% 50,00% 60,00% 70,00% 80,00% 90,00% 100,00% Tennert et al. , 2015
Tennert et al. , 2014 Yao et al. , 2012 Meire et al. , 2012 (Denfotex) Meire et al. , 2012 (Helbo) Bonsor et al., 2006
Pourcentage de cultures négatives aPDT NaOCl
réduction de la charge bactérienne. Ils remarquent que l’aPDT provoque une réduction de la charge en E. Fæcalis de 99.9%, significativement supérieure à celle de NaOCl qui était de 99.80% (p < 0.05). Ils en concluent que l’aPDT est aussi efficace qu’une irrigation à NaOCl 2.5% avec activation sonore dans l’élimination du biofilm d’E. Fæcalis en ex vivo, mais entraine une plus importante réduction de charge bactérienne qu’une irrigation classique à NaOCl 2.5% ou une désinfection au laser diode à haute puissance. Les résultats de cette étude restent toutefois peu convaincants compte tenu de la faible différence entre les résultats de ces méthodes de désinfection.
Neelakantan et al., quant à eux, utilisent de la curcumine en tant que photosensibilisant, activée cette fois-ci par de la lumière bleue ( = 380-515 nm) grâce à une lampe LED à photopolymériser (Bluephase LED, Ivoclar Vivadent), pour générer une activité photodynamique en ex vivo. Ils ont pu observer une réduction de la charge d'E. Fæcalis de 64% environs pour NaOCl 3%, contre 98% pour l'aPDT. Ils proposent ainsi une alternative aux bleus de toluidine et de méthylène et dévoilent une activité antibactérienne significativement supérieure de l'aPDT seule face à NaOCl dans la désinfection endodontique. Cependant aucune étude ne corrobore actuellement leur thèse et certains auteurs remettent en question les propriétés antibactériennes si avantageuses de la curcumine dans l'aPDT (cf. discussion).
Rare sont les auteurs qui mettent en lumière une supériorité de l’aPDT seule face à NaOCl dans la désinfection endodontique.
Prażmo et al.43 évaluent l’efficacité de l’aPDT dans la désinfection intracanalaire d’E. Fæcalis, ainsi
que l’impact que pourraient avoir plusieurs cycles d’irradiation sur les performances de l’aPDT. Ils répartissent 46 dents humaines avec un canal en 5 groupes :
- PDT : 1 cycle de aPDT (PS : bleu de toluidine ; SL : laser diode) ;
- 2PDT : 2 cycles de PDT de 2 minutes, avec un temps de pause (pas d’activation lumineuse) de 2 minutes entre les 2 cycles ;
- NaOCl : irrigation avec 10mL NaOCl 5.25% pendant 5 minutes ; - Contrôle négatif : pas d’infection ;
- Contrôle positif : irrigation au chlorure de sodium à 0.9%.
Ils observent une réduction de la charge bactérienne de 45%, 95% et 100% pour les groupes PDT, 2PDT et NaOCl respectivement. Ils en concluent à une supériorité de NaOCl dans la désinfection endodontique en ex vivo d’E. Fæcalis, ainsi qu’une utilisation préférentielle de l’aPDT en tant qu’adjuvant de la thérapie endodontique conventionnelle.
43 Prażmo, Godlewska, et Mielczarek, « Effectiveness of repeated photodynamic therapy in the elimination of
L’étude d’Hecker et al.44, sur des sections radiculaires de dents bovines, ne constatent aucune
désinfection suffisante pour l’aPDT, y compris dans les tubuli dentinaires, à l’inverse de NaOCl. Idem pour Tennert et al.45 en 2014 qui constatent, ex vivo, une activité antibactérienne de l’aPDT
contre E. Fæcalis significativement inférieure à celle de l’irrigation à NaOCl 3%. En effet, les résultats de l’étude montent une réduction de la charge bactérienne de 92.7% pour l’aPDT seule, alors qu’une réduction de 99.9% est obtenue avec NaOCl 3%. D’autre part, les dents soumises à l’aPDT présentent à l’issu du traitement une culture négative dans 5 % des cas, contre 80% pour NaOCl 3%.
Ces derniers résultats s’expliqueraient par la difficulté du photosensibilisant à pénétrer dans les strates profondes du biofilm, laissant ainsi vivantes des bactéries hors d’atteintes4647. D’après
Tennert et al.48, le recours à un agent chélatant précédant l’aPDT, tel que l’EDTA ou encore l’acide
citrique, permettrait une désorganisation du biofilm qui améliorerait la pénétration du
photosensibilisant, et donc l’efficacité de l’aPDT. Cette affirmation semble corroborer les résultats positifs de l’étude de Bonsor et al..
L'infériorité de l'aPDT face à NaOCl dans la désinfection endodontique apparaît plus marquée dans la réduction du nombre de cultures positives (fig. 6) que dans la réduction de la charge bactérienne (fig. 5), bien que celles-ci soient contestées par les études de Bonsor et al. et de Neelakantan et al.. L’infériorité des résultats de l’aPDT seule dans la désinfection endodontique par rapport à NaOCl ne semble pas indiquer son utilisation en tant qu’alternative à une irrigation conventionnelle. De nombreux auteurs se sont donc intéressés à son emploi en tant que thérapie adjuvante.
3.2.2. L’action adjuvante de l’aPDT
Les études ayant répertoriées l’action antibactérienne de l’aPDT en thérapie adjuvante au traitement endodontique conventionnel sont répertoriées dans la tableau 5. Comme vu précédemment, les paramètres employés sont eux aussi variés.
44 Hecker et al., « Establishment of an optimized ex vivo system for artificial root canal infection evaluated by use
of sodium hypochlorite and the photodynamic therapy ».
45 Tennert et al., « Effect of photodynamic therapy (PDT) on Enterococcus faecalis biofilm in experimental primary
and secondary endodontic infections ».
46 Tennert et al., « Ultrasonic activation and chemical modification of photosensitizers enhances the effects of
photodynamic therapy against Enterococcus faecalis root-canal isolates ».
47 Ng et al., « Endodontic photodynamic therapy ex vivo ».
48 Tennert et al., « Ultrasonic activation and chemical modification of photosensitizers enhances the effects of
Tableau 5 : Ensemble des paramètres employés par les études comparant NaOCl et NaOCl + aPDT.
(Tbio= temps de formation du biofilm ; PIT = temps de pré-irradiation ; TI = temps d’irradiation ; TB = Bleu de toluidine ; MB = bleu de méthylène ; PC = chlorure de phénothiazine ; pour l’étude de Ng et al., le temps d’irradiation est de 2 cycles de 2,5 min avec une pause de 2,5 min.)
Figure 7 : Comparaison de l'efficacité de la réduction de la charge microbienne entre NaOCl et NaOCl + aPDT
Source : Auteur
84,00% 86,00% 88,00% 90,00% 92,00% 94,00% 96,00% 98,00% 100,00% Oliveira et al. , 2015 (E Fæcalis)
Oliveira et al. , 2015 (P Aeruginosa) Oliveira et al. , 2015 (S Aureus) Oliveira et al. , 2015 (C Albicans) Tennert et al. , 2015 Tennert et al. , 2014 Rios et al. , 2011 Souza et al., 2010 (bleu de toluidine) Souza et al., 2010 (bleu de méthylène) Garcez et al., 2008 (1ère session) Garcez et al., 2008 (2ème session) Garcez et al., 2007
Pourcentage de réduction de la charge microbienne aPDT + NaOCl NaOCl