Réponses digestives du cerf de Virginie à l’île
d’Anticosti face à un régime alimentaire riche en
conifères
Mémoire
Michael Bonin
Maîtrise en biologie
Maître ès sciences (M.Sc.)
Québec, Canada
© Michael Bonin, 2015
RÉSUMÉ
La plasticité digestive est reconnue comme un trait adaptatif permettant aux individus de faire face à des variations de la qualité nutritive des ressources alimentaires. Nous avons comparé la morphologie digestive et la digestibilité du brout ligneux des cerfs de Virginie introduits à l’île d’Anticosti avec celle des cerfs de la population continentale source. Plusieurs traits de la morphologie digestive se sont avérés être plus grands chez le cerf à l’île d’Anticosti que chez le cerf continental. Toutefois, peu de différences ont été détectées au niveau de la digestibilité entre les deux populations. La plasticité digestive, particulièrement au niveau du rumen-réticulum, semble impliquée dans la réponse digestive du cerf face aux conditions alimentaires sous-optimales de l’île d’Anticosti et contribue probablement à améliorer son efficacité digestive.
ABSTRACT
Digestive plasticity is recognized as an adaptive trait that enables individuals to cope with variations in the quality of food resources. We compared the digestive morphology and the digestibility of woody browse of introduced deer from Anticosti Island and deer from the mainland source population. Several measurements of the digestive organs of deer from Anticosti Island were larger compared to the continental deer. However, no clear differences were detected in plant digestibility between the two populations. Digestive plasticity, especially at the rumen-reticulum scale, appears to play a central role in the digestive response to low-quality food conditions faced by deer on Anticosti Island and probably contributes to improve digestive efficiency.
TABLES DES MATIÈRES
RÉSUMÉ ... iii
ABSTRACT ... v
TABLES DES MATIÈRES ... vii
LISTE DES TABLEAUX ... ix
LISTE DES FIGURES ... xi
REMERCIEMENTS ... xiii
AVANT-PROPOS ... xv
INTRODUCTION GÉNÉRALE ... 1
L’influence de la composition du régime alimentaire sur l’écologie digestive des grands herbivores ... 1
Le système digestif des ruminants: morphologie et processus de digestion ... 2
Ajustements digestifs: efficacité et morphologie digestive ... 4
Modèle d’étude: le cerf de Virginie à l’île d’Anticosti ... 7
Aires d’étude ... 8
Objectifs et hypothèses ... 8
Approche méthodologique ... 9
CHAPITRE PRINCIPAL ... 11
Could morphological adjustments or enhancement of the digestive capacity explain the ability of a large herbivore at high density to cope with a low-quality diet? ... 11
RÉSUMÉ ... 13
ABSTRACT ... 15
INTRODUCTION ... 17
METHODS ... 19
Study area ... 19
Collection of digestive tracts from deer harvested by sport hunters ... 20
Anatomy of the digestive tract ... 20
In vitro true digestibility experiment ... 22
Statistical analyses ... 23
RESULTS ... 24
Characteristics of the white-tailed deer studied ... 24
Morphology of digestive organs ... 24
In vitro true digestibility of white-tailed deer winter diet ... 26
viii
Forestomach ... 28
Ruminal papillae ... 29
Hindgut ... 30
Liver and parotids ... 30
In vitro digestibility ... 31 CONCLUSION ... 31 ACKNOWLEDGEMENTS ... 32 REFERENCES ... 32 CONCLUSION GÉNÉRALE ... 37 Limites de l’étude ... 39
Originalité et apports de l’étude ... 42
Suggestions de recherche ... 42 BIBLIOGRAPHIE GÉNÉRALE ... 45 APPENDIX 1 ... 49 APPENDIX 2 ... 55 APPENDIX 3 ... 57 ANNEXE 4 ... 65
LISTE DES TABLEAUX
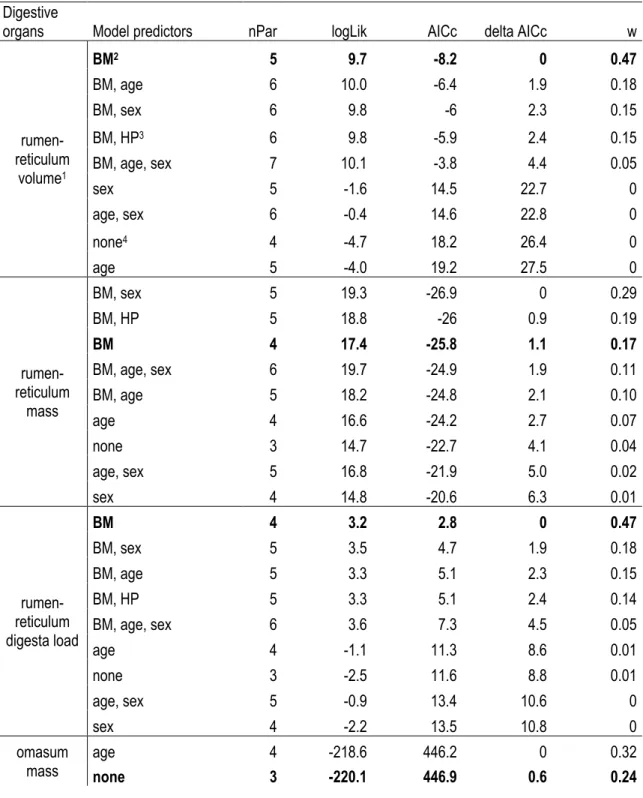
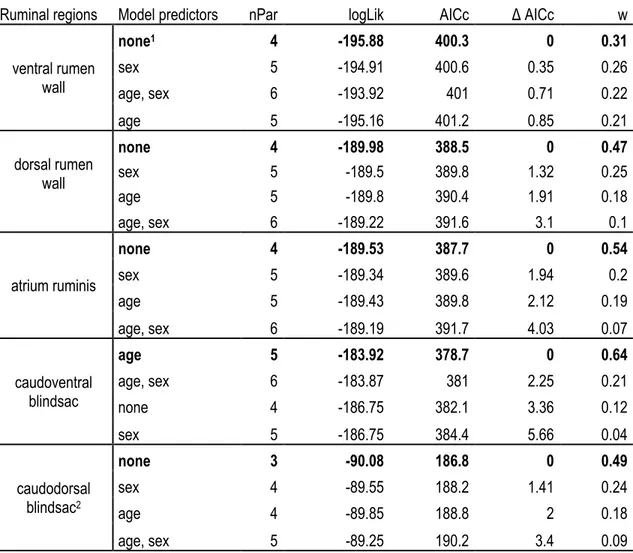
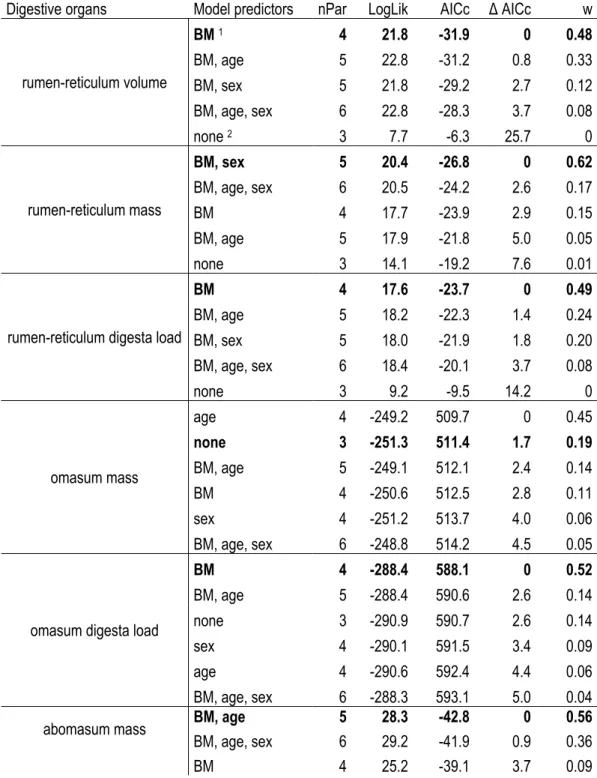
Tableau I. Contribution des auteurs de l’article présenté au chapitre principal. ... xv Table 1. Influence of the white-tailed deer population (Anticosti Island and mainland) on digestive organ morphology. Results of the analysis of covariance based on model selection (Appendix 1) are presented as means ± SE for each deer population with the corresponding analysis between population means (df = degrees of freedom, F ratio, and P values). ... 25 Table 2. Surface enlargement factor (SEFs) for each of the five ruminal indicative regions of white-tailed deer on Anticosti Island and from the mainland population. Results of the analysis of variance based on models retained from AICc (Appendix 1)are presented as means ± SE for each deer population with the corresponding
analysis of variance between population means (df = degrees of freedom, F ratio, and P values). ... 26 Table A1.1. Models (GLM, GLMM) tested to explain the digestive morphology of white-tailed deer sampled on Anticosti Island (Québec, Canada) and the mainland population. All models included “population (Anticosti and mainland)” as an independent variable. Number of parameters (nPar), loglikelihood (LogLik), second order Akaike criterion adjusted for small sample size (AICc), delta AICc (Δ AICc), and weight (w) are presented. The retained models (i.e. the most parsimonious model under Δ AICc < 2 criterion) are indicated in bold. ... 49 Table A1.2. Models (GLM, GLMM) tested to explain the surface enlargement factor (SEF) of white-tailed deer sampled on Anticosti Island (Québec, Canada) and the mainland population. All models included “population (Anticosti and mainland)” as an independent variable. Number of parameters (nPar), loglikelihood (LogLik), second order Akaike criterion adjusted for small sample size (AICc), delta AICc (Δ AICc), and weight (w) are presented. The retained models (i.e. the most parsimonious model under Δ AICc < 2 criterion) are indicated in bold. ... 53 Table A1.3. Density (nb. papilles / cm2), central width (mm) and length (mm) of ventral, dorsal, atrium ruminis,
caudodorsal and codoventral rumen walls. Data are presented as means ± SE for each ruminal regions. ... 54 Table A2.1. Fibers (natural detergent fiber (NDF), acid detergent fiber (ADF) and acid detergent lignin (ADL)), dry matter (DM) content (%) of species used for in vitro true digestibility trials. Results of fiber contents are presented as means ± SE on dry matter basis. ... 55 Table A2.2. In vitro true digestibility on dry matter basis (% IVTDDM) after 24 and 48 hours of incubation for
species representative of white-tailed deer winter diet on Anticosti Island (Québec, Canada) and the mainland population with deer ruminal inocula from both populations (Anticosti Island n = 6; mainland population n = 5). Results are presented as means ± SE. ... 56 Table A3.1. Models (GLM) tested to explain the digestive morphology of white-tailed deer sampled inside enclosures on Anticosti Island, outside enclosures on Anticosti Island and from the mainland population. All models included “habitat type (Anticosti Island enclosure, Anticosti Island natural habitat and mainland)” as an independent variable. Number of parameters (nPar), loglikelihood (LogLik), second order Akaike criterion adjusted for small sample size (AICc), delta AICc (Δ AICc), and weight (w) are presented. The retained models (i.e. the most parsimonious model under Δ AICc < 2 criterion) are indicated in bold. ... 60 Table A3.2. Comparisons (pairwise t-tests) of the effect of habitat type (inside enclosures on Anticosti Island (n = 7), natural habitat outside enclosures on Anticosti Island (n = 25), and natural habitat in the mainland (n = 24)) on the morphology of white-tailed deer digestive organs. Results are presented as adjusted means ± SE with corresponding habitat comparison for each digestive organ measurements. ... 63
LISTE DES FIGURES
Figure 1. Difference in mean in vitro true digestibility of dry matter (%IVTDDM) for selected browse species
digested for 24 h [top] or 48 h [bottom] with inocula from deer harvested on the mainland (n = 5) or on Anticosti Island (n = 6). Results are presented as the difference (effect size) of %IVTDDM with corresponding 95%
confidence interval’s (CI) for each plant species using mainland inocula as the reference compared to inocula from deer on Anticosti Island. Negative and positive values correspond respectively to lower and higher %IVTDDM values obtained for plant species when using inocula from the mainland population over inocula from
Anticosti Island. Effect size of plant species digestibility accompagnied by an asterix (*) and whose CI do not include zero are statistically different after sequential Bonferroni correction. ... 27
REMERCIEMENTS
Je tiens tout d’abord à remercier mon directeur de recherche Steeve Côté pour m’avoir donné la chance de réaliser ce projet. Merci pour ton implication à chacune des étapes du projet, également la récolte d’échantillons. Ce fût un plaisir de sortir du cadre académique et d’aller chasser en ta compagnie. Merci pour l’autonomie que tu m’as permis de développer avec l’élaboration de ce projet et la confiance que tu as eu en mes capacités pour mener sa réalisation à terme. Je remercie également mon codirecteur de recherche, Jean-Pierre Tremblay, pour son implication et ses conseils tout au long du projet. À plusieurs reprises, tes commentaires m’ont permis de voir les choses sous des angles auxquels je n’avais souvent même pas songé. Nos nombreuses discussions ont été d’un apport considérable à l’interprétation des résultats du projet. En espérant pouvoir se reprendre pour ce qui est d’aller chasser ensemble ! Merci à Sonia de Bellefeuille pour ton aide à la planification des sorties terrain, du matériel de laboratoire, la révision des textes et surtout ta bonne humeur indéfectible à toutes les fois que je passe te dire bonjour le matin en débutant la journée. Merci à Marie-Claude Martin pour ton aide en laboratoire et à la planification des aspects liés au matériel de terrain. Merci également à Nadia Aubin-Horth et Gilles Gauthier d’avoir accepté de réviser et commenter ce mémoire.
La réalisation de ce projet n’aurait pas été possible sans la collaboration de nombreux chasseurs et guides de chasse tant à l’île d’Anticosti que dans la région de Montmagny. Vous êtes trop nombreux pour être tous nommés donc je vous dis simplement merci à tous d’avoir participé. Je me permets tout de même de remercier Maxime « The killer » Moreau, sans qui le volet à l’île Anticosti n’aurait pas été un aussi grand succès. Merci pour ta participation, tes nombreuses sorties de chasse planifiées à la dernière minute et bien sûr les bons moments passés en ta compagnie. Merci aussi à Jean-Philippe Harnois, Alexandre Murray et Joël Malouin pour leur aide précieuse lors de la récolte des systèmes digestifs à l’île d’Anticosti. Un grand merci à Lise Cloutier de m’avoir aussi bien accueilli au bureau d’enregistrement de la grande faune à Montmagny. Le volet du projet réalisé dans la région de Montmagny aurait été beaucoup plus compliqué sans le soutien de Jean-François Dumont. Merci de nous avoir mis en contact avec les gens de la Zec de l’Oie blanche et surtout merci de m’avoir accueilli chez toi à bras ouvert et m’avoir permis de squatter ton garage ! Finalement, merci à Raymond et Jimmy Chabot pour leur aide lors de la récolte des carcasses de cerfs sur la route.
J’ai eu la chance au cours de ce projet d’avoir l’aide de deux assistantes de terrain merveilleuses: Clara Morissette-Boileau et Pascale Ayotte. Les filles, je ne vous remercierai jamais assez du coup de main que vous m’avez donné, on va se le dire c’était spécial et assez dégoutant au moins la moitié du temps. Clara merci pour ton enthousiasme sans limite, tes goûts musicaux un peu trop contemporains pour moi et ta bonne
xiv
une première fois à tout faut croire. Pascale merci pour tes fous rires, ta patience et d’avoir été une assistante aussi fabuleuse. Je peux t’assurer que je ne verrai plus jamais un Tim Hortons ni ne viderai plus jamais une poubelle sans penser à toi. Ce fut un plaisir de travailler avec vous deux et je suis très content de voir que vous avez chacune entrepris des études graduées, je vous souhaite beaucoup de succès.
Faire une maîtrise c’est tout un défi, mais quand on est si bien entouré au bureau que je l’ai été ça devient une vraie partie de plaisir. Merci à vous tous qui êtes désormais des amis bien plus que des collègues. Que se soit au bureau, autour d’une bière ou sur le terrain vous avez tous contribué à votre façon à rendre cette expérience meilleure de par nos discussions et nos party. Un remerciement particulier à Sabrina Plante et Amélie Drolet pour votre joie de vive, nos discussions (surtout celles n’ayant absolument aucun fondement scientifique) et nos bons moments sur le terrain. Amélie je n’aurais jamais pensé rencontrer une vraie licorne, je peux maintenant cocher ça sur ma liste de choses à faire. Merci à Valérie, Sabrina, Amélie, Nicolas, Émilie et Julien pour vos commentaires et nombreuses relectures des sections de ce mémoire.
Merci à mes parents Érik et Diane et mes frères Alexandre et Simon pour vos encouragements, votre soutien et nos bons moments passés en famille. Papa, maman, merci d’être toujours là lorsque je reviens à la maison, de m’avoir appris la valeur du travail bien fait et de m’avoir encouragé à vivre cette expérience. Merci papa d’être l’homme et le père que tu es.
Finalement, merci à ma fiancée Gabrielle qui illumine mes journées depuis tant d’années. Nous sommes passés par tellement d’aventures ensemble et celle-ci en fut une merveilleuse de par ton soutien continuel. Merci de faire partie de ma vie et de mes choix et d’être toujours là dans les bons comme dans les moins bons moments.
I’m a simple man, Hobbes.
You? Yesterday you wanted a nuclear powered car that could turn into a jet with laser-guided heat-seeking missiles!
I’m a simple man with complex tastes. Calvin and Hobbes L’homme heureux n’a pas besoin du regard des autres, c’est au contraire son regard sur les gens qu’il aime qui est gage de son bonheur
AVANT-PROPOS
Ce mémoire de maîtrise vise à déterminer si des ajustements digestifs permettent d’expliquer le maintien d’une densité élevée de cerfs de Virginie à l’île d’Anticosti (Québec, Canada) malgré la consommation en hiver d’un régime alimentaire de faible qualité nutritive riche en conifères. Pour ce faire nous avons combiné deux approches : la description macroscopique de la morphologie des organes du système digestif du cerf et l’analyse de la digestibilité in vitro, à partir d’inoculum de cerfs de Virginie, de plantes représentatives du régime alimentaire hivernal du cerf. Les aspects reliés à ces deux volets ont été comparés entre le cerf de l’île d’Anticosti et le cerf de la région continentale de Montmagny (Québec, Canada). Ce mémoire comporte 5 parties: une introduction générale, un chapitre principal présenté sous la forme d’un article scientifique rédigé en anglais en vue d’une publication dans une revue scientifique internationale, quatre annexes liées aux méthodes, analyses statistiques et résultats du projet et une conclusion générale. En tant que premier auteur, j’étais responsable du développement des hypothèses et prédictions, de l’élaboration des protocoles, la récolte des données terrain, les manipulations en laboratoire, la compilation et l’analyse des données et la rédaction. Les deux chercheurs qui seront coauteurs de l’article sont :
- Steeve D. Côté, directeur de maîtrise, professeur au département de biologie de l’université Laval et titulaire de la Chaire de recherche industrielle-CRSNG en aménagement intégré des ressources de l’île d’Anticosti.
- Jean-Pierre Tremblay, codirecteur de maîtrise et professeur agrégé au département de biologie de l’université Laval.
Contribution des différents auteurs
Tableau I. Contribution des auteurs de l’article présenté au chapitre principal.
M. Bonin J.-P. Tremblay S. D. Côté
Conception du projet X X X
Financement X
Mise en place du projet X X
Prise de données X
Analyse statistique et interprétation X
Interprétation des résultats X X X
Rédaction X
Révision X X X
INTRODUCTION GÉNÉRALE
Le système digestif des herbivores, particulièrement celui des ruminants, montre des adaptations morphologiques et physiologiques découlant d’étroites interactions avec les plantes. Bien que plusieurs études se soient intéressées à l’écologie digestive des grands herbivores (Barboza et Bowyer 2000; Clauss et Lechner-Doll 2001; Clauss et al. 2009; Codron et Clauss 2010), les déterminants proximaux et ultimes qui influencent le développement des différentes stratégies digestives demeurent méconnus. La compréhension des mécanismes d’acclimatation et d’adaptation digestifs d’une espèce permettrait par contre de mieux évaluer les effets pour l’individu de l’altération des ressources alimentaires de l’habitat.
L’influence de la composition du régime alimentaire sur l’écologie digestive des grands herbivores
Le domaine de l’écologie digestive s’intéresse aux variations de la morphologie et de la physiologie digestive en relation avec divers facteurs intrinsèques ou extrinsèques à l’animal, par exemple le sexe ou la qualité nutritive des ressources alimentaires disponibles (Barboza et Bowyer 2000; Jiang et al. 2006). Toutefois, l’influence de la composition du régime alimentaire sur le développement digestif des individus occupe une place centrale (Weckerly 1989; Holland 1994, Sassi et al. 2010). Bien que plusieurs espèces ont fait l’objet d’études portant sur des composantes morphologiques ou physiologiques digestives, les herbivores en raison de leur système digestif plus différencié que celui des carnivores représentent une proportion prédominante de la littérature des dernières décénnies réfèrant à l’écologie digestive (Hofmann 1973; Baker et Hobbs 1987; Clauss et al. 2006; Codron et Clauss 2010; Gruninger et al. 2014).
Radiation adaptative et spécialisation
Les grands herbivores présentent une vaste gamme de phénotypes digestifs en fonction des niches écologiques qu’ils exploitent. Selon la composition de leur alimentation, les individus ont développé une morphologie digestive spécifique afin de soutenir un apport nutritif adéquat provenant des ressources alimentaires. Cette radiation adaptative, décrite par Hofmann (1973), est particulièrement observable chez les ruminants. La sélectivité alimentaire est considérée comme étant le facteur clé ayant mené à l’évolution de la forme du système digestif (i.e. la stratégie digestive) des ruminants qui contraint de manière globale les individus à l’exploitation d’une niche écologique donnée. Les phénotypes digestifs observés au sein d’une population sous des conditions d’habitats données fournissent des informations essentielles pour la compréhension de l’influence du régime alimentaire sur le développement du système digestif d’un individu.
2
Composition du régime alimentaire et prise alimentaire
Différentes contraintes, intrinsèques (bilan énergétique et condition corporelle) ou extrinsèques (caractéristiques des plantes), imposent un compromis aux herbivores en termes de prise alimentaire. La qualité nutritive des ressources végétales est généralement exprimée en termes de teneur en fibres (composantes structurales telles que la cellulose, l’hémicellulose et la lignine), de nutriments (p. ex. la teneur en azote) et de composés secondaires de défense. Ces derniers retrouvés en concentrations variables dans les plantes ont un effet négatif sur la digestibilité des composantes végétales et altèrent la stabilité des enzymes bactériennes impliquées dans le processus de digestion (Zucker 1983; Robbins et al. 1987). De faibles concentrations en fibres et en composés secondaires de défense et une teneur élevée en azote sont associées à des ressources végétales de qualité nutritive élevée. La qualité nutritive des plantes peut varier de diverses manières, e.g. des changements environnementaux peuvent modifier la disponibilité des ressources pour une plante ou sa valeur nutritive peut diminuer en cours d’année suite au développement ontogénique et l’accumulation de composés phénoliques (Palo et al. 1985). Le maintien de l’équilibre nutritif d’un individu est donc dépendant de sa capacité à composer avec ces différentes contraintes et du développement d’une stratégie digestive permettant d’exploiter efficacement les ressources alimentaires d’un habitat.
L’ajustement continuel de la prise alimentaire est lié à ces différentes contraintes et vise à maintenir l’équilibre nutritif: un apport alimentaire excédentaire aux besoins métaboliques favorisera une accumulation d’énergie (par exemple sous forme de lipides) alors qu’un apport déficitaire entraînera un épuisement des réserves et à moyen ou long terme une diminution de la condition physique de l’animal. La limitation de la prise alimentaire chez les herbivores peut être en partie expliquée au niveau morphologique par l’hypothèse de limitation physique du tube digestif (Baile et Forbes 1974). Cette hypothèse s’applique lorsque les plantes consommées sont de valeur nutritive faible à modérée et stipule que la prise alimentaire est alors dépendante de l’espace digestif disponible. En d’autres termes, l’ingestion se poursuit jusqu’à ce qu’un effet d’encombrement limite la prise alimentaire et reprend à mesure que la vidange gastrique libère de l’espace (Baile et Forbes 1974).
Le système digestif des ruminants: morphologie et processus de digestion
En raison du caractère plus complexe (i.e. niveau de différenciation morphologique plus élevé) du système digestif des ruminants, comparativement aux herbivores monogastriques, l’influence de la qualité nutritive du régime alimentaire sur la prise alimentaire et le développement digestif des ruminants a reçu beaucoup d’attention (Hofmann 1973; Baker et Hobbs 1987; Clauss et al. 2003).
Le système digestif des ruminants est l’un des plus différenciés chez les mammifères herbivores. Les dents débutent la digestion en effectuant un broyage mécanique au cours duquel les glandes salivaires (parotides,
sublinguales, sous-maxillaires et molaires inférieures) produisent un volume variable de salive aqueuse. Les glandes parotides sécrètent des protéines liantes riches en proline qui forment des complexes stables avec les composés secondaires de défense des plantes (ex : tannins) et en réduisent ainsi les effets néfastes pour l’animal (McArthur et al. 1993; Shimada 2006). Les ruminants ont développé un niveau de production variable de ces protéines salivaires selon la concentration en composés secondaires de défense de leur alimentation. L’hypothèse de détoxification limitante prédit que la capacité d’élimination ou de neutralisation de ces composés détermine en majeure partie la quantité et le type de plantes pouvant être consommées par un individu (Freeland et Janzen 1974; Marsh et al. 2006).
Les ruminants possèdent quatre estomacs plus ou moins différenciés: le rumen, le réticulum, l’omasum et l’abomasum. Une fois ingéré le matériel végétal (digesta) arrive au rumen-réticulum. Selon la taille des particules, le digesta va remonter vers la bouche après un certain temps dans le rumen-réticulum pour être rebroyé et descendre à nouveau vers le rumen-réticulum. Ce processus porte le nom de rumination et vise à réduire la taille des particules végétales afin d’en maximiser la surface d’action pour la digestion. Les parois internes du rumen sont recouvertes de papilles de dimensions variables au travers desquelles les produits de la digestion, les nutriments et minéraux sont assimilés (Tamate et al. 1962). Leur morphologie et densité, selon l’emplacement dans le rumen, sont influencées positivement par la qualité nutritive des ressources alimentaires consommées et influencent la surface d’absorption disponible et le taux d’assimilation d’énergie de l’animal (Tamate et al. 1962; Hofmann et al. 1988; Hofmann 1989). Les patrons de taille et de densité des papilles ruminales ont d’ailleurs été utilisés afin de déterminer l’influence du type de régime alimentaire sur la morphologie ruminale (Kuzyk et Hudson 2008).
La digestion et la dégradation du matériel végétal chez les ruminants s’effectuent principalement au niveau du rumen-réticulum (Van Soest 1996). Comme les ruminants ne possèdent pas les enzymes nécessaires au catabolisme des liens structuraux des plantes, leur dégradation est assurée par des microorganismes symbiotiques retrouvés au niveau du rumen. Ces microorganismes (i.e. bactéries, protozoaires et mycètes) métabolisent via un processus de fermentation anaérobique les composantes végétales et libèrent dans le milieu ruminal des sous-produits métaboliques qui constituent la principale source énergétique des ruminants (Van Soest 1996). Ces sous-produits, notamment les acides gras volatils (principalement l’acétate, le propionate, le butyrate et leurs dérivés) sont assimilés avec les autres molécules plus simples au travers des papilles ruminales (Tamate et al. 1962; Van Soest 1996). Les ruminants tirent la majeure partie de l’énergie digestible des plantes consommées de l’assimilation de ces composés rendus disponibles par le métabolisme microbien (Van Soest 1996).
4
Depuis le rumen-réticulum, le digesta passe à l’omasum via le sphincter réticulo-omasal et ensuite vers l’abomasum. L’omasum et l’abomasum assurent en partie l’absorption de l’eau et des électrolytes et agissent comme filtre de la taille des particules du digesta (Prins et al. 1972; Hofmann 1989). Passé l’abomasum où survient également une digestion acide des molécules complexes, le digesta arrive au petit intestin par le sphincter pylorique où s’effectue l’absorption des minéraux et acides aminés. Arrivé au caecum, le digesta est ralenti, ce qui permet une meilleure réabsorption des produits de la digestion et chez certaines espèces, une seconde digestion des composants végétaux. Finalement, le digesta passe au gros intestin où l’eau et les métabolites qui demeurent sont assimilés. Le matériel restant est expulsé sous forme de fèces.
Ajustements digestifs: efficacité et morphologie digestive
Plusieurs aspects de l’écologie digestive chez les ruminants ont été étudiés avec une emphase sur les espèces d’élevage (Huston et al. 1986; Belanche et al. 2012). Toutefois, de plus en plus d’études s’intéressent à la digestion, la morphologie et la production d’énergie chez différents ruminants sauvages tels que l’orignal (Alces alces L.) (Renecker et Hudson 2010; Spalinger et al. 2010), le caribou (Rangifer tarandus) (Côté 1998) et plusieurs espèces de cerfs (Robbins et al. 1975; Holand 1992; Clemente et al. 2005).
Efficacité de la digestion et ajustement de l’environnement microbien ruminal
Le microbiome ruminal est qualifié de dynamique du fait que sa composition microbienne spécifique et fonctionnelle peut varier pendant la vie de l’animal hôte selon différents facteurs intrinsèques (pH ruminal, température, niveau de méthane libéré, etc.) et extrinsèques, particulièrement le type et la qualité nutritive des ressources végétales consommées. Tajima et al. (2001) ont montré par réaction de polymérase en chaînes que la diversité bactérienne du microbiome ruminal chez la vache subissait d’importants changements lors de la transition d’une alimentation de blé (teneur élevée en fibres) vers une alimentation de concentrés (faible teneur en fibres). Cette influence du type de régime alimentaire peut avoir des répercussions importantes sur l’écologie ruminale et l’efficacité digestive des ruminants. Bien que l’effet du changement de qualité nutritive de l’alimentation sur l’écologie du rumen soit reconnu, ses impacts sur la digestibilité des substrats végétaux demeurent méconnus puisque peu d’études ont détecté un effet sur la digestibilité suite à un changement de qualité nutritive du régime alimentaire au niveau intraspécifique (Gordon et al. 2002).
Digestibilité in vitro
L’analyse de la digestibilité via l’utilisation d’inocula, i.e. du fluide ruminal, est un outil très utile pour déterminer la digestibilité d’un régime alimentaire donné ou pour comparer l’efficacité de différents microbiomes ruminaux à digérer une même ressource végétale. Cette méthode basée sur les travaux de Tilley et Terry (1963) et de
Palmer et Cowan (1980) permet l’évaluation simultanée de la digestibilité de plusieurs plantes. Les valeurs de digestibilité vraies obtenues permettent de mieux comprendre comment la consommation d’une ressource alimentaire spécifique affecte le microbiome ruminal et donc l’apport nutritif pour l’animal. De telles informations s’avèrent utiles pour la comparaison interspécifique de la capacité digestive (Galbraith et al. 1998; Ammar et al. 2008), par exemple lors d’études sur les stratégies de coexistence de différentes espèces (Demarais et al. 2003; Elston et Hewitt 2010) ou encore lors d’études visant à comprendre le succès de l’exploitation des ressources d’un habitat par une espèce (Ward 1971; Baker et Hobbs 1987; Renecker et Hudson 2010).
Plusieurs études ont démontré que l’utilisation d’inocula de ruminants domestiques pour déterminer les valeurs de digestibilité pour des animaux sauvages était une solution adéquate puisque l’utilisation d’animaux sauvages implique généralement plus de contraintes que pour les espèces domestiques (Welch et al. 1983; Crawford et Hankinson 1984; Clemente et al. 2005). Par exemple, Clemente et al. (2005) ont obtenu des valeurs de digestibilité in vitro similaires à partir d’inocula de bovins et de cerf de Virginie (Odocoileus
virginianus) sauvage. Toutefois, certaines études (Clary et al. 1988; Brooks et al. 2014) mettent en garde
contre le risque d’un tel procédé principalement en raison des particularités cinétiques du microbiome ruminal spécifiques aux ruminants sauvages. Brooks et al. (2014) ont observé des variations de concentrations des différents acides gras volatils résultant du processus de digestion microbienne pour une alimentation similaire chez le cerf mulet (Odocoileus hemionus) et la vache laitière. Ce constat soulève l’importance de tenir compte de la source de l’inoculum afin de cerner les effets de la qualité nutritive du régime alimentaire sur l’écologie du rumen des individus de l’espèce à l’étude. Indépendamment de la source de l’inoculum, il est globalement accepté que l’aspect dynamique du microbiome ruminal peut résulter en une variation individuelle de la capacité digestive. L’importance de considérer cette variation lors de l’analyse de la digestibilité in vitro a d’ailleurs été soulevée chez l’orignal (Pehrson et Faber 1994).
Variations de la morphologie digestive selon la qualité nutritive du régime alimentaire
En plus d’une possible réponse des processus métaboliques liés à la digestion, les ruminants, et de manière plus générale les herbivores, peuvent faire face à des changements de la valeur nutritive de leur régime alimentaire via des modifications morphologiques des organes du système digestif. Selon la théorie de la digestion optimale (Sibly 1981; Hume 1989), la composition du régime alimentaire va affecter la taille des organes du système digestif afin d’assurer un apport nutritif adéquat au niveau individuel. Cette théorie intègre le concept de plasticité qui réfère à la capacité de différents phénotypes de varier de manière réversible en réponse à un stress métabolique ou environnemental et permet aux individus de s’ajuster à des conditions d’habitats variables au cours de leur vie (Piersma et Lindström 1995). Ces variations peuvent survenir de
6
manière répétitive ou à courte échelle temporelle (Piersma et Lindström 1995). Pour les organes digestifs, on parlera plus spécifiquement de plasticité digestive et de variations en termes de longueur, volume ou différenciation des tissus. Pour un herbivore, la qualité nutritive du régime alimentaire est un des facteurs connus qui influencent la taille relative des organes digestifs. Généralement, face à une alimentation de faible qualité nutritive la taille du système digestif d’un individu augmentera afin d’accroître le temps d’exposition du matériel végétal au processus de digestion et améliorer l’assimilation d’énergie (Sibly 1981; Hume 1989). La plasticité de la morphologie digestive peut s’avérer essentielle dans des habitats où la qualité nutritive des ressources alimentaires subie des variations temporelles ou spatiales importantes, l’étendue de la variation de taille de chaque organe étant tout de même sujette aux limites physiques de l’animal. Sassi et al. (2007) ont étudié la morphologie digestive de quatre populations réparties selon un gradient spatiotemporel de qualité nutritive des ressources alimentaires chez le cobaye nain austral (Microcavia australis) durant les saisons sèches et humides. La masse relative du caecum, principal site de fermentation du digesta chez le cobaye, était plus élevée chez les individus s’alimentant dans des habitats présentant des ressources alimentaires de faible qualité nutritive contrairement aux habitats avec des ressources alimentaires de qualité élevée (Sassi et
al. 2007). Cette différence a été attribuée au bénéfice énergétique individuel engendré par une chambre de
fermentation de plus grande capacité lors de l’ingestion de ressources alimentaires de faible qualité nutritive (Sassi et al. 2007).
Chez un ruminant, l’efficacité digestive sera influencée par le temps de contact entre le matériel végétal et les microorganismes dans le rumen et par la surface disponible pour l’absorption. Le temps de contact est déterminé par le taux de passage et de rétention du digesta et la taille du rumen-réticulum (Hume 1989). Il est possible d’établir deux extrêmes de la relation qualité-disponibilité du régime alimentaire soit: (1) une faible disponibilité et qualité nutritive des ressources alimentaires et (2) une disponibilité et une qualité nutritive des fourrages élevée. Dans le premier cas, les prédictions de la théorie de la digestion optimale (Sibly 1981) et du concept de plasticité digestive, suggèrent que le taux de passage du digesta devrait diminuer et la capacité du rumen-réticulum augmenter afin d’allouer plus de temps d’action au métabolisme microbien et à l’assimilation d’énergie. Dans le deuxième cas, le taux de passage du digesta devrait augmenter et la capacité du rumen-réticulum diminuer en réponse à une digestion et dégradation plus rapides du matériel végétal. De tels ajustements de la morphologie digestive ont été observés chez plusieurs espèces de ruminants sauvages et ont été associés à des variations de la qualité nutritive des ressources consommées, notamment chez le cerf de Virginie (Jenks et al. 1994) et le cerf Sika, Cervus nippon L. (Jiang et al. 2006).
La taille de certains organes du système digestif serait particulièrement influencée par la teneur en composés secondaires de défense des ressources alimentaires. Kay (1987) a suggéré que la masse relative des glandes
parotides chez les ruminants reflète la relation fonctionnelle positive entre la masse du tissu glandulaire, le taux de sécrétion de protéines riches en proline et la teneur en composés secondaires de défense du régime alimentaire. Étant donné que plusieurs processus de détoxification ont lieu en partie dans le foie, une augmentation de l’intensité métabolique de ces processus lors de la consommation de ressources alimentaires de faible qualité nutritive entraînerait une hypertrophie des tissus hépatiques (Hofmann 1989; Johnson et al. 1990).
La réponse des organes du système digestif aux caractéristiques des ressources alimentaires est également dépendante de certains traits biodémographiques. Plusieurs études ont démontré l’importance de considérer la masse corporelle lors de l’évaluation de la capacité du rumen-réticulum (Ramzinski et Weckerly 2007; Luna et Weckerly 2013). Chez les ruminants sexuellement dimorphiques les mâles et les femelles présentent fréquemment des différences de sélection des ressources alimentaires attribuables à des variations comportementales ou des besoins métaboliques (Jenks et al. 1994; Jiang et al. 2006). Mysterud et al. (2008) ont montré que la masse humide relative du rumen des mâles diminue lors du rut chez le cerf rouge (Cervus
elaphus) en raison d’une réduction des activités d’alimentation durant cette période. La morphologie de
certains organes du système digestif montre plutôt une relation dépendante de l’âge, comme pour la taille des papilles ruminales chez le cerf de Virginie et le cerf mulet: la taille des papilles étant plus élevée chez les adultes que chez les juvéniles (Kuzyk et Hudson 2008).
Modèle d’étude: le cerf de Virginie à l’île d’Anticosti
Le cerf de Virginie, l’un des cervidés les plus communs d’Amérique du Nord, est retrouvé sous une grande diversité d’habitats ce qui en fait un bon modèle d’étude pour mieux comprendre la relation entre le type de ressources alimentaires et le développement digestif. Cette situation a donné au cerf de Virginie une attention scientifique soutenue. Son succès sous différents habitats a fait l’objet de nombreuses études, certaines d’entre elles ayant mis l’accent sur les composantes digestives (Short et al. 1969; Taillon et al. 2006; Luna et
al. 2012). La morphologie des organes du système digestif du cerf de Virginie a reçu beaucoup d’attention,
particulièrement celle du rumen-réticulum (Weckerly 2010; Luna et Weckerly 2013). La digestibilité des ressources alimentaires du cerf a également été le sujet de nombreuses études (Ullrey et al. 1968; Gray et Servello 1995; Sauvé et Côté 2006).
Le cerf de Virginie a été introduit à l’île d’Anticosti (Québec, Canada) à la fin du 19e siècle à partir d’une
population continentale regroupant le territoire des Municipalités régionales de comté (MRC) de Montmagny, L’Islet et de Bellechasse dans la région de Chaudière-Appalaches (Québec, Canada) (Potvin et al. 2000).
8
Suite à l’introduction d’environ 200 cerfs, sa densité à l’île d’Anticosti a augmenté rapidement et atteint maintenant >20 cerfs/km2 localement (Rochette et Gingras 2007). La forte pression de broutement engendrée
par le cerf a eu pour effet d’entraîner la quasi-disparition des essences feuillues et la transition de la régénération des sapinières vers des pessières blanches (Potvin et al. 2003). Ce changement dans la structure de la communauté végétale a eu diverses répercussions, particulièrement au niveau du régime alimentaire hivernal du cerf qui se compose désormais approximativement de 70 % de sapin baumier (Abies
balsamea Mill.), 20 % d’épinette blanche (Picea glauca Voss.) et de 10 % de lichens (Lefort et al. 2007). Ce
régime alimentaire de faible qualité nutritive et riche en composés secondaires de défense contraste avec celui composé principalement de tiges d’essences feuillues (ex. Acer sp., Betula sp., Cornus sp. etc.) consommé par le cerf de Virginie sur le continent (Dumont et al. 2005). De façon surprenante, le cerf à l’île d’Anticosti parvient tout de même à se maintenir à densité élevée en consommant des ressources alimentaires de faible qualité nutritive (Lefort et al. 2007), considérées comme inadéquates au maintien d’une population viable et évitées par les individus des populations continentales voisines (Ullrey et al. 1968).
Ces particularités du régime alimentataire du cerf à l’île d’Anticosti ont fait l’objet d’études s’intéressant à la valeur nutritive des composantes végétales, aux facteurs intrinsèques des plantes régissant la sélectivié alimentaire du cerf et aux effets d’une telle alimentation sur la survie et les traits biodémographiques du cerf (Taillon et al. 2006; Lefort et al. 2007; Sauvé et Côté 2007). Toutefois, aucune étude à ce jour n’a été réalisée concernant la stratégie digestive du cerf à l’île d’Anticosti en lien avec les composantes de son régime alimentaire.
Aires d’étude
Ce projet porte sur la population de cerfs de Virginie de l’île d’Anticosti et celle de la région continentale source. L’île d’Anticosti (49o28’N, 63o00’W) est située dans le Golfe du Saint-Laurent et a une superficie de
7 943 km2. La région continentale source (46o59’N, 70o33’W) est dominée par les érables (Acer sp.), le
bouleau jaune (Betula alleghaniensis Britton.), le bouleau à papier (Betula papyrifera Marsh.) et le sapin baumier. La densité du cerf de Virginie y est évaluée à 1,6 cerfs/km2 (Huot et Lebel 2012).
Objectifs et hypothèses
Notre objectif consistait à déterminer si la consommation hivernale d’une alimentation riche en conifères par le cerf de Virginie à l’île d’Anticosti avait mené au développement d’ajustements morphologiques ou physiologiques digestifs lui permettant d’améliorer son efficacité digestive afin de répondre à ses besoins nutritionnels. Nous avons utilisé deux approches complémentaires afin de déterminer si de tels ajustements
pouvaient contribuer à expliquer le succès du cerf face aux conditions alimentaires hivernales à l’île d’Anticosti :
(1) Comparer la morphologie des organes du système digestif du cerf de Virginie à l’île d’Anticosti à celle du cerf de la population source continentale;
(2) Comparer la digestibilité in vitro du régime alimentaire hivernal du cerf à l’île d’Anticosti à celui du cerf du continent à l’aide d’inocula ruminal prélevés chez les deux populations.
En lien avec le premier objectif spécifique, nous avons émis l’hypothèse que la consommation hivernale de conifères a modulé le développement du système digestif et des organes connexes du cerf de Virginie à l’île d’Anticosti afin de pallier à la faible qualité nutritive du matériel végétal ingéré et d’en améliorer l’exploitation énergétique. Nous prédisons que de manière globale la morphologie relative (longueur, masse, volume, surface ou différenciation) des organes du système digestif et des organes connexes (foie et glande parotide) du cerf à l’île d’Anticosti sera plus élevée que celle observée chez le cerf de la population continentale.
Pour le second objectif, nous avons émis l’hypothèse que la digestibilité in vitro d’une espèce végétale donnée est déterminée par l’efficacité métabolique et l’acclimatation du microbiome ruminal et que ces deux aspects sont dépendants des plantes naturellement consommées par le cerf. Nous prédisons que la digestibilité in
vitro du sapin baumier et de l’épinette blanche sera plus élevée lorsque soumise à une digestion par de
l’inoculum de cerf de l’île d’Anticosti comparativement à de l’inoculum de cerf de la population source continentale, mais que peu de différences seront observés dans la digestibilité in vitro d’espèces feuillues entre les deux populations car ces dernières sont de bien meilleure qualité nutritive.
Approche méthodologique
Nous avons combiné une approche descriptive de la morphologie digestive à des expériences de digestion in
vitro à l’aide d’inocula ruminal de cerf pour les plantes représentatives du régime alimentaire hivernal du cerf
aux deux aires d’étude. Au cours des saisons de chasse sportive au cerf de Virginie 2012 et 2013, soit en octobre à l’île d’Anticosti et les 2 premières semaines de novembre dans la région continentale, nous avons récolté le système digestif en entier et des pièces anatomiques sur des cerfs adultes abattus à la chasse (île d’Anticosti n = 48 et population continentale n = 53). Nous avons mesuré différents paramètres morphologiques tels que la longueur, la masse, le niveau de différenciation (i.e. densité et morphologie des papilles ruminales) et le volume relatif de différents organes du système digestif. Nous avons ensuite comparé
10
ces valeurs pour chaque organe en fonction de l’appartenance populationnelle des individus. Ces différentes comparaisons ont tenu compte de covariables (masse corporelle éviscérée, sexe ou âge) retenues par sélection de modèles.
Afin d’évaluer et de comparer la capacité digestive du cerf à l’île d’Anticosti et du continent, nous avons prélevé de la liqueur ruminale de cerfs mâles adultes dans chacune des populations (île d’Anticosti n = 6 et population continentale n = 5) que nous avons ensuite mis en contact avec 11 espèces végétales sélectionnées selon leur présence dans le régime alimentaire hivernal de chaque population. L’analyse de la digestibilité in vitro a été réalisé avec un rumen artificiel de type DaisyII Incubator (Ankom Technology, NY).
Nous avons déterminé le pourcentage de digestibilité in vitro de chacune des espèces végétales selon qu’elle ait été soumise à un inoculum de cerf de l’île d’Anticosti ou de la population continentale. Nous avons réalisé les expériences de digestion pour une durée d’incubation de 48 heures en 2012 et des durées de 24 et 48 heures en 2013 dans chaque population. Une durée d’incubation de 24 heures, bien qu’étant moins représentative du temps de rétention ruminal réel chez le cerf de Virginie qu’une durée de 48 heures (Mautz et Petrides 1971; Jenks et Leslie 1989), a été ajoutée afin de détecter des différences possibles dans les premiers stades de la digestion plutôt qu’à la fin de ce processus (Gordon et al. 2002). Nous avons ensuite comparé la digestibilitéde chaque espèce végétale en fonction de la population de cerfs et de la durée de l’incubation en tenant compte de la variation individuelle et annuelle.
CHAPITRE PRINCIPAL
Could morphological adjustments or enhancement of the digestive capacity explain the ability of a large herbivore at high density to cope with a low-quality diet?
MICHAËL BONIN1, JEAN-PIERRE TREMBLAY1 and STEEVE D. CÔTÉ1
1Chaire de recherche industrielle CRSNG en aménagement intégré des ressources naturelles de l’île
d’Anticosti; Département de biologie and Centre d’études nordiques; Université Laval; Québec, QC, G1V 0A6, Canada; MB : michaelbonin.1@ulaval.ca; SDC : steeve.cote@bio.ulaval.ca
RÉSUMÉ
Des variations phénotypiques digestives ont été observées chez plusieurs herbivores qui doivent composer avec des modifications de la qualité nutritive des ressources alimentaires. Cette plasticité digestive est considérée comme un trait adaptatif permettant aux individus d’assurer leurs besoins nutritionnels. Nous avons investigué si de telles variations phénotypiques de l’anatomie et de la physiologie digestive pouvaient contribuer à expliquer le succès du cerf de Virginie (Odocoileus virginianus) à l’île d’Anticosti (Québec, Canada) face à un régime alimentaire hivernal de faible qualité nutritive. Nous avons comparé la morphologie digestive et la digestibilité in vitro de ressouces alimentaires hivernale de cerfs à l’île d’Anticosti à celle de cerfs de la région de Montmagny (population source ayant servi à introduire le cerf à l’île d’Anticosti à la fin du 19e siècle). Par rapport aux cerfs de la population source continentale, les cerfs à l’île d’Anticosti présentaient
un volume et une charge en digesta du rumen-réticulum plus élevés (respectivement 36 et 61 %), une plus grande surface d’absorption des papilles ruminales (SEF ventral 20 % et SEF caudodorsal 16 %) et une plus grande masse relative des estomacs (rumen-réticulum 32 %, omasum 39 % et abomasum 43 %). La digestibilité du brout ligneux était similaire entre les populations, bien qu’une plus grande vitesse d’ignition de la digestion puisse s’opérer chez le cerf à l’île d’Anticosti. La plasticité digestive semble jouer un rôle dans le succès du cerf face aux conditions alimentaires rigoureuses à l’île d’Anticosti. La comparaison de la morphologie digestive et de la digestibilité chez des individus issus d’une même source mais séparés pendant plus d’un siècle contribue à notre compréhension de la réponse digestive des grands herbivores face à une
ABSTRACT
Many herbivores exhibit digestive phenotypic changes in response to changes in the quality of their food resources. This digestive plasticity is considered an adaptive trait for individuals to ensure that their nutritional needs are filled. We investigated whether digestive phenotypic variations could contribute to explain the success of white-tailed deer (Odocoileus virginianus) on Anticosti Island (Québec, Canada) facing a winter diet of low-quality. We compared their digestive morphology and in vitro digestibility of winter forage to deer from the mainland source population. Compared to the deer from the mainland, deer on Anticosti Island had a higher ruminal volume and digesta load (respectively 36 and 61 %), greater absorption surface of the ruminal papillae (ventral rumen wall SEF 20 % and caudodorsal rumen wall SEF 16 %) and greater relative mass of all forestomachs (rumen-reticulum 32 %, omasum 39 % and abomasum 43 %). Woody forage digestibility was similar between the two populations, even if faster kinetic digestion may be occuring for deer on Anticosti Island. Digestive plasticity appears to play a central role in the success of deer facing harsh food conditions on Anticosti Island. Comparison of the digestive morphology and digestibility among individuals of the same population that have been separated for more than a century and have access to very different food quality resources, contributes to our understanding of the digestive response of large herbivores facing a decline in diet quality.
INTRODUCTION
The optimal digestion theory (Sibly 1981; Hume 1989) suggests that digestive morphology of individuals is adjusted to diet quality to optimise energy intake. Facing a low-quality diet, the global length (also referred as the capacity) of the digestive tract of herbivores should increase to allow a more complete digestion of the plants and higher energy acquisition. Longer digestive tracts have been observed in herbivorous rodents (Borkowska 1995; Naya et al. 2008), fishes, Perca fluviatilis L. (Olsson et al. 2007) migratory bird species (McWilliams and Karasov 2001) and cervids (Holand 1992; Serrano Ferron et al. 2011) facing poor quality diets. Digestive plasticity is the ability to exhibit changes of the size and structure of digestive organs in response to internal or external conditions, for example diet quality, at the individual level (Stearns 1989; Gotthard and Nylin 1995). Plasticity is described as a key element for individual survival and success under conditions of unpredictable food quality and availability (Sibly 1981; Hume 1989; Piersma and Lindström 1995). This ability is likely to be more significant when individuals face seasonal energy deficits, like many species in temperate and northern regions during winter. Low-quality diet during winter enhances the need for digestive adjustments to ameliorate energy intake. Many studies have shown that herbivores can sustain metabolic requirements under highly variable diet conditions (Prins and Geelen 1971; Weckerly 1989; Holand 1992; Oikawa et al. 2011). Although digestive plasticity is recognized as a key driver of individual acclimatization and adaptation following diet shifts, evidence of such plasticity, particularly in large herbivores such as ruminants, is still rare under natural conditions. Many studies on digestive morphology and physiology of ruminants in natural habitats focused on interspecific comparisons (Spalinger et al. 1993; Clauss et al. 2006; Steuer et al. 2011) or on relations between life history traits (i.e. body mass, age, sex, etc.) and digestive morphology (Weckerly et al. 2003; Parra et al. 2014) leading to fewer studies conducted at the intraspecific level questioning the role of the digestive response in the success and survival of individuals (Weckerly 1989; Serrano Ferron et al. 2011).
The rumen-reticulum complex is probably the most studied digestive organ of ruminants (Clauss et al. 2009; Codron and Clauss 2010; Luna et al. 2012) because of its significant implication for food intake and retention time (Van Soest 1996). Its size has been shown to increase following the ingestion of a low-quality diet in response to the need to increase digesta retention time (Hofmann 1989; Lechner-Doll et al. 1990; Holland 1994). Other organs like salivary glands and liver, although not directly involved in the digestion process, may also respond to shifts in diet quality. Production of proline rich proteins that bind with tannins by parotid glands is an adaptation allowing the consumption of tanniferous plants by reducing their anti-nutritional effects (Shimada 2006; Hofmann et al. 2008). Parotid size is positively correlated with the level of salivary proteins production and has been shown to vary with diet quality in ruminants (Hofmann et al. 2008). The liver, involved
18
in many physiological detoxification pathways and other metabolic functions, has also been shown to vary in size according to nutrition in ruminants (Johnson et al. 1990).
Plant quality, which is negatively related to fiber content (Van Soest 1996) and plant secondary compounds (Hanley et al. 1992). Higher plant quality generally lead to higher energy inputs and are therefore considered major determinants of the nutrition of herbivores. In the rumen-reticulum complex, ingested food is subjected to microbial anaerobic fermentation (Van Soest 1996). Ruminants rely on the by-products of this metabolism, e.g. volatile fatty acids, for approximately 75 % of their digestible energy intake (Van Soest 1996). As plant digestion occurs, absorption of volatile fatty acids in the rumen is dependent on the available ruminal papillae surface. Papillae distribution and shape are good indicators of the ruminal absorption capacity and their development has been shown to be positively correlated with diet quality and the ruminal concentration of volatile fatty acids (Hofmann 1973; Kamler 2001; Clauss et al. 2010). Modifications of papillar morphology have been interpreted as a mechanism to cope with variations in the quality of the diet in many ruminants, particularly among deer species (Fraser 1996; Kuzyk and Hudson 2008).
Metabolic efficiency of the ruminal microbiota is a key determinant of ruminant digestible energy inputs. This microbiome is dynamic and can be modified following diet shift (Mathiesen et al. 1984; Tajima et al. 2001). Even if such modifications have been quantified (Tajima et al. 2001), measurements of impacts on subsequent digestibility are still rare in wild ruminants. One such evidence has been provided by Gordon et al. (2002) who observed an increase in the in vitro digestibility of poor quality forage for red deer (Cervus elaphus) following the acclimatization of ruminal microbiota to a higher quality diet.
As recently pointed out by Naya et al. (2014), few studies have examined the digestive plasticity between populations of the same species. There is therefore a lack of knowledge about digestive plasticity under natural conditions among individuals facing contrasted habitats. Here, we investigated the digestive responses of white-tailed deer (Odocoileus virginianus) to contrasted diets using two related populations. The deer population on Anticosti Island (Québec, Canada) has been introduced in the late 1800’s from a source population from the mainland (Potvin et al. 2000). Following the introduction of approximately 200 individuals, the Anticosti deer population rapidly reached high densities (Potvin et al. 2000). Intense browsing modified vegetation structure, primarily by the eradication of the most palatable deciduous species and by reducing balsam fir (Abies balsamea Mill.) regeneration to the benefit of white spruce (Picea glauca Voss.) (Potvin et al. 2003). Those changes had a great impact on the diet of deer on Anticosti Island, especially during winter. The winter diet has been composed of approximately 70% balsam fir, 20% white spruce and 10% lichens for at least the last 2 or 3 decades (Lefort et al. 2007). This situation is unusual for white-tailed deer because balsam
fir, although present in the winter diet on the mainland, only represents a small percentage of the diet compared to deciduous twigs (Dumont et al. 2005). Ullrey et al. (1968) concluded that balsam fir could not sustain white-tailed deer during winter in Michigan (USA) because of its low apparent digestibility and palatability. Sauvé and Côté (2007) qualified both balsam fir and white spruce as poor nutritional resources for deer on Anticosti Island. However, deer on Anticosti Island have remained at high density, even if individual body size has decreased (Lesage et al. 2001), presumably through a negative feedback loop involving plants-deer interactions (Simard et al. 2008).
Our objective was to assess whether digestive changes in response to the consumption of a coniferous diet may explain, at least in part, the success of white-tailed deer on Anticosti Island. We used two complementary comparative approaches: a morphological description of the digestive tract and in vitro digestibility trials. First, we wanted to determine whether digestive organs of deer on Anticosti Island differed in size and shape compared with deer from the source population on the mainland. We predicted that deer on Anticosti Island should have heavier and/or larger digestive organs than mainland deer to allow higher retention time and larger surface to enhance absorption. Facing higher demands for detoxification, parotid and liver mass should also be heavier for deer on Anticosti Island than for deer from the mainland. Second, because ruminal microbiome efficiency is in part driven by the plants ingested we assessed whether a coniferous diet is associated with higher digestibility of balsam fir and white spruce coniferous browses for introduced deer on Anticosti Island compare to mainland individuals from the source population.
METHODS
Study area
This study took place in two areas: Anticosti Island (49o28’N, 63o00’W; 7 943 km2) located in the Gulf of St.
Lawrence, Québec, Canada and the mainland region (46o59’N, 70o33’W) located in the
Chaudières-Appalaches region, Québec, Canada that cover the Municipalités Régionales de Comté (MRC) of Montmagny, L’Islet, and Bellechasseand was used for the introduction of white-tailed deer on Anticosti Island. This area is in the sugar maple-yellow birch and the balsam fir-yellow birch bioclimatic regions. Mean deer density is evaluated at 1.6 deer /km2 (Huot and Lebel 2012). Vegetation on Anticosti belongs to the eastern balsam
fir-paper birch bioclimatic region, but following heavy browsing from deer, the vegetation is now mainly composed of white spruce, balsam fir, and black spruce (Picea mariana Mill., Britton) (Potvin et al. 2000). Deer density is evaluated at >20 deer /km2 locally (Rochette and Gingras 2007).
20
Collection of digestive tracts from deer harvested by sport hunters
We collected digestive tracks during the 2012 and 2013 deer hunting seasons in collaboration with local hunters. We also collected the digestive tracts of 2 road kill females from the mainland region. Over the two field seasons, we collected digestive tracts from 48 (23 females and 25 males) adult deer (≥ 1.5 years) on Anticosti Island and 53 adult deer (4 females and 49 males) from the mainland population. Sample collection occurred mostly during October on Anticosti Island and in the first 2 weeks of November in the mainland region in both years. For each deer, we weighted the eviscerated body mass (carcass mass without internal organs) to the nearest 1 kg. We estimated age using counts of cementum annuli in incisor teeth (Hamlin et al. 2000).
Anatomy of the digestive tract
Rumen-reticulum, omasum and abomasum
As soon as possible after death, the whole digestive tract and internal organs were removed from the abdominal cavity and either processed immediately or frozen. The rumen-reticulum capacity was determined with two methods: the digesta load and water holding capacity or volume (Ramzinski and Weckerly 2007). We used the two methods because digesta load is known to underestimate the rumen-reticulum capacity and the water holding capacity to overestimate it (Demment 1982). First, the rumen-reticulum was excised from the rest of the digestive tract by removing the mesentery and then ligated at the esophagus and at the reticulo-omasal sphincter to avoid losing digesta (Ramzinski and Weckerly 2007). We used dental floss to sew any cuts at the rumen-reticulum surface. We used the same method as Luna and Weckerly (2013) to determinate rumen-reticulum digesta load consisting in the difference between the mass of the rumen-reticulum with is content (i.e. with digesta particles) and without is content (i.e. emptied) at the nearest 0.1 kg in 2013 only. We determined omasum and abomasum digesta load to the nearest 0.1 g using the same protocol as for the rumen-reticulum also only in 2013.
To measure the rumen-reticulum volume, we ligated the emptied rumen-reticulum at the reticulo-omasal sphincter and poured water through the esophagus opening with a 1 L graduated cylinder (Ramzinski and Weckerly 2007). We recorded the volume of water that can be held by the organ to the nearest 0.1 L. This measurement was done in duplicate or triplicate when possible to assess variability and distension capacity of the organ (Ramzinski and Weckerly 2007). We did not perform a third replicate if we noticed damages to the ruminal mucosa layer. We used the mean value of the two or three replicates to compare deer of both populations.
Omasum laminae
We classified and counted the omasum laminae based on their size: 1st (≥3 cm), 2nd (≥1 and < 3 cm) and 3rd
orders (<1 cm). We measured the central height (projected in the organ lumen) of three randomly chosen lamina of each order to the nearest 0.1 cm. To estimate the omasal laminar surface area (OLSA) we used the equation developed by Lentle et al. (1998):
∑𝑛𝑖=1𝑚𝑖 ∗ ℎ𝑖 (Eq. 1)
where mi corresponds to the number of laminae in each order i, hi is the mean of lamina central height for each
order and n is the number of orders. The correlation reported by Lentle et al. (1998) between empirical measurements and predicted values by the equation (OLSA = 7.996x), where x is the result of Eq. 1, was high (r2 = 0.96).
Ruminal papillae
We cut ± 5 cm2 of rumen wall tissue from five ruminal indicative regions: ventral rumen wall, dorsal rumen
wall, atrium ruminis, caudoventral blindsac, and caudodorsal blindsac (Hofmann et al. 1988). Samples from the caudodorsal blindsac were taken only in 2013. Samples were washed with water to remove digesta particles and kept in 75% alcohol solution. We subsampled 1 cm2 of tissue in the middle of each rumen wall
samples (Fraser 1996). We estimated papillae density under a stereoscopic microscope (10x). We randomly dissected out 10 papillae and measured their central width and length at the nearest 0.1 mm with an eyepiece reticle graduated at 100 µm intervals. Papilla surface area (SA, mm2) was estimated under the assumption of
a flattened shape (SA = 2 x mean length x mean central width). Finally, a surface enlargement factor (SEF) was calculated for each rumen regions using the following equation:
SEF = (papillae density x SA)+ base surface
base surface (Eq. 2)
SEF provides quantitative values of the papillation level of the rumen regions based on how much the absorptive rumen mucosa surface is increased by the papillae compared to an unpapillated region referred as a SEF of 1.0 (Hofmann et al. 1988). We used SEF values to quantify the rumen surface available for absorption processes (Hofmann et al. 1988).
Caecum capacity and hindgut length
22
digesta load and volume of the caecum were determined using the same method previously described for the forestomachs. We estimated the volume of the caecum in triplicate to the nearest 0.1 L. We measured hindgut length on a plane surface to the nearest centimeter as follow: small intestine from the pyloric sphincter to the isocaecal junction, caecum from the ileocaecal junction to its end, and large intestine from the ileocaecal junction to the anus (Weckerly 1989).
Parotid gland and liver
We collected the left parotid from an incision in the left cheek from the ear to the bottom of the maxillary muscle within 24 h of death. Each gland was dissected to remove the lymphoid nod, fat and muscular tissue and weighed to the nearest 0.1 g (Kay 1987). Finally, the liver was weighed to the nearest 1 g.
In vitro true digestibility experiment Browse samples
Eleven browse species; balsam fir, white spruce, eastern larch (Larix laricina K. Koch), white cedar (Thuja
occidentalis L.), red maple (Acer rubrum L.), striped maple (Acer pensylvanicum L.), mountain maple (Acer spicatum Lam.), hobblebush (Viburnum lantanoides Michx.), red osier dogwood (Cornus stolonifera L.), yellow
birch (Betula alleghaniensis Britton.) and white birch (Betula papyrifera Marsh.), were selected because they represented the winter diet of deer from both populations (Dumont et al. 2005; Lefort et al. 2007). We sampled terminal twigs (1 to 5 cm long and average diameter of 4 mm) between 0.5 and 2 meters from the ground in late September 2012 and 2013. In order to mimic the winter conditions faced by deer, we kept only twigs for deciduous species (i.e. leaves were removed when present). Needles were removed for eastern larch but were kept for balsam fir and white spruce. Samples were dried at 50oC for 48 h, and grounded separately with
a centrifuge mill (1 mm particle size, Ultra Centrifugal Mill, Type ZM200, RETSCH). Samples of 0.50 g ± 0.01 were placed in pre-weighted filter bags (F57 ANKOM size 5 cm x 5 cm; pore size 25 µm). We characterized each species for neutral detergent fiber (NDF), acid detergent fiber (ADF) and acid detergent lignin (ADL) contents with an ANKOM Fiber analyser (ANKOM Technology, NY) and calculated dry matter (DM) contents (Appendix 2) (Goering and Van Soest 1970).
Extraction of inocula and in vitro true digestibility determination
Ruminal fluid (i.e. inoculum) was sampled from adult males (≥ 1.5 years) to reduce potential age and/or sex effects on digestibility. Shortly after death (< 1 hour), the digestive tract was closed at the esophagus and pyloric sphincter to prevent gas exchange and deterioration of ruminal microbiome and was kept in a plastic bag placed in hot water during transport. Handling time between the sampling and the beginning of trials varied between 1 and 2.5 hours. Digestion efficiency of dry matter by the inoculum should not have been



![Figure 1. Difference in mean in vitro true digestibility of dry matter (%IVTD DM ) for selected browse species digested for 24 h [top] or 48 h [bottom] with inocula from deer harvested on the mainland (n = 5) or on Anticosti Island (n =](https://thumb-eu.123doks.com/thumbv2/123doknet/6650020.181788/43.918.195.788.119.610/figure-difference-digestibility-selected-digested-harvested-mainland-anticosti.webp)