HAL Id: hal-02798179
https://hal.inrae.fr/hal-02798179
Submitted on 5 Jun 2020HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Agressivité de souches de Sclerotinia sclerotiorum sur
différentes espèces végétales
Océane Laurens
To cite this version:
Océane Laurens. Agressivité de souches de Sclerotinia sclerotiorum sur différentes espèces végétales. [Stage] Institut Universitaire de Technologie d’Avignon (IUT d’Avignon), FRA. 2016, 38 p. �hal-02798179�
Agressivité de souches de Sclerotinia sclerotiorum sur différentes espèces végétales de Océane Laurens est mis à disposition selon les termes de la licence Creative Commons Attribution – Pas d'Utilisation Commerciale - Pas de Modification 4.0 International.
IUT d'Avignon Université d'Avignon et des Pays du
Vaucluse
337 chemin des Meinajaries, BP 1207, 84911 Avignon
cedex 9 +33 (0)4 90 84 14 0
INRA Domaine Saint Maurice Unité de Pathologie Végétale
BP 94 84143 MONTFAVET cedex
Agressivité de souches de Sclerotinia sclerotiorum
sur différentes espèces végétales
Présenté par Océane Laurens
Année 2016
Tutrice : Mme Aline Le Menn
Maître de stage : Mr Marc Bardin
Remerciements
Je tiens à remercier mon maître de stage, Marc Bardin, pour sa patience, sa disponibilité et son écoute tout au long de ce stage. Je suis heureuse d’avoir eu la chance de réaliser ce stage
très intéressant au sein de l’unité de Pathologie Végétale.
Je suis également très reconnaissante envers Claire Troulet qui m’a accompagné tout au long de ce stage au laboratoire et dont j’ai beaucoup apprécié travailler en sa compagnie. Elle m’a
transmise le savoir-faire du nettoyage de boite mais surtout l’organisation du travail et les différentes questions à se poser avant de réaliser une expérience. Merci beaucoup !
Merci à Magali Eygrier pour son aide tout au long de mes expériences et sa bonne humeur au fil des semaines.
Merci à l’équipe des serres pour s’être occupée des nombreux plants utilisés pour ce stage ainsi qu’à Claudine Laurent pour sa présence au niveau administratif avant et pendant mon
stage.
Je souhaite remercier également ma tutrice de stage, Aline Le Menn, pour avoir répondu à mes différentes questions.
Ce stage fut une très belle première expérience dans le monde de la recherche et je remercie toutes les personnes qui ont contribué au bon déroulement de cette expérience.
Sommaire
1. Introduction ... 1
1.1 Organisme d’accueil ... 1
1.2 Impact économique de Sclerotinia sclerotiorum... 2
1.3 Le cycle de vie de Sclerotinia sclerotiorum ... 3
1.4 Interaction hôte-champignon ... 4
1.5 Variabilité de pouvoir pathogène ... 5
1.6 Contexte de l’étude ... 7
1.6.1 Le projet Scleroleg ... 7
1.6.2 Objectifs de l’étude ... 7
2. Matériels et méthodes ... 8
2.1 Matériel ... 8
2.1.1 Souches de Sclerotinia sclerotiorum ... 8
2.1.2 Matériel végétal ... 8
2.2 Test d’agressivité ... 8
2.3 Test de croissance mycélienne et de production des sclérotes ... 10
2.3.1 Test sur milieu PDA ... 10
2.3.2 Effet de l’âge des souches et du milieu de culture sur la croissance mycélienne et la production de sclérotes ... 11
2.5 Analyse de données ... 12
3. Résultats ... 13
3.1 Agressivité de Sclerotinia sclerotiorum sur feuilles/folioles détachées ... 13
3.1.1 Comparaison des différents tests d’agressivité ... 13
3.1.2 Gamme d’agressivité de S. sclerotiorum ... 14
3.1.3 Corrélations entre espèces végétales ... 16
3.1.4 Lien entre l’agressivité des souches et leur hôte de prélèvement ... 18
3.2 Croissance mycélienne et production de sclérotes ... 19
3.2.1 Test de la croissance mycélienne sur PDA ... 19
3.2.2 Test de la production de sclérotes sur PDA ... 20
3.2.3 Effet de l’âge des souches et de la disponibilité en nutriments sur la croissance mycélienne et la production de sclérotes ... 21
Glossaire ... 26 Bibliographie ... 27 Logiciels ... 27 Sites internet ... 27 Revues scientifiques ... 27 Annexe ... 30
1
1. Introduction
1.1 Organisme d’accueil
L’Institut National de Recherche Agronomique est créé en 1946 après la Seconde Guerre Mondiale dans un contexte de pénurie alimentaire, la France voulant devenir auto-suffisante en alimentation. Dans le domaine végétal, l’INRA a permis de relier les sciences et la technologie afin d’améliorer les itinéraires techniques des cultures et a mis en place la sélection génétique variétale. Il s’agit d’un établissement public à caractère scientifique et technologique (EPST), il est sous la double tutelle du ministère chargé de la Recherche et du ministère chargé de l’Agriculture.
L’INRA est représenté en France par différents centres de recherche. Le centre de recherche Provence-Alpes-Côte d’Azur regroupe les sites d’Avignon et de Sophia Antipolis. L’INRA PACA est organisé autour de différents pôles de recherche (INRA, 2012) :
- Le pôle Santé des Plantes s’attache à étudier une large gamme de bioagresseurs afin de limiter les intrants chimiques et améliorer la durabilité de l’agriculture. Des interactions étroites existent avec le pôle Production Horticole Intégrée.
- Le pôle Production Horticole Intégrée travaille sur la production intégrée des cultures, les qualités gustatives et nutritionnelles ainsi que la conservation des produits tout en prenant en compte l’influence de l’environnement et du génotype de la plante.
- Le pôle Adaptation au Changement Global travaille sur l’impact de l’agriculture et du changement climatique sur les différents écosystèmes méditerranéens.
L’unité de recherche Pathologie Végétale située à Montfavet au Domaine Saint-Maurice a pour objectif de contribuer au développement de méthodes de contrôle efficaces et raisonnées des maladies des plantes dans un contexte de production agronomique durable et de haute qualité. Les maladies virales, fongiques et bactériennes des cultures légumières et fruitières méditerranéennes sont étudiées dans différentes équipes et notamment l’équipe Mistral dans laquelle j’ai effectué mon stage. Quatorze chercheurs sont présents sur le site ainsi que 23 techniciens et administratifs accompagnés au fil des années par des doctorants, post-doctorants ou des étudiants. L’unité possède des laboratoires spécialisés en microbiologie et en sérologie permettant d’isoler, préserver et caractériser les microorganismes étudiés. Des laboratoires de biologie moléculaire et de microscopie sont également présents avec des équipements diversifiés comme des microscopes à transmission et à balayage ou des outils permettant d’étudier le génome. De plus, une équipe est responsable des installations expérimentales et notamment des serres où sont réalisés les semis des différentes espèces végétales demandées par les équipes de recherche (INRA PACA, 2015). L’équipe Mistral travaille en ce moment sur différents projets financés par le CasDar (Scléroleg, Sweet) ou par l’Europe (Euclid) qui sont focalisés sur des champignons responsables de maladies sur différentes cultures et provoquant des pertes de récolte et de rendements importants.
2
Sclerotinia sclerotiorum est un des champignons phytopathogènes étudié dans le cadre de ces
projets.
1.2 Impact économique de Sclerotinia sclerotiorum
Les cultures sont régulièrement touchées par un champignon causant la pourriture blanche ou sclérotiniose et provoquant des dégâts de récolte (Figure 1). Le champignon responsable de ces pertes de rendement fait partie de l’embranchement des Ascomycètes, de l’ordre des Hélotiacées, du genre et de l’espèce Sclerotinia sclerotiorum (Lib.) de Bary. Ce champignon ubiquitaire est nécrotrophe, c’est à dire capable de se développer sur son hôte lorsqu’il est mort (Guyon et al., 2014). Plus de 400 espèces végétales sont sensibles à cet organisme nuisible dont des cultures maraichères ou encore des adventices. Les dicotylédones sont touchées mais également les monocotylédones comme la tulipe par exemple (Bolton et al., 2006). Sclerotinia sclerotiorum impacte les cultures de colza par exemple ou une légumineuse comme le soja (Attanayake et al., 2013; Auclair et al., 2004). Le melon, l’endive et le tournesol font aussi partis des nombreuses espèces touchées par ce champignon.
Figure 1 : Observation de la pourriture blanche sur différentes espèces végétales (Butzen, 2008; Lamarque, 2008)
L’impact économique de Sclerotinia sclerotiorum est non négligeable. Sur l’endive, le champignon provoque l’apparition de pourriture. Dans des conditions très humides avec de fortes températures, la partie supérieure du collet est nécrosée. Cela peut provoquer une perte de plus de 32% de la récolte (Benigni and Bompeix, 2010) en plus du coût de triage nécessaire après la récolte pour la mise en vente. Au niveau des cultures de soja, tournesol et colza, la pourriture blanche provoque une perte annuelle de plusieurs centaines de millions de dollars avant et après la récolte (Guyon et al., 2014). En 1999, aux Etats-Unis, les pertes de culture de tournesol ont été évaluées à 100 millions de dollars. Les pertes annuelles peuvent excéder 200 millions de dollars (Bolton et al., 2006).
3
1.3 Le cycle de vie de Sclerotinia sclerotiorum
Sclerotinia sclerotiorum se développe à travers trois étapes distinctes formant un cycle
(Figure 2) : la dormance*, le saprophytisme* et le parasitisme*. Tout d’abord, S. sclerotiorum passe plus de 90% de son temps de vie sous l’état de dormance dans le sol (Adams and Ayers, 1979). La structure de conservation du champignon est le sclérote*. Sclerotinia sclerotiorum est caractérisé par la formation de sclérotes qui sont des amas de mycélium de forme variable avec une écorce noire mélanisée et un centre clair (Bolton et al., 2006; Corbaz, 1990; Messiaen, 1991). Ils permettent au champignon de résister à des conditions défavorables puisqu’ils sont très résistants aux éléments extérieurs (Corbaz, 1990). Les sclérotes matures peuvent survivre de un à cinq ans en fonction de facteurs physiques (température, humidité) et biologiques (dégradation microbienne) (Adams and Ayers, 1979). Leur diamètre est de l’ordre de 3 à 10 millimètres (Ekins et al., 2002).
La phase saprophytique correspond à la germination des sclérotes. Elle peut se réaliser par voie mycélienne ou en donnant une apothécie en forme de trompette. Premièrement, la voie mycélienne conduit à un développement à la surface du sol. La forte concentration en gaz carbonique en profondeur empêche la germination mycélienne des sclérotes mais ils s’y conservent jusqu’à ce qu’ils soient remontés à la surface avec les pratiques culturales. Ainsi la contamination par le mycélium* se retrouve sur les têtes de chou, de céleris et de salades étant donné qu’il se situe au niveau du sol (Messiaen, 1991). La présence d’une source de nutriments exogène et la disponibilité en eau sont indispensables pour l’infection des plantes par le mycélium issu des sclérotes (Abawi and Grogan, 1975; Lumsden, 1979).
Ensuite, la germination par apothécie* est fréquente chez les souches à gros sclérotes localisées à moins de 3 cm de profondeur dans le sol (Abawi and Grogan, 1979; Messiaen, 1991). Le sclérote doit rester en dormance 13 à 108 jours avant de germer pour donner une apothécie en fonction des facteurs environnementaux et physiologiques. L’apothécie se développe à partir du sclérote, un pied se développe contenant des asques* dans lesquels se trouvent des ascospores* (Willetts et al., 1980). Les ascospores sont les spores sexuées de S.
sclerotiorum. Une apothécie peut produire jusqu’à 3.107 ascospores et est fonctionnelle durant cinq à dix jours (Steadman, 1983). Les ascospores sont libérées, vont se disperser sur les feuilles, les gousses, les tiges ou les fruits et cela provoquera des dégâts de récolte importants (Messiaen, 1991). De plus, la dispersion des spores sexuées est accentuée avec l’action des pollinisateurs. Des ascospores ont été détectés sur des grains de pollen au Canada, les abeilles prélèvent les ascospores sur une culture et dispersent la maladie sur les cultures voisines (Corbaz, 1990).
4
Figure 2 : Cycle de développement et symptômes de maladies de légumes et de fleurs causées par Sclerotinia sclerotiorum (Agrios, 2005)
1.4 Interaction hôte-champignon
Sclerotinia sclerotiorum pénètre dans son hôte à l’aide d’un tube germinatif formant
un organe spécialisé, l’appressorium* qui va exercer une pression sur la cuticule (Corbaz, 1990). S. sclerotiorum pénètre également dans son hôte à travers les stomates ouverts sur la surface adaxial des feuilles (Jones, 1976). L’appressorium de S. sclerotiorum est multicellulaire (Lepoivre, 2003). Il se développe suite à un stimulus par contact avec l’hôte et crée une dépression au niveau de la cuticule (Abawi et al., 1975). Il est formé à partir de branches dichotomiques d’hyphes simples (Tariq and Jeffries, 1984) et donne ensuite des structures crochues avec une forme de doigts (Abawi et al., 1975). Un mucilage* vient cimenter l’appressorium à la cuticule de la plante-hôte et facilite la pénétration mécanique de la surface de la plante (Tariq and Jeffries, 1984). Le mucilage permet une meilleure adhérence entre l’hôte et le pathogène (Corbaz, 1990).
Lorsque la cuticule est traversée, une vésicule se forme dans les cellules épidermiques. Les cellules autour de la pénétration semblent être altérées chimiquement (Boyle, 1921). Le champignon synthétise de l’acide oxalique et des enzymes dégradantes qui agissent en synergie. La paroi est attaquée et le pH des tissus contaminés diminue (Attanayake et al., 2013).
L’acide oxalique est une phytotoxine*. La sécrétion d’acide oxalique permet de déméthyler à 93% la pectine des parois en formant un chélate* avec le Calcium des parois. Le pH diminue jusqu’à 4,5 et la polygalacturonase provoque la perte de 82% de l’acide galacturonique* (Corbaz, 1990). Il est supposé que l’acide oxalique intervient pour aider les
5
enzymes agissant à faible pH (Cessna et al., 2000). Elle induit aussi la synthèse de Reactive Oxygen Species* (ROS) chez la plante (Guyon et al., 2014). Ils sont produits par le métabolisme de la plante et jouent un rôle dans le transport d’électrons dans les mitochondries ou dans des réactions enzymatiques par exemple (Bayr, 2005). Les plantes sécrètent les ROS suite à la détection d’un agent pathogène. Durant les premiers stades de l’infection, l’acide oxalique peut éliminer les ROS ce qui réduit la résistance des plantes. En revanche, une fois que la maladie est installée, les ROS peuvent favoriser le développement de S. sclerotiorum (Zhu et al., 2013). Au niveau de la culture de tournesol, il est retrouvé quinze fois plus d’acide oxalique dans les feuilles infectées par S. sclerotiorum que dans des feuilles de plantes saines (Corbaz, 1990).
Des protéines effectrices* sont aussi sécrétées par S. sclerotiorum. La protéine extracellulaire Sclerotinia sclerotiorum integrine-like (SSITL) réprime la résistance de la plante hôte et est sécrétée dans les premiers stades de l’infection (Zhu et al., 2013). La virulence est promue par cette protéine et les réactions de défenses de la plante sont décalées ce qui compromet sa résistance (Guyon et al., 2014). La protéine SSITL a également un effet sur la croissance des hyphes, le développement des sclérotes et la germination (Zhu et al., 2013). Des endo- et exo-enzymes sont sécrétées, elles sont capables de dégrader des polysaccharides cellulosiques, hémi-cellulosiques et pectinolytiques. Les enzymes sécrétées sont responsables de l’agressivité du pathogène (Riou et al., 1991).
1.5 Variabilité de pouvoir pathogène
Une grande variation de pouvoir pathogène a été observée entre souches de Sclerotinia
sclerotiorum (Saharan and Mehta, 2008).
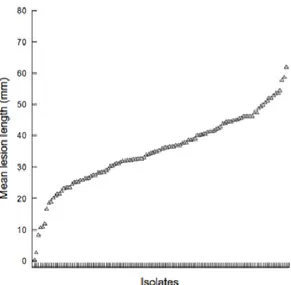
Ekins et al. (2007) ont étudié l’agressivité d’isolats de S. sclerotiorum sur une culture de tournesol. Les isolats les plus agressifs sont capables d’envahir et coloniser l’hôte plus rapidement. Des différences significatives sont trouvées parmi les isolats. Les moyennes des longueurs de lésion sont ordonnées en rang (Figure 3). Seuls quelques isolats sont très agressifs ou peu agressifs mais on remarque globalement un continuum d’agressivité rendant les isolats difficiles à classer en fonction de leur agressivité. Ce classement est rendu d’autant plus difficile que des répétitions du test d’agressivité n’aboutissent pas au même classement excepté pour les isolats les moins agressifs. Ce manque de répétabilité a également été observé par d’autres auteurs sur luzerne (Pratt and Rowe, 1995) ou sur colza (Errampalli and Kohn, 1996). D’autres exemples de variation d’agressivité entre souches de S. sclerotiorum sont présentés dans le tableau 1.
6
Figure 3: Rang ordonné des moyennes des longueurs des lésions de 120 isolats de S.
sclerotiorum sur tournesol (Ekins et al., 2007)
Tableau 1 : exemple d’études du niveau d’agressivité de souches de S. sclerotiorum
Nbr de souches / Espèce végétale
testée
Type d’organe inoculé /
type d’inoculum Résultats
A / Trèfle Feuilles détachées /
plug mycélien
Interaction entre isolats et génotypes des plantes
Effet test (Vleugels et al., 2013)
6 / Soja et haricot
Feuilles détachées Cotylédons Tige coupée / plug mycélien
Différence significative d’agressivité entre isolats sur soja et haricot (Kull et al., 2003)
4 / Colza Pétiole coupé
/ plug mycélien
Pas de différences significatives pour le nombre de jours à faner
Légères différences significatives pour les lésions (Zhao et al., 2004)
66 / Pissenlit Feuilles détachées /
plug mycélien
3 niveaux d’agressivité avec des différences significatives (Riddle et al., 1991)
Des souches hypovirulentes de S. sclerotiorum ont été détectées dans différentes études. L’hypovirulence provoque une réduction de la capacité d’un agent pathogène à infecter, coloniser et tuer son hôte. Elle peut être induite par des mycovirus qui sont des virus de champignons (Pearson et al., 2009). Ils sont révélés par la détection d’acide ribonucléique double-brin comme matériel génétique du champignon (Lemke and Nash, 1974). Le lien entre l’hypovirulence de souches et la présence d’ARN double-brin a été mis en évidence par Boland (1992) sur cinq souches de S. sclerotiorum.
7
Enfin un lien semble exister entre la taille des sclérotes produits par le champignon et son niveau d’agressivité, les isolats les plus agressifs semblant produire les sclérotes les plus petites (Nedeleu et al., 1988).
1.6 Contexte de l’étude
1.6.1 Le projet Scleroleg
En France, le projet Scleroleg est financé par le Compte d’Affectation Spécial au Développement Agricole et Rural (CasDar) et labellisé par le Groupement d’Intérêt Scientifique pour la Protection Intégrée en Cultures Légumières (GIS PICLég). Ce projet a pour but la recherche de nouveaux moyens de lutte contre ce champignon étant donné qu’il n’existe pas encore de traitements chimiques efficaces ni de résistance des plantes à cet organisme (Leyronas et al., 2016). Cette étude se divise en trois axes. Le premier consiste à mieux connaître S. sclerotiorum pour pouvoir améliorer les moyens de protection de la plante. Ensuite, le deuxième axe consiste à développer des techniques pour détecter la présence de l’agent pathogène et évaluer les risques de développement de la maladie. L’objectif de la troisième action est d’optimiser les itinéraires techniques dans la lutte intégrée contre S.
sclerotiorum. Dans ce cadre, la caractérisation de l’agressivité permet de sélectionner des
plantes résistantes et ainsi faciliter le travail des sélectionneurs (PIClég, 2014).
1.6.2 Objectifs de l’étude
La diversité de l’agressivité des différentes souches est testée sur plusieurs espèces végétales afin de vérifier l’hypothèse d’absence de spécialisation parasitaire chez le champignon responsable de la pourriture blanche. Une gamme d’agressivité est réalisée à l’aide d’un test sur feuilles détachées sur différentes espèces végétales afin de comparer l’agressivité des différentes souches de S. sclerotiorum. La croissance mycélienne et la production des sclérotes sont également caractérisées pour vérifier l’hypothèse d’une corrélation entre l’agressivité de S. sclerotiorum sur plante et son développement sur milieu de culture. Enfin l’hypothèse d’un effet de la disponibilité en nutriments des milieux de culture et de l’âge des souches sur le développement et l’agressivité de S. sclerotiorum a été testée.
8
2. Matériels et méthodes
2.1 Matériel
2.1.1 Souches de Sclerotinia sclerotiorum
Les 123 souches de Sclerotinia sclerotiorum utilisées dans cette étude (Annexe) ont été choisies dans notre collection de souches (plus de 2000 souches) sur la base de leur appartenance à des génotypes différents (caractérisés à l’aide de 9 microsatellites) et de leur plante hôte d’origine (6 espèces végétales). Soixante-six des 123 souches ont été caractérisées pour leur agressivité sur tomate, laitue et melon en 2015 (Richet, 2015). Elles ont été intégrées dans l’analyse des résultats.
Ces souches ont originellement été prélevées sur des plantes (103 souches) ou dans l’air (20 souches) dans des parcelles contaminées par la pourriture blanche en France. Les souches prélevées sur plantes contaminées sont originaires des différents hôtes suivants : haricot (21), melon (28), carotte (25), endive (11), laitue (7) ou colza (11). Les sclérotes désinfectés obtenus après cultures monohyphes* des échantillons sont conservés à 4°C, -20°C et -80°C.
2.1.2 Matériel végétal
La tomate, la laitue et le melon sont les trois espèces végétales utilisées lors de cette étude. Les variétés utilisées pour les tests d’agressivité sont Monalbo (tomate), Mantilia (laitue) et Chubaka (melon). Les graines de la variété Chubaka sont produites par le semencier Nunhems. Les graines de tomate et laitue sont produites respectivement par l’unité Pathologie Végétale et par l’unité Génétique et Amélioration des Fruits et Légumes de l’INRA. Les tomates et les laitues sont âgées de 5 semaines lorsque le test d’agressivité est réalisé tandis que les melons ont été semés 4 semaines avant le test.
2.2 Test d’agressivité
L’agressivité de Sclerotinia sclerotiorum est évaluée en déposant un implant mycélien sur une feuille (ou foliole) d’une espèce végétale. La surface de lésion est mesurée et permet de déduire l’indice d’agressivité de chaque souche.
Tout d’abord, les souches de S. sclerotiorum sont repiquées en boites de Petri, 2 jours avant l’inoculation des feuilles, sur un milieu PDA (Potato Dextrose Agar) préparé à partir de 39g de poudre (DIFCO) pesé précisément avec une balance et intégré à 1 litre d’eau permutée. La solution de PDA est homogénéisée à l’aide d’un agitateur puis autoclavée. Un litre de milieu PDA permet de couler 60 boites environ (16 mL par boite de Petri de diamètre 90 mm). A l’aide d’un bec bunsen (Fireboy) et d’un scalpel, un implant de quelques mm² est découpé sur le front de développement mycélien d’une souche dans une boite de Petri puis
9
déposé dans une nouvelle boite de Petri contenant du milieu PDA stérile. Cette étape consiste à repiquer le champignon. Les boites sont ensuite incubées dans une chambre climatique avec 14h de lumière par jour et une température stable de 21°C pendant 48h.
Les feuilles ou folioles sont prélevées sur les plantes et déposées dans des boites cristal contenant un papier absorbant humidifié pour favoriser la croissance de S. sclerotiorum. Pour
la tomate, les folioles terminales des 3ème et 4ème feuilles sont prélevées. En tout, 10 folioles de
tomates sont inoculées par souche testée. Un implant mycélien en croissance active, réalisé à l’aide d’un emporte-pièce de 5 mm de diamètre, est prélevé sur une culture âgée de 2 jours. L’implant mycélien est ensuite déposé sur les feuilles avec un scalpel, côté mycélium en contact direct avec la feuille. Les boites cristal (185x125mm) sont incubées dans la chambre climatique (21°C, 14h de photopériode). Elles sont refermées avec un couvercle comportant une étiquette avec les informations suivantes (Figure 4) :
- Nom de l’espèce végétale
- Nom du test (SA-5-16 par exemple) - Numéro de la souche (SS173 par exemple) - Numéro de boite (1 à 5)
Figure 4 : Boite cristal contenant deux folioles de tomate inoculées avec la souche SS173
La même expérience est réalisée pour la laitue et le melon mais les feuilles sont déposées dans des boites cristal de taille supérieure (250x178mm). Pour la laitue, deux
feuilles de la couronne intermédiaire sont prélevées. Pour le melon, la 2ème et la 3ème feuille
sont prélevées.
Deux jours après l’inoculation des feuilles, les boites cristal sont prises en photo afin de mesurer la surface de lésion sur les feuilles/folioles. La surface de lésion des feuilles a été mesurée à l’aide du logiciel Image J.
Du fait de notre impossibilité de tester l’ensemble des souches en une seule expérience, 12 tests successifs ont été réalisés. Sept souches ont été analysées pour chaque test. La souche de référence SS44 a été répétée pour comparer les différents tests ainsi que
10
pour calculer l’indice d’agressivité des souches. L’ordre d’expérimentation tomate-laitue-melon est respecté pour chacun des 12 tests.
2.3 Test de croissance mycélienne et de production des sclérotes
2.3.1 Test sur milieu PDA
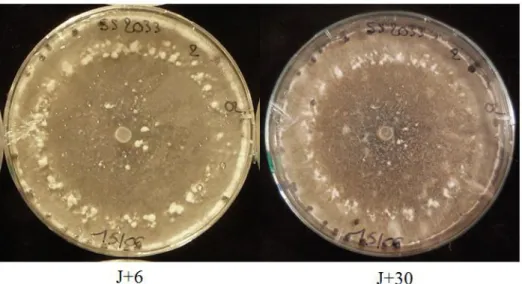
Les souches de S. sclerotiorum sont repiquées deux jours avant l’inoculation dans des boites de Petri contenant un milieu PDA. Les boites utilisées lors du test ont été préparées la semaine précédente afin qu’elles soient récentes et toutes de la même date. Un implant mycélien de 5 mm de diamètre est déposé au centre d’une boite de Petri contenant du milieu PDA, côté mycélium en contact direct avec le milieu. Les boites sont incubées dans la chambre climatique et réparties afin qu’elles aient toutes autant de lumière les unes que les autres. Le diamètre de croissance est mesuré à 1 jour (J+1), 2 jours (J+2) et 3 jours (J+3) après l’inoculation. Deux diamètres sont mesurés par boites, ils sont marqués avec deux marqueurs de couleur différente afin de mesurer les mêmes diamètres chaque jour (Figure 5). Les sclérotes sont ensuite dénombrés à J+6 et J+30 (Figure 6). Trois boites sont réalisées pour chaque souche testée. Les souches ont été réparties en deux tests différents, chaque test étant répété deux fois.
Figure 5 : Boite de Petri contenant un milieu PDA un jour après l’inoculation de S.
11
Figure 6 : Boite de Petri contenant un milieu PDA 6 jours et 30 jours après l’inoculation de
S. sclerotiorum ; comptage des sclérotes
2.3.2 Effet de l’âge des souches et du milieu de culture sur la croissance mycélienne et la production de sclérotes
Sur le même principe, l’effet de l’âge de l’inoculum sur la vitesse de croissance mycélienne a été testé pour 6 souches de S. sclerotiorum. Les souches sont repiquées sur un milieu PDA puis un implant mycélien d’un diamètre de 5 mm est prélevé après deux, trois ou quatre jours d’incubation et déposé sur du milieu PDA, PDA 1/10 ou eau gélosée. Trois répétitions sont réalisées pour chaque souche (Figure 7).
Figure 7 : Schéma du test sur l’influence de l’âge des souches et des milieux de culture
Le milieu PDA 1/10 est préparé à partir de 3,9 g de poudre PDA (DIFCO) et 11,1 g de poudre d’Agar incorporés dans 1L d’eau permutée. L’eau gélosée est composée de 15g de poudre d’Agar incorporés dans 1L d’eau permutée. Les deux solutions sont agitées puis autoclavées avant de les couler dans des boites de Petri à raison de 16mL de milieu par boite.
12
Après l’inoculation, les boites de Petri sont incubées à l’obscurité dans la chambre climatique (21°C). Deux diamètres de croissance sont mesurés le lendemain de l’inoculation (Figure 5) puis la même mesure est réalisée durant les 5 jours suivant l’inoculation. Les sclérotes sont dénombrés 6 et 25 jours après inoculation.
2.5 Analyse de données
A partir des données de surface de lésion sur feuilles, un indice d’agressivité par rapport à la souche de référence SS44 a été calculé de la façon suivante pour chaque espèce végétale testée :
IA = surface de lésion sur feuille/foliole pour une souche de 𝑆. 𝑠𝑐𝑙𝑒𝑟𝑜𝑡𝑖𝑜𝑟𝑢𝑚
moyenne de la surface de lésion de la souche de référence SS44 × 100
Le pourcentage de croissance mycélienne par rapport à la souche de référence SS44 a été calculé selon la formule suivante :
%CM = diamètre moyen mesuré à J + 1 pour une souche de 𝑆. 𝑠𝑐𝑙𝑒𝑟𝑜𝑡𝑖𝑜𝑟𝑢𝑚
diamètre moyen mesuré à J + 1 de la souche de référence SS44 × 100
Le pourcentage de sclérotes produits par rapport à la souche de référence SS44 a été calculé selon la formule suivante :
%sclérotes = nombre de sclérotes à J + 6 pour une souche de 𝑆. 𝑠𝑐𝑙𝑒𝑟𝑜𝑡𝑖𝑜𝑟𝑢𝑚
nombre de sclérotes à J + 6 de la souche de référence SS44 × 100
L’effet des souches de S. sclerotiorum sur leur niveau d’agressivité sur les différentes espèces végétales est testé pour chaque test. La normalité des résidus des données est analysée avec le test de Lilliefors (+ de 40 données) avec un seuil de 5%. L’homogénéité des variances est ensuite étudiée avec le test de Bartlett avec un seuil de 5%. Dans le cas où les résidus des données suivent la loi normale et les variances sont homogènes (p > 0.05), alors un test paramétrique d’analyse de variances à un facteur (Anova 1) est réalisé. Si les hypothèses de normalité des résidus des données et d’homogénéité des variances sont rejetées (p < 0.05) alors le test non paramétrique de Kruskal et Wallis est réalisé. La même démarche est réalisée pour tester l’effet des souches de S. sclerotiorum sur leur croissance mycélienne et sur leur production de sclérotes.
Pour évaluer des liens entre les indices d’agressivité obtenus entre les différentes espèces végétales, des analyses de corrélation ont été réalisées. La normalité des résidus des données est vérifiée comme nous l’avons vu précédemment. Le facteur étant quantitatif, un test de régression est réalisé. Si les résidus des données suivent la loi normale, un test de Pearson est réalisé. Dans le cas contraire, il s’agit du test de Spearman. Le test de régression a également été utilisé pour évaluer le lien entre l’agressivité de S. sclerotiorum et la croissance mycélienne ou la production de sclérotes.
13
Les traitements statistiques ont été réalisés à l’aide du logiciel R version 3.2.5 (R Core Team, 2016). Le package « nortest » a été utilisé pour tester la normalité des résidus des données (Juergen Gross and Uwe Ligges, 2015). Les tableaux et les graphiques ont été conçus avec Excel. La surface de lésion a été mesurée avec Image J (Rasband, 1997).
3. Résultats
3.1 Agressivité de Sclerotinia sclerotiorum sur feuilles/folioles détachées
3.1.1 Comparaison des différents tests d’agressivité
La souche SS44 de S. sclerotiorum a été intégrée dans les 20 tests effectués sur 2 ans dans le cadre de cette étude, soit 8 tests en 2015 et 12 tests en 2016. La présence de cette souche dans chaque test a permis de comparer son niveau d’agressivité sur melon, tomate et laitue en fonction de la date du test. Des différences significatives d’agressivité sont observées selon les tests, et ceci pour les trois espèces végétales (Kruskal et Wallis, p<0.05 ; Tableau 2).
Tableau 2 : Résultats statistiques de la comparaison des tests d’agressivité de SS44
Test de Lilliefors Test de Bartlett Test de Kruskal et Wallis
Tomate D = 0.07 p = 0.014 BK = 42.21 p = 0.002 KW = 158.7 p<2,2.10-16
Laitue D = 0.08 p = 0.005 BK = 61.6 p = 2,1.10-6 KW = 151.5 p<2,2.10-16
Melon D = 0.11 p = 3,53.10-6 BK = 162.6 p<2,2.10-16 KW =146.5 p<2,2.10-16
Sur feuilles de melon il y a par exemple une importante variation de la sensibilité des plantes à SS44 (Figure 8). Des résultats similaires ont été obtenus pour laitue et tomate. Cette observation du manque de répétabilité des tests nous a amené à calculer un indice d’agressivité par rapport à la souche SS44 pour chaque souche, afin de pouvoir comparer toutes les souches.
14
Figure 8 : Histogramme représentant la surface de lésion de SS44 pour chaque test d’agressivité sur melon
3.1.2 Gamme d’agressivité de S. sclerotiorum
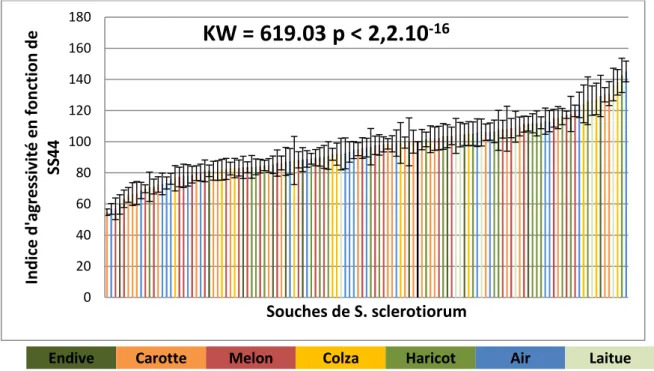
Suite à la mesure des surfaces de lésion sur les feuilles/folioles détachées et au calcul d’un indice d’agressivité par rapport à SS44, il est possible de tracer une gamme d’agressivité avec les 123 souches testées sur chacune des espèces végétales, tomate, laitue et melon (Figure 9, 10 et 11). Les hôtes d’origine des souches sont représentés de différentes couleurs d’après la légende.
Les résidus des données ne suivant pas la loi normale (Lilliefors, p<0.05) et les variances n’étant pas homogènes (Bartlett, p<0.05), un test de Kruskal et Wallis est réalisé afin de tester l’effet des souches sur l’agressivité sur plante.
Sur la tomate les indices d’agressivité des souches de S. sclerotiorum sont significativement différents. Le résultat est le même pour les indices d’agressivité sur laitue et sur melon. Ces observations suggèrent que la diversité de l’agressivité des souches de S.
sclerotiorum, estimée sur feuilles détachées, est importante.
0 500 1000 1500 2000 2500 SA -1-15 SA -2-15 SA -3-15 SA -4-15 SA -5-15 SA -6-15 SA -7-15 SA -8-15 SA -1-16 SA -2-16 SA -3-16 SA -4-16 SA -5-16 SA -6-16 SA -7-16 SA -8-16 SA -9-16 SA -10 -16 SA -11 -16 SA -12 -16 Sur fa ce d e lé si on e n m m ² d e SS 44 su r m el on Tests d'agressivité
15
Endive Carotte Melon Colza Haricot Air Laitue
Figure 9 :Histogramme représentant l’agressivité des 123 souches de S. sclerotiorum sur tomate
Endive Carotte Melon Colza Haricot Air Laitue
Figure 10 :Histogramme représentant l’agressivité des 123 souches de S. sclerotiorum sur laitue 0 20 40 60 80 100 120 140 160 180 In d ice d 'a gr e ssi vit é e n f on ct ion d e SS 44 Souches de S. sclerotiorum
KW = 619.03 p < 2,2.10
-16 0 20 40 60 80 100 120 140 160 180 200 In d ice d 'a gr e ssi vit é e n f on ct ion d e SS 44 Souches de S. sclerotiorumKW = 728.19 p < 2,2.10
-1616
Endive Carotte Melon Colza Haricot Air Laitue
Figure 11 : Histogramme représentant l’agressivité des 123 souches de S. sclerotiorum sur melon
Quelques souches semblent apparaître comme étant significativement plus agressives et d’autres comme significativement moins agressives sur les espèces végétales testées (test post hoc de Bonferroni). La souche SS173 fait par exemple partie des souches les moins agressives sur tomate, laitue et melon et la souche SS121 fait partie des souches les plus agressives sur ces espèces végétales.
3.1.3 Corrélations entre espèces végétales
Afin de vérifier l’hypothèse d’une absence de spécialisation parasitaire chez S.
sclerotiorum, l’agressivité des souches sur une espèce végétale a été mise en relation avec
l’agressivité sur une autre espèce végétale.
Le test de régression non-paramétrique de Spearman a été réalisé puisque les résidus des données ne suivent pas la loi normale (Lilliefors, p<0.05). Les indices d’agressivité sont significativement liés pour les différentes espèces (Spearman, p<0.05 ; Figure 12).
0 20 40 60 80 100 120 140 160 180 200 In d ice d 'a gr e ssi vit é e n f on ct ion d e SS 44 Souches de S. sclerotiorum
KW = 499.88 p < 2,2.10
-1617
Figure 12 : Nuage de points représentant les indices d’agressivité entre espèces végétales (A = tomate – laitue, B = tomate – melon, C = laitue – melon)
0 50 100 150 200 0 50 100 150 200 In di ce d'a gr essi vi té sur la itu e
Indice d'agressivité sur tomate S = 5,3.108 p < 2,2.10-16 r² = 24% A 0 50 100 150 200 0 50 100 150 200 In d ice d 'a gr e ssi vit é su r m el on
Indice d'agressivité sur tomate S = 5,4.108 p < 2,2.10-16 r² = 23% 0 50 100 150 200 0 50 100 150 200 In d ice d 'a gr e ssi vit é su r m el on
Indice d'agressivité sur laitue S = 5,7.108 p = 6,2.10-15 r² = 21% B
18
3.1.4 Lien entre l’agressivité des souches et leur hôte de prélèvement Les indices d’agressivité des espèces végétales ont été testés en fonction de l’hôte de prélèvement des souches avec un test de Kruskal et Wallis puisque les résidus des données ne suivent pas la loi normale et les variances ne sont pas homogènes (Lilliefors, Bartlett, p<0.05).
Les indices d’agressivité sont significativement différents en fonction des hôtes de prélèvement pour la laitue et la tomate (Kruskal et Wallis, p<0.05 ; Figure 13). Ces données suggèrent que sur melon, il n’y a pas d’évidence de spécialisation parasitaire. Sur tomate et laitue, les souches provenant de laitue apparaissent sensiblement plus agressives que celles provenant des autres hôtes avec dans certains cas des différences significatives. Cependant, le nombre de souches testées doit être pris en compte puisque seulement 7 souches de laitue ont pu être analysées tandis que 28 souches de melon ont été analysées par exemple.
Figure 13 : Indice d’agressivité des espèces végétales testées en fonction de l’hôte de prélèvement des souches de S. sclerotiorum (A = tomate, B = laitue, C = melon) ; Le nombre
19
3.2 Croissance mycélienne et production de sclérotes
3.2.1 Test de la croissance mycélienne sur PDA
Le mycélium est la forme de propagation du champignon dans la plante, c’est pourquoi nous avons voulu tester l’hypothèse d’un lien entre l’agressivité de S. sclerotiorum et le développement mycélien du champignon sur un milieu de culture riche (PDA).
Tout d’abord, nous allons analyser la croissance mycélienne en fonction des souches de S. sclerotiorum. Les résidus des données ne suivent pas la loi normale (Lilliefors, D = 0.04,
p = 2.8.10-5) et les variances ne sont pas homogènes (Bartlett, BK = 565, p < 2,2.10-16). Le
pourcentage de croissance mycélienne est significativement différent en fonction des souches
de S. sclerotiorum (Kruskal et Wallis, K-W = 587.8, p < 2,2.10-16 ; Figure 14).
Figure 14 : Histogramme représentant la croissance mycélienne des 123 souches de S.
sclerotiorum sur milieu de culture PDA un jour après l’inoculation
L’hypothèse d’une corrélation entre les indices d’agressivité des souches de S.
sclerotiorum sur chaque espèce végétale et les pourcentages de croissance mycélienne a été
testée. Les résultats des tests statistiques démontrent qu’il n’y a pas de lien entre l’agressivité des souches de S. sclerotiorum et la croissance mycélienne de ces mêmes souches (Pearson, p>0.05 ; Tableau 3). 0 20 40 60 80 100 120 % d e cr oi ssanc e m ycéli e n n e e n fon ct ion d e SS 44 Souches de S. sclerotiorum
20
Tableau 3 : Résultats statistiques du test des indices d’agressivité de S. sclerotiorum en fonction du pourcentage de croissance mycélienne
Test de Lilliefors Test de Pearson
Tomate D = 0.07 p = 0.16 F = 1.33 p = 0.25 r² = 0.3%
Laitue D = 0.08 p = 0.08 F = 0.8 p = 0.37 r² = - 0.2%
Melon D = 0.08 p = 0.1 F = 2.39 p = 0.12 r² = 1.2%
3.2.2 Test de la production de sclérotes sur PDA
Les sclérotes sont les structures de conservation de S. sclerotiorum. Lors des tests de croissance mycélienne, les sclérotes ont été dénombrés (Figure 14) afin de vérifier l’hypothèse d’un lien entre la capacité de conservation de S. sclerotiorum et son développement mycélien.
La production de sclérotes des souches de S. sclerotiorum a été analysée avec un test de Kruskal et Wallis puisque les résidus des données ne suivent pas la loi normale (Lilliefors,
D = 0.11, p < 2,2.10-16) et les variances ne sont pas homogènes (Bartlett, BK = Inf, p < 2,2.10
-16
). La production de sclérotes est significativement différente en fonction des souches de S.
sclerotiorum (Kruskal et Wallis, KW = 308.2, p < 2,2.10-16 ; Figure 15).
Endive Carotte Melon Colza Haricot
Figure 15 : Histogramme représentant la production de sclérotes des 123 souches de S.
sclerotiorum sur milieu PDA à 6 jours après inoculation
Le lien entre le nombre de sclérotes 6 jours après l’inoculation et le diamètre mycélien mesuré un jour après l’inoculation a été testé avec un test de Spearman puisque la normalité
des données n’est pas vérifiée (Lilliefors, D = 0.1, p = 8,4.10-15
). Un lien significatif est
0 50 100 150 200 250 % d e p rod u ct ion d e scl é rot e s e n fon ct ion d e SS 44 Souches de S. sclerotiorum
21
observé entre le nombre de sclérotes et le développement mycélien de S. sclerotiorum
(Spearman, S = 2,5.107, p = 5,57.10-6, r² = 18%).
La production de sclérotes n’est par contre pas significativement liée à l’agressivité des souches (Pearson, Spearman, p>0.05 ; Tableau 4). Comme pour le développement mycélien, il n’y pas de lien entre la production de sclérotes à 6 jours du champignon et son agressivité sur plante.
Tableau 4 : Résultats statistiques du test de régression de l’indice d’agressivité en fonction du pourcentage de production de sclérotes de S. sclerotiorum
Test de Lilliefors Régression
Tomate D = 0.05 p = 0.8 Pearson, F = 0.11 p = 0.74 r² = - 0.8%
Laitue D = 0.09 p = 0.03 Spearman, S = 250550 p = 0.46 r² = 7%
Melon D = 0.07 p = 0.23 Pearson, F = 0.01 p = 0.91 r² = - 0.8%
3.2.3 Effet de l’âge des souches et de la disponibilité en nutriments sur la croissance mycélienne et la production de sclérotes
Six souches de S. sclerotiorum ont été inoculées sur différents milieux de culture à différents jours d’intervalle. Le milieu PDA est un milieu de culture riche en nutriments tandis que le milieu PDA 1/10 et l’eau gélosée sont moins riches en nutriments.
Tout d’abord, l’effet du milieu de culture sur le diamètre mycélien mesuré un jour après l’inoculation en mm est testé avec le test non-paramétrique de Kruskal et Wallis puisque les résidus des données ne suivent pas la loi normale (Lilliefors, p<0.05) et les variances ne sont pas homogènes (Bartlett, p<0.05). Les diamètres de croissance sont significativement différents selon les milieux de culture (Kruskal et Wallis, p<0.05). Au plus le milieu est pauvre, au plus le diamètre de croissance des 6 souches de S. sclerotiorum est faible.
Ensuite, l’effet de l’âge des souches sur la croissance mycélienne est analysé avec un test de Kruskal et Wallis. Les résidus des données ne suivent pas la loi normale (Lilliefors, p<0.05) et les variances ne sont pas homogènes (Bartlett, p<0.05).
Le diamètre de croissance un jour après l’inoculation est significativement différent selon l’âge des souches lors de l’inoculation (Kruskal et Wallis, p<0.05). Cependant, la différence de vitesse s’accentue lorsque le milieu de culture s’appauvrit en nutriment. Sur milieu pauvre, plus les souches sont âgées lors de l’inoculation, plus la vitesse de croissance est faible (Figure 16).
22
Figure 16 : Histogrammes représentant les diamètres de croissance mycélienne un jour après l’inoculation en fonction de l’âge des souches sur milieu PDA (A), PDA 1/10 (B) et eau
gélosée (C)
Enfin, l’effet de l’âge des souches sur la production de sclérotes est testé avec un test de Kruskal et Wallis ainsi qu’une analyse de variance à 1 facteur (Anova 1) pour les sclérotes produites sur PDA puisque les résidus des données suivent la loi normale (Lilliefors, p>0.05) et les variances sont homogènes (Bartlett, p>0.05).
La production de sclérotes à 25 jours n’est significativement pas différente selon l’âge des souches. Nous pouvons voir sur le graphique que l’erreur standard est assez importante ce qui peut expliquer l’absence de différences significatives (Figure 17).
23
Figure 17 : Histogrammes représentant la production de sclérotes 25 jours après l’inoculation en fonction de l’âge des souches sur milieu PDA (A), PDA 1/10 (B) et eau
24
4. Discussion
Des différences significatives d’agressivité sont mises en évidence entre souches de S.
sclerotiorum sur les 3 espèces végétales, melon, laitue et tomate, confirmant ainsi une
diversité d’agressivité de cette espèce sur plante. Cependant, une grande partie des 123 souches testées n’ont pas une agressivité significativement différente les unes des autres. En testant l’agressivité de 120 souches de S. sclerotiorum sur tige de tournesol, Ekins et al. (2007) ont également montré que les souches sont difficiles à classer en fonction de leur agressivité. De même, sur 140 souches de S. sclerotiorum originaire du Canada aucun groupe distinctif n’est apparu sur la base de leur pathogénicité sur colza (Morrall et al., 1972). Ces résultats sont cohérents avec le fait qu’en dehors de quelques souches au comportement extrême (très agressives ou peu agressives), la plupart des souches présente un niveau d’agressivité très proche. Ceci est corroboré par le fait que le classement des souches n’est pas forcément très fiable car un manque de répétabilité est observé sur nos différents tests (voir par exemple le cas de l’agressivité de la souche SS44 en fonction des répétitions du test). De même, Ekins et al. (2007) ont montré que des répétitions du test d’agressivité sur tournesol n’aboutissent pas au même classement excepté pour les isolats les moins agressifs. Ce manque de répétabilité a également été observé par d’autres auteurs sur luzerne (Pratt and Rowe, 1995) ou sur colza (Errampalli and Kohn, 1996). Afin d’éviter un effet test, il serait nécessaire de tester toutes les souches au même moment mais tester 123 souches en un seul test est difficile à réaliser techniquement.
En dehors de la majorité des souches dont le niveau d’agressivité est proche, quelques souches présentent des différences d’agressivité significatives entre elles. Ainsi la souche SS121 fait partie des souches significativement les plus agressives sur tomate, laitue et melon. La souche SS173, quant à elle, fait partie des souches significativement moins agressives sur les trois espèces végétales. De même, des différences d’agressivité importantes ont été mises en évidence par Kull et al. (2003) pour 6 souches de S. sclerotiorum sur feuilles détachées de soja et haricot quel que soit la méthode d’inoculation utilisée (tige coupée, inoculation des cotylédons).
Dans cette étude nous avons montré que l’âge des souches a un effet significatif sur la croissance mycélienne et que dans ce cas il y a un lien entre croissance mycélienne et agressivité des souches de S. sclerotiorum sur plante (Richet, 2015). De la même façon, en étudiant 4 souches de S. sclerotiorum Vleugels et al. (2013) ont mis en évidence une corrélation entre la croissance mycélienne sur PDA et l’agressivité sur feuilles détachées. Une étude de 120 souches souligne une corrélation positive entre la croissance mycélienne et l’agressivité des souches sur pétioles de céleri (Durman et al., 2003). Ces résultats vont dans le sens que plus une souche se développe vite, plus elle est agressive sur plante. Cependant quand on considère les 123 souches testées dans cette étude, nous n’avons pas mis en
évidence de lien entre leur agressivité sur plantes et leur développement mycélien sur PDA.
Notre observation peut en partie s’expliquer par le fait que la majorité des souches présentent une croissance mycélienne proche les unes des autres. Un nouveau test de croissance mycélienne sur un milieu plus pauvre en nutriments pourrait permettre de mieux différencier
25
les souches pour leur développement mycélien. La composition du milieu de culture, et particulièrement la richesse en nutriment, a en effet une influence notable sur la vitesse de croissance mycélienne chez S. sclerotiorum.
Les souches étudiées présentent une agressivité équivalente sur les différentes espèces végétales testées. Les souches ne sont pas plus agressives sur les espèces végétales correspondant à leur hôte de prélèvement suggérant que l’agressivité des souches de S.
sclerotiorum n’est pas corrélée à leur hôte d’origine. Ce résultat va dans le sens d’une absence
de spécialisation parasitaire chez cette espèce fongique. Cette observation avait déjà été faite pour 120 souches de S. sclerotiorum testées sur tournesol (Ekins, 1999). Cependant, dans une autre étude réalisée avec 120 souches (Durman et al., 2003), il a été démontré que des souches isolées de plants de tournesol contaminés par la pourriture blanche étaient plus agressives sur tournesol que des souches originaires de plants contaminés de soja. Les auteurs suggèrent une sélection des souches par la plante hôte.
Cette étude menée dans le cadre du projet Scleroleg a permis de mieux connaître le spectre d’agressivité de S. sclerotiorum sur 3 espèces végétales. Dans le cadre de ce projet, les mêmes souches vont être évaluées par les autres partenaires pour leur niveau d’agressivité sur d’autres espèces végétales (carotte, colza, haricot, endive). Nous aurons alors plus d’éléments pour répondre à la question de l’absence de spécialisation parasitaire chez cette espèce de champignon.
Pour la suite, des moyens de protection des plantes contre S. sclerotiorum seront à développer et des itinéraires techniques seront à adapter pour lutter durablement contre ce champignon pathogène.
26
Glossaire
Acide galacturonique : constituant de la pectine responsable de la rigidité des parois. Apothécie : appareil producteur d'ascospores en forme de coupe chez les Ascomycètes Appressorium : structure ramifiée à l’extrémité d’un hyphe permettant un accroissement de
la surface d’échanges avec l’organisme hôte
Ascospore : spores issue de la reproduction sexuée des Ascomycètes, émises dans
l'atmosphère lors de légères fluctuations d'humidité relative provoquant une déchirure de l'extrémité supérieure des asques. Les asques en dénombrent huit.
Asque : organe contenant les ascospores
Chélation : processus physico-chimique conduisant à la formation d’une liaison entre un
ligand et un cation.
Dormance : arrêt momentané du développement d’un organisme
Monohyphe : un seul hyphe est repiqué afin d’avoir une colonie clonale et pure
Mucilage : substance composée de glucides qui gonfle au contact de l’eau et forme une
solution visqueuse
Mycélium : partie végétative des champignons
Parasitisme : vie d’un être vivant qui subsiste aux dépens d’un autre
Phytotoxine : molécule non-enzymatique qui perturbe le métabolisme ou détruit des
structures cellulaires
Protéine effectrice : protéine membranaire produite par l’agent pathogène reconnue par un
récepteur de la plante et qui participe aux voies de transduction des signaux aboutissant à l’induction des mécanismes de résistance de la plante.
Reactive Oxygen Species : espèces chimiques de l’oxygène comportant deux radicaux
d’oxygène comme le superoxide ou l’hydroxyle, connues pour jouer un rôle double chez la plante, à la fois délétère et bénéfique
Saprophytisme : mode de vie d’un saprophyte qui se nourrit de matière organique non
vivante.
Sclérote : amas de mycélium compact entouré d’une couche externe mélaninée. C’est la
forme de conservation hivernale de certains champignons et de Sclerotinia sclerotiorum en particulier.
27
Bibliographie
Logiciels
Juergen Gross and Uwe Ligges (2015). Nortest: Tests for Normality. R Package version 1.0-4. https://CRAN.R-project.org/package=nortest
Rasband, W.S., ImageJ, U. S. National Institutes of Health, Bethesda, Maryland, USA, http://imagej.nih.gov/ij/, 1997-2016.
R Core Team (2016). R: A language and environment for statistical computing. R Foundation for Statistical Computing, Vienna, Austria. URL https://www.R-project.org/.
Sites internet
INRA, 2012. INRA Paca [WWW Document]. URL http://www.paca.inra.fr/ (accessed 5.6.16).
Lamarque, C., 2008. Sclerotinia sclerotiorum (Lib.) de Bary x Tournesol [WWW Document]. Hypermedia En Prot. Plantes - Inra.
URL http://www7.inra.fr/hyp3/pathogene/3sclsc5.htm (accessed 3.28.16).
Leyronas, C., Bardin, M., Duffaud, M., Nicot, P.C., Troulet, C., Villeneuve, F., 2016. Sclérolég, un projet à l’interface entre le labo et le terrain [WWW Document]. URL https://www6.rennes.inra.fr/formation-rennes_eng/rubenglish
/refimageenglish/SCLEROLEG-un-projet-a-l-interface-entre-le-labo-et-le-terrain (accessed 3.11.16).
PIClég, G.I.S., 2014. Sclérolég [WWW Document]. URL https://www.picleg.fr/Les-Projets-en-cours/Scleroleg (accessed 3.11.16).
Revues scientifiques
Abawi, G.S., Grogan, R.G., 1975. Source of Primary Inoculum and Effects of Temperature and Moisture on Infection of Beans by Whetzelinia sclerotiorum. Phytopathology 65, 300. doi:10.1094/Phyto-65-300
Abawi, G.S., Polach, F.J., Molin, W.T., 1975. Infection of Bean by Ascospores of Whetzelinia
sclerotiorum. Phytopathology 65, 673–678. doi:10.1094/Phyto-65-673
Abawi, G.S., Grogan, R.G., 1979. Epidemiology of Diseases Caused by Sclerotinia Species. Phytopathology 69, 899. doi:10.1094/Phyto-69-899
Adams, P.B., Ayers, W.A., 1979. Ecology of Sclerotinia Species. Phytopathology 69, 896. doi:10.1094/Phyto-69-896
Agrios, G.N., 2005. Chapter eleven - Plant diseases caused by Fungi, in: Plant Pathology (Fifth Edition). Academic Press, San Diego, 385–614.
Attanayake, R.N., Carter, P., Jiang, D., Del Río-Mendoza, L., Chen, W., 2013. Sclerotinia
sclerotiorum populations infecting canola from China and the United States are
genetically and phenotypically distinct. Phytopathology 103, 750–761.
28
Auclair, J., Boland, G.J., Kohn, L.M., Rajcan, I., 2004. Genetic interactions betwenn Glycine max and Sclerotinia sclerotiorum using a straw inoculation method. Plant. Dis. 891– 895.
Bayr, H., 2005. Reactive oxygen species: Crit. Care Med. 33, S498–S501. doi:10.1097/01.CCM.0000186787.64500.12
Benigni, M., Bompeix, G., 2010. Chemical and biological control of Sclerotinia sclerotiorum in witloof chicory culture. Pest Manag. Sci. 66, 1332–1336. doi:10.1002/ps.2019 Boland, G.J., 1992. Hypovirulence and double-stranded RNA in Sclerotinia sclerotiorum.
Can. J. Plant Pathol. 14, 10–17. doi:10.1080/07060669209500900
Bolton, M.D., Thomma, B.P.H.J., Nelson, B.D., 2006. Sclerotinia sclerotiorum (Lib.) de Bary: biology and molecular traits of a cosmopolitan pathogen. Mol. Plant Pathol. 7, 1–16. doi:10.1111/j.1364-3703.2005.00316.x
Boyle, C., 1921. VI. Infection by Sclerotinia libertiana, in: Studies in the Physiology of Parasitism. London, pp. 337–347.
Butzen, S., 2008. Gérer la pourriture sclérotique du soja. Sciences Agronomiques Pioneer, Vision cultures 18.
Cessna, S.G., Sears, V.E., Dickman, M.B., Low, P.S., 2000. Oxalic Acid, a Pathogenicity Factor for Sclerotinia sclerotiorum, Suppresses the Oxidative Burst of the Host Plant. Plant Cell 12, 2191–2199. doi:10.1105/tpc.12.11.2191
Corbaz, R., 1990. Principes de phytopathologie et de lutte contre les maladies des plantes. PPUR presses polytechniques.
Durman, S.B., Menéndez, A.B., Godeas, A.M., 2003. Mycelial compatibility groups in Buenos Aires field populations of Sclerotinia sclerotiorum (Sclerotiniaceae). Aust. J. Bot. 51, 421–427.
Ekins, M.G., 1999. Genetic Diversity in Sclerotinia species. University of Queensland, Brisbane, Australia.
Ekins, M.G., Aitken, E. a. B., Goulter, K.C., 2002. Carpogenic germination of Sclerotinia
minor and potential distribution in Australia. Australas. Plant Pathol. 31, 259–265.
doi:10.1071/AP02022
Ekins, M.G., Aitken, E.A.B., Goulter, K.C., 2007. Aggressiveness among isolates of
Sclerotinia sclerotiorum from sunflower. Australas. Plant Pathol. 36, 580.
doi:10.1071/AP07062
Errampalli, D., Kohn, L.M., 1996. Electrophoretic Karyotypes of Sclerotinia sclerotiorum. Appl. Environ. Microbiol. 62, 4247–4251.
Guyon, K., Balagué, C., Roby, D., Raffaele, S., 2014. Secretome analysis reveals effector candidates associated with broad host range necrotrophy in the fungal plant pathogen
Sclerotinia sclerotiorum. BMC Genomics 15, 336. doi:10.1186/1471-2164-15-336
INRA PACA, 2015. Unité de Recherche Pathologie Végétale.
Jones, D., 1976. Infection of plant tissue by Sclerotinia sclerotiorum: a scanning electron microscope study. Micron 1969 7, 275–279. doi:10.1016/0047-7206(76)90029-7 Kull, L.S., Vuong, T.D., Powers, K.S., Eskridge, K.M., Steadman, J.R., Hartman, G.L., 2003.
Evaluation of Resistance Screening Methods for Sclerotinia Stem Rot of Soybean and Dry Bean. Plant Dis. 87, 1471–1476. doi:10.1094/PDIS.2003.87.12.1471
Lemke, P.A., Nash, C.H., 1974. Fungal viruses. Bacteriol. Rev. 38, 29–56.
Lepoivre, P., 2003. Phytopathologie: Bases moléculaires et biologiques des pathosystèmes et fondements des stratégies de lutte. De Boeck Supérieur.
Lumsden, R.D., 1979. Histology and physiology of pathogenesis in plant diseases caused by
Sclerotinia species. Phytopathology 69, 890. doi:10.1094/Phyto-69-890
29
Morrall, R.A.A., Duczek, L.J., Sheard, J.W., 1972. Variations and correlations within and between morphology, pathogenicity, and pectolytic enzyme activity in Sclerotinia from Saskatchewan. Can. J. Bot. 50, 767–786. doi:10.1139/b72-095
Nedeleu, L., Alexandri, A.A., Baicu, T., 1988. Pathogenicity of some isolates of Sclerotinia
sclerotiorum and their behaviour towards some fungicides. Probl. Prot. Plantelor 16,
267–274.
Pearson, M.N., Beever, R.E., Boine, B., Arthur, K., 2009. Mycoviruses of filamentous fungi and their relevance to plant pathology. Mol. Plant Pathol. 10, 115–128. doi:10.1111/j.1364-3703.2008.00503.x
Pratt, R.G., Rowe, D.E., 1995. Comparative pathogenicity of isolates of Sclerotinia
trifoliorum and S. sclerotiorum on alfalfa cultivars. Plant Dis. 79, 474–477.
Richet, C., 2015. Diversité de l’agressivité de Sclerotinia sclerotiorum sur plantes maraichères. Institut Universitaire de Technologie d’Avignon Université d’Avignon et des Pays de Vaucluse, INRA, UR 0407 PV Pathologie Végétale. Centre de Recherche PACA, Montfavet, France.
Riddle, G.E., Burpee, L.L., Boland, G.J., 1991. Virulence of Sclerotinia sclerotiorum and S.
minor on Dandelion (Taraxacum officinale). Weed Sci. 39, 109–118.
Riou, C., Freyssinet, G., Fevre, M., 1991. Production of Cell Wall-Degrading Enzymes by the Phytopathogenic Fungus Sclerotinia sclerotiorum. Appl. Environ. Microbiol. 57, 1478–1484.
Saharan, G.S., Mehta, N., 2008. Sclerotinia diseases of Crop Plants : Biology, Ecology and Disease Management, Springer science + Business Media B. V. ed.
Steadman, J.R., 1983. White Mold - A Serious Yield-Limiting Disease of Bean. Plant Dis. 67, 346–350. doi:10.1094/PD-67-346
Tariq, V.N., Jeffries, P., 1984. Appressorium formation by Sclerotinia sclerotiorum: Scanning electron microscopy. Trans. Br. Mycol. Soc. 82, 645–651. doi:10.1016/S0007-1536(84)80105-9
Vleugels, T., Baert, J., van Bockstaele, E., 2013. Morphological and Pathogenic Characterization of Genetically Diverse Sclerotinia Isolates from European Red
Clover Crops (Trifolium Pratense L.). J. Phytopathol. 161, 254–262.
doi:10.1111/jph.12056
Willetts, H.J., Wong, J.A.-L., Kirst, G.D., 1980. The biology of Sclerotinia sclerotiorum, S.
trifoliorum, and S. minor with emphasis on specific nomenclature. Bot. Rev. 46, 101–
165.
Zhao, J., Peltier, A.J., Meng, J., Osborn, T.C., Grau, C.R., 2004. Evaluation of Sclerotinia stem rot resistance in oilseed Brassica napus using a petiole inoculation technique under greenhouse conditions. Plant Dis. 88, 1033–1039.
Zhu, W., Wei, W., Fu, Y., Cheng, J., Xie, J., Li, G., Yi, X., Kang, Z., Dickman, M.B., Jiang, D., 2013. A Secretory Protein of Necrotrophic Fungus Sclerotinia sclerotiorum That Suppresses Host Resistance. Plos One 8, doi:10.1371/journal.pone.0053901
30
Annexe
Tableau récapitulatif des 123 souches de Sclerotinia sclerotiorum étudiées
Souches Hôte de
prélèvement Lieu de prélèvement Dépt
Date de prélèvement
1 Laitue MONTFAVET 84 non communiqué
2 Laitue MONTFAVET 84 novembre 2012
3 Laitue MONTFAVET 84 décembre 2012
4 Laitue MONTFAVET 84 décembre 2012
5 Laitue MONTFAVET 84 décembre 2012
6 Laitue MONTFAVET 84 janvier 2013
7 Laitue ALENYA 66 novembre 2013
10 Haricot LE TREVOUX 29 septembre 2011
15 Haricot MENEAC 29 septembre 2011
17 Haricot RIEC SUR BELON 29 septembre 2011
22 Carotte ST JEAN BREVELAY 29 juillet 2012
23 Haricot RIEC SUR BELON 29 septembre 2012
24 Haricot LAUZACH 29 septembre 2012
25 Haricot MENEAC 29 septembre 2012
26 Haricot QUESTEMBERT 29 octobre 2012
28 Haricot PLESCOP 29 septembre 2012
29 Haricot NOSTANG 29 septembre 2012
30 Haricot ARZANO 29 septembre 2012
31 Haricot MELLAC 29 septembre 2012
33 Haricot MELGVEN 29 septembre 2012
34 Haricot PONT SCORFF 29 septembre 2012
35 Haricot MELGVEN 29 septembre 2012
36 Haricot MELGVEN 29 septembre 2013
37 Haricot MELLAC 29 septembre 2013
40 Haricot LUXEY 40 septembre 2012
41 Haricot UZEIN 40 octobre 2012
44 Melon ST GERVAIS LES TROIS
CLOCHERS 86 juillet 2012
45 Melon LA POLKA 86 juillet 2012
46 Colza MORHANGE 57 2003 47 Colza CHAMBON 17 2003 48 Colza CIVRAY 18 2007 50 Colza LE PIN 82 2003 51 Colza SPOY 21 2007 54 Carotte GPS 40 février 2014
31 56 Carotte GPS 40 décembre 2013 58 Endive ROMESCAMPS 60 2012 59 Endive VIRONCHAUX 80 2012 60 Endive WICRES 59 2013 61 Endive GAVRELLE 62 2012 62 Endive BOURSIES 59 2013
63 Endive HERENT Belgique 2001
64 Endive ARRAS 62 2001
65 Endive FINS 80 2011
66 Endive BOURSIES 59 2012
70 Melon SAINTES 17 juin 2014
73 Melon MONTAUBAN 82 juin 2014
75 Melon MONTAUBAN 82 juin 2014
79 Melon SAINTES 17 2014 80 Melon SAINTES 17 2014 82 Melon SAINTES 17 2014 83 Melon SAINTES 17 2014 86 Melon SAINTES 17 2014 88 Melon SAINTES 17 2014 90 Melon SAINTES 17 2014 93 Melon SAINTES 17 2014 95 Melon SAINTES 17 2014 102 Melon SAINTES 17 2014 103 Melon SAINTES 17 2014 106 Melon SAINTES 17 2014 109 Melon SAINTES 17 2014 120 Colza FRANXAULT 21 2014 121 Colza ST ANTOINE 47 2014 123 Colza YEBLES 77 2014
125 Colza TERTRE ST DENIS 78 2014
138 Colza GRISY SUR SEINE 77 2014
147 Air (melon) SAINTES 17 mai 2014
158 Air (melon) SAINTES 17 mai 2014
161 Melon SAINTES 17 juin 2014
162 Melon SAINTES 17 juin 2014
166 Air (melon) SAINTES 17 mai 2014
170 Melon SUD-OUEST 81 2014
172 Melon MONTAUBAN 82 septembre 2014