Impact des acides gras oméga-3 sur les désordres
métaboliques associés à l’obésité : rôle potentiel du
microbiote intestinal
Mémoire
Noëmie DANIEL
Maîtrise en nutrition
Maître ès Sciences (M.Sc.)
Québec, Canada
© Noëmie DANIEL, 2015
iii
Résumé
L’obésité et ses complications métaboliques dont notamment la stéatose hépatique non alcoolique, sont principalement attribuables à des facteurs environnementaux, parmi lesquels la diète joue un rôle majeur. Il est donc justifié pour les scientifiques de s’intéresser à l’effet des aliments sur cette pathologie, à commencer par les acides gras oméga-3 dont les effets bénéfiques sur la santé métabolique ont été démontrés. La découverte récente du rôle du microbiote intestinal et de ses interactions, non seulement avec les nutriments mais également avec les fonctions métaboliques de l’hôte, ouvre un nouveau champ de recherche. L’étude proposée dans ce mémoire avait pour but de déterminer le lien entre l’obésité, le microbiote intestinal et les acides gras oméga-3. Les résultats démontrent que certains des effets bénéfiques attribués aux acides gras oméga-3 sont dépendants du passage de ces acides gras dans la lumière du tube digestif. La prévention de l’accumulation des triglycérides hépatiques est en effet seulement induite lorsque les acides gras oméga-3 transitent par l’intestin, tandis que leur seule présence au niveau tissulaire est insuffisante pour provoquer ces effets. De même, le passage des acides gras oméga-3 par le tube digestif est associé avec une augmentation de la masse du caecum, ce qui suggère également une implication de la flore intestinale, mais qui demeure toutefois à confirmer par des analyses métagénomiques.
v
Table des matières
Résumé ... iii
Table des matières ... v
Liste des figures ... vii
Liste des abréviations et des sigles ... ix
Remerciements ... xiii
Avant-Propos ... xv
Chapitre I - Introduction ... 1
1. Obésité et stéatose hépatique non alcoolique ... 1
1.1. Données épidémiologiques relatives à l’obésité ... 1
1.2. La stéatose hépatique non alcoolique et le syndrome métabolique ... 3
2. Le microbiote intestinal ... 4 2.1. Au commencement ... 4 2.2. Caractérisation ... 5 2.3. Le modèle axénique ... 7 2.4. Facteurs influents ... 8 2.5. L’intestin ... 9
2.6. Les interactions entre microbiote et alimentation ... 11
3. Les acides gras oméga-3 ... 15
3.1. Description, apports et sources ... 15
3.2. Biodisponibilité ... 16
3.3. Ratio n-3 : n-6 ... 17
3.4. Oméga-3 et inflammation ... 19
3.5. Les acides gras oméga-3 et les maladies cardiovasculaires ... 21
4. Obésité, oméga-3 et microbiote intestinal ... 22
4.1. Obésité et microbiote ... 22
4.2. Obésité et oméga-3 ... 26
4.3. Microbiote et oméga-3 ... 29
5. Mise en contexte et but de l’étude ... 31
Chapitre II – Implication de l’axe intestin- foie dans les effets bénéfiques attribués aux acides gras oméga-3 dans un modèle d’obésité murin : rôle potentiel du microbiote ... 33
Chapitre III - Conclusion ... 67
vii
Liste des figures
Figure 1 : Représentation mondiale de l’indice de masse corporelle par pays selon le sexe. Word Health Association, 2014. ... 1 Figure 2 : L'hypothèse "multi-HIT" de la stéatohépatite et la relation avec le syndrome métabolique (oxLDL : oxidized low-density lipoprotein, TLR : Toll-Like Receptor). Figure tirée du rapport de l'Organisatoin Mondiale de la Gastroentérologie de 2012 sur la NAFLD et la NASH. ... 4 Figure 3 : Phylums microbiens humains et leurs espèces. Figure tirée de la revue de Gangarapu et al, 2014 (Gangarapu et al. 2014). ... 6 Figure 4 : L'évolution du microbiote depuis l'origine de l'homme. ... 9 Figure 5 : Impact du microbiote sur la physiologie de l'hôte. Figure tirée de la revue de Sommer et al, 2013. ... 11 Figure 6 : Impact de divers émulisifiants (CMC : carboxymethylcellulose ; P80 : polysorbate-80) sur la muqueuse intestinale. (Chassaing et al. 2015). ... 12 Figure 7 : Cascade de dégradation des polysaccharides et de la fermentation par le microbiote intestinal humain. (Bernalier-Donadille 2010). ... 14 Figure 8 : Désaturation et élongation des acides gras oméga-3 et oméga-6. Les enzymes désaturases Δ5 et Δ6 sont encodées respectivement par FADS2 et FADS1. Figure tirée du rapport Bellagio (Simopoulos 2014). ... 18 Figure 9 : Réponse inflammatoire induite par une infection microbienne et l'implication de médiateurs lipidiques (Serhan and Petasis 2011). ... 21 Figure 10 : Mécanismes proposés par Musso et al (2010) concernant les effets du microbiote intestinal sur le métabolisme de l'hôte et les processus anti-inflammatoires. LPL : lipoprotein lipase; CLA, conjugated linoleic acid; ChREBP, carbohydrate-responsive element-binding protein; SREBP-1c, sterol-responsive element-binding protein-1c; FIAF, fasting-induced adipose factor; PGC1-a, peroxisomal proliferator-activated receptor coactivator-1a; LPS, lipopolysaccharide; TLR-4, toll-like receptor 4. ... 25 Figure 11 : Synthèse des effets potentiels des acides gras oméga-3 au niveau du foie et du tissu adipeux pour améliorer la stéatose hépatique non alcoolique (Scorletti and Byrne 2013). ... 28
ix
Liste des abréviations et des sigles
AA : acide arachidonique Acc : Acétyl-coA carboxylase
AGCC : Acides Gras à Chaîne Courte AGL : Acide Gras Libre
AGPL : Acides Gras Polyinsaturés à Chaîne Longue AL : Acide Linoléique
ALA : acide α-linolénique (Alpha-Linolenic Acid) ALT : ALanine Aminotransférase
AMPK : Adenosine Monophosphate-activated Protein Kinase AST : ASpartate Aminotransférase
BAT : tissu adipeux brun (Brown Adipose Tissue)
ChREBP : Carbohydrate Response Element Binding Protein CLA : acide conjugué linoléique (Conjugated Linoleic Acid) DHA : acide docosahexaénoïque (DocosaHexaenoic acid) EPA : acide eicosapentaénoïque (EicosaPentaenoic Acid)
eWAT : tissu adipeux blanc épididymaire (epididymal White Adipose Tissue) FADS : Fatty Acid Desaturase
FAO : Food and Agriculture Organization of the United Nations Fas : Fatty acid synthase
FFAR : Récepteur des Acides Gras Libres (Free Fatty Acid Receptor) FXR : Farnesoid-X-Receptor
Fiaf : Fasting-induced adipose factor FOS : Fructo-OligoSaccharides
GABA : Acide Gamma - aminobutyrique (Gamma-aminobutyric acid) GLP-1 : Glucagon-Like Peptide 1
GOS : Galacto-OligoSaccharides
GPR : Récepteur couplé à une protéine G (G protein -coupled receptor) GTT : Test de tolérance au glucose (Glucose Tolerance Test)
HF (diet) : (diète) riche en gras (High-Fat (diet))
HOMA-IR : Modèle d'évaluation de l'homéostasie de la résistance à l'insuline (HOmeostatic Model Assessment of Insulin Resistance)
IL : Interleukine
IMC : Indice de Masse Corporelle
iNOS : oxyde nitrique-synthase inductible (inducible Nitric Oxide Synthase) ITT : test de tolérance à l'insuline (Insulin Tolerance Test)
iWAT : Tissu Adipeux Blanc inguinal (inguinal White Adipose Tissue) JNK : Jun N-terminal kinase
LF (diet) : (diète) faible en gras (Low-Fat (diet)) LPL : LipoProtéine Lipase
LPS : LipoPolySaccharide LT : Leucotriène
MetaHIT : projet européen de caractérisation génétique de la flore intestinale humaine (Metagenomics of the Genome Intestinal Tract)
x
MUC : mucine
NAFLD : stéatose hépatique non alcoolique (Non-Alcoholic Fatty Liver Disease) NASH : stéatohépatite non-alcoolique (Non-alcoholic steatohepatitis)
NOD : Nucleotide-binding Oligomerization Domain OMS : Organisation Mondiale de la Santé
oxLDL : lipoprotéine oxydée de faible densité (oxidized Low-Density Lipoprotein) PG : Prostaglandine
PGC1 : Peroxisome proliferator activator receptor Gamma Coactivator 1 PPAR : Peroxisome proliferator-actived receptor
PRR : Pattern Recognition Receptor PSA : PolySaccharide A
PYY : Peptide YY
SREBP : Sterol Regulatory Element Binding Protein TLR : Toll-Like Receptor
TGF : Transforming Growth Factor TNF : Tumor Necrosis Factor
xi A Jean, Nicole et Patrice.
xiii
Remerciements
Je ne peux commencer ce mémoire sans remercier toutes les personnes qui m’ont permis aujourd’hui de l’écrire.
Je tiens d’abord à remercier le docteur André Marette, pour m’avoir permis en premier lieu d’intégrer son laboratoire et de me permettre de vivre une telle expérience. La multiplicité des projets sur lesquels il travaille, son amour de la science et son équipe formidable m’ont permis d’évoluer mentalement et humainement d’une manière que je n’aurais pas crue possible.
Ce travail n’aurait pas été ce qu’il est aujourd’hui sans Geneviève Pilon, que je tiens à remercier de tout mon cœur et qui exprime sa bonne humeur et son soutien constamment et de manière inconditionnelle à tous ceux qui passent à sa portée. Son sens de l’écoute et son incroyable capacité à gérer tous les problèmes m’auront maintes fois aidée à surmonter les obstacles de cette maîtrise. Geneviève, je ne saurai jamais assez comment te remercier.
J’aimerais également exprimer toute ma gratitude aux collègues et surtout aux amies sans qui mon expérience n’aurait pas été la même : Mélanie, Valérie, Geneviève C., Marie-Pier et Bruno, merci à vous pour tous ces moments, bons ou moins bons, dans lesquels vous avez toujours répondu présent, et d’avoir permis une si belle aventure au Québec. Je tiens également à saluer mes amis qui, malgré la distance, m’ont toujours encouragée.
Enfin, à ma famille : un immense merci pour votre amour, votre soutien financier et moral malgré les kilomètres qui nous séparent. Vous avez toujours trouvé les mots justes et m’exprimer tout le soutien dont vous êtes capables. Ce mémoire vous est particulièrement dédié.
xv
Avant-Propos
Ce mémoire porte sur l’étude des effets des acides gras oméga-3 en lien avec l’obésité et potentiellement le microbiote intestinal. Plus précisément, il s’agit de déterminer si les effets bénéfiques sur l’obésité que l’on attribue aux acides gras oméga-3 ne mettraient pas en jeu des facteurs spécifiques tels que le passage par la voie digestive et donc la flore bactérienne.
L’introduction générale résume globalement le manuscrit, lequel est ensuite divisé en deux chapitres. Le premier chapitre est une revue de littérature qui décrit d’abord le contexte d’obésité et ses complications, plus particulièrement la stéatose hépatique non alcoolique. Le microbiote est ensuite abordé et suivi par une partie sur les acides gras oméga-3. Enfin, les liens entre l’obésité, les oméga-3 et le microbiote intestinal sont évoqués.
Une remise en contexte de l’étude a été effectuée avant d’aborder le deuxième chapitre présenté sous la forme d’un article scientifique écrit en anglais. Celui-ci décrit l’implication de l’axe intestin-foie dans les effets bénéfiques des acides gras oméga-3 alimentaires dans un modèle d’obésité murin, et évoque l’implication potentielle du microbiote intestinal. Dès que les résultats de métagénomiques seront disponibles et viendront renforcer l’hypothèse abordée ici, l’article sera soumis à la fin de l’année 2015 dans le journal Gut : Journal of the British Society of Gastroenterology.
Sous la supervision du Dr. André Marette et les conseils avisés de sa directrice de projet Geneviève Pilon, le protocole animal a été réalisé par Mélanie Le Barz et moi-même. En tant que premier auteur, j’ai par la suite effectué les analyses tissulaires et plasmatiques présentées dans ce mémoire, et interprété les données expérimentales. Enfin, le projet se déroule en étroite collaboration avec le Dr Emile Levy, dont l’équipe sera chargée d’autres analyses par la suite, notamment en ce qui concerne le dosage des oméga-3 et oméga-6 hépatiques. Le mémoire se poursuit par une conclusion générale qui met en lumière le travail accompli, le lien avec la littérature existante mais aussi les futures perspectives à envisager pour la pérennité du projet. Finalement, le manuscrit se clôture avec une bibliographie listant l’ensemble des références évoquées.
1
Chapitre I - Introduction
1. Obésité et stéatose hépatique non alcoolique
1.1. Données épidémiologiques relatives à l’obésité
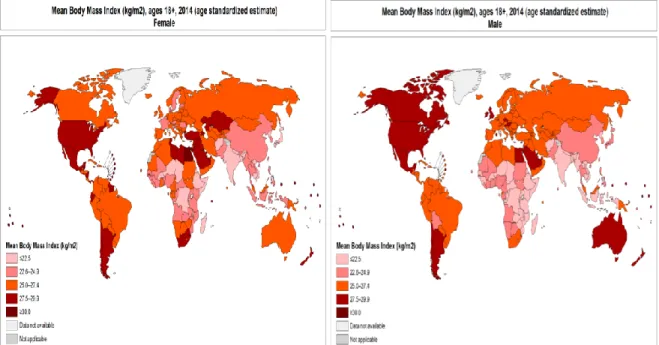
L’obésité est un fléau qui a progressé de manière conséquente ces dernières années, à tel point que l’Organisation Mondiale de la Santé (OMS) a qualifié ce phénomène d’épidémie en 2003 (WHO 2015). Twells et al. ont démontré que la prévalence de l’obésité a plus que doublé depuis 1980 (Twells et al. 2014). En 2014, l’OMS recense 13% de la population mondiale déclarée obèse (Indice de Masse Corporelle -IMC- ≥ 30), tandis que 39% des adultes âgés d’au moins 18 ans affichaient un surpoids (IMC ≥ 25) (Figure 1 : Représentation mondiale de l’indice de masse corporelle par pays selon le sexe. Word Health Association, 2014. En 2013, 42 millions d’enfants de moins de 5 ans étaient en surpoids ou obèses, avec un taux d’augmentation de 30% plus important dans les pays développés comparés aux pays en voie de développement (WHO 2015).
Figure 1 : Représentation mondiale de l’indice de masse corporelle par pays selon le sexe. Word Health Association, 2014.
2
En 2008, 62.1% de la population adulte canadienne souffrait d’embonpoint, dont 25.4% a été déclarée obèse (Canada 2011a), alors que le Canada se classait au 3e rang des pays avec
le taux d’obésité infantile le plus élevé en 2013 selon une étude du Fond des Nations Unies pour l’enfance (UNICEF 2013).
L’obésité est caractérisée par un groupe de phénotypes pathologiques (stéatose hépatique, hypertension, hyperlipidémie) dont les deux principaux sont la résistance à l’insuline et l’accumulation excessive de tissu adipeux viscéral (Tchernof and Després 2013) qui relèvent du syndrome métabolique (Hawkesworth 2013), accompagnés d’une inflammation systémique chronique de faible niveau. Même s’il convient de considérer tous les stades de l’obésité (Flegal et al. 2013), l’augmentation de la prévalence de l’obésité générale est un facteur de risque pour les maladies non transmissibles (WHO 2015) telles que les maladies cardiovasculaires (principale cause de mortalité en 2012), le diabète, les désordres musculo squelettiques et certains cancers (endomètre, sein, colon). De plus, l’obésité est également un problème de santé publique puisque le coût des soins de santé est estimé à plus de 900 milliards de dollars aux États-Unis d’ici 2030 (Wang et al. 2008).
Malgré les avancées scientifiques dans ce domaine et l’immensité du champ de recherche à explorer, les facteurs génétiques ne suffisent pas à eux seuls à donner une explication à ce phénomène d’expansion de la maladie (Waalen 2014). L’étiologie en est complexe, et implique également des facteurs environnementaux et sociologiques comme la sédentarisation, le développement des techniques agroalimentaires ou l’évolution des comportements. Ces facteurs ont ainsi favorisé une plus grande consommation, tout en dépensant moins de calories, ce qui a engendré une balance énergétique positive (Bergouignan 2010). En dépit du rôle récent attribué aux glucides (Tappy and Lê 2010), les études ont depuis longtemps montré l’association entre un apport excessif en lipides (Bray and Popkin 1998) et l’augmentation de la prévalence et de la gravité de l’obésité ainsi que de toutes les comorbidités qui y sont associées, en particulier la stéatose hépatique non-alcoolique.
3
1.2. La stéatose hépatique non alcoolique et le syndrome métabolique
La stéatose hépatique non alcoolique (NAFLD) regroupe en réalité un large spectre de plusieurs maladies. En effet, le cas le plus simple de la NAFLD, à savoir la simple stéatose hépatique, soit l’accumulation des triglycérides au niveau du foie, est caractérisée comme telle par biopsie lorsque l’infiltration des triglycérides excède 5% des hépatocytes (Organisation 2012), sans qu’il y ait consommation notable d’alcool ou des preuves d’une maladie hépatique virale, autoimmune ou induite par les médicaments. Toutefois, la stéatose hépatique peut progressivement évoluer vers la stéatohépatite non alcoolique (NASH), caractérisée par l’apparition de l’inflammation et de lésions au foie, allant jusqu’à la fibrose, la cirrhose, voire même jusqu’au carcinome hépatocellulaire (Abd El-Kader and El-Den Ashmawy 2015).La pathogénicité de la NAFLD peut s’expliquer par la théorie « multi-HIT » (Lavigne 2005). Le 1er HIT conduisant à la stéatose à partir d’un foie en santé est induit par
l’insulinorésistance et donc la suppression de l’inhibition de la lipolyse par l’insuline, ce qui mène à l’augmentation des acides gras libres (AGL) plasmatiques et à un pool hépatique plus important. Cette augmentation d’AGL induit une hyperglycémie que tente de compenser une hyperinsulinémie, qui diminue à son tour l’oxydation mitochondriale des acides gras et favoriserait leur accumulation hépatique. A ce stade, le 2e HIT qui mène à la
stéatohépatite est une conséquence du stress cellulaire et implique le stress oxydatif, l’apoptose et la lipopolysaccharide (LPS) dérivée de l’intestin qui induit une réaction inflammatoire avec implication des molécules concernées (TNF α, TGF β, IL6, IL8) (Takaki, Kawai, and Yamamoto 2013). Il a également été suggéré que les caractères génétiques pourraient influencer la survenue de la NASH à partir de la NAFLD, tels que le polymorphisme PNPLA3 rs738409 (Xu et al. 2015). Enfin, un 3e HIT mènerait à la
4
Figure 2 : L'hypothèse "multi-HIT" de la stéatohépatite et la relation avec le syndrome métabolique (oxLDL : oxidized low-density lipoprotein, TLR : Toll-Like Receptor). Figure tirée du rapport de l'Organisation Mondiale de la Gastroentérologie sur la NAFLD et la NASH (Organisation 2012).
Le syndrome métabolique regroupe cinq facteurs : l’augmentation de l’adiposité abdominale (> 102 cm pour les hommes, > 88 cm pour les femmes), un taux de triglycérides supérieur ou égal à 1.7 mmol/L, la diminution du taux de cholestérol des lipoprotéines de haute densité (HDL-cholestérol < 1.03 mmol/L pour les hommes, < 1.29 mmol/L pour les femmes), l’augmentation de la pression sanguine (systolique ≥ 130 mmHg, diastolique ≥ 85 mmHg), et enfin une glycémie à jeun supérieure ou égal à 5.6 mmol/L (Organisation 2012). Pour que ce syndrome soit diagnostiqué, être sujet à au moins trois de ces facteurs suffit.
La NAFLD est considérée comme la manifestation hépatique du syndrome métabolique car elle est associée à toutes ces caractéristiques, incluant obésité, diabète de type 2, hypertension artérielle et hyperlipidémie (Postic and Girard 2008).
2. Le microbiote intestinal
2.1. Au commencement
L’avènement de la bactériologie se fait principalement par l’intermédiaire de Robert Koch qui découvre pour la première fois le bacille responsable de l’anthrax ou maladie charbonneuse : Bacillus anthracis. Il obtient également le prix Nobel en 1905 pour ses
5 travaux sur la tuberculose et établit la notion de contagion par des agents exogènes (Kaufmann and Schaible 2005). C’est cependant Ilya Ilith Metchnikoff, prix Nobel de 1908 pour son avancement dans le domaine de l’immunité (Media 2015), qui postule le premier sur les effets bénéfiques apportés par certains microorganismes. Ce fut en effet ce « grand-père » des probiotiques nommés pour la première fois en 1965 (Lilly and Stillwell 1965), qui découvrit les propriétés digestives et immunitaires de la bactérie lactique Bulgarian bacillus (Anukam 2007).
2.2. Caractérisation
Depuis, le microbiote intestinal fait l’objet de nombreuses investigations, et l’engouement pour le sujet ces dernières années se base sur des études ayant montré l’implication grandissante de la flore intestinale du point de vue de la santé. Le sujet fascine, car l’intestin est l’organe du corps humain qui contient le plus grand nombre de bactéries et dont l’impact est loin d’être négligeable. L’étendue du microbiote prend toute sa signification avec l’étude européenne Metagenomics of the Genome Intestinal Tract (MetaHIT) dont les premiers résultats paraissent en 2010 (Qin et al. 2010). L’étude révèle ainsi que parmi un consortium de 1 000 à 1 150 espèces bactériennes détectées dans les échantillons humains, au moins 160 sont communes à tous les individus. 3,3 millions de gènes microbiens dont 99% sont bactériens ont été identifiés, ce qui représente environ 150 fois le génome humain. Dès lors, le nombre d’espèces et de gènes mis à jour ne cesse d’augmenter avec le regroupement de divers échantillons parfois transcontinentaux, qui ont mené à la création d’une base de données de près de 10 millions de gènes (Li, Jia, et al. 2014). De plus, la symbiose est telle entre les microorganismes et l’hôte que l’environnement de l’intestin humain est plus favorable aux transferts horizontaux de gènes entre bactéries (Smillie et al. 2011). La présence de la flore microbienne confère également à l’homme un pool de gènes supplémentaire, et par conséquent des fonctions additionnelles, tels que l’acquisition d’enzymes actives carbohydrates capables de cliver les liaisons des fibres et polysaccharides complexes via le microbiote (El Kaoutari et al. 2013). Les 1014 microorganismes que l’on trouve dans notre intestin représentent finalement plus
6
Il n’est donc pas étonnant que le microbiote intestinal soit aujourd’hui caractérisé comme un nouvel « organe » à part entière, un « petit monde » à l’intérieur de nous-mêmes (Cani and Delzenne 2011), de telle sorte que la symbiose entre humain et microbiote soit aujourd’hui définie comme un « superorganisme » (Eberl 2010).
Au fur et à mesure des études, les grandes familles caractéristiques du microbiote se dévoilent et sont à ce jour catégorisées en cinq phylums bactériens (Firmicutes, Bacteroidetes, Actinobacteria, Verrumicrobia et Proteobacteria) et un phylum archéen (Euryarchaeota), qui eux-mêmes se déclinent en plusieurs espèces (Tremaroli and Bäckhed 2012) (Figure 3). Cependant, les phylums Firmicutes et Bacteroidetes forment à eux deux environ 90% des catégories phylogénétiques connues et dominent les populations microbiennes (Eckburg et al. 2005), c’est pourquoi l’apparition de certaines maladies est souvent associée avec le ratio Firmicutes/Bacteroidetes (Ley et al. 2005).
Figure 3 : Phylums microbiens humains et leurs espèces. Figure tirée de la revue de Gangarapu et al (Gangarapu et al. 2014).
Selon les données de 2010 de l’étude MetaHIT, la population a été catégorisée en trois entérotypes : Bacteroides, Prevotella et Ruminococcus suivant les populations prédominantes au sein de chaque individu. Cependant, certains auteurs auraient tendance à
7 les qualifier de gradients ou de types de biome plutôt que d’entérotypes, qui semble être une classification trop prématurée étant donné l’immensité des recherches encore à mener sur le sujet (Jeffery et al. 2012).
2.3. Le modèle axénique
Afin d’explorer en profondeur l’impact du microbiote sur l’organisme de son hôte, les équipes de recherches se tournent de plus en plus vers le modèle de souris axénique. Exempts de tout microorganisme, ces animaux stériles sont manipulés avec grande précaution et servent notamment à montrer l’implication de la flore microbienne. Il est ainsi possible de transplanter le microbiote de souris conventionnelles à des souris axéniques afin d’observer l’influence de la flore intestinale. Des expériences récentes ont ainsi utilisé ce modèle dans le cadre de désordres spécifiques comme le diabète (Wen et al. 2008) ou l’obésité. Ainsi, une souris axénique à laquelle on a implanté le microbiote d’une souris obèse a vu son métabolisme changer pour devenir à son tour celui d’une souris obèse (Turnbaugh et al. 2006). Néanmoins, ce modèle présente certaines lacunes puisque les souris axéniques montraient des villosités intestinales plus longues et fines que celles de souris conventionnelles, ainsi qu’une altération de la muqueuse (El Aidy et al. 2012) et des fonctions lymphatiques immunitaires (Lamousé-Smith, Tzeng, and Starnbach 2011). Cependant, il est à noter que les résultats de ces études sont difficilement extrapolables à l’humain (Nguyen et al. 2015). L’utilisation des modèles murins gnotobiotiques (hébergeant un ou plusieurs microorganismes parfaitement connus) est cependant de plus en plus répandue et peut fournir des informations essentielles sur le comportement de la flore intestinale dans un contexte donné. Certaines études introduisent ainsi au sein de rongeurs une partie ou la totalité d’un microbiote humain spécifique, ce qui semble être un modèle prometteur plus représentatif de la condition humaine. En effet, il permet d’étudier les fluctuations des microorganismes dans des conditions précises induites volontairement, telles qu’une maladie ou la sélection de certains phyla. (Faith et al. 2011).
8
2.4. Facteurs influents
De ce fait, la population humaine possède une base commune concernant son microbiote intestinal, mais des variabilités interindividuelles existent. De plus, de nombreux facteurs influencent qualitativement et quantitativement les populations bactériennes. La condition physique (O'Sullivan et al. 2015), la situation géographique, le sexe, l’âge, le métabolisme ou l’environnement comme le facteur diététique sont donc à même de modifier l’équilibre microbien (Qin et al. 2010).
L’influence de l’environnement sur la variation des populations microbiennes se fait dès la naissance. En effet, bien que les études soient aujourd’hui en conflit pour déterminer si le microbiote de l’enfant s’acquiert initialement ou non dans le ventre de sa mère (Rodríguez et al. 2015), la plupart s’accordent à dire qu’il se développe progressivement à partir de l’accouchement et tend à ressembler au microbiote d’un adulte au bout d’environ 24 mois (Marques et al. 2010). Jusqu’à cette période, la flore microbienne est sensible à de nombreux facteurs externes, à commencer par le type de parturition (voie basse ou césarienne). Un enfant prématuré n’aura pas non plus le même microbiote que celui dont la grossesse aura été menée à terme (DiGiulio 2015, Arboleya et al. 2015), sans compter les facteurs génétiques de l’enfant (Murphy et al. 2015) ainsi que le mode d’alimentation (allaitement maternel ou via des substituts) ou même l’ajout d’antibiotiques ou de prébiotiques (Barrett et al. 2015).
L’étude MetaHIT de 2013 montre également une association entre la diversité du microbiote et les marqueurs métaboliques. En effet, la pauvre diversité microbienne chez les individus serait associée à une adiposité générale, une résistance à l’insuline et une dyslipidémie plus marquée comparé aux individus disposant d’une grande variété bactérienne (Le Chatelier et al. 2013).
De même, les herbivores arborent une diversité microbienne plus élevée que les carnivores, ce qui les avantagerait face aux perturbations potentielles qui pourraient lui être imposées (Ley et al. 2008), montrant encore une fois l’importance du régime alimentaire.
9 Étant donné que le microbiote co-évolue avec son hôte, l’évolution même de l’humanité expliquerait en partie le statut actuel de nos populations bactériennes. En effet, le régime alimentaire de l’homme s’est progressivement tourné vers une nourriture facilement accessible et digérable grâce à l’acquisition de nouvelles technologies comme le feu ou l’agriculture. Ceci s’est donc traduit par une réduction du volume de l’intestin, un allongement de l’intestin grêle, une réduction du colon et du caecum, et par un passage rapide par la bile. Fatalement, toutes ces modifications ont conduit à la régression de la population du microbiote intestinal (He, Marco, and Slupsky 2013) (Figure 4). Malgré cela, nous sommes bien loin de comprendre tous les domaines et mécanismes dans lesquels est impliquée notre flore bactérienne. Étant donné les récentes recherches et la place prépondérante que semble occuper le microbiote dans l’équilibre métabolique, les études se portent notamment sur l’interaction entre ce nouvel organe et l’alimentation, et s’intéressent de même aux désordres qui peuvent en résulter.
Figure 4 : L'évolution du microbiote depuis l'origine de l'homme (He, Marco, and Slupsky 2013).
2.5. L’intestin
On ne peut parler du microbiote sans parler de l’intestin ni des interactions qui unissent ces deux entités. Intermédiaire et interface entre la lumière intestinale et la circulation sanguine, l’intestin exerce un rôle de filtre extrêmement important étant donné la contradiction des deux tâches principales qui lui sont assignées. En effet, il est tout d’abord nécessaire à l’absorption des nutriments donc à leur assimilation par l’organisme, mais il est également essentiel pour la protection contre les agents pathogènes qu’il doit différencier des
10
« bonnes » bactéries. L’intestin joue donc un double rôle, c’est pourquoi la régulation de sa perméabilité est fondamentale.
Étant donné le nombre conséquent de microorganismes directement en contact avec l’intestin et les fluctuations dont ils peuvent être l’objet sous l’influence des nombreux facteurs précédemment évoqués, l’homéostasie et les interactions entre bactéries et paroi intestinale doivent être modulées sous peine d’affecter le système immunitaire programmé en réponse aux agressions (Zhang and Luo 2015).
La muqueuse est la première barrière qui protège la translocation des bactéries vers la circulation sanguine, et son épaisseur varie selon l’intestin proximal ou distal (Hansson and Johansson 2010). Sécrétée par les cellules caliciformes et constituée de protéines hautement glycosylées appelées mucines (MUC), la muqueuse constitue un milieu de choix pour les bactéries en tant que source nutritionnelle, ce qui permet de confiner les agents pathogènes dans sa couche externe (Etzold and Juge 2014). Les études ont montré l’influence réciproque de la muqueuse envers le microbiote grâce aux modèles murins : la défectuosité en MUC2 par exemple, mènerait à un débalancement du microbiote en faveur de Clostridium difficile (Cobo et al. 2015), tandis que certaines populations bactériennes protègeraient la muqueuse (Jakobsson et al. 2015).
La muqueuse est également l’un des sièges du système immunitaire par le biais des structures lymphocytaires qui réagissent à l’intrusion d’agents pathogènes. La formation et le développement du tissu lymphatique secondaire intestinal tel que les plaques de Peyer dépendent également de l’acquisition du microbiote (Van Praet et al. 2015), tandis que l’activation de certains récepteurs PRR (pattern recognition receptor) comme les NOD (nucleotide-binding oligomerization domain) ou les TLR (Toll-like receptors) par les bactéries engendrent une réponse immunitaire innée par le biais de cytokines ou chemokines (Sommer and Bäckhed 2013) qui peuvent être à la fois pro- ou anti-inflammatoires.
De plus, l’épithélium intestinal en tant que tel constitue lui aussi une barrière discriminative, notamment grâce aux jonctions serrées intercellulaires, qui ne laisse passer que certaines molécules comme les nutriments, tout en freinant le passage des pathogènes.
11 La découverte de la zonuline, capable de moduler la perméabilité intestinale, a notamment permis de comprendre une partie du fonctionnement de la fonction protectrice de l’intestin et son rôle dans les dysfonctionnements métaboliques (Fasano 2011).
La relation qu’entretient la flore microbienne avec ces différents facteurs implique donc qu’un équilibre soit constamment maintenu pour assurer l’homéostasie des fonctions. La modification de cet équilibre ou une dysbiose des populations microbiennes pourraient ainsi entraîner un dysfonctionnement pouvant affecter non seulement le métabolisme général, mais également les fonctions cérébrales, intestinales et osseuses, sans compter toutes les maladies qui en découlent (Figure 5).
Figure 5 : Impact du microbiote sur la physiologie de l'hôte. Figure tirée de la revue de Sommer et al (Sommer and Bäckhed 2013).
2.6. Les interactions entre microbiote et alimentation
Au vu de la liaison étroite qui existe entre le microbiote et l’intestin, il est logique de conclure à des interactions entre ces deux entités et l’alimentation qui se retrouvent en contact direct. La nourriture ingérée est à la fois source de nutriments pour l’hôte grâce à la translocation des nutriments par la barrière intestinale, mais elle l’est aussi pour le
12
microbiote qui lui-même pourvoit également à ses besoins au travers du mucus. Tout ce qui passe donc par le tractus digestif, y compris antibiotiques, pré- et probiotiques, est à même de modifier les populations intestinales et d’induire ou non une dysbiose avec des répercussions sur l’organisme (Hawrelak and Myers 2004). Zhang et al ont ainsi estimé que 60% de la variation totale des populations microbiennes pourrait être expliquée par le changement de régime alimentaire, alors que 10% sont attribués à la variation génétique propre à l’hôte (ZHANG, 2010).
Pour montrer par exemple l’importance de la muqueuse intestinale et l’influence que peut avoir l’alimentation, Chassaing et al ont testé divers émulsifiants sur la perméabilité intestinale et ont découvert un effet négatif flagrant de ces composés sur l’épaisseur du mucus et la translocation des bactéries (Figure 6).
Figure 6 : Impact de divers émulsifiants (CMC : carboxymethylcellulose ; P80 : polysorbate-80) sur la muqueuse intestinale. (Chassaing et al. 2015).
Aussi, de nombreux aliments sont testés sur le microbiote intestinal qui devient une cible potentielle dans le traitement contre certaines maladies et notamment l’obésité et le diabète. Fibres (Peng et al. 2013), polyphénols (Anhê et al. 2015) et acides gras oméga-3 (Yu et al. 2014) ne sont que des exemples de facteurs potentiels et d’aliments fonctionnels (Gul, Singh, and Jabeen 2015), sans compter les bactéries lactiques ou les processus de transformation comme la fermentation (Van Hylckama Vlieg et al. 2011).
13 Avec la notion de microbiote intestinal a émergé l’idée que puisque de « bonnes » bactéries logeaient dans notre intestin, en rajouter dans notre diète pourrait induire des effets bénéfiques, d’où la notion de probiotiques. Les premiers probiotiques sont nés avec la compréhension que les microorganismes du lait et du yaourt (Lactobacillus delbreuckii subsp. bulgaricus et Streptococcus thermophilus) semblaient induire des effets bénéfiques (Anukam 2007). Un probiotique est considéré comme tel lorsqu’il s’agit d’un microorganisme vivant qui confère un effet santé à l’hôte quand il est administré en quantité adéquate selon l’Organisation des Nations Unies pour l'Alimentation et l'Agriculture (FAO) (FAO/OMS 2001). Depuis, de nombreuses souches sont testées pour leur potentiel probiotique, mais les plus intéressantes médicalement parlant se sont principalement limitées aux Lactobacilles (Simeoli et al. 2015) et Bifidobactéries (Urita et al. 2015). Pourtant, une nouvelle génération de probiotiques est en train de voir le jour avec Faecalibacterium prausnitzii, Akkermansia muciniphila, Bacteroides uniformis et les groupes Clostridia IV, XIVa et XVIII (Patel and DuPont 2015).
La notion de flore intestinale est aussi accompagnée par le concept de prébiotiques, substrats des probiotiques et microorganismes intestinaux, parmi lesquels on trouve par exemple les galacto-oligosaccharides (GOS) et les dérivés de l’inuline comme les fructo-oligosaccharides (FOS) (Laparra and Sanz 2010). Roberfroid établit en 2007 l’une des définitions les plus complètes à partir de trois critères : un prébiotique doit donc être résistant à l’acidité gastrique et à l’hydrolyse enzymatique des mammifères, être fermenté par le microbiote intestinal et stimuler la croissance ou l’activité des bactéries intestinales qui contribuent à la santé et au bien-être de l’hôte (Roberfroid 2007). L’absence d’une définition internationale est palliée en 2008 lorsque la FAO les décrit comme étant des « composés alimentaires non viables qui confèrent un bénéfice sur la santé à l’hôte, associé à la modulation du microbiote ».
Le microbiote exerce donc de nombreuses fonctions physiologiques qui influencent la nutrition et la santé de l’hôte. Parmi ces fonctions figure la fermentation, qui joue un rôle prépondérant dans la production de métabolites à partir des substrats à sa disposition. La fermentation se fait principalement dans le colon, lequel arbore la majorité des colonies
14
bactériennes (Slavin 2013). En effet, il est propice au développement bactérien grâce à son pH adéquat, à la lenteur du transit et à la biodisponibilité des nutriments. La flore microbienne excelle à transformer les éléments qui échapperaient à la digestion de l’intestin grêle. De par sa richesse en gènes impliqués dans le catabolisme des hydrates de carbone, le microbiote est particulièrement apte à dégrader les hydrates de carbone complexes tels que les composants des membranes végétales et l’amidon résistant (Qin et al. 2010, El Kaoutari et al. 2013).
Les produits de la fermentation sont principalement des acides gras à chaîne courte (AGCC), mais le processus engendre également certains gaz (dioxyde de carbone, méthane et hydrogène) dont la majorité est recyclée par les bactéries elles-mêmes (Nakamura et al. 2010), ainsi que de l’éthanol (Figure 4), des vitamines (K2, B12), des neurotransmetteurs (acide γ- aminobutyrique-GABA-) ou d’autres molécules actives (polysaccharide A -PSA-, acide conjugué linoléique -CLA-) (Van Hylckama Vlieg et al. 2011).
Figure 7 : Cascade de dégradation des polysaccharides et de la fermentation par le microbiote intestinal humain (Bernalier-Donadille 2010).
Les acides gras à chaîne courte sont les produits issus de la fermentation les plus importants, en particulier les acides butyrique, acétique et propionique (Cummings et al. 1987). Tandis que l’acétate et le propionate sont réabsorbés par la veine portale et
15 métabolisés par le foie en tant que source énergétique, le butyrate est rapidement absorbé par l’hôte et constitue la source énergétique majeure des colonocytes (Thibault et al. 2010). Étant donné que l’on a estimé que les AGCC produits par fermentation bactérienne représentaient 10% de l’apport énergétique issu de l’alimentation, la science les a impliqués dans le métabolisme énergétique. De plus, ils sont également engagés dans des mécanismes de protection de la muqueuse intestinale (en particulier en ce qui concerne le butyrate), et anti-inflammatoires par interaction avec les récepteurs couplés aux protéines G (GPR) ou récepteur des acides gras libres (FFAR) (Lin et al. 2012).
3. Les acides gras oméga-3
3.1. Description, apports et sources
Les oméga-3 (n-3) sont des acides gras polyinsaturés à chaîne longue (AGPL), que l’on qualifie d’essentiels (Flock, Harris, and Kris-Etherton 2013). En effet, incapables de synthétiser ces composants par eux-mêmes, les mammifères doivent impérativement subvenir à leurs besoins en acides gras oméga-3 par voie exogène, c’est-à-dire via l’alimentation. Détenteurs d’une double liaison en position C3 à partir de l’extrémité méthylée de la molécule, les acides gras oméga-3 sont reconnus pour être des composants fondamentaux des membranes biologiques, sans compter les multiples effets bénéfiques sur la santé qui leur sont attribués.
Le phytoplancton constitue la source naturelle majeure d’acides gras oméga-3 et se trouve à la base de la chaîne alimentaire marine (Flachs, Rossmeisl, and Kopecky 2014). L’être humain trouve donc son apport en acides gras oméga-3 principalement dans les poissons gras (saumon, maquereau, hareng), mais également dans des sources végétales telles que les noix, ainsi que dans les graines et huiles issues de certaines plantes comme le lin, le colza ou le soja (Deckelbaum and Torrejon 2012).
Les apports moyens d’acides gras oméga-3 au sein de la population ont été jugés insuffisants en 2002 (Trumbo et al. 2002). Malgré les recommandations de divers
16
organismes tels que l’Association Américaine du Cœur ou le Guide Alimentaire Canadien (deux portions de 75 à 100g de poisson cuit par semaine) (Association 2015, Canada 2011b), seuls des Apports Suffisants pour l’acide α-linolénique qui oscillent entre 0.5g/j pour le nourrisson et 1.6g/j pour un homme adulte en passant par la femme enceinte (1.1g/j) ont pour l’instant été déterminés (Canada 2010). Ainsi, l’encadrement des acides gras oméga-3 et notamment des acides eicosapentaénoïque et docosahexaénoïque par des Apports Nutritionnels de Référence n’a pas encore été défini et demande à l’être (Flock, Harris, and Kris-Etherton 2013).
De nos jours, de nombreux produits sont enrichis en acides gras oméga-3 (œufs, matières grasses, produits laitiers etc.), sans compter tous les suppléments alimentaires, nutraceutiques et aliments fonctionnels (Gul, Singh, and Jabeen 2015) élaborés par les industries, dont l’impact réel concernant notre apport en ces acides gras est plus ou moins controversé. Cependant, la science fait face à une limitation relative des sources d’acides gras oméga-3 et à certains problèmes environnementaux. En effet, la trop grande exploitation des ressources maritimes entraîne le développement de l’aquaculture, et donc l’augmentation de la nourriture que l’on donne aux poissons d’élevage, elle-même élaborée à partir de chair et d’huile de poisson (Tocher 2009), ce qui ne constitue pas une solution viable. De plus, la pollution des eaux (e.g. méthylmercure) devient de plus en plus préoccupante concernant la qualité du poisson et leur répercussion sur la santé humaine (Racine and Deckelbaum 2007, Hong et al. 2015). Les scientifiques se tournent donc vers de nouvelles sources et de nouveaux moyens de produire des acides gras oméga-3, comme l’huile d’algue (Salem and Eggersdorfer 2015, Maki et al. 2014) ou la modification génétique de certaines levures (Lipomyces starkeyi) (Salunke et al. 2015) ou plantes (Camelina sativa) (Betancor et al. 2015).
3.2. Biodisponibilité
La biodisponibilité des acides gras oméga-3 est influencée par de nombreux paramètres et devrait être prise en compte dans toutes les études qui impliquent ces AGPL pour mieux appréhender les divergences au niveau des résultats (Cicero, Morbini, and Borghi 2015).
17 Bien évidemment, la source est importante (krill, poisson ou source végétale), mais la forme galénique (viande, huile, poudre) (Köhler et al. 2015, Sanguansri et al. 2015) et la forme chimique des acides gras oméga-3 peuvent également influencer leur biodisponibilité. En effet, les études montrent globalement que l’assimilation des acides gras oméga-3 libres et phospholipidiques est supérieure à celle des oméga-3 sous forme de triacylglycérols (Rossmeisl et al. 2012, Ghasemifard, Turchini, and Sinclair 2014), même si les triglycérides ré estérifiés ont eux-mêmes montré une meilleure biodisponibilité que les esters éthyliques. L’effet matrice doit également être considéré et serait en mesure d’améliorer l’assimilation des acides gras oméga-3 au niveau de l’organisme, notamment lorsque ces derniers sont ingérés avec un repas riche en gras comparativement à un régime faible en gras (Schuchardt and Hahn 2013).
Browning et al. ont également établi l’importance de la structure du traitement en testant différents types d’échelonnage. Ils ont ainsi démontré qu’au bout d’un traitement de 12 mois, les acides gras oméga-3 administrés quotidiennement étaient mieux absorbés au niveau des plaquettes et cellules mononuclées par rapport aux oméga-3 administrés une seule fois par semaine (Browning et al. 2014).
Enfin, la biodisponibilité des oméga-3 dépend également du patrimoine génétique propre à l’individu tel que les polymorphismes (Cormier et al. 2014) qui influent également sur leur assimilation et sur la réponse induite par l’organisme vis-à-vis de certaines maladies (Madden et al. 2011). Selon Harris et al, le tiers de la variabilité connue de l’index oméga-3 serait due aux facteurs génétiques (Harris et al. 2012).
3.3. Ratio n-3 : n-6
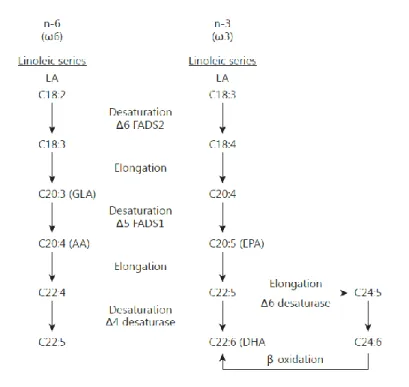
Les oméga-3 font en premier lieu référence à l’acide α-linolénique (ALA, 18:3 n-3), précurseur à partir duquel sont notamment issus l’acide eicosapentaénoïque (EPA, 20:5 n-3) et l’acide docosahexaénoïque (DHA, 22:6 n-n-3) dont les propriétés sont actuellement les plus étudiées. Cependant, les enzymes responsables des réactions d’élongation et de désaturation nécessaires à la synthèse de l’EPA et du DHA à partir de l’ALA sont également mobilisées par la cascade de réactions menant à la synthèse des oméga-6 comme
18
l’acide arachidonique (AA, 20 : 4 n-6) issu de l’acide linoléïque (AL, 18 : 2, n-6), tel qu’illustré à la Figure 8 (Simopoulos 2014). Ainsi, un contenu élevé en LA dans la diète entraînera la diminution de la synthèse d’EPA et DHA, de la même manière qu’un contenu élevé en ALA diminuera la synthèse d’AA. De plus, l’ajout direct d’EPA et DHA est préférable à l’ajout d’ALA car leur synthèse à partir de leur précurseur est relativement lente (Flachs, Rossmeisl, and Kopecky 2014).
Figure 8 : Désaturation et élongation des acides gras oméga-3 et oméga-6. Les enzymes désaturases Δ5 et Δ6 sont encodées respectivement par FADS2 et FADS1. Figure tirée du rapport Bellagio (Simopoulos 2014).
Les oméga-3 et oméga-6 sont deux classes d’acides gras polyinsaturés et se distinguent métaboliquement et physiologiquement. De plus, leurs propriétés diffèrent : tandis que les acides gras oméga-6 et leurs dérivés métaboliques tendent à être pro-inflammatoires et induisent la prolifération du tissu adipeux, les acides gras oméga-3 et leurs dérivés ont un effet protecteur (Simopoulos 2006, Li, Li, et al. 2014).
Ainsi, la stabilité d’un ratio n-6 : n-3, souvent exprimé sous la forme AA/EPA au sein des tissus est essentielle pour maintenir l’équilibre des fonctions métaboliques. Cependant, ce ratio a augmenté au fil de l’évolution dans les sociétés occidentales, passant de 1:1 à 16:1
19 (Simopoulos 2014), quand l’Agence Française de Sécurité Sanitaire des Aliments a fixé une recommandation de 5:1 pour ce ratio en 2002 (AFSSA 2002). Ce déséquilibre est principalement dû à l’enrichissement de la diète en oméga-6 (maïs, huile de carthame etc.) et occasionne un certain nombre de désordres métaboliques, d’où l’importance de consommer des oméga-3 pour rétablir le ratio n-6 : n-3.
3.4. Oméga-3 et inflammation
Ces dernières années, de multiples effets bénéfiques ont été attribués aux oméga-3 concernant les maladies cardiovasculaires (Jain, Aggarwal, and Zhang 2015), les déficiences cognitives (Muldoon et al. 2014), les cancers (Biondo et al. 2008) ou encore l’athérosclérose (Chang and Deckelbaum 2013). Si les mécanismes moléculaires relatifs à ces effets font toujours l’objet de nombreuses études et controverses, les chercheurs sont néanmoins unanimes quant aux effets anti-inflammatoires des oméga-3 qui pourraient être la réponse à un grand nombre d’interrogations. En effet, l’inflammation est impliquée dans une majorité de disfonctionnements métaboliques qui pourraient être prévenus voire renversés par la réponse anti-inflammatoire induite par les oméga-3.
La découverte des eicosanoïdes et de leur synthèse à partir des acides gras polyinsaturés qui valut le prix Nobel à Bergstrom, Samuelsson et Vane en 1982 (Samuelsson 1983) marque véritablement l’avènement de l’intérêt envers les acides gras polyinsaturés. Dans un premier temps sont d’abord découverts les eicosanoïdes issus des oméga-6 : prostaglandines (PGE), leucotriènes (LTB) et lipoxines sont rapidement révélées et caractérisées (Samuelsson et al. 1987). Tandis que les produits d’oxydation issus des oméga-6 tendent à être pro-inflammatoires (LTB4, PGE2), la différence de structure des eicosanoïdes issus des oméga-3 les prédispose moins à cet effet (Calder 2015). Le groupe de Serhan découvre ensuite grâce à une expérience faisant intervenir l’aspirine une nouvelle famille de molécules issues des oméga-3, qu’il nomme résolvines pour leur action anti-inflammatoire au niveau de la phase de résolution anti-inflammatoire (Serhan et al. 2002). Depuis lors, les mécanismes des médiateurs lipidiques dans le cadre de l’inflammation au
20
sein des membranes biologiques ont été l’objet de nombreuses investigations (Calder 2008).
L’acide eicosapentaénoïque est notamment le précurseur des résolvines de série E, dont la synthèse se fait par la voie de la cyclooxygénase ou du cytochrome P450 et peut être déclenchée par la présence d’acide acétylsalicylique (aspirine). Selon les réactions de peroxydation ou d’époxydation, on obtient les résolvines de série E1 ou E2 (Figure 2). De la même manière, les actions enzymatiques de différentes lipoxigénases, cyclooxygénase et cytochrome P450 à partir de l’acide docosahexaénoïque mènent à la synthèse de nombreux médiateurs lipidiques tels que des résolvines de série D (D1 à D4), des marésines (marésine 1) ou encore des protectines (PD1, PDX) (Calder 2015, Browning et al. 2014).
La découverte de ces nombreux métabolites impliqués dans les mécanismes anti-inflammatoires ouvre donc la voie à la résolution de certains désordres métaboliques. En empêchant par exemple la migration des neutrophiles vers les sites de l’inflammation ou en inhibant la production d’eicosanoïdes, ces médiateurs lipidiques nouvellement mis à jour pourraient être d’un grand secours dans la résolution des maladies inflammatoires telles que les maladies cérébrales (Alzheimer) ou métaboliques (athérosclérose, diabète) (Serhan and Petasis 2011) (Figure 9).
21
Figure 9 : Réponse inflammatoire induite par une infection microbienne et l'implication de médiateurs lipidiques (Serhan and Petasis 2011).
3.5. Les acides gras oméga-3 et les maladies cardiovasculaires
Parmi toutes les affections dont la résolution est associée aux acides gras oméga-3, les maladies cardiovasculaires occupent une place prépondérante, d’autant plus que leur lien avec l’obésité est étroit. En effet, depuis les travaux des Danois Bang et Dyerberg dans les années 1970 (Bang, Dyerberg, and Nielsen 1971), de très nombreuses études se sont consacrées à l’influence de ces acides gras polyinsaturés sur ces maladies. Ces derniers avaient en effet publié une série de travaux sur la diminution de la prévalence de ces maladies au sein de la population inuite due à leur régime alimentaire basé sur la graisse animale marine. Depuis une quarantaine d’années, une multitude d’études se sont construites sur cette base qui présente pourtant certaines lacunes méthodologiques (Fodor et al. 2014).
En dépit de la remise en question des premières études sur les Inuits, les effets préventifs des acides gras oméga-3 sur les maladies cardiovasculaires ont été par la suite approuvés (Wen et al. 2008) et s’appuient sur de grandes études comme DART (Burr et al. 1989),
22
JELIS (Yokoyama et al. 2007) ou GISSI-HF (2007). De plus, l’étude GOCADAN montre l’association entre un index oméga-3 élevé et la diminution de la fréquence cardiaque (Ebbesson et al. 2010). L’index oméga-3 est exprimé par la somme de l’EPA et du DHA par rapport au total des acides gras au niveau des membranes cellulaires érythrocytaires, et est fréquemment utilisé pour refléter les acides gras oméga-3 cardiaques même s’il n’est pas valable dans toutes les situations (Harris et al. 2004, Aarsetoey et al. 2009). Pourtant, malgré les nombreuses années à étudier les acides gras oméga-3, les méta-analyses cliniques récentes peinent à faire ressortir leurs effets bénéfiques (Rizos et al. 2012, Wen, Dai, and Gao 2014, Chowdhury et al. 2014) et nombre de leurs propriétés, comme dans le cas de la prévention de la mort cardiaque subite, demeurent vagues.
Les études peu nombreuses à ce sujet tendent à associer la consommation d’acides gras oméga-3 avec la diminution du risque de mort subite, mais d’autres analyses doivent être menées (Albert et al. 2002, Streppel et al. 2008, Friedman et al. 2013). De plus, l’arythmie cardiaque et la fibrillation auriculaire sont corrélées avec le risque de mort cardiaque mais il existe un débat sur l’efficacité des acides gras oméga-3 à améliorer les désordres à ce niveau (Volpe 2012). Si les effets anti-arythmiques de ces AGPL énoncés par d’anciennes études (Leaf et al. 2003, Mozaffarian et al. 2004, Richardson, Iaizzo, and Xiao 2011) viennent renforcer l’hypothèse de prévention contre certaines maladies cardiovasculaires et positionner les acides gras oméga-3 comme médications potentielles pour la prévention de la mort subite et des phénomènes associés, (Savelieva and Camm 2008), certaines études récentes tendent à démontrer le contraire (Darghosian et al. 2015, Saravanan, Calder, and Davidson 2015).
4. Obésité, oméga-3 et microbiote intestinal
4.1. Obésité et microbiote
Bäckhed et al suggèrent en 2004 l’implication du microbiote au niveau du métabolisme énergétique de son hôte. Après avoir conventionnalisé des souris axéniques par un microbiote normal, les auteurs observent chez ces souris une augmentation de 60% de la
23 masse totale adipeuse alors que la prise alimentaire diminue chez ces animaux. De plus, cette conventionnalisation s’accompagne d’une augmentation des triglycérides hépatiques (plus de deux fois celui des souris sans germe), ainsi qu’une élévation significative de deux enzymes clés dans la biosynthèse des acides gras de novo par le foie : Acc1 (Acétyl-CoA Carboxylase) et Fas (Fatty Acid Synthase). La production de ces enzymes serait potentiellement stimulée via l’augmentation de l’expression de ChREBP (Carbohydrate Response Element Binding Protein) et de SREBP-1 (Sterol Response Element Binding Protein 1) dans une moindre mesure, suite à la dégradation de polysaccharides par la flore intestinale (Bäckhed et al. 2004). Enfin, l’hypertrophie des adipocytes induite par le microbiote serait également induite par l’augmentation de l’expression de la lipoprotéine lipase (LPL) via l’inhibition de Fiaf (angiopoietin-like protein 4).
En 2007, Bäckhed et al apportent des éléments nouveaux, selon lesquels les souris axéniques seraient protégées contre l’obésité et l’accumulation du stockage lipidique grâce à des niveaux de Fiaf élevés, ce qui induit une augmentation de l’expression de PGC1 (peroxisomal proliferatoractivated receptor coactivator) d’une part, et l’augmentation de l’activité de l’AMPK (AMP-activated protein kinase) de l’autre (Bäckhed et al. 2007).
Par la suite, de nombreuses études s’attellent à étudier le microbiote intestinal, notamment dans un contexte d’obésité. Il est ainsi notamment révélé que le microbiote spécifique d’un obèse a une plus grande capacité d’absorption énergétique à partir du bol alimentaire, en lien avec la balance énergétique positive (Turnbaugh et al. 2006), sans compter que ses effets sont transmissibles. En effet, la colonisation de souris axéniques par le microbiote de souris obèses induit également le développement de l’obésité chez ces animaux, montrant ainsi le lien entre la flore intestinale et le métabolisme lipidique.
Le microbiote intestinal et la répartition des grands phyla qui le constituent peuvent donc être spécifiques à chaque condition. La flore microbienne en situation d’obésité se caractérise par une augmentation des Firmicutes et une diminution des Bacteroidetes (Ley et al. 2005). Cet état s’accompagne également d’une atteinte de la barrière intestinale et de ses jonctions serrées, ce qui engendre le passage de certaines molécules comme la lipopolysaccharide (LPS) qui se retrouve dans la circulation sanguine et provoque
24
l’inflammation liée à l’obésité et à la résistance à l’insuline (Cani et al. 2007). Cela est donc aussi valable pour la stéatose hépatique non alcoolique (Harte et al. 2010), qui est également caractérisée par la prolifération bactérienne de l’intestin grêle (Ferolla et al. 2014). Les études ont montré le rôle important que jouent les populations microbiennes dans ce contexte, capables de moduler l’endotoxémie selon la nature des souches représentées (Cani et al. 2008).
Il a été démontré que l’inflammation dans le cadre de l’obésité et plus particulièrement de la NAFLD pouvait être induite via l’activation des récepteurs TLR par le microbiote intestinal (Miura and Ohnishi 2014). Les TLRs 2, 4 et 5 en particulier seraient en mesure de reconnaître la LPS et de déclencher la cascade signalétique inflammatoire en partie responsable de l’évolution de la NAFLD vers la NASH. En 2010, Musso et al. ont envisagé les mécanismes liés au microbiote et responsables de l’apparition de désordres métaboliques liés à l’obésité (Musso, Gambino, and Cassader 2010) (Figure 10).
Enfin, une étude récente portant sur la comparaison des diètes africaines (riche en polysaccharides végétaux) et occidentale (riche en gras et faible en fibres) chez des enfants montre les différences profondes qu’il existe entre les populations consommant ces deux types de diète. Tandis que les Entérobactéries (Shigella, Escherichia) sont sous-représentées chez les enfants africains, ceux-ci bénéficient d’une plus grande présence des genres Prevotella et Xylanibacter, ce qui est également corrélé avec une concentration plus importante d’acides gras à chaîne courte, comparé aux enfants européens (De Filippo et al. 2010). Fait intéressant, une étude de cohorte en Europe et en Chine montre que les patients avec un diabète de type 2 avaient majoritairement une diminution de l’abondance des bactéries productrices de butyrate (Qin et al. 2012, Karlsson et al. 2013).
25
Figure 10 : Mécanismes proposés par Musso et al (2010) des effets du microbiote intestinal sur le métabolisme de l'hôte et les processus anti-inflammatoires. LPL : lipoprotein lipase; CLA, conjugated linoleic acid; ChREBP, carbohydrate-responsive element-binding protein; SREBP-1c, sterol-responsive element-binding protein-1c; FIAF, fasting-induced adipose factor; PGC1-a, peroxisomal proliferator-activated receptor coactivator-1a; LPS, lipopolysaccharide; TLR-4, toll-like receptor 4.
Les acides gras à chaîne courte ont fréquemment été associés à l’amélioration de la sensibilité à l’insuline, de la tolérance au glucose, de la distribution du tissu adipeux et du contenu lipidique hépatique via une modulation des hormones intestinales comme GLP1 (Glucagon-Like Peptide 1) ou PYY (Peptide YY) (Gao et al. 2009, Lin et al. 2012, Chambers et al. 2014). Par l’intermédiaire des récepteurs FFAR2/GPR43 et FFAR/GPR41 majoritairement, la flore intestinale est donc capable d’agir sur les métabolismes glucidique et lipidique grâce à la production d’acides gras à chaîne courte, ce qui a été démontré grâce au modèle axénique (Maslowski et al. 2009, Kimura et al. 2011, Kimura et al. 2013).
Certaines bactéries récemment découvertes ont montré un rôle positif dans la prévention et même la réversibilité de l’obésité, telles que Faecalibacterium prausnitzii chez l’humain aux propriétés anti-inflammatoires (Miquel et al. 2015) ou encore Akkermansia
26
muciniphila. L’administration de cette dernière bactérie, dont le taux est diminué dans le cadre de l’obésité, a permis de renverser et d’améliorer les désordres métaboliques induits par une diète riche en gras, à savoir le gain de poids, l’endotoxémie métabolique, l’inflammation du tissu adipeux et la résistance à l’insuline (Everard et al. 2013).
L’influence des bactéries pourrait également être bénéfique grâce à l’administration d’autres probiotiques qui pourraient remédier à ces pathologies. On peut citer par exemple VSL#3, dont les propriétés de prévention envers les disfonctionnements hépatiques ont été établies et s’exercent via la modulation de l’expression de récepteurs nucléaires et PPARγ (peroxisome proliferator-activated receptor γ ) entre autres (Mencarelli et al. 2012).
70% de l’apport sanguin au foie est apporté par la veine porte, elle-même reliée à l’intestin. Avec la notion d’interaction entre l’intestin, ses populations bactériennes et le foie, on parle de plus en plus de nos jours de l’axe intestin-foie (Compare et al. 2012, Visschers et al. 2013), qui pourrait même se prolonger jusqu’au cerveau (De Vadder et al. 2014).
4.2. Obésité et oméga-3
Malgré les nombreuses études portées sur le sujet, l’impact des acides gras oméga-3 sur l’homéostasie du glucose et la sensibilité à l’insuline demeure incertain, étant donné la variabilité des résultats, mais aussi les variations inter-espèces et la difficulté d’extrapoler le modèle murin au modèle humain. Dans le modèle animal, les effets bénéfiques globalement acceptés par la communauté scientifique sont l’amélioration de la sensibilité à l’insuline hépatique, associée à une réduction de l’accumulation hépatique des diacylglycérols, la diminution du dépôt des triglycérides dans des tissus variés sensibles à l’insuline et la diminution de l’inflammation de bas grade au niveau du tissu adipeux blanc, potentiellement grâce à la modulation des hormones incrétines (GLP1). Cependant, la situation est plus complexe pour l’humain à cause de paramètres influents comme le stade de la maladie et sa progression, ou encore l’âge des sujets (Flachs, Rossmeisl, and Kopecky 2014).
En revanche, les deux modèles bénéficient d’effets des oméga-3 plus connus, à savoir la prévention voire la normalisation de l’hypertriglycéridémie ainsi que l’amélioration de
27 l’inflammation systémique de faible grade et de l’inflammation tissulaire, ce qui nous intéresse particulièrement dans ce modèle.
Les mécanismes majeurs associés avec les effets des acides gras oméga-3 sur le foie incluent tout d’abord l’activation de PPARα, qui induit l’augmentation de l’oxydation des acides gras par les peroxysomes et les mitochondries (Zúñiga et al. 2011).
Ces acides gras peuvent également diminuer l’expression du gène de SREPB1 qui mène à l’inhibition de l’expression des gènes lipogéniques et à la diminution de la formation des acides gras, triglycérides et VLDL (Very Low Density Lipoprotein) (Takeuchi et al. 2010). Plus précisément, les acides gras oméga-3 induisent la suppression de la production de l’apolipoprotéine B (apoB) hépatique des VLDLs, ce qui engendre la diminution de la production des triglycérides et l’augmentation de l’oxydation mitochondriale. Les acides gras oméga-3 peuvent ensuite stimuler l’agrégation de l’apolipoprotéine B qui sera oxydée au niveau de l’appareil de Golgi. De plus, à ce stade le DHA possède une caractéristique supplémentaire par rapport aux acides gras oméga-3, car il est le seul à induire un processus d’autophagie dirigé contre l’apolipoprotéine B100 (Pan et al. 2008).
L’activation de l’AMPK peut également se faire par le biais des acides gras oméga-3 et module les facteurs de transcription PPARα et SREBP1 dans le foie et le tissu adipeux. Cela stimule par conséquent l’oxydation des lipides, et module les métabolismes glucidique (amélioration de la sensibilité à l’insuline) et lipidique ainsi que l’inflammation, probablement via un mécanisme impliquant l’adiponectine (Jelenik et al. 2010), ce qui peut potentiellement réduire le risque de progression de la NAFLD vers la NASH.
Les acides gras oméga-3 ont également un rôle dans l’inflammation et provoquent l’élévation de la production des médiateurs lipidiques anti-inflammatoires dérivés des oméga-3 (résolvines E1, D1, protectine D1) qui protègent les hépatocytes contre le stress oxydatif et la dégradation de l’ADN en cas de lésions nécroinflammatoires du foie (Rius et al. 2012).
Ils sont également à même de modifier la composition des membranes lipidiques en interagissant avec les phospholipides cavéolaires, ce qui améliore la signalisation et l’apoptose, et inhibe l’activité de la sphingomyélinase impliquée dans le stress cellulaire,
28
induisant la diminution de l’activité pro-inflammatoire des cytokines TNF-α et IL-1β (Ma et al. 2004).
Finalement, les acides gras oméga-3 sont impliqués au niveau du métabolisme du cholestérol dans le cadre de la NAFLD via FXR (Farnesoid X receptor), activé par la stimulation de la synthèse des acides biliaires primaires et leur excrétion par le foie (Kim et al. 2012).
Figure 11 : Synthèse des effets potentiels des acides gras oméga-3 au niveau du foie et du tissu adipeux pour améliorer la stéatose hépatique non alcoolique (Scorletti and Byrne 2013).
Pour résumer, les acides gras oméga-3 à longue chaîne peuvent intervenir au niveau du foie et du tissu adipeux dans le but de remédier à la stéatose hépatique non alcoolique. Dans le foie, les acides gras oméga-3 régulent le métabolisme des lipides hépatiques en augmentant l’oxydation des acides gras et en inhibant l’activité de SREBP1c et ChREBP qui stimulent la lipogénèse hépatique de novo. Dans le tissu adipeux, ils ont un potentiel anti-inflammatoire et inhibent le recrutement et l’activation des macrophages et diminuent la libération des acides gras, ainsi que la sécrétion d’adipokines et cytokines. Ils stimulent finalement l’expression de CYP7A1 (cholesterol 7 alpha-hydroxylase), ce qui a pour effet de stimuler la synthèse et l’excrétion des acides biliaires (Figure 11).