Rôle de DEPTOR dans la
régulation du bilan d’énergie
Thèse
Alexandre Caron
Doctorat en physiologie-endocrinologie
Philosophiae doctor (Ph.D.)
Québec, Canada
© Alexandre Caron, 2015
Résumé
La mechanistic target of rapamycin (mTOR) est une kinase qui s’associe à différentes protéines pour former deux complexes distincts (mTORC1 et mTORC2). Ces complexes jouent un rôle fondamental dans la régulation centrale du bilan d’énergie en assurant à la fois l’intégration hormonale et nutritionnelle, de même que le contrôle des déterminants énergétiques. Dans un contexte d’obésité, l’activation constitutive de mTORC1 engendrée par le surplus de nutriments conduit à la mise en place de boucles de rétroaction négative envers la voie de l’insuline. Cet évènement est en partie responsable de l’initiation de la résistance périphérique et hypothalamique à l’insuline. Des études récentes ont identifié Deptor comme un régulateur négatif de la voie de signalisation mTOR. Les connaissances actuelles démontrent que Deptor perturbe l’activité kinase de mTORC1 envers ses substrats en amont. Conséquemment, Deptor représente une cible de choix afin d’améliorer la sensibilité à l’insuline, particulièrement dans un contexte de balance énergétique positive qui exacerbe l’activité de mTORC1.
Les travaux réalisés dans le cadre de cette thèse ont révélé la présence de Deptor dans différentes régions cérébrales impliquées dans la régulation du bilan d’énergie. De fait, nos travaux dévoilent la première caractérisation de la présence et de la modulation de Deptor dans le cerveau du rat et de la souris. L’expression de Deptor s’avère affectée par la restriction alimentaire dans un contexte d’obésité. Afin d’identifier le rôle de Deptor dans la régulation du métabolisme énergétique, nous avons développé des modèles murins permettant la surexpression systémique et hypothalamique de Deptor. Les résultats obtenus à partir de ces modèles démontrent que Deptor joue un rôle majeur dans la régulation centrale du bilan d’énergie en prévenant l’obésité et les complications métaboliques induites par une diète riche en gras. Nous avons observé que la surexpression hypothalamique de Deptor affecte la dépense énergétique et améliore le métabolisme du glucose. Au plan mécanistique, Deptor améliore la sensibilité neuronale à l’insuline en favorisant l’activation de la protéine kinase B (Akt) et en réprimant l’expression du peptide orexigène agouti-related (AgRP).
Abstract
The mechanistic target of rapamycin (mTOR) is a kinase that nucleates two large protein complexes (mTORC1 and mTORC2). These complexes play fundamental roles in the central regulation of energy balance by ensuring the integration of nutrient and hormonal cues, and modulating the energy determinants. In a context of obesity, the constitutive activation of mTORC1 generated by nutrient overload leads to the generation of several negative feedback loops toward the insulin signaling pathway. This event is, at least in part, responsible for the initiation of hypothalamic and peripheral insulin resistance. Recent studies have identified Deptor as a negative regulator of the mTOR signaling pathway. Current knowledge demonstrates that Deptor affects the kinase activity of mTORC1 toward its upstream substrates. Consequently, Deptor represents a prime target to improve insulin sensitivity, particularly in a context of positive energy balance that exacerbates the activity of mTORC1.
This thesis revealed the presence of Deptor in different brain regions involved in the regulation of energy balance. Our work reports the first characterization of the presence and modulation of Deptor in the mouse and rat brain. We revealed that expression of Deptor is affected by dietary restriction in a context of obesity. In order to identify the role of Deptor in regulating energy homeostasis, we have developed mouse models allowing the systemic and hypothalamic overexpression of Deptor. The results obtained from these models indicate that Deptor prevents obesity and metabolic complications induced by a high-fat diet. Therefore, hypothalamic Deptor overexpression affects energy expenditure and improves glucose metabolism. Mechanistically, our work reveals that Deptor improves neuronal insulin sensitivity by promoting the activation of protein kinase B (Akt/PKB) and by suppressing the expression of the orexigenic agouti-related peptide (AgRP).
Table des matières
Résumé ... iii
Abstract ... v
Table des matières ... vii
Liste des tableaux ... xi
Liste des figures ... xiii
Liste des abréviations ... xv
Remerciements ... xxi
Avant-propos ... xxv
Articles présentés ... xxvii
INTRODUCTION ... 1
1. La régulation du bilan d’énergie ... 3
1.1. Le réseau cortical exécutif ... 5
1.2. Le circuit de la récompense ... 7
1.3. La régulation autonome du bilan d’énergie ... 8
1.3.1. Historique ... 8
1.3.2. Régulation du bilan d’énergie par l’hypothalamus médio-basal ... 10
1.3.2.1. Le noyau arqué ... 12
1.3.2.1.1. Le duel POMC-AgRP et le système aux mélanocortines ... 15
1.3.2.1.2. Les neurones orexigènes NPY/AgRP ... 16
1.3.3. L’hypothalamus ventromédian et les neurones SF-1 ... 18
1.3.4. Intégration hormonale et nutritionnelle du MBH ... 19
1.3.4.1. La leptine ... 20
1.3.4.2. L’insuline ... 23
1.3.4.3. La voie PI3K et la réunion des voies de la leptine et de l’insuline ... 25
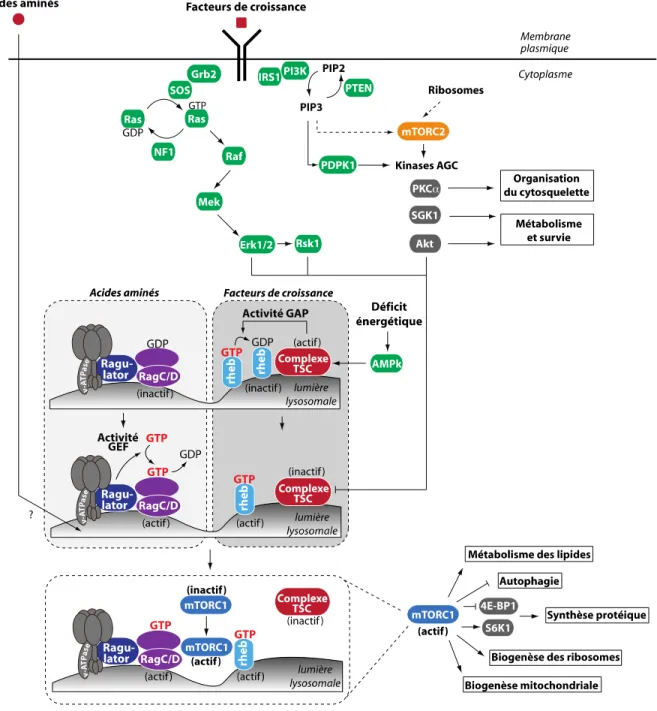
2. La voie de signalisation mTOR ... 27
2.1. Le complexe mTORC1 ... 29
2.1.1. Fonctions importantes ... 30
2.1.2. Régulateurs en amont de mTORC1 ... 31
2.1.2.1. Les facteurs de croissance ... 31
2.1.2.2. Le stress, l’énergie et l’oxygène ... 34
2.1.3. Boucles de rétrocontrôle négatif ... 36
2.2. Le complexe mTORC2 ... 37
2.2.1. Fonctions ... 38
2.2.2. Régulateurs en amont de mTORC2 ... 39
3. La voie mTOR et le métabolisme ... 39
3.1. Régulation du métabolisme périphérique ... 40
3.2. mTORC1 et l’intégration hormonale hypothalamique ... 42
3.2.1. Convergence des effets de l’insuline et de la leptine ... 42
3.2.2. Autres voies hormonales et nutritionnelles contrôlées par mTORC1 ... 44
3.2.3. mTORC2 et la régulation du bilan d’énergie ... 45
3.3. La rapamycine pour traiter l’obésité? ... 46
4. Deptor, un régulateur endogène de la voie de signalisation mTOR ... 47
4.1. Structure et fonctions ... 48
4.1.1. Les domaines DEP ... 50
4.1.2. Le domaine PDZ ... 51
4.2. Régulation ... 52
4.3. Rôles physiologiques ... 54
4.3.1. Implications dans le cancer ... 54
4.3.2. Implications dans le métabolisme ... 57
4.3.3. Régulation des boucles de rétrocontrôle négatif vers IRS1 ... 59
Problématique ... 63
Objectifs généraux ... 65
Objectifs spécifiques ... 65
CHAPITRE 1 ... 67
DEP domain-containing mTOR-interacting protein in the rat brain: distribution of expression and potential implication ... 67
AVANT PROPOS ... 69
RÉSUMÉ ... 71
ABSTRACT ... 73
INTRODUCTION ... 75
MATERIAL AND METHODS ... 77
Animals ... 77
Deptor and Deptor mRNA expression in rat brain and tissues ... 77
Deptor mRNA expression in fasted obese and lean rat ... 77
Western blots ... 78
Brain in situ hybridization histochemistry ... 79
Brain immunohistochemistry and immunofluorescence ... 82 RESULTS ... 85 DISCUSSION ... 97 CONCLUSION ... 101 ACKNOWLEDGEMENT ... 101 REFERENCES ... 103 CHAPITRE 2 ... 107
Hypothalamic Deptor overexpression improves glucose homeostasis and protects against high-fat diet-induced obesity ... 107
AVANT PROPOS ... 109 RÉSUMÉ ... 111 ABSTRACT ... 113 INTRODUCTION ... 115 METHODS... 117 RESULTS ... 121
Generation of a conditional Deptor transgenic mouse model ... 121
Whole-body Deptor overexpression increases locomotor activity and improves glucose homeostasis in lean mice ... 122
DeptorO/E mice are protected against high-fat diet-induced obesity and metabolic alterations. ... 124
Deptor is expressed in key regions of the brain regulating energy balance ... 125
MBH-specific Deptor overexpression increases locomotor activity and improves glucose homeostasis. ... 127
MBH-specific Deptor overexpression protects mice against obesity. ... 128
Deptor overexpression enhances hypothalamic insulin sensitivity and reduces the expression of Agrp. ... 129 DISCUSSION ... 133 CONCLUSION ... 137 ACKNOWLEDGEMENT ... 137 REFERENCES ... 139 DISCUSSION GÉNÉRALE ... 145
Signature neuronale de Deptor ... 145
Distribution et rôles potentiels de Deptor ... 146
Les organes circumventriculaires et l’intégration des signaux périphériques ... 146
Structures impliquées dans la régulation des systèmes nerveux sympathique et parasympathique ... 147
Structures du système limbique et la neurodégénérescence ... 147
L’hypothalamus médio-basal et la régulation du métabolisme énergétique ... 148
Modulation potentielle de Deptor par le stress ... 149
Intérêt de comprendre le rôle métabolique de Deptor ... 150
L’hypothalamus à l’origine des effets métaboliques de Deptor ... 152
Deptor améliore le métabolisme énergétique en augmentant la sensibilité neuronale à l’insuline ... 153
PERSPECTIVES DE RECHERCHE ... 157
CONCLUSION ... 161
Liste des tableaux
INTRODUCTION
Tableau 1. Modèles génétiques d'obésité attribuée au SNC. ... 14
CHAPITRE 1
Table 1. Brain structures expressing Deptor mRNA and relative intensity of the
Liste des figures
INTRODUCTION
Figure 1. Les complications de l'obésité. ... 2
Figure 2. Circuits neuronaux impliqués dans le comportement alimentaire. ... 5
Figure 3. L'hypothalamus médio-basal. ... 11
Figure 4. Régulation du bilan d'énergie par le noyau arqué. ... 12
Figure 5. Convergence entre les voies de la leptine et de l'insuline dans le MBH. ... 23
Figure 6. Structures et caractéristiques importantes de mTORC1 et mTORC2. ... 27
Figure 7. Sites d'interactions des différents compagnons de mTOR. ... 29
Figure 8. La voie de signalisation mTOR simplifiée. ... 33
Figure 9. Boucles de rétrocontrôle de mTORC1. ... 37
Figure 10. DEPTOR est une protéine bien conservée. ... 48
Figure 11. Profil d'expression génique de Deptor chez la souris. ... 49
Figure 12. L'activation de Deptor par les glucocorticoïdes promeut l'adipogenèse. ... 58
Figure 13. La surexpression de Deptor réduit les rétrocontrôles négatifs vers IRS1. ... 61
CHAPITRE 1 Figure 1. Analysis of Deptor protein expression in rat tissues. ... 85
Figure 2. Rostrocaudal distribution of Deptor in the rat brain. ... 87
Figure 3. Deptor mRNA and Deptor protein expression in the forebrain. ... 89
Figure 4. Deptor mRNA expression in the hippocampal formation. ... 90
Figure 5. Deptor mRNA and Deptor protein expression in the hypothalamus. ... 91
Figure 6. Deptor is expressed in neurons and colocalizes with POMC neurons. ... 92
Figure 7. Deptor mRNA and Deptor protein expression in the midbrain. ... 93
Figure 8. Deptor mRNA and Deptor protein expression in the hindbrain. ... 94
Figure 9. Hypothalamic Deptor expression is enhanced by fasting in obesity. ... 95
CHAPITRE 2 Figure 1. Generation of a Deptor transgenic mouse. ... 121
Figure 2. Phenotype of DeptorO/E mice. ... 123
Figure 3. DeptorO/E mice are protected against HFD-induced obesity and metabolic alterations. ... 124
Figure 4. Deptor is expressed in key regions of the brain regulating energy balance. .... 126
Figure 5. MBH-specific Deptor overexpression increases physical activity and improves glucose homeostasis. ... 127
Figure 6. MBH-specific Deptor overexpression protects mice against obesity. ... 129
Figure 7. Deptor overexpression increases hypothalamic insulin sensitivity and reduces the expression of Agrp. ... 131
DISCUSSION Figure 1. Schéma récapitulatif du rôle de Deptor dans le MBH. ... 154
Liste des abréviations
10N Noyau dorsal du nerf vague
4E-BP1/2 eIF4E-binding protein 1/2
AgRP Agouti-related peptide
Akt/PKB Protéine kinase B
AMPK AMP-activated protein kinase
ARC Noyau arqué de l'hypothalamus
BMK1 Mitogen activated protein kinase 1
CART Cocaine and amphetamine regulated transcript
CCK Cholécystokinine CKI Casein kinase I
DEP DVL, EGL-10, pleckstrin
DEPDC1-7 DEP-domain containing protein 1-7
Deptor DEP domain-containing mTOR-interacting protein
DMH Hypothalamus dorsomédian
DREADD Designer Receptor Exclusively Activated by Designer Drugs
DVL Dishevelled
EGL-10 Egg-laying defective protein 10
eIF4E eukaryotic translation initiation factor 4E
EPAC Exchange protein directly activated by cAMP
ERK1/2 Extracellular signal-regulated kinase 1/2
FAT Domaine FAT-carboxy terminal FATC Domaine FRAP-ATP-TTRAP FKBP12 FK506-binding protein of 12 kDa
FoxO1/3a Forkhead box protein O1/3a
FRB Domaine FKBP12-rapamycin binding
GABA Acide γ-aminobutyrique
GAP GTPase activating protein
GEF Guanidine exchange factor
GLP1/2 Glucagon-like peptide 1/2
GNMT Glycine N-methyltransferase
GPR155 G protein-coupled receptor 155 (DEPDC3)
Grb10 Growth factor receptor-bound 10
HEAT Huntingtin-elongation factor-3 regulatory subunit A of PP2A-TOR1
HIF-1 Hypoxia-inducible factor 1
icv Intracérébroventriculaire IGF1 Insulin growth factor 1
IMC Indice de masse corporelle
IR Récepteur de l'insuline
IRS Insulin receptor substrate
KD Knock-down
LEPR Récepteur de la leptine
LEPR-B Isoforme longue du récepteur de la leptine
LH Hypothalamus latéral
MBH Hypothalamus médio-basal
MC3R Récepteur de la mélanocortine 3 MC4R Récepteur de la mélanocortine 4
mLST8 Mammalian lethal with SEC13 protein 8 (GβL)
mSin1 Mammalian stress-activated protein kinase interacting protein
mTOR Mechanistic target of rapamycyn
NPY Neuropeptide Y
NPYR Neuropeptide Y Receptor
OMS Organisation mondiale de la santé p110 Sous-unité catalytique de la PI3K p53 Tumor protein p53
p85 Sous unité régulatrice de la PI3K
pCREB Phosphorylated cAMP response-element binding protein
PDPK1 Phosphoinositide-dependent kinase-1
PDZ Postsynaptic density 95, disc large, zonula occludens-1
PGC1α PPARγ coactivator 1α
PI3K Phosphoinositide 3-kinase
PIKK Phosphatidylinositol 3-kinase-related kinase
PIP3 Phosphatidylinositol (3,4,5)-trisphosphate
PKCα Protein kinase C-α
POA Aire préoptique
POMC Pro-opiomélanocortine PP Polypeptide pancréatique
PPARγ Peroxisome proliferator-activated receptor γ
PRAS40 Proline-rich Akt substrate of 40 kDa
PREX2 Phosphatidylinositol 3,4,5-trisphosphate-dependent Rac exchanger 2 protein (DEPDC2)
Protor1/2 Protein observed with Rictor-1/2
Pten Phosphatase and tensin homolog deleted on chromosome 10
PVH Hypothalamus paraventriculaire
PYY Peptide YY
QTL Locus de caractère quantitatif RAC1 Ras-related protein 1
Rag Ras-related GTP-binding protein
Raptor Regulatory-associated protein of mTOR
REDD1 Protein transcriptional regulation of DNA damage response 1
Rheb Ras-homolog enriched in brain
Rictor Rapamycin-insensitive companion of mTOR
RSK1 Ribosomal S6 kinase 1
RTK Récepteur tyrosine kinase
S6K1 Ribosomal protein S6 kinase 1
SF-1 Steroidogenic factor-1 (NR5A1)
SGK1 Serum- and glucocorticoid-induced protein kinase 1
SH2 Src Homology 2
SMARCD3 SWI/SNF related, matrix associated, actin dependent regulator of chromatin, subfamily d, member 3 (BAF60C)
SNC Système nerveux central
SOCS Suppressor of cytokine signaling
SREBP1 Sterol regulatory element binding protein 1
STAT Signal transducer and activator of transcription
T3 Triiodothyronine
TBC1D7 TBC1 domain family member 7
Tel2 Telomere maintenance 2
TGFβ Transforming growth factor β
TNFα Tumor necrosis factor α
TSC1 Tuberous sclerosis 1 (tubérine)
TSC2 Tuberous sclerosis 2 (hamartine)
Tti TELO2 interacting protein 1
UCP1 Protéine découplante 1
v-ATPase Lysosomal H+-adenosine triphosphase ATPase VGAT Transporteur vésiculaire GABA
VMH Hypothalamus ventromédian
Don’t be trapped by dogma, which is living with the results of other people’s thinking. Don’t let the noise of others’ opinions drown out your own inner voice. And follow your heart and intuition. They somehow already know that you truly want to become.
Steve Jobs
Remerciements
Les études graduées représentent une grande aventure constituée d’un parcours semé d’embuches, de décisions difficiles et de rudes épreuves. Bien entendu, cette aventure comporte également son lot de moments appréciables, de rencontres admirables et de prises de conscience plus que profitables. À l’issue de cet épisode, le bébé scientifique maintenant adolescent concoit que la tâche accomplie est imputable à de nombreuses personnes, à de nombreux amis, qui ont participé directement, inconsciemment ou émotionnellement à sa réussite. Cet accomplissement repose donc d’abord et avant tout sur les personnes suivantes.
J’adresse d’abord mes remerciements à mon directeur de recherche, le Dr Denis Richard, pour sa confiance de mon premier stage à ma maîtrise, à mon passage au doctorat, à aujourd’hui, et à demain. Cette confiance réciproque m’aura permis d’évoluer d’un point de vue scientifique, personnel et professionnel. Denis, tu es un véritable modèle d’acharnement à l’origine de mes ambitions professionnelles. Tu m’auras permis de développer à la fois mes aptitudes et mon attitude à différents niveaux. Tu es la source de mon autonomie et de ma détermination scientifique. J’ai apprécié l’étendue de latitude que tu m’as offerte et qui m’a permis d’appliquer et de développer mon esprit créatif et mon indépendance. Derrière l’administrateur accomplis se trouve un collègue dont l’amitié perdurera.
Peu de jeunes scientifiques ont la chance d’être soutenue par deux excellents mentors. De ce fait, je dois aussi toute ma gratitude à mon co-directeur, le Dr Mathieu Laplante. Mathieu, j’ai eu l’honneur et le privilège d’être acceuilli à bras ouvert dans le prélude de ta carrière professorale. Ta générosité, ton accessibilité, ta minutie et ta persévérance font de toi un modèle incontestable pour l’ensemble de la relève. Tu es également à l’origine de mon développement professionnel et de ma discipline personnelle. J’ai apprécié toutes les opportunités que tu m’as offertes, ainsi que les nombreux conseils quant à mon avenir. Tu représentes sans contredit un ami inestimable.
Je dois également des remerciements particuliers à Dre Elena-Dana Baraboi. Dana, tu es un exemple de détermination absolue et de gentillesse incarnée. Alors que tu avais l’unique mandat de superviser mes travaux lorsque j’étais un jeune stagiaire, tu m’as pris sous ton aile afin de m’apprendre toutes les bases de la neurobiologie. Mes connaissances actuelles sont attribuables à ta patience et à ton temps. Tout comme tu as contribué à ma réussite, je te souhaite le succès que tu mérites dans le domaine de la médecine.
Mes laboratoires d’acceuil m’ont aussi alloué un support technique incroyable. Je remercie d’abord Marie-Claude Roy et Yves Gélinas. Votre disponibilité, votre engagement et votre enseignement m’ont permis d’effectuer l’ensemble de mes tâches avec brio. Votre esprit scientifique fait de vous des personnes extraordinaires pour guider de jeunes étudiants ambitieux. Marie, ton esprit maternel aura contribué grandement à mon développement scientifique et au succès du laboratoire. Yves, ton grand cœur de bougon m’aura également permis de devenir un scientifique soucieux de son travail et de l’environnement collaboratif. Merci pour les centaines de génotypages que tu as accomplis. Merci aussi à Julie Plamondon pour m’avoir enseigné plusieurs techniques dont l’hybridation in situ et à Pierre Samson pour tout ton aide concernant les études calorimétriques. Un grand merci aux techniciennes en santé animale qui m’ont fourni une formation et une aide technique exemplaire : Cynthia Bouchard, Audrey Chalifoux et Érika Turmel.
J’ai aussi eu la chance de partager une partie de mon histoire avec des collègues et amis incroyables au sein de mes équipes d’acceuil (Dr Sébastien Labbé, Dr Damien Lanfray, Dr Christian Roy, Blandine Secco, Dr David St-Pierre, Thomas Grenier-Larouche, Charles-Étienne Plourde, Étienne Camiré, Inan Bakan, Dre Kanta Chechi, Dr Boris Monge-Rofarello, Dominique Caron-Dorval, Mihaela Barbuta, Carlos Lopez, Stéphanie Lavoie, Dre Véronique Ouellet, Wei Li). Je vous remercie tous pour votre support technique et moral, de même que pour tous le merveilleux temps passé en votre compagnie.
Je remercie aussi mes collaborateurs directs, complices intellectuels et amis du CRIUCPQ qui m’ont toujours forcé à réfléchir davantage et à me surpasser tant dans la science que dans la vie de tous les jours : Dr Yves Deshaies, Dr Pierre-Gilles Blanchard, Dr Frédéric Picard, Marc Lapointe, Dr Alexandre Fisette, Dre Elena Timofeeva, Christophe Lenglos, Geneviève Guevremont, Arojit Mitra, Dre Julianne Calvez, Dr Luca Pellegrini, Dre Aditi Sood, Dr André Marette, Michael Shum)
De nombreuses personnes ressources se doivent également d’être remerciées. Un grand merci à l’équipe de l’animalerie pour votre accessibilité, rigueur et conscience scientifique (Justin Robillard, Nicolas Thiboutot-Gagnon, Sébastien Poulin, Tony Néron, Chloé Bouchard). Merci également au professionallisme et au support de l’équipe de direction du CRIUCPQ (Michèle Clavet, Dr Éric Paradis, Caroline Paquin, France Côté, Lyne Michaud, Annie Moreau).
J'adresse bien entendu mes remerciements aux membres de ma famille pour l’ensemble du support, de l’encouragement et de l’amour reçus depuis le tout début (maman, papa, Gaston, Antoine, Raphaël, Kassandra). Merci également à mes précieux amis qui acceptent mon peu de disponibilités depuis des années et qui m’offrent toujours de merveilleux moments. Une pensée toute spéciale va au noyau solide qui m’accompagne depuis si longtemps (Françis, David, Maxime et Étienne) de même qu’à ma bonne amie Audrey, qui malgré la distance demeure tout près de moi depuis nos débuts en athlétisme. Vous représentez tous une partie importante des mes accomplissements personnels et académiques.
Ces études graduées m’auront également permises de rencontrer une personne exceptionnelle avec qui j’ai le prévilège de partager ma vie. Merci Sophie d’être là et de m’aimer. Je suis convaincu que tu es la grande dame qui me permettra de devenir un grand homme, comme le veut l’adage. Je t’aime.
Avant-propos
Le présent ouvrage est déposé à la Faculté des études supérieures de l'Université Laval pour l'obtention du diplôme de Philosophiae Doctor ès Sciences (Ph.D.). Cette thèse porte essentiellement sur le rôle de la protéine Deptor dans la régulation du bilan d’énergie. La thèse comprend une introduction générale rédigée en français qui s’articule autour de la problématique de l’épidémie actuelle d’obésité, ainsi que de l’importance de la l’intégration et de la régulation hypothalamique dans le développement de cette pathophysiologie. On y retrouve également une description détaillée des mécanismes centraux qui gouvernent le métabolisme énergétique et celui du glucose, couplée à l’importance de la leptine et de l’insuline dans cette régulation. L’introduction dresse également un portrait général de la voie de signalisation mTOR et de son implication dans le métabolisme périphérique et central. Ce préambule permet également un survol global des connaissances actuelles quant à la protéine Deptor. Les chapitres 1 et 2 forment le corps de l’ouvrage et exposent certaines découvertes en liens avec le sujet que j’ai eu le plaisir d’effectuer à travers mes études graduées. Ces chapitres sont sous forme d'articles scientifiques rédigés en anglais, tels qu'ils ont été présentés aux éditeurs en vue de leur publication. Quelques modifications dans la disposition des figures permettent un flot continu de l’ouvrage, lequel se termine par une discussion générale appuyée de perspectives de recherche pertinentes.
Articles présentés
Mon aventure au sein des laboratoires des Drs Denis Richard et Mathieu Laplante m’aura permis de participer directement à différentes études et à la rédaction de revues de littérature. Le fruit de ces travaux publiés ou en voie de l’être, doit sa raison aux collaborateurs et collègues exceptionnels que j’ai eu le privilège de côtoyer. La liste qui suit résume les articles découlant de tous mes travaux et collaborations. Les articles précédés d’un cercle représentent ceux qui seront présentés dans cette thèse.
Carter S*, Caron A*, Richard D, Picard F. Role of leptin resistance in the
development of obesity in older patients. Clinical Interventions in Aging.
2013;8:829-44. PMID: 23869170. *Co-premier auteur.
Roffarello BM, Labbé SM, Lenglos C, Caron A, Lanfray D, Samson P, Richard D. The medial preoptic nucleus as a site of the thermogenic and metabolic
actions of Melanotan. The American Journal of Physiology - Regulatory,
Integrative and Comparative Physiology. 2014 Jul 15;307(2):R158-66. PMID: 24808495.
Chabot F*, Caron A*, Laplante M, St-Pierre DH. Interrealationships between
ghrelin, insulin and glucose homeostasis: physiological relevance. World Journal
of Diabetes. 2014 Jun 15;5(3):328-41. PMID: 24936254. *Co-premier auteur. Sood A, Jeyaraju D, Prudent J, Caron A, Lemieux P, McBride H, Laplante M,
Tóth K, Pellegrini L. A Mitofusin-2-dependent inactivating cleavage of Optic
atrophy-1 (Opa1) links dynamic changes in mitochondria architecture and ER contacts in the postprandial mouse liver. Proceedings of the National Academy
of Sciences of the United States of America. 2014; 111(45):16017-22. PMID: 25352671.
o Caron A, Baraboi ED, Laplante M*, Richard D*. DEP domain-containing
mTOR-interacting protein in the rat brain: distribution of expression and potential implication. The Journal of Comparative Neurology. 2015 Jan 1;523(1):93-107.
Labbé SM, Caron A, Bakan, I, Lecompte R, Carpentier A, Laplante M, Richard D. Acute and chronic cold exposures differentially affect energy substrateshandling and contribution in brown adipose tissue thermogenesis. The FASEB
Journal. 2015 Feb 13. pii: fj.14-266247. PMID: 25681456.
Caron A, Richard D, Laplante M. The roles of mTOR complexes in lipidmetabolism. Annual Review in Nutrition. 2015. 35:15.1–15.28. Article sous
presse.
Labbé SM*, Caron A*, Lanfray D*, Monge-Rofarello B, Bartness TJ, Richard D.Hypothalamic control of brown adipose tissue thermogenesis. Revue invitée
soumise à Frontiers in Neuroscience.
Caron A, Labbé SM, Carter S, Roy MC, Lecomte R, Ricquier D, Picard F, Richard D. Molecular PET imaging to investigate the role of Uncoupling Protein2 in brown adipose tissue substrate metabolism. Article en révision.
o Caron A, Labbé SM, Lanfray D, Blanchard P, Richard D*, Laplante M*.
Hypothalamic DEPTOR overexpression improves glucose homeostasis and protects against high-fat diet-induced obesity. *Co-auteur de correspondance.
Article en révision.
Carter S, Miard S, Caron A, St-Pierre P, Anhê F, Sallé S, Charland E, Drolet MC, Lefebvre J, Bossé Y, Laplante M, Rivest S, Marette A Marsolais D, Richard D, Picard F. Loss of OcaB prevents age-associated fat accretion and insulinresistance through browning of white adipose tissue and increased sympathetic drive. Article en préparation.
Landray D, Caron A, Roy MC, Laplante M, Morin F, Leprince J, Tonon MC, Richard D. Involvement of ACBD7 in the control of food intake and energyINTRODUCTION
Le surpoids et l’obésité sont des facteurs de risque importants dans le développement de nombreuses maladies chroniques telles que le diabète de type 2, les maladies cardiovasculaires ainsi que certains cancers (Berrington de Gonzalez, Hartge et al. 2010) (Figure 1). La prévalence de l’excès pondéral est telle, que l’Organisation Mondiale de la Santé (OMS) estime qu’au moins 2,8 million d’adultes en meurent chaque année, ce qui en fait le cinquième facteur de risque de décès au niveau planétaire (WHO 2015). D’autres chiffres préoccupants indiquent qu’en 2014, 39% de la population adulte mondiale était en surpoids, dont 13% était obèse (WHO 2015). L’obésité et le surpoids se traduisent respectivement par un indice de masse corporelle (IMC) égal ou supérieur à 25 et 30 kg/m2, et résultent d’un excès de graisse corporelle attribué à un déséquilibre entre l’apport et la dépense énergétique (Berrington de Gonzalez, Hartge et al. 2010). Ces derniers représentent les deux déterminants indubitables du bilan d’énergie. L’étiologie de l’obésité est aussi complexe que redondante et propose la participation de différentes composantes génétiques, environnementales et métaboliques (van der Klaauw and Farooqi 2015). Malheureusement, bien que plusieurs mécanismes aient été révélés, les tentatives cliniques échouent à traiter l’obésité et ses comorbidités et la chirurgie bariatrique, bien qu’imparfaite, représente actuellement l’unique option thérapeutique efficiente (Gautron, Elmquist et al. 2015).
Figure 1. Les complications de l'obésité.
L’obésité est associée à une constellation de comorbidités qui affectent l’ensemble de l’organisme.
Source : http://www.edimark.fr
La compréhension des mécanismes complexes de régulation du bilan d’énergie est essentielle afin de discerner les causes de l'excès pondéral et d'envisager des stratégies de prévention et de traitement efficaces de l’obésité. Il est ainsi essentiel de préciser les mécanismes intégrateurs et régulateurs de la balance énergétique afin d’améliorer la qualité de vie de millions d’individus. Le contrôle de la prise alimentaire et de la dépense énergétique étant sous la gouverne de communications hautement coordonnées par différentes voies neurobiologiques cognitives ou autonomes, le système nerveux central (SNC) assure une régulation fine du métabolisme énergétique (Schwartz, Woods et al. 2000, Gautron, Elmquist et al. 2015). Plus précisément, l’hypothalamus héberge des centres neuronaux qui jouent un rôle majeur dans l’intégration des signaux associés à l’état nutritionnel et aux réserves énergétiques, tels que certaines hormones (insuline, leptine, ghréline) et nutriments (acides aminés, acides gras,
glucose) (Dietrich and Horvath 2013). Cette fonction maitresse est assurée par des réseaux interconnectés de neurones qui expriment de nombreux récepteurs et qui produisent différents peptides et neurotransmetteurs nécessaires à la régulation autonome de l’homéostasie énergétique (Schwartz, Woods et al. 2000, Morton, Cummings et al. 2006). L’intégration des signaux périphériques est altérée dans les cas d’obésité, et des perturbations dans la détection de ces signaux sont associées à l’accumulation de masse grasse et à des dérégulations de l’homéostasie glucidique (Elmquist, Coppari et al. 2005, Hill, Xu et al. 2009). Ces observations démontrent la pertinence de l’intégration hypothalamique des hormones/nutriments dans la régulation du bilan d’énergie ainsi que dans la physiopathologie de l’obésité et des complications métaboliques qui y sont rattachées. Il est ainsi primordial d’identifier et de caractériser les interactions des signaux hormonaux et nutritifs et les différents neurones impliqués dans la régulation du bilan d’énergie. L’identification des acteurs protéiques et cellulaires qui contrôlent ces interactions représente incontestablement la clé de la compréhension.
1. La régulation du bilan d’énergie
Au-delà de l’importance de l’intégration périphérique du statut énergétique et de la régulation du métabolisme, le processus d’apprentissage représente une étape foncière dans le contrôle de la prise alimentaire. En fait, tout être vivant doit avant tout apprendre à subsister avec la nourriture et l’environnement de manière à savoir ce qui est bénéfique ou néfaste. La prise alimentaire est le résultat d’une séquence comportementale complexe qui résulte de l’intégration au niveau central des signaux métaboliques de faim et de satiété, des propriétés organoleptiques de la nourriture, tels le goût et l’odeur, ainsi que des facteurs émotionnels, incluant le stress, l’anxiété et l’humeur (Berthoud 2006, Berthoud 2007, Berthoud 2012) (Figure 2). Le simple fait de penser à de la nourriture suffit à induire plusieurs réponses physiologiques, incluant la production de salive, d’acide gastrique et d’insuline, en modulant l’activité neuronale de certaines régions spécifiques du cerveau impliquées dans les contrôles cognitifs et le comportement alimentaire
(Arana, Parkinson et al. 2003, Berthoud 2007). De plus, la satisfaction que procure un repas ou un élément palatable (agréable au goût) exerce aussi des actions importantes sur la régulation centrale du bilan d’énergie (Volkow, Wang et al. 2013). Conséquemment, le contrôle de la prise alimentaire et de la dépense énergétique peut être représenté comme étant sous la gouverne de voies neurobiologiques, soit cognitives ou autonomes (Richard 2015). Ces circuiteries incluent (i) un réseau cortical exécutif responsable de la maitrise de soi
(self-control) sur la prise alimentaire, (ii) un circuit de la récompense, aussi appelé
système hédonique, comprenant des réseaux interconnectés de neurones impliqués dans les aspects liés à la satisfaction, au plaisir et à la motivation de manger, et (iii) un circuit autonome de régulation de la balance énergétique qui module à la fois les activités du réseau exécutif et du système hédonique, tout en contrôlant la dépense énergétique et la nécessité physiologique de s’alimenter (Figure 2). Ces différentes circuiteries permettent ainsi de former le réseau de l’appétit du cerveau (brain appetitive network), qui gouverne ainsi l’appétence envers la nourriture. Ce dernier se distingue du réseau autonome (ou métabolique) constitué essentiellement de l’hypothalamus et du tronc cérébral (Richard 2015).
Figure 2. Circuits neuronaux impliqués dans le comportement alimentaire.
Des circuits dopaminergiques du striatum (2), de l’aire tegmentale ventrale (5) et de l’amygdale (7) forment le circuit de la récompense (wanting). Des circuits essentiellement opioïdes tels que le noyau accumbens et le pallidum ventral (4) sont aussi liés au circuit de la récompense (liking). Ces régions cérébrales s’intègrent et s’associent à l’hypothalamus (6), l’hippocampe (3), les aires corticales (1) et certaines régions du tronc cérébral (8) afin de réguler l’appétit et la prise alimentaire. À ceux-ci s’associe également le cortex somatosensoriel (9). Adaptation de van der
Klaauw et Farooqi 2015.
1.1. Le réseau cortical exécutif
Le réseau cortical exécutif régule de nombreux processus cognitifs complexes, incluant la résolution de problèmes, le raisonnement déductif, le contrôle émotionnel, la planification et la mémoire fonctionnelle (Berthoud 2007, Dallman 2010). Conséquemment, des dysfonctions du réseau cortical exécutif sont à l’origine de troubles antisociaux ou d’usage abusif de substances (Riggs,
Spruijt-Prise de décision/ évaluation 1 2 3 4 5 6 7 8 9 Stimulus homéostasique Hedonisme/ liking Saillance incitative/ wanting Signaux hormonaux de satiété Apprentissage/ mémoire Goût/ odeur Comportement alimentaire
Metz et al. 2010). Il n’est donc pas étonnant que ce dernier soit responsable du contrôle personnel sur la prise de nourriture. Bien que la prise alimentaire soit un comportement principalement induit par des nécessités physiologiques, la décision consciente de tout individu à prendre ou non la fourchette repose sur un comportement volontaire, sous la gouverne du réseau cortical exécutif. En fait, la décision de s’engager à manger est principalement imputable aux cortex préfrontal et cingulaire antérieur (Vainik, Dagher et al. 2013). Plus précisément, le cortex somatosensoriel inclus (i) le cortex sensoriel viscéral qui perçoit et oriente les informations sensorielles de la cavité buccale et du tractus digestif, (ii) le cortex piriforme qui assure l’intégration des odeurs, et (iii) le cortex temporal qui relaye les informations visuelles (Berthoud 2002) (Figure 2). D’un point de vue rationnel, il serait attendu qu’une commande interne associée à un déficit énergétique motive sans limitation, pour des raisons de survie, l’action de manger. Pourtant, nous gardons en tout temps le pouvoir volontaire de ne pas consommer d’aliments grâce au contrôle cognitif. Nous choisissons donc de supprimer ou de repousser un repas, en fonction de notre quotidien. Notre volonté acharnée à perdre du poids peut aussi conduire à une restriction volontaire cognitive, une situation où nous privilégions une abstraction inconditionnelle des signaux de la faim, au profit de ce corps de plage tant désiré. C’est donc à travers cette collection de facteurs comportementaux que notre inconscient dicte la prise alimentaire, bien au-delà des nécessités physiologiques.
Le contrôle émotionnel cognitif peut ainsi jouer un rôle considérable dans l’obésité puisque l’humeur, particulièrement négative, est liée à une augmentation de la prise alimentaire (Greeno and Wing 1994, Tice, Bratslavsky et al. 2001). La fonction cognitive exécutive peut aussi être à l’origine de dérégulations de la prise alimentaire telle que la surconsommation d’aliments palatables (Riggs, Spruijt-Metz et al. 2010). De ce fait, la palatabilité d’un aliment, bien qu’elle implique également le circuit de la récompense étant donné les impulsions motivationnelles qu’elle implique, fait aussi appel à la capacité de faire face aux influences affectives (Schroeder, Binzak et al. 2001, Grigson 2002). Un individu devrait donc cognitivement avoir la capacité de renoncer à l’ingestion d’un tel aliment. Toutefois,
comme l’environnement obésogène dans lequel la société actuelle est plongée incite à la suralimentation (Dietrich, Federbusch et al. 2014), cette impulsivité envers la nourriture principalement palatable exacerbe les problèmes (Bongers, van de Giessen et al. 2014). D’ailleurs, l’impulsivité, définie comme une tendance à adopter un comportement sans réfléchir aux conséquences, est un prédicteur important de l’obésité (Jansen, Nederkoorn et al. 2009, Sutin, Ferrucci et al. 2011). Par conséquent, l’intégrité du cortex préfrontal à permettre une discipline appropriée envers l’ingestion d’aliments est nécessaire au maintien de la balance énergétique (Volkow, Wang et al. 2013). Le cortex préfrontal fonctionne parallèlement et est influencé par le plaisir que procure la nourriture, lequel s’intègre au circuit de la récompense.
1.2. Le circuit de la récompense
Les composantes hédonique et motivationnelle de la prise alimentaire dont l’intégration est assurée par différents circuits neuronaux, incluant les systèmes mésolimbique dopaminergique, opioïde et endocannabinoïde, jouent également un rôle majeur dans la régulation du poids corporel (Richard 2015). En fait, la satisfaction de manger comporte deux composantes dissociables : une composante hédonique (liking), correspondant à l’appréciation affective que procure la nourriture, et une composante dynamique de désir ou d’appétit (wanting) (Richard 2015). Certains aliments, dont les aliments palatables, ont une saillance incitative qui les rend plus désirables. Par contre, au-delà du désir et de l’appréciation (le désir de ce que l’on aime) réside le sentiment de récompense que procurent certains aliments. C’est d’ailleurs suite à des stimulations électriques dans des régions cérébrales précises que la notion d’hédonisme est venue enrichir la littérature dans les années 50 (Dagher 2012). Le sentiment de récompense ou de renforcement associé à la stimulation de certaines régions est aussi intimement lié aux abus de substances, d’où la relation entre les addictions alimentaires et l’usage de drogues, reconnue depuis 1916 (Dagher 2009). D’ailleurs, des études portant sur la toxicomanie ont montré une circuiterie neurobiologique étonnamment similaire entre l’usage abusif de drogues et la récompense naturelle que procure la
nourriture (Dagher 2009). D’un point de vue mécanistique, on observe une réduction similaire de la disponibilité des récepteurs à la dopamine au niveau du striatum dorsal chez les individus obèses ou dépendants à la cocaïne (Volkow and Wise 2005). Au plan observationnel, on constate le pouvoir du circuit de la récompense sur notre convoitise envers les aliments sucrés et gras. De ce fait, le plaisir engendré par l’ingestion d’aliments sucrés et gras se répercute sur l’ensemble de notre régulation métabolique.
1.3. La régulation autonome du bilan d’énergie
La régulation autonome implique une circuiterie qui intègre une variété de nutriments et d’hormones pour produire différentes réponses systémiques. Cette régulation implique à la fois la prise alimentaire et la dépense énergétique, et est en constante relation avec de nombreuses régions cérébrales influencées par des composantes à la fois physiologiques, cognitives et hédoniques (Richard 2015). Bien que la section qui suit mettra l’emphase sur l’importance de l’hypothalamus, la régulation autonome du bilan d’énergie implique également des régions du tronc cérébral qui jouent un rôle majeur et qui se doivent d’être tout autant considérées (Schneeberger, Gomis et al. 2014). L’intégration de ces signaux ainsi que les réponses qu’ils induisent reposent sur différents mécanismes intracellulaires que la communauté scientifique commence tout juste à révéler.
1.3.1. Historique
Pendant longtemps, la régulation homéostatique de la prise alimentaire reposait sur un modèle (dual-center hypothesis) impliquant deux noyaux hypothalamiques importants : l’hypothalamus latéral (lateral hypothalamus; LH), alors reconnu comme étant le centre de la faim, et l’hypothalamus ventromédian (ventromedial hypothalamus; VMH), dont on attribuait la fonction de centre de la satiété (Teitelbaum and Stellar 1954). Ce modèle s’est avéré partiellement faux à mesure que les connaissances sur la régulation centrale se sont accumulées. Il n’en demeure pas moins que cette conception primaire a permis d’établir les bases des connaissances actuelles en proposant un modèle simple couplant intégration
et réaction (régulation). Dans les faits, ce modèle dérive originalement d’observations cliniques chez des patients atteints d’un syndrome de Fröhlich (aussi nommé syndrome adiposo-génital ou de Babinski), une situation initialement considérée comme résultante d’une tumeur hypothalamique, associée à une obésité et un hypogonadisme (Brobeck 1946). Toutefois, ce n’est qu’en 1940 qu’on attribue une réelle origine hypothalamique à l’obésité lors d’études classiques de lésions/stimulations de noyaux précis (Hetherington and Ranson 1940). En effet, tandis que des lésions au niveau du VMH induisent une hyperphagie considérable et une obésité conséquente, la stimulation de cette structure entraine l’arrêt complet de la prise de repas chez les rongeurs. À l’opposée, la lésion du LH entraine une aphagie sévère (Anand and Brobeck 1951), alors que la stimulation de cette structure force l’alimentation même en situation de rassasiement. À ce modèle vient se greffer les premières hypothèses d’intégration et de régulation, qui considèrent alors que la faim est conséquente à certaines stimulations (hypoglycémie), alors que la satiété émane de signaux périphériques opposés (hyperglycémie) (Saper, Chou et al. 2002). Cette conception basée sur l’état glycémique correspond à l’une des premières hypothèses de régulation du bilan d’énergie, la théorie glucostatique, à laquelle vient s’ajouter l’hypothèse lipostatique et la conception des signaux de satiété (Kennedy 1953, Mayer and Thomas 1967, Gibbs, Young et al. 1973). L’utilisation de techniques stéréotaxiques plus précises permettra plus tard de définir que des lésions strictes du VMH ne sont pas efficaces à produire une hyperphagie, mais que des lésions plus dorsales, au niveau de l’hypothalamus paraventriculaire (paraventricular
hypothalamus; PVH), sont davantage compétentes (Gold 1973). Bien que cette
étude invalide à la fois la dual-center hypothesis et l’implication du VMH dans la satiété, ce noyau représente toujours un acteur important du métabolisme énergétique (Yi, Scherer et al. 2011). Avec ses partenaires hypothalamiques, il correspond encore à l’une des composantes clés du bilan d’énergie.
1.3.2. Régulation du bilan d’énergie par l’hypothalamus médio-basal
Les molécules assurant l’intégration et la régulation de la balance énergétique sont exprimées dans des régions cérébrales précises, telle que l’hypothalamus médio-basal (mediobasal hypothalamus; MBH), localisé au niveau du plancher de l’hypothalamus, adjacent au troisième ventricule cérébral. L’importance du MBH dans la régulation autonome de la balance énergétique a été mise en évidence par différents groupes de recherche qui lui ont associé un rôle intégrateur et régulateur lui permettant de dicter les réponses physiologiques en fonction des besoins (Sainsbury and Zhang 2010, Coll and Yeo 2013, Joly-Amado, Cansell et al. 2014). Le MBH regroupe deux noyaux clés dans la régulation de la prise alimentaire et de la dépense énergétique : le noyau arqué (arcuate nucleus; ARC) et le VMH. L’ARC et le VMH reçoivent différentes afférences et projettent vers de nombreux centres hypothalamiques et extra-hypothalamiques, les plaçant stratégiquement au milieu de l’intégration et de la coordination du bilan d’énergie (Figures 3 et 4).
Cette régulation autonome de la balance énergétique implique à la fois le contrôle de la prise alimentaire et de la thermogenèse. Cette dernière est essentiellement dépendante du tissu adipeux brun, un organe possédant la propriété exceptionnelle de découpler la chaîne respiratoire de la mitochondrie afin de profiter du gradient électrochimique pour produire de la chaleur (Cannon and Nedergaard 2004). Le potentiel thermogénique du tissu adipeux brun doit son origine à la présence singulière de la protéine découplante 1 (UCP1), une protéine localisée dans la membrane interne de la mitochondrie. Cette dernière est responsable de la dissipation du gradient de proton, un évènement de découplage permettant au tissu adipeux brun d’effectuer son rôle de radiateur biologique (Richard and Picard 2011). Physiologiquement, l’activation du tissu adipeux brun est sous la dépendance du système nerveux sympathique (Murano, Barbatelli et al. 2009, Bartness, Vaughan et al. 2010). De ce fait, les adipocytes bruns expriment de nombreux récepteurs β3-adrénergiques leur permettant d’être stimulés lors d’un relargage de noradrénaline par les fibres efférentes
postganglionnaires (Bachman, Dhillon et al. 2002, Jimenez, Leger et al. 2002, Lowell and Bachman 2003). Conséquemment, de nombreux centres neuronaux gouvernent l’activité thermogène du tissu adipeux brun, incluant le MBH (Richard and Picard 2011), d’où émanent principalement les commandes du système mélanocortine (Song, Vaughan et al. 2008) et du VMH (Choi, Fujikawa et al. 2013) (Figures 3 et 4).
Figure 3. L'hypothalamus médio-basal.
(A) Plan sagittal du cerveau du rongeur indiquant la localisation de l’hypothalamus. (B) Plan coronal du cerveau du rongeur indiquant la localisation du VMH. (C) Section coronale d’un cerveau ayant une coloration Nissl (haut) et la shématisation de la même région qui inclue le VMH et l’ARC (bas). (D) Schéma présentant la disposition des différents gènes exprimés dans le VMH. On constate la présence de SF-1 et LEPR dans la région dorso-médiale. Abréviations : ARC, noyau arqué; BDNF, facteur neurotrophique dérivé du cerveau; DMH, hypothalamus dorsomédial; ERα, estrogen
receptor α; IR, récepteur de l’insuline; LEPR, récepteur de la leptine; SF-1, steroidogenic factor 1;
VMH, hypothalamus ventro-médial. (Adaptation de Choi, Fujikara et al. 2013).
Plan sagittal Plan coronal
1.3.2.1. Le noyau arqué
Les neurones afférents primaires (ou neurones de premier ordre) de l’ARC projettent vers des neurones de deuxième ordre dans différentes régions cérébrales, incluant le PVH, impliqué dans la régulation des fonctions neuroendocrines et autonomes (Figure 4) (Ghamari-Langroudi, Srisai et al. 2011). Ce duo ARC-PVH est impliqué de façon remarquable dans la régulation de la balance énergétique. L’ARC émet également de nombreuses projections vers le VMH, le LH, l’hypothalamus dorsomédian (dorsomedial hypothalamus; DMH) et l’aire préoptique (preoptic area; POA). La manière dont l’hypothalamus relaie les informations homéostatiques vers le brain appetitive network n’est pas formellement caractérisée, mais pourrait impliquer un axe hypothalamus-thalamus-striatum ou encore hypothalamus-tronc-hypothalamus-thalamus-striatum (Kelley, Baldo et al. 2005, Carter, Soden et al. 2013, Shah, Vong et al. 2014, Richard 2015).
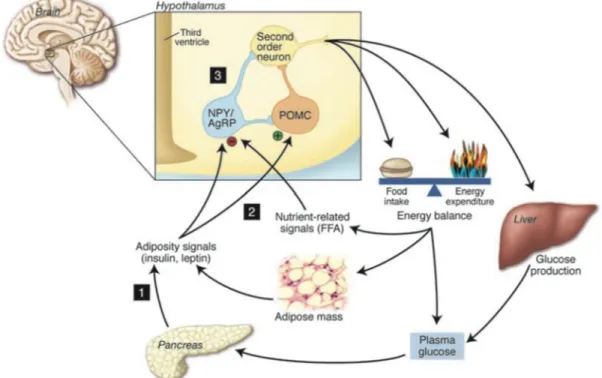
Figure 4. Régulation du bilan d'énergie par le noyau arqué.
Le modèle neurocentrique implique que des défauts dans l’intégration des signaux périphériques perturbent la balance énergétique et conduisent au développement de l’obésité. Des défauts (1) dans la sécrétion ou la voie de signalisation de l’insuline et de la leptine, (2) dans la perception du
augmentation de la prise alimentaire au détriment de la dépense énergétique, de même qu’à une augmentation de la production hépatique du glucose. Ceci implique une circuitrie composée des neurones de 1re ordre de l’ARC (NPY/AgRP et POMC/CART) qui projètent vers les neurones de 2e ordre situés dans diverses régions cérébrales. Abréviations : AgRP, agouti-related peptide; FFA, acides gras libres; NPY, neuropeptide Y; POMC, pro-opiomélanocortine. (Source : Schwartz et
Porte 2005).
Au cours des dernières années, la communauté scientifique a particulièrement insisté sur le rôle métabolique joué par deux populations neuronales situées dans l’ARC. Ces régulateurs prototypiques de la balance énergétique s’antagonisent quant à leurs actions sur la balance énergétique. En fait, l’une d’elle, considérée comme catabolique (stimule la dépense énergétique) et anorexigène (réduit la prise alimentaire), co-synthétise la pro-opiomélanocortine (POMC) et la cocaine and amphetamine-regulated transcript (CART), tandis qu’une population aux propriétés anaboliques (réduit la dépense énergétique) et orexigène (stimule l’appétit), co-exprime le neuropeptide Y (NPY) et l’agouti-related
peptide (AgRP) (Figure 4) (Elmquist, Elias et al. 1999). Les neurones POMC/CART
et NPY/AgRP ont longtemps été considérés comme les régulateurs primaires centraux de l’homéostasie énergétique (Elmquist, Elias et al. 1999, Williams and Schwartz 2005), d’où l’importance des acquis actuels en ce qui les concerne. L’émergence de nouvelles technologies, incluant l’optogénétique et la transgenèse ciblée, permet toutefois d’apprécier la complexité débordante de ce système ainsi que l’étendue du nombre de participants (Tableau 1).
Tableau 1. Modèles génétiques d'obésité attribuée au SNC.
(Adaptation de Sohn, Elmquist et Williams 2013)
Abréviations : Agrp, agouti-related peptide ; ChAt, choline O-acetyltransferase ; Foxo1, forkhead
box protein O1 ; Insr, récepteur de l’insuline ; Lepr, récepteur de la leptine ; Mc3/4r, récepteur de la
mélanocortine 3/4; Npy, neuropeptide Y ; Npy1/2/4/5r, récepteurs du neuropeptide Y ; Phox1b, paired-like homeobox 2b ; Pik3r1, sous-unité régulatrice de la PI3K ; Pomc, pro-opiomélanocortine ; Rictor, rapamycin insensitive companion of mTOR ; SF-1, steroidogenic factor-1 ; SIM1,
single-minded 1 ; Vgat, transporteur vésiculaire du GABA ; Vglut2, transporteur vésiculaire du glutamate. Mélanocortines
Délétion de Pomc ↑↑↑ ND ND ↑ ND ND
Délétion de Mc3r ↑↑ ↔ ↑ ↔ ↔ ↓↓
Délétion de Mc4r ↑↑↑ ↑↑ ↑↑ ↑ ↓ ND
Mc4r exprimé seulement dans les neurones SIM1 ↑ ↑ ↑ ↔ ↓ ND Mc4r exprimé seulement dans les neurones ChAT ↑↑ ↑↑ ↑ ↑ ↑ ↔ Mc4r exprimé seulement dans les neurones Phox2b ↑↑↑ ↑↑ ↑↑ ↑ ↔ ↔
NPY/AgRP
Délétion de Npy ↔ ND ↔ ↔ ND ↔
Délétion de Agrp ↔ ND ↔ ↔ ND ND
Délétion de Npy et Agrp ↔ ND ↔ ↔ ND ↔
Délétion de Npy1r ↑ ↔ ↑ ↓ ↓ ND
Délétion de Npy2r ↑ ↔ ↑ ↑ ND ND
Délétion de Npy4r ↓ ND ↓ ND ND ND
Délétion de Npy5r ↑ ND ↑ ↑ ND ND
Leptine
Souris db/db ou ob/ob ou délétion de Lepr ↑↑↑ ↔ ↑↑ ↑ ↓ ↓
Délétion de Lepr dans les neurones POMC ↑ ↔ ↑ ↔ ↓ ↓
Délétion de Lepr dans les neurones SF1 ↑ ↔ ↑ ↔ ↓ ND
Délétion de Lepr dans les neurones POMC et SF1 ↑↑ ↔ ↑↑ ↔ ↓ ND
Délétion de Lepr dans les neurones AgRP ↑ ↔ ↑ ↔ ↓ ↓
Délétion de Lepr dans les neurones POMC et AgRP ↑↑ ↔ ↑↑ ↔ ↓ ↓ Délétion de Lepr dans les neurones Phox2b ↔ ↔ ↔ ↑ ↑ ↔ Délétion de Lepr dans les neurones Vglut2 ↑ ↔ ↑ ↔ ND ND Délétion de Lepr dans les neurones Vgat ↑↑↑ ↑ ↑↑ ↑ ND ND Lepr exprimé seulement dans les neurones POMC ↑↑ ↔ ↑ ↑ ↓ ↑
Insuline
Délétion de Insr dans le cerveau ↑↑ ND ↑ ↑ ND ND
Délétion de Insr dans les neurones POMC ↔ ND ↔ ↔ ND ↔ Délétion de Insr dans les neurones AgRP ↔ ND ↔ ↔ ND ND
Délétion de Insr dans les neurones SF1 ↓ ND ↓ ↔ ↔ ↔
Délétion de Pik3r1 dans les neurones POMC ↔ ↔ ↔ ↔ ↔ ↔ Délétion de Pik3ca dans les neurones POMC ↑ ↔ ↑ ↔ ↓ ↔ Délétion de Pik3ca dans les neurones SF1 ↑ ↔ ↑↑ ↔ ↓ ↔ Délétion de Rictor dans les neurons Nestin ↔ ↓ ↑ ↔ ↓ ↔ Délétion de Rictor dans les neurones POMC ↑ ↔ ↑ ↑ ↔ ND Délétion de Rictor dans les neurones AgRP ↔ ↔ ↔ ND ND ND
Délétion de Foxo1 dans les neurones POMC ↓ ↑ ↓ ↓ ↔ ↓
Délétion de Foxo1 dans les neurones SF1 ↑↑ ↓ ↓ ↔ ↑ ↔
Activité physique Modèles génétiques par systèmes corporelPoids maigreMasse grasseMasse alimentairePrise énergétiqueDépense
1.3.2.1.1. Le duel POMC-AgRP et le système aux mélanocortines
L’importance des neurones POMC dans la régulation du bilan d’énergie est telle que la délétion du gène Pomc induit une obésité hyperphagique sévère (Yaswen, Diehl et al. 1999). Les neurones POMC et AgRP forment, avec les récepteurs aux mélanocortines de type 3 et 4 (MC3R et MC4R), le système aux mélanocortines (Millington 2007, Mountjoy 2010, Pandit, de Jong et al. 2011, Renquist, Lippert et al. 2011, Girardet and Butler 2014). Plus précisément, la POMC est une pro-hormone qui subit des processus de protéolyse menant à la production de différents petits peptides, dont l’alpha-melanocyte-stimulating
hormone (α-MSH), un agoniste très puissant de MC3R et MC4R (Huszar, Lynch et
al. 1997, Butler and Cone 2002), tandis qu’AgRP représente un agoniste inverse de ces récepteurs (Ollmann, Wilson et al. 1997). Une étude récente indique également que AgRP représente un agoniste ‘biaisé’ de MC4R capable d’hyperpolariser certaines populations de neurones (Ghamari-Langroudi, Digby et al. 2015). Cette étude suggère donc que différentes sous-populations de neurones MC4R, jusqu’ici considérées identiques de par l’expression de récepteurs spécifiques, peuvent être stimulées ou inhibées par les mêmes ligands, dépendamment de la situation physiologique. Par conséquent, notre conception actuelle des liens entre les neurones de premier et de deuxième ordre (Figure 4) représente certainement une sur-simplification de la réalité. L’identification de marqueurs spécifiques à ces sous-populations permettra indubitablement une meilleure appréciation de la complexité des circuits neuronaux liés à la régulation du bilan d’énergie.
Il est important de noter que des mutations dans le gène Mc4r sont aussi suffisantes à induire une obésité sévère, tant chez le rongeur que chez l’humain (Huszar, Lynch et al. 1997, Yeo, Lank et al. 2003). En plus de réguler la balance énergétique, le système aux mélanocortines module également l’homéostasie du glucose et des lipides, indépendamment de ses effets sur l’équilibre énergétique (Balthasar, Dalgaard et al. 2005, Nogueiras, Wiedmer et al. 2007, Rossi, Balthasar et al. 2011). Il y actuellement une éclosion d’informations sur l’identité des populations neuronales exprimant MC4R et leurs fonctions respectives (Xu,
Elmquist et al. 2011). Par exemple, les neurones MC4R du PVH et de l’amygdale sembleraient d’avantage impliqués dans la régulation de la prise alimentaire (Balthasar, Dalgaard et al. 2005). De leur côté, les neurones MC4R localisés au niveau de la colonne intermédiolatérale, un relais majeur permettant entre autres la régulation de l’activité thermogénique du tissu adipeux brun (Uno and Shibata 2001), seraient impliqués dans la sensibilité à l’insuline hépatique et la thermogenèse (Rossi, Balthasar et al. 2011), tandis que ceux exprimés dans le noyau dorsal du nerf vague (10N) seraient principalement impliqués dans la production pancréatique d’insuline (Rossi, Balthasar et al. 2011). Les neurones MC3R jouent également un rôle pivot dans la régulation de la dépense énergétique et la sensibilité au développement de l’obésité (Butler, Kesterson et al. 2000, Chen, Marsh et al. 2000). Toutefois, leur implication dans la régulation de la prise alimentaire n’est pas parfaitement claire étant donné certaines divergences entre les études (Butler, Kesterson et al. 2000, Chen, Marsh et al. 2000). Il semblerait que le rôle de MC3R soit majoritairement orienté vers le contrôle circadien de la prise alimentaire et de l’homéostasie du glucose (Chen, Marsh et al. 2000, Sutton, Begriche et al. 2010). La découverte de différents marqueurs moléculaires spécifiques aux différents noyaux cérébraux a mené à l’éclosion spectaculaire de nombreux modèles animaux (Tableau 1) qui permettront certainement de comprendre le rôle de chacune des populations du système mélanocortine dans la régulation du métabolisme énergétique.
1.3.2.1.2. Les neurones orexigènes NPY/AgRP
Le NPY représente l’un des agents ayant le plus grand potentiel orexigène (Lin, Boey et al. 2004). Il fait partie d’une famille qui inclut des peptides structuralement similaires, le peptide YY (PYY) et le polypeptide pancréatique (PP) (Loh, Herzog et al. 2015). Le NPY exerce ses effets orexigènes par l’entremise de différents récepteurs couplés aux protéines G (NPY1R, NPY2R, NPY4R et NPY5R). La délétion de ces récepteurs s’est avérée responsable d’effets divergents sur le poids corporel (Tableau 1). En effet, tandis que l’ablation de NPY1R, NPY2R et NPY5R augmente le gain de poids, celle de NPY4R le diminue
responsable des effets du système NPY dans la reproduction plutôt que dans la régulation du poids corporel (Sainsbury, Schwarzer et al. 2002). Tandis que les propriétés anorexigènes des neurones POMC sont indiscutables, des questions demeurent sur les propriétés métaboliques des neurones NPY/AgRP (Tableau 1). En fait, la délétion de NPY et/ou AgRP ne semble induire aucune anomalie chez la souris (Qian, Chen et al. 2002). Ces résultats sont particulièrement étonnant, considérant que l’administration centrale de ces peptides augmente fortement la prise alimentaire et le poids corporel (Pierroz, Catzeflis et al. 1996, Ollmann, Wilson et al. 1997).
Des études plus récentes, ayant recours à de nouvelles technologies, semblent indiquer que de probables compensations génétiques sont à l’origine de l’absence de phénotype suite à la délétion embryonnaire de NPY/AgRP (Bewick, Gardiner et al. 2005, Gropp, Shanabrough et al. 2005, Luquet, Perez et al. 2005). En fait, ces investigations suggèrent que d’autres populations neuronales pourraient subir des changements adaptatifs durant le développement embryonnaire, incluant les neurones POMC (Xu, Elmquist et al. 2011). Dans une étude, des chercheurs ont sélectivement induit la délétion d’AgRP chez des souris adultes, en utilisant un modèle de Cre-recombinase inductible, couplé aux propriétés du modèle d’induction au récepteur de la toxine diphtérique (Gropp, Shanabrough et al. 2005). Suite à l’injection de toxine diphtérique à des souris adultes, ils ont ainsi observé une réduction rapide et massive de la prise alimentaire et du poids corporel (Gropp, Shanabrough et al. 2005). D’autres investigations ayant recours à des technologies de pointe ont permis d’obtenir les mêmes conclusions (Bewick, Gardiner et al. 2005, Xu, Kaelin et al. 2005, Aponte, Atasoy et al. 2011, Krashes, Koda et al. 2011). Notons par exemple l’utilisation de l’optogénétique, qui a permis de stimuler uniquement les neurones AgRP/NPY, une action qui induisant la prise alimentaire (Aponte, Atasoy et al. 2011). Un autre exemple fascinant est la technologie designer receptors exclusively activated by
designer drugs (DREADD) (Alexander, Rogan et al. 2009, Ferguson, Eskenazi et
al. 2011), qui a permis d’identifier qu’une dépolarisation des neurones AgRP/NPY conduit également à l’ingestion d’aliments (Krashes, Koda et al. 2011). Ces
observations renforcent la notion de nécessité de modèles plus spécifiques et non-embryonnaires pour l’étude future des différentes populations neuronales.
Les neurones NPY/AgRP produisent également le γ-aminobutyric acid (GABA), un neurotransmetteur classique impliqué dans la régulation du poids corporel (Gropp, Shanabrough et al. 2005, Flier 2006, Tong, Ye et al. 2008). Incidemment, le GABA permet aux neurones NPY/AgRP de réguler la balance énergétique, principalement en modulant négativement l’activité des neurones POMC (Mercer, Hentges et al. 2013), mais aussi en affectant certains neurones du noyau parabrachial (Wu, Boyle et al. 2009). En générant un modèle de souris portant une délétion de vesicular GABA transporter (VGAT) spécifiquement dans les neurones NPY/AgRP, il a été effectivement possible de montrer une réduction du poids corporel attribuable à une augmentation de la dépense énergétique (Tong, Ye et al. 2008). Les neurones NPY/AgRP peuvent donc promouvoir la survie en favorisant la prise alimentaire et en prévenant la dépense énergétique, principalement en conditions de jeûne.
1.3.3. L’hypothalamus ventromédian et les neurones SF-1
Le VMH représente un groupe bilatéral de cellules disposées en forme d’élipse et localisées de part et autre du troisième ventricule cérébral (Figure 3). Son rôle métabolique est tout aussi important que celui de l’ARC. De ce fait, depuis les études classiques de lésions de Hetherigton et Ranson (Hetherington and Ranson 1940), de nombreuses investigations ont démontré son implication dans la régulation de la balance énergétique. Le VMH comprend des neurones qui expriment de nombreux récepteurs métaboliques, incluant les récepteurs à la leptine (LEPR) et à l’insuline (IR) (King 2006, Kim, Sohn et al. 2011, Yi, Scherer et al. 2011) (Figure 3). De plus, le VMH est le seul noyau cérébral à posséder des neurones exprimant le steroidogenic factor 1 (SF-1, aussi connu sous le nom de NR5A1), lesquels sont impliqués dans la régulation du poids corporel ainsi que dans la thermogénèse (Majdic, Young et al. 2002) (Figure 3). Il est important de noter que SF-1 est nécessaire au développement de la cytoarchitecture du VMH, et que ce facteur de transcription exerce des fonctions affectant à la fois la
dépense énergétique et le métabolisme du glucose (Tran, Akana et al. 2006, Kim, Sohn et al. 2011, Kim, Zhao et al. 2011, Yi, Scherer et al. 2011, Kim, Donato et al. 2012, Choi, Fujikawa et al. 2013). En effet, l’administration de leptine directement dans cette structure est suffisante à augmenter le captage du glucose dans le muscle squelettique, le cœur et le tissu adipeux brun (Kamohara, Burcelin et al. 1997, Haque, Minokoshi et al. 1999, Minokoshi, Haque et al. 1999, Toda, Shiuchi et al. 2009, Kim, Donato et al. 2012, Lindberg, Chen et al. 2013). Ces résultats indiquent une relation entre le VMH et les différents tissus métaboliques, appuyée par des évidences selon lesquelles l’intégrité du système nerveux sympathique est nécessaire aux effets systémiques du VMH (Kim, Sohn et al. 2011). De plus, la délétion de SF-1 dans le VMH conduit à une réduction de la thermogenèse (Kim, Sohn et al. 2011, Kim, Zhao et al. 2011). L’importance des neurones SF-1 du VMH est aussi appuyée par des études montrant que la délétion de différentes composantes des voies de la leptine ou de l’insuline (Tableau 1) conduit à un phénotype métabolique particulier (Dhillon, Zigman et al. 2006, Bingham, Anderson et al. 2008, Kim, Li et al. 2010, Kim, Sohn et al. 2011, Xu, Nedungadi et al. 2011, Kim, Donato et al. 2012, Cheung, Kurrasch et al. 2013, Choi, Fujikawa et al. 2013). Les détails de ces résultats seront discutés dans les sections suivantes.
1.3.4. Intégration hormonale et nutritionnelle du MBH
Plusieurs hormones et nutriments représentent des signaux clés de la régulation de la balance énergétique en activant directement les neurones hypothalamiques. La leptine, l’insuline et la ghréline représentent certainement les trois hormones métaboliques les plus étudiées et auxquelles on concède une importance capitale dans la régulation de l’homéostasie énergétique par le MBH (Coppari, Ichinose et al. 2005, Abizaid and Horvath 2008, Woods and D'Alessio 2008, Belgardt and Bruning 2010) (Figure 3). À ces dernières viennent également se greffer les glucagon-like peptides 1 et 2 (GLP-1/2), la cholécystokinine (CCK), l’oxynthomoduline, le PYY, le glucagon et l’amyline, pour ne nommer que celles-ci (Kalra, Dube et al. 1999). Comme les voies de signalisation de la leptine et de l’insuline, en plus d’être les mieux caractérisées, convergent vers des voies