Université de Sherbrooke
Identification et caractérisation d’un nouveau rôle de la sous-unité Gα
sau niveau du compartiment endosomal
Par
Rosciglione Stéphanie Programme de Pharmacologie
Thèse présentée à la Faculté de Médecine et des Sciences de la Santé en vue de l’obtention du grade de Philosophiae doctor (Ph.D.)
en Pharmacologie
Sherbrooke, Québec, Canada 07 Juillet 2015
Membres du jury d’évaluation :
Pre Christine Lavoie, Directrice de thèse, FMSS, UdeS
Pr Terry Hebert, Department of Pharmacology and Therapeutics, McGill University Pr Fernand-Pierre Gendron, Département de Biologie Cellulaire, FMSS, UdeS Pr Michel Grandbois, Directeur du programme de Pharmacologie, FMSS, UdeS Représentant du Doyen, FMSS, Université de Sherbrooke
R
ESUMELa protéine Gαs est une GTPase hétérotrimérique, actrice principale de la
signalisation intracellulaire couplée aux récepteurs couplés aux protéines G (RCPG). Un de ses rôles majeurs est de transmettre l’activation d’un RCPG par un agoniste au niveau de la membrane plasmique, en signal intracellulaire, ceci grâce à un changement conformationnel dû à sa liaison à un GTP. En réponse, la protéine Gαs activera principalement la voie de l’AMP cyclique. Or, depuis
quelques années, la protéine Gαs semble impliquée dans un tout autre phénomène
intracellulaire, qu’est le trafic vésiculaire. En effet, sa localisation au niveau du compartiment endosomal laisse perplexe. Certains ont démontré le couplage de cette sous-unité avec des récepteurs internalisés, induisant une signalisation à partir de la membrane endosomale, tandis que d’autres ont démontré une implication de cette sous-unité au niveau du complexe de triage protéique présent sur la membrane endosomale. Ainsi, l’équipe du Dr Farquhar a démontré l’implication de Gαs avec la protéine hepatocyte growth factor-regulated tyrosine
kinase substrate (HRS) dans la dégradation du récepteur à l’epidermal growth factor (EGF).
A travers nos travaux, nous avons pu démontrer une implication générale de la sous-unité Gαs dans la régulation de la dégradation endosomale de nombreux
récepteurs, comme les RCPG. Nous avons identifié deux complexes, un indépendant et un dépendant. Le premier, ubiquitine-indépendant, implique une interaction directe de la protéine Gαs avec les proteines
GPCR associated sorting protein 1 (GASP-1) et dysbindin. Ces deux protéines ont déjà été démontrées comme étant indispensables à l’adressage du récepteur delta opioïde (DOP) vers le compartiment lysosomal. Nous avons identifié que GASP-1 et dysbindin font le lien entre Gαs et HRS, et induisent l’adressage aux lysosomes
du récepteur DOP, via les complexes endosomal sorting complexes required for transport (ESCRT). Le second complexe identifié, ubiquitine-dépendant, est spécifique au récepteur C-X-C motif receptor 4 (CXCR4). L’adressage de ce récepteur aux lysosomes fait intervenir de nombreuses enzymes ubiquitine-ligases ainsi que des enzymes déubiquitinases. Nous avons démontré que Gαs, via son
interaction directe avec l’E3 ubiquitine ligase Deltex 3 like (DTX3L), module l’activation d’une autre E3 ubiquitine ligase atrophin-1 interacting protein 4 (AIP4) et influence l’état d’ubiquitination du complexe ESCRT0, ceci régulant la dégradation du récepteur CXCR4.
Paradoxalement, nous avons pu remarquer que les complexes identifiés ne semblent pas affecter les récepteurs couplés à Gαs. En effet, les récepteurs
connus pour être couplés à la protéine Gαs, d’un point de vue signalétique,n’ont
pas leur trafic intracellulaire affecté par la déplétion de l’expression de la protéine Gαs. De plus, l’état d’activation de Gαs ne semble pas influencer ces complexes.
S
UMMARYThe Gαs protein is a heterotrimeric GTPase protein, lead actress of
intracellular signaling coupled to G protein-coupled receptors (GPCR). One of its major role is to transmit the binding of a ligand on the GPCR at the plasma membrane in intracellular signaling, thanks to a conformational change due to binding to GTP. In response, the activated Gαs protein will mainly stimulate the way
of cyclic AMP. However, in recent studies, the Gαs protein appears to be involved
in other intracellular phenomenon, like vesicular trafficking, due to its location at the endosomal compartment. Some studies showed the coupling of this subunit with internalized receptors, inducing signaling from the endosomal membrane, while others have shown implication of this subunit in the protein sorting complex presents on the endosomal membrane. Thus, the team of Dr. Farquhar demonstrated the involvement of Gαs protein with hepatocyte growth
factor-regulated tyrosine kinase substrate (HRS) protein, in the epidermal growth factor receptor (EGFR) degradation.
Through our study, we demonstrated a general involvement of Gαs subunit in
the regulation of endosomal degradation of many receptors, such as GPCRs. We identified two complexes, an ubiquitin-independent and an ubiquitin-dependent. The first, ubiquitin-independent one, involves a direct interaction of Gαs protein with
GPCR associated sorting protein 1 (GASP-1) and dysbindin. These two proteins have been previously shown to be essential for delta opioid receptor (DOP) targeting to the lysosomal compartment. We identified that GASP-1 and dysbindin make the link between Gαs and HRS, and induce the DOP receptor addressing to
lysosomes, via complexes with endosomal sorting complex required for transport (ESCRT). The second complex identified is the ubiquitin-dependent complex, which is specific to the CXC motif receptor 4 (CXCR4). The lysosomal sorting of this receptor involves many ubiquitin ligases and deubiquitinases enzymes. We demonstrated that Gαs, through a direct interaction with the E3 ubiquitin ligase
Deltex 3 like (DTX3L), modulates the activation of another E3 ubiquitin Atrophin-1 interacting protein ligase 4 (AIP4) and influences the ESCRT-0 ubiquitination pattern. This complex regulates the CXCR4 receptor degradation.
Paradoxically, we observed that receptors coupled to Gαs are not affected.
Indeed, the receptors known to be coupled to the Gαs protein have not their
intracellular trafficking affected by Gαs depletion. Moreover, Gαs activation state
does not seem to influence these complexes.
Pierre Bidart (1932 – 1995) A toi, qui m’a donné confiance en mon avenir.
« La réussite n'est pas toujours une preuve d'épanouissement, elle est souvent même le bénéfice secondaire d'une souffrance cachée.» Boris Cyrulnik
T
ABLE DES MATIERESRésumé ... ii
Summary ... iii
Table des matières ... vi
Liste des figures ... x
Liste des tableaux ... xi
Liste des abréviations ... xii
Introduction ... 1
I. Les protéines G hétérotrimériques ... 1
1) Découverte ... 1
2) Les sous-unités et la signalisation ... 3
a. Sous-unités Gα ... 3 1. Classe de la sous-unité Gαi ... 7 2. Classe de la sous-unité Gαs ... 8 3. Classe de la sous-unité Gαq/11 ... 9 4. Classe de la sous-unité Gα12/13 ... 9 b. Sous-unités Gβγ ... 10
3) Régulation de la signalisation par les AGS et RGS ... 11
II. Les récepteurs couplés aux protéines G ... 14
1) Généralités ... 14
2) Activation et transduction du signal ... 17
3) Désensibilisation ... 19
b. Recyclage ... 28
c. Dégradation ... 30
1. Mécanistique ubiquitine-indépendante ... 30
2. Mécanistique ubiquitine-dépendante ... 34
3. Les complexes ESCRT ... 36
III. Localisations et rôles atypiques des RCPG et des protéines G ... 43
1) Localisation et signalisation des RCPG dans les compartiments intracellulaires ... 43
a. Les RCPG au niveau du Réticulum endoplasmique ... 43
b. Les RCPG au niveau du noyau ... 45
c. Les RCPG au niveau des endosomes ... 46
1. Signalisation via la protéine Gαs ... 47
2. Signalisation via la β arrestine ... 48
3. Signalisation via AIP4 et STAM ... 50
2) Localisation des protéines G au niveau des compartiments intracellulaires – Implication dans l’expression génique et le trafic vésiculaire . 51 a. Les protéines G au niveau du noyau ... 51
b. Les protéines G au niveau de la mitochondrie ... 52
c. Les protéines G au niveau de l’appareil de Golgi... 53
d. Les protéines G au niveau des endosomes ... 55
Problématique de l’étude ... 57
Hypothèse ... 57
Objectifs ... 58
Articles ... 59
I. Gs regulates the post-endocytic sorting of G-protein coupled receptors.59 1) Avant-Propos ... 59
2) Résumé ... 59 3) Abstract ... 60 4) Introduction ... 60 5) Results ... 62 6) Discussion ... 73 7) Methods ... 79 8) References ... 86 9) Supplementary Information ... 92
II. Gs promotes CXCR4 degradation by modulating ubiquitination of endosomal sorting machinery ESCRT-0 ... 95
1) Avant-Propos ... 95 2) Résumé ... 95 3) Abstract ... 96 4) Introduction ... 96 5) Results ... 99 6) Discussion ... 104 7) Figures ... 108
8) Material and Methods ... 113
9) References ... 118 10) Supplementary Information ... 125 Discussion ... 127 Remerciements ... 139 Références ... 142 Annexes ... 162
II. Annexe 2 : Licence d’utilisation Figure 4 ... 163 III. Annexe 3 : Licence d’utilisation Figure 5 ... 164 IV. Annexe 4 : Preuve de Soumission Article 2 ... 166
L
ISTE DES FIGURESFigure 1 : Cristal d'un dimère de sous-unité Gαs ... 4
Figure 2 : Alignement de séquences des Gαs; i ; z ; 12 et q ... 5
Figure 3 : Schématisation des voies de signalisation des protéines Gα ... 6 Figure 4 : Schématisation des domaines présents dans la structure des différentes RGS et RGS-like humaines ... 12
Figure 5 : Représentation de l’arbre phylogénétique permettant la
classification des RCPG. ... 15 Figure 6 : Schématisation du récepteur β2AR ... 16 Figure 7 : Schématisation du trafic intracellulaire des RCPG. ... 19 Figure 8 : Schématisation de l’internalisation ubiquitine-indépendante des récepteurs dans les vésicules des corps multivésiculaires. ... 30
Figure 9 : Schématisation de l’internalisation ubiquitine-dépendante du récepteur CXCR4, dans les vésicules des corps multivésiculaires. ... 34
Figure 10 : Schématisation des domaines structuraux des protéines
impliquées dans la formation des complexes ESCRT 0, I, II et III. ... 39 Figure 11 : Schématisation de l’intervention des complexes ESCRT dans l’internalisation des RCPG dans les vésicules intraluminales des corps
multivésiculaires. ... 40 Figure 12 : Résultat de prédiction des sites potentiellement ubiquitinylables sur la protéine Gαs (même résultat pour les formes courte et longue). ... 134
Figure 13 : Interaction des protéines Gαs et HRS traduites in vitro avec des
L
ISTE DES ABREVIATIONS-A-
5’AMP : Adénosine mono-phosphate A : Adhésion
AEBP1 : Adipocyte enhancer-binding protein 1
AGS : Activateurs des Signalisations des protéines G AIP4 : Atrophin 1 interacting protein 4
AMPc : Adenosine mono-phosphate cyclique AP2 : Protéine adaptateur 2
ARRDC : Arrestin Domain Containing ou α arrestine AT1R : Angiotensin 1 receptor
ATP : Adenosine tri-phosphate
-B-
β2AR : Récepteur β2 adrénergique
BLOC-1 : Biogenesis of lysosome related organels complex 1
-C-
CREB : cAMP response element binding proteins CXCR4 : C-X-C chemokine receptor type 4
-D-
D1R : Dopamine 1 recepteur D2R : Dopamine 2 récepteur
DAG : Diacylglycérol DOP : Récepteur δ opioide DTX3L : Deltex 3 like
Dysbindin : Dystrobrevin-binding protein 1
-E-
E1 : Ubiquitin-activating enzyme E2 : Ubiquitin-conjugating enzyme E3 : Ubiquitine ligase
EEA1 : Early endosomal antigen 1 EGF : Epidermal growth factor
eNOS : Endotheliale Oxyde Nitrique Synthase EP : Récepteur aux prostaglandines
ERM protéines : Ezrin-radixin-moesin
ESCRT : Endosomal sorting complex required for transport ET-1R : Endothelin 1 recepteur
-F-
F : Frizzled/Taste2
FRET : Transfert d’énergie de fluorescence par résonance
-G-
G : Glutamate
GABA B : Récepteur à l’acide gamma-aminobutyrique GASP-1 : GPCR Associated Sorting Protein 1
GDI : Guanine dissociation inhibitor
GDP/GTP : Guanosine di-phosphate / guanosine tri-phosphate GEF : Guanine exchange factor
GGL : G-gamma like domain
GLUE : Grame like ubiquitin-binding in EAP45 GPCR = RCPG : Récepteur couplé aux protéines G GRK : GPCR kinases
GTPasique : Hydrolyse du GTP
-H-
HDAC : Histones déacétylases
HECT : Homologous to the E6-AP Carboxyl Terminus
HRS : Hepatocyte growth factor regulated tyrosine Kinase substrate
-I-
IP3 : Inositol 1-4-5 triphosphate
-K-
kDa : Kilo Dalton
-M-
MABO : Mvb12 associated β prism
MAPK; MAP kinases : Mitogen-activated protein kinases Mfn1 : Mitofusin 1
MIT : Microtubule interacting motif MOP : µ opioid receptor
-N-
NHERF : Na+ / H+ exchanger regulatory factor NTD : domaine N terminal
-P-PAR1 : Protease activated receptor PDE : Phosphodiestérases
PDZ : domaine homologue retrouvé dans les protéines PSD95 (post-synaptic density protein) ; Dlg (Drosophyla disc large tumor suppressor); Zo1(Zonula occludens 1 protein)
PI3K : Phosphatidyl inositol 3 phosphate kinase PIP2 : Phosphatidyl Inositol 4,5 diphosphate PKA : Protéine kinase A
PKC : Protéine Kinase C PLC : Phospholipase C
PP2a: Protéine phosphatase 2a
Protéines G : Guanine nucleotide binding proteins
-R-
R : Rhodopsine
Rab : petites protéines GTPases
RGS : Régulateurs de la Signalisation des G-protéines
-S-
SH3 : Src homology 3
SLM : Signal de localisation mitochondrial SNAP25 : Synaptosomal associated protein 25 STAM : Signal transducine adaptor molecule
-T-
TGN : Trans golgi network
TSG 101 : Tumor susceptibility gene 101
-U-
UEV : Ubiquitine E2 variant UIM : Ubiquitin interacting motif UMA : Ubiquitin motif associated
-V-
VIH : virus de l’immunodéfiscience humaine Vps : Vacuolar protein sorting
-W-
I
NTRODUCTIONI. L
ES PROTEINESG
HETEROTRIMERIQUESLes protéines G hétérotrimériques (Guanine nucleotide binding proteins) sont composées de trois sous-unités distinctes: une sous-unité Gα portant le site de fixation des guanosine diphosphate ou guanosine triphosphate (GDP/GTP) ainsi qu’une activité GTPasique; une sous-unité Gβ, et une sous-unité Gγ (Northup, Sternweis et al. 1980; Hanski, Sternweis et al. 1981; Sternweis, Northup et al. 1981; Sternweis, Northup et al. 1981; Hanski and Gilman 1982; Bokoch, Katada et al. 1984). Actuellement chez les vertébrés, il a été dénombré seize gènes codant pour les unités Gα; cinq pour les unités Gβ, et douze pour les sous-unités Gγ (Simon, Strathmann et al. 1991; Birnbaumer 2007; Oldham and Hamm 2008). Cependant, il existe également des phénomènes d’épissages alternatifs qui viennent augmenter la variété de ces protéines. Elles jouent un rôle prépondérant dans la signalisation cellulaire, via la transduction d’un signal extracellulaire (fixation d’un ligand sur un récepteur couplé aux protéines G (RCPG), en un signal d’adaptation intracellulaire.
1) DECOUVERTE
Ces protéines ont été découvertes grâce à leur liaison au GTP, à leur action sur l’adenylate cyclase et leur sensibilité à différentes drogues, telles la toxine du choléra et la toxine pertussique.
Dès 1959, Rall et Sutherland ont isolé des cellules de foies, qu’ils ont traitées avec de l’épinéphrine ou du glucagon, afin de déterminer la réponse cellulaire (Rall and Sutherland 1959; Rall and Sutherland 1962; Sutherland, Oye et al. 1965; Weiss and Costa 1967). Ceci leur a permis d’isoler l’adenosine mono-phosphate cyclique (AMPc) comme second messager induit par les traitements à l’épinéphrine et au glucagon. Ils ont également identifié l’enzyme responsable de la formation d’AMPc, l’adénylate cyclase. Ces observations ont permit d’ouvrir la voie à l’étude de leurs mécanismes d’action. Durant plusieurs années, différentes équipes de recherche ont pu observer la présence d’AMPc dans de nombreux
tissus, principalement dans ceux répondants aux hormones, et ont identifié ses mécanismes de synthèse à partir de l’adenosine triphosphate (ATP) et de dégradation en 5’adenosine mono-phosphate (AMP) (Butcher and Sutherland 1962; Rall and Sutherland 1962; Sutherland and Robison 1966). Il faudra ensuite attendre 1975 pour que l’équipe des Drs Gill et King identifie l’adénylate cyclase comme cible de la toxine du choléra dans des érythrocytes de pigeon (Gill and King 1975). En 1976, Cassel et Selinger démontrèrent que suite à une stimulation aux catécholamines d’érythrocytes de dinde, une activité GTPase était associée et qu’elle était inhibée par le traitement préalable des érythrocytes par la toxine du choléra (Cassel and Selinger 1976; Cassel and Selinger 1977). En 1978, les deux précédentes équipes identifièrent de façon concomitante une protéine de 42kDa, associée aux membranes et liant le GTP, qui suite à la mise en présence de la toxine du choléra, subissait une étape d’ADP-ribosylation engendrant l’activation de l’adénylate cyclase et la production d’AMPc (Cassel and Pfeuffer 1978; Gill and Meren 1978). Cette protéine fut nommée G/F. En 1980, Northup et collaborateurs ont isolé le composant régulateur de l’adénylate cyclase (la protéine G/F) et ont ainsi identifié qu’il s’agissait en fait d’un complexe de 3 sous-unités, de poids moléculaires approximatifs de 52kDa, 45kDa et 35kDa (Northup, Sternweis et al. 1980).
Parallèlement à la découverte des protéines G se faisait la découverte des RCPG. Dr Ahlquist, en 1948, s’est basé sur les hypothèses des Drs Langley et Dale, affirmant la présence de récepteurs aux molécules telles que l’épinéphrine. Il identifia ainsi, à l’aide de différents modèles animaux, la présence de récepteurs adrénergiques, qu’il sépara en deux classes : activateur et inhibiteur. Cependant, dépendamment de l’organe, une même molécule pouvait avoir des effets contraires (Ahlquist 1948). Dr Ahlquist fût le premier à identifier que les effets contraires sur différents organes étaient dus à la fixation de la molécule sur des types différents de récepteurs. Durant de nombreuses années, la confusion a régnée entre adénylate cyclase comme protéine à 2 sous-unités, une réceptive et une catalytique, ou deux protéines distinctes (Robison, Butcher et al. 1967). Le concept même de récepteur était controversé (Stellwagen and Baker 1976). Ce
n’est qu’en 1977 que Limbird et Lefkowitz ont pour la première fois démontré qu’un récepteur β-adrénergique et l’adénylate cyclase étaient deux entités distinctes et qu’elles n’interagissaient pas (Limbird and Lefkowitz 1977). Le lien entre le récepteur adrénergique, la protéine G/F et l’adénylate cyclase ne sera concrètement établi qu’en 1980 via les études de Ross et Gilman (Northup, Sternweis et al. 1980). A partir des années 1980, l’ensemble des connaissances sur les récepteurs, les voies de signalisation, les agonistes / antagonistes ont explosé.
2) LES S OUS-UNITES ET L A SIGNALIS ATION
Comme mentionné précédemment, les protéines G hétérotrimériques sont composées de trois sous-unités, Gα, Gβ et Gγ et sont associées aux membranes, afin de transduire la signalisation des RCPG. Cette association aux membranes est permise grâce à des modifications lipidiques, de myristoylation et palmitoylation pour la famille des Gαi/o ; et des palmitoylations pour les autres Gα (Kokame,
Fukada et al. 1992; Neubert, Johnson et al. 1992; Galbiati, Guzzi et al. 1994; Hepler, Biddlecome et al. 1996; Marrari, Crouthamel et al. 2007). Les Gγ peuvent aussi subir des modifications lipidiques, comme l’ajout d’un groupement farnesyl ou geranylgeranyl (Kisselev, Ermolaeva et al. 1995).
a. Sous-unités Gα
Les sous-unités Gα sont à ce jour au nombre de 16 et portent l’activité principale des protéines G hétérotrimériques (Birnbaumer 2007).
Elles sont séparées en 4 classes : Gαi/o ; Gαs ; Gαq/11 et Gα12/13 dans la
signalisation couplée aux RCPG généraux, classification basée sur les homologies de séquences et les signalisations induites (Simon, Strathmann et al. 1991). Il existe également Gαt (transducin) et Gαolf, respectivement impliquées dans la
vision et l’olfaction (Simon, Strathmann et al. 1991).
Les structures des protéines Gα ont été déterminées par différentes équipes à la fin des années 90. Elles ont toutes une structure identique, consistant en une succession d’hélices alpha (α) (Noel, Hamm et al. 1993; Coleman, Berghuis et al.
1994; Sprang 1997; Sunahara, Tesmer et al. 1997; Tesmer, Sunahara et al. 1997). La Figure 1 représente la structure d’un homodimère de la sous-unité Gαs fixant
des GTP, mentionnant les domaines α-helicaux (α-helical domain) et les domaines GTPasiques (Ras-like domain).
Figure 1 : Cristal d'un dimère de sous-unité Gαs
Structure obtenue par (Sunahara, Tesmer et al. 1997), suite à la cristalisation d’un homodimère de Gαs liées au GTP. (Droits d’utilisation Annexe 1)
L’alignement des séquences de Gαs ; Gαi, Gαz ; Gαq et Gα12 grâce au site
PRALINE (http ://www.ibi.vu.nl/programs/pralinewww/) montre la conservation des acides aminés (Figure 2). Elles possèdent toutes trois domaines très conservés : Switch I, II et III. Ces domaines switchs sont organisés autour de la fixation du GTP (le GTP se lie dans la fente formée par les switch I et II). Le domaine switch II possède le site catalytique d’hydrolyse du GTP (activité GTPasique) et tous subissent de forts réarrangements conformationnels suite à l’hydrolyse du GTP.
Figure 2 : Alignement de séquences des Gαs; i ; z ; 12 et q
Alignement effectué grâce au site PRALINE. Le code couleur représente la conservation des acides aminés (bleu 0 ; rouge 10).
Ces domaines sont aussi intimement impliqués dans la liaison des dimères Gβγ, ainsi que dans la liaison aux effecteurs (adenylate cyclase pour Gαs et Gαi)
(Sunahara, Tesmer et al. 1997; Skiba and Hamm 1998). Cependant, malgré la conservation des structures et de certains domaines, elles ont toutes des rôles bien différents au niveau de la signalisation cellulaire (Figure 3) (Neves, Ram et al. 2002).
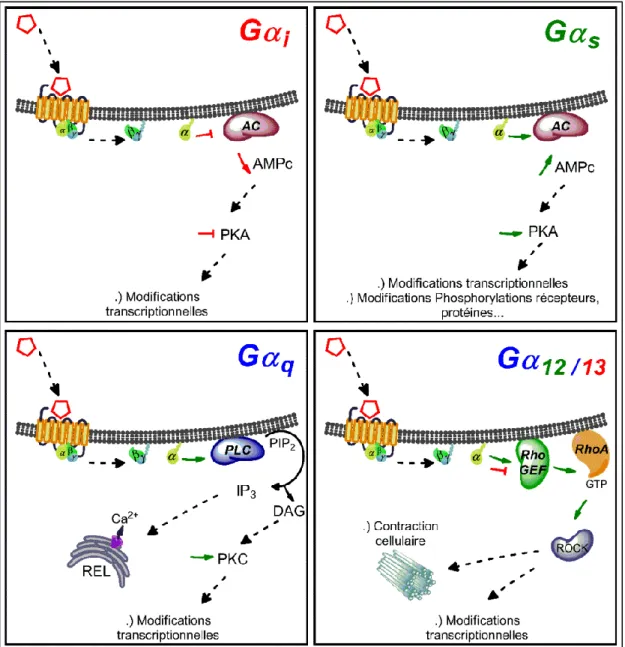
Figure 3 : Schématisation des voies de signalisation des protéines Gα
Schématisation de la signalisation induite par les différentes sous-unités Gα, suivant l’activation d’un récepteur à 7 domaines transmembranaires.
Légende : flêches rouges : inhibition ; flêches vertes : activation ; flêches pointillées : induction. AC : Adénylate cyclase ; AMPc : adenosine mono-phosphate cyclique ; PKA : protéine kinase A ; PKC : protéine kinase C ; PLC : phospholipase C ; PIP2 : phosphatidyl Inositol 4,5 diphosphate ; DAG : Diacylglycérol ; IP3 : Inositol 1-4-5 triphosphate ; REL : reticulum endoplasmique lisse.
1. Classe de la sous-unité Gαi
Cette classe de protéines Gα est composée des protéines Gαi (inhibitrice),
Gαo (others), Gαt (transducin, impliquée dans la vision), GαGust (gustducin,
impliquée dans le gout, dont les récepteurs sont trouvés sur la langue) et Gαz.
Exceptée la sous-unité Gαz, toutes ces sous-unités sont sensibles à la toxine
pertussique, en subissant une ADP-ribosylation (Locht, Coutte et al. 2011). Les sous-unités Gαi, Gαo et Gαz, lorsqu’activées, vont inhiber l’adénylate cyclase, alors
que Gαt et GαGUST vont réguler les guanosine mono-phosphate cyclique (cGMP)
phosphodiesterases (PDE) (Kinnamon 2012).
Le modèle de la voie de signalisation de la sous-unité Gαi/o est schématisé Figure 3. Suite à la fixation d’un ligand sur le récepteur RCPG, la modification de la conformation du récepteur induit un changement conformationnel de la sous-unité Gαi/o, qui libère son GDP et lie un GTP. Le récepteur est alors considéré
comme un facteur d’échange guanidine (GEF : guanine exchange factor, facteur d’échange guanidine). La sous-unité Gα se dissocie également du complexe Gβγ et se fixe à l’adénylate cyclase (Grishina and Berlot 1997). L’adénylate cyclase est une enzyme qui catalyse la conversion de l’ATP en AMPc. Elle a été cristallisée pour la première fois par les Drs Tesmer, Sunahara, Gilman et Sprang en 1997, en complexe avec Gαs-GTPγS (Tesmer, Sunahara et al. 1997). Il en existe 10
isoformes chez l’homme, 9 sont transmembranaires et une est soluble (Steegborn 2014). Les isoformes transmembranaires sont connues pour être la cible des protéines Gα dans la signalisation des RCPG, alors que l’isoforme soluble est directement activée par les ions Ca2+, et sert de senseur du pH, de la concentration en ATP cellulaire, ou encore en bicarbonate (Steegborn 2014). Suite à l’inactivation de l’adénylate cyclase, la concentration intracellulaire en AMPc va diminuer et ainsi mener à l’inactivation de la protéine kinase A (PKA). Les
sous-unités Gαt et GαGust vont également participer à l’inactivation de la PKA, en
activant les cGMP PDE. Ces enzymes sont impliquées dans la dégradation de l’AMPc en 5’AMP (Brooker, Thomas et al. 1968).
2. Classe de la sous-unité Gαs
La sous-unité Gαs (pour stimulatrice) a pour rôle direct d’activer l’adénylate
cyclase (Figure 3). La protéine Gαolf fait partie de la même famille, mais est
essentiellement retrouvée dans le système olfactif. Contrairement à la sous-unité Gαi, l’activation de la sous-unité Gαs va lui permettre de fixer l’adenylate cyclase et
de l’activer. Les effets seront donc l’inverse que précédemment décrits, soit une augmentation de la concentration d’AMPc, induisant une activation de la PKA. La PKA est une enzyme appartenant à la famille des sérine/thréonine kinases, constituée de deux sous-unités catalytiques et deux sous-unités régulatrices (Walsh, Perkins et al. 1968), dont la structure fut caractérisée par l’élaboration d’un cristal pour la première fois par Knighton et al. en 1991 (Knighton, Zheng et al. 1991). Lorsque la concentration en AMPc intracellulaire est élevée, deux molécules d’AMPc se fixent sur les deux sous-unités régulatrices de la PKA. Ceci induit une dissociation du complexe et l’activation des deux sous-unités catalytiques qui vont alors phosphoryler leurs protéines cibles (Zetterqvist, Ragnarsson et al. 1976; Zetterqvist and Ragnarsson 1982; Pinna and Ruzzene 1996; Ubersax and Ferrell 2007). L’activation de la PKA induit la phosphorylation de ses cibles suite à la reconnaissance de sites consensus : [Arg-Arg-X-Ser/Thr-X] (Krebs and Beavo 1979; Zetterqvist and Ragnarsson 1982). Les cibles de la PKA sont retrouvées aussi bien dans le cytoplasme que dans le noyau. La localisation des sous-unités catalytiques au niveau du noyau semble être dépendante d’une interaction avec la protéine interagissant avec la PKA (AKIP1 : PKA-interacting protein) (Sastri, Barraclough et al. 2005). Les cibles de la PKA sont diverses, regroupant aussi bien des enzymes (elles-mêmes kinases), des canaux ioniques (menant à la contraction cardiaque) (Xiao, Cheng et al. 1999), des protéines nucléaires (telles que les histones H1), ou encore des facteurs de transcriptions, le plus important étant CREB (cAMP response element binding proteins). Une fois
phosphorylé, CREB devient apte à se fixer sur des sites consensus au niveau de différents promoteurs et active la transcription de certains gènes cibles (Mayr and Montminy 2001; Mayr, Canettieri et al. 2001; Sands and Palmer 2008).
3. Classe de la sous-unité Gαq/11
Les sous-unités Gαq/11, contrairement à la famille des Gαi ou Gαs,
n’interviennent pas au niveau de l’adénylate cyclase, ni de la concentration en AMPc (Figure 3). La cible de Gαq-GTP et Gα11-GTP est la phospholipase C (PLC)
(Wu, Lee et al. 1992). Cette enzyme hydrolyse les phospholipides membranaires phosphatidyl Inositol 4,5 diphosphate (PIP2), en diacylglycérol (DAG) et inositol 1-4-5 triphosphate (IP3). Le DAG induit l’activation de la protéine kinase C (PKC), qui phosphoryle alors différentes cibles, notamment des facteurs de transcriptions, et induit des modifications d’expression génique. La PKC induit également une augmentation de la concentration calcique cytoplasmique, via l’ouverture de canaux calciques membranaires. Parallèlement, la concentration en IP3 augmente et l’IP3 va pouvoir se fixer sur son récepteur (récepteur à l’IP3) situé au niveau de la membrane du réticulum endoplasmique. Ce récepteur est un canal calcique qui s’ouvre suite à la fixation de l’IP3 et induit une libération massive d’ion Ca2+ dans le milieu intracellulaire (Kadamur and Ross 2013).
4. Classe de la sous-unité Gα12/13
Les sous-unités Gα12/13 lorsqu’activées par un RCPG, vont stimuler la voie
des protéines Rho/Ras (Figure 3). Il s’agit de petites protéines G liant également les GDP/GTP. L’activation se fait par liaison directe avec des protéines régulatrices de la signalisation des protéines G (RGS) contenant des domaines Rho-GEF. L’activation de RhoGEF va activer la protéine Ras homologue A (RhoA) via la fixation d’un GTP, puis induire l’activation des protéines kinases Rho associated protein kinase (Rock). Ceci va permettre la modulation des fibres de stress et l’organisation du cytosquelette d’actine dans les cellules (Buhl, Johnson et al. 1995; Lyon, Taylor et al. 2014).
b. Sous-unités Gβγ
Bien que la signalisation engendrée par les sous-unités Gα soit le mécanisme principalement étudié de la signalisation des RCPG, les sous-unités Gβγ sont également impliquées dans la signalisation intracellulaire, via les mêmes effecteurs que les protéines Gα, ou via des effecteurs différents. Les sous-unités Gβ et Gγ forment un dimère indissociable dans les cellules, exceptée Gβ5, qui semble pouvoir interagir directement avec des RGS possédant un domaine G Gamma Like (GGL) (Sondek and Siderovski 2001). Les sous-unités Gβγ peuvent se retrouver associées avec les sous-unités Gα, afin de les maintenir inactives, ou peuvent induire une signalisation intracellulaire en régulant l’adénylate cyclase, la PLCβ, ou plus particulièrement des canaux ioniques (Boyer, Paterson et al. 1994; Boyer, Graber et al. 1994; Diverse-Pierluissi, McIntire et al. 2000). Le dimère Gβγ est aussi identifié comme activateur de la phosphatidyl inositol 3 phosphate kinase (PI3K), pouvant ainsi induire l’activation de la voie Akt de survie cellulaire (Murga, Laguinge et al. 1998; Castellone, Teramoto et al. 2005). Au nombre de cinq Gβ et douze Gγ, ce n’est qu’en 2000 que Diverse-Pierluissi et collaborateurs ont identifiés des couples de Gβγ qui semblent être favorisés dépendamment du type cellulaire, et ce malgré la présence de toutes les Gβ et Gγ dans tous les types cellulaires (Diverse-Pierluissi, McIntire et al. 2000; Hynes, Tang et al. 2004; Hynes, Yost et al. 2008; Hynes, Yost et al. 2011).
Cependant, malgré des voies de signalisations qui semblent être spécifiques à chaque sous-unité (Gα ou Gβγ), l’évolution des techniques d’analyses telle la technique de transfert d’énergie par résonance, a permis d’ouvrir la porte à certaines controverses, notamment la remise en question de la dissociation de la sous-unité Gα-GTP, des sous-unités Gβγ (Levitzki and Klein 2002). Cette hypothèse a été soulevée par le Dr Levitski, qui suite à l’étude d’une protéine Gα de levure (GpaI), a démontré que la dissociation de la sous-unité Gβ correspondante (Ste4) n’était pas nécessaire à l’activation de la signalisation par la protéine Gα (Klein, Reuveni et al. 2000). En effet, une protéine de fusion GpaI-Ste4 est capable d’induire la signalisation induite par des phéromones. De plus,
d’autres études utilisant le transfert d’énergie de fluorescence par résonance (FRET) ont démontré que cette controverse dissociation / réorganisation était toujours d’actualité. En 2001, Janetopoulos et collaborateurs ont montré que l’activation d’une protéine G marquée par un fluorophore, induisait la dissociation de Gα du couple Gβγ, dont Gβ était également marquée par un autre fluorophore (Janetopoulos, Jin et al. 2001). Paradoxallement, Bunemann et collaborateurs en 2003 ont montré qu’une Gαi fluorescente et que le couple Gβ1γ2 aussi fluorescent,
subissaient un réarrangement suite à l’activation de la Gα, mais qu’il n’y avait pas de dissociation (Bunemann, Frank et al. 2003). Cette controverse est toujours d’actualité, et continue à animer des débats dans le monde de la recherche sur les RCPG.
3) REGUL ATION DE L A SIGN ALISATION PAR LES AGS ET RGS
Malgré une signalisation bien établie suite à l’activation classique des RCPG, les protéines G hétérotrimériques peuvent aussi être régulées par d’autres protéines. Celles-ci peuvent intervenir pour activer les protéines G, indépendamment d’un RCPG, ou modifier la signalisation déjà engendrée par un RCPG. Il s’agit des protéines activatrices des signalisations des protéines G (AGS) et des protéines régulatrices de la signalisation des protéines G (RGS).
Les protéines AGS ont été identifiées grâce à l’élaboration d’une librairie en double-hybride chez la levure Saccharomyces cerevisiae, visant à identifier des protéines, autres que des récepteurs, qui pouvaient activer les protéines G (Cismowski, Takesono et al. 1999). Les AGS sont séparées en 3 groupes (classes I à III), dépendamment de leur rôle de GEF (identique à celui des RCPG pour l’activation des protéines G), d’inhibiteur de dissociation de guanine (GDI :Guanine dissociation inhibitor) (grâce à un motif GPR, ou Goloco, spécifique de la famille des Gαi), ou de leur liaison directe à Gβγ (Blumer, Cismowski et al. 2005).
Les protéines RGS se caractérisent par la présence d’un domaine RGS conservé. Initialement découvertes en 1996, ces protéines comportent toutes un domaine d’environ 120 acides aminés, nécessaire à l’activité GTPasique intrinsèque des protéines G (De Vries, Mousli et al. 1995; Druey, Blumer et al.
1996). Une schématisation de la structure des protéines RGS est représentée Figure 4. Le domaine RGS y est représenté en orange. De part leur domaine RGS, ces protéines vont aider l’inactivation des protéines Gα, en accélérant l’hydrolyse du GTP (Kach, Sethakorn et al. 2012). Depuis 1996, de nombreuses RGS ont été identifiées (actuellement au nombre de 37 dans le génome humain), classées par familles, et ce dépendamment des domaines (autres que RGS) qu’elles comportent (Figure 4) (Siderovski and Willard 2005). De façon surprenante, la majorité des RGS lient Gαi/o ou Gαq (Ross and Wilkie 2000;
Papakonstantinou, Karoussiotis et al. 2015) et Gα12/13 pour les Rho-GEF (Tanabe,
Kreutz et al. 2004), et seules deux RGS ont été identifiées comme pouvant lier Gαs
(RGS2 et RGS-PX1) (Zheng, Ma et al. 2001; Zheng, Lavoie et al. 2004; Roy, Baragli et al. 2006; Roy, Nunn et al. 2006). Les RGS peuvent être retrouvées aussi bien au niveau de la membrane plasmique, du cytoplasme, ou de la membrane d’organites, ceci grâce à la présence de nombreux domaines permettent un adressage / ancrage au niveau des membranes (domaines DEP, PH, PX, PDZ) (De Vries, Zheng et al. 2000).
Figure 4 : Schématisation des domaines présents dans la structure des différentes
RGS et RGS-like humaines
Modifié de (Siderovski and Willard 2005). Les RGS sont réparties en 7 familles dépendamment des domaines (autres que le domaine RGS) qui élaborent leurs structures. GGL : G-gamma like domain ; DEP : Dishevelled, EGL-10, and pleckstrin domain ; PDZ : PSD-95–Dishevelled–ZO1 homology domain; PTB :
domaine d’interaction à une phosphotyrosine ; DH : double homology ; PH : Pleckstrin homology ; PX : Phosphoinositide binding domain. (Droits d’’utilisation Annexe 2).
Paradoxallement, certaines RGS (de la famille R12) ont des domaines Goloco, domaines impliqués dans l’association aux sous-unités Gαi–GDP. Ceci
contredit l’activité principale accordée aux RGS en tant que GAP, et vient bouleverser le dogme des connaissances de ces protéines.
Les RGS ne sont donc pas uniquement des GAP, mais sont aussi impliquées dans différents mécanismes cellulaires. Par exemple, les RGS du groupe R7 possèdent un domaine GGL permettant la fixation au niveau du site de liaison de Gβ5, site habituellement impliqué dans la liaison à la sous-unité Gγ, et sont capables d’inactiver également la sous-unité Gαi grâce au domaine RGS (Hooks,
Waldo et al. 2003; Siderovski and Willard 2005). Les RGS du groupe GEF quant à elles ont la particularité de fixer une Gα-GTP grâce à leur domaine RGS, et de transmettre cette activation à la voie de signalisation Rho grâce au domaine Rho-GEF (Hart, Sharma et al. 1996). Les RGS du groupe GRK sont impliquées dans la désensibilisation des récepteurs, de part l’activation de leur domaine Ser/Thr kinase, qui sera actif suite à la reconnaissance d’une Gα active, ainsi que la liaison au RCPG actif (Baameur, Morgan et al. 2010). Enfin, les RGS du groupe SNX sont spécifiquement localisées au niveau des endosomes, et SNX13 (RGS-PX1) permet l’inactivation de la sous-unité Gαs au niveau des endosomes, et module la
dégradation du récepteur à l’epidermal growth factor (EGF) (Zheng, Ma et al. 2001; Zheng, Lavoie et al. 2004).
Le rôle physiologique des RGS est encore mal défini, mais il semble que suite à l’activation de certains RCPG couplés à une protéine Gα en particulier (par exemple Gαs), la transcription de la protéine RGS régulant la protéine Gα opposée
(soit RGS2 pour Gαi) soit augmentée (Roy, Nunn et al. 2006). Cette observation
conduit à l’hypothèse que les protéines RGS permettraient une régulation croisée des voies de signalisation induites par les protéines Gα. Ces protéines RGS auraient une importance dans la régulation rapide de ces voies de signalisation, en
évitant les signaux contradictoires (Kach, Sethakorn et al. 2012). Certaines de ces protéines RGS ont été démontrées comme importantes pour l’hématopoïese, ou encore les fonctions plaquettaires (Louwette, Van Geet et al. 2012).
II. L
ES RECEPTEURS COUPLES AUX PROTEINESG
1) GENERALITES
Les récepteurs couplés aux protéines G (RCPG) représentent la plus grande classe de récepteurs codés par le génome humain. Classiquement retrouvés au niveau de la membrane plasmique, et au nombre d’environ 800 chez l’Homme, ils ont tous une structure similaire, composée de sept domaines transmembranaires, avec un N-terminal extracellulaire et un C-terminal intracellulaire, ainsi que trois boucles extracellulaires impliquées dans la liaison du ligand et trois boucles intracellulaires aidant à la liaison des protéines G ou d’autres protéines accessoires. Pour qu’un récepteur soit classé comme RCPG, il doit respecter deux exigences : la succession de sept domaines formés de 25 à 35 acides aminés hydrophobes très conservés, permettant de former les hélices α des sept domaines transmembranaires, et posséder la capacité de lier une protéine G. Ces récepteurs sont classés en 5 classes (A à F), dépendamment des homologies de séquences. Cependant, dans le génome humain, les classes représentées par les lettre D et E, ainsi que la sous-classe IV de la famille A ne sont pas présentes (Fredriksson, Lagerstrom et al. 2003; Kochman 2014). Le premier RCPG à avoir été cristallisé est le récepteur rhodopsine (récepteur aux photons) (Palczewski, Kumasaka et al. 2000) et la classe A comprend les récepteurs dis « Rhodopsin-like ». Cette classe englobe environ 90% des RCPG, dont le récepteur β2 adrénergique (β2AR) (Pele, Abdi et al. 2011). La classe B comprend les « secretin-receptor » (Harmar 2001), tandis que la classe C regroupe les récepteurs métabotropiques au glutamate « metabotropic-glutamate receptor ». La classe B se caractérise par un long domaine N terminal, qui intervient avec les boucles extracellulaires pour la fixation d’un ligand. La classe F quant à elle regroupe les récepteurs Frizzled. Une seconde classification des RCPG a émergé, basée sur des études phylogénétiques, mais est encore peu utilisée. Cette classification est
dite GRAFS, pour Glutamate (G), Rhodopsine ( R), Adhésion (A), Frizzled/Taste2 (F), et Sécrétine (S) (Fredriksson, Lagerstrom et al. 2003; Schioth and Fredriksson 2005). L’arbre phylogénétique des RCPG est représenté Figure 5.
Figure 5 : Représentation de l’arbre phylogénétique permettant la classification des RCPG.
L’arbre phylogénétique permet d’observer les RCPG selon leur pourcentage d’homologie génétique (classification GRAFS). En orange la famille G ; en bleu : la famille R, en violet la famille A ; en vert la famille F puis en rouge la famille S. (Modifié de (Kufareva, Rueda et al. 2011). Les gènes entourés codent pour les différents RCPG utilisés durant notre étude : en vert, le gène codant pour le récepteur CXCR4 ; en rose le gène codant pour le récepteur 1 de l’angiotensine II, en jaune le gène codant pour le récepteur delta opioïde, en jaune entouré de rouge pour le récepteur µ opioïde ; en orange le gène codant pour le récepteur β2AR, en
kaki le gène codant pour le récepteur dopaminergique D1, et enfin en bleu pale le gène codant pour le récepteur dopaminergique D2. (Droits d’utilisation Annexe 3).
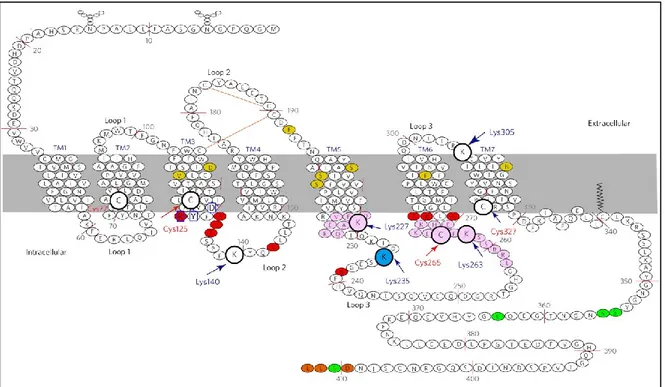
Les deux RCPG types de la classe A (ou R) les mieux connus sont le récepteur rhodopsine et le récepteur β2AR. La structure bidimensionnelle du récepteur β2AR est schématisée sur la Figure 6, afin de visuellement repérer les résidus impliqués dans les différentes interactions. Ce récepteur servira de modèle pour expliquer les différentes séquences et les mécanismes impliqués dans la vie des RCPG, de nombreux mécanismes étant valables pour tous les RCPG.
Figure 6 : Schématisation du récepteur β2AR
Représentation de la structure bidimensionnelle du récepteur β2AR, avec l’emphase mise sur les différents résidus impliqués dans son activité ou sa vie. En jaune : des résidus de pochette de liaison au ligand, en rose/rouge les résidus impliqués dans l’interaction avec la protéine Gαs, en orange le domaine «
PDZ-like », en vert les résidus phosphorylés, et en vert et bleu, les résidus impliqués dans l’interaction avec la protéine β arrestine. (Inspiré de la Figure 2 (Kahsai, Xiao et al. 2011)).
2) ACTIVATION ET TRANS DU CTION DU SIGNAL
Les RCPG sont principalement localisés au niveau de la membrane plasmique. Afin de transduire son signal, un RCPG doit à la fois fixer un agoniste et la protéine G qu’il activera en réponse. Les RCPG sont la cible de divers signaux « agonistes », tels que des neurotransmetteurs, des phéromones, des hormones ou encore des photons ou des acides gras (Schioth and Fredriksson 2005). Malgré la diversité des ligands possibles, la pochette de liaison à l’agoniste est toujours constituée de plusieurs résidus (acides aminés), pouvant être retrouvés aussi bien au niveau du N terminal, qu’au niveau des domaines transmembranaires, et des boucles extracellulaires. En jaune sur la Figure 6 sont représentés les résidus impliqués dans la liaison au ligand naturel l’épinéphrine (Isin, Estiu et al. 2012). Cependant, les résidus impliqués diffèrent dépendamment de l’agoniste ou de l’antagoniste, même si certains résidus sont impliqués dans la liaison à plusieurs agonistes (Isin, Estiu et al. 2012). Un motif consensus très conservé est présent à la fin du domaine transmembranaire trois : le motif D/ERY (acides aminées encadrés en bleu dans la Figure 6). Ce motif semble nécessaire à la liaison d’un agoniste, de part son influence sur la structure et l’orientation des domaines transmembranaires du récepteur s’il est modifié. (Ge, Scheinin et al. 2003). Ce motif est retrouvé dans la séquence de tous les RCPG de la classe A. Une mutation de l’arginine dans ce domaine empêche l’activation de la protéine Gαs par le récepteur V2 suite à l’activation par la vasopressine (Wilbanks, Laporte
et al. 2002), tandis qu’une mutation dans ce même domaine (substitutions D130A ou D130N) peut rendre le récepteur β2AR constitutivement actif, de part un réarrangement conformationel du domaine transmembranaire six (Rasmussen, Jensen et al. 1999; Ballesteros, Jensen et al. 2001). L’arginine de ce motif est également impliquée dans la liaison du récepteur à la protéine Gα et est importante pour induire son activation (Franke, Sakmar et al. 1992). Durant de nombreuses années, le domaine d’interaction de la protéine Gα avec le RCPG a été plus ou moins bien défini (Bourne 1997; Wess 1998). Les premières études étudiant le domaine d’interaction ont modifié le récepteur par des mutations de délétions. Ils ont montré que les deux domaines représentés en rose sur la Figure
6 étaient importants pour la liaison du récepteur à la protéine Gα (Kobilka, Kobilka et al. 1988; Rasenick, Watanabe et al. 1994). Or, depuis la réalisation du cristal du récepteur couplé à la sous-unité Gαs, certains résidus précis sont démontrés
comme impliqués dans cette liaison (Rasmussen, Choi et al. 2007; Rasmussen, DeVree et al. 2011). Ceux-ci sont représentés en rouge sur la Figure 6. Même si les résidus « réels » sont proches des résidus « potentiels » dans la séquence du récepteur, la divergence entre les résidus identifiés par les études de cristalographie et ceux prédits par les essais de mutations peut s’expliquer par les modifications de structure tridimensionnelle que les mutations de délétions induisent. Ces modifications de structure empêcheraient alors la liaison de la sous-unité Gαs avec le récepteur. L’exemple le plus flagrant de modification influençant
la liaison de la sous-unité Gα, est la phosphorylation de la tyrosine au niveau du motif DRY. Cette modification post-traductionnelle réduit l’activation de la protéine Gα (Clayton, Bruchas et al. 2010), en empêchant sa liaison au récepteur. Ce motif DRY est aussi impliqué dans le « ionic-lock » des RCPG. Lorsque le RCPG est à l’état inactif, l’arginine de ce motif forme une liaison ionique avec un acide glutamique du domaine transmembranaire 6, et empêche ainsi le récepteur de fixer une protéine G (Ballesteros, Jensen et al. 2001). Suite à la liaison d’un agoniste dans la pochette de liaison, le récepteur subit des changements conformationels se traduisant par des rotations très marquées de certains résidus (identifiés en plus gros sur la Figure 6) (Kahsai, Xiao et al. 2011; Isin, Estiu et al. 2012; Nygaard, Zou et al. 2013). Ceci augmente l’affinité de liaison du récepteur pour la protéine G et la transmission des mouvements à la protéine G induit sa perte d’affinité pour le GDP, et la liaison du GTP (Nygaard, Zou et al. 2013). La liaison au GTP induit un changement conformationnel drastique au niveau de la sous-unité Gα, lui permettant d’interagir avec ses effecteurs (Tesmer 2010; Westfield, Rasmussen et al. 2011; Singh, Ramachandran et al. 2012) (cf. I). Le récepteur (avec les sous-unités Gβγ) joue donc un rôle de GEF pour la protéine G associée.
3) DESENSIBILIS ATION
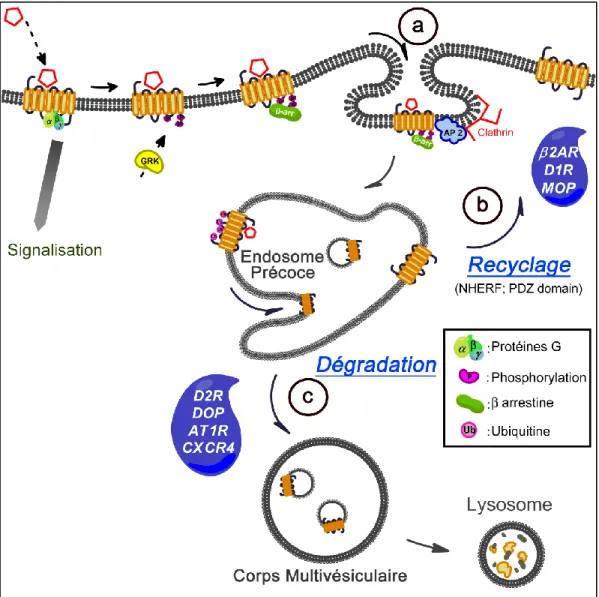
Afin de délimiter dans le temps et l’espace l’activation d’un RCPG au niveau de la membrane plasmique d’une cellule et éviter une stimulation anarchique, celui-ci doit rapidement être désensibilisé. La désensibilisation fait intervenir différentes étapes, dont la première est l’internalisation du récepteur au niveau des endosomes précoces. Au niveau de ce compartiment, un tri sera effectué grâce à l’intervention d’une succession de protéines qui permettront soit de recycler le récepteur au niveau de la membrane plasmique, soit de le dégrader, par l’adressage aux lysosomes (Figure 7). Parallèlement, le pH acide des endosomes permettra de libérer le RCPG de son agoniste.
Figure 7 : Schématisation du trafic intracellulaire des RCPG.
Représentation schématique de la vie d’un RCPG suite à son activation au niveau de la membrane plasmique par un agoniste (Inspiré de (Hanyaloglu and von Zastrow 2008). a : internalisation ; b : recyclage ; c : dégradation. NHERF (Na+ / H+ exchanger regulatory factor) ; PDZ domain (domaine homologue retrouvé dans les protéines PSD95 (post-synaptic density protein) ; Dlg (Drosophyla disc large tumor suppressor); Zo1 (Zonula occludens 1 protein)).
a. Internalisation
La membrane plasmique d’une cellule est en perpétuel remaniement. Afin d’effectuer une rotation des protéines et des lipides la composant, de multiples mouvements d’exocytoses et d’endocytoses se réalisent. L’endocytose permet l’internalisation des protéines et s’éffectue habituellement suite à l’interaction de la protéine (ou du récepteur) à internaliser, avec une protéine adaptine. L’adaptine permet de recruter la protéine clathrine. Celle-ci ayant une forme de triskel caractéristique, l’association de plusieurs complexes protéine/adaptine/clathrine induit une invagination de la membrane, dite dans des puits recouverts de clathrine. Cette internalisation conduit à la formation d’une vésicule appelée endosome précoce.
Le routage d’un RCPG au niveau des endosomes précoces reste cependant un peu particulier. Il nécessite plusieurs signaux, dont des phosphorylations du récepteur. Le récepteur occupé par un agoniste, et libéré de l’interaction avec la protéine G, va être reconnu par des kinases de RCPG (GRK) (Figure 7). Même si aujourd’hui ceci est un paradigme, la découverte de ce phénomène prit plusieurs décennies.
L’identification de phosphorylations au niveau des RCPG a été réalisée pour la première fois en 1972 par l’équipe du Dr Stahlman, sur le récepteur rhodopsine (Bownds, Dawes et al. 1972). Les auteurs ont observé qu’une stimulation à la lumière du récepteur rhodopsine, purifié chez la grenouille, engendrait une étape de phosphorylation rapide au niveau de résidus sérine du récepteur. Ces phosphorylations pouvaient être légèrement augmentées par une stimulation lumineuse plus intense, mais elles ne dépassaient jamais plus de 50% de récepteurs phosphorylés. Les auteurs pensaient que ces phosphorylations
pouvaient être un résultat d’autophosphorylation du récepteur suite à sa stimulation, et que cette étape faisait partie intégrante de la signalisation cellulaire (Bownds, Dawes et al. 1972). Parallèlement, l’équipe du Dr Kenyon montra que ces phosphorylations n’étaient pas le produit de transfert de phosphates depuis l’AMPc ou le GMPc, et qu’elles étaient dépendantes de la présence d’ion Mg2+, donc que les phosphorylations n’étaient pas liées à la signalisation induite par l’activation du récepteur (Frank, Cavanagh et al. 1973). En 1975, l’équipe du Dr Mandel montra la présence d’une protéine kinase dans les fractions contenant le récepteur rhodopsine, protéine kinase spécifique au récepteur rhodopsine et qui phosphorylait uniquement les récepteurs activés (Virmaux, Weller et al. 1975; Weller, Goridis et al. 1975; Weller, Virmaux et al. 1975). Les auteurs émirent alors l’hypothèse que cette phosphorylation induisait une diminution de perméabilité de la membrane à proximité du récepteur, et engendrait une diminution du signal induit préalablement par la stimulation limineuse. Il s’agissait donc d’un rétrocontrôle, afin d’augmenter l’efficacité du signal reçu et éviter le « bruit de fond » (Weller, Goridis et al. 1975). Cependant, la même année, l’équipe du Dr Lefkowitz montra que des érythrocytes de grenouille exprimant le récepteur β2AR, suite à une stimulation soutenue et continue en catécholamines, développaient une tolérance à l’agoniste. Ils observèrent que l’activation de l’adénylate cyclase atteignait rapidement un plateau, puis finissait par décroitre, alors que le nombre de récepteurs au niveau de la surface cellulaire diminuait (Mukherjee, Caron et al. 1975). Le concept de désensibilisation des récepteurs venait d’apparaitre.
En 1983, l’équipe du Dr Lefkowitz démontra que la désensibilisation du récepteur β2AR suite au traitement soutenu aux catécholamines, était accompagnée de la phosphorylation du récepteur, mais uniquement que s’il était activé (Stadel, Nambi et al. 1983; Stadel, Nambi et al. 1983). Cependant, contrairement au récepteur rhodopsine, le récepteur β2AR pouvait être phosphorylé à la fois par la PKA, kinase activée par la voie de signalisation, mais également par une autre kinase (Stadel, Nambi et al. 1983). L’équipe du Dr Clark confirma ces résultats en observant qu’une lignée cellulaire ne comprenant pas d’adénylate cyclase, a ses récepteurs β2AR qui subissent une étape de
phosphorylation, malgré l’absence d’activation de la PKA (Green and Clark 1981). L’identification de la protéine kinase responsable des phosphorylations du récepteur β2AR ne fut réalisée qu’en 1986 (Benovic, Strasser et al. 1986). Le clonage de ces protéines permit d’identifier une famille de kinases : GRK, responsables de la phophorylation des RCPG (Lorenz, Inglese et al. 1991). Les sites de phosphorylations ciblés par ces GRK pour le récepteur β2AR, sont montrés en vert sur la Figure 6 (Bouvier, Hausdorff et al. 1988; Campbell, Hnatowich et al. 1991; Hausdorff, Campbell et al. 1991).
Les GRK sont des sérine/thréonine kinases, au nombre de sept chez l’homme, et réparties en trois groupes : 1- GRK1 : kinase du récepteur rhodopsine et GRK7 ; 2- GRK 2 et GRK3, kinases du récepteur β2AR, puis 3- GRK4, 5 et 6, kinases du groupe GRK4 (Premont, Inglese et al. 1995; Beautrait, Michalski et al. 2014). Les GRK ont un domaine kinase, un domaine homologue aux RGS permettant de stabiliser la conformation du domaine kinase, ainsi qu’un domaine N terminal (αN) d’environ 20 résidus en conformation hélicoïdale (Beautrait, Michalski et al. 2014). Bien que les GRK soient connues et leurs structures cristallisées depuis quelques années, leur séquence d’activation et de reconnaissance des RCPG dans leur état actif sont des éléments encore flous. D’après les dernières études, le N terminal (αN) semble être l’élément de reconnaissance du récepteur, et permettrait d’activer l’activité kinase de la protéine (Beautrait, Michalski et al. 2014).
Parallèlement à l’identification des phosphorylations et des protéines GRK, l’équipe du Dr Wilden a montré le recrutement d’une autre protéine au niveau de la membrane plasmique, suite à l’activation du récepteur rhodopsine par de la lumière (Kuhn, Hall et al. 1984). Cependent, l’activation seule du récepteur ou la phosphorylation seule des résidus ne permettent pas le recrutement de cette protéine, les deux évenements étant nécessaires. De plus, la protéine G compétitionne la liaison de cette protéine au récepteur, sauf en présence de GTPγS, suggérant que la liaison de cette protéine au récepteur ne peut s’effectuer que lorsque la protéine G s’est préalablement dissociée du récepteur (Kuhn, Hall
et al. 1984; Wilden, Hall et al. 1986). Cette protéine de 48kDa fût nommée arrestine, à cause de sa capacité à arrêter l’activation des phosphodiestérases induites par l’activation du récepteur rhodopsine (Zuckerman and Cheasty 1986). L’équipe du Dr Lefkowitz, en 1987, démontra que l’arrestine n’était pas spécifique au système visuel, mais qu’elle agissait également dans le système β2 adrénergique, donc fut nommée β-arrestine (Benovic, Kuhn et al. 1987).
Les protéines arrestines sont au nombre de quatre : l’arrestine 1, la β-arrestine 1 (β-arrestine 2), la β-β-arrestine 2 (β-arrestine 3) et l’β-arrestine 4. Elles peuvent être séparées en deux groupes : les arrestines 1 et 4 étant retrouvées uniquement dans le système visuel et sensoriel, et les β-arrestine 1 et β-arrestine 2 étant ubiquitaires (Gurevich and Gurevich 2006). Les arrestines lient les RCPG activés et phosphorylés au niveau du C terminal et au niveau des boucles intracellulaires. Les résidus phosphorylés sont nécessaires à la liaison de l’arrestine au RCPG actif (résidus en vert et bleu sur la Figure 6) (Kuhn, Hall et al. 1984; Gurevich and Gurevich 2006). Les domaines N et C terminaux de l’arrestine sont impliqués dans l’interaction avec le RCPG phosphorylé, mais la spécificité au substrat est donnée par le domaine C terminal, évitant ainsi la liaison d’arrestine avec un RCPG phosphorylé non activé, ou un RCPG non phosphorylé (Gurevich and Benovic 1992; Gurevich and Benovic 1993; Gurevich, Richardson et al. 1993). Enfin, un dernier domaine d’interaction entre les RCPG et les arrestines a été découvert en 2006, par les équipes des Drs Caron et Barack. Ces derniers ont mis en évidence que, pour la classe du récepteur rhodopsine, le motif DRY présent au niveau de la seconde boucle intracellulaire et la dizaine d’acides aminés très conservés qui l’entourent, forment le point crucial impliqué dans le recrutement des β-arrestines par les différents RCPG (Marion, Oakley et al. 2006). L’affinité des β arrestines 1 et 2 n’est pas forcément la même pour un même RCPG, permettant une classification en deux groupes dépendamment de ce paramètre. Le premier groupe, ou classe A, comporte les RCPG s’associant préférentiellement et transitoirement avec la β-arrestine 2. Le second groupe, ou classe B, est composé des RCPG qui lient avec une même affinité les β-arrestines 1 et 2, et qui ont une association stable avec les arrestines (Oakley, Laporte et al. 2000).
Parallèlement à l’identification des étapes de phosphorylations et à l’interaction avec la β-arrestine, plusieurs études ont révélé que la stimulation de cellules par l’épinéphrine induisait une redistribution rapide des récepteurs β2AR dans un compartiment intracellulaire (Harden, Cotton et al. 1980; Clark, Friedman et al. 1985). Ce n’est qu’en 1992 que les Drs von Zastrow et Kobilka démontrèrent que le récepteur β2AR activé, subit une étape d’internalisation au niveau des endosomes, dépendante de vésicules recouvertes de clathrine (von Zastrow and Kobilka 1992). Cette étape d’internalisation fût clarifiée en 1996 par les études des laboratoires des Drs Caron et Benovic (Ferguson, Barak et al. 1996; Ferguson, Downey et al. 1996; Goodman, Krupnick et al. 1996; Zhang, Ferguson et al. 1996). En utilisant des protéines recombinantes purifiées in vitro, Goodman et collaborateurs démontrèrent que les protéines β-arrestines 1 et 2 interagissent avec des molécules de clathrine, tandis que les arrestines visuelles n’interagissent pas avec la clathrine. Ceci permettrait l’internalisation du récepteur β2AR activé dans des vésicules de clathrine (Goodman, Krupnick et al. 1996). Cependant, en 1999, Laporte et collaborateurs démontrèrent que la β-arrestine 1 nécessite une interaction avec le complexe adaptateur 2 (AP2) afin de recruter la clathrine et la dynamine, et former des vésicules d’internalisation (Laporte, Oakley et al. 1999) (Figure 7 a). La même année, Gaidarov et collaborateurs démontrèrent que les arrestines permettent de recruter les récepteurs à internaliser dans des domaines membranaires lipidiques particuliers, permettant la formation des puits recouverts de clathrine. En effet, une perte d’interaction de la molécule arrestine avec les phosphoinositides membranaires induit un défaut de localisation du récepteur β2AR au niveau des puits recouverts de clathrine, causant ainsi une impossibilité de l’internaliser (Gaidarov and Keen 1999; Gaidarov, Krupnick et al. 1999). Les protéines β-arrestines régissent aussi l’internalisation des RCPG via des interactions et le recrutement d’autres protéines, dont la protéine ARNO, une ARF6-GEF. Ces protéines forment un complexe AP2 /clathrine /β-arrestine /ARNO, permettant l’internalisation des récepteurs dans les puits recouverts de clathrine (Claing, Chen et al. 2001).
Même si ce complexe commence à être bien identifié, une modification post-traductionnelle se produisant au moment de l’internalisation des récepteurs se révèle un évènement indispensable à la dégradation des RCPG. Il s’agit d’ajout d’ubiquitines. En 1996, l’équipe du Dr Riezman a observé qu’un RCPG de levure (Ste2) subissait, suite à son activation par un ligand, une étape de mono-ubiquitination, étape indispensable à son internalisation (Hicke and Riezman 1996). Ces mêmes auteurs confirmèrent leurs résultats en démontrant que l’ubiquitination necessitait au préalable la phosphorylation de la queue C terminale du récepteur par les GRK (Hicke, Zanolari et al. 1998). L’ubiquitine est une molécule de 76 acides aminés, habituellement retrouvée comme signal de dégradation, permettant la reconnaissance des protéines à dégrader par le protéasome. Cependant, les ubiquitinations subies par les récepteurs lors de leurs internalisations dans les puits recouverts de clathrine sont différentes, car il s’agit de plusieurs mono-ubiquitinations (Barriere, Nemes et al. 2006). En 2001, l’équipe du Dr Lefkowitz démontra que l’ubiquitination des récepteurs lors de leurs internalisations était également un évènement qui se déroulait chez les mammifères. Ils observèrent que l’interaction du récepteur β2AR phosphorylé avec la protéine β-arrestine est indispensable à son ubiquitination, et à sa dégradation. De plus, ils démontrèrent que la protéine β-arrestine elle-même subissait une étape d’ubiquitination lors de l’internalisation du récepteur β2AR. Les auteurs identifièrent l’E3 ubiquitine ligase Mdm2 comme protéine ayant la possibilité d’ubiquitinyler la protéine β-arrestine. Or, l’ubiquitination du récepteur β2AR, bien que dépendante de l’ubiquitinylation de la β-arrestine, n’était pas affectée par l’absence de Mdm2 (Shenoy, McDonald et al. 2001). Parallèlement, l’équipe du Dr Hicke continua d’étudier l’ubiquitination du récepteur Ste2, et montra que les ubiquitines ligases responsables étaient de la famille des ubiquitine ligases homologues à E6-AP Carboxyl Terminal (HECT), dont Nedd4 fait partie (Dunn and Hicke 2001). Enfin, en 2008, l’équipe du Dr Weissman démontra que le récepteur β2AR, dans les cellules de mammifère, était également ubiquitinylé par la E3 ubiquitine ligase Nedd 4 (Shenoy, Xiao et al. 2008).
L’ajout d’ubiquitine sur un substrat fait intervenir la succession de trois ubiquitines ligases. Les enzymes E1 (ubiquitin-activating enzyme), au nombre de deux chez l’Homme, vont activer l’ubiquitine de façon ATP dépendante, et induire le transfert de la molécule d’ubiquitine sur un site cystéine spécifique de l’enzyme. L’ubiquitine sera ensuite transférée de l’enzyme E1 sur l’enzyme E2 (ubiquitin-conjugating enzyme). Chez l’Homme, il existe 38 enzymes E2, qui vont ensuite être reconnues par l’enzyme E3, qui fixera simultanément le substrat devant être ubiquitinylé. Les enzymes E3 sont au nombre de 600 à 1000 chez l’Homme, et dénotent de la diversité des substrats ciblés. Ces enzymes vont catalyser le transfert de la molécule d’ubiquitine de l’enzyme E2 vers le substrat (Schulman and Harper 2009; Ye and Rape 2009; Alonso and Friedman 2013). Les enzymes E3 sont réparties en quatre groupes dépendamment du type de domaine ubiquitine ligase : HECT ; Ring finger ; U-box and PH finger (Nakayama and Nakayama 2006). Les enzymes E3 impliquées dans l’ubiquitination des récepteurs (RCPG ou EGFR) à internaliser sont des E3 possédant un domaine HECT, de la famille Nedd4.
Malgrè ces connaissances, le lien entre la β-arrestine, le récepteur phosphorylé et l’ubiquitine ligase Nedd4 reste flou. En 2010, l’équipe du Dr Lu identifia qu’un ancêtre de la famille des arrestines, α-arrestine (ou ARRDC : Arrestin Domain Containing), interagissait avec le récepteur β2AR actif, et permettait de recruter l’ubiquitine ligase Nedd4 (Nabhan, Pan et al. 2010). En 2012, l’équipe du Dr Alvarez démontra que la protéine α-arrestine, en plus d’interagir avec le récepteur β2AR actif et de lier la protéine Nedd4, permettait également de lier la protéine β-arrestine (Shea, Rowell et al. 2012). L’ubiquitination des récepteurs lors de leur internalisation a été démontrée pour de nombreux autres RCPG, mais la mécanistique reste encore mal définie (Puca, Chastagner et al. 2013; Qi, O'Hayre et al. 2013). De plus, dépendamment du RCPG, l’ubiquitination aura ou non une réelle incidence sur leur internalisation. En effet, il semblerait que pour certains RCPG, cette ubiquitination ne soit qu’obsolète, et dispensable à l’internalisation du récepteur dans les puits recouverts de clathrine (Henry, White et al. 2011).