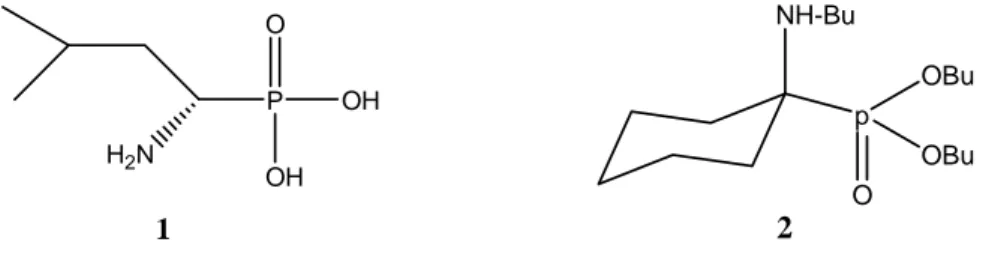راتخم يجاب ةعماج
–
ةبانع
Faculté des sciences Année 2012
Département de chimie
THESE
Présentée en vue de l’obtention du diplôme de DOCTORAT
Option
Chimie organique appliquée
Par
Samia GUEZANE LAKOUD
Soutenue le: 28 Juin 2012DIRECTRICE DE THESE:Malika BERREDJEM Professeur Université d’ Annaba
DEVANT LE JURY
PRESIDENT: Nour-Eddine AOUF Professeur Université d’Annaba
EXAMINATEURS: Mohamed ABDAOUI Professeur Université de Guelma
Zahia KABOUCHE Professeur Université de Constantine
Rachid MERDES Professeur Université de Guelma
Houria BJEBBAR Professeur Université d’Annaba
UNIVERSITE BADJI MOKHTAR-ANNABA
SYNTHESE ET ACTIVITE TOXICOLOGIQUE DES
COMPOSES AZOTES CONTENANT LE
ًف لامعلأا مها هم شبخعٌ تٌىضع ثابكشم ىهع ثاوىفسىفنا تعىمجم لاخدإ نإ .تٌسىفسىفنا ءاٍمٍكنا قشط ةذعب كنرو ،ةساخخم شخسا اىىٍما هم ءاذخبا ثاوىفسىفوذٍما هم ةذٌذج تهسهس عاىطصاب اىمق ممعنا ازه للاخ همف نزكو ،ساكٍب ـضٍناكٍم ،فوصىبسا ـضٍناكٍم معافح :اهىم لامعخساب ك جواضخنا مماع ." BOP" :مسا جحح لىحكنا تعىمجم ىهع يىخحح ثاوىفسىفوذٍما اوشضح ازه ىنإ تفاضلإاب ـ 2 )ذٍمخٍسا مٌسىفسف ًسكىحإٌد(ـ 2 لىواخٌا مٍكنأـ . (s) ( :بكشمنا ىهع لىصحهن سىهكنا تعىمجمب لىحكنا تعىمجم لاذبخساب اىمق اهذعبو s ـ) 2 مٌسىفسف ًسكىحإٌد(ـ ا )ذٍمخٍس 2 ناخٌاوسىهك مٍكنأـ .تقٍقذنا تٍحنا ثاىئاكنا ىمو ظٍبثح ًف مهاسح اهوأ ثشهظأف تٍجىنىٍب ثاسابخخلا جعضخ ثابكشمنا يزه ضعب .ثاوىفسىفىخٍكنا تعىمجم يىخحح هٌىخووذٍهافنىس شٍضحح فذهب هٌىخووذٍهافنىس ـ مٍخساو هٌىخووذٍهافنىس ثابكشم شٍضحخب اىمق امك نا ثامهكنا فوصىبسا ـضٍناكٍم معافح ،ثاوىفسىفوذٍمأ ،ثاوىفسىف :تناذ ساكٍب ـضٍناكٍم معافح ،
The introduction of phosphonate moieties in various organic molecules is very interesting in phosphorus chemistry.
In this work, we have developed the synthesis of a new series modified amidophosphonates from aminoesters previously selected, by different methods: Arbuzov reaction, Becker reaction, and using the activating agent “BOP”.
We have synthesized the amidophosphonates containing the alcohol function to prepare: (s)- 2-[diethoxyphosphoryl acetamide] 2-alkylethanol.
We than made a substitution of the alcohol function by the chlorine function to obtain: (s) - 2-[diethoxyphosphoryl acetamide] 2-alkylchloroethane.
Some of these amidophosphonates have been tested toxicological properties; they have shown an inhibition in the growth of microorganisms
We have also prepared the sulfahydantoïnes than acetyl-sulfahydantoïnes in order to synthesis the sulfahydantoïnes containing a ketophosphonate groups.
Ces travaux entrent dans le cadre de la recherche et l’amélioration des propriétés chimiques et biologiques des molécules contenant le motif phosphonate
L’introduction des groupements phosphonates dans différentes molécules organiques joue un rôle important en chimie du phosphore.
Au cours de ce travail, nous avons développé la synthèse d’une nouvelle série d’amidophosphonates à partir d’aminoesters préalablement choisis, par différentes méthodes : réaction d’Arbuzov, réaction de Becker et par une réaction de couplage en utilisation l’agent activant « BOP ».
Les amidophosphonates synthétisés précédemment ont subi une réaction de réduction pour préparer l’alcool correspondant. La chloration de ces derniers nous a permis de former des composés susceptibles d’être des précurseurs dans la synthèse des hétérocycles azotés contenant le groupement phosphonate. Les essais de cyclisation des composés chlorés n’ont pas abouti.
Certains de ces amidophodphonates synthétisés ont subi des tests toxicologiques, ils ont présenté une inhibition dans la croissance cellulaire des micro-organismes par différentes doses en fonction de temps.
Nous avons également préparé une série des sulfahydantoïnes modifiées à partir d’aminoesters et du chlorure de sulfonyle, le N-acylation de ces hétérocycles avec le chlorure de chloroacétyle, nous a permis de générer un halogène sur les sulfahydantoïnes .
La phosphorylation des composés acylé dans les conditions d’Arbuzov n’a pas abouti
A la mémoire de mon père
A ma chère maman
A mon marie
A ma sœur Assia
A ma petite fille Amira
A mon frère et mes sœurs
A ma belle mère
A mes belles sœurs et beaux frères
A tous mes proches
es travaux présentés dans cette thèse ont été réalisés au sein du laboratoire de Chimie organique Appliquée (LCOA) de l’université Badji-Mokhtar d’ Annaba.
Je souhaite tout d’abord exprimer ma gratitude envers tous les membres du jury:
Je tiens à remercie de manière très particulièrement et à exprimer ma profonde reconnaissance au professeur Malika BERREDJEM ma directrice de thèse, qui a initié, suivi et dirigé ce travail durant ces cinq années. Je la remercie pour la confiance qu’elle m’a accordée, ainsi que pour les conseils avisés qu’elle a su me prodiguer au cours de la discussion qui a été toujours fructueuse. J’apprécie fortement ses hautes qualités scientifiques et valeurs humaines. Les mots ne peuvent exprimer toute ma gratitude, car quelque soit la formulation adoptée ça sera très en dessous de la réalité.
Mes plus vifs remerciements s’adressent au professeur Noureddine AOUF directeur de laboratoire, pour m’avoir accueillie au sein de son équipe, je le remercie tout particulièrement pour ses précieux conseils, sa disponibilité, ses encouragements et sa grande volonté pour nous faire travailler dans des meilleures conditions. Je le remercie aussi pour l’honneur qu’il me fait en acceptant de présider ce jury.
Je remercie vivement le professeur Zahia KABOUCHE de l’université de Constantine pour l’attention qu’elle a bien voulu porter à ce travail en acceptant de le juger. Qu’elle soit assurée de ma sincère reconnaissance.
Je tiens aussi à remercier vivement Mohamed ABDAOUI professeur à l’université de Guelma pour m’avoir accordé un peu de leur temps précieux en acceptant de juger ce travail. Qu’il trouve ici l’expression de mes vives considérations.
Je remercie également le professeur Rachid MERDES de l’université de Guelma pour avoir voulu apporter son appréciation à cette thèse comme membre de jury. Qu’il soit assuré de ma sincère reconnaissance.
d’Annaba pour la réalisation des tests toxicologiques, et qui m’a fait l’honneur d’avoir accepté de participer à ce jury.
Je tiens à exprimer ma profonde reconnaissance au Professeur Marc LECOUVEY, chef du laboratoire de paris 13, pour m’avoir accueillie dans son laboratoire, dans le cadre du stage de courte durée. Je tiens à lui exprimer mes plus sincères remerciements pour la chaleur de son accueil, la confiance qu'il m'a témoignée et le soutien constant accordé durant mes séjours.
Je remercie également tous mes collègues de travail.
En fin, ce travail n’aurait pu être réalisé sans la compétence des services communs des universités de Constantine et Paris 13 qui ont assuré l’enregistrement des spectres RMN, IR et de Spectrométrie de masse.
Ces travaux ont été financés par:
- La direction Générale de la Recherche Scientifique et du Développement Technologique, DGRS-DT.
- Le ministère Algérien de la Recherche Scientifique, (FNR). - Le projet CMEP Franco-Algérien 08 MDU 729.
Figure 1: structures chimiques de phosphonoleucine et d’aminophosphonate….……….….3
Figure 2 : structures chimiques de quelques amidophosphonates………...4
Figure 3 : Un phosphate et phosphonate correspondant………10
Figure 4 : β-céto phosphonate………....10
Figure 5 : Structures des anti-inflammatoires contenants le motif phosphonate …...……...11
Figure 6 : Structures chimiques des cyclopropyl-phosphonates………....12
Figure 7 : Structures chimiques de quelques arylphosphonates contenant du Fluor.………13
Figure 8 : Le pyrrole phosphonate ……….13
Figure 9 : Structures des aminophosphonates………...14
Figure 10 : Structures de quelques amidophosphonates ayant une activité biologique….…28 Figure 11: Structure d’inhibiteur d’ATX. ………..…28
Figure 12: Un dérivé d’amidophosphonate antituberculeux……...………….………...29
Figure 13: Structures de quelques agents de couplages……….……….51
Figure 14: dérivé d’hydantoïne………...68
Liste des tableaux :
Tableau 1 : caractéristiques physico-chimiques et spectroscopiques d’aminoesters……...…41 chlorohydrates.
Tableau 2 : caractéristiques physico-chimiques et spectroscopiques de chloroacétamides…42 alkylacétate de méthyle.
Tableau 3 : caractéristiques physico-chimiques de amidophosphnates………...48 Tableau 4: Caractéristiques physico-chimiques de (diéthoxyphosphoryl acétamide)……...59 alkyléthanol.
Tableau 5: caractéristiques physico-chimiques de (diéthoxyphosphoryl acétamide)………..61 alkylchloroéthane.
Tableau 6: Caractéristiques physico-chimiques des tosyl amidophosphonates………….….66 Tableau 7: Caractéristiques physico-chimiques des bis-L-aminoesters sulfones………75 Tableau 8: Caractéristiques physico-chimiques des Sulfahydantoïnes……….………….….76 Tableau 9: Caractéristiques physico-chimiques des N-chloroacéthyl- Sulfahydantoïnes .….66
Schéma 1: La réaction d’Arbuzov………..…..………….. 15
Schéma 2 : Mécanisme réactionnel de la réaction d’Arbuzov………..…...15
Schéma 3 : Réaction de Perkow………..….16
Schéma 4: Synthèse d’un dérivé de morpholine contenant le groupement phosphonate… 16 Schéma 5 : Réaction séléctive d’Arbuzov ………...…..17
Schéma 6 : Synthèse de β-hydroxyphosphonate modofiés………..…………. .17
Schéma 7 : Synthèse d’un nucléoside phosphonate en utilisant le Micro-onde………..18
Schéma 8: Réaction de Michaelis-Becker……….…..18
Schéma 9: Synthèse de (S)-perillyl-dibenzylphosphonate……….……..19
Schéma 10: Synthèse de dialkyl 2-pyrazine phosphonate………..……….19
Schéma 11: Réaction d’Abramov………20
Schéma 12: Synthèse des α-aminophosphonates et des bis α-aminophosphonates …....…..20
Schéma 13: Synthèse d’un dérivé de β-cétophosphonate………..…..21
Schéma 14 : Synthèse d’oxazolidinone phosphonate……….……….21
Schéma 15: Synthèse de γ-aminophosphonates ……….….22
Schéma 16: Synthèse d’un ester α-β-insaturés………...…..22
Schéma 17 : Synthèse d’ ortho-XCF2 arylphosphonates……….…23
Schéma 18 : Synthèse de l’acide 1-hydroxyalkyl-1,1-bisphosphonique.…...…….…………23
Schéma 19: Synthèse de β-hydroxyphosphonates γ-[amino (N-p-toluènesulfonyle)]……...24
Schéma 20: Synthèse d’un dérivé de phosphonoacétamide………29
Schéma 21 : Synthèse des β-amidophosphonates………...……30
Schéma 24: Synthèse de α-amidophosphonate à partir des imines………..……31
Schéma 25: Préparation d’amidophosphonate par l’utilisation d’isocyanures…………...…32
Schéma 26: Synthèse de β-keto-γ-amidophosphonate………...33
Schéma 27: Synthèse des amidophosphonates chiraux………...33
Schéma 28: Synthèse de pipérazine amidophosphonate……….….34
Schéma 29: Synthèse des cis amides α-β - insaturés………...………34
Schéma 30: Synthèse de macrocycle à partir de phosphonoacétamide………..…….35
Schéma 31: Substitution en position α-amidophosphonate………...36
Schéma 32: Synthèse d’un dérivé d’oxazolidinone phosphonate à partir………..….37
d’amidophosphonate. Schéma 33: Addition de tiéthylphosphite sur un dérivé halogéné………...…39
Schéma 34: Equilibre phosphonate / phosphite………...40
Schéma 35 : Addition du diéthylphosphite sur un dérivé halogéné……….40
Schéma 36: Protection des acides aminés………...…….41
Schéma 37: Synthèse de (s)-2-Chloroacétamide- 2-alkylacétates de méthyle. …………..….41
Schéma 38: Synthèse des (s) 2-[diéthoxyphosphoryl acétamide] 2-alkylacétates ….………43
de méthyle. Schéma 39: Mécanisme réactionnel de la réaction d’Arbuzov………...44
Schéma 40: Synthèse des (s) 2-[diéthoxyphosphoryl acétamide] 2-alkylacétates …………..45
de méthyle. Schéma 41: Synthèse de 2-(diéthyoxyphosphoryl) acétate de méthyle ………..……48
Schéma 44: Couplage d’un acide avec un ester en utilisant le BOP………...….53
Schéma 45: Couplage d’un aminoalcool avec un hydroxyphosphonates ………….………..53
Schéma 46: Synthèse d’éthyl 3-(2-hydroxyphenoxy) benzyl butylphosphonate……….…...54
Schéma 47: Synthèse des (s)-2-[diéthoxyphosphoryl acétamide] 2-alkylacétate……. .…….54
de méthyles. Schéma 48: Mécanisme réactionnel de la synthèse d’amidophosphonates ……… .55
Schéma 49: Synthèse des (s)- 2-[2-diéthoxyphosphoryl acétamide] 2-alkyléthanols…..…..55
Schéma 50: Synthèse des (s)- 2-[2-diéthoxyphosphoryl acétamide] 2-alkylchloro-………...58
éthanes. Schéma 51: Essaie de synthése d’ aziridine chiral contenant β-ketophosphonates…………6 2 Schéma 52: Réaction de Mitsunobu………..……….…..62
Schéma 53: Synthèse de tosyl amidophosphonates……….63
Schéma 54: Essai de cyclisation……….……….65
Schéma 55 : Synthèse des sulfahydontoïnes chirales………….….……….………..69
Schéma 56: Synthèse des Boc-Sulfahydontoïnes……….………..70
Schéma 57 : Synthèse des Sulfahydantoïnes à partir de chlorure de sulfamoyle…………...71
Schéma 58: Synthèse des O-alkyl sulfahydantoïnes ………..……….…72
Schéma 59: Sulfahydantoïnes contenant le motif phosphate ………...…………...72
Schéma 60: Synthèse des bis-L-aminoesters sulfone ……….………73
Schéma 61 : Synthèse des sulfahydantoïnes à partir des bis-L-aminoesters sulfones………75
18-C-6 18-Couronne-6 HMPA Hexaméthylphosphoramide BOP (benzotriazol-1-yloxy) tris (diméthyl- HOBT Hydroxybenzotriazole lamino) phosphonium hexafluorophosphate iBu i-Butyle
CDI 1, 1-Carbonyldiimidazole ICS Isocyanate de chlorosulfonyle DBU 1 ,8- diazabicyclo [5, 4, 0] undec- iPr i-Propyle
7-ène LDA diisopropylamidure de lithium DCC N,N'-Dicyclohexylcarbodiimide n-BuLi n-Butyllithium
DEAD Diéthylazodicarboxylate NCS N- chlorosuccinimide DIAD Diisopropylazodicarboxylate t-BuNC isocyanure de tert-Butyle DMAP 4-diméthylaminopyridine TEA Triéthylamine
DIPEA N,N-Diisopropyléthylamine TFA Acide trifuoroacétique EDC 1-Ethyl-3-(3-diméthylaminopropyl) TMSBr Bromure de triméthylsilane Carbodiimide TsCl Chlorure de tosyle
HAUT (2-(7-Aza-1H-benzotriazol-1-yl)- Ts para-Toluènesulfonyle (tosyle) 1,1,3,3 tetraméthyluronium hexafluoropho- t-BuOH tert-Buthanol
sphate
DMSO Diméthlsulfoxyde MeOH Méthanol EtOH Ethanol THF Tetrahydrofurane
Réactifs
Boc tert-Butyloxycarbonyle Me Méthyle Bn Benzyle Ph Phényle Cbz benzyloxycarbonyl Pr Propyle
Et Ethyle OTs O- (p-toluènesulfonyle) i-Bu i-Butyle
i-Pr i-Propyle
ccm Chromatographie sur couche mince Rdt Rendement
IR Infrarouge RMN Résonance magnétique nucléaire J (RMN) constante de couplage R f (CCM) rapport frontal
m (RMN) multiplet ou massif SM Spectroscopie de masse M Masse molaire
s
(RMN) singuletPPm Partie par million
t
(RMN) tripletq (RMN) quadruplet
δ
(RMN) déplacement chimiqueéq équivalent N Normale
t.a température ambiante M molaire (mole/litre) j jour Δ Reflux
Chromatographie et spectroscopie
Introduction générale
Schémas synoptiques
Chapitre I
Aperçu bibliographique sur les phosphonates : Activité pharmacologique,
Synthèse et Réactivité.
I-1- GENERALITES SUR LES PHOSPHONATES
I-2- ACTIVITE PHARMACOLOGIQUE DES PHOSPHONATES
I-3-METHODES D’ACCES AUX COMPOSES CONTENANT LE MOTIF PHOSPHONATE
I-3-1 Par la réaction d’Arbuzov
I-3-1-a) Le mécanisme I-3-1-1 Synthèse de polyhalogéno-alkyl contenant le groupement
phosphonate I-3-1-2 Réaction d’ouverture du cycle d’époxyde avec
le triéthylphosphite en présence d’un catalyseur Al(OTf)3 I-3-1-4 En utilisant le Micro-onde
I-3-2 Par la réaction de Michaelis-Becker I-3-2-1 Synthèse de monotérpene phosphonate I-3-2-2 Synthèse d’hétéroaryl phosphonate
I-3-3 Par autres méthodes I-3-3-1 Par réaction de Pudovic et Abramov I-3-3-2 Synthèse d’un α-aminophosphonate et bis α-aminophosphonate I-3-3-3 A partir d’α-Lithioalkylphosphonate
10 11 14 14 16 15 18 17 18 19 19 19 21 20
I-3-3-5 Par l’Addition d'un bisphosphonate sur un aldéhyde
I-4- REACTIVITE DES PHOSPHONATES I-4-1 Synthèse d’ester α-β-insaturés
I-4-2 Synthèse de phosphonate aromatique par la réaction de Diels-Alder I-4-3 Formation de bisphosphonate par l’intermédiaire d’un α-cétophosphonate I-4-4 Synthèse d’hydroxyphosphonate
CONCLUSION
Chapitre II
Aperçu bibliographique sur les Amidophosphonates : Activité
pharmacologique, Synthèse et Réactivité
II-1- GENERALITES SUR LES AMIDOPHOSPHONATES
II-2- ACTIVITE PHARMACOLOGIQUES DES AMIDOPHOSPHONATES
II-3- METHODES D’ACCES AUX AMIDOPHOSPHONATES II-3-1 A partir d’acide phosphonoacétique II-3-2 A partir d’un amide α, β- insaturé II-3-3 A partir d’alkylation de β-amidobenzène II-3-4 A partir de N-bromoacétyle morpholine II-3-5 A partir des imines II-3-6 A partir d’isocyanures
II-3-7 A partir de diméthyl méthylphosphonate
II-3-8 A partir de chlorure d’acyle de (S)-Naproxène et (S)-Ibuprofène II-3-9 A partir de Cbz-pipérazine
II-4 REACTIVITE DES AMIDOPHOSPHONATES 22 22 22 22 23 24 25 27 27 29 29 29 30 31 31 31 32 33 34 34
II-4-2 Synthèse des macrocycles à 17 chaînons
II-4-3 Benzylation en position α-amidophosphonate
II-4-4 Synthèse d’oxazolidinone contenant un groupement phosphonate
CONCLUSION
Chapitre III
Synthèse des amidophosphonates modifiés à partir d’acides aminés.
III-1 LES PHOSPHITES III-1-1 Les trialkyles phosphites III-1-2 Les dialkyles phosphites
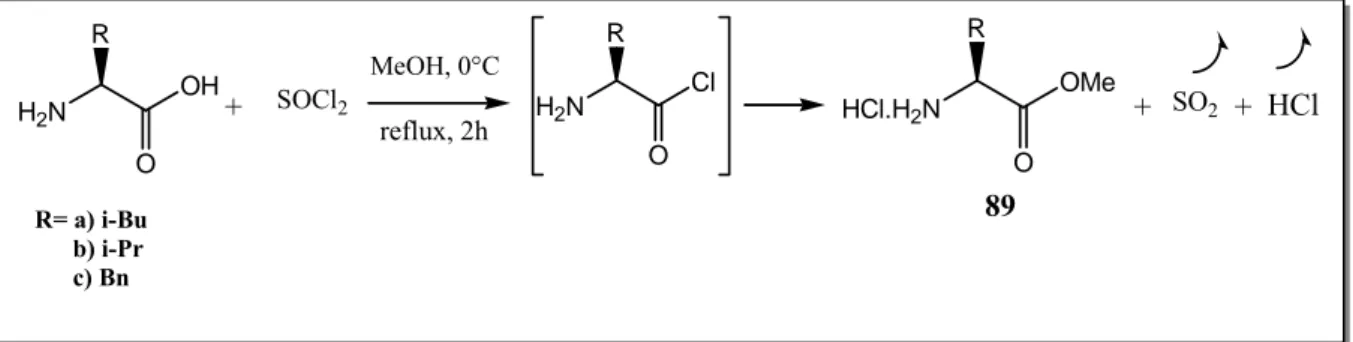
III-2 SYNTHESE D’α-CHLOROACETAMIDES CHIRAUX III-2-1 Protection des acides aminés
III-2-1-1Caractérisation III-2-2 Synthèse des (s)-2-chloroacétamide- 2-alkylacétates de méthyle
III-2-2-1 Caractérisation
III-3 SYNTHESE DES AMIDOPHOSPHONATES III-3-1 Selon la voie A
III-3-1-1 Par la réaction de Michaelis-Arbuzov III-3-1-2 Par la réaction de Michaelis-Becker III-3-1-a) Caractérisation III-3-2 Selon la voie B III-3-2-1 Phosphorylation III-3-2-1-1 Caractérisation III-3-2-2 Saponification III-3-2-2-1 Caractérisation III-3-2-3 Réaction de couplage
III-3-2-3-1 Généralité sur les agents de couplages 36 35 35 39 37 39 39 40 40 41 41 42 44 44 44 45 46 48 48 48 49 49 51 51
III-3-2-3-2 a) Préparation de phosphopeptides C-terminaux III-3-2-3-2 b) Couplage d’acide carboxylique conjugué avec l’aminoester chlorhydrate III-3-2-3-2 c) Synthèse de l’éthyl-Boc-S-phénylalaninyl -4-(Boc-imino) benzylphosphonate III-3-2-3-2 d) Synthèse de l’éthyl 3-(2-hydroxyphenoxy) benzyl butylphosphonate.
III-3-2-4 Synthèse des amidophosphonates en utilisant le BOP III-3-2-4-a) Mécanisme réactionnel
III-4 REDUCTION DES AMIDOPHOSPHONATES III-4-1 Caractérisation
III-5 CHLORATION DES AMIDOPHOSPHONATES III-5-1 Caractérisation
III-6 ESSAIS DE CYCLISATION III-6-1 Essai de la préparation d’aziridine chirale III-6-2 Essai de la préparation d’un 4,5 dihydro-oxazole contenant
le motif phosphonate III-6-2-1 Réaction de tosylation
III-6-2-1-1 Caractérisation III-6-2-2 Essai de la préparation dihydro 4,5-oxazol phosphonate
CONCLUSION
Chapitre IV
Synthèse des Sulfahydontoïnes modifiées.
IV-1 GENERALITES SUR LES SULFAHYDANTOÎNES
IV-2 METHODES D’ACCES AUX SULFAHYDANTOÎNES
52 52 53 53 54 55 55 56 58 58 62 62 63 63 63 65 66 68 69
IV-1-2 Synthèse de Boc-Sulfahydontoïne IV-1-3 A partir d’un aminoesters
IV-3 REACTIVITE DES SULFAHYDANTOÎNES
IV-3-1 Réaction de condensation IV-3-2 Réaction de phosphorylation
IV-4 SYNTHESE DES SULFAHYDANTOÎNES IV-4-1 Synthèse des bis-L-aminoesters sulfone
IV-4-1-1 Caractérisation IV-4-2 Cyclisation des bis-L-aminoesters sulfone
IV-4- 2-1 Caractérisation IV-4-3 Acylation des sulfahydantoïnes
IV-3-1 Caractérisation CONCLUSION
Chapitre V
PROTOCOLES EXPERIMENTAUX CONCLUSION GENERALEAnnexe
EVALUATION TOXICOLOGIQUE 70 70 71 71 72 72 73 74 75 75 76 76 77 78 101Le travail rapporté dans cette thèse, en vue de l’obtention du titre de docteur, a fait l’objet de deux publications, une parue et l’autre est en cours :
1- Efficient method for the synthesis of -amidophosphonates via the Michaelis-Arbuzov reaction.
Samia Guezane Lakoud, Malika Berredjem, and Nour-Eddine Aouf. Journal of
Phosphorus, Sulfur, and Silicon. 2012, 187, 762–768.
2- Evaluation Toxicologique des nouveaux amidophosphonates.
Samia Guezane Lakoud, Malika Berredjem, Nour-Eddine Aouf and Houria DJEBBAR. Soumise au Journal: Toxicological and environment chemistry.
Introduction générale :
e phosphore joue un rôle primordial dans la chimie du vivant et est prépondérant dans de nombreux biomolécules et métabolites biologiques.
Les analogues d’acides phosphoniques et leurs dérivés phosphonates ont été largement étudiés en biochimie et en médecine 1. Jusqu’à maintenant, ils ont vu des applications en tant qu’agents antibactériens 2, inhibiteurs d’enzymes 3; tels que synthase 4, protéase du VIH 5, rénine 6, l’activité phosphatase 7, des agents anti VIH 8, antifongiques 9, herbicides 10, antitumoraux 11, ils ont été aussi utilisé comme haptènes pour la génération d’anticorps catalytiques 12, et incorporés dans des analogues peptidiques13.
Ainsi, une série d’acides phosphoniques dérivés de la phényl phénylalanine a été étudiée dans le but d’optimiser la structure d’un inhibiteur de l’endopeptidase neutre14.Cette
protéine de zinc membranaire est impliquée dans la dégradation d’une hormone vasodilatatrice et son inhibition pourrait ainsi prévenir l’hypertension et le risque d’infarctus
15.
1 Palacios, F.; Alonso, C.; de los Santos, J. M. Chem. Rev. 2005, 105, 899–931.
2 Allen, J. G.; Arthenton, F. R.; Hall, M. J.; Hassall, C. H.; Holmes, S. W.; Lambert, R. W.; Nisbert, L. J.; Ringrose, P. S. Nature. 1978, 272, 56–58.
3 (a) Kolodiazhnyi, O. I. Tetrahedron: Asymmetry 2005, 15, 3295–3340; (b) Smith, W. W.; Bartlett, P. A. J. Am. Chem. Soc. 1998, 120, 4622–4628.
4 (a) Emgenbroich, M.; Wulff, G. Chem.dEur. J. 2003, 9, 4106–4117; (b) Sikorski, J. A.; Miller, M. J.; Braccolino, D. S.; Cleary, D. G.; Corey, S. D.; Font, J. L.; Gruys, K. J.; Han, C. Y.; Lin, K.-C.; Pajengraa, P. D.; Ream, J. E.; Schnur, D.; Shah, A.; Walker, M. C. Phosphorous, Sulfur Silicon Relat. Elem. 1993, 76, 375–378.
5 (a) Senten, K.; Daniels, L.; Var der Veken, P.; De Meester, I.; Lambeir, A.-M.; Scharpe´ , S.; Haemers, A.; Augustyns, K. J. Comb. Chem. 2003, 5, 336–344; (b) Stowasser, B.; Budt, K.-H.; Jian- Qi, L.; Peyman, A.; Ruppert, D. Tetrahedron Lett. 1992, 33, 6625–6628.
6 Patel, D. V.; Rielly-Gauvin, K.; Ryono, D. E. Tetrahedron Lett. 1990, 31, 5587–5590.
7 Beers, S. A.; Schwender, C. F.; Loughney, D. A.; Malloy, E.; Demarest, K.; Jordan, J. Bioorg. Med. Chem. 1996, 4, 1693–1701.
8 Huang, J.; Chen, R. Heteroat. Chem. 2000, 11, 480–492.
9 (a) Maier, L.; Diel, P. J. Phosphorous, Sulfur Silicon Relat. Elem. 1994, 90, 259–279; (b) Maier, L.; Diel, P. J. Phosphorous, Sulfur Silicon Relat. Elem. 1991, 57, 57–64.
10 (a) Yager, K. M.; Taylor, C. M.; Smith, A. B., III. J. Am. Chem. Soc. 1994, 116, 9377–9378; (b) Natchev, I. A. Liebigs Ann. Chem. 1988, 861–867.
11 Lavielle, G.; Hautefaye, P.; Schaeffer, C.; Boutin, J. A.; Cudennec, C. A.; Pierre´, A.. J. Med. Chem. 1991, 34, 1998–2003.
12 Lerner, R. A. ; Benkovic, S. J. ; Schultz, P, G.; Science. 1991, 252, 659-667. 13 Kalarski, P.; Leczak, B.; Phosphorus, Sulfur, and Silicon. 1991, 63, 193-215. 14 Ried, W. ; Keil, G. Liebigs. Ann. Chem. 1958, 616, 108.
15 De Lombaert, S. ; Blanchard, L. ; Tan, J. ; Sakane, Y. ; Berry, C. ; Ghai, R. D. Bioorg. Med. Chem. Lett. 1995, 5, 145.
Les aminophosphonates sont considérés comme une classe importante de composés, car ils présentent plusieurs activités biologiques intéressantes. Leur structure rappelle en effet celle des α-aminoacides. Ils trouvent de nombreuses applications en tant qu’analogues de peptides 16, qu’agents antibiotiques et pharmaceutiques 17 et en tant qu’inhibiteurs
enzymatiques peptidiques18 ou non peptidiques, dérivés par exemple d’un seul acide aminé.
Par exemple, le phosphonoleucine (1) est un inhibiteur de leucine aminopeptidase 19, l’aminophosphonates (2) est utilisé comme herbicide 20 (Fig.1).
Figure 1 : Structures chimiques d’aminophosphonate.
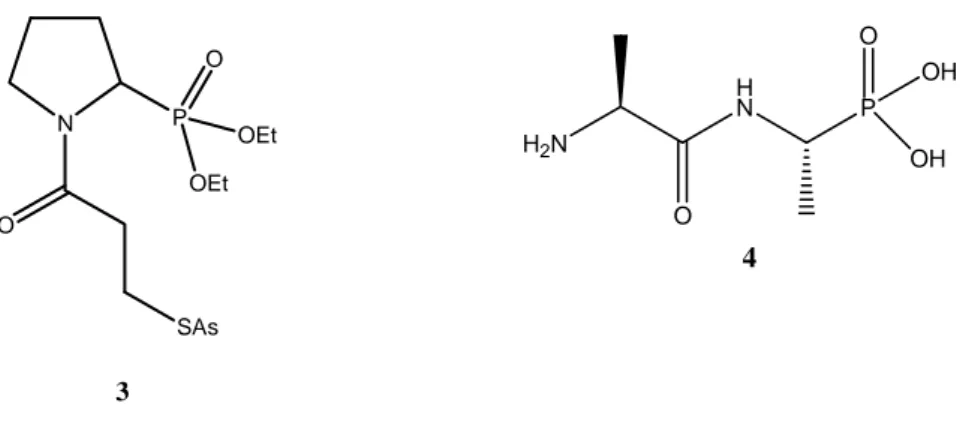
Les amidophosphonates ont une activité pharmacologique très élevée due à l’association des deux fonctions carboxamide et phosphonate 21.
On retrouve que le dérivé de la proline (3) contient les deux motifs amide et phosphonate; est un inhibiteur de l’angiotensine utilisé qu’agent anti-hypertenseur 22.
Récemment, les amidophosphonates de type alafosfalin (4) montre une activité antibactérienne 23 (Fig. 2).
16 Jacobsen, N. E. ; Bartlett, P. A. J. Am. Chem. Soc. 1981, 103, 654 ; Kafarski, P. ; Lejczak, Phosphorus, Sulfur, Silicon Relat.Elem. 1991, 63, 193.
17 Atherton, F. R.; Hassal, C. H. ; Lambert, R. W. J. Med. Chem. 1986, 29, 29.
18 Allen, M. C. ; Fuhrer, W. ; Tuck, B. ; Wade, R. ; Wood, J. M. J. Med. Chem. 1989, 32, 1652. 19 Drag, M.; Grembecka, J.; Pawelczak, M.; Kafarski, P. Eur. J. Med. Chem. 2005, 40, 764–771. 20 Moore, J. D.; Sprott, K. T.; Hanson, P. R. J. Org. Chem. 2002, 67, 8123–8129.
21 Tay. M. K, About-Jaudet, E, Collignon. N, Savignac. P, Tetrahedron, 1989, 45, 4415-4430. 22 Petrillo, E. W. U.S. Patent 4,186,268, 1980; Chem. Abstr. 1980, 93, 8008.
23 Ordonez. M., Rojas-Gabrera. H., Cativiela. Carlos. Tetrahedron. 2009, 65, 17-49.
H2N P O OH OH 1 NH-Bu p O OBu OBu 2
Figure 2 : Structures chimiques de quelques amidophosphonates.
En dehors de leur activité biologique, les phosphonates sont d’excellents intermédiaires en chimie organique puisqu’ils permettent la création de liaisons carbone– carbone de manière efficace. Plus particulièrement, ils sont très utiles pour la synthèse de cétones α, β-insaturées en employant la réaction de Horner–Wadsworth–Emmons (HWE)24
.
Sur la base de ces travaux et dans le domaine de la recherche de nouveaux composés contenant le motif phosphonate, notre choix s’est porté sur la synthèse des nouveaux dérivés d’amidophosphonates.
Le travail que nous présentons dans cette thèse est composé de cinq chapitres. Le premier chapitre concerne la mise au point bibliographique sur l’intérêt biologique et chimique des composés contenant les groupements phosphonates, ainsi que les différentes méthodes d’accès à ces molécules.
Dans le deuxième chapitre, nous décrirons un rappel bibliographique sur l’activité pharmacologique et les différentes méthodes d’accès aux amidophosphonates, ainsi que leurs réactivités chimiques.
Dans le troisième chapitre, nous aborderons la synthèse des amidophosphonates par deux voies A et B
24Maryanoff, B. E.; Reitz, A. B. Chem. Rev. 1989, 89, 863.
H2N O H N P O OH OH 4 N SAs O P O OEt OEt 3
La voie A : consiste à l’application de deux méthodes ; la réaction d’Arbuzov et la réaction de Michaelis-Becker.
La voie B : se traduit par la réaction de couplage en utilisant l’agent activant « BOP ».
Dans ce chapitre nous décrirons la synthèse d’un dérivé du chloro-amidophosphonate chiral, et puis les essais de cyclisations.
Le quatrième volet de cette thèse est concentré à la synthèse des sulfahydantoïnes, puis la synthèse du N-chloroacetyl sulfahydantoïnes dans le but de préparer des hétérocycles azotés contenant le motif phosphonate.
Les protocoles expérimentaux seront rassemblés dans le cinquième chapitre.
En annexe sera présentée l’évaluation toxicologique de quelques amidophosphonates synthétisés.
Schéma synoptique de la voie I
Schéma synoptique de la voie II
O Cl Cl + R CO2CH3 NH2.HCl * Cl O R CO2CH3 * réaction d'Arbuzov Réaction de Becker P O H N R CO2CH3 O EtO EtO * réduction P O H N R O EtO EtO * OH chloration réaction de Mitsunobu P O N O EtO EtO R * P O H N R O EtO EtO * Cl O N R P O EtO EtO * acylation cyclisation R= i-Bu i-Pr BnSchéma synoptique de la voie II
R CO2CH3 NH2.HCl * Phosphorylation P O H N R CO2CH3 O EtO EtO * réduction P O H N R O EtO EtO * OH tosylation P O H N R O EtO EtO * OTs O N R P O EtO EtO * cyclisation Br-CH2-CO2CH3 P O OCH3 O EtO EtO saponification P O OH O EtO EtO BOP R= i-Bu i-Pr Bn N P O EtO EtO R *Schéma Synoptique III
, R CO2CH3 NH2.HCl TEA (3éq), CH2Cl2 0°C, 15mn R CO2CH3 NH2 SO2Cl2 0°C, 45mn 3h, ta cyclisation HN S N R O R CO2CH3 * O O N S N R O R CO2CH3 * O O O Cl acylation N S N R O R CO2CH3 * O O O P O EtO EtO réaction d'Arbvuzov SO2 N H NH R CO2CH3H3CO2C R R= i-Bu i-pr BnAperçu bibliographique sur les phosphonates :
Activité pharmacologique,
I-1- GENERALITES SUR LES PHOSPHONATES :
Dans la plupart des composés, le phosphore se trouve dans son état d’oxydation le plus élevé et se présente sous forme de phosphate (5), la substitution d’un atome d’oxygène par un groupement méthylène fournit le phosphonate correspondant (6) (Fig 3).
Phosphate 5 Phosphonate 6
Figure 3: Un phosphate et phosphonate correspondant.
Les acides phosphoniques et leurs dérivés ont été préparés et étudiés comme analogues isostères d'acides carboxyliques. Parmi les exemples des groupements phosphonates les plus pertinents, on retrouve les acides nucléiques, les phospholipides, des polysaccharides. Le phosphore se trouve aussi dans l’acide désoxyribonucléique (ADN) porteur, entre autres, de l’information génétique chez les êtres vivants, et dans certaines protéines.
Les phosphonates sont d’excellents intermédiaires en chimie organique puisqu’ils permettent la création de liaisons carbone–carbone de manière efficace. Plus particulièrement, les β-céto phosphonates (7) sont très utiles pour la synthèse de cétones α, β-insaturées en employant la réaction de Horner–Wadsworth–Emmons (HWE) 1 (Fig. 4)
Figure 4 : β-céto phosphonate.
1
Maryanoff, B. E.; Reitz, A. B, Chem. Rev. 1989, 89, 863.
P O RO RO C H2 C O R' 7
I-2- ACTIVITE PHARMACOLOGIQUE DES PHOSPHONATES :
Bien qu’ayant un profit pharmacologique particulièrement intéressant, les phosphonates ont suscité l’intérêt de la communauté scientifique et le nombre d’études concernant leur synthèse ou leur activité biologique ne cesse de croître 2, 3. La raison d’un tel engouement provient principalement de la différence de stabilité relative des groupements phosphate et phosphonate. Les phosphates ont tendance à s’hydrolyser notamment au contact des phosphatases digestives et par conséquent cela en fait de mauvais candidats en tant que médicaments. La faible stabilité métabolique de cette fonctionnalité diminue fortement la biodisponibilité de drogues potentielles et, par conséquent, leur efficacité.
La substitution d’un atome d’oxygène par un atome de carbone permet généralement d’accéder à des composés aussi actifs, mais plus stables et plus lipophiles, ce qui empêche leur hydrolyse par les phosphatases.
Beaucoup de phosphonates ont des applications en médecine, par exemple les époxyphosphonates sont utilisés comme antibactériens, les analogues nucléosidiques phosphonates comme des antiviraux, et les bisphosphonates en tant que médicaments pour le traitement des maladies osseuses multiples 4.
Des composés phosphorés contenant des hétérocycles tel que; les Oxaphospholes (8), l’oxaphosphinine (9) et le vinyloxaphosphinine phosphonate (10) ont été décrits comme des anti-inflammatoires 5(Fig. 5).
Figure 5: Structures chimiques des anti-inflammatoires contenant le motif phosphonate.
2 Wiemer, D. F. Tetrahedron. 1997, 53, 16609. 3 Engel, R. Chem. Rev. 1977, 77, 349.
4Teresa, B. M.; Faísca, P. A. M. Tetrahedron Asymmetry. 2010, 21, 2746–2752.
5Abdou, W. M.; Kamel, A. A.; Shaddy, A. A. European Journal of Medicinal Chemistry. 2010, 45, 5217-5224. O P O OEt O Me Me R 1a, R= CN 1b, R=CO2Me 1c, R= CO2Et 8 2a, R= CN 2b, R=CO2Me 2c, R= CO2Et 9 P O S Br R O OEt Me 10 P O S Me O OEt Me H (EtO)2P H O
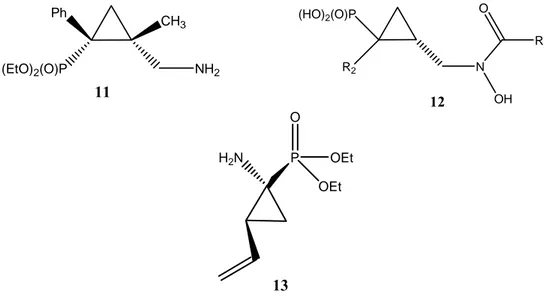
Des études récentes ont montré une excellente activité antidépresseur et antibiotique de 2-aminométhyl cyclopropyl-phosphonate (11) et d’acide 2-[(N-Hydroxy) carbamoylméthyl-cyclopropyl] phosphonique (12) respectivement 6, et le diéthyl 1-amino-2-vinylcyclopropane-1-phosphonate comme inhibiteur de protéase du VHC (13)7(Fig. 6)
Figure 6: Structures chimiques des cyclopropyl-phosphonates.
Il y a eu un intérêt croissant dans la synthèse des arylphosphonates contenant du fluor. Certains de ces composés ont été utilisés comme des additifs efficaces dans la composition élastomère acrylique (14), comme photo stabilisant des polymères (15), comme la construction blocs dans la synthèse des catalyseurs pour la polymérisation d'éthylène (16). Par ailleurs, leurs dérivés benzimidazole montrent une bonne activité biologique vers la protéine kinase AMP, utile pour la prévention de diabète (17) (Fig. 7)8.
6 El-Gokha, A.; Maas, G. Tetrahedron. 2011, 67, 2849-2857.
7 Pyun, H-J.; Chaudhary, K.; Somoza, J. R. X.; Sheng, C.; Kim, C. U. Tetrahedron Lett. 2009, 50 3833–3835.
8 Tverdomed, S. N.; Kolanowski, J.; Lork, E.; Röschenthaler, G-V. Tetrahedron. 2011, 67, 3887-
3903. Ph (EtO)2(O)P CH3 NH2 11 (HO)2(O)P R2 N OH O R 12 H2N P O OEt OEt 13
Figure 7: Structures chimiques de quelques arylphosphonates contenant du Fluor.
Les phosphonates liés à un hétérocycle azoté sont décrits comme des classes importantes de composés ayant un potentiel biologique autant que bioisostères. Par exemple le pyrrole phosphonate est décrit en tant que modulateur pour l'excitabilité du système nerveux central, et cela par leur capacité d'action sur les sites liant les canaux fermés du récepteurs GABA (Arho) (Fig. 8) 9.
Figure 8 : Structure chimique de pyrrole phosphonate
De nos jours, les phosphonates et particulièrement l’aminophosphonates sont utilisés quotidiennement dans plusieurs secteurs d'activités 10-11-12-13.
9 Ayhan, S. Demir, Servet, Tural. Tetrahedron. 2007, 63, 4156-4161. 10
Atherton, F. R.; Hassall, C. H.; Lambert, R. W. J. Med. Chem. 1986, 29, 29. 11 De Lombaert, S.; Blanchard, L.; Tan, T. Bioorg. Med. Chem. Lett. 1995, 5, 145. 12 Kafarski, P.; Lejczak, B. Current Med. Chem.: Anti-Cancer Agents, 2001, 1, 301. 13 Emsley, J.; Hall, D. The chemistry of phosphorus, Harper and Row, London. 1976.
(EtO)2(O)P (CF2)7CF3 14 F3C P(O)(OEt)2 NO2 NO2 15 CF3 F3C OH P(O)(OEt)2 16 N H N N O Cl C F2 P(O)(OEt)2 17 N H P OR O MeO MeO 18
Par exemple, le Buminafos, est utilisé comme régulateur de la croissance des plantes dans l'industrie agrochimique, le glyphosate (Round up©) est un pesticide le plus utilisés au monde, le Fyrol 6 © est utilisé comme ignifuge dans différents matériaux (Fig. 9).
Figure 9: Structures chimiques des aminophosphonates.
I-3- METHODES D’ACCES AUX COMPOSES CONTENANT LE MOTIF PHOSPHONATE:
Plusieurs voies de synthèse permettent d’accéder à ce type de composés ont été décrites dans la littérature, nous citerons les exemples suivants.
I-3-1 Par la réaction d’Arbuzov :
Parmi les nombreuses méthodes disponibles pour la synthèse des phosphonates, on retrouve la réaction de Michaelis–Arbuzov qui est probablement la plus utilisée.
Originalement découverte par Michaelis et al en 1898 14et reprise plus en détail par
Arbuzov quelques années après 15. Cette réaction permet, entre autres, d’accéder aux
phosphonates de manière relativement simple en faisant réagir à chaud un trialkylphosphite sur un halogénure d’alkyle en absence de solvant (Schéma 1).
14 Michaelis, A.; Kaehne, R. Ber. Dtsch. Chem. Ges. 1898, 31, 1048. 15 a Arbuzov, A. E. J. Russ. Phys. Chem. Soc. 1906, 38, 687.
b Arbuzov, A. E. J. Russ. Phys. Chem. Soc.1910, 42, 395.
P N OH OH O EtO EtO Fyrol 6 19 P O O O HN Buminafos 21 HOOC NH P OH HO O
Glyphosate (Round up)
Schéma 1 : Réaction d’Arbuzov
En ce qui concerne la synthèse des composés organophosphorés, cette réaction apparaît la plus utilisée et étudiée.
Cette voie de synthèse comprend deux étapes principales16 :
1- une quaternisation initiale de trialkylphosphite par attaque nucleophile sur l’halogénure d’alkyle.
2- une déalkylation du cation alkoxyphosphonium par l’anion lébéré suivant le mécanisme ci-dessous (schéma 2) :
I-3-1-a) Le mécanisme:
Schéma 2: Mécanisme réactionnel de la réaction d’Arbuzov.
Il existe cependant, une limitation importante dans la réaction d’Arbuzov: les cétones chlorées ou bromées en position α sont sujettes à une réaction parasite qui conduit à la formation d’un phosphate de vinyle (schéma 3).
Cette réaction est connue sous le nom de réaction de Perkow 17-18. Afin de supprimer cette réaction secondaire, il est nécessaire de recourir à des électrophiles plus réactifs; les
cétones iodées sont moins sujettes à la réaction de Perkow 19 et exclut l’utilisation
d’halogénures secondaires comme les cétones cycliques.
16 Bhattacharya, A. K., Thyagarajan, G. Chem. Rev. l 98l, 81,415. 17 Arbuzov, B. A. Pure Appl. Chem. 1964, 9, 307.
18 a Perkow, W.; Ullerich, K.; Meyer, F. Naturwiss. 1952, 39, 353.
b Perkow, W. Chem. Ber. 1954, 87, 755. 19 Lichtenthaler, F. W. Chem. Rev. 1961, 61, 607.
P(OR)3 R'-X P O RO RO R' + R-X P RO OR R' X P O RO OR R' + R OR X -P RO R' OR O + R X
Schéma 3: Réaction de Perkow.
I-3-1-1 Synthèse de polyhalogénoalkyl contenant le groupement phosphonate :
Tarasenko K et al 20 ont synthétisé un polyhalogènoalkyl contenant le phosphonate (25a- e) à partir d’une énaminones (24a-e) et le triéthylphosphite, par chauffage dans le 1,4 dioxane. En présence du groupement perfluoroalkyl dans l’énaminones (24b-c), la réaction donne un excellent rendement dans un temps court.
Ils ont observé que la substitution nucléophile exclusivement du brome puis l’obtention de trihalogénométhyle contenant le phosphonate (25d-e) donne de bons rendements, et l'inactivité similaire du chlore avec des phosphites pour les deux groupes ; trichlorométhyle (e) et chlorodifluorométhyle (d) (schéma 4).
Schéma 4: Synthèse d’un dérivé de morpholine contenant le groupement phosphonate.
20Tarasenko K, V.; Manoylenko, O. V.; Kukhar, V. P.; Röschenthaler, G-V.; Gerus, I. I. Tetrahedron Lett. 2010, 51, 4623–4626. O R OMe Br2, CH2Cl2, 25°C, 1h Pyridine, 0°C, 1h 80-93% O R Br OMe N O Br O R N O P(O)(OEt)2 O R morpholine, CH2Cl2, 0-25°C 8h, 59-85% P(OEt)3, 1.4-dioxane, 50-100°C 72-120h, 70-85%
22a-e 23a-e 24a-e
25a-e 22-25 R a b c d e CF3 C2F5 C3F7 CF2Cl CCl3 X O R P(OEt)3 (EtO)2P O R O Et X O R P(OEt)2 O Et X O R P(OEt)2 O EtX
On peut aussi noter que la réaction sélective d’Arbuzov entre le produit (27) qui contient deux chlores et le triéthylphosphite dans le toluène à reflux conduit à un seul produit (28). Il est à noter qu’aucune trace du produit de double substitution n’a pu être détectée. Cette sélectivité s’explique sans doute par l’encombrement stérique engendré par l’hydrazone (schéma 5) 21.
Schéma 5 : Réaction séléctive d’Arbuzov.
I-3-1-2 Réaction d’ouverture du cycle d’époxyde avec le triéthylphosphite en présence d’un catalyseur Al(OTf)3:
La réaction d’ouverture des différents époxydes avec le triéthylphosphite en utilisant le catalyseur Al(OTf)3 dans le n-hexane à reflux, a été décrite par Sobhani S et al 22. Cette
réaction a été réalisée avec une régéoséléctivité totale pour obtenir le β-hydroxyphosphonate (30) avec un rendement élevé.
Par ailleurs, les résultats montrent que le triéthylphosphite attaque le cycle d’époxyde (29) dans les conditions d’Arbuzov même en présence d’autres fonctions (avec différents R), donc une excellente chimioséléctivité a été observée dans cette méthode (schéma 6).
Schéma 6 : Synthèse des β-hydroxyphosphonates modifiés.
21 Gorbel, B.; Medinger, L.; Haelters, J. P. Sturtz. G. Synthesis. 1985, 1048. 22 Sobhani. S, Vafaee. A, Tetrahedron. 2009, 65, 7691–7695.
O R + P(OEt)3 Al(OTf)3(10mol%) n-hexane, reflux R OH P O OEt OEt R: a- O b-CH2-Cl c-O O 29 30 O Cl Cl NH O OMe H2N Et2O, t.a Cl N NH O OMe P(OEt)3
toluène, reflux (EtO)
2P Cl N O NH O OMe Cl 26 27 28
I-3-1-4 En utilisant le Micro-onde :
Suzanne Peyrottes et al 23 ont synthétisé un nucléoside contenant un groupement phosphonate (32) en utilisant 5 équivalents de triéthylphosphite sous micro-onde, ces composés sont des intermédiaires utiles dans la synthèse des organophosphorés, le produit est obtenu avec un excellent rendement (schéma 7).
Schéma 7 : Synthèse d’un nucléoside phosphonate.
I-3-2 Par la réaction de Michaelis-Becker:
Les phosphonates peuvent également être synthétisés par la réaction de Michaelis– Becker, décrite pour la première fois en 1897 24. Il est nécessaire de générer l’anion d’un dialkylphosphite que l’on fait réagir sur un dérivé halogéné, l’hydrure de sodium est ainsi utilisé à basse température (Schéma 8).
Schéma 8: Réaction de Becker.
I-3-2-1 Synthèse de monoterpène phosphonate :
Le monoterpène (S)-perilliol (33) a été facilement transformé en chlorure de perillyl (34) en utilisant la procédure de Corey-Kim 25.
23Peyrottes. S.; Gallier. F.; Béjaud. J.; Périgaud. C. Tetrahedron Lett. 2006, 47, 7719-7721. 24 Michaelis, A.; Becker, T. Ber. Dtsch. Chem. Ges. 1897, 30, 1003.
25 Corey, E. J.; Kim, C. U.; Takeda, M. Tetrahedron Lett. 1972, 4339.
O O O O O I P(OEt)3 O O O O O (OEt)2P O + P(OEt)3 O 31 32 (RO)2PH (RO)2P O R' + R'-X NaH, THF 0°C O
Le Couplage de ce dernier avec le sel de sodium de dibenzylphosphite sous les conditions de Michaelis-Becker conduit au (S)-perillyl-dibenzylphosphonate (35) correspondant avec un rendement pratiquement quantitatif (schéma 9)26.
Schéma 9: Synthèse de (S)-perillyl-dibenzylphosphonate.
I-3-2-2 Synthèse d’hétéroaryl phosphonate :
La réaction de l’halogénopyrazine (36) avec le diisopropylphosphite en utilisant le catalyseur Pd(PPh3)4 et le N, N-diisopropyléthylamine comme base fournit le dialkyl
2-pyrazine phosphonate (37) avec un rendement élevé (schéma 10) 27.
Schéma 10: Synthèse de dialkyl 2-pyrazine phosphonate.
I-3-3 Par autres méthodes:
I-3-3-1 Par réaction de Pudovik et Abramov
:
Les réactions de Pudovik et Abramov représentent les plus importants modes de phosphorylation des composés organiques par la création d’un dérivé tétra-coordonné avec une liaison P-C 28.
26Eummer, J. T.; Gibbs, B. S.; Zahn, T. J.; Sebolt-Leopold, J. S and Gibbs, R. Bioorganic & Medicinal Chemistry. 1999, 7, 241-250.
27 Belabassi, Y.; Alzghari, S.; Montchamp, J-L. Journal of Organometallic Chem. 2008, 693, 3171–3178.
28 Pudovik, A. N.; Konovalova, I. V. Synthesis. 1979, 79, 81.
N P O H i-PrO i-PrO + N P O i-PrO i-PrO cat. Pd(PPh3)4 (i-PrO)2EtN X X= Br, Cl 36 37 OH Cl P O OBn OBn NCS, Me2S, CH2Cl2, Ta 96% P O H OBn OBn NaH, THF/HMPA, 0°C to Ta (98%) 33 34 35
Alors que la réaction d’Abramov (schéma 11) consiste en l’addition d’un dialkylphosphite sur le groupement carbonylé d’un composé organique, la réaction de Pudovik, quant à elle est caractérisée par l’addition du phosphore sur un alcène activé.
Ces deux réactions impliquent la rupture de la liaison P-H dans une étape préliminaire induite par la présence d’une base dans le milieu.
Schéma 11: Réaction d’Abramov
I-3-3-2 Synthèse d’un α-aminophosphonate et bis α-aminophosphonate:
Les composés α-aminophosphonate et bis α-aminophosphonate (38 et 39) respectivement, présentent une activité biologique très élevée, Rezaei. Z et al 29 ont synthétisé ces composés à partir de: benzaldéhyde, aniline et diéthylphosphite dans le THF à température ambiante en présence d’un catalyseur FeCl3 (schéma 12).
Schéma 12: Synthèse des α-aminophosphonates et des bis α-aminophosphonates.
29 Rezaei, Z.; Firouzabadi, H.; Iranpoor, N. Ghaderi, A.; Jafari, M. R.; Jafari, A. A.; Zare, H. R. European Journal of Medicinal Chem. 2009, 44, 4266–4275.
X O H + H P O OEt OEt FeCl3, THF H2N H2N Y NH2 N H P X OEt O EtO X NH P OEt EtO O Y N H P OEt EtO O X 38 39 X= 4-Me, 4-OMe, 4-OH, 4-Cl, 4-NO2
Y= -O-, -CH2-, -C=O P O H RO RO + O R' R" P O C RO RO OH R' R" R' = Alkyl, Arom R" = H, Alkyl Base
I-3-3-3 A partir de α-Lithioalkylphosphonate :
Narkunan, K et al 30 ont synthétisé un dérivé de phosphonate par une autre méthode, en utilisant l’acylation de dialkylphosphonate de lithium à basse température (-78°) qui conduit au β-cétophosphonate (41) correspondant (schéma 13).
Schéma 13: Synthèse d’un dérivé de β-cétophosphonate
I-3-3-4 A partir de diéthyl chlorophosphonate :
La phosphorylation de benzyloxazolidinone est effectuée à partir de diphényl ou diéthyl chlorophosphonate en présence de n-BuLi dans le THF à -78°C (schéma 14)31.
Schéma 14 : Synthèse d’oxazolidinone phosphonate.
30Narkunan, K.; Nagarajan, M. J. Org. Chem. 1994, 59, 6386.
31 Jones, S.; Selitsianos, D. Tetrahedron Asymmetry. 2005, 16, 3128-3138.
O O MeO OBn OMe OMe OMe THF, -78°C O O P OBn OMe OMe OMe MeO Li CH2P O OMe OMe O MeO 40 41 O NH O Ph (i) (ii) 72% 84% O N O Ph P O OPh OPh O N O Ph P O OEt OEt
(i): n-BuLi, THF, (PhO)2P(O)Cl (ii):n-BuLi, THF, (EtO)2P(O)Cl 42
43a
I-3-3-5 Par l’Addition d'un bisphosphonate sur un aldéhyde :
Le groupe de Langlois, N et al 32 a également synthétisé une proline
γ-aminophosphonates conjugué (45) à partir d'un dérivé d’aldéhyde de la proline (44) en présence d’un bisphosphonate (schéma15).
Schéma 15: Synthèse de γ-aminophosphonates
I-4- REACTIVITE DES PHOSPHONATES: I-4-1 Synthèse d’ester α-β-insaturés :
Les groupements phosphonates sont des intermédiaires efficaces pour la préparation des esters α, β-insaturés. Wadsworth et Emmons rapportèrent que les anions phosphonates sont fortement nucléophile, pouvaient se condenser sur des aldéhydes ou des cétones et donner ainsi accès à des alcènes substitués de manière stéréosélective, dans des conditions douces (schéma16) 33.
Schéma 16: Synthèse d’un ester α-β-insaturé.
I-4-2 Synthèse de phosphonate aromatique par la réaction de Diels-Alder:
Le perfluoroacétylènphosphonates (46a-b) et difluoro-halogénoacétylènphosphonates
(46c-e) peuvent réagir avec le 2,3-diméthyl-1,3-butadiène pour donner l’ortho-XCF2
arylphosphonates (49a-e) avec un excellent rendement (90-98%) (schéma 17) 8.
32 Langlois, N.; Rojas-Rousseau, A.; Decavallas, O. Tetrahedron Asymmetry. 1996, 4, 1095. 33 Kaori, A.; Kyohei, Y. Tetrahedron Lett. 2010, 51, 3297–3299.
(EtO)2P(O)CH2CO2Et + RCHO
DBU, t.a sans solvant R CO2Et N R O O CH2(P(O)(OEt)2)2 n-BuLi N R P O O O OEt EtO O H 44 45
Schéma 17: Synthèse d’ortho-XCF2 arylphosphonate.
I-4-3 Formation de bisphosphonate par l’intermédiaire d’un α-cétophosphonate :
Les bisphosphonates (51) peuvent également être préparés par le traitement de α-cétophosphonates (50) avec un dialkylphosphite (Schéma 18). les α-α-cétophosphonates sont synthétisés par la réaction de Michaelis-Arbuzov qui consiste à faire réagir un trialkylphosphite P(OR)3 avec un chlorure d’acide (aliphatique ou aromatique), avec de bons
rendements. Cette réaction se réalise soit en milieu basique, soit à haute température.
L’étape de déalkylation est ensuite réalisée soit par hydrolyse acide, soit par traitement par le bromotriméthylsilane suivi d’une méthanolyse 34.
Schéma 18 : Synthèse de l’acide 1-hydroxyalkyl-1,1-bisphosphonique.
34Thèse deDelphine, L. « Synthèse et Applications de composés gem-bisphosphonates, de puissants
complexants de métaux » Université de Paris Sud, 2007.
R O Cl O R P O (OEt)2 base HP(O)(OEt)2 P O (OEt)2 R OH P O (OEt)2 P O (OH)2 R OH P O (OH)2 HCl ou TMSBr P(OEt)3 50 51 52 XCF2 P O OEt OEt + H3C CH3 110-160°C 180-235°C H3C H3C P CF2X O OEt OEt H3C H3C P CF2X O OEt OEt KMnO4/Al2O3
46a-e 47a-e 48a-e
49a-e
I-4-4 Synthèse d’hydroxyphosphonate :
Les composés phosphonates contenant particulièrement les deux fonctions; amine et hydroxyle ont été attirés beaucoup d’attention ces dernières années en raison de leurs applications comme inhibiteurs de la rénine et comme des agents anti-viraux.
La synthèse de β-hydroxyphosphonates γ-[amino (N-p-toluènesulfonyle)] (54) a été réalisée par la réduction du groupement carbonyle de β -ketophosphonates γ [amino (N-p-toluènesulfonyl)] (53) par le NaBH4 à 0°C dans le MeOH. Cette réaction donne un excellent
rendement et une bonne diastéréoséléctivité anti : syn (81-19) en faveur du diastéréoisomère
anti-2 (schéma 19)35.
Schéma 19: Synthèse de β-hydroxyphosphonates γ-[amino (N-p-toluènesulfonyle)].
35 Ordonez, M. ; Cruz-Cordero, R.; Fernandez-Zertuche, M.; Munoz-Hernandez, M. A. ; Garcıa-
Barradas, O. Tetrahedron Asymmetry. 2004, 15 3035–3043.
O P(OMe)2 O NHSO2R NaBH4, 0°C OH P(OMe)2 O NHSO2R OH P(OMe)2 O NHSO2R + 54 anti-2 54 syn-3 53 R= p-Tol
Conclusion :
Dans ce chapitre nous avons présenté une mise au point bibliographique sur l’activité biologique essentielle des composés contenant des groupements phosphonates décrites dans la littérature.
Nous avons rapporté les deux principales méthodes d’accès aux groupements phosphonates; la réaction d’Arbuzov et la réaction de Michaelis-Becker et d’autres méthodes.
La réactivité des composés contenant le motif phosphonate ester apparaît dans leur utilisation comme des substrats. Dans la plupart des réactions, ces composés sont comme des intermédiaires clés dans la réaction de Horner–Wadsworth–Emmons (HWE).
Aperçu bibliographique sur les Amidophosphonates:
Activité pharmacologique,
II-1- GENERALITES SUR LES AMIDOPHOSPHONATES:
Les amidophosphonates ou les phosphonoacétamides sont des phosphonates porteur une fonction carboxamide en position α, β ou γ, ces composés sont des intermédiaires utiles en synthèse organique.
Les β-amidophosphonates ont été choisis comme intermédiaires clés, en raison de leur potentiel élevé pour la conversion en γ-aminophosphonates.
Ils sont souvent utilisés aussi comme réactifs de couplage dans la réaction de Horner-Wadsworth-Emmons, pour obtenir des amines α-β-insaturés qui ne sont pas accessibles par d’autres méthodes. En outre, ces derniers appartiennent à une classe importante de produits naturels, ils ont montré une grande activité biologique1.
II-2- ACTIVITE PHARMACOLOGIQUES DES AMIDOPHOSPHONATES:
L’évaluation de l’activité biologique potentielle, notamment pesticide des amidophosphonates est à l’origine de l’association phosphonyl-carboxamide.
Les molécules possédant un groupement amidophosphonate ont un champ d’activités biologiques très étendu. Parmi les nombreux exemples cités dans la littérature, on retrouve des composés possédant une activité antibiotique ou antivirale, ainsi que des composés qui se sont montrés efficaces comme insecticides ou herbicides 2. Par exemple, le composé (55), est un dipeptide dérivé de la proline et la glycine phosphonique est reconnu pour ses propriétés antibactériennes. Le dipeptide (56), nommé alaphosphine, est un herbicide et fongicide puissant et est un dérivé d'alanine et d'alanine phosphonique. Pour le traitement du diabète type II, le dipeptide (57), est un peptide formé d'un dérivé de proline et d'une proline phosphonique, est reconnu comme étant un inhibiteur de haute affinité pour l'enzyme DPP IV.
1Amagata, T.; Minoura, K.; Numata, A. J. Nat. Prod. 2006, 69, 1384–1388. 2Lejczak, B.; Kafarski, P.; Mastalerz, P. Beitrage zur Wirkstofforschung. 1985, 25.
Figure 10: Structures chimiques de quelques amidophosphonates ayant une activité biologique.
On retrouve que les hydroxy-amidophosphonates sont utilisés comme inhibiteurs de ATX (ATX est un facteur de la motilité autocrine qui favorise l'invasion des cellules cancéreuses, la migration cellulaire et l'angiogenèse) (Fig. 11) 3.
Figure 11: Structure d’inhibiteur d’ATX.
Une série d’inhibiteurs potentiels avec différente longueur d’une chaîne alkyle a été préparée afin d’étudier l’influence de la taille et hydrophobicité des composés cibles sur les inhibitions de l’activité antituberculeuse. Ces études montrent que le composé (59d) possède la plus forte croissance inhibitrice, donc la chaîne alkyle de taille moyenne est la plus préférée
comme inhibiteur de l’activité antituberculeuse (Fig. 12) 4.
3 Cui, P.; Tomsig, J. L.; McCalmont, W. F.; Lee, S.; Becker, C. J.; Lynch, K. R.; Macdonalda, T. L.
Bioorganic & Medicinal Chem Lett. 2007, 17, 1634–1640.
4Gobec, S.; Plantan, I.; Mravljak, J.; Svajger, U.; Wilson, R. A.; Besra, G. S.; Soares, S. L.;
Appelberg, R.; Kikelj, D. European Journal of Medicinal Chem. 2007, 42, 54-63.
R2O OH H N O R1 P O HO HO 58 O H2N N H P O OH HO 56 N H COOH O HN P O OH OH 55 N P O NH O O O
Figure 12: Un dérivé d’amidophosphonate antituberculeux.
II-3- METHODES D’ACCES AUX AMIDOPHOSPHONATES:
La synthèse des composés contenant un groupement amidophosphonate est très peu décrite dans la littérature.
II-3-1 A partir d’acide phosphonoacétique:
L’amidophosphonate (61) a été préparé par un traitement d’acide phosphonoacétique (60) par le L-phénylglycinol en présence de DCC et une quantité catalytique de DMAP dans le CH2Cl2 à température ambiante avec un excellent rendement (93-97%) (shéma 20) 5.
Schéma 20: Synthèse d’un dérivé de phosphonoacétamide. II-3-2 A partir d’un amide α, β- insaturé:
Un dérivé de β-amidophosphonate a été synthétisé avec un rendement modéré (55%), en traitant l’amide α, β- insaturé avec 2 équivalents de diéthylphosphite et 2 équivalents de NaH.
5Ordonez, M.; Hernandez-Fernandez, E.; Montiel-Perez, M.; Bautista, R.; Bustos, P.; Rojas-Cabrera, H.; Fernandez-Zertuchea. M.; Garcıa-Barradas, O. Tetrahedron Asymmetry. 2007, 18, 2427–2436.
(RO)2P O OH O H2N Ph OH DCC, DMPA CH2Cl2 93-97% (RO)2P O N H O Ph OH R: Me Et 60 61 N O O O P O OEt H3C n x 1a n= 1, x= 1 1b n=1, x= 2 1c n= 4, x= 1 1d n= 6, x=1 1e n= 6, x= 2 1f n= 11, x= 1 59
La diastéréosélectivité est toujours supérieure à 90%, mais lorsque R est remplacé par un phényle, la diastéréosélectivité diminue à 45% (schéma 21) 6.
Schéma 21 : Synthèse des β-amidophosphonates.
II-3-3 A partir d’alkylation de β-amidobenzène :
Castelot-Deliencourt, G et al 7 ont développé une autre voie de synthèse d’un α-amidophosphonate chiral par l’introduction d’un groupemment phosphonate, en utilisant le chlorophosphite diéthylique comme un bon électrophile, selon les conditions expérimentales décrites par Beak et al 8, ils n’ont pas observé une diastéréosélectivité dans la formation du composé substitué (65) (schéma 22).
Schéma 22 : Synthèse de α-phényl β-amidophosphonate.
6Castelot-Deliencourt, G.; Pannecoucke, X.; Quirion, J-C. Tetrahedron Lett. 2001, 42, 1025– 1028.
7Castelot-Deliencourt, G.; Roger, E.; Pannecoucke, X.; Quirion, J-C. Eur. J. Org. Chem. 2001, 3031- 3038.
8 a) Beak, P.; Du, H. J. Am. Chem. Soc. 1993, 115, 2516.
b) Lutz, G. P.; Du, H.; Gallagher, D. J.; Beak, P. J. Org. Chem. 1996, 61, 4542. c)Basu, A.; Beak. P. J. Am. Chem. Soc. 1996, 118, 1575.
d) Gallagher, D. J.; Du, H. Long, S. A.; Beak, P. J. Am. Chem. Soc. 1996, 118, 11391. e) Pippel, D. J.; Curtis, M. D.; Du, H.; Beak, P. J. Org. Chem. 1998, 63, 223.
R O N OH Ph Ph R O N OH Ph Ph (EtO)2P O 2éq NaH 2 éq HPO(OEt)2 R: 1- Et 2- iPr 3- Ph 62 63 O H N Ph CH3 Ph * O H N Ph CH3 P * Ph O EtO EtO 1) 2éq, s BuLi, -78°C, THF 2) (EtO)2P O Cl 64 65
II-3-4 A partir de N-bromoacétyle morpholine:
Le N-bromoacétyl morpholine (66) a été réagi avec le diphényléthylphosphite. La réaction se fait à reflux pendant 6-8 h pour fournir l’amidomorpholine phosphonate correspondant (67) avec un rendement de 64-79% (schéma 23) 9.
Schéma 23: Synthèse d’amidomorpholine phosphonate II-3-5 A partir des imines:
L’addition des trialkylphosphites sur des imines 10 en présence de chlorure de chloroacétyle selon la réaction d’Arbuzov, permet de former le α-amidophosphonate correspondant (schéma 24).
Schéma 24: Synthèse de α-amidophosphonate à partir des imines.
II-3-6 A partir d’isocyanures :
L’amidophosphonate a été synthétisé par l’utilisation d’isocyanure en deux étapes. Des quantités équimolaires d’un aldéhyde, de diéthylphosphite et de benzylamine ont été chauffées pendant 8 h à 60°C, en présence de perchlorate de lithium LiClO4 (20% en mole)
comme catalyseur efficace pour cette procédure. Après la formation du composé (70) qui a été
9 Ando, K.; Nagaya, S.; Tarumi, Y. Tetrahedron Lett. 2009, 50, 5689–5691.
10 Boduszek, B. Pol. J. Chem. 2001, 75, 663, Soroka, M. Pol. J. Chem. 2002, 76, 1105.
BrCH2C O N O+ R O 2 P-OEt 150°C R O 2 P(O)CH2C O N O 67 R= Me (65%) = i-Pr (72%) = t-Bu (79%) 66 R1 N R2 + Cl O Cl + P(OR)3 Cl O NR2 R1 P(OR)2 O NaH NR2 O R1 P(OR)2 O 68 69
vérifié par RMN 1H, le mélange est refroidi à température ambiante avant d'ajouter l'isocyanure de tert-butyle (1éq), le formaldéhyde (1éq en une solution, 40% dans l'eau) et l'acide acétique (0,5éq.). Après quatre jours d’agitation à température ambiante, l’amidophosphonate a été obtenu avec un rendement de 62% (schéma 25)11.
Schéma 25: Préparation d’amidophosphonate par l’utilisation d’isocyanure
II-3-7 A partir de diméthyl méthylphosphonate:
La synthèse de β-keto-γ-amidophosphonate (74) a été réalisée par l’acylation de l'ammonium chlorhydrate de l’aminoester de la tyrosine avec le chlorure d’acyle approprié pour obtenir le composé (72). Ce dernier subit une éthérification du phénol par le mésylate pour conduire à la tyrosine protégée (73), suivi par l’ajout du diméthyl méthylphosphonate sous l’action d’une base forte n-BuLi à basse température (-78°C), pour accéder au β-keto- γ-amidophosphonate (74) avec un rendement de (50-60%) (schéma 26)4.
11El Kaım, L.; Grimaud,L.; Hadrot, S. Tetrahedron Lett. 2006, 47, 3945–3947.
O + Ph NH 2 HPO(OEt)2, 60°C LiClO4 (20 mol%) 8h NH P O Ph EtO EtO t-BuNC CH2O CH3CO2H, 0.5éq 4j, t.a N O Ph NHt-Bu P O EtO EtO 62% 70 71