© Arnaud Gandon, 2021
Élaboration de nanoparticules coeur@coquille
magnétiques pour la catalyse de la scission oxydante
des acides gras insaturés
Thèse
Arnaud Gandon
Doctorat en génie chimique
Philosophiæ doctor (Ph. D.)
Élaboration de nanoparticules cœur@coquille
magnétiques pour la catalyse de la scission
oxydante des acides gras insaturés
Thèse
Arnaud Gandon
Sous la direction de :
Trong On Do, directeur de recherche Serge Kaliaguine, codirecteur de recherche
ii
Résumé
La raréfaction des ressources pétrolières exacerbe la demande de nouveaux produits issus de sources durables, tels que les huiles issues des plantes. Afin de pouvoir intégrer les acides gras insaturés présents dans ces produits biosourcés dans l’industrie pétrochimique, une réaction clivante revêt un grand intérêt. Cette thèse présente des voies de synthèse pour des nanocatalyseurs magnétiques, actifs pour la scission oxydante des acides gras insaturés, et notamment l’acide oléique.
Les nanocatalyseurs magnétiques constituent une nouvelle catégorie de catalyseurs hétérogènes dont les propriétés catalytiques permettent d’avoisiner les performances des catalyseurs homogènes. Cependant, leur nature solide couplée à leur propriété magnétique permet facilement leur récupération, et donc leur réutilisation, au contraire des catalyseurs homogènes. Ainsi, un nanocatalyseur magnétique est un type de catalyseur prometteur s’inscrivant dès lors dans une démarche de chimie verte.
Cette thèse présente, en plus de deux chapitres non expérimentaux, des méthodes de synthèse pour la conception in fine de nanocatalyseurs de type cœur@coquille, permettant d’exhiber des propriétés magnétiques grâce à un cœur constitué d’oxyde de fer et d’une coquille composée en partie de la phase active qu’est le catalyseur. Ainsi, les articles présentés incluent, dans le troisième chapitre, une méthode de synthèse de nanoparticules d’oxyde de fer, la magnétite Fe3O4, ayant une très grande reproductibilité et une très faible
dispersité en taille. Ces nanoparticules serviront de cœur pour la conception des nanocatalyseurs au cœur magnétique. Dans un quatrième chapitre, une nouvelle voie de synthèse de nanoparticules cœur@coquille magnétiques ayant de l’oxyde de molybdène à la surface est présentée. L’oxyde de molybdène est reconnu pour ses propriétés catalytiques pour la scission oxydante des acides gras insaturés.
Finalement, dans un cinquième chapitre, une seconde voie de synthèse est présentée pour l’élaboration d’un nanocatalyseur cœur@double coquille, entièrement inorganique. Cette nanoparticule est composée d’un cœur de magnétite, le plus magnétique des oxydes de fer, d’une première coquille de silice et finalement d’une coquille d’oxyde de tungstène. En plus de présenter les étapes de synthèse détaillées et les mécanismes associés, cet article a évalué les propriétés catalytiques de cette nanoparticule de Fe3O4@SiO2@WO3.
Lorsqu’employé sur l’acide oléique, et comparé à d’autres catalyseurs à base de tungstène, ce nanocatalyseur exhibe une activité catalytique proche du catalyseur homogène (soit l’acide pertungstique) et bien au-delà des catalyseurs hétérogènes, qu’ils soient à l’échelle macroscopique (oxyde de tungstène brut), ou à l’échelle nanoscopique avec des nanoparticules supportées. De plus, sa récupérabilité et sa réutilisabilité permettent de qualifier cette nanoparticule de nanocatalyseur.
Cette méthode fiable et robuste pourrait être mise en œuvre sur d’autres oxydes métalliques pouvant être utilisés comme catalyseurs, tels que le molybdène. Elle permettrait ainsi d’ouvrir une nouvelle voie de synthèse de catalyseurs verts que sont les nanocatalyseurs magnétiques de type cœur@coquille. En effet, la silice étant facilement fonctionnalisable, cette méthode offre de multiples possibilités en termes d’applications.
iii
Abstract
The scarcity of the fossil resources exacerbates the need for new products, based on sustainable resources such as the vegetable oils. To integrate the unsaturated fatty acids of these biobased products to the petrochemical industry, a bond cleavage is required. This thesis provides new synthesis routes for magnetic nanocatalysts, effective for the oxidative cleavage of fatty acids, in particular oleic acid.
The magnetic nanocatalysts are a new type of heterogenous catalysts with catalytic properties close to the performances of the homogeneous catalysts. As a solid material exhibiting magnetic properties, they are easy to recover from reaction media and thus to reuse, contrary to the homogeneous catalysts. Thus, a magnetic nanocatalyst is a promising catalyst in green chemistry.
This thesis introduces, in addition two theoretical chapters on the above mentioned concepts, various methods of synthesis to in fine conceive a core@shell nanocatalyst. The latter intend to exhibit a magnetic core of iron oxide and a shell containing the active phase of the catalyst. Thus, the articles included in this thesis contribute to achieving this purpose. The first article provides a method for the synthesis of iron oxide nanoparticles, the magnetite Fe3O4, with a high reproducibility and a low dispersity in size. These nanoparticles
will be further used as the core in the design of nanocatalysts with a magnetic core. The second article provides a new synthesis route for the synthesis of magnetic core@shell nanoparticles with molybdenum oxide at the external surface. Molybdenum oxide is a known catalyst for the oxidative cleavage of unsaturated fatty acids.
Finally, a new method for the design of a nanocatalyst core@dual shell fully inorganic, is presented. This nanoparticle is composed of a magnetic core of magnetite, the more magnetic phase of iron oxide, a first shell of silica and then a shell of tungsten oxide. Not only the detailed step-by-step synthesis route is provided, but the catalytic activity of this Fe3O4@SiO2@WO3 nanoparticle is also assessed. When applied and compared to other
tungsten-based catalysts for the oxidative cleavage of oleic acid, this nanocatalyst exhibits a catalytic activity similar to the homogeneous catalyst (i.e. pertungstic acid) and far above that of existing heterogeneous catalysts. The latter were either a macroscopic catalyst (i.e. bulk tungsten oxide) or nanoscopic catalysts with tungsten oxide nanoparticles and supported nanoparticles. In addition, the easy recovery of this material and its reusability allow qualifying this nanoparticle as a nanocatalyst.
This reliable and robust method could be implemented on other catalytic active metal oxides such as molybdenum. This method is a new synthesis path for green catalysts as magnetic core@shell nanocatalysts. Indeed, as the silica is an easy functionable support, this method could be easily implemented and open new catalytic possibilities.
iv
Table des matières
Résumé ... ii
Abstract ... iii
Table des matières ... iv
Liste des Figures ... vii
Liste des Tableaux ... xi
Liste des abréviations, sigles, acronymes ... xiii
Remerciements ... xvii
Avant-propos ... xviii
Introduction ... 1
Chapitre 1. Les nanoparticules cœur@coquille magnétiques et leur application en catalyse…….. ... 5
1.1. Les catalyseurs pour la scission oxydante de l’acide oléique ... 6
1.1.1. Catalyseurs homogènes ... 8
1.1.2. Catalyseurs hétérogènes ... 11
1.1.3. Les nanoparticules dans la scission oxydante d’acides gras ... 18
1.2. Le magnétisme ... 21
1.2.1. Introduction au magnétisme ... 21
1.2.2. Le magnétisme dans les matériaux ... 24
1.2.3. Le cas particulier de l’oxyde de fer ... 32
1.3. Les nanoparticules cœur@coquille ... 34
1.3.1. L’origine des nanoparticules cœur@coquille ... 34
1.3.2. Leurs différentes utilisations dans différents domaines ... 36
1.3.3. Leurs utilisations en catalyse ... 36
1.3.4. Mécanisme de croissance des nanoparticules ... 38
1.3.5. Méthodes de synthèse de nanoparticules cœur@coquille ... 41
Chapitre 2. Méthodes de caractérisation ... 46
2.1. Caractérisation morphologique des nanoparticules ... 47
2.1.1. TEM ... 47
2.1.2. SEM ... 50
v
2.2.1. ICP-AES ... 52
2.2.2. XPS ... 54
2.2.1. DRX ... 56
2.2.2. Caractérisation de la surface spécifique par physisorption d’azote ... 59
2.3. Caractérisation des interactions de surface des nanoparticules ... 62
2.3.1. FTIR ... 62
2.3.2. TGA ... 64
2.4. Détermination de l’activité catalytique ... 67
2.4.1. GC-MS ... 67
2.4.2. Estérification ... 70
Chapitre 3. Synthesis of single-phase and controlled monodisperse magnetite Fe3O4 nanoparticles…. ... 72 3.1. Résumé ... 73 3.2. Abstract ... 73 3.3. Introduction ... 74 3.4. Experimental methods ... 76 3.4.1. Starting chemicals ... 76 3.4.2. Synthesis ... 76 3.4.3. Characterization ... 77
3.5. Results and discussion ... 78
3.6. Conclusion ... 87
3.7. Acknowledgements ... 87
Chapitre 4. A novel route to prepare recoverable FexOy@SiO2@MoO3 core-dualshell nanoparticles for catalytic oxidation reactions ... 88
4.1. Résumé ... 89 4.2. Abstract ... 89 4.3. Introduction ... 90 4.1. Experimental Section ... 92 4.1.1. Chemical ... 92 4.1.2. Preparation of EDA/OA-capped Fe3O4 ... 92
4.1.3. Preparation of FexOy@SiO2@MoO3 core@shell ... 92
vi
4.2. Results and discussion ... 93
4.3. Conclusion ... 99
4.4. Acknowledgements ... 99
4.5. Supplementary information ... 100
Chapitre 5. Synthesis of magnetic core@dual shell Fe3O4@SiO2@WO3 nanocatalyst for olefin double bond oxidative cleavage ... 102
5.1. Résumé ... 103 5.2. Abstract ... 103 5.3. Introduction ... 104 5.4. Experimental Section ... 107 5.4.1. Material ... 107 5.4.2. Characterization ... 107 5.4.3. Synthesis ... 107 5.4.4. Catalytic test ... 108
5.5. Results and discussion ... 109
5.5.1. Magnetite Fe3O4 nanoparticle (NPs) ... 109
5.5.2. Core@shell Fe3O4@SiO2 NPs ... 110
5.5.3. Core@double shell Fe3O4@SiO2@WO3 NPs ... 111
5.5.4. Catalytic performances ... 117
5.5.5. Recyclability of the catalyst ... 119
5.6. Conclusion ... 120
5.7. Acknowledgements ... 120
Conclusion ... 121
Perspectives ... 123
vii
Liste des Figures
Figure 1 : La filière de la pétrochimie.[4–6] ... 1
Figure 2 : Distribution des acides gras dans quelques végétaux.[12] ... 2
Figure 3 : Exemples d'acides gras courants. ... 6
Figure 4 : Ensemble de complexes organométalliques présentant une activité catalytique non négligeable pour la scission oxydante de la double liaison d’acides gras insaturés.[25,26] ... 8
Figure 5 : Présentations schématiques des principales structures polyoxométallates.[42] . 11 Figure 6 : Mécanisme possible de la scission oxydante de la double liaison de l'acide oléique proposé par Venturello[44] et adapté par Dubois[14]. ... 12
Figure 7 : Catalyseurs dérivés du TPA.[45] ... 13
Figure 8 : L’application du magnétisme dans un dispositif d’enregistrement audio ... 23
Figure 9 : Schéma de l'expression du moment magnétique. ... 25
Figure 10 : Schéma de l'expression du moment magnétique d’un électron. ... 26
Figure 11 : Le moment magnétique orbital et le moment magnétique de spin de l’électron.[68] ... 26
Figure 12 : Comportement schématique de matériaux diamagnétiques en réponse à un champ magnétique externe.[72] ... 28
Figure 13 : Comportement schématique de matériaux paramagnétiques en réponse à un champ magnétique externe[72] et représentation graphique de l'arrangement des moments magnétiques de matériaux dans l'état paramagnétique. ... 28
Figure 14 : Représentation graphique de l'arrangement des moments magnétiques de matériaux dans l'état ferromagnétique avec des domaines de Weiss et l’état paramagnétique. ... 29
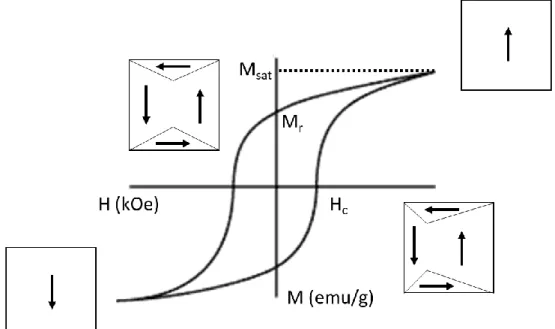
Figure 15 : Cycle présentant l'hystérèse magnétique d’un matériau ferromagnétique dur avec les domaines magnétiques correspondant aux états introduits. ... 30
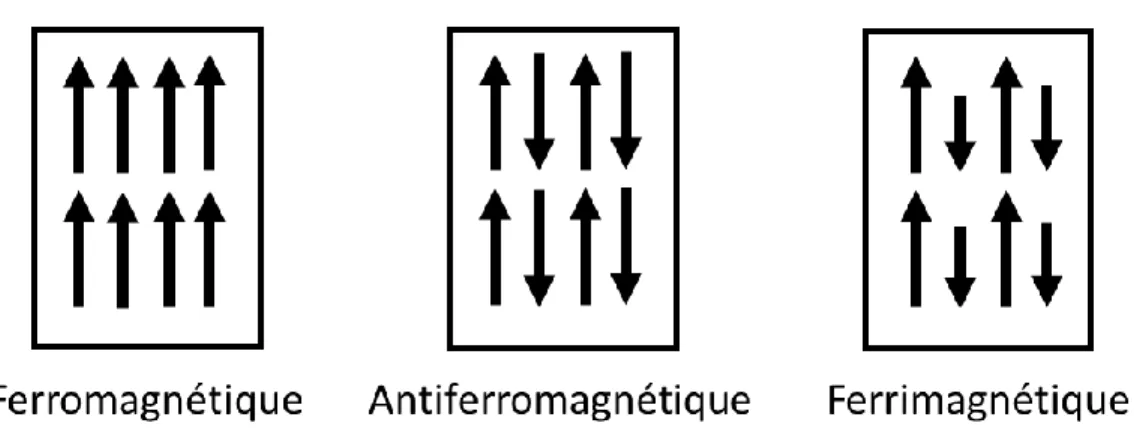
Figure 16 : Présentation de l’orientation des moments magnétiques dans les différents ordres magnétiques permanents... 31
Figure 17 : Représentation de la maille cristalline de Fe3O4.[75] ... 32
Figure 18 : Photographie de poudre de magnétite et de maghémite. ... 33
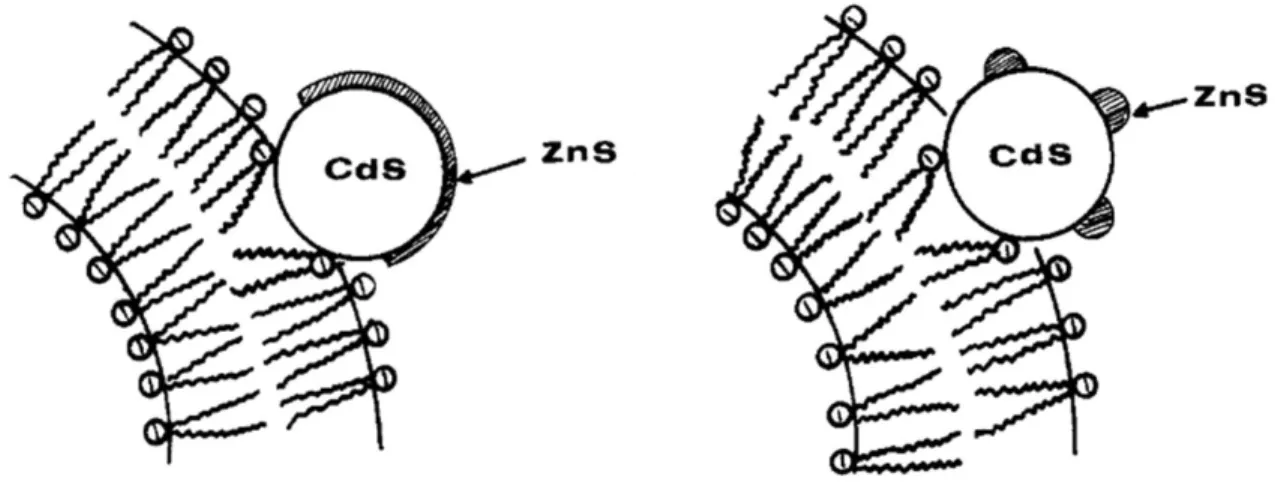
Figure 19 : Différents modèles de croissance de la couche de ZnS sur la particule de cœur de CdS : (a) Modèle de croissance épitaxie ; (b) Modèle de croissance par îles.[81] ... 34
Figure 20 : Spectre photoluminescent à température ambiante après calcination de : (A) (CdSe)Ph, (B) (CdSe)1(ZnS)4Ph. Le rendement quantique du graphique B est supérieur de plus d’un ordre de grandeur à celui de A.[83] ... 35
viii
Figure 21 : Présentation du diagramme de LaMer présentant les différentes phases de nucléation croissance et maturation[139] dans le temps en fonction de la concentration en
précurseur. Les unités d’abscisse et d’ordonnée sont arbitraires. ... 38
Figure 22 : Principe de fonctionnement d’un microscope électronique à transmission. .... 48
Figure 23 : Principe de fonctionnement d’un microscope électronique à balayage (SEM).[223] ... 50
Figure 24 : Interaction électron-matière et les émissions résultantes.[224] ... 51
Figure 25 : Schéma de fonctionnement d’un ICP-AES.[225] ... 52
Figure 26 : Principe de fonctionne d'un XPS avec (a) l’adsorption d’un photon et (b) l’émission d’un photoélectron.[226] ... 54
Figure 27 : Spectres XPS de référence du Fe(0), Fe(II) et Fe (III).[227] ... 55
Figure 28 : Principe de la diffraction des rayons X (DRX) par un réseau cristallin.[229] ... 56
Figure 29 : Structures cristallines de (a)FeO, (b) Fe3O4, et (c) α-Fe2O3[230] et le diffractogramme de (a) Fe3O4 et (b) α-Fe2O3.[231] ... 57
Figure 30 : Deux porte-échantillons de DRX de taille différente remplie avec une poudre blanche.[232] ... 58
Figure 31 : Potentiel de Lennard-Jones.[236] ... Erreur ! Signet non défini. Figure 32 : Principe de fonctionnement de la physisorption[238] ... 59
Figure 33 : Classification IUPAC des isothermes d'adsorption physique.[236,239] ... 60
Figure 34 : Mode de vibration d’une liaison covalente.[242] ... 62
Figure 35 : Principe de fonctionnement du spectromètre FTIR.[244] ... 63
Figure 36 : Principe de fonctionnement de l’analyse TGA.[246] ... 64
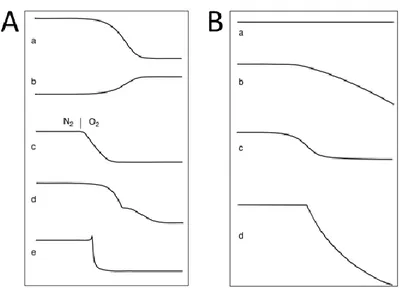
Figure 37 : A) Profils de variation massique selon les réactions chimiques pour une analyse TGA. (a) décomposition thermique avec formation de produits volatils, (b) corrosion ou oxydation de métaux (génération d’oxydes non volatils), (c) combustion du carbone lors du chargement d’atmosphère d’azote à oxygène, (d) décomposition en plusieurs étapes et (e) décomposition explosive avec effet de recul. B) Profils de variation massique lors de la fusion. (a) Échantillon avec peu de pression de vapeur (pas d’effet sur la TGA), (b) fusion avec formation d’un composé volatil (le liquide s’évapore), (c) l’humidité s’échappe lors de la fusion et (d) l’échantillon fond et se décompose.[247] ... 65
Figure 38 : TGA et DTG de l’oxalate de calcium.[247] ... 66
Figure 39 : Principe de fonctionnement d'une GC-MS.[249]... 67
Figure 40 : Détection et analyse par GC-MS : chromatogramme et spectres de masse.[250] ... 68
Figure 41 : Spectre de masse théorique du butane. ... 69
ix
Figure 43 : Programme de température pour l’analyse des réactants de la scission oxydante de l’acide oléique. ... 70 Figure 44 : Schematic illustration of the solvothermal synthesis of Fe3O4 NPs in autoclave
at 200 °C for different reaction times. ... 76 Figure 45 : TEM images of the samples obtained at 200 °C in autoclave for different synthesis times: A, B, C, and D for 3, 6, 9, and 14 hours, with respectively, 40, 80, 139, and 210 nm mean size, E) Average particle size and yield of the synthesis. ... 78 Figure 46 : TEM images of the samples Fe3O4 NPs after 3 h (A, B) and 6 h of synthesis (C,
D). Possible domains that correspond to the first mother nanoparticles at the early stage of synthesis are highlighted in B and D. ... 79 Figure 47 : TEM image of nanoparticles (200 nm) of the sample after 14 h of synthesis including “aggregates” and core size analysis. ... 80 Figure 48 : A) XRD patterns of the samples of Fe3O4 NPs synthesized at 200 °C for different
times: 3 h, 6 h, 14 h, and ICDD datasheets for maghemite and magnetite, B) XRD patterns of the sample obtained after 6 h of synthesis, introduction of ICDD datasheets for maghemite and magnetite, C) Extension of the 25-45° region, D) Extension of the 45-65° region. ... 81 Figure 49 : TGA in argon of the sample Fe3O4 NPs–6 after 6 h of synthesis. ... 82
Figure 50 : A) 50 mg of the sample after 6 h of synthesis (Fe3O4 NPs-6) suspended in 20
mL of ethanol, B) All nanoparticles separated after only 10 seconds of magnet contact (the solution became transparent). ... 83 Figure 51 : Detailed Fe2p XPS photolines of the sample Fe3O4-NPs-6 h: t0m (A) and exposed
in air for after 4 months: t4m (B) and O1s XPS spectra: t0m (C) and t4m (D). ... 85
Figure 52 : (A) FTIR spectra of (a) sample Fe3O4-NPs-6h, (b) sodium acetate, (c)
ethylenediamine and (d) pure Fe3O4 magnetite as the reference. (B) Survey XPS of the
sample Fe3O4-NPs-6h. ... 86
Figure 53 : A) Schematic illustration of FexOy@SiO2@MoO3 core- shell particles: 1)
Solvothermal method to prepare EDA/OA-capped Fe3O4; 2) coating based on reverse
microemulsion-like approach. and 3) annealing at 400 °C (the first step is designed by an autoclave); B) Schematic illustration for the formation of FexOy@SiO2@MoO3 core-shell
NPs. ... 94 Figure 54 : A-B) FTIR characterizations; C) XRD patterns and D) recoverability of a) as-prepared iron oxide and b) core-shell FexOy@SiO2@MoO3 nanoparticles. ... 95
Figure 55 : SEM images and corresponding EDX of A-B) the as-synthesized E-O/Fe3O4 NPs
and C-F) FexOy@SiO2@MoO3 core- shell. Notably, the presence of Au and Pd is rooted in
the coating process needed for SEM measurements. ... 96 Figure 56 : A) TEM images of the E-O/Fe3O4 NPs), B) TEM images of the FexOy
@SiO2@MoO3 core-shell NPs sample; C and D) TEM image and corresponding EDX of
FexOy @SiO2@MoO3 core-shell NPs Notably, the presence of Co and Ni is rooted in the
x
Figure 57 : A) STEM and B-E) corresponding elemental mapping of Fe (blue), O (green), Si (red), and Mo (gray) of the FexOy@SiO2@MoO3 core-shell sample. Scale bar of 200 nm. 98
Figure 58 : FTIR BioRad reference of ethylene diamine ... 100 Figure 59 : FTIR BioRad reference of oleyamine ... 100 Figure 60 : TEM image and corresponding EDS of the sample FexOy@SiO2@MoO3 ... 101
Figure 61 : Synthesis route to magnetic core@shell Fe3O4@SiO2@WO3 nanospheres. 109
Figure 62 : SEM image of the Fe3O4 NPs (Inset: TEM image and statistical size particle
distribution of Fe3O4 NPs)... 109
Figure 63 : SEM image of the Fe3O4@SiO2 core@shell NPs. (Inset: statistical particle size
distribution). ... 110 Figure 64 : A) TEM images and B-D) HRTEM elemental mapping of Fe, Si and Fe/Si of the core@shell Fe3O4@SiO2 NPs sample. ... 111
Figure 65 : SEM image of the core@double shell Fe3O4@SiO2@WO3 NPs (Inset: particle
size distribution) ... 111 Figure 66 : A) TEM image and B-E) HRTEM elemental mapping of Fe, Si, W and Fe/Si/W of the core@double shell Fe3O4@SiO2@WO3 NPs. ... 112
Figure 67 : EDS spectra of the Fe3O4, Fe3O4@SiO2 and Fe3O4@SiO2@WO3 samples with
atomic ratio (in %) of Fe/Si/W. ... 113 Figure 68 : Survey XPS spectrum of the Fe3O4@SiO2@WO3 sample with the atomic ratio
(in %) of Fe/Si/W ... 114 Figure 69 : XRD patterns of Fe3O4 and Fe3O4@SiO2@WO3 NPs including Fe3O4 ICDD data
sheet peaks. ... 115 Figure 70 : Suspension of 50 mg of nanoparticles in 20 mL of ethanol and after ca. 25 seconds of magnet contact of: (A-B) Fe3O4 NPs, (C-D) Fe3O4@SiO2 NPs and (E-F)
Fe3O4@SiO2@WO3 NPs. ... 116
Figure 71 : Magnetic separation and recycling of the Fe3O4@SiO2@WO3 nanocatalyst in
heterogeneous oxidative cleavage of oleic acid. Weight of catalyst, conversion and yields of reaction products (PA and AA) over 3 cycles. ... 119
xi
Liste des Tableaux
Étant donné que cette thèse intègre des articles rédigés en anglais, les légendes sont référées comme « Tableau » et non « Table » afin d’assurer la cohérence, bien que le texte associé soit en anglais.
Tableau 1 : Liste des abréviations. ... xiii
Tableau 2 : Liste des unités. ... xiv
Tableau 3 : Liste des ordres de grandeur. ... xiv
Tableau 4 : Acides gras issus de végétaux communément disponibles.[10] ... 1
Tableau 5 : Oxydation de l'acide oléique par 2,2% de RuCl3 avec 4,1 équivalent de NaIO4[34]. ... 9
Tableau 6 : Résultats obtenus pour la scission oxydante de l'acide oléique en une seule étape à 373K.[39] ... 10
Tableau 7 : Résultats de l'oxydation de l'acide oléique par des catalyseurs dérivés du TPA.[45] ... 13
Tableau 8 : Résultats de l'étude sur l’impact des différents contre-ions de la structure H3W12O40 dans le cadre de la scission oxydante de l'acide oléique.[46] ... 14
Tableau 9 : Influence de différents métaux contenus dans un support poreux pour l'oxydation de l'acide oléique par l’oxygène moléculaire, dans un milieu de dioxyde de carbone supercritique.[47] ... 15
Tableau 10 : Recyclabilité des zéolithes ZSM-5 chargées catalytiquement en Cr et Cr-W pour la catalyse de la scission oxydante de l'acide oléique.[52] ... 16
Tableau 11 : Résultats de l’essai catalytique de la scission oxydante de la double liaison de l'acide oléique par des macroparticules d'oxyde de tungstène et de l'oxyde de tungstène supporté par l'alumine.[54] ... 17
Tableau 12 : Efficacité catalytique obtenue après plusieurs cycles par la catalyse du Mo-CTAB 1:3.[55] ... 17
Tableau 13 : Activité de NPs d'Au pour la catalyse de l'oxydation de stilbène en benzaldéhyde.[57] ... 18
Tableau 14 : Activité de NPs d'Ag pour la catalyse de l'oxydation de stilbène en benzaldéhyde.[57] ... 19
Tableau 15 : Conditions de synthèse et de préparation des échantillons.[61] ... 19
Tableau 16 : Résultat des essais catalytiques (conversion de l'acide oléique et production des produits désirés) et fraction massique de l'oxyde de tungstène dans le catalyseur.[61] 20 Tableau 17 : Paramètres instrumentaux de l’ICP-AES. ... 53
xii
Tableau 18 : Analysis of several XRD patterns through the Debye Scherrer equation to calculate the crystallite size through 3 main crystallographic planes (220), (311) and (422). ... 81 Tableau 19 : Reproducibility of the synthesis of Fe3O4 NPs: 3 times for each synthesis time.
... 83 Tableau 20 : BET surface areas of the sample synthesized for 6 h and various materials reported in the literature compared to the theoretical calculation (hard spheres) values. . 84 Tableau 21 : Average particle size after each successive step of synthesis: bare Fe3O4,
Fe3O4@SiO2 and Fe3O4@SiO2@WO3 nanoparticles (number of particles 100) ... 112
Tableau 22 : Catalytic activity at different amounts of Fe3O4@SiO2@WO3 nanocatalyst for
the oxidative cleavage of oleic acid. ... 118 Tableau 23 : Catalytic activity of homogenous H2WO5 catalysts and tungsten oxide
xiii
Liste des abréviations, sigles, acronymes
Tableau 1 : Liste des abréviations.
Abréviation Nom
AA Acide azélaique (ou diacide nonanoique) APTES aminopropyl triethoxysilane
BET Modèle de Brunauer, Emmett et Teller CTAB cetyltrimethylammonium bromide
DCC N,N’-dicyclohexylcarbodiimide DMAP 4-Diméthylaminopyridine
DSC Analyse calorimétrique différentielle DTA Analyse thermique différenciée
DTG Analyse différentielle thermogravimétrique EDA Éthylène diamine
EDC 1-éthyl-3-(3-diméthylaminopropyl)carbodiimide EDX (ou EDS) Spectroscopie de rayons X à dispersion d’énergie
EG Éthylène glycol
EI Ionisation par bombardement d’électron
FEI-SEM Field emission in-lens scanning electron microscopy
FTIR Spectrométrie infrarouge par transformée de Fourier FWHM Largeur à mi-hauteur
GC-MS Chromatographie en phase gazeuse couplée à la spectrométrie de masse
HRTEM Microscopie électronique à transmission à haute résolution ICDD International Centre for Diffraction Data
ICP-AES Plasma à couplage inductif couplé à la spectrométrie d'émission atomique
IR Infrarouge
IRM Imagerie par résonnance magnétique
IUPAC International Union of Pure and Applied Chemistry MNP Nanoparticule magnétique
NN Nonanal
NaAc (ou NaOAc) Sodium acétate
NP Nanoparticule
NSERC Natural Science and Engineering Research Council of Canada
OA Acide oléique
PA Acide pélargonique (ou acide nonanoïque)
POM Polyoxométallate
SEM (ou MEB) Microscopie électronique à balayage STEM HAADF High Angle Annular Dark Field
TEM Microscopie électronique à transmission TEOS Orthosilicate de tétraéthyle
TGA Analyse thermogravimétrique TMA Analyse thermomécanique
xiv TPA Acide phosphotungstique
UV Ultraviolet
XPS Spectrométrie de photoélectrons induits par rayons X XRD (ou DRX) Diffraction des rayons X
Tableau 2 : Liste des unités.
Unités Nom Å Angstrom °C Degré Celcius eV Électron-volt g Gramme J Joules L Litre m Mètre min Minute Pa Pascal rad Radian s Seconde V Volt W Watt
Tableau 3 : Liste des ordres de grandeur.
Ordre de grandeur Préfixe Abréviation
10-15 femto- f 10-12 pico- p 10-9 nano- n 10-6 micro- µ 10-3 milli- m 10-2 centi- c 103 kilo- k 106 méga- M 109 giga- G
xv
Au docteur Claire Dalencourt, tu es, a été et
seras mon oxymore le plus brillant !
xvi
« Les malentendus sont toujours causés par
l’incapacité à apprécier le point de vue
d’autrui. » - Nicolas Tesla
xvii
Remerciements
Je souhaite remercier tout d’abord le Professeur Trong On Do pour m’avoir accueilli au sein de son laboratoire et pour m’avoir offert l’opportunité de travailler sur un sujet de thèse sous sa direction. Son grand support et ses conseils ont été en mesure de répondre à mes nombreux questionnements durant cette thèse. Je souhaiterais le remercier tout particulièrement pour son travail acharné dans la publication de mes différents manuscrits. Je souhaiterais aussi remercier mon co-directeur, le Professeur Serge Kaliaguine pour son support, ses conseils ainsi que pour avoir partagé une petite partie de ses immenses connaissances et de son expérience. Je le remercie également pour son travail effectué sur mes différents manuscrits. Je remercie aussi le Docteur Éric Gagnon pour son implication dans les premiers temps de ma thèse.
Je souhaiterais aussi remercier tous les membres permanents de l’Université Laval m’ayant aidé durant ces quatre années. Les membres des laboratoires de microscopie électroniques, Richard Janvier et Alain Goulet de la plateforme d’imagerie-microscopie de l’Institut de Biologie Intégrative et des Systèmes, Marc Choquette et Suzie Côté du laboratoire de microanalyse du département de géologie et génie géologique de l’Université Laval ainsi que Jean-Philippe Masse du laboratoire (CM)² de l’Université polytechnique de Montréal. Alain Adnot, du laboratoire d’analyse des surfaces du département de génie chimique de l’Université Laval pour son aide et sa grande expérience sur les analyses XPS. Guillaume Gauvin du laboratoire du Professeur Houshang Alamdari du département de génie des mines, de la métallurgie et des matériaux, la Professeure Safia Hamoudi du département des sols et génie agroalimentaire ainsi que Jean Frenette du laboratoire de microanalyse du département de géologie et génie géologique de l’Université Laval pour leur aide et expérience en matière d’analyse de diffraction des rayons X. Jérôme Noël, Marc Lavoie ainsi que Jean-Nicolas Ouellet du département de génie chimique pour leur aide et leur travail sur tout l’appareillage entourant une thèse et indispensable à sa réussite. Et enfin, l’ensemble du personnel administratif du département de génie chimique, Ann Bourassa, Nadia Dumontier et tout particulièrement France Cayouette, pour leur temps, leur compréhension et leur support.
Je souhaiterais aussi remercier tous les membres des laboratoires des Professeurs Do et Kaliaguine, passés et présents, pour leur soutien, leur aide et in fine leur cohésion. Un grand merci donc à : Duc Trung Nguyen, Dr Chinh Chien Nguyen, Dr Amir Enferadi Kerenkan, Dr Serge Ello, Dr Sibi Malayil, Gloire Justesse Adolphe Mbou, Rokesh Karuppannan, Jorge Becerra Sanchez, Vishnu Nair Gopalakrishnan, Dr Mohammad Reza Gholipour, Manh-Duy Phan, Anh Quach, Nhu Nang Vu et Manh Hiep Vu.
Je souhaiterais aussi remercier les partenaires et partenaires financiers de ce projet, le CRSNG (Conseil de recherche en Sciences naturelles et génies du Canada), Oleotek, maintenant Kemitek (M. David Berthiaume, Directeur général et M. Alain Tremblay, Directeur de Recherche), tout particulièrement Dominic Thibault, Éric Gagnon, François Rouillard, ainsi que Silicycle et ARKEMA, tout particulièrement Dr Francois Béland et Dr Jean-Luc Dubois.
Enfin un remerciement tout particulier à ma famille et mes amis, votre support à tous fut inestimable.
xviii
Avant-propos
Cette thèse de 4 ans a été réalisée dans le laboratoire de photocatalyse du Pr Tong On Do (Département de génie chimique, Université Laval), avec la codirection du Pr Serge Kaliaguine (Département de génie chimique, Université Laval). Cet avant-propos vise à clarifier la contribution des auteurs dans chacun des articles faisant office de chapitres dans cette thèse. Les articles du Chapitre 3, du Chapitre 4 et du Chapitre 5 sont tous des articles soumis ou publiés dont le premier auteur – ou premier auteur à égale contribution – est l’auteur de cette thèse. Un dernier article est en cours de rédaction, mais n’a pas été intégré à cette thèse étant donné le retard engendré par la crise de la COVID-19 dans la réalisation des expériences. Cet article porte sur une étude paramétrique des nanocatalyseurs vis-à-vis de l’essai catalytique, au niveau de la taille, du solvant ainsi que de la phase active (oxyde de tungstène, molybdène, chrome et titane).
L’article faisant office de Chapitre 3 présente une méthode fiable pour la synthèse de nanoparticules magnétiques. Cet article intitulé « Synthesis of single-phase and controlled monodisperse magnetite Fe3O4 nanoparticles » a été accepté pour publication dans The
Canadian Journal of Chemical Engineering, après révision auprès des pairs. Les
expériences et résultats présentés, ainsi que leurs interprétations sont originales. Chinh-Chien Nguyen a contribué à la rédaction de cet article.
Deux voies de synthèse pour la réalisation de nanoparticules cœur@coquille magnétiques ont été envisagées. Le Chapitre 4 présente une première méthode de synthèse de nanoparticules cœur@coquille, avec un cœur magnétique et une coquille composée d’oxyde de molybdène, un catalyseur pour la scission oxydante d’acides gras insaturés. Cet article intitulé « A novel route to prepare recoverable Fe3O4@SiO2@MoO3 core@dual shell
nanoparticles for catalytic oxidation reactions » a été soumis auprès du journal Chemical
Communication, à égale contribution avec Chinh-Chien Nguyen. La synthèse de ces
nanoparticules a été réalisée par ce dernier, avec un apport scientifique de la part de l’auteur de cette thèse. Les caractérisations et leurs interprétations sont des travaux originaux de l’auteur de cette thèse, ainsi qu’une partie de la rédaction de l’article.
Finalement, le Chapitre 5 présente la seconde voie de synthèse. Cet article introduit un nouveau nanocatalyseur de type cœur@double coquille pour la scission oxydante des acides gras insaturés, par l’exemple de l’acide oléique. Il présente méticuleusement la méthode de synthèse développée dans le but de former le nanocatalyseur Fe3O4@SiO2@WO3, en plus de démontrer son efficacité en tant que catalyseur. Cet article
intitulé « Synthesis of magnetic core@dual shell Fe3O4@SiO2@WO3 nanocatalyst for olefin
double bond oxidative cleavage » a été accepté pour publication dans The Canadian
Journal of Chemical Engineering, après révision par les pairs. Les expériences et résultats
présentés, ainsi que leurs interprétations sont originales. Chinh-Chien Nguyen a contribué à la rédaction de cet article, ainsi qu’à l’interprétation de certains résultats.
De plus, l’auteur de cette thèse est également co-auteur d’un article publié dans Dalton
Transaction en 2018 par Enferadi-Kerenkan et al. où il a contribué à la rédaction et
xix
encapsulated Keggin-type polyoxotungstates: Synthesis, structural characterization, and catalytic capability in oxidative cleavage of unsaturated fatty acids » porte sur l’utilisation de POM de type Keggin à base de tungstène en tant que catalyseur pour la scission oxydante des acides gras insaturés.
Il est à noter qu’un quatrième article était en cours d’élaboration au moment de la crise sanitaire de la Covid-19. Les plans d’expériences et les travaux préliminaires sont présentés dans les perspectives étant donné l’état d’avancement de ce dernier. Nous remercions d’avance les examinateurs pour leur compréhension concernant l’absence de ce dernier article.
1. Gandon, C. C. Nguyen, S. Kaliaguine, T.O. Do. (2020). Synthesis of single phase and controlled monodispersed magnetite Fe3O4 nanoparticles. Can. J. Chem. Eng., in
press.
2. Gandon, C. C. Nguyen, S. Kaliaguine, T.O. Do. (2020). Synthesis of magnetic core@dual shells Fe3O4@SiO2@WO3 nanocatalyst for olefin double bond oxidative
cleavage. Can. J. Chem. Eng., in press.
3. C. Nguyen, A. Gandon, T. O. Do. (2020). A novel route to prepare recoverable Fe3O4@SiO2@MoO3 core-dual shell nanoparticles for catalytic oxidation reactions.
ACS Appl. Nano Mater., 3, 10571.
4. Enferadi-Kerenkan, A. Gandon, T. O. Do, Dalt. Trans. 2018, 47, 1214.
5. Gandon, T. O. Do. (2018). Core@Shell nanoparticles for effective double bond oxidation cleavage catalysis. Conférence annuel 2018.
6. Gandon, T. O. Do. (2019). Synthesis of a novel nanocatalyst core@shell Fe3O4@SiO2@WO3 for the oxidative cleavage of fatty acid double bond. Conférence
1
Introduction
Face à la raréfaction des ressources fossiles et à la demande croissante de produits issus de la pétrochimie, des alternatives s’inscrivant dans une économie durable ont été proposées. Parmi ces alternatives, le remplacement des produits issus des ressources fossiles telles que le pétrole par des ressources de carbone renouvelables est un des douze principes de la chimie verte, au même titre que l’emploi de la catalyse[1]. Les produits
biosourcés seraient une alternative viable à condition de remplacer efficacement les produits de la pétrochimie.[2,3]
Figure 1 : La filière de la pétrochimie.[4–6]
Les produits de base actuels de l’industrie chimique sont issus du raffinage du pétrole. Ces composés carbonés comprennent entre 3 et 12 carbones et proviennent de la fraction de raffinage autour de 70°C, le naphta (Figure 1). Cette fraction permet la production des principaux composés de l’industrie pétrochimique, soit le propylène, l’éthylène, le butane, le butène, le benzène, le toluène et le xylène.[4,7–9]
Tableau 4 : Acides gras issus de végétaux communément disponibles.[10] Avec C le nombre de
carbone et D le nombre d’insaturation.
C:D Nom commun Formule semi-développée Source
6:0 Caproïque CH3(CH2)4CO2H Palme, coco
8:0 Caprylique CH3(CH2)6CO2H Palme, coco
10:0 Caprique CH3(CH2)8CO2H Palme, coco
12:0 Laurique CH3(CH2)10CO2H Palme, coco
14:0 Myristique CH3(CH2)12CO2H Palme, coco
16:0 Palmitique CH3(CH2)14CO2H Palme, coton
18:0 Stéarique CH3(CH2)16CO2H Cacao
18:1 9c Oléique CH3(CH2)7CH=CH(CH2)7CO2H Coton, olive,
palme, canola 18:2 9c12c Linoléique CH3(CH2)4(CH=CHCH2)2(CH2)6CO2H Soja, tournesol
sésame, maïs 18:3 9c12c15c α-linolénique CH3CH2(CH=CHCH2)3(CH2)6CO2H Lin
2
22:1 9c Érucique CH3(CH2)7CH=CH(CH2)11CO2H Moutarde,
canola
Une des sources de produits carbonés biosourcés, et donc renouvelables, sont les plantes, et notamment leurs huiles. Les acides gras quelles comportent comprennent généralement entre 4 et 22 carbones avec quelques doubles liaisons. Ils sont d’ailleurs couramment désignés en fonction de ces deux paramètres que sont le nombre de carbones (C) et le nombre d’insaturations par double liaison (D), sous la notation C:D. L’emplacement de la double liaison est par la suite explicité. Ainsi l’acide oléique comprenant 18 carbones et une double liaison entre le 9e et 10e carbone se note 18:1 9c. Le Tableau 4 introduit les acides
gras communément disponibles dans les triglycérides des végétaux tandis que la Figure 2 présente leur distribution. Ainsi, bien qu’il existe une variété d’acide gras, certains d’entre eux sont prédominants dans les plantes tels que l’acide oléique dans l’huile d’olive ou de canola ; tandis que certains acides sont distribués équitablement comme pour le beurre de cacao. Il est à noter que l’acide oléique est cependant présent dans la majorité des produits végétaux, faisant de cet acide gras le produit de référence pour l’étude des produits biosourcés.[11]
Figure 2 : Distribution des acides gras dans quelques végétaux.[12]
À part l’huile de coco présentant principalement des acides gras à faible teneur en carbone, la plupart des huiles sont constituées de chaînes carbonées supérieures à 16 carbones, contenant une ou deux insaturations[12]. Ainsi, afin d’adapter ces nouveaux produits
biosourcés aux procédés industriels déjà en place, il est notamment nécessaire de les fractionner pour obtenir des chaînes carbonées plus courtes, telles que celles présentes dans le naphte. Pour les composés comprenant une double liaison, la scission oxydante est un procédé couramment employé. Bien que l’ozonolyse soit la méthode la plus fréquemment utilisée, elle présente de nombreux inconvénients, tels que les coûts de production de l’ozone et des traitements post-réactionnels ainsi que leurs risques. Il apparaît
3
donc nécessaire de développer des méthodes alternatives permettant la scission oxydante des acides gras, respectueuses des principes de la chimie verte. Ainsi, le peroxyde d’hydrogène est préconisé dans le cadre d’un procédé « vert ». Cet oxydant présente un potentiel d’oxydation légèrement plus faible que l’ozone (1,8 V contre 2,1 V)[13], et son
couplage avec un catalyseur permet d’atteindre des performances intéressantes.
Cette thèse s’inscrit dans le cadre d’un projet en collaboration avec Kemitek (Oleotek) et Arkema, pour permettre de développer un catalyseur efficace pour la scission oxydante des acides gras issus de l’huile de ricin et leur séparation[14]. Ainsi, le but de cette thèse est
d’élaborer un nanocatalyseur magnétiquement récupérable pour la scission oxydante des acides gras insaturés. Étant donné que l’acide oléique est l’acide de référence dans le domaine tant par sa grande disponibilité que par le nombre d’études dédiées à cet acide, il fera également l’objet de ces travaux de recherche.
Basée sur l’expérience du groupe de recherche du Pr Tong On Do sur la catalyse, cette thèse présente la synthèse de nanocatalyseurs dont la surface serait active pour la catalyse de la scission oxydante de l’acide oléique. Les travaux précédents dans le groupe de recherche portaient sur l’oxyde de tungstène et l’oxyde de molybdène, sous forme particulaire, supportée, ou sur des polyoxométallates[15]. La conception d’une nanoparticule
cœur@coquille permettrait de coupler les deux propriétés requises que sont le magnétisme et une activité catalytique à la surface.
Ainsi, le Chapitre 1 présente les principaux points théoriques reliés à la synthèse de nanoparticules cœur@coquille magnétiques pour la catalyse. Ce chapitre se divise en 3 parties. La première est axée sur un état de l’art des catalyseurs déjà existant pour la scission oxydante d’acide gras, tant homogènes qu’hétérogènes. Ensuite, les nanocatalyseurs ayant été développés dans ce domaine sont introduits. La deuxième partie présente le magnétisme et le cas particulier de la magnétite, qui servira de vecteur de recouvrement lors de son utilisation en tant que cœur dans les nanoparticules cœur@coquille. La théorie du magnétisme ainsi que les méthodes de synthèse seront présentées. Finalement, les nanoparticules cœur@coquille, de leur origine à leur utilisation, notamment en catalyse, en passant par leurs méthodes de synthèse, seront abordées. La caractérisation des différents matériaux synthétisés et leur activité catalytique reposent sur l’usage de divers outils métrologiques complémentaires. Le Chapitre 2 présente les techniques de caractérisation utilisées lors de cette thèse, tant d’un point de vue théorique que d’un point de vue pratique avec leurs protocoles d’utilisation.
Le Chapitre 3 présente les résultats obtenus pour la synthèse de nanoparticules de magnétite. Une étude paramétrique sur le temps de synthèse permet notamment d’obtenir des nanoparticules monodisperses et extrêmement reproductibles et de taille contrôlée. Ce protocole de synthèse simple sera utilisé pour synthétiser les nanoparticules magnétiques servant de support pour les catalyseurs développés au cours de cette thèse. Ce travail a été publié en tant qu’article dans The Canadian Journal of Chemical Engineering.
4
Le Chapitre 4 présente une nouvelle méthode pour la synthèse de nanoparticules de type cœur@coquille. L’utilisation de l’oxyde de molybdène en tant que coquille permettrait une possible application pour la catalyse de la scission oxydante des acides gras. La méthode présentée permet de synthétiser en deux étapes succinctes une nanoparticule composée d’un cœur magnétique, et d’une coquille d’oxyde de molybdène et de silice. Cet article a été soumis en tant que communication auprès du journal Chemical Communication.
Le Chapitre 5 présente un nouveau nanocatalyseur de type cœur@coquille pour la scission oxydante des acides gras avec pour exemple celui de l’acide oléique. Dans cet article, la méthode de synthèse en 3 étapes et les résultats intermédiaires sont détaillés afin de mettre en avant la réalisation d’une nanoparticule cœur@double coquille entièrement inorganique, Fe3O4@SiO2@WO3. Cette nanoparticule composée d’un cœur de magnétite, phase la plus
magnétique du fer, est entièrement recouverte de silice afin d’éviter la réaction de Fenton ou la création d’oxydes mixtes entre l’oxyde de fer et l’oxyde de tungstène. Ce dernier constitue la phase active de ce nanocatalyseur. Les performances catalytiques de ce nouveau catalyseur, à la frontière entre catalyse homogène et hétérogène, sont également présentées. Ce travail a été publié en tant qu’article dans The Canadian Journal of Chemical
Engineering.
Finalement, une conclusion viendra clore cette thèse. Elle sera enrichie des perspectives concernant les méthodes de synthèses de nanoparticules cœur@coquille, et notamment leur possible application à d’autres systèmes catalytiques.
Ces perspectives intègrent notamment le contenu d’un article en cours de rédaction portant sur une étude paramétrique de cette méthode de synthèse pour une application pour la catalyse de la scission oxydante des acides gras insaturés avec l’acide oléique comme exemple. Pour ce faire, les paramètres suivants de la méthode de synthèse sont étudiés : la nature du catalyseur (oxyde de tungstène, oxyde de molybdène, oxyde de chrome et oxyde de titane) et la taille des nanoparticules de cœur. Avant de procéder à l’étude de leur activité catalytique, une optimisation des conditions de l’essai catalytique devra être réalisée sur Fe3O4@SiO2@WO3. Cette optimisation portera sur le solvant et la température du milieu
5
Chapitre 1. Les nanoparticules cœur@coquille
magnétiques et leur application en catalyse
Ce chapitre permet de présenter les notions théoriques utiles pour l’élaboration de nanoparticules magnétiques de type coeur@coquille à des fins de produire des catalyseurs pour la scission oxydante de la double liaison des acides gras.
Dans un premier temps, un état de l’art sur les catalyseurs utilisés dans le cadre de la scission de la double liaison des acides gras est présenté. Ainsi, les catalyseurs homogènes, suivis des catalyseurs hétérogènes, seront abordés. Une dernière partie présentera les avancées réalisées dans la catalyse hétérogène par une augmentation de la surface spécifique avec les nanoparticules, sur lesquelles sont basés les travaux développés dans cette thèse.
La magnétisation de telles nanoparticules pourrait leur procurer un pouvoir de récupération, et ainsi les rendre possiblement applicables en industrie. Dans une seconde partie, le magnétisme sera présenté. Cette propriété physique est nécessaire afin d’assurer une récupération aisée des nanoparticules produites. Ainsi, le cœur de la nanoparticule sera une phase inorganique présentant une aimantation à saturation importante, l’oxyde de fer. Une telle aimantation est essentielle afin de conserver cette propriété malgré son atténuation due au recouvrement du cœur par des phases inorganiques exemptes de propriétés magnétiques. Cette présentation du magnétisme est divisée en trois parties distinctes constituées d’une brève introduction du magnétisme d’un point de vue historique et des applications courantes, d’une partie théorique sur le magnétisme et ses différentes formes et finalement d’une présentation des oxydes de fer.
Enfin, les nanoparticules de type coeur@coquille seront présentées. Cette section contient un état de l’art sur les premiers travaux ayant mené à l’émergence de ces structures, leurs applications actuelles, la dernière partie étant axée sur les applications pour la catalyse. Finalement, une dernière partie sera dédiée aux méthodes de synthèse permettant la production de ce type de nanoparticules. Leurs avantages et inconvénients seront abordés afin de comprendre le choix de la méthode proposée au cours de cette thèse.
6
1.1.
Les catalyseurs pour la scission oxydante de l’acide
oléique
Comme cela a été mentionné précédemment, l’objectif du catalyseur développé dans cette thèse est la scission oxydante de la double liaison d’acide gras. Afin de permettre des comparaisons avec le reste de la littérature sur ce sujet, le substrat utilisé pour les essais catalytiques sera l’acide oléique (OA).
Les acides gras sont, typiquement, des acides carboxyliques composés d’une longue chaîne carbonée allant de 4 à 36 carbones[16]. Ces molécules possédant un nombre de
carbones pair, présentent généralement une à trois insaturations (Figure 3). Ces composés sont très présents dans les huiles végétales ainsi que les graisses animales et végétales sous forme de triglycérides. Ils sont, pour les organismes, des sources d’énergie métaboliques à hauteur de 37 kJ par gramme (17 kJ/g pour les glucides) notamment grâce aux omégas 3 et 6. Pour l’être humain, ils peuvent également jouer le rôle d’hormones[17,18].
Figure 3 : Exemples d'acides gras courants.
Aujourd’hui ces composés semblent de plus en plus intéressants pour l’industrie chimique grâce à l’oléochimie[19]. Cette science consiste à transformer les huiles ou graisses d’origine
végétale ou animale en produits valorisables dans l’industrie chimique. Cette démarche s’inscrit dans le cadre plus large du développement durable puisque ces huiles sont considérées comme des ressources renouvelables. Ainsi des acides gras tels que l’acide linoléique pourraient être une source alternative d’acides carboxyliques avec 3, 5 ou encore 9 carbones (C3, C5 et C9).
L’une des réactions les plus communes pour transformer ces acides gras en produits à haute valeur ajoutée est la scission oxydante de leurs doubles liaisons. Or, cette réaction nécessite des conditions de réaction très dures, telles que celles de l’ozonolyse encore utilisée de nos jours. Ainsi, des catalyseurs homogènes puis hétérogènes ont été développés afin de diminuer les coûts énergétiques et environnementaux de cette réaction[20].
De par sa disponibilité et les nombreuses applications de ses produits, la réaction de scission oxydante la plus étudiée est celle de l’acide oléique. En effet, l’acide pélargonique (PA) et l’acide azélaïque (AA), produits de la scission oxydante complète de la double liaison de l’acide oléique, possèdent de nombreuses applications tant dans le domaine des plastiques, des pesticides que dans celui des cosmétiques[19]. Si le mécanisme de scission
7
intermédiaires réactionnels tel que l’acide 9,10-dihydroxyoctadécanoïque (diol), l’acide 9-oxononanoïque et le nonanal (cétone, NN)[14,15,21]est admise. La détection de ces espèces
intermédiaires est importante, car elles permettent de déterminer l’état de l’avancement de la réaction et les problèmes potentiels. Ainsi, durant ces travaux, la présence de nonanal et sa concentration seront largement utilisées afin de déterminer l’état d’avancement de la réaction. En effet, une concentration trop élevée en nonanal indique une réaction incomplète nécessitant soit une température/durée de réaction plus importante pour arriver à terme, soit une plus grande quantité d’oxydant afin d’amener la réaction à son stade d’oxydation final.
Des études récentes se sont intéressées aux réactions secondaires pouvant être observées dans le cas de cette réaction. En effet, pour la plupart des travaux qui seront présentés dans cette section, les sélectivités vis-à-vis de l’AA et du PA sont inférieures à 100%. L’une des explications principales, outre une réaction incomplète, est l’existence de réactions non désirées entre les intermédiaires réactionnels menant à des produits secondaires à haute masse moléculaire. Récemment, quelques articles[22,23] se sont intéressés à ces oligomères
provenant de réactions pour l’instant non déterminées. Cependant, les recherches sur ce sujet sont récentes et ne permettent pas une explication de ce phénomène. Il est donc important de garder ce point en mémoire lors de la présentation des résultats, qu’une quantité négligeable des travaux publiés dans le domaine de la scission oxydante de la double liaison de l’acide oléique a pris en compte la formation d’oligomères mais qu’ aucun ne les a établis quantitativement.
8
1.1.1. Catalyseurs homogènes
Un catalyseur homogène est un catalyseur présent dans la même phase que le substrat de la réaction catalytique.[24] Dans le cas présent, l’acide oléique étant en phase liquide, tout
catalyseur pouvant être dissous dans la même phase ou sous forme liquide peut être désigné comme un catalyseur homogène. Il existe plusieurs catalyseurs homogènes pour la scission oxydante de la double liaison des acides gras. Les premiers que nous aborderons ici sont les catalyseurs organométalliques. Généralement constitués d’un atome de métal de transition complexé par des molécules organiques, il existe plusieurs composés organométalliques ayant démontré des activités catalytiques.
1.1.1.1. Complexes organométalliques
Le métal le plus recensé dans la littérature est le fer. Il est apparu que l’époxydation des oléfines pouvait être aisément réalisée lorsque le complexe de fer présente une morphologie proche du fer non-héminique. Ainsi, plusieurs complexes ont été éprouvés sur des chaînes carbonées insaturées comprenant des acides gras.[25,26]
Figure 4 : Ensemble de complexes organométalliques présentant une activité catalytique non négligeable pour la scission oxydante de la double liaison d’acides gras insaturés.[25,26]
Les premiers résultats intéressants pour la scission oxydante ont été obtenus grâce au complexe Fe-bpbp qui nécessite une pureté chirale afin de présenter une activité satisfaisante (Figure 4). Après plusieurs améliorations, des complexes plus simples et abordables de [Fe(OTf)2(mix-bpbp)][25,27]ont été développés. Enfin, grâce à une modulation
durant la réaction du pH ainsi qu’une légère modification du complexe, la sélectivité envers les acides carboxyliques a pu être augmentée jusqu’à un maximum de 85%.
9
Plusieurs autres complexes organométalliques sont à mentionner comme ayant une activité catalytique dans la scission oxydante de double liaison carbone-carbone, sans pour autant avoir été analysés sur des acides gras.[28,29]
1.1.1.2. Tétraoxydes du groupe 8
Il existe de nombreux travaux ayant démontrés la capacité oxydante des oxydes de type MO4, avec M un élément provenant du groupe 8. Il apparaît ainsi évident que ces oxydes
ont été utilisés pour la catalyse de la scission oxydante d’acide gras. Le catalyseur de cette forme le plus présent dans la littérature est le RuO4, présentant une activité permettant des
rendements entre 70 et 99% suivant les conditions expérimentales avec une conversion de 100% du substrat (Tableau 5).[30–32] Le OsO4 est aussi présent dans la littérature et présente
une activité similaire, permettant des rendements de 80 à 95% avec des conversions de 100%.[33] Certaines améliorations liées à l’utilisation d’ultrasons par exemple ont pu être
observées dans la littérature.[34]
Tableau 5 : Oxydation de l'acide oléique par 2,2% de RuCl3 avec 4,1 équivalent de NaIO4[34].
Co-solvants Rapport volumique (mL) Temps (h) Conversion OA (%) Rendement AA (%) H2O/MeCN/CCl4 3/2/2 2 80 55 H2O/MeCN/CCl4 3/2/2 4,5 100 70 H2O/MeCN/AcOEt 3/2/2 2 100 73 H2O/MeCN/AcOEt + 3/2/2 0,75 100 81 H2O/MeCN/AcOEt + 5/1/1 1 100 51 H2O/MeCN+ 6/1 1 100 41 H2O/AcOEt+ 4/3 1 100 41 H2O+ 7 8 30 4 + en présence d'ultrasons
Les catalyseurs de ce type sont formés à partir de chlorures oxydés généralement in situ par NaIO4. De surcroît, la stabilisation de tels oxydants nécessite des solvants spécifiques
ou des mélanges comme le CCl4 ou l’acétonitrile couplé à l’acétate d’éthyle. Il faut aussi
noter la dangerosité de ces oxydes envers l’environnement ou les manutentionnaires, qui nécessite des conditions de sécurité renforcées. Pour toutes ces raisons ainsi que le prix initial du catalyseur et malgré l’activité importante démontrée par ces catalyseurs, aucune utilisation industrielle n’a été envisagée.[30–32]
1.1.1.3. Les peroxydes
L’acide pertungstique (H2WO5) et son équivalent H2MoO5 sont deux composés reconnus
pour leur activité catalytique dans la scission de la double liaison des acides gras[35–37]. Le H2WO5 peut être considéré comme le catalyseur de référence pour cette réaction (Tableau
6). Ces espèces sont généralement issues de la réaction entre l’acide tungstique, H2WO4,
et le peroxyde d’hydrogène, sur la même base que la solution piranha, très répandue en laboratoire. Les espèces ainsi obtenues sont des acides et des super oxydants[38] ; ces deux
10
de double liaison jusqu’à l’acide carboxylique. Afin d’optimiser l’activité de l’acide pertungstique, un cocatalyseur d’acétate de cobalt (Co(Ac)2)[21,36] a été utilisé.
Tableau 6 : Résultats obtenus pour la scission oxydante de l'acide oléique en une seule étape à 373K.[39]
Rendement
Temps (h) OA/H2WO4 OA/H2O2 Diol (%)a,b PA (%)a,b AA (%)a,b
4c 100/1 1/4 90 ± 2 - - 4 - 1/4 20 ± 1,0 14 ± 1,0 10 ± 1,1 4 100/1 1/4 26 ± 1,1 36 ± 2 43 ± 1,3 4 50/1 1/4 5,0 ± 0,2 24 ± 1,3 41 ± 2 4 100/1 1/8 4,0 ± 0,2 52 ± 3 64 ± 3 4 50/1 1/8 - 44 ± 2 72 ± 4 4 100/1 1/(4+4) 1,0 33 ± 2 72 ± 4 8 50/1 1/4 3,0 ± 0,2 26 ± 1,4 43 ± 2 8 100/1 1/4 5,0 ± 0,4 55 ± 1,2 64 ± 2 8 100/1 1/8 - 69 ± 1,5 91 ± 2
a Rendements obtenus par la moyenne des trois analyses chromatographiques b D’autres produits d’oxydation mineurs sont présents, mais non rapportés c Réaction effectuée à 343 K.
11
1.1.2. Catalyseurs hétérogènes
Un catalyseur hétérogène est un catalyseur présent dans une phase différente de celle du substrat.[24] Dans le cas de cette revue de littérature, l’attention sera porté sur les catalyseurs
sous forme solide et ne mentionnera pas de catalyseur liquide ou gazeux quasi absent de la littérature recensée.
Les catalyseurs hétérogènes sont donc, pour ceux ayant été rapportés, des phases solides dispersées dans le milieu liquide. Cette différence de phase permet généralement une meilleure et moins coûteuse récupération que pour les catalyseurs homogènes. En contrepartie, la disponibilité du catalyseur pour la réaction est généralement inférieure, en effet, pour une phase solide, une partie du catalyseur se trouve au cœur du matériau et ne participe pas à la réaction.. Pour toutes ces raisons, un catalyseur solide présente généralement une activité inférieure à celle d’un catalyseur homogène.[40]
Les catalyseurs solides et donc hétérogènes observés dans la littérature peuvent être regroupés en trois catégories, les polyoxométallates (POM), les catalyseurs supportés et les macroparticules.
1.1.2.1. Les polyoxométallates
Les structures polyoxométallates (POM) sont une famille de matériaux issue d’un arrangement spécifique d’oxydes de métaux provenant des groupes 5 et 6 (généralement vanadium, tantale, molybdène ou tungstène) sous leur forme la plus oxydée. Il existait, à l’origine, quatre types de POM : les structures d’Anderson, de Lindqvist, de Dawson et enfin de Keggin. Par la suite, la recherche a permis de mettre au point de nouvelles structures de POM telles que les structures couronne, sphérique ou encore géante (Figure 5).[41]
12
La plupart des études utilisant les POM privilégient l’utilisation de structures de Keggin, principalement H3PW12O40.nH2O, l’acide phosphotungstique (TPA). Ces polyoxométallates
basés sur le tungstène ont démontré une activité en tant que catalyseurs pour un grand nombre de réactions.[43] Les premiers travaux ayant démontré l’activité des POM sur la
scission oxydante des acides gras s’intéressaient au mécanisme de la scission oxydante de doubles liaisons par les POM[44]. Ces travaux, en plus de démontrer l’activité des POM basés
sur le tungstène pour la scission oxydante d’alcènes, ont mis en lumière la possibilité de deux mécanismes concurrents dans cette scission oxydante, fonction de la longueur des alcènes utilisés comme substrat. Il est cependant à noter que si des valeurs de rendement de 82% pour l’acide pélargonique et de 79% pour l’acide azélaïque ont été obtenues avec l’acide oléique, les mécanismes réactionnels présentés ne sont pas acceptés par l’intégralité de la communauté scientifique. Le mécanisme le plus largement reconnu pour cette réaction est présenté à la Figure 6.
Figure 6 : Mécanisme possible de la scission oxydante de la double liaison de l'acide oléique proposé par Venturello[44] et adapté par Dubois[14].
Par la suite, des recherches ont comparé l’activité du PO4[WO(O2)2]4 en modifiant les
différents ions et contre-ions. Ainsi, plusieurs chaînes carbonées cationiques d’une longueur croissante ont été testées en présence de contre-ions Cl- ou Br- (Tableau 7 et Figure 7).[22,45]
13
Tableau 7 : Résultats de l'oxydation de l'acide oléique par des catalyseurs dérivés du TPA.[45] Catalyseur Méthode de préparation Contre-ion Conversion OA (%) Rendement AA (%) Rendement PA (%) - - - 38,1 1,8 2,2 A In situ Cl- 100,0 77,6 80,9 A Préalablement Cl- 100,0 52,0 57,1 A In situ Br- 100,0 71,8 76,2 B In situ Cl- 100,0 81,5 86,1 B Préalablement Cl- 100,0 70,2 75,1 B Préalablement Cl- 100,0 68,0 73,3 C In situ Cl- 100,0 75,7 80,7 D In situ Cl- 100,0 73,2 76,5
Figure 7 : Catalyseurs dérivés du TPA.[45]
Il est apparu que les POM basés sur le tungstène pouvaient être utilisés comme catalyseurs, en présence de peroxyde d’hydrogène comme agent oxydant, pour la scission oxydante d’acide gras ainsi que d’époxyde. Les résultats obtenus démontrent la dépendance de l’activité du catalyseur envers le système d’ion et de contre-ion. Ainsi, les rendements en acide pélargonique et acide azélaïque présentent chacun un maximum dans le cas de l’utilisation du cation aliphatique le plus long/encombré. Identiquement, le rendement obtenu est plus élevé pour les catalyseurs utilisant le chlore comme anion que ceux utilisant le brome. Cette réaction n’utilisant pas d’autre solvant que le substrat lui-même, le milieu réactionnel est donc une émulsion entre l’eau de l’oxydant et la phase organique du substrat. Ainsi l’activité supérieure de catalyseurs présentant de longues chaînes aliphatiques peut s’expliquer par la stabilisation du système d’émulsion par le cation présent avec le POM ainsi que par la capacité du POM à transférer l’agent oxydant d’une phase à une autre. Durant ces études, il est aussi apparu que le catalyseur synthétisé ex situ présentait une activité plus faible de celui produit in-situ.[45]
Récemment, le groupe du professeur Do a effectué des essais sur des structures de Keggin contenant du tungstène pour la scission oxydante de l’acide oléique.[46] L’objectif de ces
travaux était l’étude de l’influence de la longueur de chaîne des contre-ions sur l’activité du catalyseur dans une solution de tert-butanol avec le peroxyde d’hydrogène comme agent oxydant. Les catalyseurs utilisés étaient des H3W12O40, couplés avec les contre-ions
suivants : le triméthylméthanaminium, le tripropyl-1-propanaminium ou encore le tributyl-1-butanaminium. Pour des fins de comparaison, des macroparticules d’oxyde de tungstène pur ont été analysées également (Tableau 8).
14
Tableau 8 : Résultats de l'étude sur l’impact des différents contre-ions de la structure H3W12O40 dans
le cadre de la scission oxydante de l'acide oléique.[46]
Catalyseur Conversion OA (%) Rendement AA (%) Rendement PA (%) - 41 2 4 WO3·nH2O 100 49 50 WO3·nH2O et [MAxWO3+x/2·nH2O] 100 62 61 [(CH3CH2CH2)4N]2,75[H5,25W12O40] ·7,42H2O 100 72 69 [(CH3CH2CH2 CH2)4N]3,31[H4,69W12O40] ·1,08H2O 100 79 78
1g d’acide oléique, 4mL de peroxyde d’hydrogène à 30%, 7,5 mL de 2-méthyl-2-propanol, 0,45 g de catalyseur chauffé à 120°C pendant 5h
Les résultats obtenus avec le dernier contre-ion sont comparables à ceux obtenus lors de l’étude précédente. Ainsi, il est possible d’observer une nette augmentation de l’activité avec le nombre de carbones présents sur le contre-ion. Il apparaît de plus que les POM présentent une meilleure activité que des macroparticules d’oxyde de l’hétéroatome pures utilisées pour la comparaison. Une explication possible de ce phénomène est le caractère acide exacerbé du tungstène présent dans les polyoxométallates, ce qui favoriserait la catalyse. Il serait intéressant de comparer ces résultats avec des nanoparticules de tungstène dont la réactivité de surface serait augmentée due au manque de voisin des atomes de tungstène présents.[46]
1.1.2.2. Les catalyseurs supportés
Les catalyseurs supportés sont des clusters de phase active déposés à la surface d’une structure poreuse. Ce type de catalyseur présente généralement l’avantage de stabiliser le catalyseur tout en augmentant la surface spécifique. Plus tard dans cette partie on expliquera de façon plus détaillée que le support peut aussi servir de cocatalyseur en fournissant des sites actifs additionnels favorisant l’activité.
Plusieurs catalyseurs utilisant des éléments du groupe 6 ont déjà été présentés ici, tungstène, molybdène ; cependant aucun catalyseur n’utilisant le chrome n’avait été présenté jusqu’alors. Une étude s’est intéressée à l’activité d’un catalyseur de chrome déposé sur une silice mésoporeuse de type MCM-41.[19]
Afin d’étudier l’impact du support ainsi que l’activité de plusieurs métaux de transition, les catalyseurs CrMCM-41 (silice mésoporeuses), CoMCM-41 (silice mésoporeuses), MnMCM-41 (silice mésoporeuses), CrALPO-5 (molecular seives), MnMFI (zéolite) et CoMFI (zéolite) ont été employés sur la scission oxydante de l’acide oléique (Tableau 9).[47] Il est aussi à
noter que l’utilisation de structures mésoporeuses entraîne généralement des problèmes de diffusion des produits et réactifs, ce qui diminue de façon non négligeable l’activité du catalyseur. Dans l’étude suivante, afin d’éviter ce phénomène, le solvant utilisé est du dioxyde de carbone sous forme supercritique. Ses capacités de solvant pour les oléfines ont déjà été démontrées et son comportement supercritique permet une meilleure diffusion des produits de la réaction catalytique.[48–51]
![Tableau 4 : Acides gras issus de végétaux communément disponibles. [10] Avec C le nombre de](https://thumb-eu.123doks.com/thumbv2/123doknet/2886119.73544/21.918.125.807.783.1048/tableau-acides-gras-issus-végétaux-communément-disponibles-nombre.webp)
![Tableau 5 : Oxydation de l'acide oléique par 2,2% de RuCl 3 avec 4,1 équivalent de NaIO 4 [34]](https://thumb-eu.123doks.com/thumbv2/123doknet/2886119.73544/29.918.131.796.454.675/tableau-oxydation-acide-oléique-rucl-équivalent-naio.webp)
![Figure 6 : Mécanisme possible de la scission oxydante de la double liaison de l'acide oléique proposé par Venturello [44] et adapté par Dubois [14]](https://thumb-eu.123doks.com/thumbv2/123doknet/2886119.73544/32.918.286.632.429.860/figure-mécanisme-possible-scission-oxydante-oléique-proposé-venturello.webp)

![Figure 31 : Principe de fonctionnement de la mesure de l’équilibre de physisorption [238]](https://thumb-eu.123doks.com/thumbv2/123doknet/2886119.73544/79.918.125.804.366.723/figure-principe-fonctionnement-mesure-l-équilibre-physisorption.webp)
![Figure 39 : Détection et analyse par GC-MS : chromatogramme et spectres de masse. [250]](https://thumb-eu.123doks.com/thumbv2/123doknet/2886119.73544/88.918.219.700.119.420/figure-détection-analyse-gc-ms-chromatogramme-spectres-masse.webp)