Identification des sous-groupes d’individus les plus à
risque de mortalité chez les cas confirmés de la
COVID-19 au Québec
Mémoire
Catherine De Montigny
Maîtrise en santé publique - avec mémoire
Maître ès sciences (M. Sc.)
RÉSUMÉ
En mars 2020, l’Organisation mondiale de la santé (OMS) déclarait la pandémie de la nouvelle maladie à coronavirus-19, aussi connue sous le nom de COVID-19. Le 26 juillet 2020, le SRAS-CoV-2 avait infecté 15 785 641 personnes, causant 640 016 décès. Un groupe de travail de l’Institut national de santé publique du Québec a été mandaté pour identifier les sous-groupes de la population vulnérables aux complications sévères liées à la COVID-19. L’objectif principal de ce mémoire est d’identifier les sous-groupes d’individus les plus à risque de mortalité chez les cas confirmés de la COVID-19 au Québec. Une étude de cohorte populationnelle de l’ensemble des cas confirmés de la COVID-19 au Québec a été réalisée. Parmi les 58 733 cas confirmés entre le 23 février 2020 et le 26 juillet 2020, 92% ont pu être jumelés avec les données du Système intégré de surveillance des maladies chroniques du Québec. La majorité de ces cas avait entre 20 et 64 ans, 60% étaient des femmes et 55% présentaient au moins une maladie chronique. Parmi les cas, 10% sont décédés, 12% ont été hospitalisés et 2% ont été admis aux soins intensifs. Peu de décès ont été observés avant l’âge de 60 ans. Les analyses de régression ont révélé que les sous-groupes d’individus les plus à risque de mortalité étaient les personnes âgées de 70 ans et plus, particulièrement de sexe masculin; les personnes aux prises avec certaines comorbidités; de même que les personnes plus jeunes cumulant des maladies chroniques. Ces résultats permettront aux décideurs du réseau de la santé de mettre en place des mesures dans le but de protéger les individus les plus vulnérables aux complications sévères liées à la COVID-19 et de prioriser des sous-groupes d’individus pour lesquels la vaccination serait le plus bénéfique.
TABLE DES MATIÈRES
RÉSUMÉ ... II TABLE DES MATIÈRES ... III LISTE DES TABLEAUX ... VI LISTE DES FIGURES ... VII LISTE DES ABRÉVIATIONS ... VIII REMERCIEMENTS ... IX
INTRODUCTION ... 1
CHAPITRE 1 – ÉTAT DES CONNAISSANCES ... 2
1.1. Dernières épidémies causées par des coronavirus ... 2
1.1.1. SARS-CoV ... 2 1.1.2. MERS-CoV ... 2 1.1.3. SRAS-CoV-2 ... 3 1.2. Nomenclature ... 3 1.3. Contagiosité ... 4 1.3.1. Modes de transmission ... 5 1.3.1.1. Contact et gouttelettes ... 5 1.3.1.2. Contact indirect ... 5 1.3.1.3. Échantillons biologiques ... 6
1.4. Symptômes courants de la COVID-19 ... 6
1.5. Examens diagnostiques ... 7
1.5.1. TAAN ... 7
1.5.2. Test sérologique ... 8
1.6. Définition de cas ... 8
1.6.1. Cas confirmé par laboratoire ... 8
1.6.2. Cas confirmé par lien épidémiologique ... 8
1.7. Maladie à déclaration obligatoire ... 9
1.8. Sévérité de la COVID ... 9
1.8.1. Portrait des patients à risque de complications de la COVID ... 10
1.8.1.1. Maladies cardiovasculaires ... 11 1.8.1.2. Maladies respiratoires ... 11 1.8.1.3. Maladies rénales ... 12 1.8.1.4. Maladies hépatiques ... 12 1.8.1.5. Diabète ... 13 1.8.1.6. Obésité ... 13 1.8.1.7. Multimorbidité ... 14
1.9. Décès imputable à la COVID ... 15
1.10. Généralisation à la population québécoise ... 15
CHAPITRE 2 – OBJECTIFS ... 18
2. Objectif principal ... 18
CHAPITRE 3 – MÉTHODOLOGIE ... 19
3.1. Devis et population à l’étude ... 19
3.2. Sources de données ... 20
3.2.1. Fichier V10 ... 20
3.2.2. SISMACQ ... 20
3.3. Mesure des comorbidités ... 21
3.4. Variables de stratifications ... 24
3.5. Analyse des données ... 24
3.5.1. Analyse descriptive ... 25
3.5.2. Analyse de régression ... 25
3.6. Analyse de sensibilité ... 26
CHAPITRE 4 – RÉSULTATS ... 28
4.1. Répartition des cas confirmés en fonction des données sociodémographiques ... 28
4.2. Répartition des décès ... 30
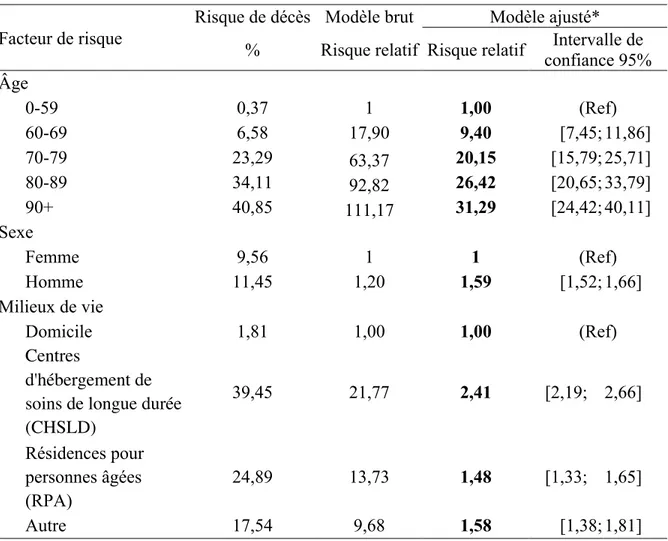
4.3. Risque de décès pour les cas confirmés de la COVID-19 ... 32
4.3.1. Risque de décès pour les cas confirmés de la COVID-19 selon l’âge, le sexe et le milieu de vie ... 32
4.3.2. Risque de décès pour les cas confirmés de la COVID-19 selon les maladies chroniques ... 33
4.3.2. Risque de décès pour les cas confirmés de la COVID-19 par cumul des comorbidités ... 41
CHAPITRE 5 – DISCUSSION ... 46
5.1. Principaux constats ... 46
5.1.1. Comorbidités associées à une augmentation du risque de mortalité ... 46
5.1.1.1. Comparaison avec d’autres études ... 47
5.1.2. Cumul de comorbidités associées à une augmentation du risque de mortalité ... 48
5.1.2.1. Comparaison avec d’autres études ... 49
5.2. Validité interne ... 49
5.2.1. Biais d’information ... 49
5.2.2. Biais de sélection ... 50
5.2.3. Biais de confusion ... 51
5.4. Validité externe ... 52
5.5. Implication pour la santé publique et travaux à venir ... 53
CONCLUSION ... 54
LISTE DES TABLEAUX
Tableau 1 Symptômes courants de la COVID-19 ... 6
Tableau 2 Spectre de sévérité de la COVID-19 selon l’OMS ... 10
Tableau 3 Maladies chroniques à risque de sévérité selon les dix instances de santé
publique ... 16
Tableau 4 Liste des 21 maladies utilisées dans le rapport journalier provenant de l’indice de comorbidité et regroupées afin de respecter la catégorisation
utilisée dans le Fichier V10 ... 22
Tableau 5 Description de la population des cas confirmés de la COVID-19 entre le 23 février 2020 et le 26 juillet 2020 au Québec en comparaison avec l’ensemble de la population québécoise de 2017 ... 29
Tableau 6 Risque de décès pour les cas confirmés de la COVID-19 entre le 23 février 2020 et le 26 juillet 2020 au Québec par âge, sexe et milieu de vie ... 33
Tableau 7 Comorbidités associées au décès selon le modèle de régression de Poisson
avec estimateur robuste de la variance chez les cas confirmés de la COVID-19 entre le 23 février 2020 et le 26 juillet 2020 au Québec, par ordre
alphabétique ... 38
Tableau 8 Risque de décès pour les cas confirmés de la COVID-19 par comorbidité,
selon le milieu de vie entre le 23 février 2020 et le 26 juillet 2020 au Québec 39
Tableau 9 Risque de décès pour les cas confirmés de la COVID-19 par comorbidité,
selon l’âge entre le 23 février 2020 et le 26 juillet 2020 au Québec ... 40
Tableau 10 Risque de décès chez les cas confirmés de la COVID-19 entre le 23 février 2020 et le 26 juillet 2020 au Québec vivant à domicile ou en CHSLD par cumul des comorbidités associées au décès et par groupe d'âge ... 43
Tableau 11 Risque de décès chez les cas confirmés de la COVID-19 entre le 23 février 2020 et le 26 juillet 2020 au Québec résidant en RPA par cumul des
LISTE DES FIGURES
Figure 1 Ligne du temps des dernières épidémies à coronavirus ... 2
Figure 2 Nomenclature des coronavirus ... 4
Figure 3 Organigramme de programmation du nombre de cas confirmés de la
COVID-19 au Québec ... 19
Figure 4 Ligne du temps de l’extraction des données dans le SISMACQ et le Fichier
V10 ... 21
Figure 5 Répartition des 5 550 individus décédés selon l’âge et le sexe parmi les 53 773 cas confirmés de la COVID-19 entre le 23 février 2020 et le 26 juillet 2020 au Québec ... 31
Figure 6 Risque de décès pour les cas confirmés de la COVID-19 entre le 23 février
2020 et le 26 juillet 2020 au Québec par comorbidité sans ajustement ... 34
Figure 7 Risque de décès pour les cas confirmés de la COVID-19 entre le 23 février
2020 et le 26 juillet 2020 au Québec par comorbidité, ajustés pour l’âge
seulement ... 35
Figure 8 Risque de décès pour les cas confirmés de la COVID-19 entre le 23 février
2020 et le 26 juillet 2020 au Québec par comorbidité, ajustés pour l’âge, le sexe, les autres comorbidités et les indices de défavorisation sociale et
matérielle ... 36
Figure 9 Impact du cumul de comorbidités sur le risque relatif de décès selon l’âge chez les cas confirmés de la COVID-19 entre le 23 février 2020 et le 26
LISTE DES ABRÉVIATIONS
AHPPC Australian Health Protection Principal Committee
ASPC Agence de la santé publique du Canada
BCCDC BC Center for Disease Control
CDC Center for Disease Control
CH Centre hospitalier
CHSLD Centre d’hébergement et de soins de longue durée
CIM Classification internationale des maladies COVID-19 Maladie à coronavirus
CSG Coronaviridae Study Group
ECDC European Center for Disease Control
HCSP Haut Conseil de la santé publique
ICTV Comité international de taxonomie des virus
IgG Immunoglobuline G
IgM Immunoglobuline M
IMC Indice de masse corporelle
INSPQ Institut national de santé publique du Québec
LSPQ Laboratoire de santé publique du Québec
MADO Maladie à déclaration obligatoire
MED-ÉCHO Maintenance et exploitation des données pour l’étude de la clientèle hospitalière
MERS Syndrome respiratoire du Moyen-Orient
MSSS Ministère de la Santé et des Services sociaux
NHS National Health Service
NIPH Norwegian Institute of Public Health
OMS Organisation mondiale de la santé
PCR Réaction de polymérase en chaine
PHO Public Health Ontario
RI Ressources intermédiaires
RPA Résidence privée pour ainés
SISMACQ Système intégré de surveillance des maladies chroniques du Québec
SRAS Syndrome respiratoire aigu sévère
REMERCIEMENTS
CAROLINE SIROIS, DIRECTRICE
Caroline, je ne sais pas si tu te souviens de notre première rencontre. Je suis venue à ton bureau t’expliquer mon premier projet de maîtrise, un projet sur les pieds bots. Tu te demandais sûrement ce que je faisais devant toi, la renommée en polymédication chez les ainés. Tu étais dans un monde inverse au mien, moi qui souhaitais développer une clinique pédiatrique de pieds bots en Colombie. Ce que je peux te dire, c’est qu’avant même que tu acceptes d’être ma directrice de maîtrise, j’avais vu en toi une mentore malgré nos champs d’expertise contraire. Tu as été ma personne-ressource, au-delà de mes espérances. Tes encouragements, tes judicieux conseils, ton souci pour que je perce dans mon domaine, tes recommandations à mon égard et surtout ton côté si humain ont fait de toi une directrice d’exception. Je te remercie d’avoir été à mes côtés pendant ces 2 dernières années et d’avoir cru en moi… et en mes trois projets différents. Toutes les heures de correction que tu as mises dans mes différents projets, je t’en suis tellement reconnaissante. Ton positivisme a mis un réel baume sur mon cheminement, je n’y serais pas arrivée sans toi. J’espère avoir la chance de travailler de nouveau avec toi. Merci, ma précieuse directrice.
MARC SIMARD, BIOSTATISTICIEN À L’INSTITUT NATIONAL DE SANTÉ PUBLIQUE DU QUÉBEC Marc, mon collègue des derniers mois. Nos rencontres Teams vont me manquer! Tu as été mon premier visage au département avec le cours de biostatistiques. Déjà, au début de ma maîtrise en 2017, tu étais mon préféré! Ta bonne humeur, ta façon de vulgariser les concepts complexes et abstraits et tes petites blagues rendaient mes matins avec toi positifs, malgré la théorie plutôt ennuyante! Merci de m’avoir donné l’opportunité de travailler avec toi et avec toute l’équipe de l’INSPQ. Tes encouragements et ta reconnaissance face à mon travail ont rendu ma courte expérience à l’Institut tellement agréable. Merci d’avoir été si patient à mon égard et de m’avoir réexpliqué à de multiples reprises tes analyses. J’ai tellement appris avec toi. Je suis choyée d’avoir eu la chance de commencer et terminer mon parcours académique à tes côtés. Tu as été d’une aide précieuse. J’espère que tu vas continuer de m’appeler de temps à autre! Merci, cher acolyte!
Merci aux différents membres de l’Institut national de santé publique du Québec qui ont collaboré étroitement à ce projet, dont Sonia Jean, Élise Fortin, Claudia Blais, Isabelle Théberge, Louis Rochette, Marjolaine Dubé, Pierre-Luc Trépanier et Rodica Gilca. Merci également aux équipes de Direction régionale de santé publique qui participent, depuis le début de la pandémie, à la cueillette des données sur les cas de la COVID-19. Merci également à Marilou Kiely, Emily Manthorp et Thomas Chevrier-Laliberté pour votre appui.
CHANTAL ST-LOUIS
À ma chère maman, les mots me manquent. Merci, merci tellement. Merci d’avoir cru en moi, de m’avoir appris à me relever après chaque embuche. Sans tes bons mots, sans tes encouragements, je ne serais pas là où j’en suis présentement. Tu m’as enseigné, dès mon jeune âge, que lorsque le plan A ne fonctionne pas, on se retourne et on y va pour le plan B. Et quand on est rendu au plan Z et bien on ne se décourage pas et on double les lettres! J’ai dû appliquer ces conseils pendant mon parcours de deuxième cycle laborieux. Dans mes phases de découragements, je me rappelais ce que tu me dis toujours : t’es belle, t’es bonne, t’es capable! Aujourd’hui, j’ai le bonheur de te dire que j’ai finalement terminé ma maîtrise. Je sais que tu as toujours cru en moi, même dans mes périodes indécises. Ton oreille attentive, tes bons conseils, tes petites attentions m’ont permis de me donner le courage de passer à travers les obstacles mis sur mon chemin. Merci d’être là, j’ai la chance d’avoir la meilleure à mes côtés.
INTRODUCTION
La maladie à coronavirus (COVID-19), une maladie infectieuse causée par le nouveau coronavirus SRAS-CoV-2, a provoqué une pandémie depuis son apparition à la fin de l’année 2019. En date du 26 juillet 2020, cette maladie avait infecté près de 16 millions de personnes dans le monde et était responsable de plus de 640 000 décès (WHO, 2020j).
Dans le but de protéger les populations vulnérables, de nombreuses études ont été publiées dans les derniers mois afin d’identifier des maladies chroniques potentiellement associées à des complications liées à une augmentation de la sévérité la COVID-19. La sévérité de la COVID-19, telle qu’énoncée par l’Organisation mondiale de la santé (OMS), est définie par la présence d’un syndrome respiratoire aigu sévère chez le patient atteint de la maladie pouvant mener à l’hospitalisation ou au décès (WHO, 2020e). Les comorbidités et l’âge ont été démontrés par plusieurs auteurs comme ayant une association avec la sévérité de la maladie (Guan et al., 2020; Imam et al., 2020; Liu et al., 2020). Certaines comorbidités, dont les maladies cardiovasculaires, les maladies pulmonaires, l’insuffisance rénale chronique, les maladies auto-immunes et le diabète semblent être associées à une hausse du risque de décès chez certaines populations (Guan et al., 2020; Liang et al., 2020; Reilev et al., 2020; Zeng et al., 2020). Le nombre de comorbidités a également été identifié par certains auteurs comme étant un facteur potentiellement à risque de survenue de complications (Guan et al., 2020; Liang et al., 2020; Reilev et al., 2020).
Il existe une grande variabilité entre les pays à l’égard du portrait des patients atteints de la COVID-19. À ce jour, aucune étude n’a porté sur l’identification des facteurs de risque de la complication chez les cas de la COVID-19 au Québec, la province canadienne qui compte le plus grand nombre de cas confirmés et de décès. L’objectif principal de ce mémoire est d’identifier les sous-groupes d’individus les plus à risque de mortalité chez les cas confirmés de la COVID-19 au Québec. Ces résultats permettront d’identifier les individus les plus vulnérables aux complications liées à la COVID-19 afin d’être en mesure de mieux les protéger contre l’infection et d’établir une priorisation pour une éventuelle campagne de vaccination.
CHAPITRE 1 – ÉTAT DES CONNAISSANCES
1.1. Dernières épidémies causées par des coronavirusDans les deux dernières décennies, trois virus de la famille des coronavirus ont été responsables d’épidémies majeures causant de nombreux décès au niveau mondial (Figure 1) (Gorbalenya et al., 2020).
Figure 1 Ligne du temps des dernières épidémies à coronavirus
1.1.1. SARS-CoV
En novembre 2002, le coronavirus SRAS-CoV a infecté un premier humain dans la province de Guangdong en Chine (WHO, 2004). Le SRAS-CoV, d’origine animale, a été identifié en 2003 comme étant le virus causant le syndrome respiratoire aigu sévère (SRAS) (WHO, 2004). À lui seul, il a été responsable d’une épidémie causant plus de 8000 cas, dont plus de 800 décès, dans 30 pays différents entre 2002 et 2004 (WHO, 2020c). Bien qu’une transmission d’animal à humain ait été identifiée, la majorité de la transmission de cette maladie s’effectue d’humain à humain (WHO, 2020c). Il n’existe, à ce jour, aucune prophylaxie ni médicament pour contrer cette maladie (WHO, 2020c).
1.1.2. MERS-CoV
Le coronavirus MERS-CoV est également un virus zoonotique, c’est-à-dire un virus transmis aux humains par un animal infecté (WHO, 2020a). Cet agent pathogène, identifié en 2012 et à l’origine
*
du syndrome respiratoire du Moyen-Orient (MERS), a été transmis aux humains par le biais de dromadaires infectés. (WHO, 2020a). En date du mois de novembre 2019, 2492 cas ont été répertoriés dans 27 pays du Moyen-Orient, d'Afrique et d'Asie du Sud, incluant 858 décès (WHO, 2019). À ce jour, aucun vaccin ni médicament n’existe pour traiter cette maladie mortelle qui possède un taux de fatalité de près de 35% (WHO, 2019)
1.1.3. SRAS-CoV-2
En date du 26 juillet 2020, le nouveau coronavirus, le SRAS-CoV-2, est connu pour avoir infecté 15 785 641 personnes dans 206 pays, incluant 640 016 décès (WHO, 2020j). Le 31 décembre 2019, la Chine a alerté l’OMS des nouveaux cas de pneumonie à Wuhan de causes, à ce moment, inconnues (WHO, 2020i). Ce n’est que le 9 janvier 2020 que les autorités chinoises ont déclaré qu’il s’agissait d’une infection causée par un coronavirus (WHO, 2020i). L’infection s’est rapidement propagée à travers le monde. Les premières personnes infectées par ce virus, en provenance de Wuhan en Chine, ont été rapportées aux États-Unis le 21 janvier 2020 et en France le 24 janvier 2020 (WHO, 2020i). Avec la flambée rapide de nouveaux cas, l’OMS a déclaré, le 11 mars 2020, qu’il s’agissait d’une pandémie, soit une propagation mondiale d’une nouvelle maladie, la maladie à coronavirus-19 (WHO, 2010, 2020i). Avec une transmission importante d’humain à humain et en raison de l’absence de traitement et de vaccination pour contrer cette nouvelle maladie, les diverses autorités ont émis des directives pour diminuer sa propagation en appliquant des mesures d’hygiène et de distanciation sociale.
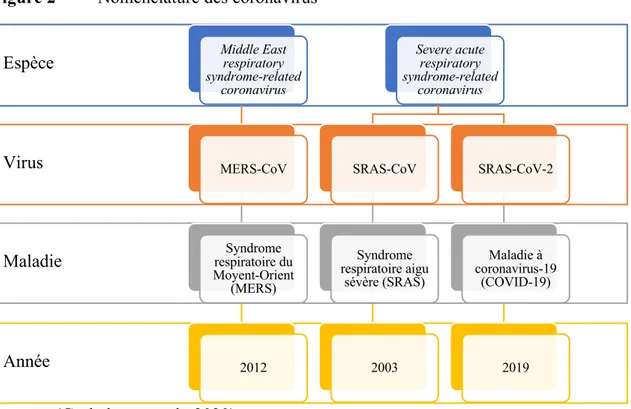
1.2. Nomenclature
Le nouveau coronavirus, précédemment nommé 2019-nCoV, a été renommé le coronavirus 2 lié au syndrome respiratoire aigu sévère (SRAS-CoV-2) par le Comité international de taxonomie des virus (ICTV) le 11 février 2020 (Gorbalenya et al., 2020). La classification élaborée par le
Coronaviridae Study Group (CSG), un groupe de travail de l'ICTV, reconnaît actuellement 39
espèces de coronavirus (Gorbalenya et al., 2020). Bien qu’appartenant à l’espèce Severe acute
respiratory syndrome-related coronavirus, le génome de ce nouveau virus diffère des deux autres
coronavirus zoonotiques responsables d’épidémies majeures dans les 20 dernières années, soit le SRAS-CoV ainsi que le MERS-CoV (figure 2) (Gorbalenya et al., 2020).
Afin d’éviter toute ambiguïté avec le SRAS, responsable d’une épidémie majeure en Asie au début du XXIe siècle, l’OMS a nommé la maladie causée par le SRAS-CoV-2 la maladie à coronavirus-19 (COVID-coronavirus-19) conformément au cadre de la Classification internationale des maladies (CIM) le 11 février 2020 (WHO, 2020b).
Figure 2 Nomenclature des coronavirus
Source : (Gorbalenya et al., 2020).
1.3. Contagiosité
Le R0, soit le nombre de reproduction de base, est utilisé comme indicateur de la propagation des
virus (Rothman, 2012). Le R0 se définit comme étant le nombre moyen de nouveaux cas émergeant
d’une personne infectée dans une population d’individus susceptibles (Rothman, 2012). Il peut théoriquement varier selon la population et les mesures de prévention (Rothman, 2012). À titre comparatif, le SRAS-CoV de 2003 avait un R0 se situant entre 1,7 et 1,9 alors que le MERS-CoV
de 2012 avait un nombre de reproduction de base inférieur à 1 (Petrosillo et al., 2020). Au début de l’épidémie, soit à la fin février 2020, l’OMS a mentionné que le R0 du SRAS-CoV-2 se situait
entre 2,0 et 2,5 (WHO, 2020d). Cette estimation, basée sur les données de Wuhan en Chine, tend Espèce Virus Maladie Année Middle East respiratory syndrome-related coronavirus MERS-CoV Syndrome respiratoire du Moyent-Orient (MERS) 2012 Severe acute respiratory syndrome-related coronavirus SRAS-CoV Syndrome respiratoire aigu sévère (SRAS) 2003 SRAS-CoV-2 Maladie à coronavirus-19 (COVID-19) 2019
à démontrer que le nombre de reproduction du SRAS-CoV-2 est supérieur aux dernières épidémies à coronavirus (Petrosillo et al., 2020; WHO, 2020d).
Il est cependant important de prendre en considération que ce nombre peut fluctuer entre les pays et entre certains sous-groupes en raison des contacts potentiels qui sont variables entre les diverses populations (Rothman, 2012). Le R0 va se moduler en fonction des comportements adoptés et de
l’immunité de la population (Rothman, 2012). Ainsi, en pratiquant la distanciation sociale et par le biais de l’immunité acquise par la vaccination et par le rétablissement de la maladie, ce nombre va tendre à diminuer.
1.3.1. Modes de transmission 1.3.1.1. Contact et gouttelettes
Il existe plusieurs modes de transmission du SRAS-CoV-2. Le principal mode de transmission se fait par contact et par gouttelettes (WHO, 2020h). L’hôte infecté peut projeter des gouttelettes respiratoires, ayant un diamètre entre 5 et 10 μm, en toussant, en éternuant, en parlant ou en chantant (WHO, 2020h). Ces gouttelettes contaminées par le virus sont susceptibles d’être transmises à une tierce personne si celle-ci se trouve en contact étroit avec l’hôte infecté, soit à moins d’un mètre, et qu’elles atteignent sa bouche, son nez ou ses yeux (WHO, 2020h).
Un rapport de l’OMS publié en février 2020 démontre que 78 à 85% des infections du SRAS-CoV-2 se sont produites à l’intérieur de la cellule familiale chez la population chinoise, laissant présager qu’un contact étroit et prolongé avec une personne infectée est favorable à la propagation du virus (WHO, 2020d).
1.3.1.2. Contact indirect
Le SRAS-CoV-2 peut également se propager par contacts indirects, tels que par le biais de surfaces infectieuses, lorsqu’un hôte infecté expulse des gouttelettes respiratoires contaminées (WHO, 2020h). Le virus pouvant survivre quelques heures à quelques jours sur différentes surfaces, il est possible de retrouver des sécrétions respiratoires et des gouttelettes respiratoires contaminées par le virus sur des objets et des surfaces de l’environnement (WHO, 2020h). Le SRAS-CoV-2 peut
ainsi se transmettre par contact indirect si une personne touche une surface infectée et porte ses mains à sa bouche, à son nez ou à ses yeux (WHO, 2020h).
1.3.1.3. Échantillons biologiques
Une récente étude a démontré la présence du virus dans les échantillons biologiques des patients infectés, tels que dans l’urine, les matières fécales et le sérum sanguin (Zheng et al., 2020). L’OMS souligne toutefois qu’aucun rapport n’a été publié à ce jour concernant la transmission possible du virus par le biais d’échantillons biologiques (WHO, 2020h). Davantage d’études sont nécessaires pour conclure sur la transmissibilité du virus par les matières biologiques.
1.4. Symptômes courants de la COVID-19
L’infection de la maladie à coronavirus-19 se traduit par de nombreux symptômes. En effet, il semble difficile de reconnaître cette maladie en raison des symptômes non spécifiques qui y sont reliés. Les principaux symptômes associés à la COVID-19 selon le Ministère de la Santé et des Services sociaux (MSSS) sont résumés dans le tableau 1.
Tableau 1 Symptômes courants de la COVID-19
Symptômes généraux Symptômes respiratoires Symptômes
gastro-intestinaux
Fièvre Toux (nouvelle ou
aggravation)
Nausée Anosmie (perte soudaine de
l’odorat) avec ou sans agueusie (perte de goût)
Dyspnée (essoufflement) Vomissement
Grande fatigue Maux de gorge Diarrhée
Perte d’appétit importante Écoulement nasal Maux de ventre
Courbatures Congestion nasale
1.5. Examens diagnostiques
Dans le but de diagnostiquer la COVID-19 chez les personnes symptomatiques et asymptomatiques, différents tests et examens sont possibles. C’est le cas notamment du test d’amplification des acides nucléiques et du test sérologique.
1.5.1. TAAN
Le test d’amplification des acides nucléiques (TAAN) est l’outil diagnostique principal pour confirmer une infection au SRAS-CoV-2 (LSPQ, 2020). Ce test sert principalement à détecter les infections virales des voies respiratoires par le biais d’une réaction de polymérase en chaine, appelée PCR (polymerase chain reaction) (INESSS, 2019). Le TAAN permet de dupliquer la séquence désirée de l’ARN du virus à partir des acides nucléiques qui ont été prélevés chez le patient (INESSS, 2019). Le TAAN est reconnu pour avoir une sensibilité et une spécificité élevées avec un délai de réponse de 24h ou moins (INESSS, 2019). À l’aide de cet outil diagnostique, il est possible de détecter la présence d’un virus influenza, d’un virus respiratoire syncytial, d’un adénovirus, d’un métapneumovirus, d’un coronavirus, d’un virus parainfluenza humain, d’un rhinovirus, d’un entérovirus et d’un bocavirus en début et en fin d’infection de même que pendant une infection latente (INESSS, 2019). Cependant, ce test ne permet pas de connaître le stade d’infection du patient (INESSS, 2019).
Utilisé comme outil de diagnostic chez les personnes symptomatiques et comme outil de dépistage chez les personnes asymptomatiques, le TAAN est le principal examen médical utilisé pour détecter la présence du SRAS-CoV-2 (MSSS, 2020c). Un spécimen naso-pharyngé sur un écouvillon velouteux ou un spécimen oropharyngé combiné à un spécimen nasal antérieur sur le même écouvillon doit être prélevé chez le patient, de préférence dans les sept jours suivant le début des symptômes (LSPQ, 2020). Selon certains auteurs, il serait possible de détecter la présence de l’ARN viral du SRAS-CoV-2 à l’aide d’un prélèvement naso-pharyngé analysé par le biais du TAAN dès le premier jour des symptômes (Sethuraman et al., 2020). La sensibilité de ce test peut varier selon le moment de prélèvement de la phase de la maladie de même que selon le type de test effectué (Arevalo-Rodriguez et al., 2020). Une méta-analyse récente a démontré qu’il existe un
taux de faux négatif variant entre 2 et 29%, ce qui correspond à une sensibilité du test de 71 à 98% (Arevalo-Rodriguez et al., 2020).
1.5.2. Test sérologique
Un test PCR peut être utilisé pendant la phase d’infection de la maladie lorsque la charge virale est élevée (INESSS, 2020b). Cependant, dans les semaines suivant le début de l’infection, soit à partir de la 2e ou 3e semaine suite au début des symptômes, un test sérologique serait davantage approprié
(Sethuraman et al., 2020). Ce test permettrait de détecter la présence d’immunoglobulines G (IgG) et d’immunoglobulines M (IgM) contre le SRAS-CoV-2 dans la phase de développement de l’immunité (Sethuraman et al., 2020). Par ailleurs, bien que la radiographie soit une modalité d’imagerie utilisée pour évaluer une pneumonie à COVID-19, ce type d’examen ne permet pas d’exclure la présence de la maladie en raison de sa faible sensibilité, soit de 69% (Wong et al., 2020).
1.6. Définition de cas
En avril 2020, une définition de cas a été établie par le MSSS afin d’assurer la surveillance de la COVID-19 au Québec. Il existe actuellement deux définitions de cas confirmés de la maladie à coronavirus (MSSS, 2020a).
1.6.1. Cas confirmé par laboratoire
Par définition, un cas confirmé par laboratoire consiste en la détection d’acides nucléiques du SRAS-CoV-2 lors du TAAN chez un patient symptomatique ou asymptomatique (MSSS, 2020c). En cas de décès, des manifestations cliniques compatibles avec la COVID-19 doivent avoir été observées avant le décès chez le patient et un TAAN doit avoir détecté la présence d’acides nucléiques du SRAS-CoV-2 (MSSS, 2020c).
1.6.2. Cas confirmé par lien épidémiologique
Une personne ayant des manifestations cliniques compatibles avec la COVID-19 (présence de fièvre de plus de 38°C; ou présence d’une toux récente ou chronique exacerbée; ou une difficulté
respiratoire; ou une anosmie brutale sans obstruction nasale, accompagnée ou non d’agueusie; ou des signes radiologiques d’infiltrats correspondants à une pneumonie; ou un syndrome de détresse respiratoire; ou un examen pathologique compatible) et ayant une exposition jugée à risque élevée (personne vivant sous le même toit qu’un cas confirmé ou partenaire intime avec un cas confirmé ou personne prodiguant des soins corporels dans un cadre non médical à un cas confirmé ou personne ayant eu un contact direct avec des liquides biologiques infectieux) avec un cas confirmé par laboratoire pendant la période de contagion et sans autre cause apparente est considéré comme un cas confirmé par lien épidémiologique (INSPQ, 2020; MSSS, 2020c).
1.7. Maladie à déclaration obligatoire
Selon la Loi sur la santé publique adoptée en décembre 2001, certaines maladies sont considérées comme étant des maladies à déclaration obligatoire (MADO) (Loi sur la santé publique, 2001). Il existe une variété d’intoxications, d’infections et de maladies qui doivent obligatoirement être déclarées aux autorités de santé publique (MSSS, 2019). Au Québec, la COVID-19 fait partie des MADO (MSSS, 2020c). À des fins de vigie sanitaire, un cas confirmé de la COVID-19 par laboratoire ou par lien épidémiologique doit être signalé à la santé publique par le biais du fichier V10 contenant l’ensemble des cas confirmés au Québec.
1.8. Sévérité de la COVID
La COVID-19 est connue pour avoir un spectre de sévérité allant du stade asymptomatique au stade critique (voir Tableau 2).
Tableau 2 Spectre de sévérité de la COVID-19 selon l’OMS
Spectre de sévérité Signes et symptômes
Asymptomatique Cas confirmé de la COVID-19 sans symptômes apparents
Léger Cas confirmé de la COVID-19 symptomatique (voir tableau 1)
sans signe d’évidence de pneumonie ni d’hypoxie
Modéré
Cas confirmé de la COVID-19 avec signe clinique de pneumonie (fièvre, toux, dyspnée, tachypnée) sans signe de pneumonie sévère (SpO2 ≥ 90)
Sévère
Cas confirmé de la COVID-19 avec signe clinique de
pneumonie (fièvre, toux, dyspnée, tachypnée) et au moins un signe de pneumonie sévère (tachypnée, détresse respiratoire sévère ou SpO2 < 90%)
Critique Cas confirmé de la COVID-19 avec une détresse respiratoire, choc septique ou dysfonction multiple des organes
(WHO, 2020g)
1.8.1. Portrait des patients à risque de complications de la COVID
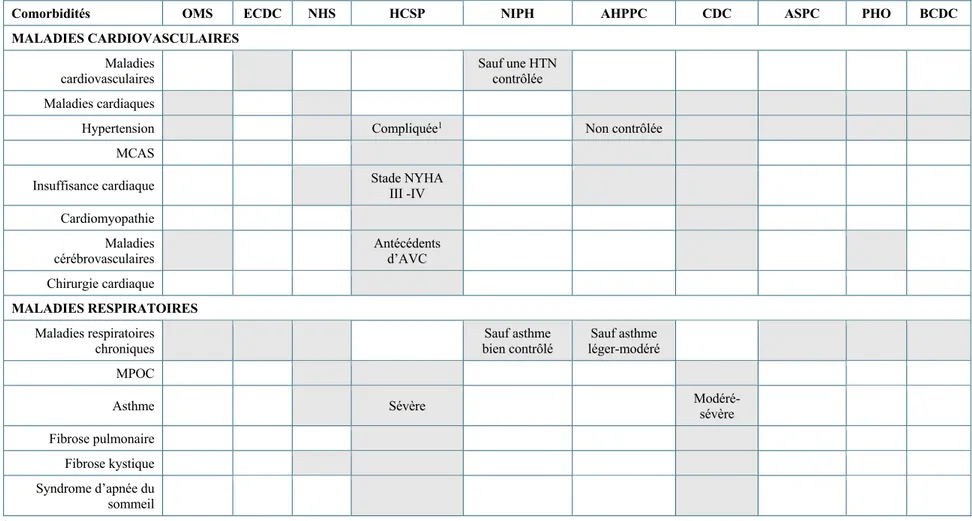
Le portrait des patients à risque de complications sévère de la COVID, incluant le décès, varie, mondialement, selon les différentes instances de santé publique. Une revue de la littérature a été effectuée en collaboration avec l’équipe de l’Institut national de santé publique du Québec (INSPQ) pour laquelle un avis concernant les recommandations intérimaires pour la protection des travailleurs avec maladies chroniques sera publié prochainement (Manthorp et al., À paraître). Les principaux constats de cette revue littéraire sont présentés dans les prochaines sections.
Le tableau 3 résume les constats de dix sociétés savantes, soit l’OMS, l’European Center for
Disease Control (ECDC), le National Health Service (NHS), le Haut Conseil de la santé publique
(HCSP), le Norwegian Institute of Public Health (NIPH), l’Australian Health Protection Principal
Committee (AHPPC), le Center for Disease Control (CDC), l’Agence de la santé publique du Canda (ASPC), le Public Health Ontario (PHO) et le BC Center for Disease Control (BCCDC). De nombreuses recommandations générales ont été émises dans les derniers mois dans le but de protéger les plus vulnérables. Toutefois, celles-ci sont générales et peu de critères sont disponibles pour identifier les personnes les plus à risque de complications.
1.8.1.1. Maladies cardiovasculaires
Dans la littérature, une association constante est présente entre les maladies cardiovasculaires et la sévérité de la COVID-19, incluant l’hospitalisation et le décès (Aggarwal et al., 2020; Chen et al., 2020; Inciardi et al., 2020; Javanian et al., 2020; Reilev et al., 2020; Shi et al., 2020; Tian et al., 2020; Wang et al., 2020; Williamson et al., 2020; Zhang et al., 2020; Zheng et al., 2020). Cependant, bien qu’il semble y avoir une association entre le risque de sévérité de la COVID-19 et les maladies cardiovasculaires, certains facteurs de confusion, dont l’âge et les autres comorbidités, n’ont pas été ajustés dans la majorité de ces études (Aggarwal et al., 2020; Chen et al., 2020; Inciardi et al., 2020; Javanian et al., 2020; Tian et al., 2020; Zhang et al., 2020; Zheng et al., 2020). Il est également à noter que plusieurs de ces études ont été réalisées en Chine auprès de patients hospitalisés (Chen et al., 2020; Wang et al., 2020; Zhang et al., 2020). Lorsque les variables potentiellement confondantes sont considérées dans les études, il est possible de constater que l’effet des maladies chroniques est moindre, voire non statistiquement significatif (Reilev et al., 2020; Williamson et al., 2020). Par ailleurs, selon les institutions sanitaires consultées, les personnes atteintes de maladies cardiovasculaires semblent davantage à risque de souffrir d’une forme de sévérité de la COVID-19 (Agence de la santé publique du Canada, 2020; BCCDC, 2020; CDC, 2020a; ECDC, 2020; HCSP, 2020; NHS, 2020; NIPH, 2020; PHO, 2020; WHO, 2020g). 1.8.1.2. Maladies respiratoires
En général, dans la littérature, les maladies respiratoires, telles que la maladie pulmonaire obstructive chronique (MPOC), sont associées à une augmentation du risque de sévérité de la COVID-19, dont l’hospitalisation et la mortalité (Alqahtani et al., 2020; Guan et al., 2020; Javanian et al., 2020; Reilev et al., 2020; Tian et al., 2020; Wang et al., 2020; Zheng et al., 2020). Avec des ajustements pour des variables confondantes, dont l’âge, l’effet semble persister (Guan et al., 2020; Reilev et al., 2020; Wang et al., 2020). Bien qu’il y ait une association pour certaines maladies respiratoires, l’asthme ne semble pas faire partie de cette constante (Williamson et al., 2020). Cependant, il est difficile de tirer des conclusions puisque peu d’études ont été réalisées en séparant les maladies respiratoires. Selon les institutions sanitaires consultées, les personnes atteintes de maladies respiratoires, sans égard au diagnostic ni au niveau de sévérité de la maladie, semblent davantage à risque de souffrir d’une forme de sévérité de la COVID-19 (Agence de la santé
publique du Canada, 2020; BCCDC, 2020; CDC, 2020a; ECDC, 2020; HCSP, 2020; NHS, 2020; NIPH, 2020; PHO, 2020; WHO, 2020g). Certaines institutions précisent toutefois que seul l’asthme sous sa forme sévère ou non-contrôlée chez une population plus âgée serait un facteur de vulnérabilité (HCSP, 2020; NHS, 2020; NIPH, 2020).
1.8.1.3. Maladies rénales
Des études réalisées dans quatre pays différents portant sur l’association entre les maladies rénales chroniques, dont l’insuffisance rénale chronique (IRC), et la mortalité liée à la COVID-19, ont démontré un lien significatif (Javanian et al., 2020; Reilev et al., 2020; Tian et al., 2020; Williamson et al., 2020). Il est à noter que certaines de ces associations proviennent d’analyses multivariées (Reilev et al., 2020; Williamson et al., 2020). Certains auteurs ont relevé des rapports de cotes supérieurs à 2, démontrant un lien considérable entre les maladies rénales chroniques et la forme sévère de la COVID-19 (Javanian et al., 2020; Reilev et al., 2020; Tian et al., 2020). Certaines institutions sanitaires consultées, dont le CDC, le HCSP et le PHO, considèrent les maladies rénales chroniques comme un facteur de risque élevé de sévérité de la COVID-19 (CDC, 2020b; HCSP, 2020; PHO, 2020). Ce risque semble particulièrement plus élevé chez les individus sous hémodialyse ou chez les personnes plus âgées avec une insuffisance rénale significative (HCSP, 2020; NIPH, 2020).
1.8.1.4. Maladies hépatiques
Il existe peu d’études qui évaluent l’association entre les maladies hépatiques chroniques et la forme sévère de la COVID-19, menant à l’hospitalisation ou au décès. Deux études avec des devis robustes et une taille d’échantillon importante ont révélé un risque significatif de complications chez les patients ayant une maladie hépatique chronique (Reilev et al., 2020; Williamson et al., 2020). Des analyses multivariées avec un ajustement pour des variables confondantes, telles que l’âge et le sexe, ont permis de tirer ces conclusions (Reilev et al., 2020; Williamson et al., 2020). Parmi les institutions sanitaires consultées, la majorité s’entendent sur le fait que les patients atteints de maladies hépatiques chroniques semblent davantage à risque de développer des complications en lien avec la COVID-19, bien que les données probantes soient limitées (CDC, 2020b; HCSP, 2020; PHO, 2020).
1.8.1.5. Diabète
Dans l’ensemble, le fait d’avoir le diabète est associé à une augmentation du risque de sévérité, d’hospitalisation, d’admission aux soins intensifs et de mortalité en lien avec la COVID-19 (Guan et al., 2020; Reilev et al., 2020; Tian et al., 2020; Williamson et al., 2020; Zheng et al., 2020; Zhu et al., 2020). Le risque semble persister après l’ajustement pour certaines variables de confusion, dont l’âge et le sexe, bien que seulement quatre études aient effectué cet ajustement (Guan et al., 2020; Reilev et al., 2020; Williamson et al., 2020; Zhu et al., 2020). Deux études, portant respectivement sur une population chinoise (Zhu et al., 2020) et une population anglaise (Williamson et al., 2020), ont considéré le niveau de contrôle du diabète en distinguant le diabète contrôlé du diabète non contrôlé. En somme, les personnes avec diabète dont la glycémie n’est pas contrôlée semblent avoir un risque de mortalité supérieur comparativement aux diabétiques ayant une glycémie bien contrôlée. (Williamson et al., 2020; Zhu et al., 2020)
Le CDC inclut le diabète de type 2 comme condition médicale sous-jacente augmentant le risque de maladie sévère liée à la COVID-19 sur la base de preuves scientifiques solides et cohérentes, tandis que la preuve scientifique est limitée pour le diabète de type 1 (CDC, 2020b).
L’ensemble des institutions sanitaires consultées considèrent le diabète comme facteur de risque de sévérité de la COVID-19 (Agence de la santé publique du Canada, 2020; BCCDC, 2020; CDC, 2020a; ECDC, 2020; HCSP, 2020; NHS, 2020; NIPH, 2020; PHO, 2020; WHO, 2020g). Le NHS considère le diabète comme étant à risque modéré, tandis que l’OMS, l’ASPC, le PHO, le BCCDC identifient le diabète comme étant à risque élevé de complications de la COVID-19 (Agence de la santé publique du Canada, 2020; BCCDC, 2020; NHS, 2020; PHO, 2020; WHO, 2020g). Pour le NIPH, le risque serait élevé pour les personnes atteintes de diabète âgées de 66-80 ans, tandis que le risque serait légèrement élevé chez les 50-65 ans (NIPH, 2020). Finalement, seul le HCSP considère le diabète non contrôlé ou avec complications comme étant associé à un risque élevé de sévérité de la COVID-19 (HCSP, 2020).
1.8.1.6. Obésité
Dans l’ensemble, l’obésité est associée à une augmentation du risque de sévérité, d’hospitalisation et de mortalité en lien avec la COVID-19 (Reilev et al., 2020; Seidu et al., 2020; Williamson et al.,
2020). L’effet semble plus prononcé pour les niveaux d’obésité plus importants ainsi que pour les personnes plus âgées (Seidu et al., 2020; Williamson et al., 2020). De plus, le risque semble persister, même si atténué, après l’ajustement pour certaines variables de confusion, dont l’âge et le sexe (Reilev et al., 2020; Williamson et al., 2020).
La définition de l’obésité varie d’une étude à une autre allant d’un indice de masse corporelle (IMC) > 25 à un IMC > 35 (Seidu et al., 2020; Williamson et al., 2020) alors qu’une étude ne spécifie pas le diagnostic précis de l’obésité (Reilev et al., 2020).
Le CDC inclut l’obésité, soit un IMC > à 30, comme condition médicale sous-jacente augmentant le risque de maladie sévère liée à la COVID-19 sur la base de preuves scientifiques solides et cohérentes (CDC, 2020b). Selon l’ECDC et le HCSP, l’obésité constitue un facteur de risque élevé de complications de la COVID-19 (ECDC, 2020; HCSP, 2020). Le NIPH classe l’obésité (IMC ≥ 35 avec maladies métaboliques ou IMC ≥ 40) comme facteur de risque léger chez les 50-55 ans, tandis qu’il serait modéré à élevé chez les personnes âgées de 66-80 ans (NIPH, 2020). Le NHS considère l’obésité comme étant à risque modéré, alors que l’ASPC, le PHO et le BCCDC n’ont pas identifié l’obésité comme condition à risque de complications de la COVID-19 (Agence de la santé publique du Canada, 2020; BCCDC, 2020; NHS, 2020; PHO, 2020).
1.8.1.7. Multimorbidité
Les études portant sur l’association entre le cumul de maladies chroniques et le risque de complications liées à la COVID-19 ont été réalisées sur la population chinoise (Guan et al., 2020; Liang et al., 2020) et sur la population danoise (Reilev et al., 2020). Globalement, il semble y avoir une relation dose-réponse constante entre le nombre de comorbidités et la sévérité lié à la COVID-19 (Guan et al., 2020; Liang et al., 2020; Reilev et al., 2020). En ajustant pour des variables confondantes, dont l’âge, cet effet semble persister (Reilev et al., 2020).
Le NIPH est le seul à définir les individus vulnérables à souffrir d’une forme sévère de la COVID-19 en fonction du nombre de comorbidités (NIPH, 2020). Les personnes âgées entre 50 à 65 ans ayant une maladie chronique seraient considérées à risque modéré alors que les individus du même
âge cumulant deux maladies chroniques ou plus seraient considérés à risque modéré à élevé (NIPH, 2020).
1.9. Décès imputable à la COVID
À des fins de surveillance de la pandémie, l’OMS a défini un décès imputable à la COVID-19 comme étant : « le décès résultant d’une maladie cliniquement compatible d’une personne présentant une infection probable ou confirmée par le virus de la COVID-19, à moins qu’une autre cause de décès qui ne peut pas être liée à la COVID-19 (par exemple, un traumatisme) n’ait été clairement établie. Il ne devrait pas y avoir de période de rétablissement complet entre la maladie et le décès. » (WHO, 2020, p.3). Cette définition est utilisée à l’échelle internationale dans le but de recenser le nombre de décès dans le monde afin d’être en mesure de suivre la pandémie (WHO, 2020f).
1.10. Généralisation à la population québécoise
Un consensus à l’égard des groupes vulnérables est difficile puisqu’il existe une grande variabilité dans les données des différentes sources consultées. De plus, la validité externe de ces études est limitée, car elles sont majoritairement effectuées sur des populations chinoises plus jeunes avec une taille d’échantillonnage réduite. Peu d’études ont effectué des analyses multivariées en ajustant pour certaines variables potentiellement confondantes telles que l’âge, le sexe, les comorbidités ainsi que l’indice de défavorisation sociale et matérielle. À notre connaissance, il n’existe aucune étude qui a analysé l’association du milieu de vie sur la vulnérabilité des cas positifs de la COVID-19. Il est donc difficile de généraliser ces données à l’ensemble de la population québécoise et d’identifier les sous-groupes vulnérables aux complications de la COVID-19. Cette recherche identifiera les sous-groupes les plus à risque de mortalité chez les cas confirmés de la COVID-19 au Québec.
Tableau 3 Maladies chroniques à risque de complications de la COVID-19 selon dix instances de santé publique
Les cases colorées en gris correspondent aux maladies que chaque institut sanitaire identifie comme constituant un facteur de risque. Lorsque des précisions sont données sur le niveau de sévérité de la maladie chronique, les critères sont énoncés à l’intérieur des cases (Manthorp et al., À paraître).
Comorbidités OMS ECDC NHS HCSP NIPH AHPPC CDC ASPC PHO BCDC
MALADIES CARDIOVASCULAIRES Maladies cardiovasculaires Sauf une HTN contrôlée Maladies cardiaques
Hypertension Compliquée1 Non contrôlée
MCAS
Insuffisance cardiaque Stade NYHA III -IV Cardiomyopathie Maladies cérébrovasculaires Antécédents d’AVC Chirurgie cardiaque MALADIES RESPIRATOIRES Maladies respiratoires chroniques Sauf asthme bien contrôlé Sauf asthme léger-modéré MPOC
Asthme Sévère Modéré-sévère
Fibrose pulmonaire Fibrose kystique Syndrome d’apnée du
sommeil
1 Avec complications cardiaques, rénales, vasculo-cérébrales
Comorbidités OMS ECDC NHS HCSP NIPH AHPPC CDC ASPC PHO BCDC AUTRES MALADIES
Maladie rénale chronique Sous dialyse Maladie hépatique
chronique
Stade B ou C (Child Pugh)
Diabète Non contrôlé ou
avec complications Obésité IMC ≥ 40 IMC > 30 IMC ≥ 30 avec maladies métaboliques ou IMC ≥ 40
IMC ≥ 40 IMC ≥ 30 IMC ≥ 40 Anémie falciforme
Thalassémie Maladie neurologique
chronique Note2 Avec diminution des capacités pulmonaires AVC, démence, autres selon MD Démence Démence ÂGE 50 ans et plus Risque légèrement élevé Autochtones avec maladies
chroniques Aucun âge spécifique, risque progressif avec l’âge Personnes âgées Personn es âgées 60 ans et plus 65 ans et plus Risque modéré à élevé Avec maladies chroniques 70 ans et plus
2 Incluant la maladie de Parkinson, la sclérose en plaques, un trouble de l’apprentissage, la paralysie cérébrale, une autre maladie neuromotrice.
Légende : HTN : hypertension, , IMC : indice de masse corporelle, MCAS : maladie coronarienne athérosclérosante, MD : médecin, MPOC : maladie pulmonaire obstructive,
NYHA : New York Heart Association, MPOC : maladie pulmonaire obstructive
CHAPITRE 2 – OBJECTIFS
Le MSSS a mandaté, au printemps 2020, un groupe de travail de l’INSPQ pour identifier les sous-groupes de la population vulnérables aux complications sévères liées à la COVID-19, incluant l’hospitalisation, l’admission aux soins intensifs et le décès.
2. Objectif principal
L’objectif principal de ce mémoire est d’identifier les sous-groupes d’individus les plus à risque de mortalité chez les cas confirmés de la COVID-19 au Québec.
L’objectif principal est structuré autour des objectifs spécifiques suivants :
1) Identifier les comorbidités associées à une augmentation du risque de mortalité chez les cas confirmés de la COVID-19 au Québec.
2) Quantifier l’impact du cumul de comorbidités sur le risque de mortalité chez les cas confirmés de la COVID-19 au Québec.
Pour les besoins du MSSS, les résultats concernant la mortalité en lien avec la COVID-19 seront par la suite joints aux résultats des autres mesures de sévérité, soit l’hospitalisation ou l’admission aux soins intensifs attribuables à la COVID-19, qui ne font pas l’objet de ce mémoire.
CHAPITRE 3 – MÉTHODOLOGIE
3.1. Devis et population à l’étudeUne étude de cohorte populationnelle rétrospective de l’ensemble des cas confirmés de la COVID-19 au Québec entre le début de la pandémie, soit le 23 février 2020, et le 26 juillet 2020 a été réalisée. La population à l’étude inclut la totalité des cas confirmés de la COVID-19 inscrits dans le fichier V10 en date du 26 juillet 2020. Puisque ce projet n’a utilisé que des données secondaires dénominalisées de manière définitive et irréversible, une exemption d’approbation au comité d’éthique a été accordée.
En date du 26 juillet 2020, 58 733 cas confirmés étaient inscrits dans le Fichier V10. Pour l’ensemble de cas confirmés, il a été possible de jumeler 53 773 données du SISMACQ avec le Fichier V10, soit près de 92% des cas (Figure 3). Deux raisons principales expliquent le fait qu’il était impossible de jumeler les cas du fichier V10 avec les données administratives du SISMACQ, soit; 1- le fait qu’aucun numéro d’assurance maladie (NAM) n’était codé pour l’individu empêchant donc la fusion avec les données du SISMACQ ou, 2- l’individu est arrivé au Québec après le 31 mars 2019, date à laquelle le SISMACQ a été mis à jour.
Figure 3 Organigramme de programmation du nombre de cas confirmés de la COVID-19
au Québec
Nombre total de cas confirmé au 26 juillet 2020
dans le V10 n = 58 733
Information sur les maladies chroniques (SISMACQ)
n = 53 773 Issue : décès
3.2. Sources de données
Dans le cadre de ce mémoire, deux principales sources de données ont été utilisées provenant essentiellement de bases de données médicoadministratives de même que du Fichier V10 utilisé par les différentes directions de santé publique régionales dans le but d’assurer la vigie des cas confirmés au Québec. Ces bases de données couvrent l’ensemble de la population québécoise de même que l’ensemble des cas confirmés au Québec.
3.2.1. Fichier V10
Au Québec, le fichier V10 est utilisé pour la saisie des cas confirmés par laboratoire ou par lien épidémiologique de la COVID-19 (MSSS, 2020b). Afin d’assurer un suivi épidémiologique de l’ensemble de cas confirmés, plusieurs variables doivent être saisies dans le V10 conformément aux exigences du MSSS. Les données démographiques, le milieu de vie permettant de spécifier le type de résidence, l’occupation identifiant le milieu de travail, la date du début des symptômes en plus des différents symptômes compatibles avec la COVID-19, le type de contact avec un cas connu ou inconnu, l’historique de voyages hors pays, hors province ou hors région, le milieu d’acquisition suspecté, les conditions et maladies préexistantes, l’évolution clinique comprenant les différentes manifestations cliniques ainsi que la gravité allant de l’isolement à domicile à l’admission aux soins intensifs de même que les informations en cas de décès sont répertoriés à l’intérieur de ce fichier (MSSS, 2020b).
3.2.2. SISMACQ
Les données du V10 ont été jumelées avec le Système intégré des maladies chroniques du Québec (SISMACQ). Mis à jour annuellement, ce système résulte d’un jumelage de cinq fichiers médicoadministratifs permettant de produire les données essentielles à la surveillance des maladies chroniques chez la population québécoise (Blais et al., 2014). Ces fichiers sont les suivants :
1. Fichier d’inscription des personnes assurées (FIPA)
2. Fichier des hospitalisations Maintenance et exploitation des données pour l’étude de la clientèle hospitalière (MED-ÉCHO)
4. Fichier des services médicaux rémunérés à l’acte
5. Fichier des services pharmaceutiques (personnes assurées par le régime public d’assurance médicaments)
Par ailleurs, le SISMACQ inclut également l’indice de défavorisation matérielle et sociale de l’INSPQ qui a été créé à partir de six indicateurs, soit le niveau d’étude, le rapport d’emploi, le revenu, la proportion des personnes veuves, séparées ou divorcées, la proportion des personnes vivant seules ainsi que la proportion des familles monoparentales (Blais et al., 2014).
3.3. Mesure des comorbidités
Les comorbidités ont été mesurées à partir des diagnostics posés par les médecins et inscrits dans le fichier des actes médicaux de la RAMQ et le fichier des hospitalisations MED-ÉCHO. Chaque maladie a été identifiée avec la même définition de cas que celle utilisée dans le cadre du rapport décrivant le portrait de la multimorbidité au Québec en 2016-17 (Simard et al., 2019). Cette définition considère qu’un individu est atteint de la maladie si la personne a reçu un diagnostic de la maladie lors de deux visites médicales en moins d’un an espacé d’au moins 30 jours, ou encore un diagnostic de la maladie lors d’une hospitalisation (Simard et al., 2019).
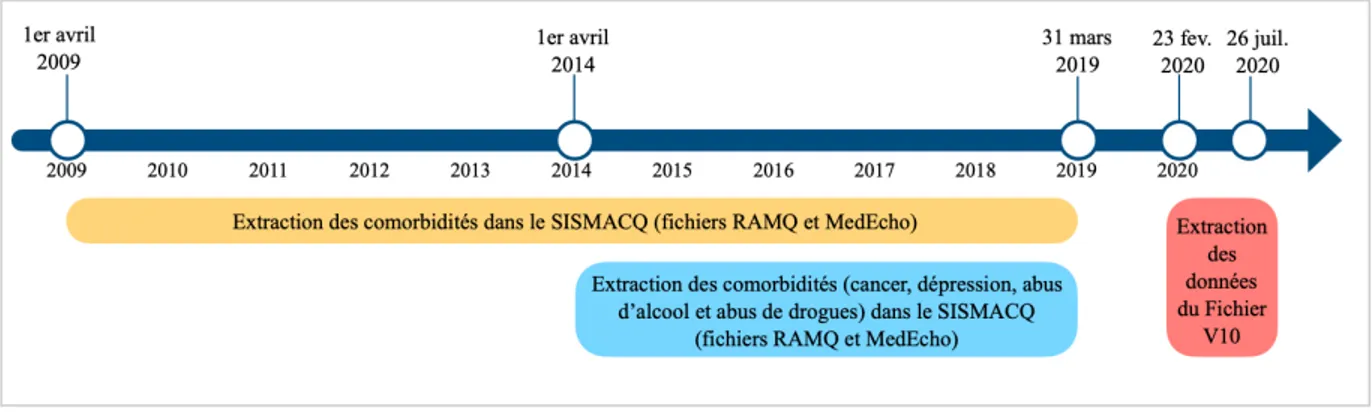
Une fenêtre rétrospective de 10 ans (1er avril 2009 au 31 mars 2019) a été utilisée pour identifier les
maladies au SISMACQ à l’exception du cancer de même que la dépression, l’abus de drogues et l’abus l’alcool pour lesquels une fenêtre rétrospective de 5 ans a été utilisée (voir figure 4). En effet, la littérature démontre qu’un laps de temps plus court est préférable lors de l’utilisation des données administratives pour le cancer et certains troubles mentaux légers (Lesage & Émond, 2012; Tonelli et al., 2015).
La liste des 21 maladies rapportées dans le rapport quotidien de vigie de la COVID-19, comprenant les codes diagnostiques respectifs, a été retenue (voir tableau 4). Cette liste regroupe les 31 comorbidités de l’indice de comorbidité (Simard et al., 2019). Les maladies pulmonaires chroniques de même que les maladies de la circulation pulmonaire sont regroupées sous les maladies respiratoires. L’infarctus du myocarde, l’arythmie cardiaque, l’insuffisance cardiaque congestive, la valvulopathie, les maladies cérébrovasculaires de même que les troubles vasculaires périphériques sont regroupés sous les maladies cardiovasculaires. Le diabète avec et sans complications font partie du regroupement diabète. La tumeur sans métastases ainsi que le cancer métastatique font partie du regroupement cancer. Finalement, l’arthrite rhumatoïde ou collagénose avec manifestation vasculaire de même que le VIH/SIDA sont intégrés dans le regroupement de problèmes du système immunitaire.
Les diagnostics sont codés à partir de l’adaptation québécoise de la 9e version de la classification
internationale des maladies (CIM-9-QC) pour les fichiers des services médicaux et de la version canadienne de la 10e version de la classification internationale des maladies (CIM-10-CA) pour les
fichiers MED-ÉCHO.
Tableau 4 Liste des 21 maladies utilisées dans le rapport journalier provenant de l’indice de comorbidité et regroupées afin de respecter la catégorisation utilisée dans le Fichier V10
Conditions de l’indice de comorbidité Regroupement des comorbidités 1 Hypertension artérielle 1 Hypertension artérielle
2 Maladies pulmonaires chroniques
2 Maladies respiratoires 3 Maladie de la circulation pulmonaire
4 Infarctus du myocarde
3 Maladies cardiovasculaires 5 Arythmie cardiaque
6 Insuffisance cardiaque congestive 7 Valvulopathie
8 Maladies cérébrovasculaires 9 Troubles vasculaires périphériques 10 Diabète, sans complication
4 Diabète 11 Diabète, avec complication
12 Tumeur sans métastase
5 Cancer 13 Cancer métastatique
14 Démence
6 Troubles neurologiques 15 Troubles neurologiques
16 Maladie du rein 7 Maladie du rein 17 Maladie hépatique 8 Maladie hépatique 18 Arthrite rhumatoïde/collagénose avec
manifestation vasculaire 9 Problèmes du système immunitaire 19 VIH/SIDA
20 Obésité 10 Obésité
21 Troubles des fluides et électrolytes 11 Troubles des fluides et électrolytes 22 Hypothyroïdie 12 Hypothyroïdie
23 Psychose 13 Psychose
24 Dépression 14 Dépression
25 Abus d’alcool 15 Abus d’alcool 26 Abus de drogue 16 Abus de drogue 27 Perte de poids 17 Perte de poids
28 Paralysie 18 Paralysie
29 Coagulopathie 19 Coagulopathie
Conditions de l’indice de comorbidité Regroupement des comorbidités
31 Ulcère 21 Ulcère
3.4. Variables de stratifications
Les covariables disponibles sont l’âge, le sexe, les indices de défavorisation matérielle et sociale, le milieu de vie et le statut de travailleur. L’âge, le sexe et les indices de défavorisation proviennent du SISMACQ tandis que le milieu de vie provient du fichier V10. L’âge est présenté en quatre grandes catégories, soit 0-59 ans, 60-69 ans, 70-79 ans et 80 ans et plus. Des analyses de sensibilité ont été effectuées afin d’obtenir ces catégories (voir section 3.6. Analyses de sensibilité).
Les indices de défavorisation indiquent le quintile de défavorisation du voisinage dans lequel l’individu réside. Un niveau de défavorisation matérielle élevé indique que l’individu réside dans un milieu où le niveau de scolarité, le taux d’emploi et le revenu moyen sont parmi les plus bas au Québec (Pampalon et al., 2012). Un niveau de défavorisation sociale élevé indique que l’individu réside dans un milieu où les proportions de personnes vivant seules ou en situation de monoparentalité sont parmi les plus élevées au Québec (Pampalon et al., 2012).
Le milieu de vie a été regroupé en quatre catégories, soit 1) les résidences pour aînés (RPA), 2) les centres d’hébergement et de soins de longue durée (CHSLD) et les centres hospitaliers (CH), 3) le domicile ainsi que 4) les autres milieux de vie qui incluent les ressources intermédiaires (RI), les centres de réadaptation, les hébergements communautaires, les prisons et les milieux de vie inconnus.
3.5. Analyse des données
Dans le cadre de cette étude, les analyses statistiques ont été réalisées avec le logiciel informatique
3.5.1. Analyse descriptive
Dans le but de décrire la population à l’étude, des analyses descriptives ont été effectuées. Pour ce faire, la population des cas confirmés de la COVID-19 inscrits dans le fichier V10 entre le 23 février 2020 et le 26 juillet 2020 jumelant avec le SISMACQ a été utilisée.
Une analyse descriptive a comparé la proportion d’individus atteints de la COVID-19 selon l’âge, le sexe, l’indice de défavorisation sociale et matérielle, le cumul des maladies, la présence de chaque maladie individuellement, le milieu de vie (CHSLD, RPA, domicile, autre/inconnu) ainsi que l’issue de la maladie (décès, hospitalisation, admission aux soins intensifs).
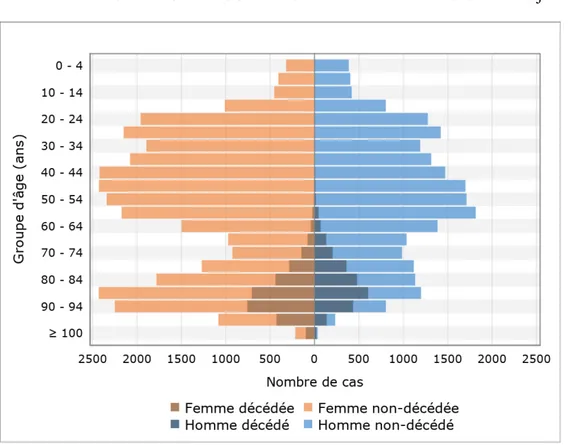
Une analyse descriptive démontrant la répartition des 5 550 individus décédés de la COVID-19 selon l’âge et le sexe parmi les 53 773 cas confirmés de la COVID-19 a également été réalisée.
3.5.2. Analyse de régression
Des analyses de régression ont été effectuées pour calculer les risques relatifs de décès imputables à la COVID-19. Pour ce faire, des modèles de régressions brutes ont d’abord été effectués pour calculer le risque relatif pour chaque condition préexistante. Ces modèles ont ensuite été ajustés pour l’âge seulement, puis pour l’âge, le sexe, les autres comorbidités, les milieux de vie de même que l’indice de défavorisation matérielle et sociale. Pour chacune des comorbidités, les risques relatifs ont été calculés pour l’ensemble des cas et ajustés pour les autres conditions préexistantes pour chaque milieu de vie et par groupe d’âge. Pour qu’une condition médicale soit associée à une augmentation du risque de décéder de la COVID-19, le risque relatif ajusté devait être significatif dans au moins un milieu de vie ou un groupe d’âge.
Des termes d’interactions ont ensuite été ajoutés dans les modèles de régression pour calculer l’effet du cumul des comorbidités sur le risque de décéder de la COVID-19. L’effet a été modélisé dans chacun des milieux de vie et chaque groupe d’âge. Ces modèles ont également été ajustés pour les autres variables, soit l’âge, le sexe, les autres comorbidités, les milieux de vie de même que l’indice de défavorisation matérielle et sociale. Le risque relatif ajusté, soit l’effet relatif du cumul de maladies sur le risque de décès, permet d’estimer le facteur multiplicatif du risque de
décès chez un individu ayant la COVID-19 lorsqu’il a des conditions médicales préexistantes comparativement à un individu n’ayant pas de comorbidités.
Pour l’ensemble des analyses, le modèle de régression de Poisson avec estimateur robuste de la variance a été utilisé. L’avantage de ce modèle est qu’il permet d’estimer directement des risques relatifs plutôt que des rapports de cotes, ces derniers étant plus difficiles à interpréter (Zou, 2004).
3.6. Analyse de sensibilité
Dans le but de déterminer les sous-groupes de la population à l’étude, des analyses de sensibilité ont été effectuées. Pour ce faire, les données ont d’abord été modélisées en utilisant l’âge en continu où quelques inconvénients sont ressortis. D’abord, tel qu’énoncé par Moser et Coombs, le fait de catégoriser une variable continue peut avoir un effet sur la puissance statistique (Moser & Coombs, 2004). Une erreur de mesure peut subvenir à l’ensemble des données d’une même catégorie lorsqu’une variable continue, ici l’âge, est catégorisée, ce qui peut en résulter en une perte de puissance statistique (Altman et al., 1994). De plus, il peut y avoir un enjeu au niveau du choix des catégories de référence. Dans cette étude, les catégories de référence étaient 50, 70 et 90 ans. Malgré la justesse possible dans les tests d’association, il peut être difficile d’exposer ces données lorsqu’elles sont présentées sous forme de variables continues et l’interprétation par le lecteur peut s’avérer plus complexe (Bouyer, 2019).
Les résultats ont ensuite été modélisés par catégorie. Les résultats ont d’abord été présentés en huit catégories : 0-59 ans, 60-64 ans, 65-69 ans, 70-74 ans, 75-79 ans, 80-84 ans, 85-89 ans et 90 ans et plus. Puisqu’il y a peu de décès avant l’âge de 60 ans, les 0-59 ans ont été regroupés à l’intérieur de la même catégorie. Afin de s’assurer de la justesse de cette catégorie, une modélisation en excluant une partie des données, soit les individus entre 0 et 49 ans, a été effectuée. Puisque les changements dans les rapports de risques s’avéraient minimes en incluant et en excluant la catégorie 0-49 ans, il a été possible de regrouper l’ensemble des données sous la catégorie 0-59 ans.
Dans le but d’augmenter la puissance statistique en diminuant le nombre de catégories, les résultats ont également été présentés en quatre catégories, soit 0-59 ans, 60-69 ans, 70-79 ans et 80 ans et plus. En comparant le modèle en quatre et en huit catégories, les données semblaient peu varier en utilisant des intervalles de 10 ans. Il a donc été décidé d’utiliser les données en quatre catégories. Les données en quatre catégories ont ensuite été comparées avec les données obtenues de la modélisation en utilisant l’âge en continu. En comparant les deux modèles, les résultats étaient semblables. Dans le but de faciliter la compréhension du lecteur et d’avoir une vision globale des résultats, l’utilisation du modèle en quatre catégories semblait plus adéquate pour cette étude.
CHAPITRE 4 – RÉSULTATS
En date du 26 juillet 2020, 58 733 cas confirmés à la COVID-19 étaient inscrits dans le fichier V10. Il a été possible de jumeler 53 773 cas confirmés avec le SISMACQ, représentant près de 92 % des cas confirmés du Québec.
4.1. Répartition des cas confirmés en fonction des données sociodémographiques
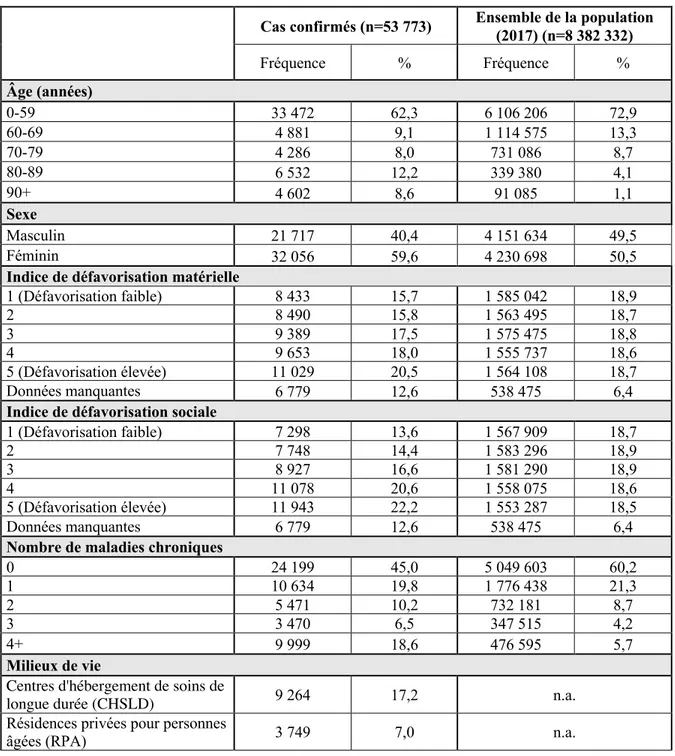
Le tableau 5 montre la distribution des données démographiques de même que les comorbidités des 53 773 cas confirmés comparativement à l’ensemble de la population québécoise en date de 2017. Il est possible de constater que la majorité des cas se retrouvent dans la catégorie 0-59 ans, totalisant 62,3 % des cas confirmés, suivi par la catégorie 80-89 ans avec 12,2 % des cas confirmés. Les femmes étaient davantage atteintes par le SRAS-CoV-2, totalisant 59,6 % des cas. En ce qui a trait à l’indice de défavorisation sociale et matérielle, bien qu’il y ait un gradient pour les cas confirmés, il ne semble pas y avoir de différence marquée entre les cas confirmés et l’ensemble de la population québécoise. À l’opposé, les cas confirmés de la COVID-19 qui cumulaient quatre maladies chroniques ou plus étaient surreprésentés avec une proportion de 18,6 % comparativement à 5,7 % dans l’ensemble de la population québécoise. Cependant, il est important de noter que la majorité des cas, soit 45 %, n’avait aucune maladie connue au moment où ils ont été infectés par le virus. Les six comorbidités les plus prévalentes chez les cas confirmés de la COVID-19 sont l’hypertension artérielle (28,6 %), les maladies cardiovasculaires (18 %), les troubles neurologiques (17,6 %), l’anémie (14,3 %) les maladies respiratoires (13,8 %) ainsi que le diabète (13,6 %). Hormis les troubles neurologiques et l’anémie qui sont surreprésentés chez les cas confirmés de la COVID-19 comparativement à l’ensemble de la population (3,1 % et 5,2 % respectivement), l’hypertension artérielle (15,8 %), les maladies cardiovasculaires (8,2 %), le diabète (7,1 %) ainsi que les maladies respiratoires (9,8 %) sont également les comorbidités les plus prévalentes au sein de la population.
Bien qu’une grande proportion des cas de la COVID-19 n’ait pas eu de complications majeures suite à la positivité du test PCR, cette maladie est responsable, en date du 26 juillet 2020, de 5 550 décès (10,3 %), 6 371 hospitalisations (11,8 %) et 1 159 admissions aux soins intensifs (2,2 %).
Tableau 5 Description de la population des cas confirmés de la COVID-19 entre le 23 février 2020 et le 26 juillet 2020 au Québec en comparaison avec l’ensemble de la population québécoise de 2017 Cas confirmés (n=53 773) Ensemble de la population (2017) (n=8 382 332) Fréquence % Fréquence % Âge (années) 0-59 33 472 62,3 6 106 206 72,9 60-69 4 881 9,1 1 114 575 13,3 70-79 4 286 8,0 731 086 8,7 80-89 6 532 12,2 339 380 4,1 90+ 4 602 8,6 91 085 1,1 Sexe Masculin 21 717 40,4 4 151 634 49,5 Féminin 32 056 59,6 4 230 698 50,5
Indice de défavorisation matérielle
1 (Défavorisation faible) 8 433 15,7 1 585 042 18,9 2 8 490 15,8 1 563 495 18,7 3 9 389 17,5 1 575 475 18,8 4 9 653 18,0 1 555 737 18,6 5 (Défavorisation élevée) 11 029 20,5 1 564 108 18,7 Données manquantes 6 779 12,6 538 475 6,4
Indice de défavorisation sociale
1 (Défavorisation faible) 7 298 13,6 1 567 909 18,7 2 7 748 14,4 1 583 296 18,9 3 8 927 16,6 1 581 290 18,9 4 11 078 20,6 1 558 075 18,6 5 (Défavorisation élevée) 11 943 22,2 1 553 287 18,5 Données manquantes 6 779 12,6 538 475 6,4
Nombre de maladies chroniques
0 24 199 45,0 5 049 603 60,2 1 10 634 19,8 1 776 438 21,3 2 5 471 10,2 732 181 8,7 3 3 470 6,5 347 515 4,2 4+ 9 999 18,6 476 595 5,7 Milieux de vie
Centres d'hébergement de soins de
longue durée (CHSLD) 9 264 17,2 n.a.
Résidences privées pour personnes